附件 99.1

| 1 NASDAQ/TASE:PPBT 2025年5月公司介绍

| 2前瞻性陈述和安全港本演示文稿中的某些前瞻性陈述而非历史事实陈述属于1995年《私人证券诉讼改革法案》安全港条款含义内的前瞻性陈述。此类前瞻性陈述包括但不限于非历史事实陈述的陈述,可通过“相信”、“预期”、“打算”、“计划”、“可能”、“应该”、“可以”、“可能”、“寻求”、“目标”、“将”、“项目”、“预测”、“继续”或“预期”等词语或其否定或这些词语或其他类似词语的变体或通过这些陈述与历史事项不严格相关的事实来识别。你不应该过分依赖这些前瞻性陈述,这些陈述不是对未来业绩的保证。前瞻性陈述反映了我们目前对未来事件的看法、预期、信念或意图,并受制于许多假设,涉及已知和未知的风险,其中许多风险超出我们的控制范围,以及可能导致我们的实际结果、业绩或成就与前瞻性陈述明示或暗示的任何未来结果、业绩或成就存在重大差异的不确定性和其他因素。可能导致或促成此类差异的重要因素包括,除其他外,与以下相关的风险:管理层对未来运营的计划、战略和目标;NT 219、CM24和IM1240的产品开发;此类早期治疗候选者可能导致获得批准的药物产品的过程很长,并面临高度重大的风险,特别是在联合开发合作方面;药物开发和商业化涉及一个漫长而昂贵的过程,结果不确定;我们成功开发和商业化我们的医药产品的能力;费用,长度,任何临床试验的进展和结果;法规和立法的任何变化的影响这可能会影响制药行业;难以获得将我们的产品商业化所需的监管批准;难以预测美国食品药品监督管理局或任何其他适用的医药产品监管机构的行动;监管环境和卫生政策的变化以及我们经营所在国家/地区的制度;我们的医药产品一旦获准在特定市场营销,其实际市场接受度的不确定性;竞争产品的引入;竞争对手获得的专利;对我们的专利有效性的依赖以及对创新产品的其他保护;我们获得、维护和捍卫已发布专利的能力;对我们的专利发起任何专利干涉或侵权诉讼,以及我们在任何此类诉讼中胜诉、获得有利决定或追回损害赔偿的能力;以及面临诉讼的风险,包括专利诉讼和/或监管行动;以色列、美国和我们可能经营或获得我们的产品或业务批准的其他国家的经济、公共卫生、政治和安全局势的影响,以及我们在截至2024年12月31日止年度的20-F表格年度报告和我们向美国证券交易委员会(“SEC”)提交的其他文件中讨论的其他因素,包括我们在注册声明和年度报告中对“风险因素”下的风险和不确定性进行的谨慎讨论。我们认为,这些因素可能导致我们的实际结果与预期结果存在重大差异。除我们列出的因素外,其他因素也可能对我们产生不利影响。本新闻稿中的任何前瞻性陈述仅在其发表之日发表。我们不承担任何公开更新或修改此处包含的任何前瞻性陈述或其他信息的意图或义务,无论是由于新信息、未来事件或其他原因,除非适用法律要求。不过,建议您查阅我们在提交给SEC的报告中所做的任何额外披露,这些信息可在SEC网站https://www.sec.gov上查阅。

| 3家公司亮点Purple Biotech(NASDAQ/TASE:PPBT)截至2024年12月31日•未偿ADS:260万•现金余额:820万美元,具备推进下一个临床里程碑的良好条件•两种一流的临床阶段药物•一个临床前三特异性免疫接合器平台•精益和全球化运营•进入2026年中期的现金跑道Purple Biotech确定了有前景的一流候选药物,以治疗具有高度未满足医疗需求的癌症

| 4个合作者价值驱动因素开发阶段适应症目标项目III期II期I期临床前□启动2b期2H25胰腺癌(+ nivolumab + soC)CEACAM1 mAB CM24 □启动2期1H25头颈部(+西妥昔单抗/帕博利珠单抗)STAT3xIRS1/2双抑制剂NT219 □ FIH2026实体瘤CD3x5T4xNKG2A CAPTN-3三特异性AB IM 1240 A管线致力于推进肿瘤疗法CM24 & NT219临床获益证明

推进一流的肿瘤疗法CM24:一种α-CEACAM1*mAB在医疗需求未满足的多个大适应症中的重大机遇临床POC实现*癌胚抗原细胞粘附分子

| 6 CM24:潜在CEACAM1-靶向疗法的POC • CEACAM1在某些肿瘤细胞和浸润免疫细胞上过度表达• CEACAM1是中性粒细胞胞外陷阱(NETS)结构的一部分有吸引力的新靶点• C M24增加T细胞和NK CE LLS介导的对肿瘤的细胞毒性• CM24与NET上的CEACAM1结合并抑制NET相关活性• CM24与免疫肿瘤治疗联合显示出益处证明了作用机制•单一疗法具有良好的安全性并与纳武单抗联合使用• P2疗效数据阳性•血清CEACAM1和MPO潜在生物标志物显示出具有临床意义的结果•已确定的其他潜在生物标志物,例如C EA CAM1 +肿瘤细胞和CPS POC临床疗效•在多个适应症(肺、结肠、乳腺、胃肠道等)中利用MoA的巨大机会•胰腺导管腺癌(PDAC)这一最常见的胰腺癌形式的重大未满足的医疗需求具有相当大的市场潜力
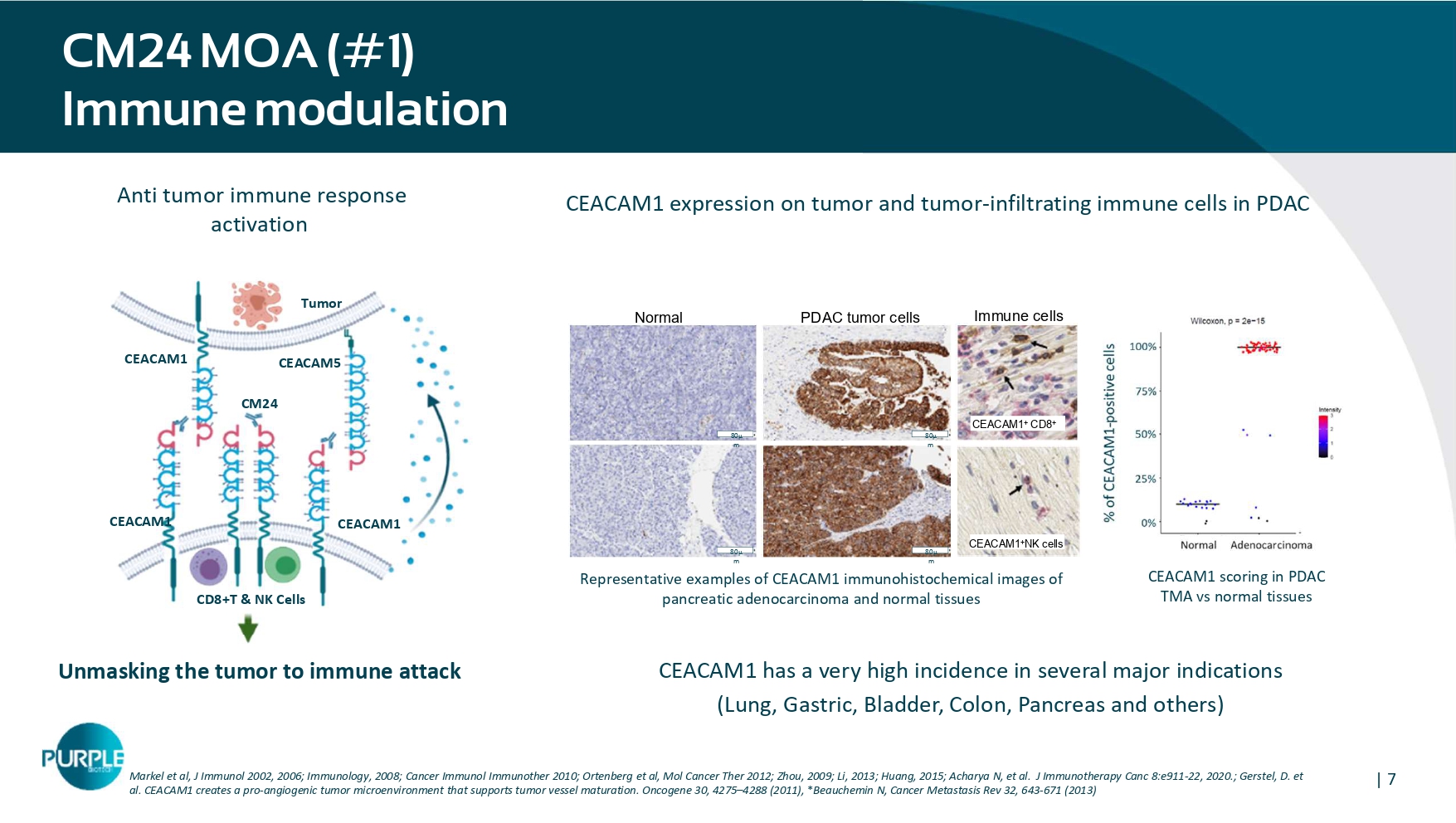
| 7 CD CM24 MOA(# 1)免疫调节马克尔保险等,J Immunol 2002,2006;Immunology,2008;Cancer Immunol ImmunOther 2010;Ortenberg等,MOL Cancer Ther 2012;Zhou,2009;Li,2013;Huang,2015;Acharya N等,J Immunotherapy CANC 8:e911-22,2020。;Gerstel,D. et al. CEACAM1创建了一个支持肿瘤血管成熟的促血管生成肿瘤微环境。癌基因30,4275 – 4288(2011),*Beauchemin N,Cancer Metastasis Rev 32,643-671(2013)肿瘤CD8 + T & NK细胞CEACAM1 CEACAM1 CEACAM1 CEACAM5揭示肿瘤免疫攻击CM24抗肿瘤免疫应答激活PDAC肿瘤细胞正常80 μ m 80 μ m 80 μ m 80 μ m 80 μ m CEACAM1在肿瘤和肿瘤浸润免疫细胞上的表达PDAC CEACAM1评分在PDAC TMA vs正常组织中的代表性CEACAM1免疫组化图像CEACAM1 + CD8 + CD CEACAM1 + NK细胞免疫细胞CEACAM1在几个主要适应症(肺、胃、膀胱、结肠、胰腺等)中的发病率极高
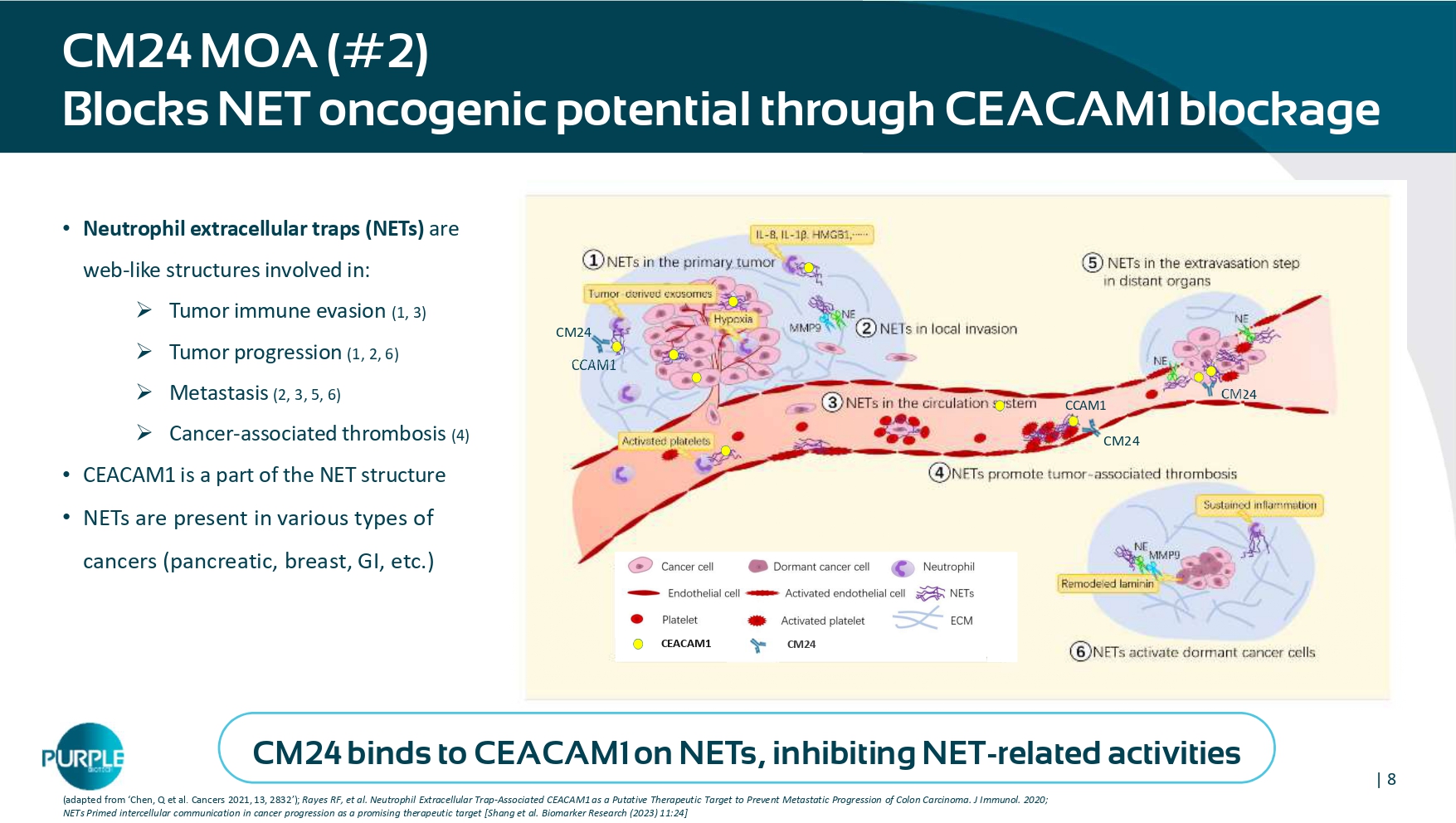
| 8 CM24 MOA(# 2)B锁定NET致癌电位thr o ugh CEACAM1阻塞•中性粒细胞胞外陷阱(NET)是一种网状结构,涉及:»肿瘤免疫逃避(1,3)»肿瘤进展(1,2,6)»转移(2,3,5,6)»癌症相关血栓形成(4)• CEACAM1是NET结构的一部分• NET存在于各种类型的癌症(胰腺、乳腺、胃肠道等)中(改编自‘Chen,Q et al. Cancers 2021,13,2832’);Rayes射频,等人。中性粒细胞细胞外陷阱相关CEACAM1作为推定的治疗靶点,以预防结肠癌的转移进展。J免疫。2020;NETS引发癌症进展中的细胞间通讯成为有前景的治疗靶点【Shang et al. Biomarker Resea rch(2023)11:24】CCAM1 CM24 CM24 CCAM1 CM24 CEACAM1 CM24 CEACAM1 CM24与NETS上的CEACAM1结合,抑制NET相关活动
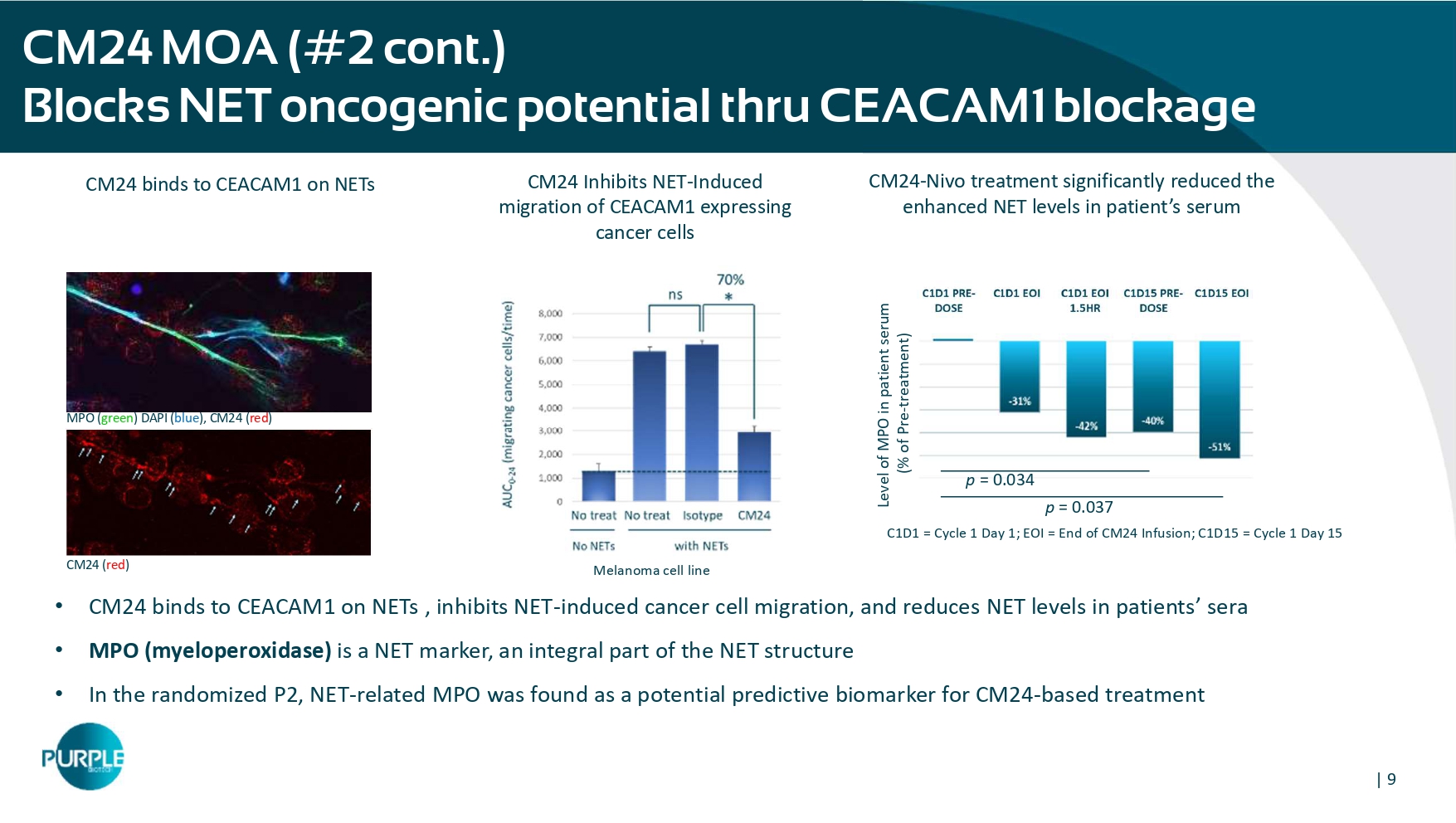
| 9 CM24 MOA(# 2 cont.)B通过CEACAM1阻断MPO(绿色)DAPI(蓝色)锁定净致癌电位,CM24(红色)CM24(红色)CM24抑制NET诱导的CEACAM1表达癌细胞迁移CM24与NET上的CEACAM1结合患者血清中MPO水平(占预处理的百分比)p = 0.034 p = 0.037 C1D1 =周期1第1天;EOI = CM24输注结束;C1D15 =周期1天15 CM24-Nivo治疗显著降低患者血清中增强的NET水平• CM24与NET上的CEACAM1结合,抑制NET诱导的癌细胞迁移,并降低患者血清中的NET水平• MPO(髓过氧化物酶)是NET标志物,是NET结构的组成部分•在随机P2中,NET相关MPO被发现是基于CM24的治疗黑色素瘤细胞系的潜在预测生物标志物

| PDAC中的10个CM24机会•胰腺癌仅在美国就占~6万例新发病例/年;5年相对生存率为12。2线患者化疗5年总生存率为3% 4 •全球范围内2线使用两种主要可互换方案,获益有限,OS范围为6-8个月5,6• CEACAM1表达与胰腺癌预后不良相关7 •临床和临床前数据支持CM24与目前已上市的IO疗法协同作用在医疗需求未得到满足的多个大适应症中的重要机会• CEACAM1在不同癌症适应症中上调:结肠和膀胱> 90%,肺、胃、乳腺> 70%,和其他1 •在肺癌、乳腺癌、消化道癌症等多种癌症中观察到中性粒细胞细胞外陷阱(NETs)水平升高,以及其他2,3 •有很强的科学依据和支持临床数据1.Beauchemin N,Cancer Metastasis Rev 32,643-671(2013)。2. https://doi.org/10.3389/fimmu.2020.01749。3 doi:10.3748/wjg.v27.i33.5474。4. https://seer.cancer.gov/statfacts/html/pancreas.html7。De Jesus VHF、Camandaroba MPG、Calsavara VF、Riechelmann RP。5.FOLFIRINOX治疗晚期胰腺癌后基于吉西他滨的化疗的系统综述及荟萃分析。医学肿瘤学的治疗进展。2020;12. DOI:10.1177/17588359209054086。Wang-Gillam A,Hubner RA,Siveke JT等人NAPOLI-1脂质体伊立替康在转移性胰腺癌中的3期研究:长期幸存者的最终总生存期分析和特征。EUR J癌症。2019;108:78-87.doi:10.10 16/j.ejca.2018.12.007。7.Calinescu et al,Journal of Immunology Research 2018:7169081;癌胚抗原相关细胞粘附分子(CEACAM)1、5和6作为胰腺癌的生物标志物,DOI:10.1371/journal.pone.0113023
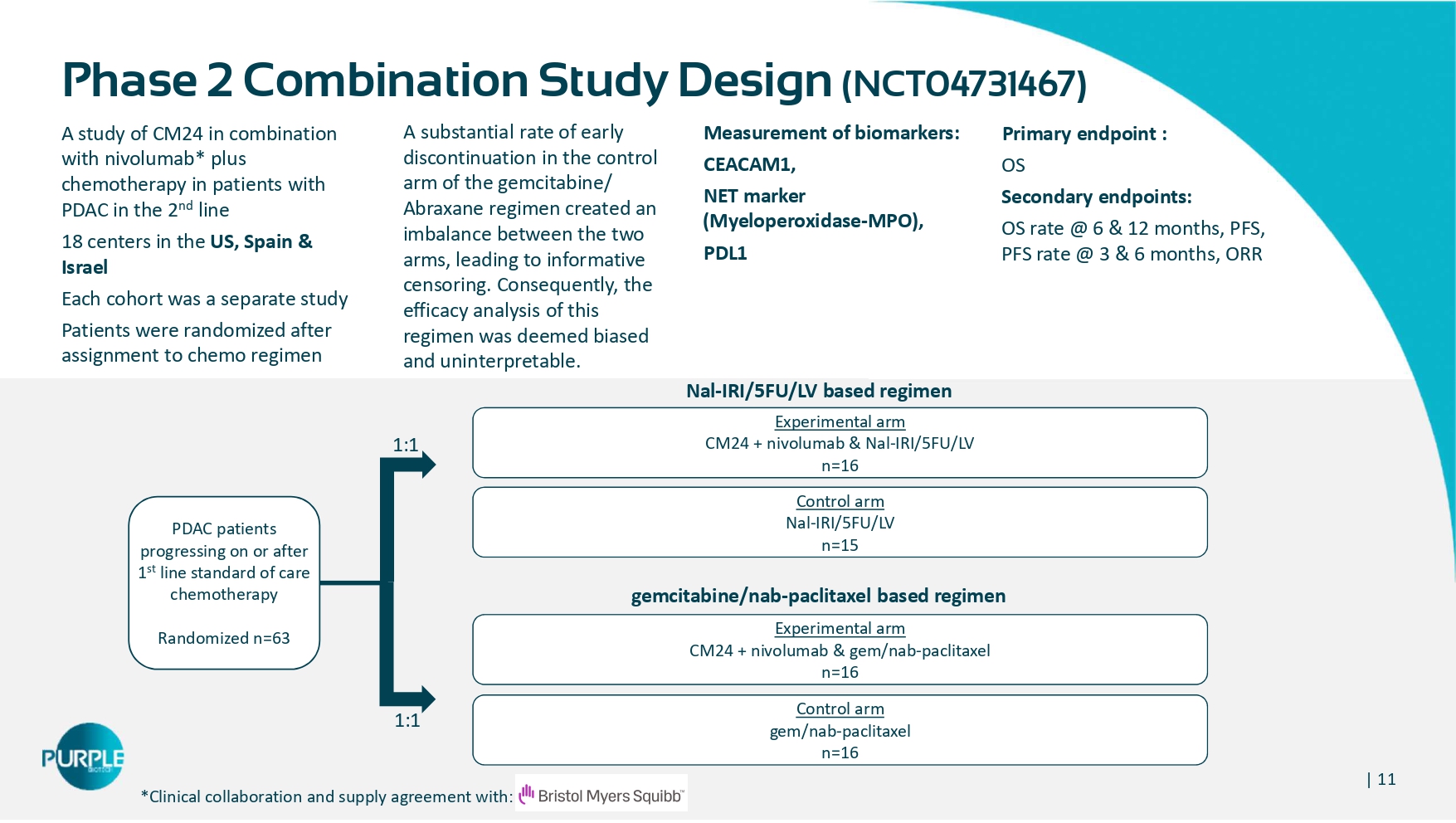
| 11一项CM24联合纳武单抗的研究*在美国、西班牙和以色列的2线18中心对PDAC患者进行加化疗每个队列是一项单独的研究患者在分配到化疗方案后被随机分配生物标志物的测量:CEACAM1、NET标志物(髓过氧化物酶-MPO)、PDL1主要终点:OS次要终点:OS率@6 & 12个月,PFS,PFS率@3 & 6个月,ORR 2期联合研究设计(NCT04731467)–吉西他滨/Abraxane方案对照组的大量早期停药率造成了两组之间的不平衡,导致了信息性审查。因此,该方案的疗效分析被认为是有偏见的,无法解释。实验臂CM24 + nivolumab & Nal-IRI/5FU/LV n = 16对照臂Nal-IRI/5FU/LV n = 15实验臂CM24 + nivolumab & gem/nab-紫杉醇n = 16对照臂gem/nab-紫杉醇n = 16 PDAC患者1线标准护理化疗或之后进展随机n = 631:11:1 Nal-IRI/5FU/LV为基础的方案吉西他滨/nAB-紫杉醇为基础的方案*临床合作和供应协议:
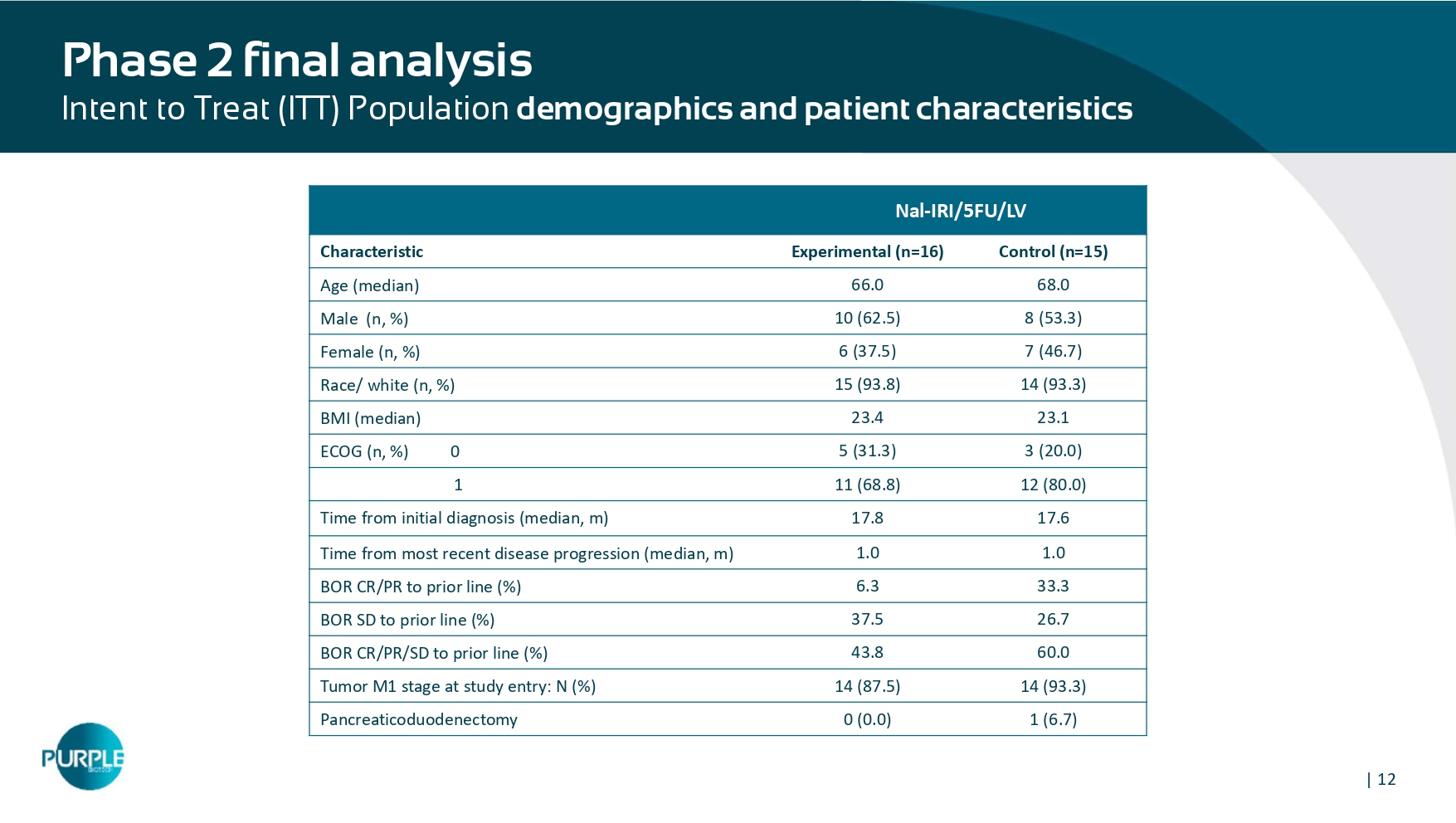
| 12 Nal-IRI/5FU/LV对照(n = 15)实验(n = 16)特征68.0 66.0年龄(中位数)8(53.3)10(62.5)男性(n,%)7(46.7)6(37.5)女性(n,%)14(93.3)15(93.8)种族/白人(n,%)23.12 3.4 BMI(中位数)3(20.0)5(31.3)ECOG(n,%)012(80.0)11(68.8)1周lyphosphate tumor 8 from initial diagnosis(median,m)1.0 1.0 from the recent disease evelopment(median,m)33.36.3 BOR CR/PR对前期线(%)26.7 37.5 BOR SD对前期线(%)60.04 3.8 BOR CR/PR/SD对前期线(%)14(93.3)14(87.5)研究进入时的肿瘤M1阶段:N(%)1(6.7)0(0.0)胰十二指肠切除术2期最终分析意向治疗(ITT)人群人口统计学和患者特征
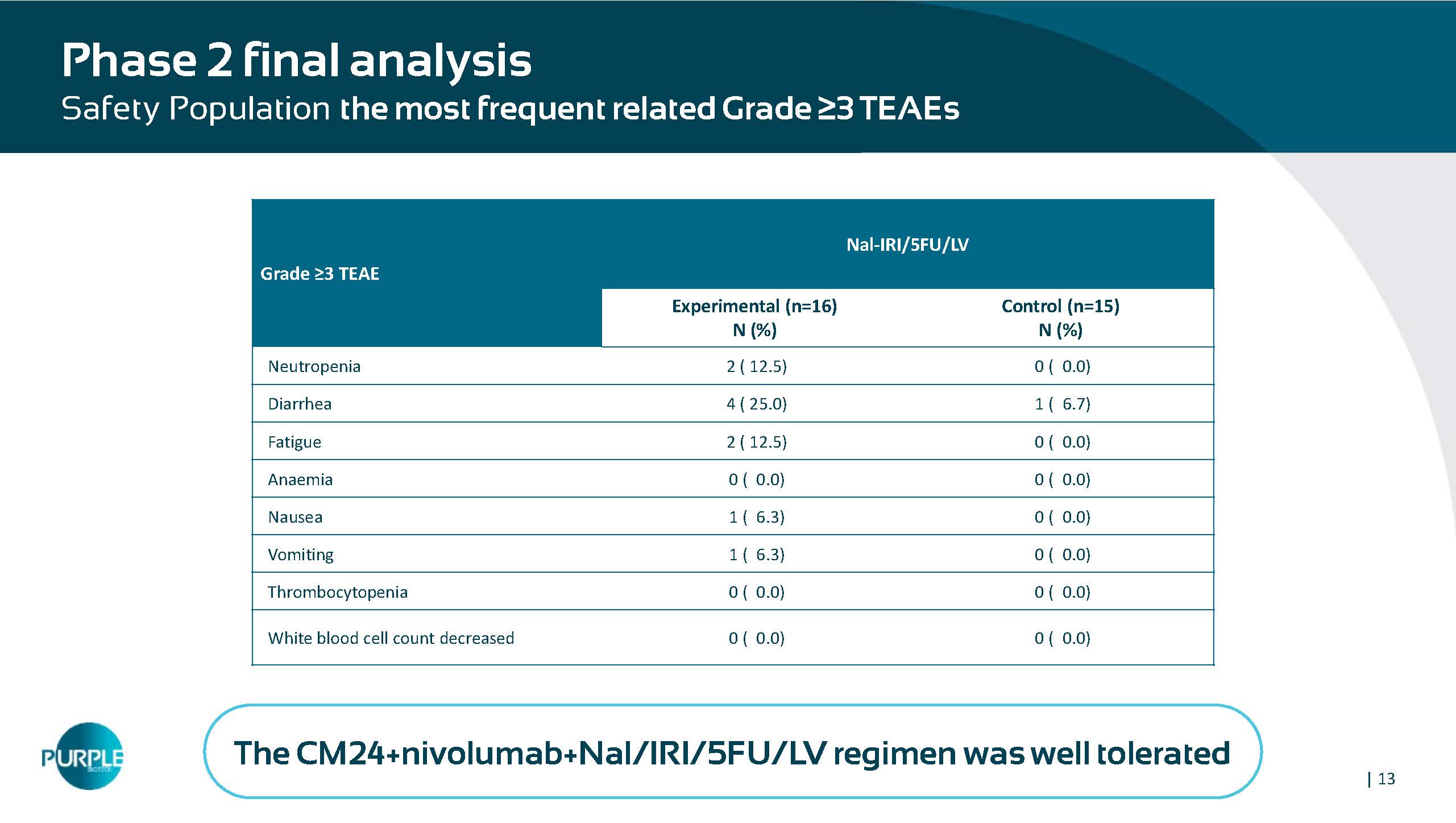
| 13 Nal-IRI/5FU/LV级≥ 3 TEAEE对照(n = 15)N(%)实验型(n = 16)N(%)0(0.0)2(12.5)中性粒细胞减少1(6.7)4(25.0)腹泻0(0.0)2(12.5)疲劳0(0.0)0(0.0)贫血0(0.0)1(6.3)反胃0(0.0)1(6.3)呕吐0(0.0)血小板减少0(0.0)白细胞计数下降2期终分析安全人群最多见相关3级TEAEs CM24 + nivolumab + Nal/IRI/5FU/LV方案耐受性良好
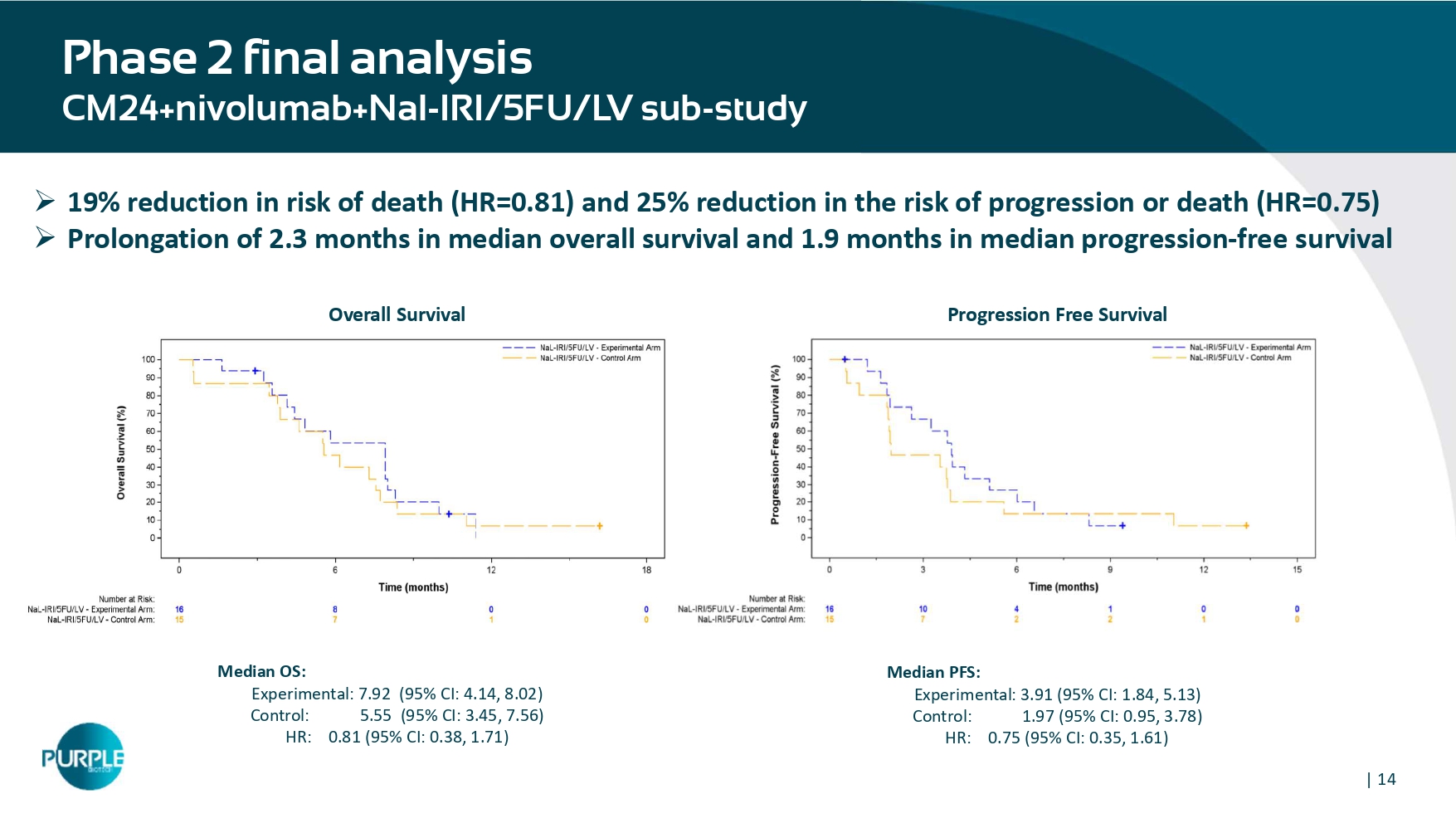
| 142期最终分析CM24 + nivolumab + Nal-IRI/5FU/LV子研究进展无生存期总生存期»死亡风险降低19%(HR = 0。81)和25%的进展或死亡风险降低(HR = 0.75)»延长2。中位总生存期3个月,中位无进展生存期1.9个月PFS中位数:实验型:3.91(95% CI:1.84,5.13)对照组:1.97(95% CI:0.95,3.78)HR:0.75(95% CI:0.35,1.61)中值OS:实验型:7.92(95% CI:4.14,8.02)对照组:5.55(95% CI:3.45,7.56)HR:0.81(95% CI:0.38,1.71)
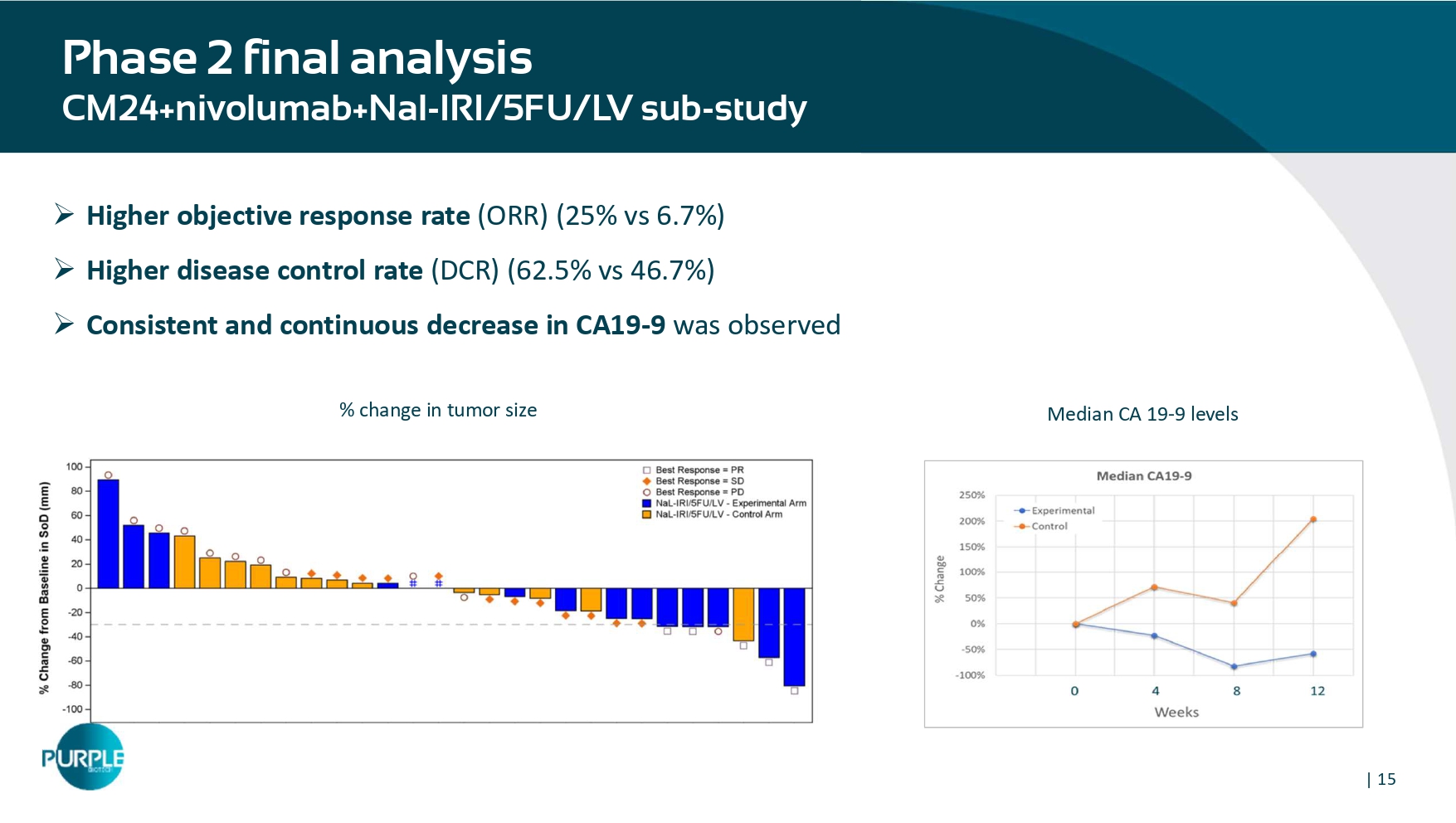
| 152期最终分析CM24 + nivolumab + Nal-IRI/5FU/LV子研究»更高的客观缓解率(ORR)(25% vs 6.7%)»更高的疾病控制率(DCR)(62.5% vs 46.7%)»观察到CA19-9持续下降,肿瘤大小的中位数加利福尼亚州 19-9水平%变化
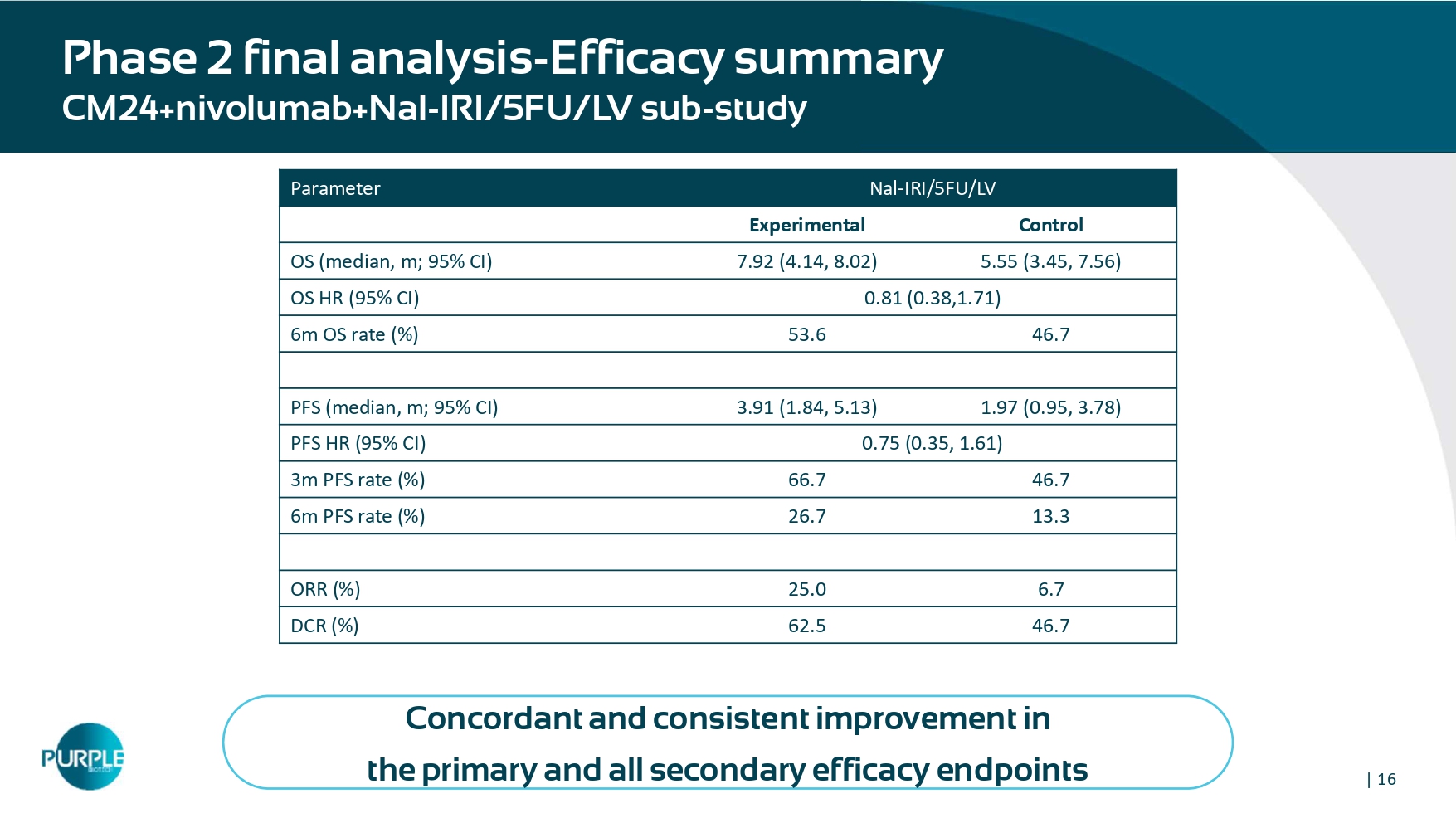
| 162期最终分析-疗效总结CM24 + nivolumab + Nal-IRI/5FU/LV子研究在主要和所有次要疗效终点Nal-IRI/5FU/LV参数控制实验5.55(3.45,7.56)7.92(4.14,8.02)OS(中位数,m;95% CI)0.81(0.38,1.71)OS HR(95% CI)46.75 3.66 6m OS率(%)1.97(0.95,3.78)3.91(1.84,5.13)PFS(中位数,m;95% CI)0.75(0.35,1.61)PFS HR(95% CI)46.766.7 3m PFS率(%)13.3 26.3
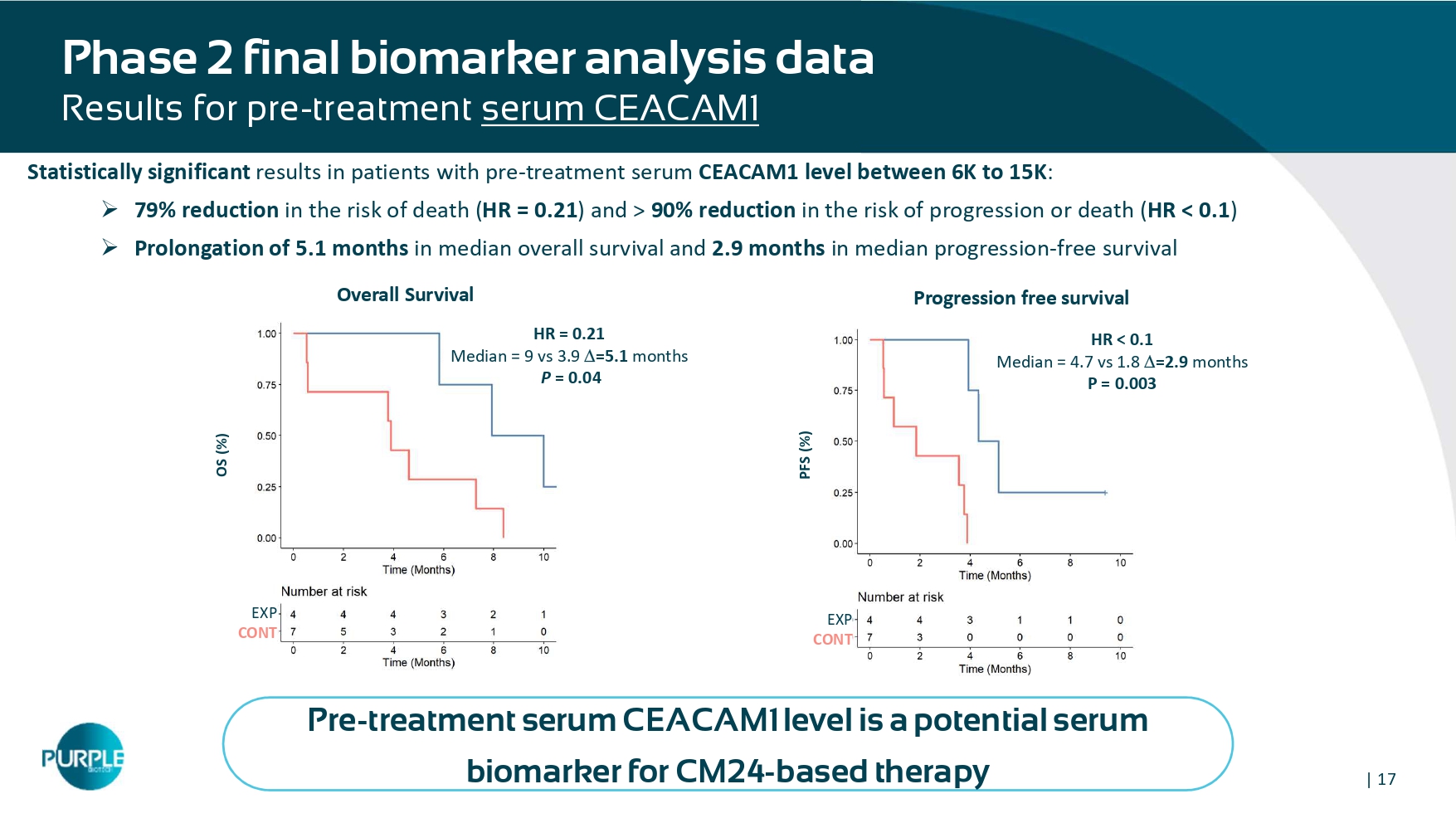
| 17期最终生物标志物分析数据结果p再治疗血清CEACAM1在治疗前血清CEACAM1水平在6K至15K之间的患者中具有统计学意义的结果:»死亡风险降低79%(HR = 0。21)和> 90%的进展或死亡风险降低(HR < 0.1)»中位总生存期延长5.1个月和中位进展2.9个月-无进展生存期HR < 0.1中位数= 4.7 vs 1.8 = 2.9个月p = 0.003无进展生存期总生存期总生存期总生存期(%)PFS(%)EXP CONT OS(%)HR = 0.21中位数= 9 vs 3.9 = 5.1个月p = 0.04治疗前血清CEACAM1水平是基于CM24的治疗的潜在血清生物标志物
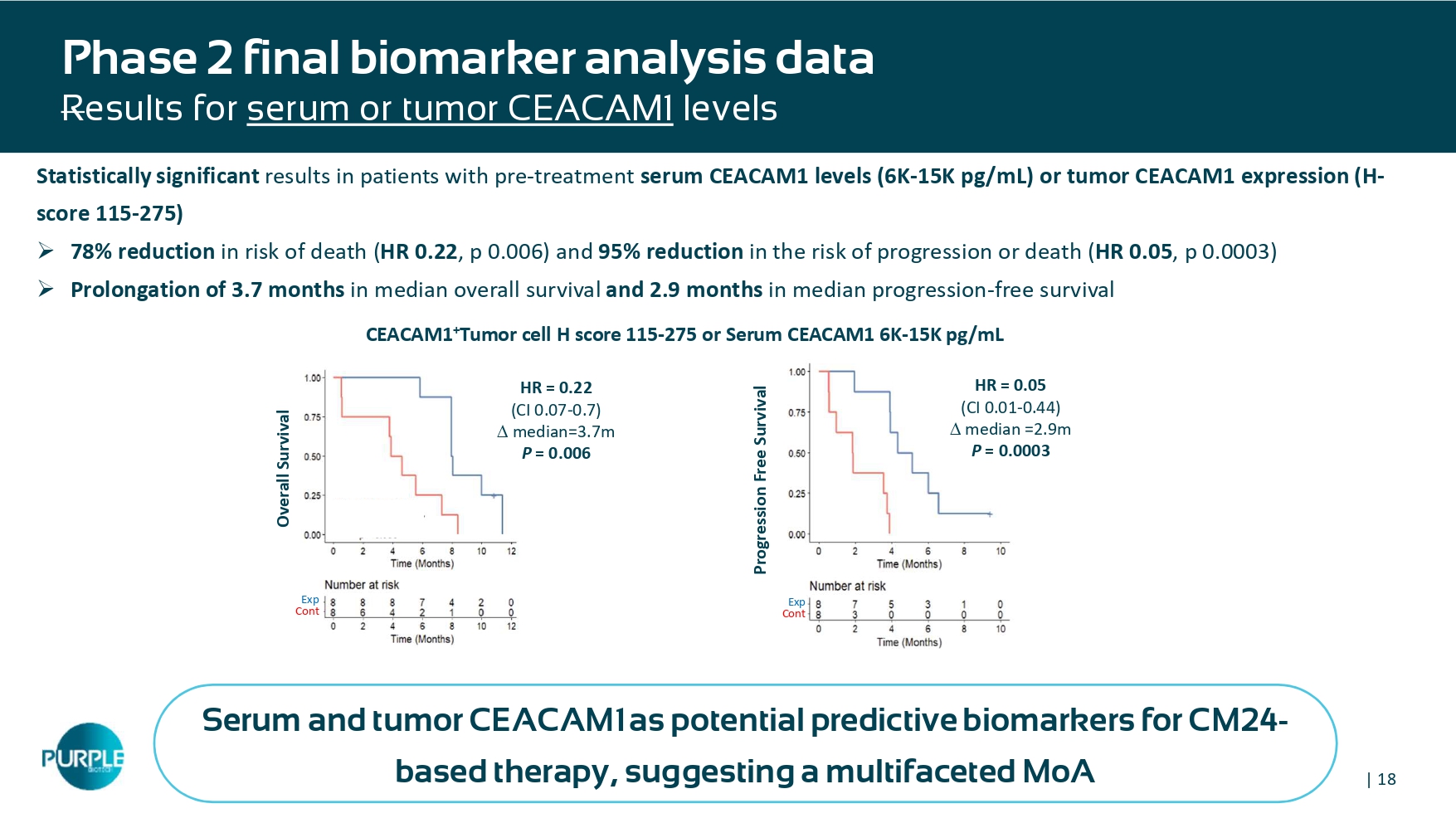
| 18个2期最终生物标志物分析数据R esults对治疗前血清CEACAM1水平(6K-15K pg/mL)或肿瘤CEACAM1表达(H-评分115-275)患者的血清或肿瘤CEACAM1水平有统计学意义的结果»死亡风险降低78%(HR 0。22,p 0.006)和进展或死亡风险降低95%(HR 0.05,p 0.0003)»中位总生存期延长3.7个月,中位进展延长2.9个月-无生存期CEACAM1 +肿瘤细胞H评分115-275或血清CEACAM1 6K-15K pg/ml总生存期HR = 0.22(CI 0.07-0.7)中位数= 3.7m p = 0.006 exp cont无进展生存期HR = 0.05(CI 0.01-0.44)中位数= 2.9m p = 0.0003 exp cont血清和肿瘤CEACAM1作为基于CM24的治疗的潜在预测生物标志物,提示多方面的MoAYL0
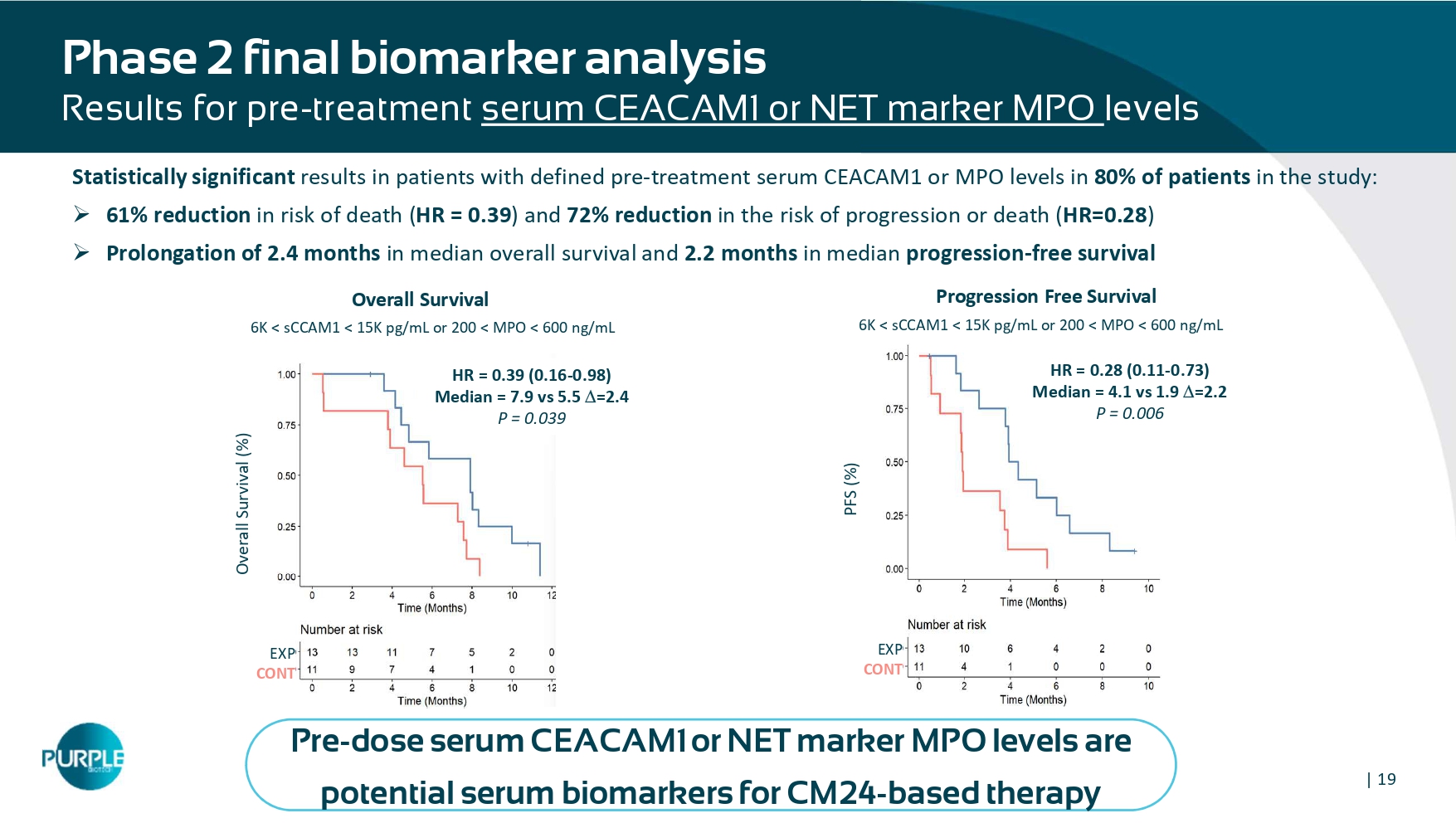
| 19治疗前血清CEACAM1或NET标志物MPO水平的2期最终生物标志物分析结果在研究中80%的患者中具有明确的治疗前血清CEACAM1或MPO水平的患者中具有统计学意义的结果:»死亡风险降低61%(HR =0。39)和72%的进展或死亡风险降低(HR = 0.28)»延长2。中位总生存期4个月和2.2个月的中位无进展生存期6K < SCCAM1 < 15K PG/mL或200 < MPO < 600ng/mL PFS(%)EXP CONT 6K < SCCAM1 < 15K PG/mL或200 < MPO < 600ng/mL总生存期(%)HR = 0.39(0.16-0.98)中位数= 7.9 vs 5.5 = 2.4 p = 0.039 EXP CONT HR = 0.28(0.11-0.73)中位数= 4.1 vs 1.9 = 2.2 p = 0.006无进展生存期总生存期剂量前血清CEACAM1或NET标志物MPO水平是潜在的血清生物标志物用于基于CM24的疗法
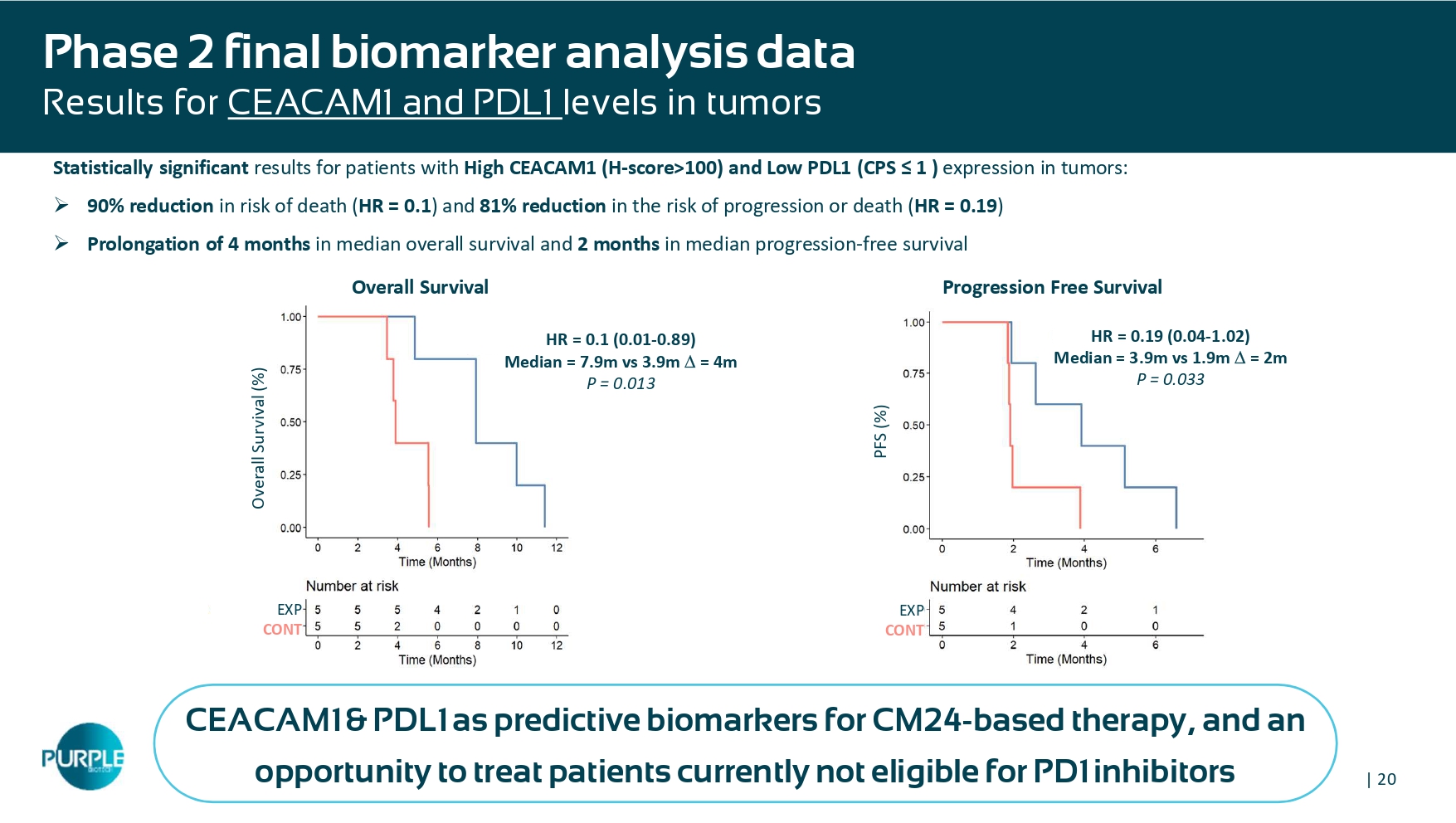
| 20总生存期(%)HR = 0.1(0.01-0.89)中位数= 7.9m vs 3.9m = 4m p = 0.013肿瘤中CEACAM1高(H-评分> 100)和PDL1低(CPS ≤ 1)表达患者的统计学显著结果:»死亡风险降低90%(HR =0。1)并将进展或死亡风险降低81%(HR = 0.19)»中位总生存期延长4个月,中位进展延长2个月-无生存期肿瘤中CEACAM1和PDL1水平的最终生物标志物分析数据结果EXP CONT HR = 0.19(0.04-1.02)中位数= 3.9m vs 1.9m = 2m p = 0.03 3 ↓ PFS 丨PFS(%)EXP CONT无进展生存期总生存期CEACAM1 & PDL1作为基于CM24的治疗的预测生物标志物,以及治疗目前不符合PD1抑制剂条件的患者的机会

| 21CM24路径向前新的MoA导向机会•在其他临床环境和适应症(例如,胰腺、GI、BTC、肺、结肠、黑色素瘤)中利用新的MoA的多重机会•每个治疗前血清CEACAM1和MPO水平的潜在靶向患者•生物标志物数据为在各种适应症中不符合抗PD1治疗条件的患者打开了新的机会2L PDAC患者的随机2期POC研究完成了未来开发2b期MOA/生物标志物-p2b驱动研究(胰腺、胃/食管)Li JC、Zou XM、Yang SF、Jin JQ、Zhu L、Li CJ,杨H、张AG、赵TQ、陈CY。中性粒细胞细胞外陷阱参与了胃癌患者癌症相关血栓的发展。世界J胃肠素。2022;28(26):3132 – 49..;C Heng-周峻等人,癌胚抗原相关细胞粘附分子1(CEACAM1)的不同表达以及在胃癌素瘤中的可能作用,病理学-研究与实践,第205卷,2009年第7期;CM24,一种针对癌胚抗原相关细胞粘附分子1(CEACAM1)的新型MAB,可抑制中性粒细胞外陷阱(NET)诱导的癌细胞迁移和转移Hadas Reuveni;Hava Ben David;Julie Rumble;Tomer Meirson;Michael Schickler,Cancer Res(2023)83(2 _ Supplement _ 2):B029。

推进一流的肿瘤疗法NT219:IRS1/2和STAT3先导适应症的小分子双抑制剂:复发/转移性头颈癌(SCCHN)

| 23 NT219,改善癌症患者治疗结果的新方案• NT219是一流的、IRS1/2和STAT3的小分子双重抑制剂•与IRS1/2共价结合并导致其降解•既影响肿瘤又影响TME •抑制癌症干细胞创新MOA •在各种PDX模型中单药治疗和联合治疗中均有突出疗效•在应对EGFRi等癌症治疗耐药性方面具有独特定位,MAPKi和ICI稳健临床前包•单药治疗或联合治疗中没有DLTs •早期临床活性证明•活化的IGF1 R和STAT3被确定为潜在的预测生物标志物• RP2D在100mg/kg时确定,1期结束。2期启动1 H25临床阶段•在2L r/m SCCHN患者中建立护理标准的机会•与主要癌症治疗相结合的多重市场优势• NT219是唯一可用于临床研究的IRS抑制剂广阔的市场潜力YL0
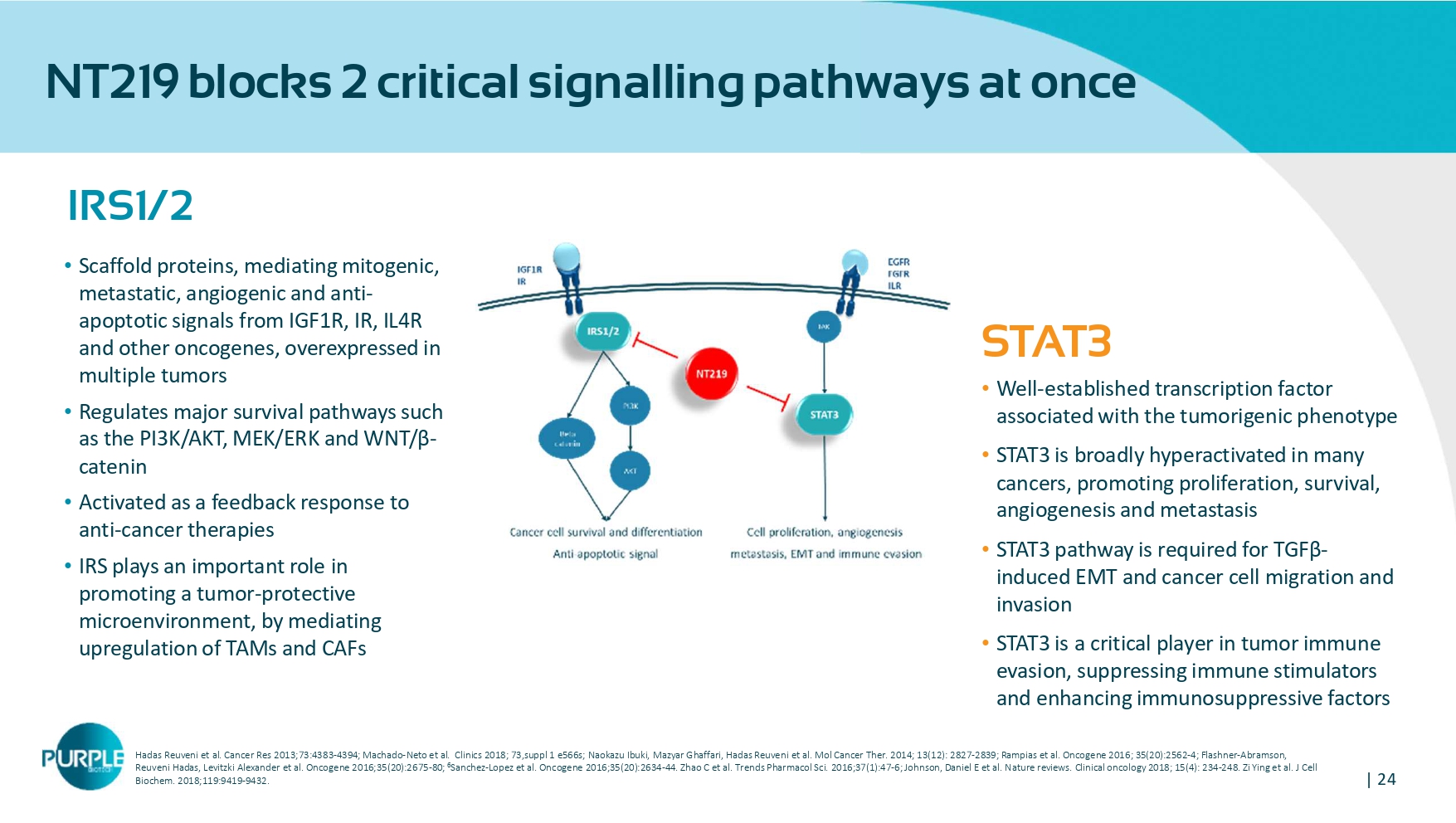
| 24 NT219一次阻断2个关键信号通路IRS1/2 •支架蛋白,介导来自IGF1R、IR、IL4R和其他癌基因的有丝分裂、转移、血管生成和抗凋亡信号,在多个肿瘤中过度表达•调节PI3K/AKT、MEK/ERK和WNT/β-catenin等主要生存通路•作为抗癌疗法的反馈反应被激活• IRS在促进肿瘤保护微环境中发挥重要作用,通过介导TAM和CAFS的上调STAT3 •与致瘤表型相关的公认转录因子• STAT3在许多癌症中广泛过度激活,促进增殖、存活、血管生成和转移• TGF β诱导的EMT和癌细胞迁移和侵袭需要STAT3通路• STAT3是肿瘤免疫逃避、抑制免疫刺激物和增强免疫抑制因子的关键参与者,Hadas Reuveni等人Cancer Res 2013;73:4383-4394;Machado-Neto等人Clinics2018;73,suppl 1 e566s;Naokazu Ibuki,Mazyar Ghaffari,Hadas Reuveni等人Mol Cancer Ther。2014;13(12):2827-2839;Rampias et al. Oncogene 2016;35(20):2562-4;Flashner-Abramson,Reuveni Hadas,Levitzki Alexander et al. Oncogene 2016;35(20):2675-80;6 Sanchez-Lopez et al. Oncogene 2016;35(20):2634-44。Zhao C et al. Trends Pharmacol Sci. 2016;37(1):47-6;Johnson,Daniel E et al. Nature reviews。临床肿瘤学2018;15(4):234-248。Zi Ying et al. J Cell Biochem。2018;119:9419 - 9432.
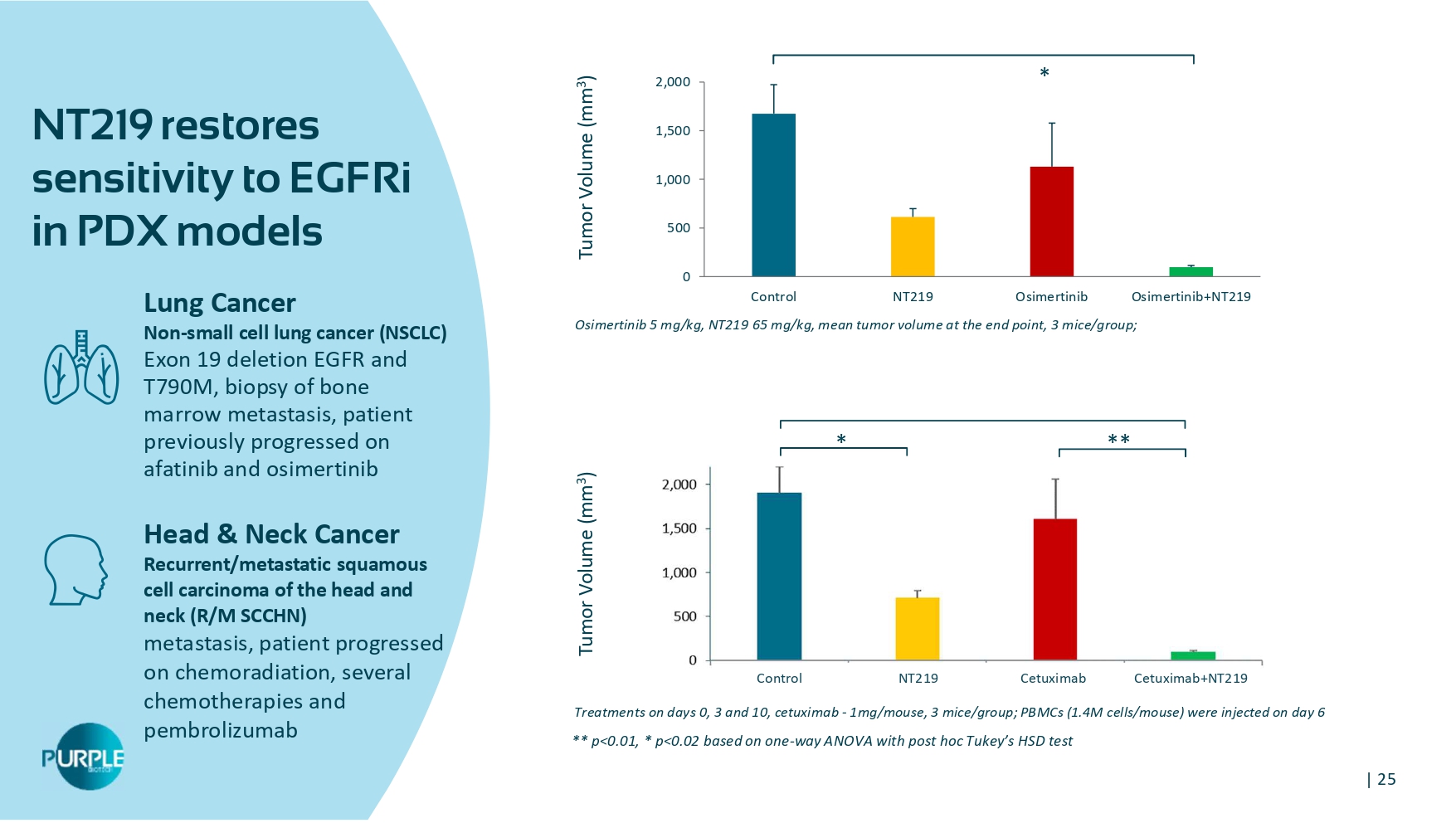
| 25 NT219在PDX模型肺癌非小细胞肺癌(NSCLC)外显子19缺失EGFR和T790M中恢复对EGFRi的敏感性,骨髓转移活检,患者既往使用阿法替尼和奥希替尼头颈癌复发/转移性头颈部鳞癌(R/M SCCHN)转移进展,患者在第0天、第3天和第10天放化疗、几种化疗和派姆单抗治疗进展,西妥昔单抗-1mg/小鼠,3小鼠/组;第6天注射PBMC(1.4m细胞/小鼠)奥希替尼5 mg/kg,NT 219 65 mg/kg,终点平均肿瘤体积,3只小鼠/组;0500100015002000对照NT219奥希替尼奥希替尼+ NT219肿瘤体积(mm 3)肿瘤体积(mm 3)**p < 0.01,*p < 0.02基于单向ANOVA与post hoc tukey的HSD测试****对照NT219西妥昔单抗西妥昔单抗+ NT219
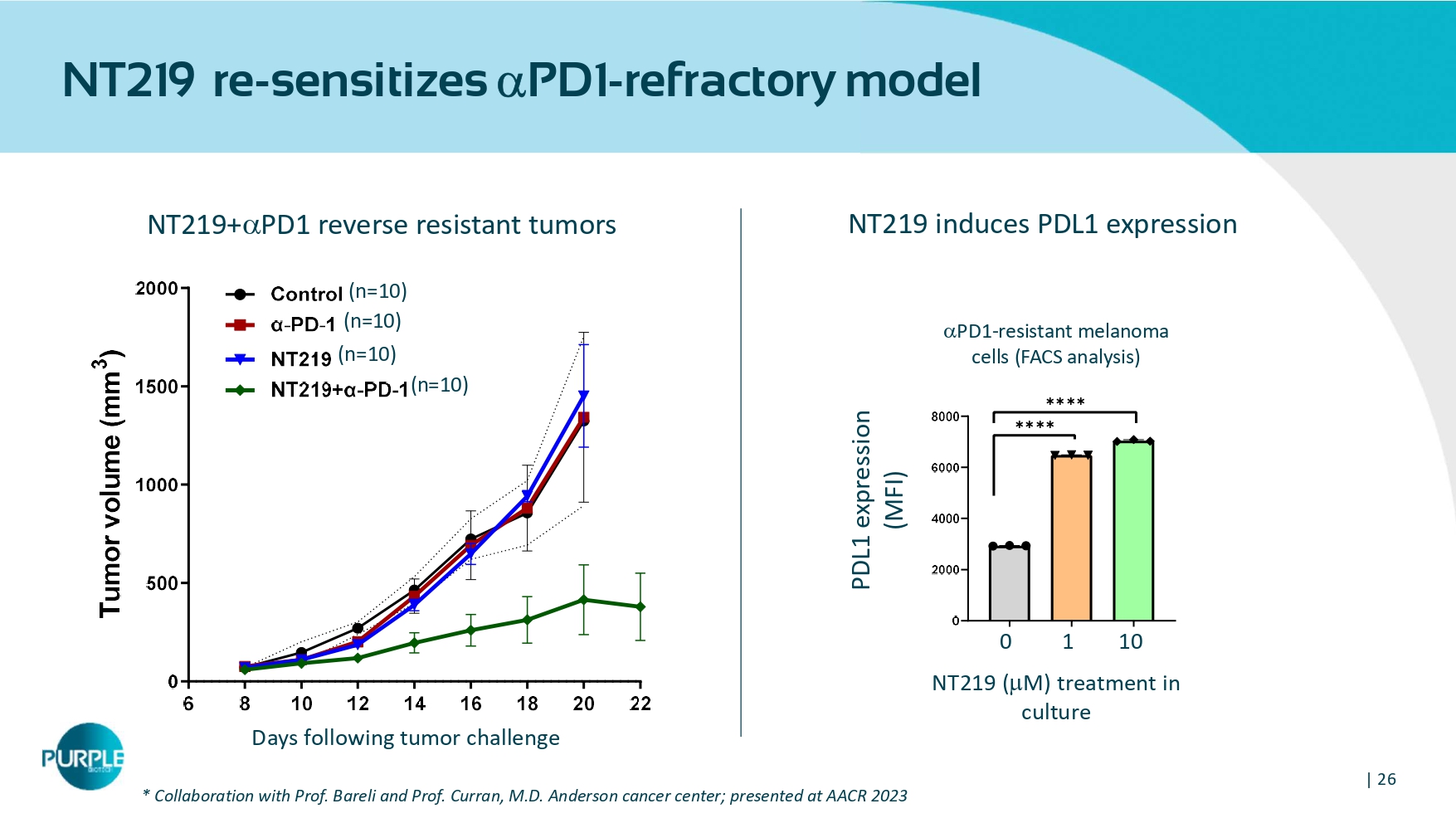
| 26 NT219再致敏PD1-难治模型68 101214161820220500100015002000对照α-PD-1 NT219 + α-PD-1肿瘤攻击后T u m o r v o l u m e(m m 3)肿瘤攻击后天数PD1-耐药黑色素瘤细胞(FACS分析)PDL1表达(MFI)NT219(m)培养中治疗0110NT 219 + PD 1反向耐药肿瘤NT 219诱导PDL1表达(n = 10)(n = 10)(n = 10)(n = 10)*与教授的合作。Bareli和Curran教授,医学博士安德森癌症中心;在AACR 2023上发表
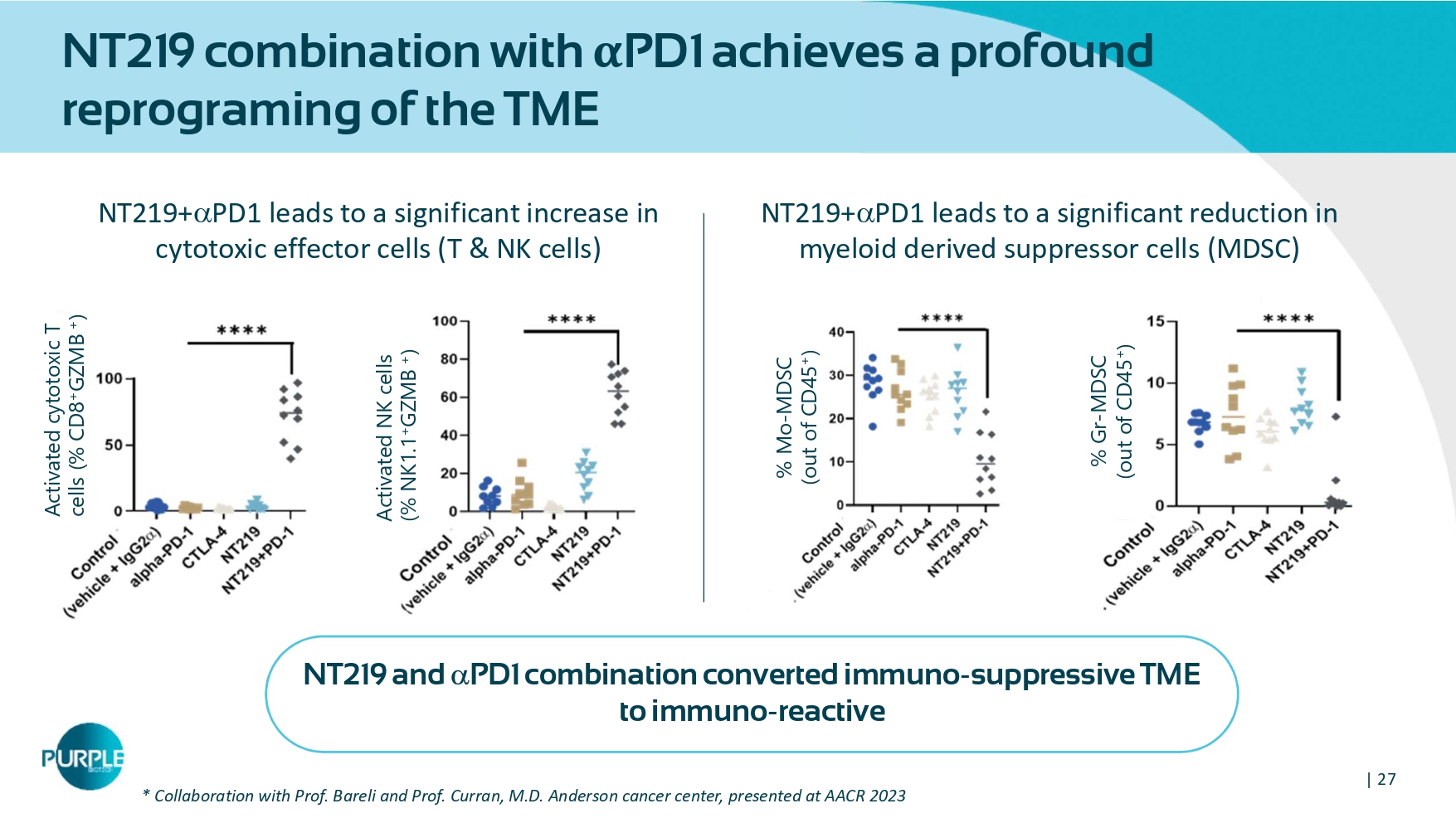
| 27 NT219联合α PD1实现了将NT219和PD1组合将免疫抑制性TME转化为免疫反应性的TME的深度重编程*与医学博士安德森癌症中心Bareli教授和Curran教授的合作,在AACR2023上展示的活化细胞毒性T细胞(% CD8 + GZMB +)活化NK细胞(% NK 1.1 + GZMB +)NT219 + PD1导致细胞毒性效应细胞(T & NK细胞)显著增加NT219 + PD1导致骨髓源性抑制细胞(MDSC)显著减少% Mo-MDSC(out of CD45 +)% GR-MDSC(out of CD 45 +)
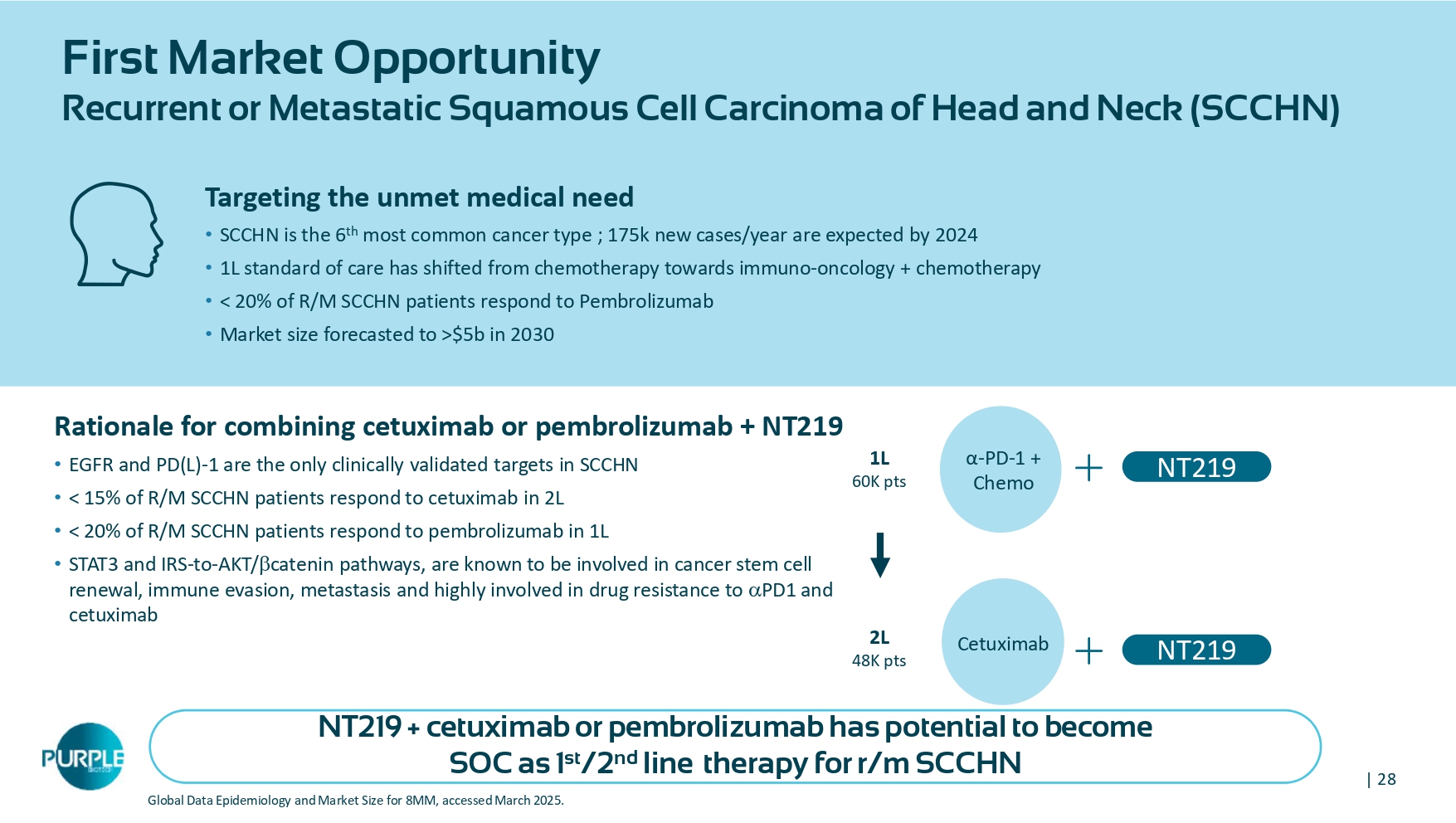
| 28 First Market Opportunity复发性或转移性头颈部鳞状细胞癌(SCCHN)8mm全球数据流行病学和市场规模,2025年3月访问。西妥昔单抗或帕博利珠单抗+ NT 219的联合使用理由• EGFR和PD(L)-1是SCCHN中唯一获得临床验证的靶点•< 15%的R/M SCCHN患者在2L中对西妥昔单抗有应答• < 20%的R/M SCCHN患者在1L中对帕博利珠单抗有应答• STAT3和IRS--to-AKT/catenin通路,已知与癌症干细胞更新、免疫逃避、转移和高度参与对PD 1的耐药性和西妥昔单抗靶向未满足的医疗需求• SCCHN是第6大最常见的癌症类型;预计到2024年新增17.5万例/年• 1L标准护理已从化疗转向免疫-肿瘤+化疗•< 20%的R/M SCCHN患者对Pembrolizumab有应答•预测2030年市场规模> $ 5b α-PD-1 +化疗1L 60K pts西妥昔单抗2L 48K pts NT219 NT219 +西妥昔单抗或帕博利珠单抗有潜力成为SOC作为R/m SCCHN NT 219的1 st/2线治疗
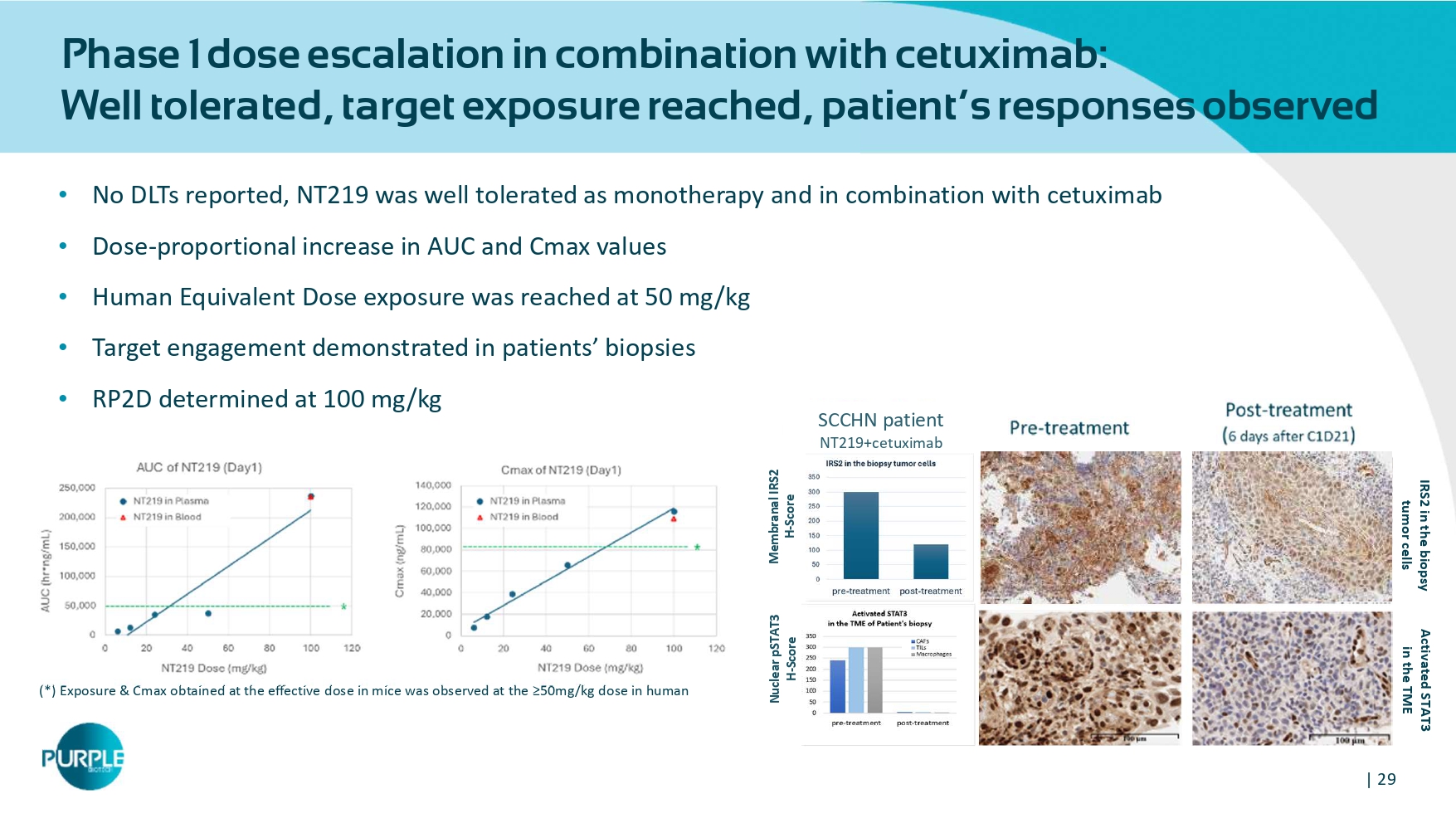
| 29与西妥昔单抗联合用药的1期剂量递增:耐受性良好,达到目标暴露,观察到患者反应•无DLTs报告,NT219作为单一疗法和联合西妥昔单抗具有良好的耐受性• AUC的剂量-比例增加和Cmax值•人体等效剂量暴露量达到50mg/kg •患者活检中证明的目标接合度• RP2D确定为100mg/kg(*)在人IRS2中以≥ 50mg/kg剂量在活检肿瘤细胞中激活STAT3的小鼠中观察到有效剂量下获得的暴露& CAmax在TME核PSTAT3 H-评分H-评分核PSTAT3 H-评分SCCHN患者NT219 +西妥昔单抗
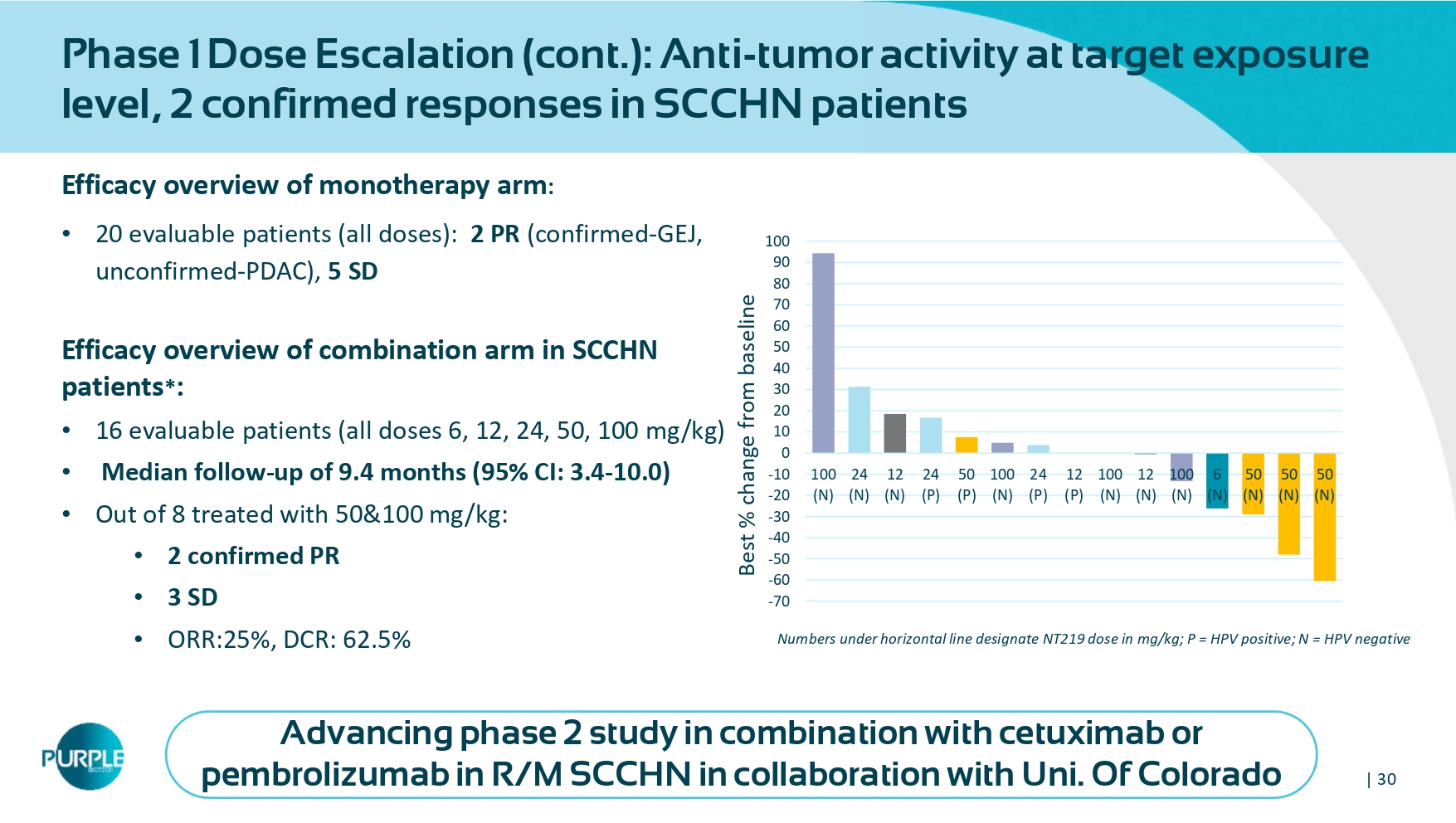
| 30个m onotherapy组疗效综述:• 20个可评估患者(所有剂量):2个PR(确诊-GEJ,未确诊-PDAC),5个SD组合组在SCCHN患者中的疗效综述*:• 16名可评估患者(所有剂量6、12、24、50,100mg/kg)•中位随访9.4个月(95% CI:3.4-10.0)•接受50 & 100mg/kg治疗的8名患者中:• 2名确诊PR • 3名SD • ORR:25%,DCR:62.5% 1期剂量递增(续):目标暴露水平下的抗肿瘤活性,SCCHN患者中2例确诊应答水平线下指定NT219剂量,单位为mg/kg;P = HPV阳性;N =与Uni合作联合西妥昔单抗或派姆单抗在R/M SCCHN中的HPV阴性推进2期研究。科罗拉多州-70-60-50-40-30-20-10 0102030405060708090100100(N)24(N)12(N)24(P)50(P)100(N)24(P)12(P)100(N)12(P)100(N)12(N)100(N)100(N)6(N)50(N)50(N)50(N)与基线的最佳百分比变化
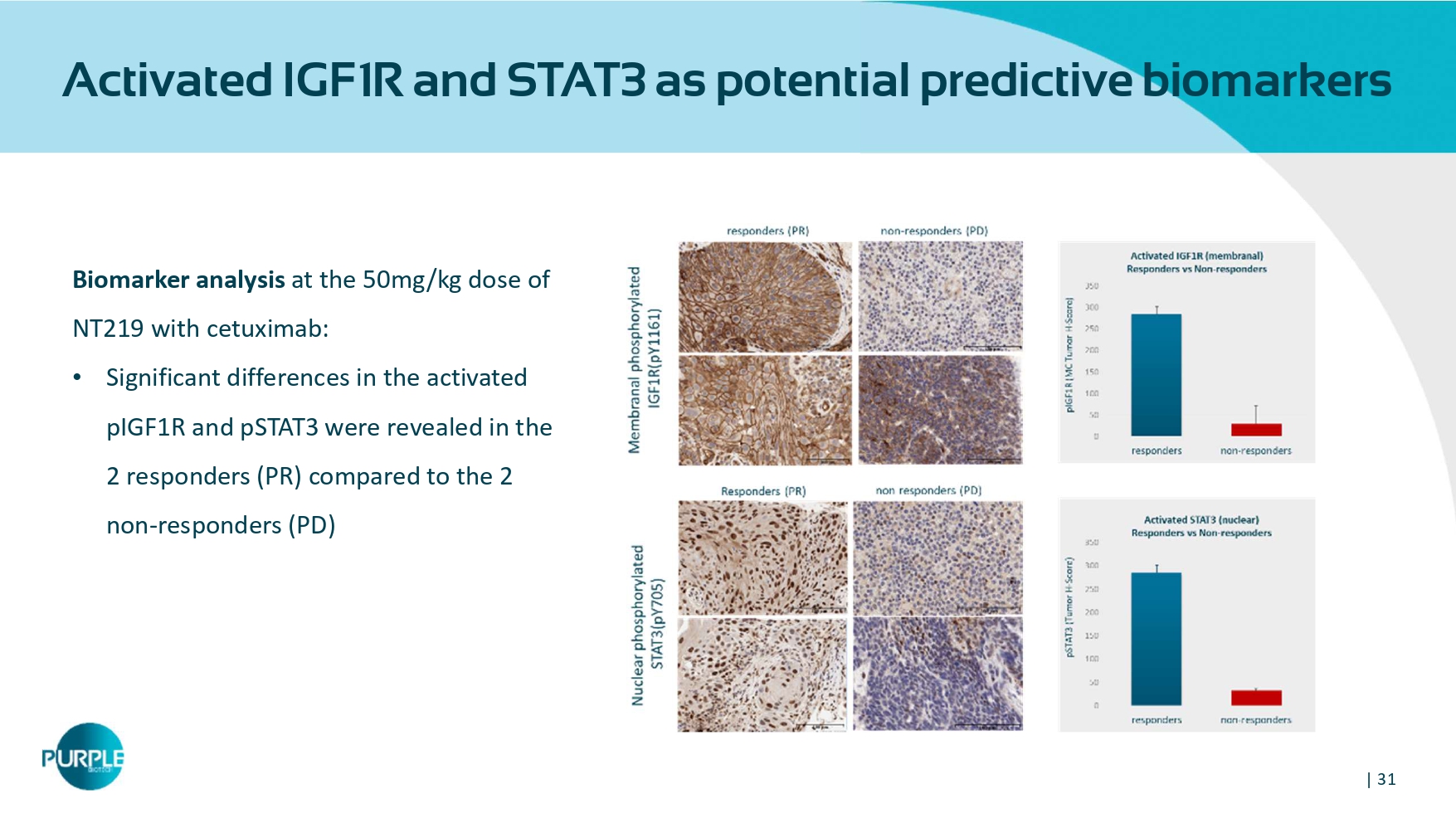
| 31活化IGF1 R和STAT3作为潜在预测生物标志物NT219用西妥昔单抗50mg/kg剂量下的生物标志物分析:• 2应答者(PR)与2无应答者(PD)相比,活化的pIGF1R和PSTAT3存在显着差异

推进一流的肿瘤疗法CAPTN-3:有条件激活的三特异性抗体平台主要候选者:IM1240(CD3x5T4xNKG2A)
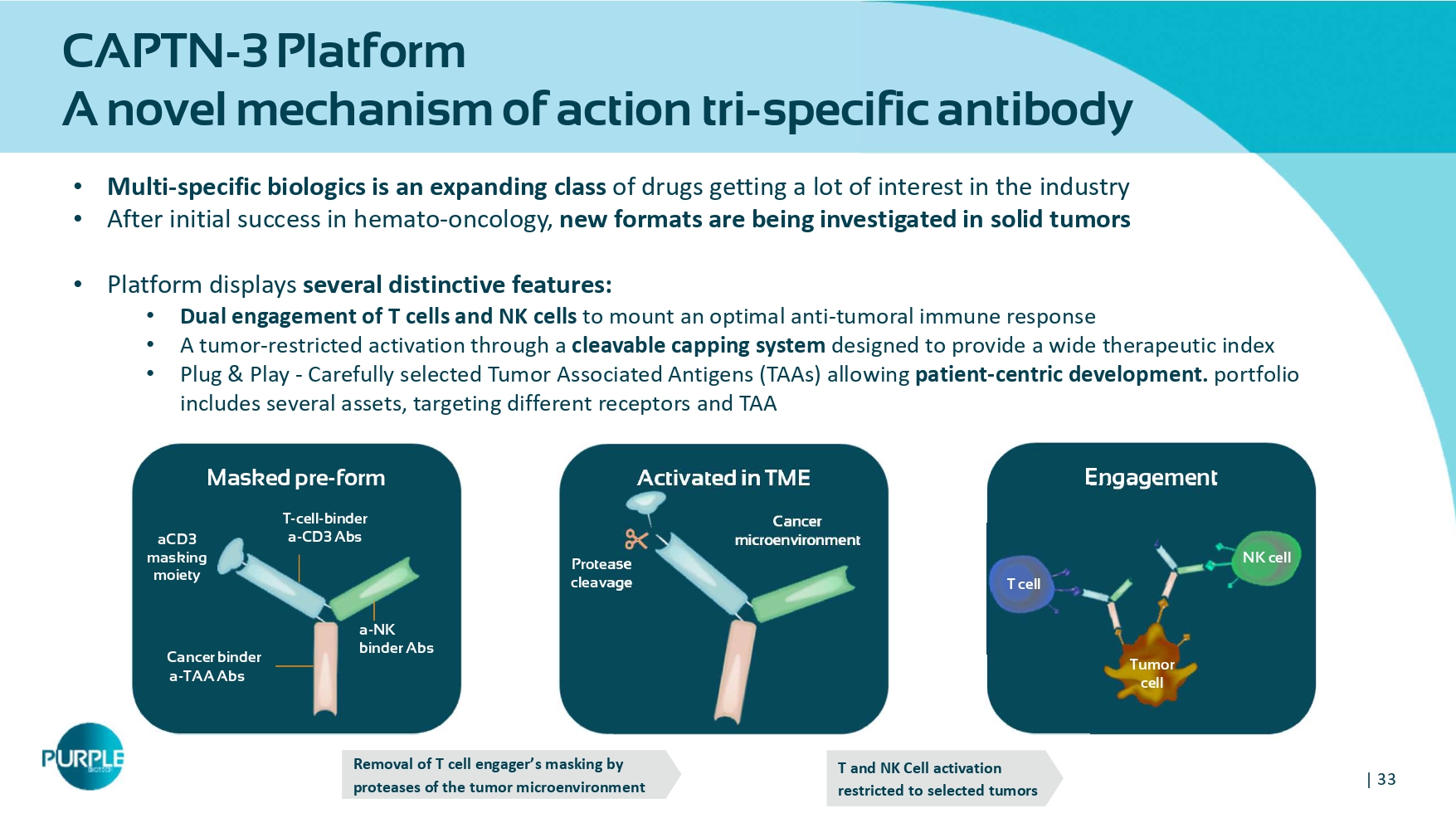
| 33 CAPTN-3平台一种新的作用机制三特异性抗体•多特异性生物制剂是一类不断扩大的药物,获得了业界的大量兴趣•在血液肿瘤学方面取得初步成功后,正在研究实体瘤中的新形式•平台展示了几个独特的特征:• T细胞和NK细胞的双重参与,以安装最佳的抗肿瘤免疫应答•通过可切割的加帽系统进行肿瘤限制性激活,该系统旨在提供广泛的治疗指数•即插即用-精心挑选的肿瘤相关抗原(TAA),允许以患者为中心的开发。投资组合包括几项资产,靶向不同受体及TAA接合在TME掩蔽的预成型癌症结合剂a-TAA ABS a-NK结合剂ABS T-cell-binder a-CD 3 ABS aCD3掩蔽部分肿瘤细胞NK细胞癌症微环境蛋白酶切割去除T细胞接合剂的掩蔽肿瘤微环境T和NK细胞活化仅限于选定肿瘤T细胞
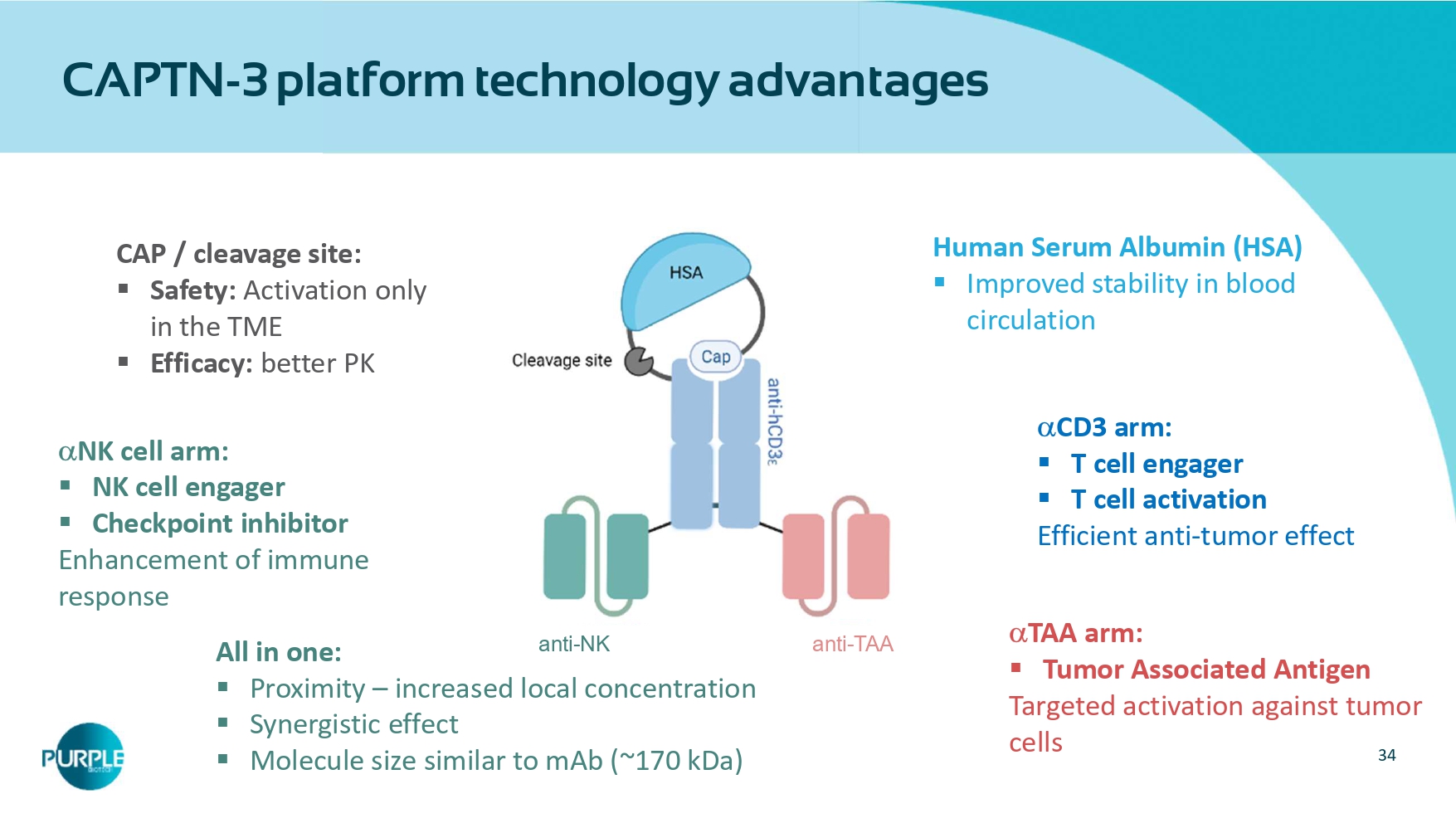
34 CAPTN-3平台技术a dvantages CAP/解理位:▪安全:激活仅在TME▪功效:更好的PK人血清白蛋白(HSA)▪改善血液循环稳定性CD 3臂:▪T细胞接合器▪T细胞活化高效抗肿瘤效应NK细胞臂:▪NK细胞接合器▪免疫应答TAA臂的检查点抑制剂E增强:▪针对肿瘤细胞的肿瘤相关抗原T靶向激活All in one:▪接近度–当地集中度提高▪协同效应▪分子大小类似MAB(~170kDa)抗TAA抗NK
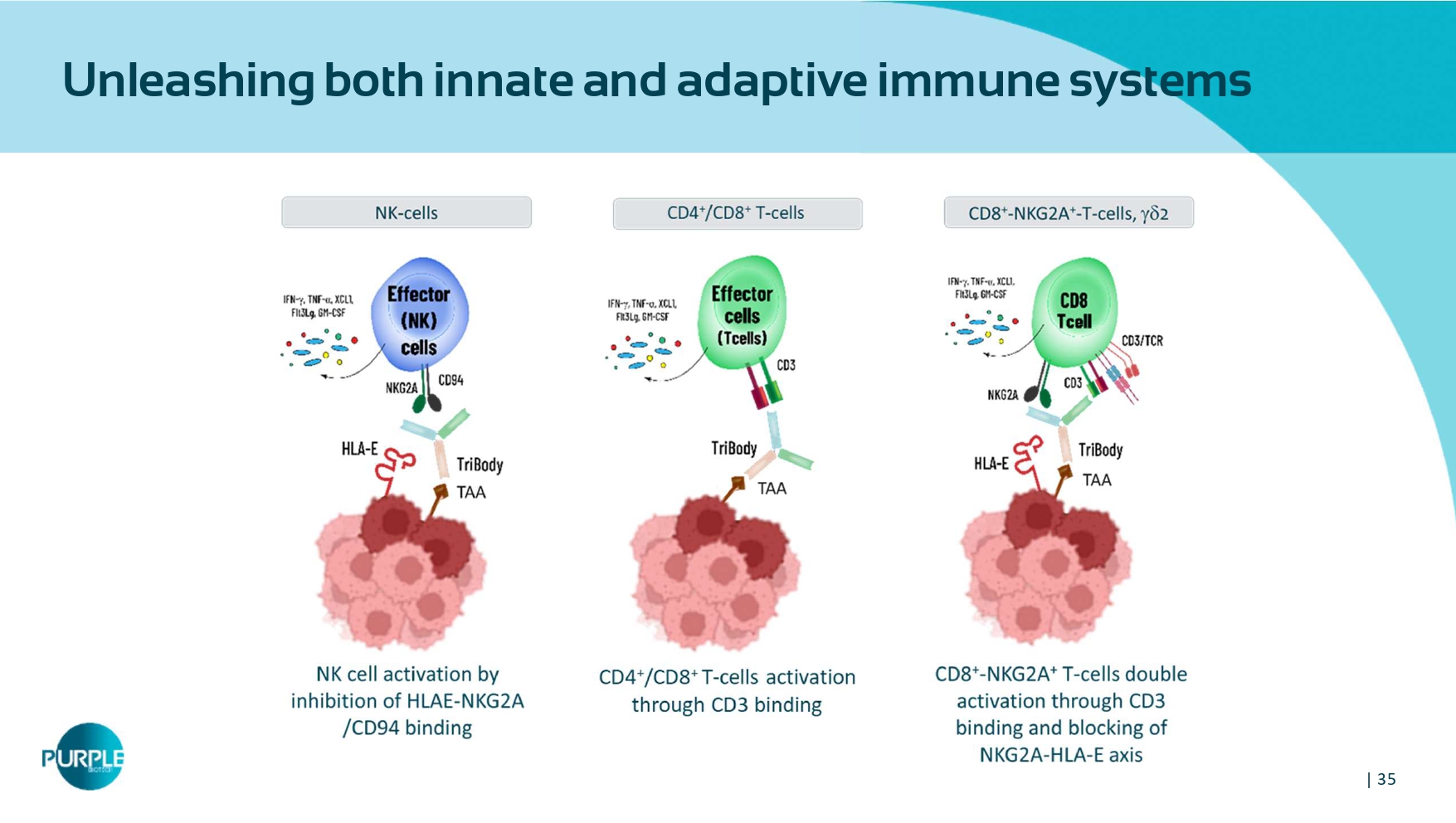
| 35同时释放先天和适应性免疫系统
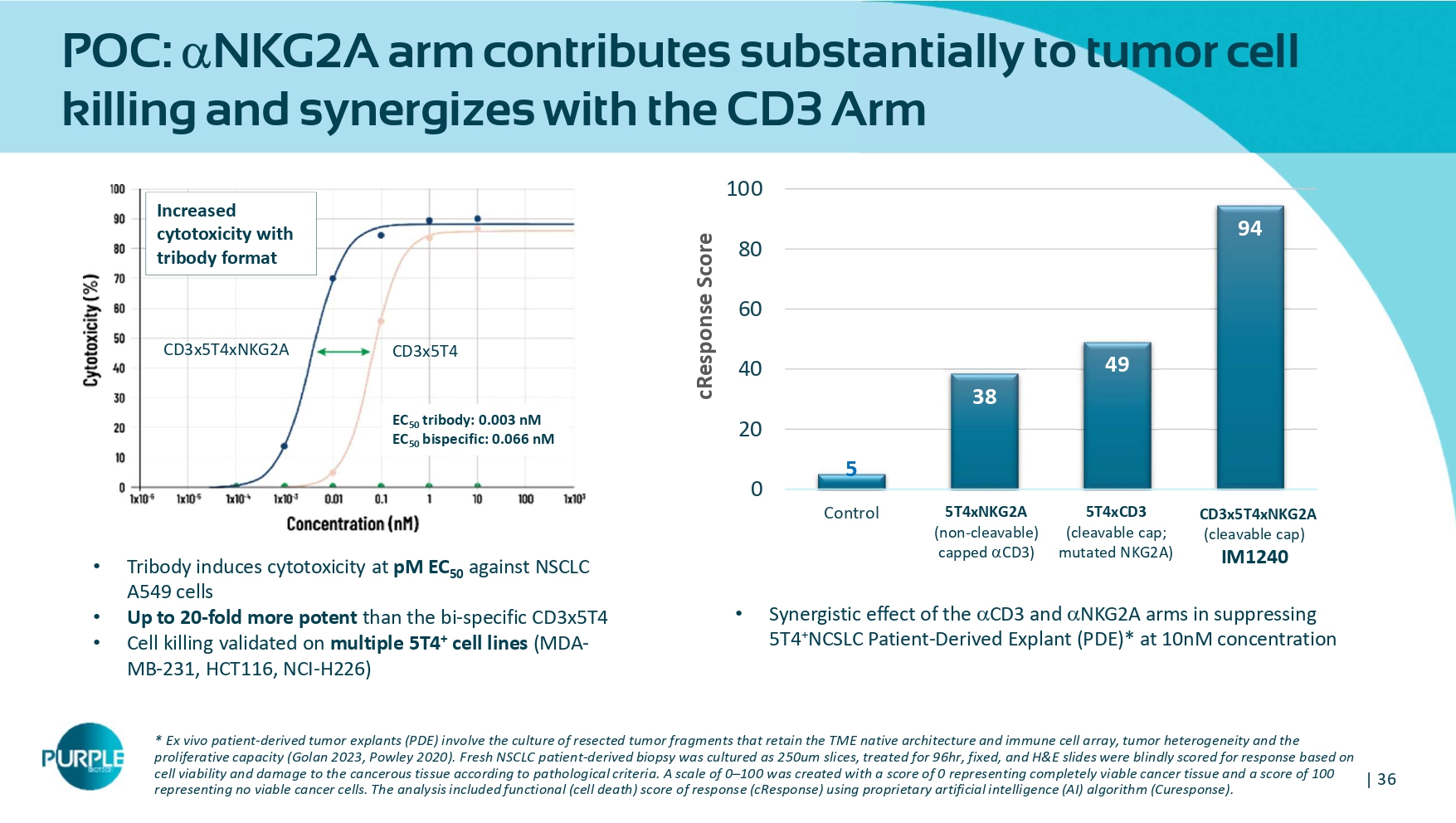
| 365384994020406080100控制IM1242 IM1340 IM1240 cResponse Score CD 3 x 5 T 4 x NKG 2 A(可切割盖子)IM 12405 T 4 xNKG 2 A(不可切割)封顶CD 3)5 T 4 xCD 3(可切割盖子;突变NKG 2 A)• CD3的协同效应和NKG 2 A臂抑制5例T4 + NCSLC患者-衍生E xplant(PDE)*在10 nm浓度下*体外患者来源的肿瘤外植体(PDE)涉及保留TME天然Archit结构和免疫细胞阵列的切除肿瘤片段的培养、肿瘤异质性和增殖能力(Golan 2023、Powley 2020)。新鲜NSCLC患者来源活检以250um切片培养,治疗96hr,固定,H & E载玻片根据病理标准,根据细胞活力和癌组织损伤情况,对反应进行盲目评分。创建了一个0– 100的等级,评分为0代表完全存活的癌症组织,评分为100代表没有存活的癌细胞。该分析包括使用propri eta ry人工智能(AI)算法(Curesponse)的功能性(细胞死亡)响应评分(cResponse)。• Tribody在pM EC 50对NSCLC A549细胞诱导细胞毒性•比BI特异性CD3 x5 T4的效力高达20倍•在多个5 T4 +细胞系(MDA-MB-231、HCT 116、NCI-H 226)上验证的细胞杀伤CD3x5T4xNKG2A CD 3 x5 T4增加的细胞毒性与tribody格式EC 50 tribody:0.003 nM EC 50双特异性:0.066 nM POC:NKG 2 A臂对肿瘤细胞杀伤有重大贡献,并与CD3臂协同作用
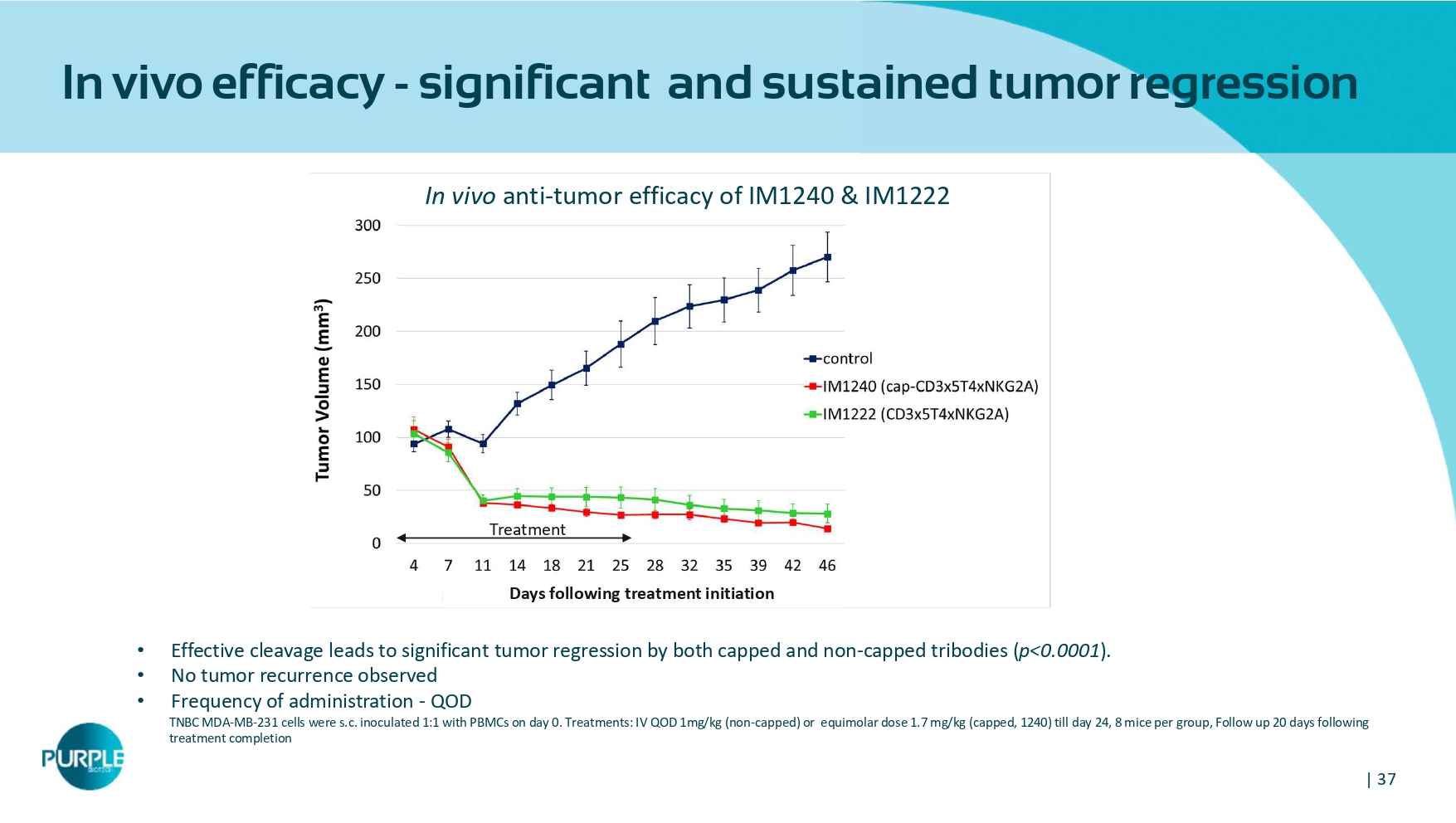
| 37体内疗效-显著且持续的肿瘤消退•有效的切割导致带帽和非带帽三体均显着的肿瘤消退(p < 0.0001)。•未观察到肿瘤复发•给药频率-QOD TNBC MDA-MB-231细胞在第0天用PBMC 1:1接种s.c.。治疗:IV QOD1 mg/kg(非封顶)或等摩尔剂量1.7 mg/kg(封顶,1240)至第24天,每组8只小鼠,治疗结束后20天随访治疗开始后的天数治疗IM1240 & IM1222的体内抗肿瘤疗效
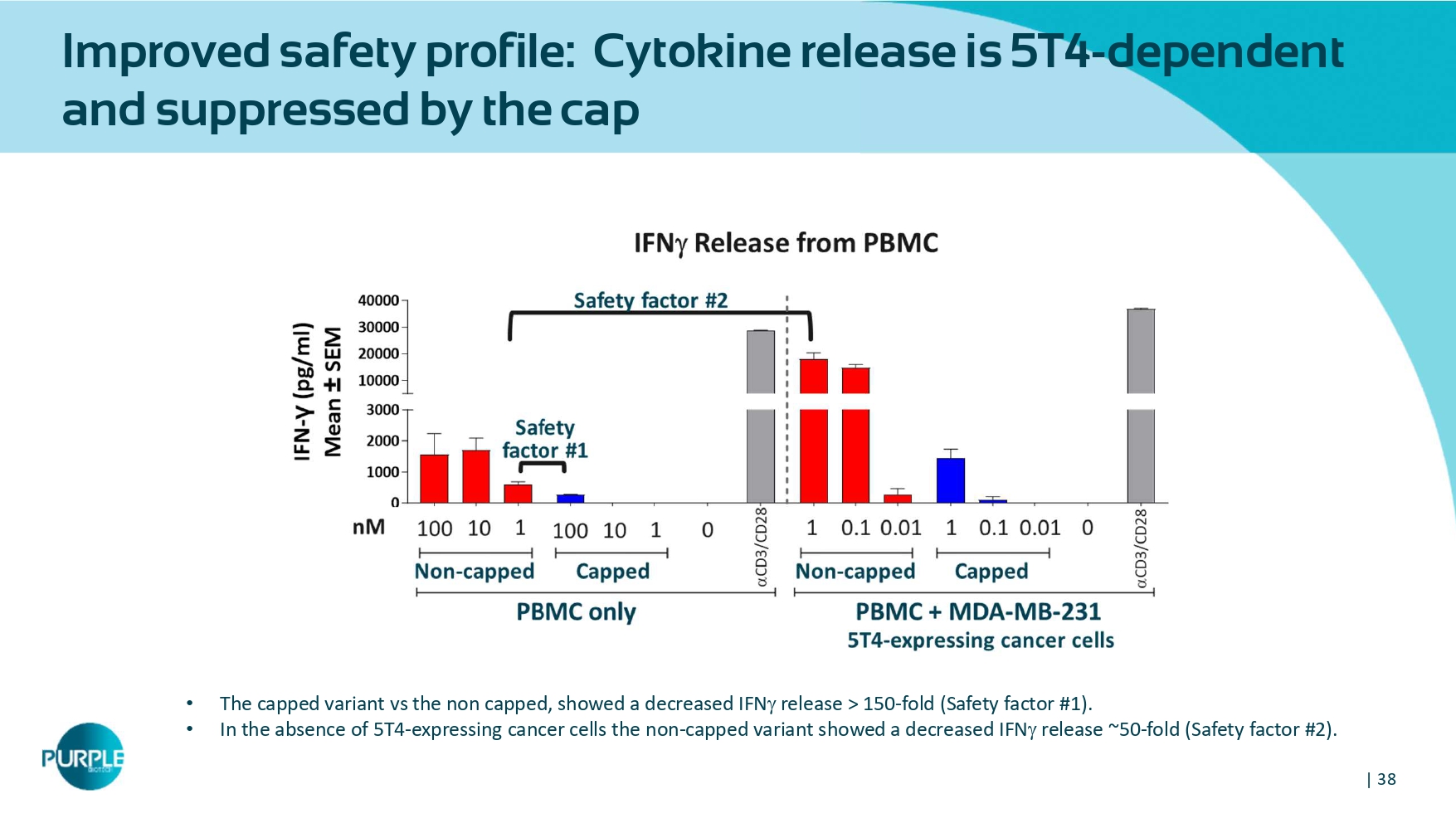
| 38安全性改善:细胞因子释放5T4-依赖并受封顶抑制•有封顶的变体与未封顶的变体相比,显示IFN释放降低> 150倍(安全系数# 1)。•在没有5个T4-表达癌细胞的情况下,非封顶变异表现出IFN释放减少~50倍(安全系数# 2)。
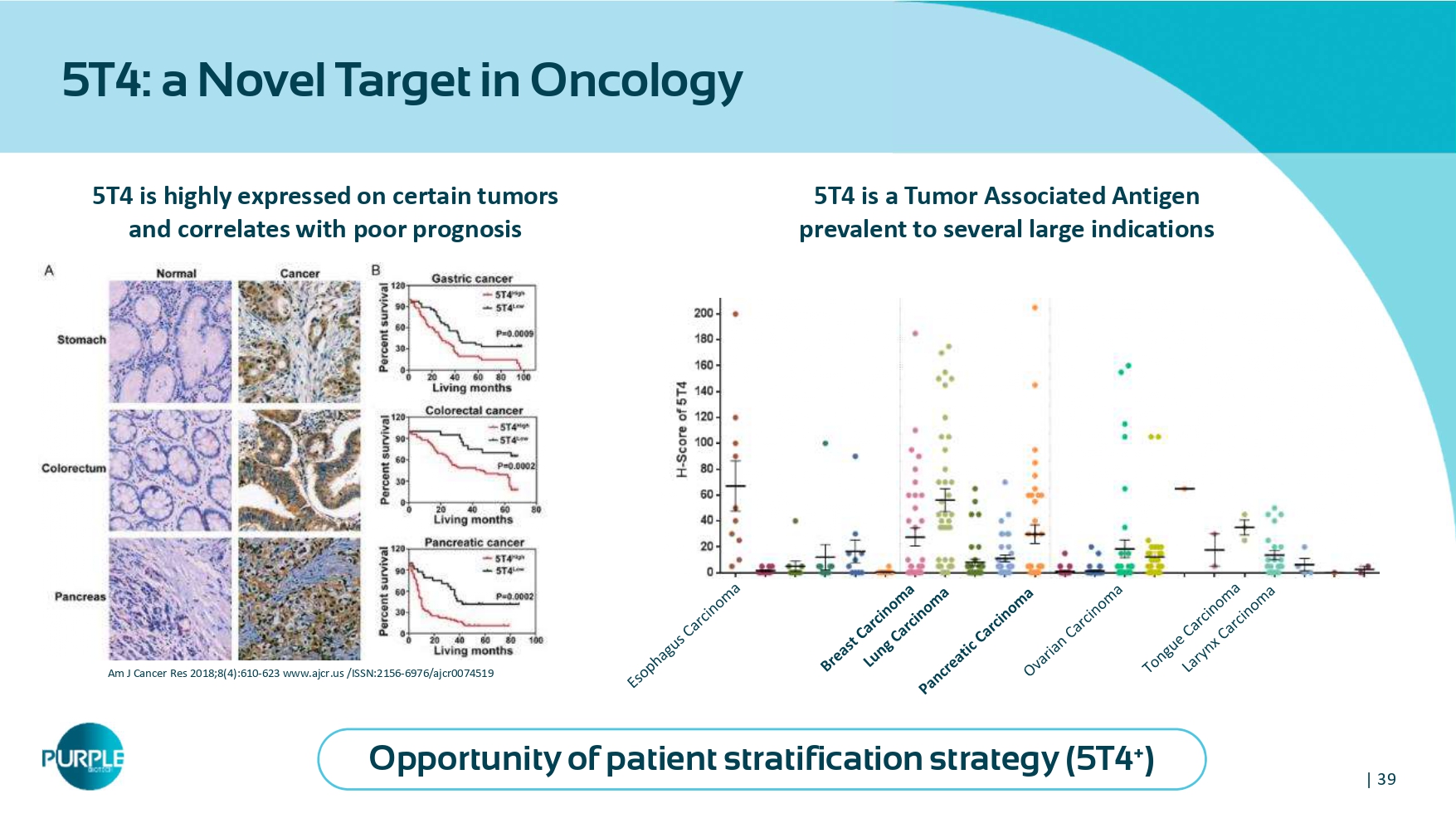
| 39 5T4:肿瘤学新靶点5 T4在某些肿瘤上高表达,与预后不良相关AM J Cancer Res 2018;8(4):610-623 www.ajcr.us/ISSN:2156-6976/ajcr0074519 5 T4是一种肿瘤相关抗原,流行于几个大适应症患者分层策略的机会(5 T4 +)

| 40家公司亮点Purple Biotech(NASDAQ/TASE:PPBT)截至2024年12月31日•未偿ADS:260万•现金余额:820万美元,具备推进下一个临床里程碑的良好条件•两种一流的临床阶段药物•一个临床前三特异性免疫接合器平台•精益和全球化运营•进入2026年中期的现金跑道Purple Biotech确定了有前景的一流候选药物,以治疗具有高度未满足医疗需求的癌症

| 41联系我们:ir@purple-biotech.com谢谢

附录A | CM24
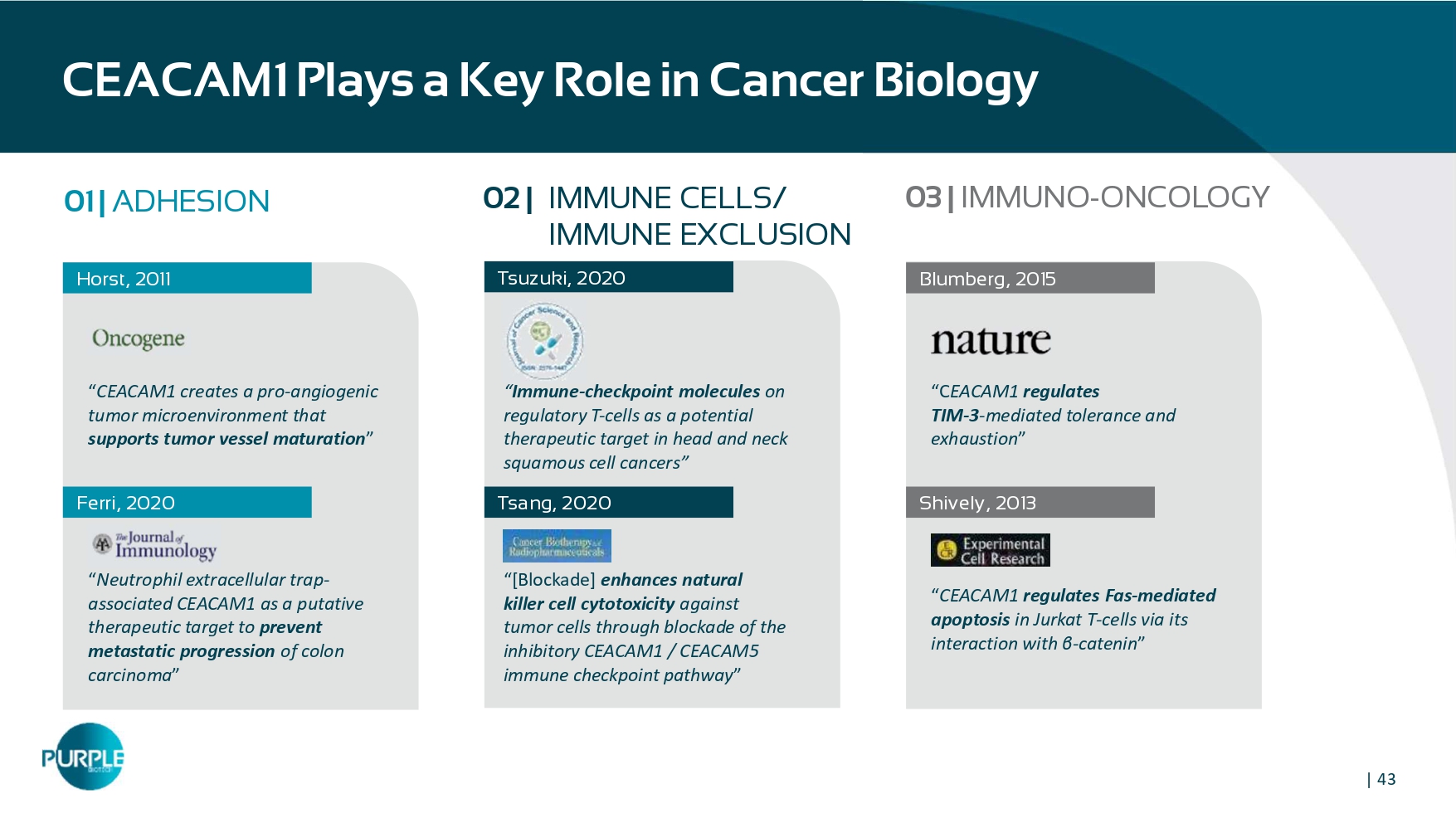
| 43 CEACAM1在癌症生物学中发挥关键作用01 | ADHESION Horst,2011“CEACAM 1创造支持肿瘤血管成熟的促血管生成肿瘤微环境”“中性粒细胞细胞细胞外陷阱相关CEACAM 1作为防止结肠癌转移进展的推定治疗靶点”Ferri,2020 Tsuzuki,2020 Tsang,2020 Blumberg,2015“C EACAM 1调节TIM-3介导的耐受性和衰竭”“CEACAM1通过其与β-catenin的相互作用调节Jurkat T细胞中FAS-介导的凋亡”Shively,201302 |免疫细胞/免疫排除03 | IMMUNO-ONCOLOGY“调节性T细胞上的免疫检查点分子作为头颈部鳞状细胞癌潜在治疗靶点”“[阻断]通过阻断抑制性CEACAM 1/CEACAM 5免疫检查点通路,增强自然杀伤细胞对肿瘤细胞的细胞毒性”
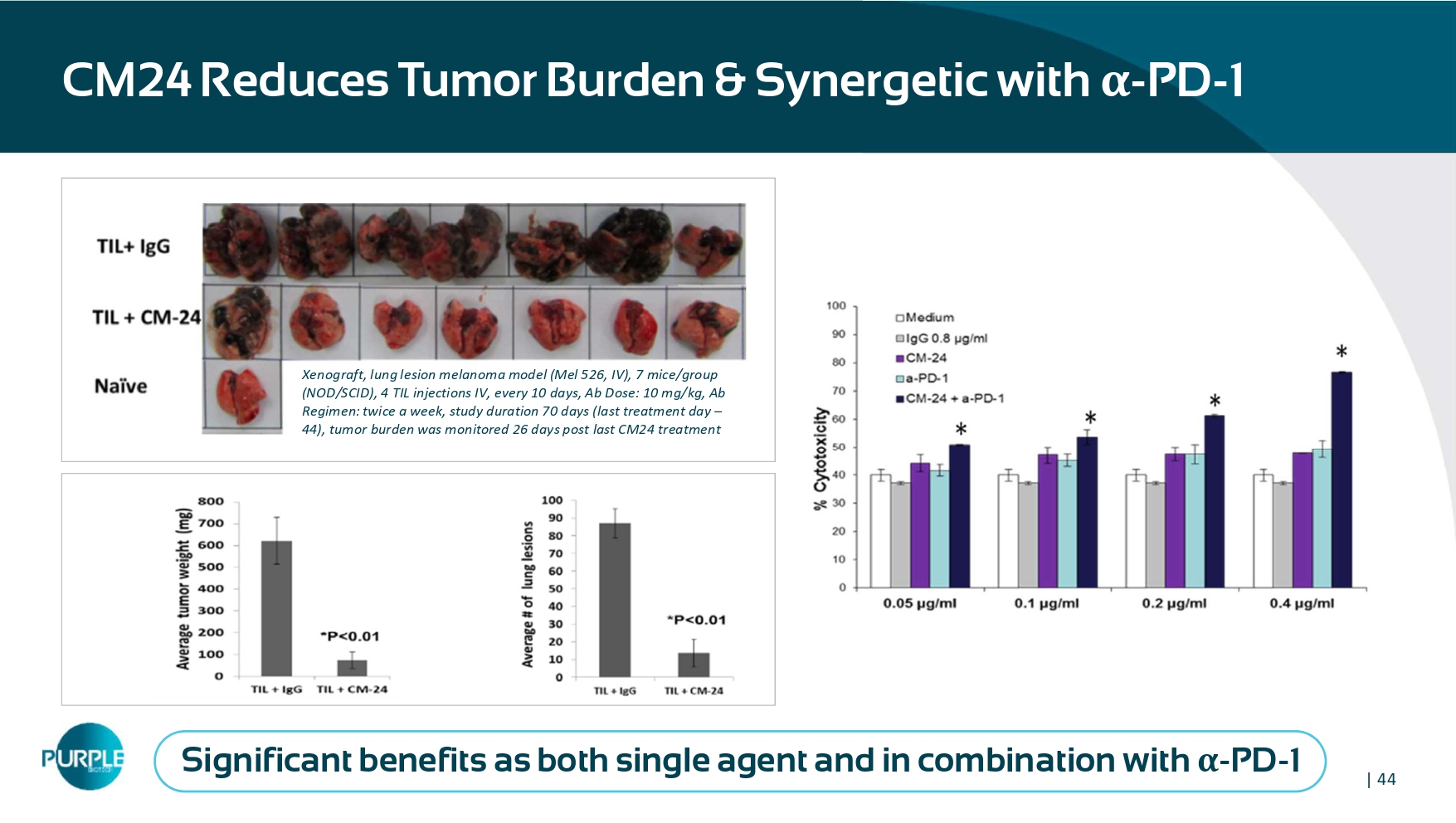
| 44CM24减轻肿瘤负担&与α-PD-1异种移植物协同增效,肺部病变黑色素瘤模型(MEL526、IV),7小鼠/组(NOD/SCID),4次TIL注射IV,每10天一次,AB剂量:10mg/kg,AB方案:每周两次,研究持续时间70天(最后一次治疗日– 44),在最后一次CM24治疗后26天监测肿瘤负荷,作为单药和与α-PD-1联合使用均显着获益
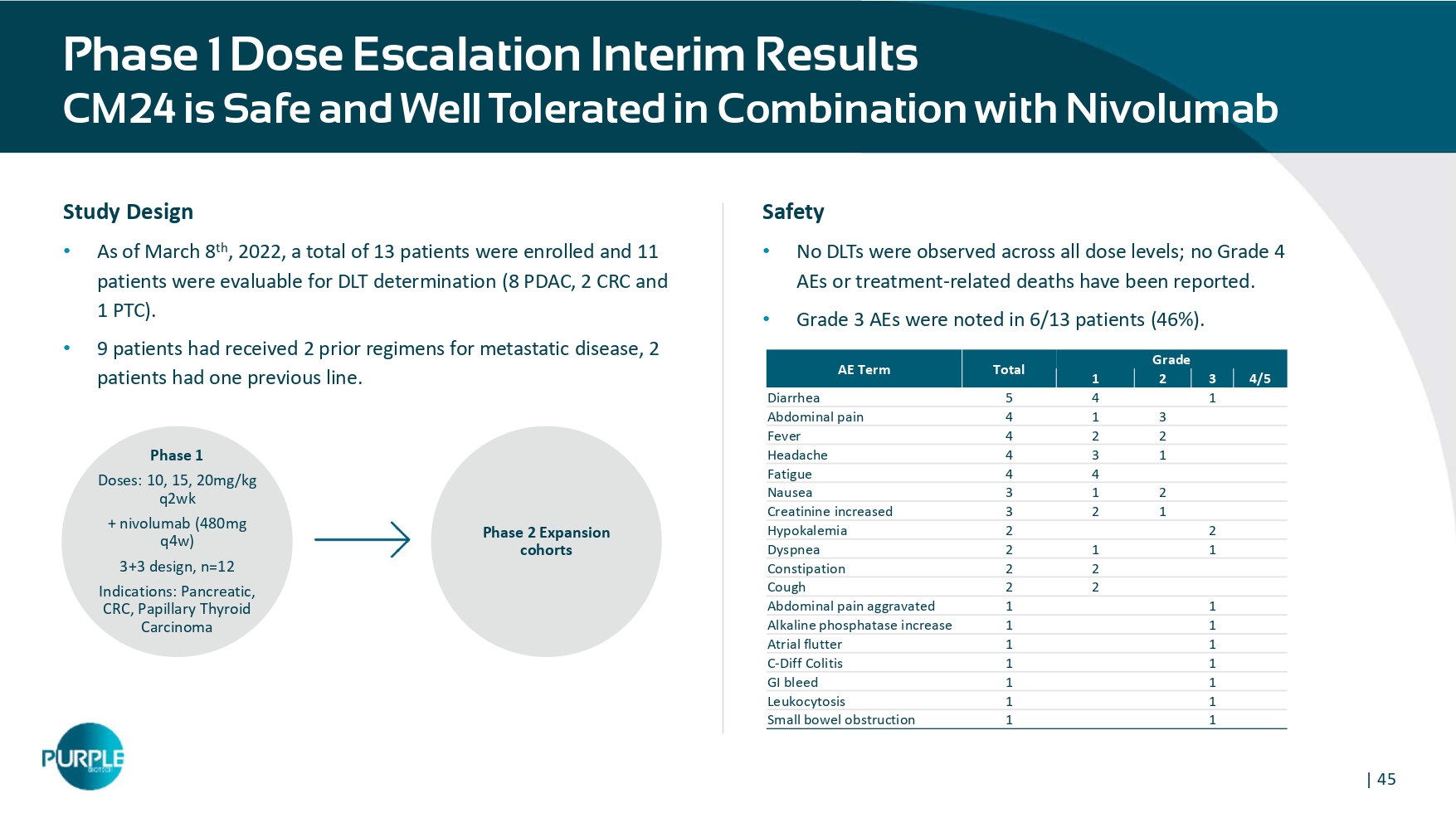
| 45期1剂量递增中期业绩CM24安全无虞并在Combi NATION与Nivolumab级总AE4/5321145腹泻314腹痛224发热134头痛44乏力213恶心123肌酐升高22低钾血症112呼吸困难22便秘22咳嗽11腹痛加重11房扑11 C-Diff结肠炎11胃肠道出血11白细胞增多11小肠梗阻研究设计•截至3月8日,2022年,共入组13例患者,11例可评估DLT测定(8例PDAC、2例CRC和1例PTC)。•9名患者接受过2次转移性疾病既往治疗方案,2名患者有1次既往行。1期剂量:10、15、20mg/kg q2wk + nivolumab(480mg q4w)3 + 3设计,n = 12适应症:胰腺、CRC、甲状腺乳头状癌2期扩展队列安全性•所有剂量水平均未观察到DLTs;未报告4级AEs或与治疗相关的死亡。• 6/13例患者(46%)出现3级AEs。

| 46例CM24 1期联合研究(NCT04731467)1期部分的人口统计数据显示,有指示难治性癌症的患者分别以10、15和20mg/kg q2w和nivolumab 480mg q4w给药CM24。•这部分的主要目的是评估安全性、耐受性、药代动力学并确定RPTD •安全性根据CTCAE v5进行评估,研究人员根据RECISTV1.1使用CT/MRI评估初步抗肿瘤活性•血清、活检标本和TILs中的CM24和CEACAM1测量,以及肿瘤和TILs PD-L1水平正在确定中截至2022年3月8日,共入组13例患者,11例患者可评估剂量限制性毒性(DLT)测定(8 PDAC,2例CRC和1例PTC)•9例患者接受了2例转移性疾病的既往治疗方案,2例患者有1例既往行。CM24(10,15,20mg/kg)联合纳武利尤单抗(480mg)治疗的患者人口统计,n(%)65(49-76)中位年龄,年龄(范围)2(18%)1性别,n(%)9(82%)25(45%)男性诊断,n(%)6(55%)女性8(73%)胰腺癌种族,n(%)1(9%)甲状腺乳头状癌10(91%)不是西班牙裔或拉丁裔2(18%)大肠癌1(9%)西班牙裔或拉丁裔23(11-73)从初次诊断开始的中位时间(范围)种族,n(%)ECOG,n(%)10(91%)白7(64%)01(9%)黑人或非裔美国人4(36%)1
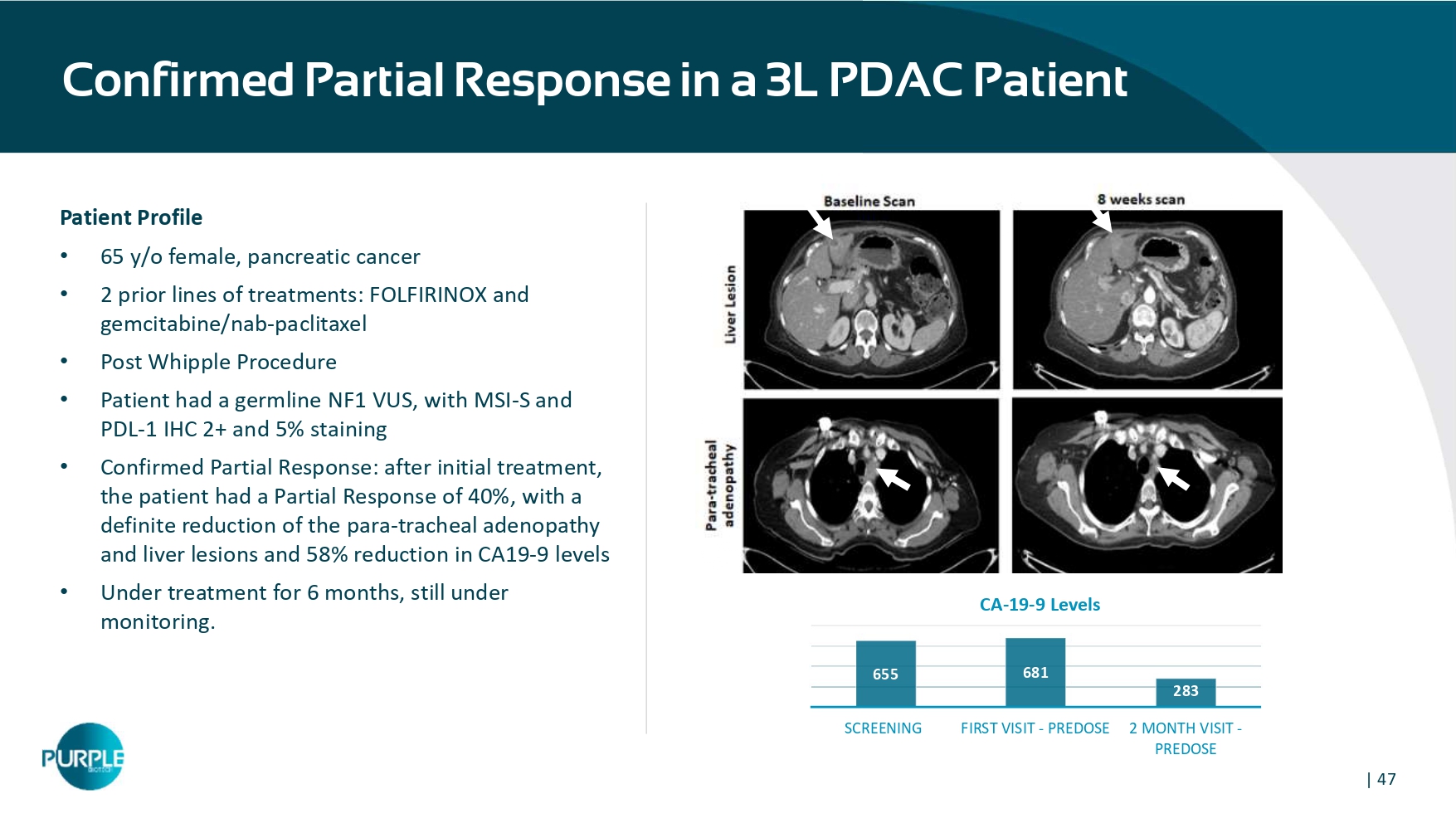
| 47例3L PDAC患者确诊部分缓解• 65 y/o女性,胰腺癌•2个既往治疗线:FOLFIRINOX和吉西他滨/nAB-紫杉醇• Whipple术后•患者出现生殖系NF1 VUS,伴有MSI-S和PDL-1丨IHC丨2 +和5%染色•确诊部分缓解:初步治疗后,患者部分缓解40%,副气管淋巴结肿大和肝脏病变明确减少,CA19-9水平降低58% •正在治疗6个月,仍在监测中。655681283筛查首次访问-PreDOSE 2个月访问-PreDOSE 加利福尼亚州-19-9级
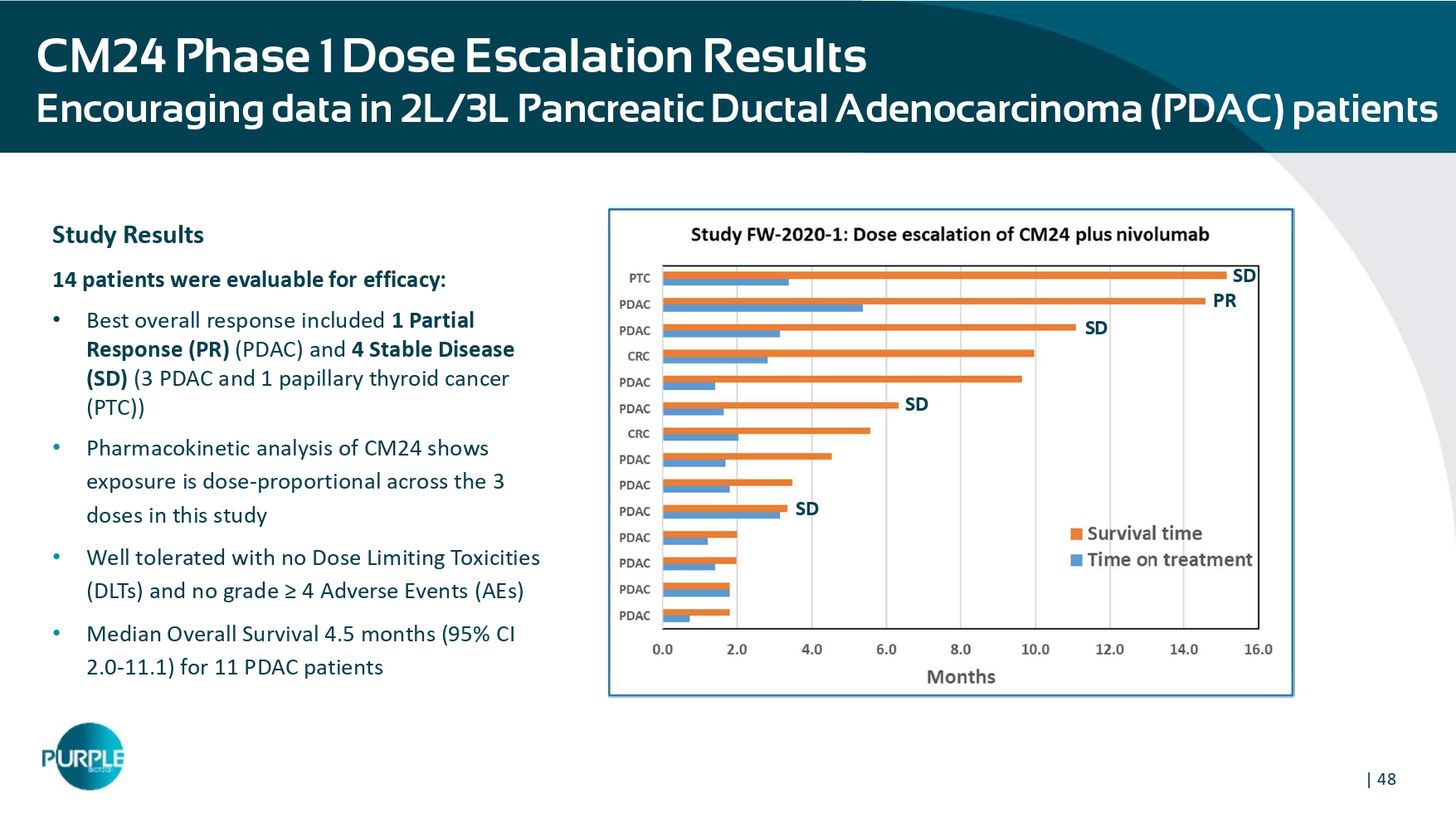
| 2L/3L胰腺导管腺癌(PDAC)患者中48例CM24 1期剂量递增结果E耐药数据研究结果14例患者的疗效可评估:•最佳总体缓解包括1例部分缓解(PR)(PDAC)和4例稳定疾病(SD)(3例PDAC和1例甲状腺乳头状癌(PTC))• CM24的药代动力学分析显示,在本研究的3个剂量中,暴露是剂量成正比的•耐受性良好,无剂量限制毒性(DLTs)且无≥ 4级不良事件(AEs)• 11例PDAC患者PR SD SD SD SD的中位总生存期4.5个月(95% CI 2.0-11.1)

附录b | NT219
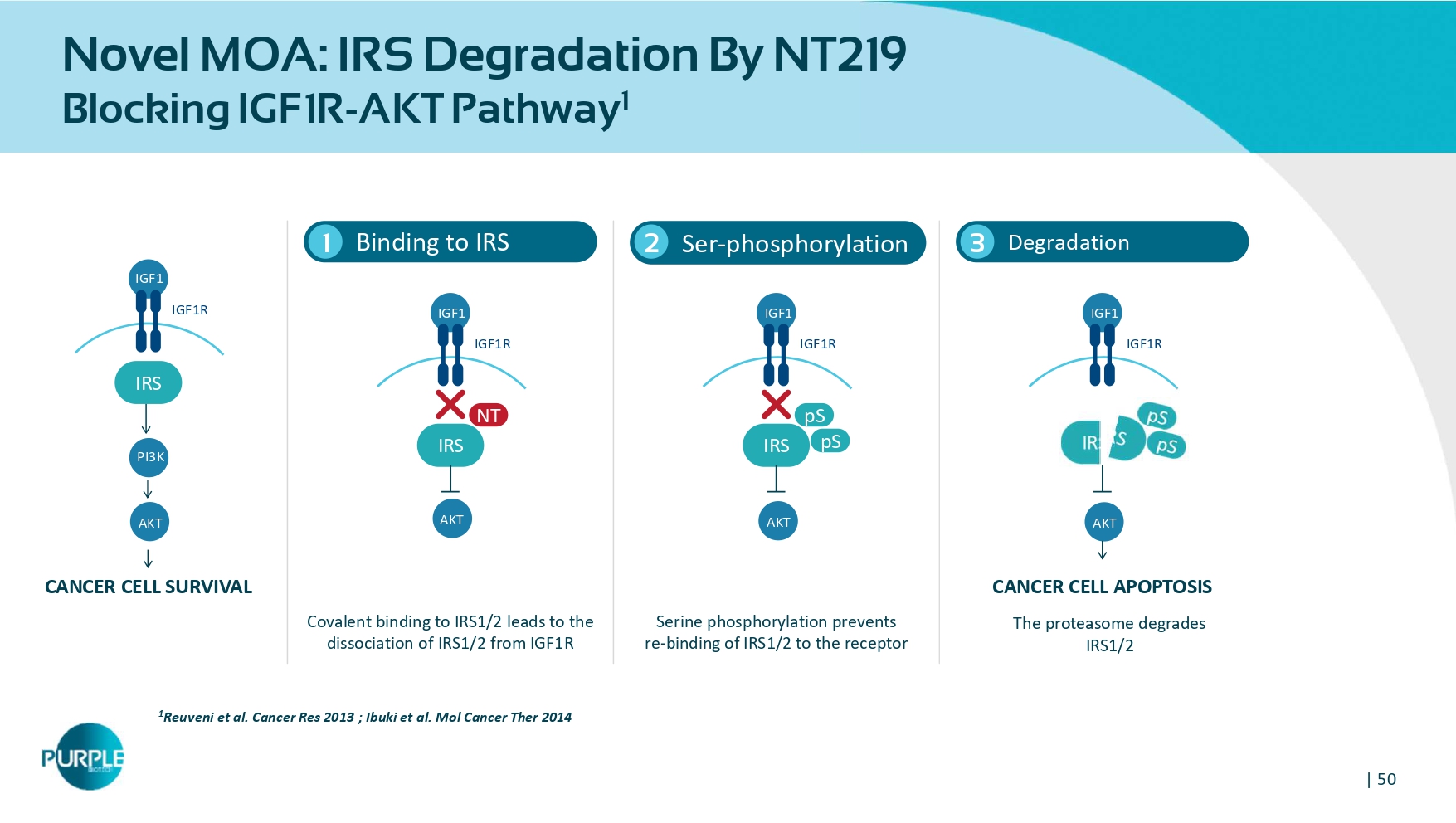
| 50种新型MOA:IRS通过NT219阻断IGF1R-AKT通路1结合IRS 11 Reuveni等人Cancer Res 2013;Ibuki等人mol Cancer ther 2014 Ser-磷酸化2降解3共价结合IRS1/2导致IRS1/2从IGF1R丝氨酸磷酸化中解离,阻止IRS1/2与受体癌症细胞存活性癌症细胞凋亡蛋白酶体降解IRS1/2 IGF 1 IGF 1 R IRS AKT PI 3 K IGF 1 IGF 1 R IRS NT AKT IGF 1 IGF 1 R IRS PS AKT IGF1 IGF 1 R AKT
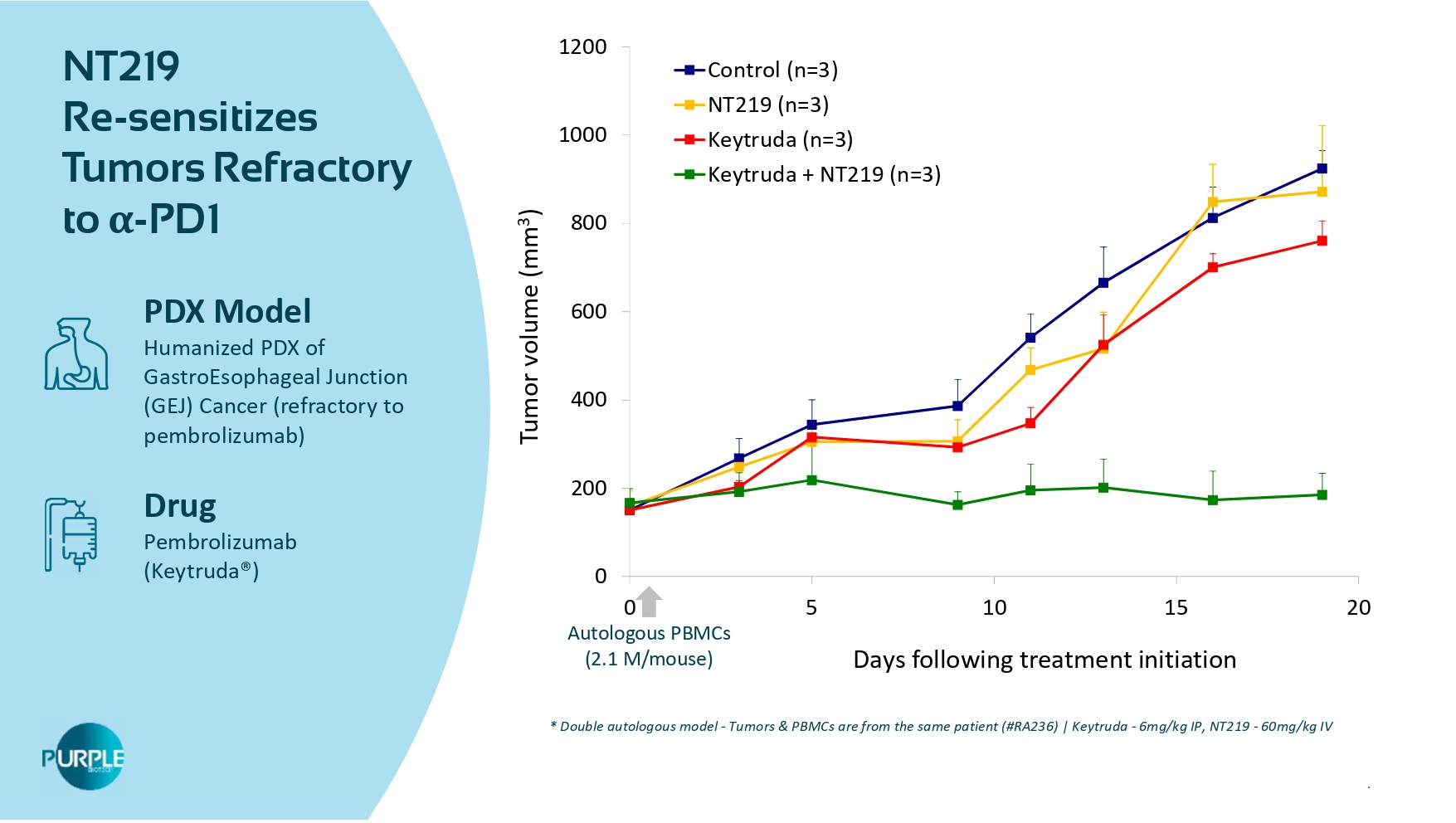
| 51 NT219 RE-对α-PD 1PDX模型胃食管结合部(GEJ)癌(pambrolizumab难治)药物pambrolizumab(Keytruda®)02004006008001000120005 101520治疗开始后的肿瘤体积(mm 3)天数控制(n = 3)NT219(n = 3)Keytruda(n = 3)Keytruda + NT219(n = 3)自体PBMC(2.1 m/mouse)*双自体模型-肿瘤& PBMC来自同一患者(# RA236)| Keytruda-6 mg/kg IP,NT219-60 mg/kg IV
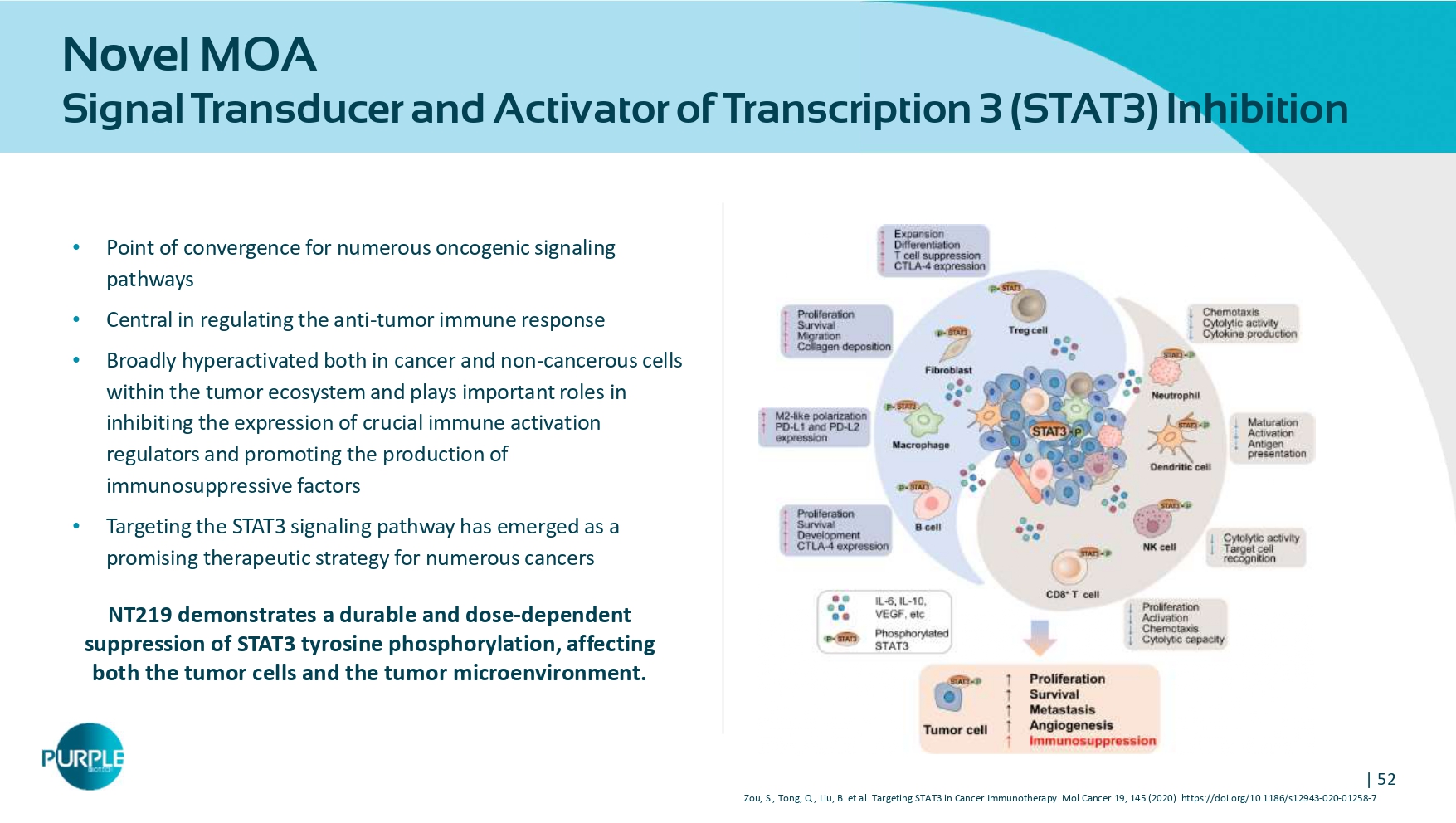
| 52种新型MOA信号转导子和转录激活子3(STAT3)抑制•众多致癌信号通路的汇聚点•调节抗肿瘤免疫反应的核心•在肿瘤生态系统内的癌症和非癌细胞中广泛过度激活,并在抑制关键免疫激活调节因子的表达和促进免疫抑制因子的产生方面发挥重要作用•靶向STAT3信号通路已成为众多癌症的一种有前途的治疗策略NT 219展示了一种持久的和剂量依赖性抑制STAT3酪氨酸磷酸化,同时影响肿瘤细胞和肿瘤微环境。Zou,S.,Tong,Q.,Liu,B. et al.靶向STAT3 in cancer immunotherapy。MOL Cancer 19,145(2020). https://doi.org/10.1186/s12943-020-01258-7
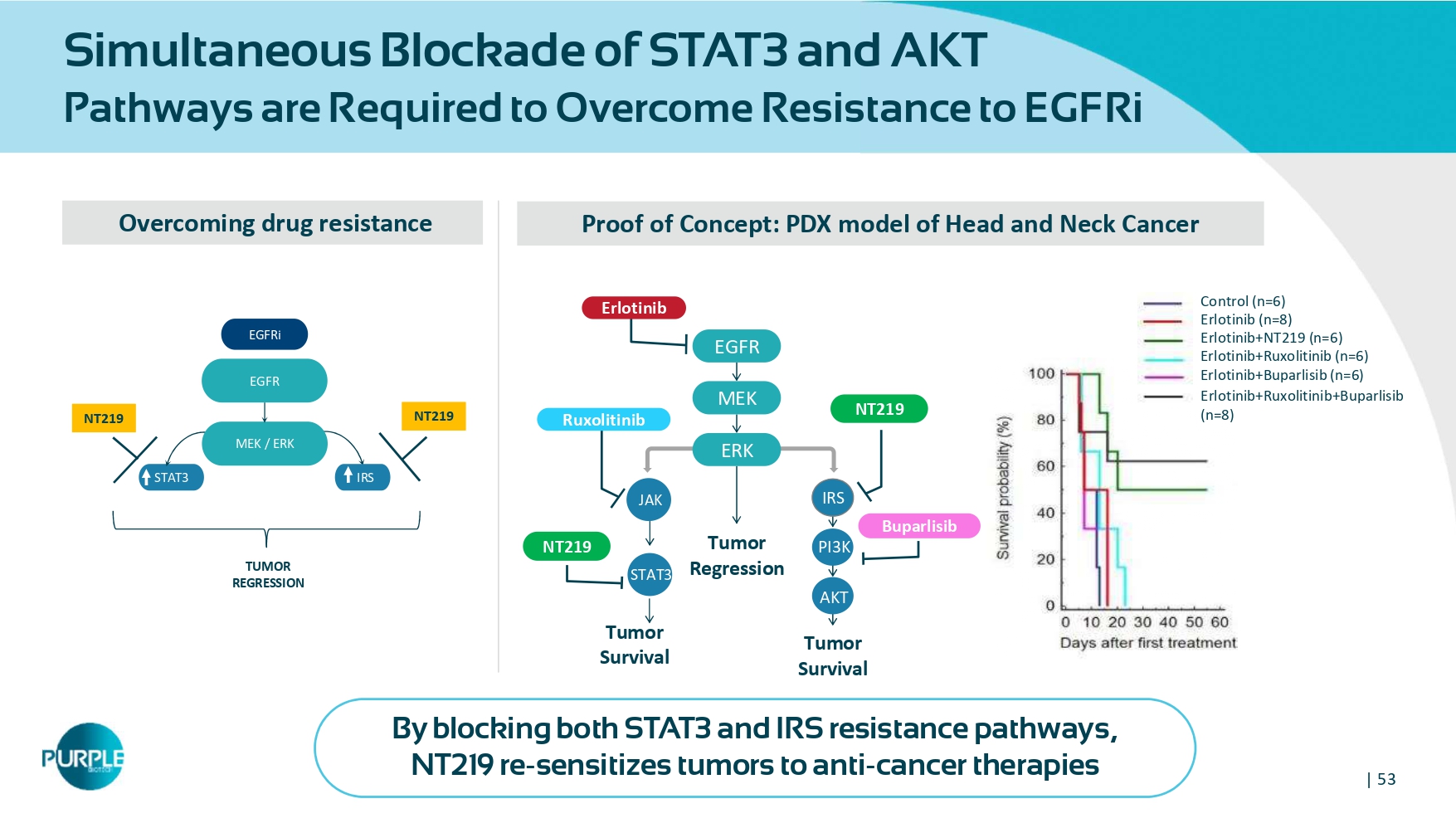
| 53同时阻断STAT3和AKT通路需克服耐药性EGFRi克服耐药性NT219 NT219 STAT3 IRS EGFR EGFRi MEK/ERK肿瘤复发概念证明:PDX模型头颈癌厄洛替尼+鲁索替尼(n = 6)厄洛替尼+布帕利西(n = 6)对照(n = 6)厄洛替尼(n = 8)厄洛替尼+ NT219(n = 6)厄洛替尼+鲁索替尼+布帕利西(n = 8)STAT3 IRS EGFR MEK肿瘤消退ERK PI 3K AKT肿瘤生存期肿瘤生存期布帕利西和IRS耐药通路,NT219使肿瘤对抗癌疗法重新敏感

| 54篇精选出版物Michael Karin Alexander Levitzki Menashe Bar-Eli Michael Cox
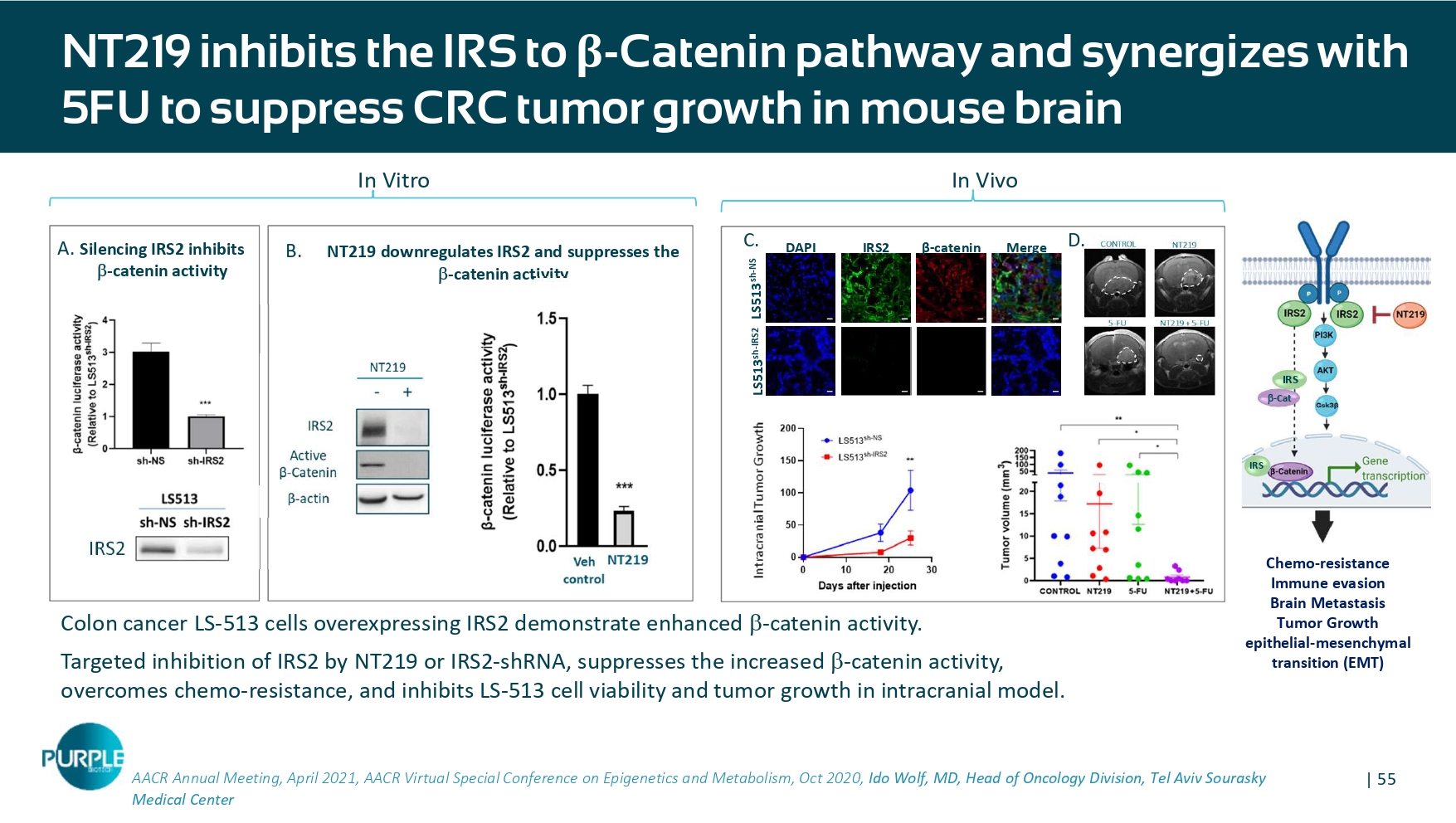
| 55 AACR年会,2021年4月,AACR表观遗传学和代谢虚拟特别会议,2020年10月,特拉维夫Sourasky医学中心结肠癌LS-513个过表达IRS2的细胞显示出增强的-catenin活性。NT219或IRS2-shRNA靶向抑制IRS2,抑制增加的-catenin活性,克服化疗耐药,抑制LS-513细胞活力和颅内模型肿瘤生长。NT219抑制IRS至β-Catenin通路并与5FU协同抑制CRC肿瘤在小鼠脑化疗中的生长-抵抗免疫逃避脑转移肿瘤生长上皮-间充质转化(EMT)IRS-CAT IRS IRS 2 NT219下调IRS 2并抑制-catenin活性沉默IRS2体外抑制-catenin活性LS513 SH-NS LS513 SH-IRS2 DAPI β-catenin IRS2 merge 10 μ m 10 μ m 10 μ m 10 μ m 10 μ m 10 μ m 10 μ m 10 μ m 10 μ m 10 μ m in vivo C. A. B. D。

| 56PDX模型胰腺癌药物吉西他滨(Gemzar®)NT219 |胰腺癌联合吉西他滨高效抗癌活性表现NT219联合吉西他滨
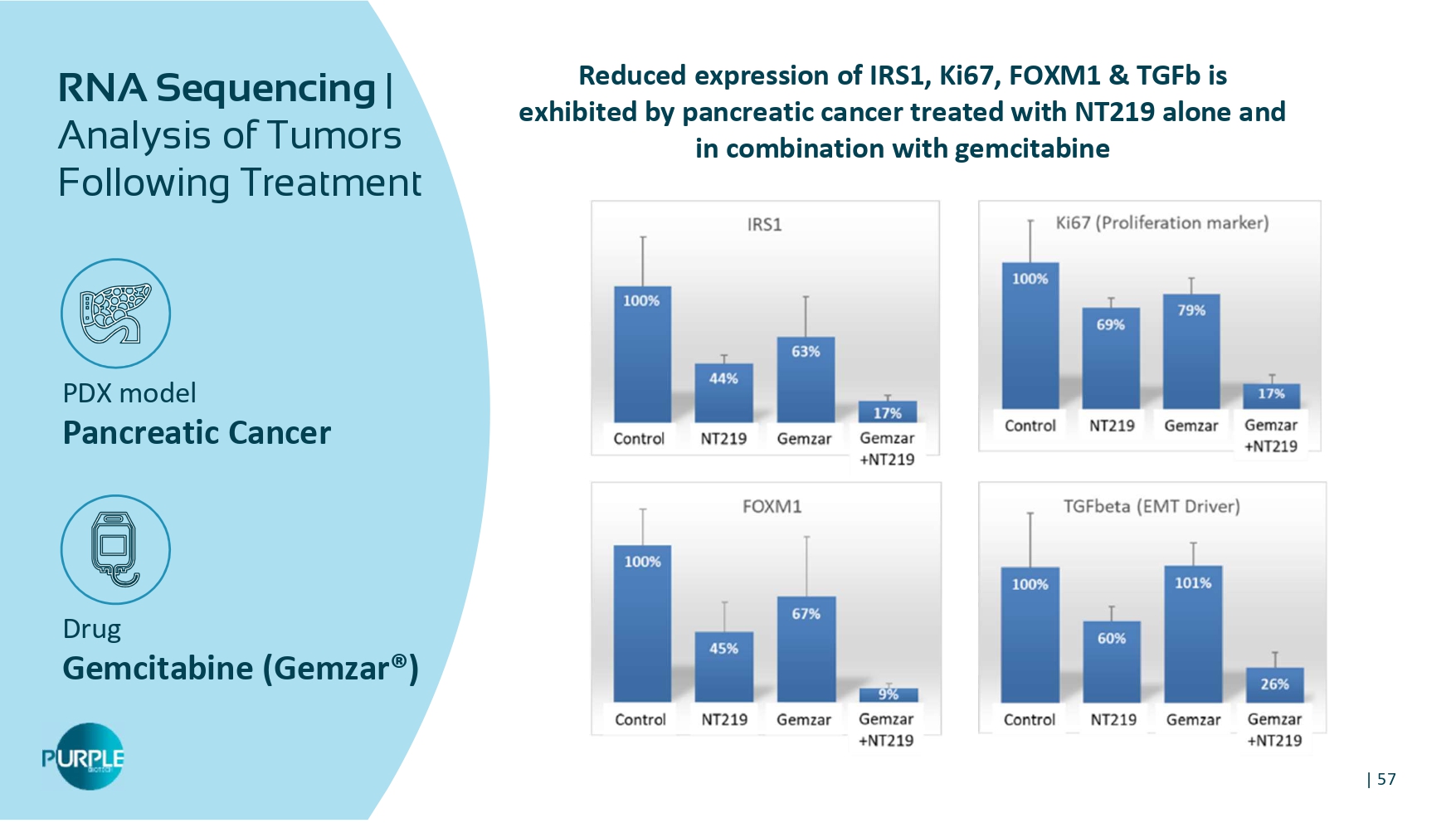
| 57 PDX模型胰腺癌药物吉西他滨(Gemzar®)RNA测序|治疗后肿瘤分析IRS1、KI67、FOXM1 & TGFB表达降低胰腺癌单独用NT219和联合吉西他滨治疗表现
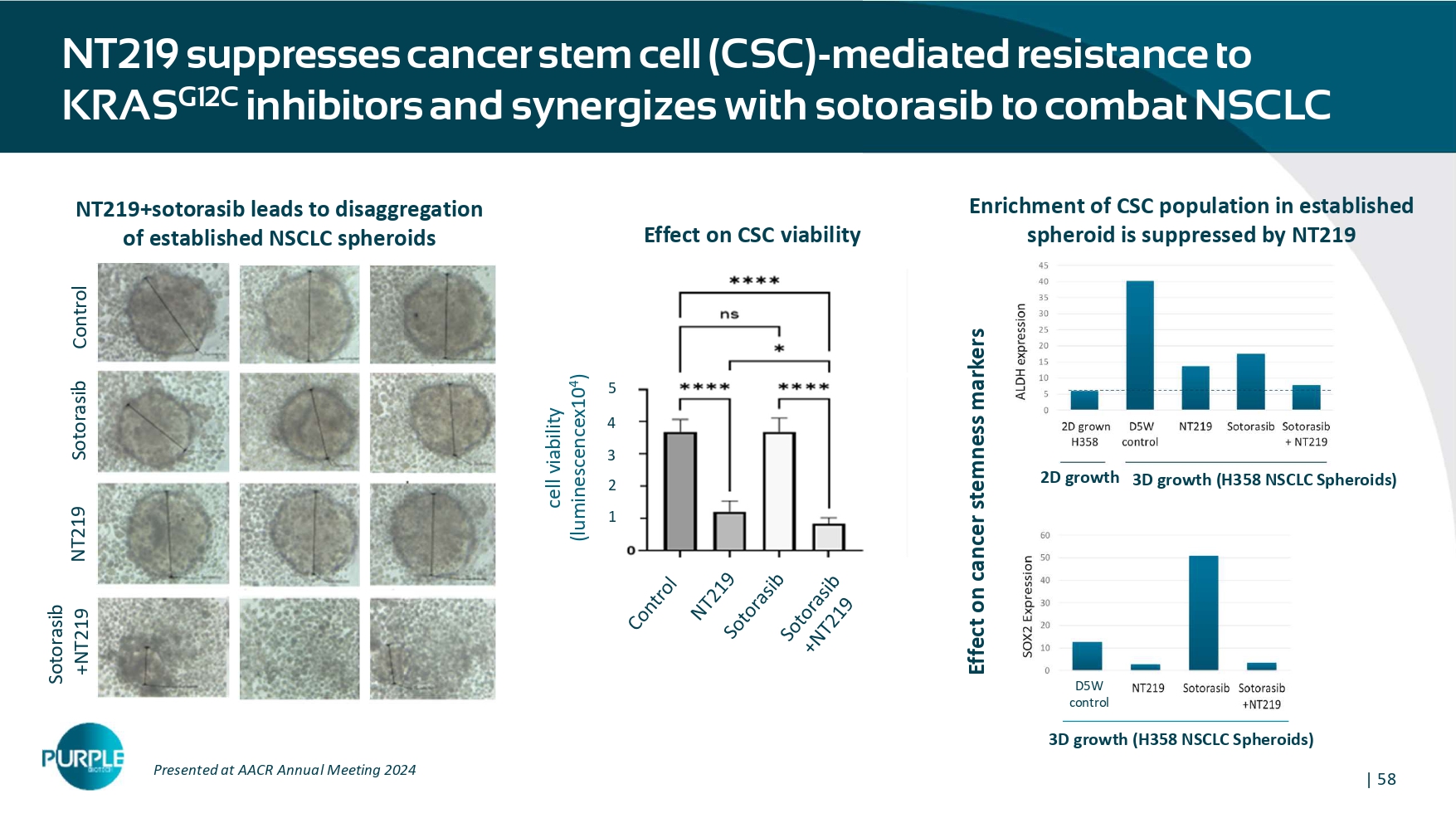
| 58 NT 219抑制癌症干细胞(CSC)-介导的对KRAS G12C抑制剂的耐药性并与sotorasib协同对抗NSCLC控制NT219 Sotorasib Sotorasib + NT219对CSC活力的影响54321细胞活力(luminescencex 104)3D生长(H358 NSCLC球体)2D生长3D生长(H358 NSCLC球体)D5W对癌干性标志物的控制作用NT219 + sotorasib导致在AACR年会上展示的已建立的NSCLC球体的分解2024已建立的球体中CSC群体的丰富被NT219抑制
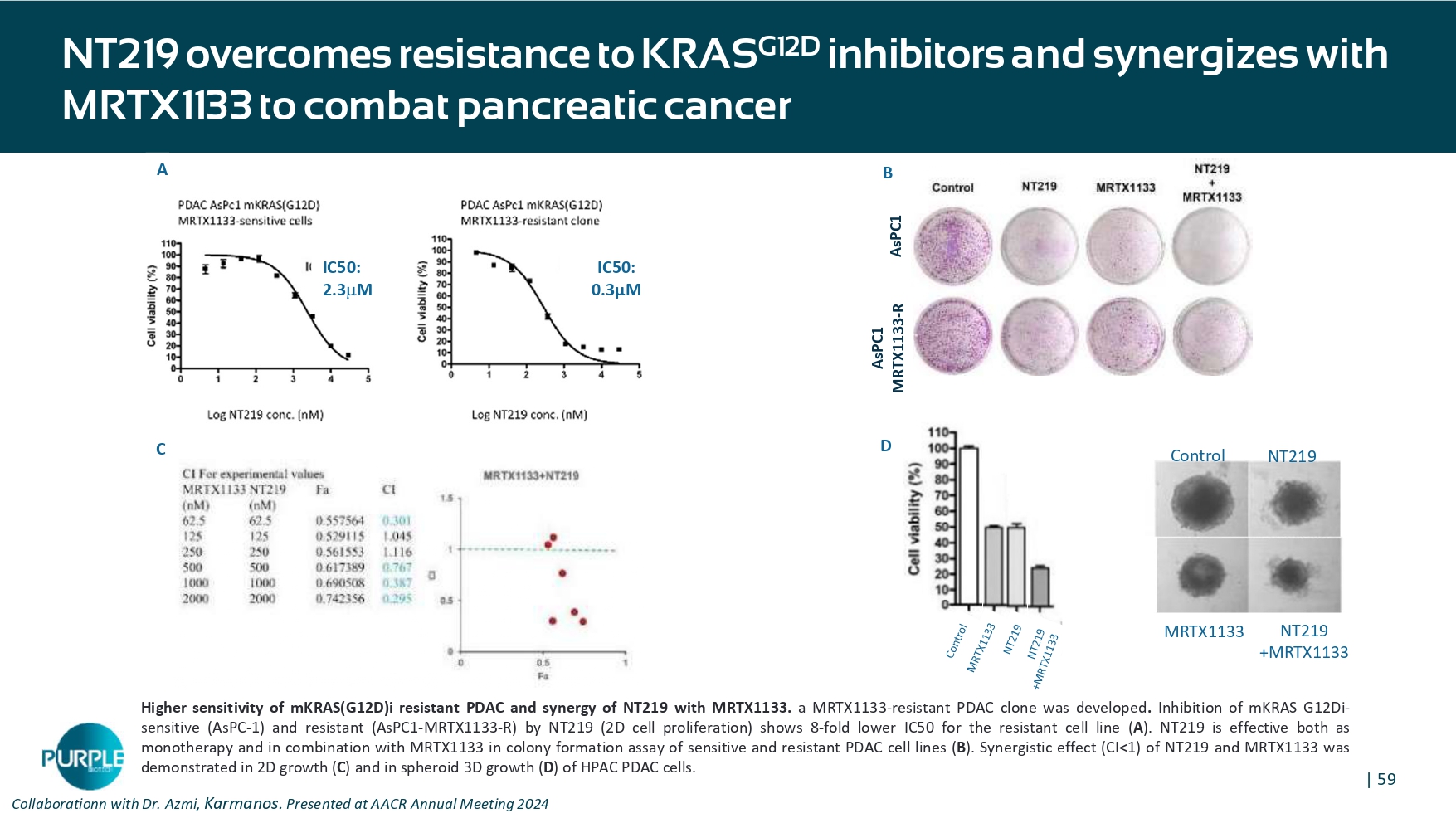
| 59 NT 219克服对KRAS G12D抑制剂的耐药性,与MRTX 1133协同对抗胰腺癌B C D A NT 219对照MRTX 1133 NT 219 + MRTX 1133 IC 50:0.3 μ m IC 50:2.3 m ASPC 1 ASPC 1 MRTX 1133-R与Azmi博士、Karmanos合作。在AACR年会2024上展示了耐mKRAS(G12D)i PDAC的更高灵敏度以及NT219与MRTX 1133的协同作用。开发了一种耐MRTX 1133-的PDAC克隆。NT 219(2D细胞增殖)对m KRAS G12 Di敏感(ASPC-1)和抗性(ASPC1-MRTX 1133-R)的抑制作用显示,抗性细胞系(A)的IC 50低8倍。NT219作为单一疗法和与MRTX 1133联合用于敏感和耐药PDAC细胞株(B)的集落形成试验均有效。NT219和MRTX 1133的协同效应(CI < 1)在2D生长(C)和HPAC PDAC电池的球状3D生长(D)中得到证明。