
附件 99.2 Day One生物制药靶向治疗适用于所有年龄段的人群2025年11月

免责声明本演示文稿和随附的口头评论包含前瞻性陈述,这些陈述基于我们管理层的信念和假设以及我们管理层目前可获得的信息。前瞻性陈述本质上受到风险和不确定性的影响,其中一些风险和不确定性无法预测或量化。在某些情况下,您可以通过诸如“可能”、“将”、“应该”、“可能”、“预期”、“计划”、“预期”、“相信”、“估计”、“预测”、“打算”、“潜在”、“将”、“继续”、“正在进行”或这些术语或其他类似术语的否定词来识别前瞻性陈述。前瞻性陈述包括本演示文稿中除历史事实陈述外的所有陈述,包括与我们未来财务业绩有关的信息,包括我们的现金、现金等价物和短期投资是否足以为我们的运营提供资金、业务计划和目标、我们的商业化和营销工作的时机和成功、我们计划的非临床和临床开发活动的时机和成功、我们提议的对Mersana Therapeutics及其Emi-Le计划的收购的成功、我们任何战略合作的结果,包括可能实现里程碑和根据其提供特许权使用费,我们的产品和候选产品的功效和安全性概况,OJEMDA(tovorafenib)治疗儿科低级别神经胶质瘤(pLGG)或相关适应症的能力,我们的产品和候选产品的潜在治疗益处和经济价值,潜在的增长机会、竞争地位、行业环境和潜在的市场机会,我们保护知识产权的能力以及全球商业或宏观经济条件的影响,包括由于通货膨胀、利率变化、政府关闭、网络安全事件、重大的政治、贸易或监管发展,包括关税,转移美国食品和药物管理局内部的优先事项,减少联邦医疗保健计划的资金,以及全球区域冲突,对我们的业务和运营产生影响。前瞻性陈述受已知和未知风险、不确定性、假设和其他因素的影响。我们的管理层不可能预测所有风险,也无法评估所有因素对我们业务的影响或任何因素或因素组合可能导致实际结果与我们可能做出的任何前瞻性陈述中包含的结果存在重大差异的程度。这些因素,连同我们最近向美国证券交易委员会(SEC)提交的10-Q表格季度报告和我们不时向SEC提交的其他文件中包含的“风险因素”标题下描述的因素,可能会导致我们的实际结果、业绩或成就与我们的前瞻性陈述所预期或暗示的存在重大不利差异。此外,“我们相信”的声明和类似声明反映了我们对相关主题的信念和看法。这些声明是基于截至本演示文稿发布之日我们可获得的信息,尽管我们认为此类信息构成此类声明的合理基础,但此类信息可能有限或不完整,我们的声明不应被解读为表明我们已对所有可能获得的相关信息进行了彻底调查或审查。这些声明本质上是不确定的,告诫投资者不要过度依赖这些声明。此外,如果我们的前瞻性陈述被证明是不准确的,那么不准确可能是重大的。鉴于这些前瞻性陈述中的重大不确定性,您不应将这些陈述视为我们或任何其他人的陈述或保证,即我们将在任何特定的时间范围内实现我们的目标和计划,或者根本不会。我们不承担公开更新任何前瞻性陈述的义务,无论是由于新信息、未来事件或其他原因,除非法律要求。本演示文稿还包含独立方和我们就市场规模和增长做出的估计和其他统计数据,以及有关我们行业的其他数据。这些数据涉及许多假设和限制,请注意不要对这些估计给予不应有的权重。此外,对我们未来业绩的预测、假设和估计以及我们经营所在市场的未来业绩必然受到高度不确定性和风险的影响。2

受儿童迫切需求的启发,Day One创造性、有意识地为各个年龄段有生命危险疾病人群研发新药3

更快地为患者带来改变生活的药物我们是谁•商业阶段的生物制药公司•我们的目标是尽快开发并为所有年龄段的患者提供获得靶向新药的途径•专注于推进用于儿童和成人疾病的一流或同类最佳药物201820212024 TM OJEMDA创立的IPO批准纳斯达克:DAWN OJEMDA于2024年4月获得批准,适用于治疗6个月及以上患有BRAF4融合或重排,或BRAF V600突变的复发或难治性儿科低级别胶质瘤的儿科患者。
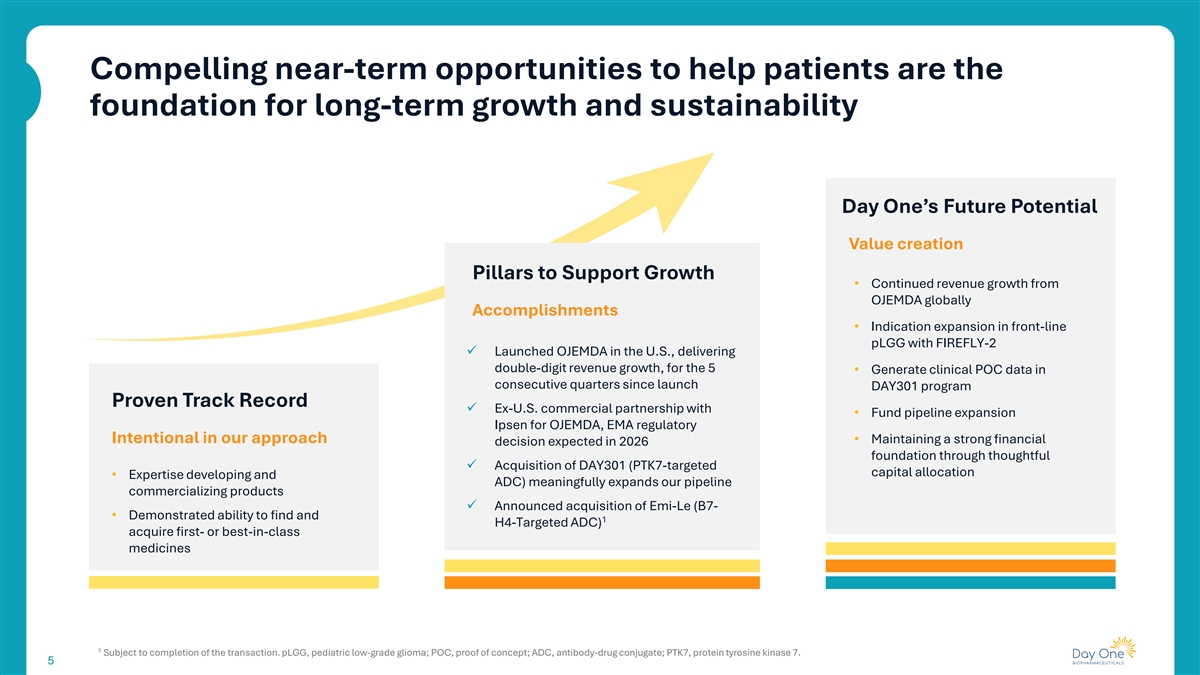
帮助患者的令人信服的近期机会是长期增长和可持续性的基础Day One未来潜在的价值创造支柱以支持增长• OJEMDA全球成就带来的收入持续增长• FIREFLY-2在一线pLGG的适应症扩展ü在美国推出OJEMDA,实现了两位数的收入增长,用于5 •自DAY301计划启动以来连续几个季度产生临床POC数据Proven Track Record ü Ex-US与• Fund Pipsen for OJEMDA的商业合作伙伴关系,EMA监管有意在我们的方法中•通过深思熟虑ü收购DAY301(以PTK7为目标的资本分配•专业知识开发和ADC)保持预期在2026年的强劲财务决策基础,有意义地扩展我们的管道商业化产品ü宣布收购Emi-Le(B7-•被证明有能力发现和1个H4为目标的ADC)获得一流或一流的药物1以交易完成为前提。pLGG,儿科低级别胶质瘤;POC,概念验证;ADC,抗体-药物偶联物;PTK7,蛋白酪氨酸激酶7。5 5
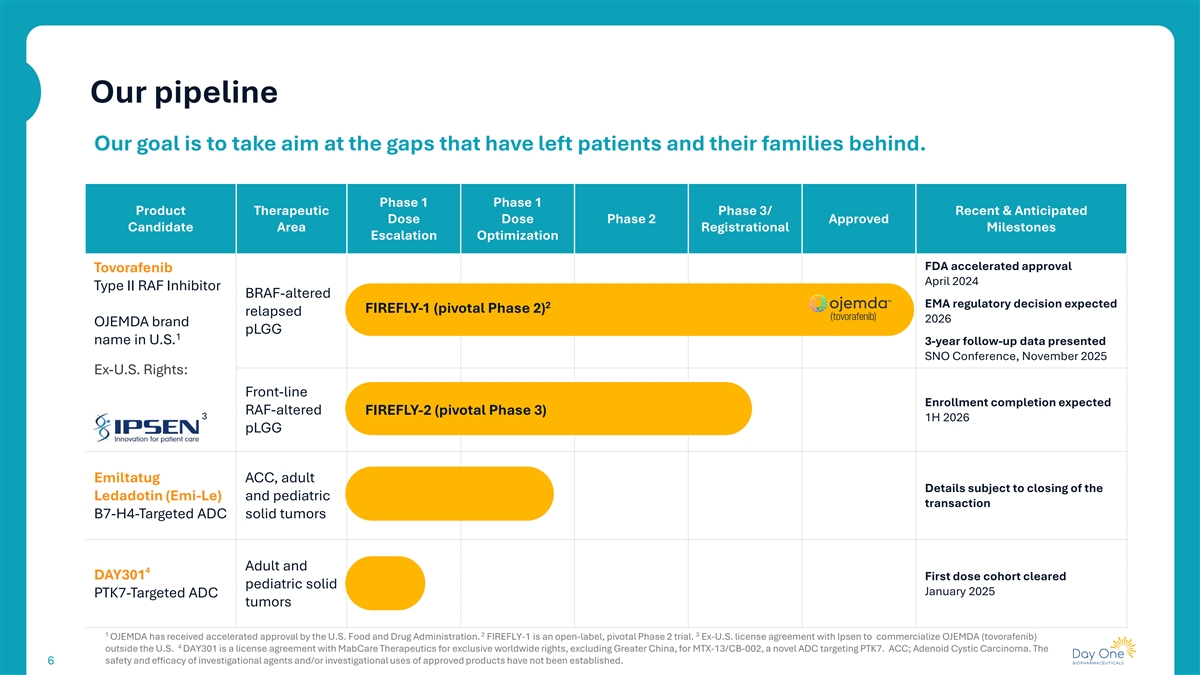
我们的管道我们的目标是瞄准那些让患者及其家人掉队的差距。1期1期产品治疗性3期/近期&预期剂量2期获批候选区域注册里程碑升级优化FDA加速批准Tovorafenib 2024年4月II型RAF抑制剂BRAF改变的EMA监管决定预期2 FIREFLY-1(关键2期)复发2026年OJEMDA品牌pLGG 1名称在美国的3年随访数据提交SNO会议,2025年11月前美国权利:一线注册完成预期RAF改变的FIREFLY-2(关键3期)3 1H2026 pLGG Emiltatug ACC,Ledadotin(Emi-Le)和儿科交易B7-H4靶向ADC实体瘤的成人详情和4 DAY301第一剂量组清除的儿科实体2025年1月PTK7靶向ADC肿瘤123 OJEMDA已获得美国食品和药物管理局的加速批准。FIREFLY-1是一项开放标签、关键的2期试验。与易普森达成的在美国境外商业化OJEMDA(tovorafenib)4的许可协议DAY301是与MabCare Therapeutics就MTX-13/CB-002(一种针对PTK7的新型ADC)的全球独家权利(不包括大中华区)达成的许可协议。ACC;腺样囊性癌。研究药物和/或已批准产品的研究用途的安全性和有效性尚未确定。6

OJEMDA复发或难治性BRAF改变的pLGG Nora与pLGG 7一起生活

小儿低度脑胶质瘤:儿童最常见的脑肿瘤类型一种严重且危及生命的疾病•对于大多数复发环境中的pLGG患者来说,没有标准的护理,直到最近,没有批准的疗法pLGG是慢性的,并且•高达75%的pLGG有BRAF改变*,在那些无情的患者中,~80%是BRAF融合,~20%是BRAF V600患有严重的肿瘤和2-6突变治疗相关发病率,可能影响他们的生活•尽管手术在治疗中发挥了重要作用,1绝大多数患者仍需要长期的全身轨迹7,8治疗•由于疾病复发率高,大多数患者会在病程中接受多线的全身治疗12*BRAF改变的发生率因pLGG亚型而异。西弗特AJ,费舍尔MJ。小儿低度胶质瘤。J儿童神经。10(11):1397-1408。doi:10.1177/0883073809342005。Penman CL et al. Front Oncol。3 4 5 6 2015;5:54.科恩 AR.,N Engl J Med. 2020;386(20):1922-1931。Lassaletta A,et al. J Clin Oncol。2017;35(25):2934-2941.Faulkner C,et al. J Neuropathol exp Neurol。2015;74(9):867-872.Packer RJ,et al. Neuro 788 Oncol。2017;19(6):750-761.Ostrum QT等,Neuro Oncol。2015;16(Suppl 10):x1-x36;De Blank P. et al.,Curr Opin Pediatr。2019年2月;31日(1):21-27日。

概述OJEMDA美国处方信息可用片剂剂型和儿科友好型粉剂口服混悬剂适应症OJEMDA适用于治疗6个月及以上患有BRAF融合或重排的复发或难治性儿科低级别胶质瘤的儿科患者,或BRAF V600突变推荐剂量2380mg/m每周口服一次(不超过600mg剂量每周一次);OJEMDA可配食或不配食服用完整处方信息,请访问dayonebio.com*该适应症根据应答率和应答持续时间在加速审批下获批。该适应症的持续批准可能取决于验证性试验中临床获益的验证。9 9

产品简介与医生在治疗中寻求的一致•在临床试验中,OJEMDA可能会实现有意义的肿瘤稳定或缩小:疗效• 51%的儿童经历了至少25%的肿瘤缩小• 82%的儿童看到他们的肿瘤缩小或保持稳定•治疗通常耐受性良好,在临床试验中10名患者中有9名继续接受治疗安全性•最常见的3/4级不良事件包括:贫血、升高的CPK、斑丘疹、疲劳和呕吐•每周一次,在家中方便地带或不带食物服用可能意味着更少的每日中断剂量OJEMDA适用于治疗6个月及以上患有BRAF融合、重排或BRAF V600突变的复发或难治性儿科低级别胶质瘤(LGG)的患者。Pivotal 2期FIREFLY-1试验的数据。10
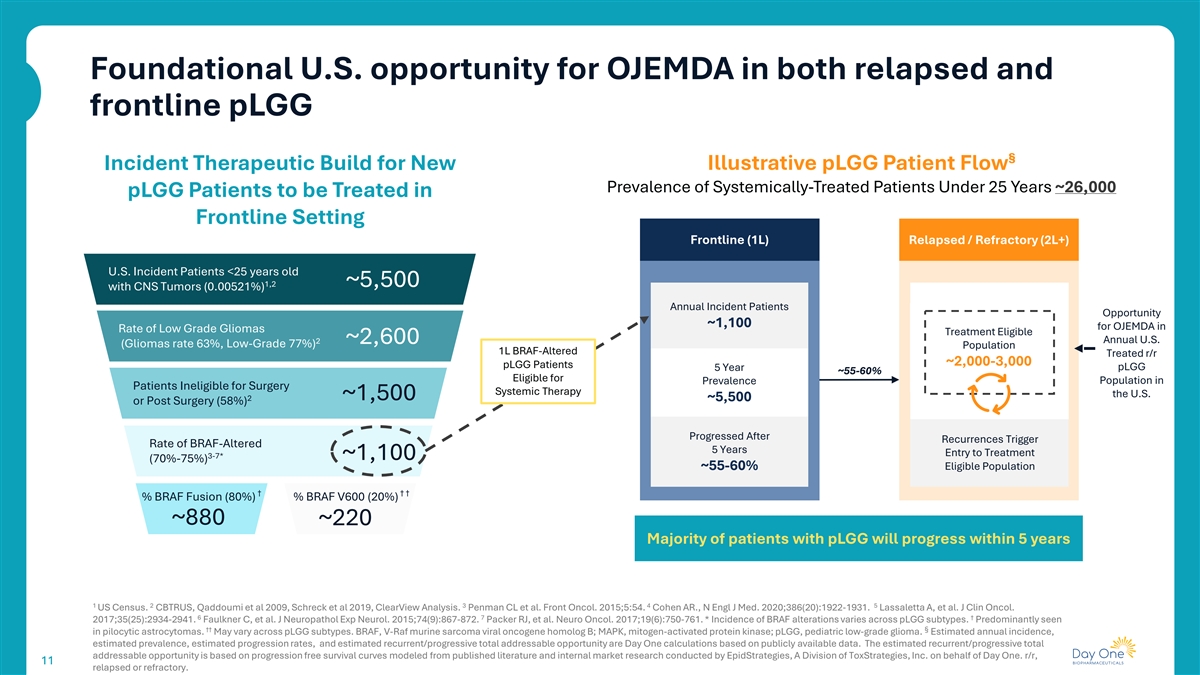
OJEMDA在复发和前线pLGG中的基础美国机会§事件治疗构建新的说明性pLGG患者流速流行率25岁以下的系统治疗患者~26,000名pLGG患者在前线设置前线接受治疗(1L)复发/难治性(2L +)美国事件患者< 25岁1,2~5,500名CNS肿瘤(0.00521%)年事件患者机会~1,100名OJEMDA在低级别神经胶质瘤治疗率符合2~2,600年美国(神经胶质瘤率63%,低等级77%)人群1L BRAF改变治疗的r/r~2,000-3,000名pLGG患者pLGG 5年~55-60 %符合人群在流行患者中不符合手术系统治疗美国~1,5002~5,500或术后(58%)进展后复发触发率BRAF改变5年进入治疗3-7*~1,100(70%-75 %)~55-60 %合资格人群† ↓% BRAF融合(80%)% BRAF V600(20%)~880~220大多数pLGG患者将在5年内进展12345美国人口普查。CBTRUS,Qaddoumi et al 2009,Schreck et al 2019,ClearView Analysis。Penman CL et al. Front Oncol。2015;5:54.科恩 AR.,N Engl J Med. 2020;386(20):1922-1931。Lassaletta A,et al. J Clin Oncol。6 7 † 2017;35(25):2934-2941.Faulkner C,et al. J Neuropathol exp Neurol。2015;74(9):867-872.Packer RJ等Neuro Oncol。2017;19(6):750-761.*BRAF改变的发生率因pLGG亚型而异。主要见于毛细胞星形细胞瘤中的† ↓ §。可能因pLGG亚型而异。BRAF,V-RAF鼠肉瘤病毒癌基因同源物B;MAPK,丝裂原活化蛋白激酶;pLGG,小儿低级别胶质瘤。估计的年发病率、估计的患病率、估计的进展率以及估计的复发/递进总可寻址机会是根据公开可得数据进行的Day One计算。估计的复发/递进总可寻址机会是基于根据已发表的文献和由ToxStrategies,Inc.的一个部门EpidStrategies代表DayOne进行的内部市场研究建模的无进展生存曲线。r/r,1111复发或难治。
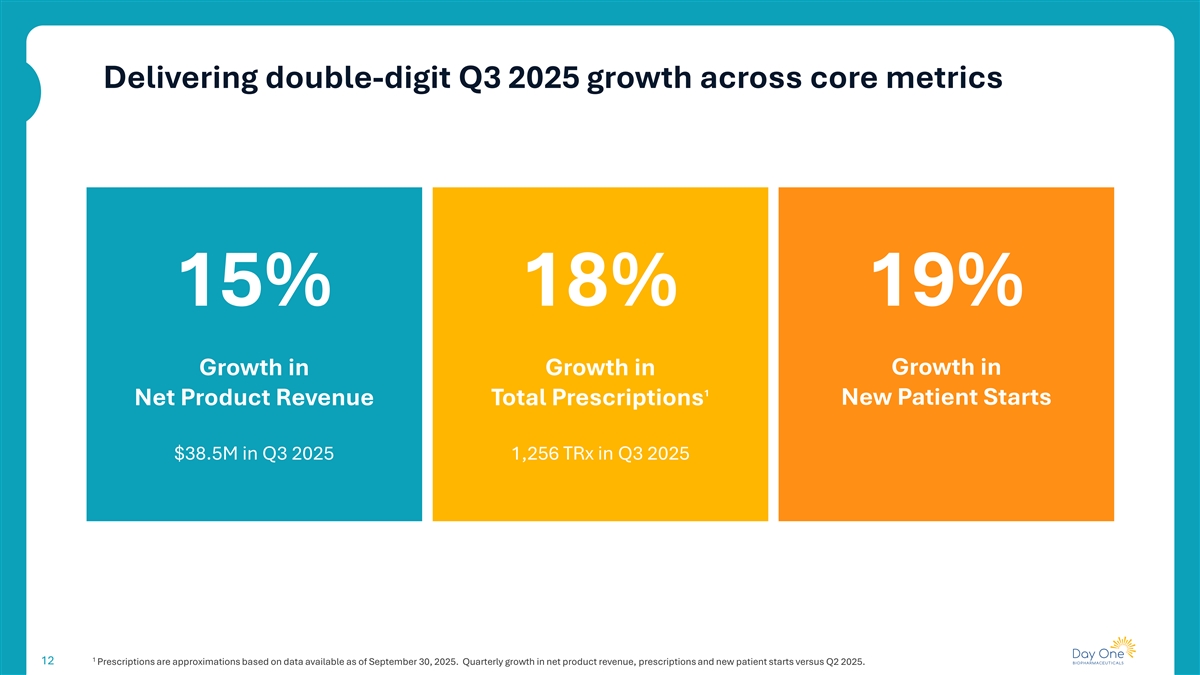
在核心指标上实现2025年第三季度两位数的增长15% 18% 19%增长1净产品收入增长总处方新患者在2025年第三季度开始3850万美元2025年第三季度1,256TRX 112处方是基于截至2025年9月30日的可用数据的近似值。与2025年第二季度相比,产品净收入、处方和新患者开始的季度增长。
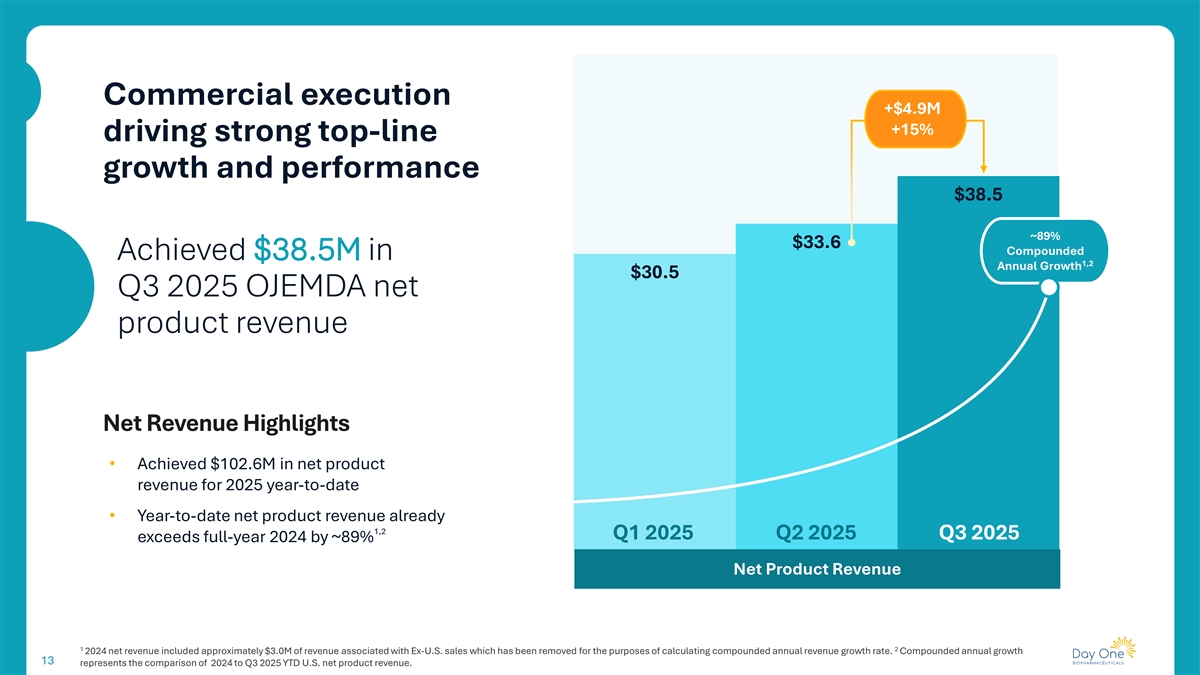
商业执行+ 490万美元+ 15%推动强劲的收入增长和业绩38.5美元~89% 33.6美元复合在1,2年增长中实现3850万美元30.5美元2025年第三季度OJEMDA净产品收入净收入亮点•年初至今实现2025年净产品收入1.026亿美元•年初至今净产品收入已经1,2 2025年第一季度2025年第二季度2025年第三季度超过2024年全年约89%的净产品收入122024净收入包括与美国以外地区相关的约300万美元收入销售,为计算复合年收入增长率已将其删除。复合年增长率13代表2024年与2025年第三季度年初至今美国产品净收入的比较。
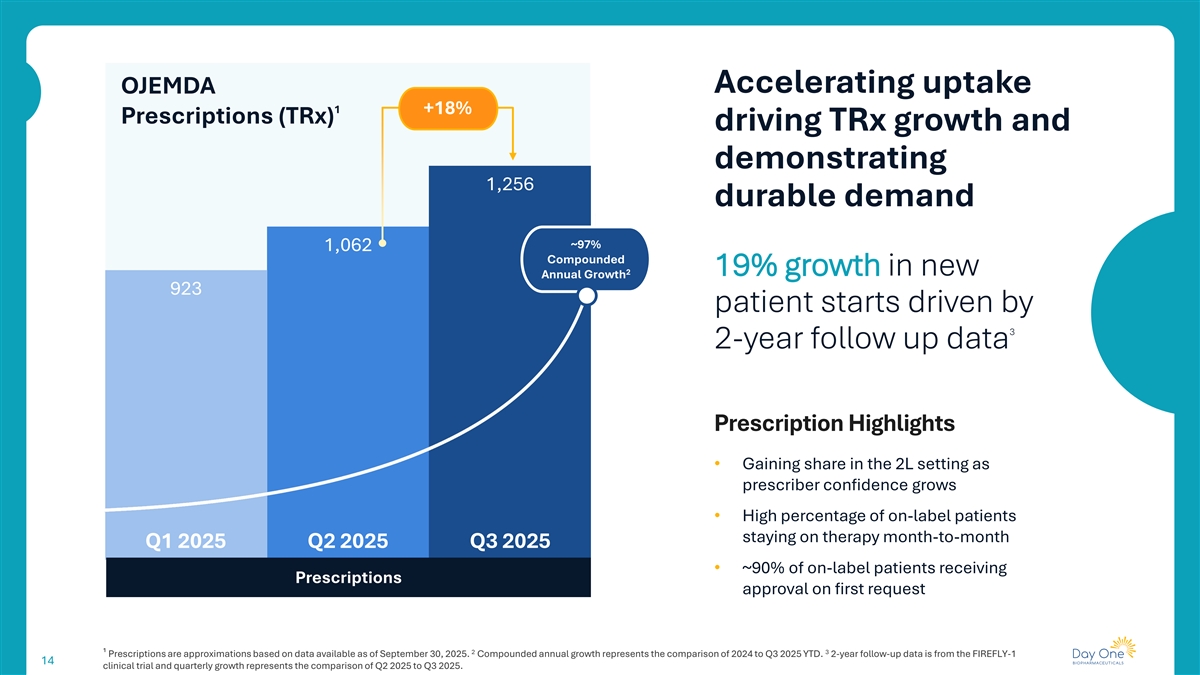
加速吸收OJEMDA 1 + 18%处方(TRX)推动TRX增长,并展示了1,256个持久需求~97% 1,062复合219%的新年度增长923名患者开始接受3次2年随访数据处方亮点•随着处方者信心的增长,在2L环境中获得份额•随着2025年第一季度、2025年第二季度、2025年第三季度、2025年第三季度的逐月保持治疗的标签上患者的高百分比•根据截至2025年9月30日的可用数据,接受首次请求批准的处方的标签上患者中约90%的23丨处方是近似值。复合年增长率代表2024年与2025年第三季度年初至今的比较。2年随访数据来自FIREFLY-1 14临床试验,季度增长代表2025年Q2与2025年Q3的对比。
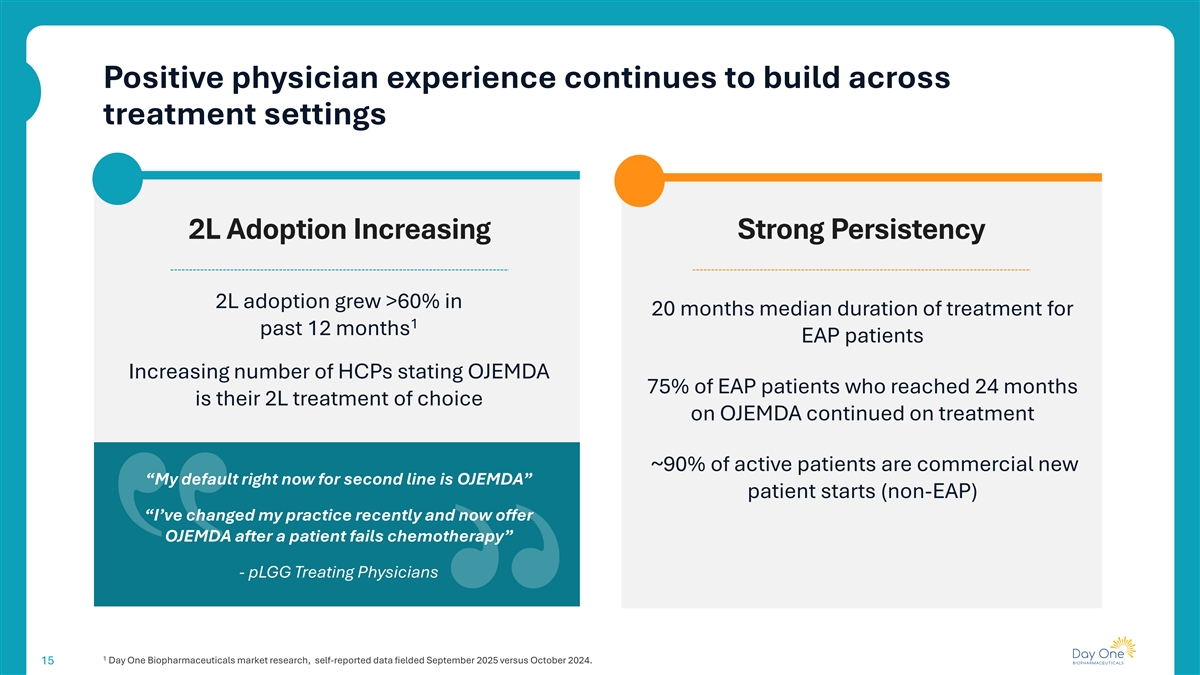
积极的医生经验继续在治疗环境中建立2L采用率增加强持久性2L采用率在20个月内增长> 60% 1过去12个月的中位治疗持续时间EAP患者增加HCP数量说明OJEMDA 75%达到24个月的EAP患者是他们在OJEMDA上选择的2L治疗继续治疗~90%的活跃患者是商业新“我现在对二线的默认是OJEMDA”患者开始(非EAP)“我最近改变了我的做法并且现在在患者化疗失败后提供OJEMDA”-pLGG治疗医师1 Day One生物制药市场研究,自报告数据于2025年9月与2024年10月提交。15
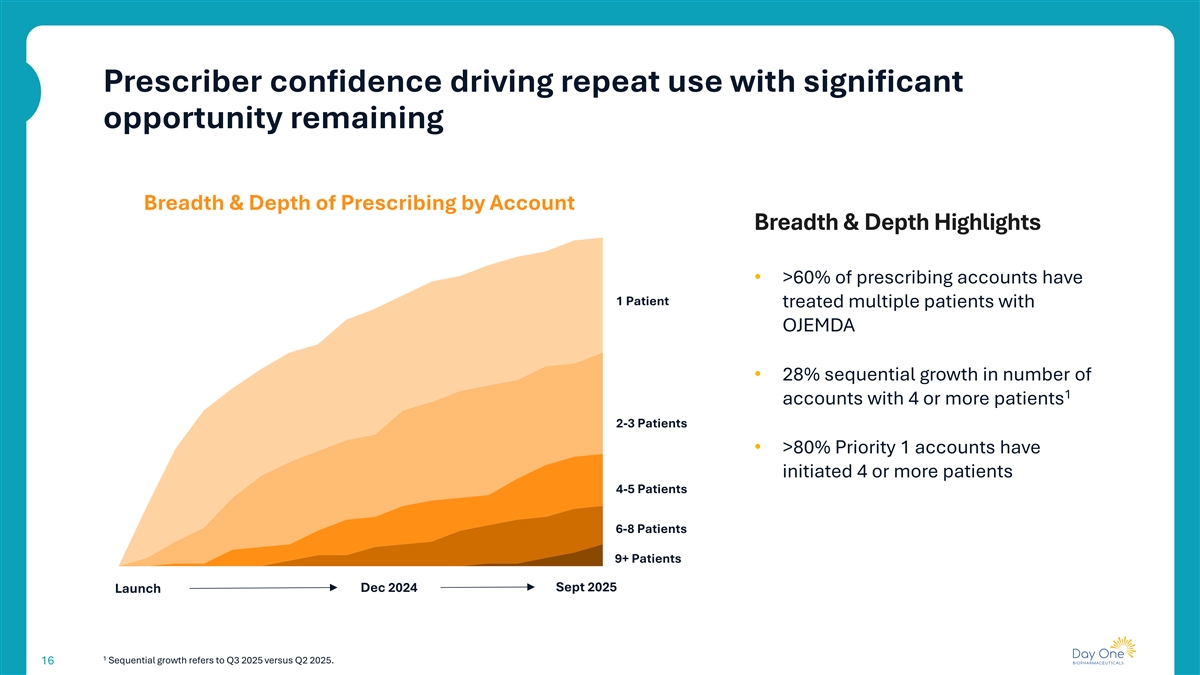
处方者信心推动重复使用,仍有显着机会按账户广度和深度亮点划分的处方广度和深度•> 60%的处方账户有1名患者治疗了OJEMDA的多名患者• 1个账户数量环比增长28%,有4名或更多患者2-3名患者•> 80%优先1账户已发起4名或更多患者4-5名患者6-8名患者9 +患者2025年9月启动2024年12月1连续增长是指2025年第三季度与2025年第二季度相比。16
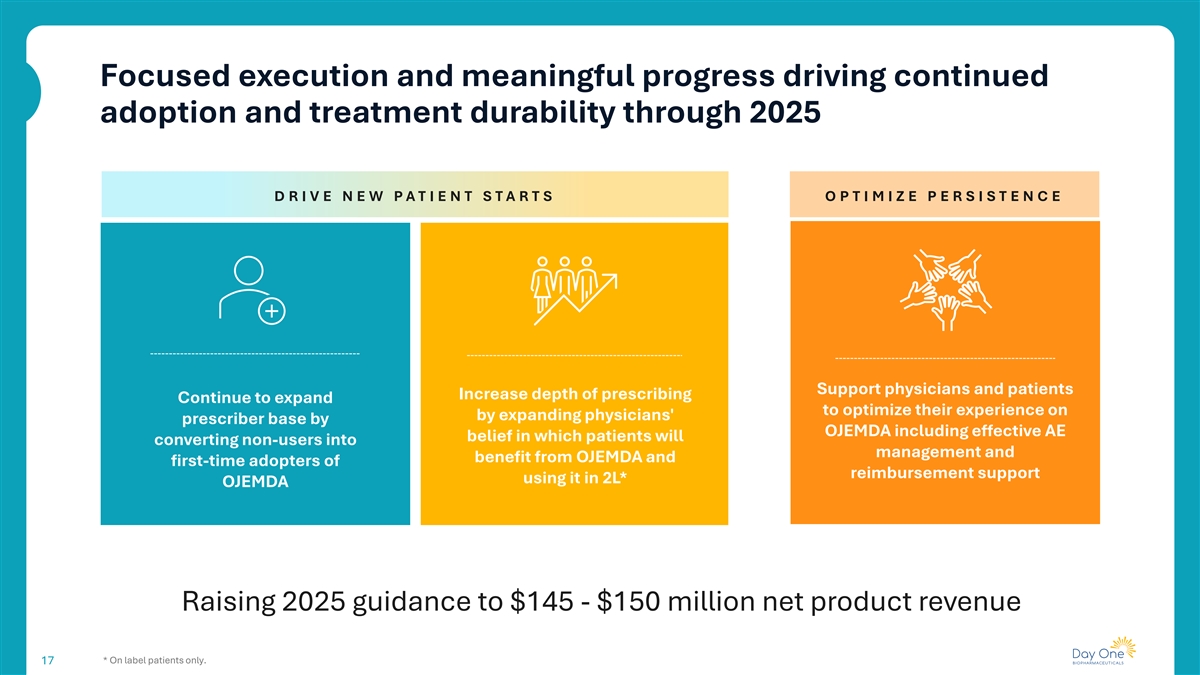
有重点的执行和有意义的进展推动了到2025年的持续采用和治疗持久性D R I V E新PAT I ENT S TA RT S O P T IM IZ E P E RS IS T E N C E支持医生和患者增加处方深度继续扩展,通过OJEMDA扩大医生的处方者基础来优化他们的体验,包括有效的AEE信念,患者将把非用户转化为管理并从OJEMDA中受益以及在2L中使用它的报销支持的首次采用者*OJEMDA上调2025年指引至1.45-1.5亿美元净产品收入*仅限标签患者。17

我们继续加强OJEMDA的故事,方法是增强目标产品概况和数据生成FIREFLY-1 3年数据,在建立OJEMDA治疗后突出临床稳定性,并有机会将OJEMDA作为2L r/r BRAF中护理的再治疗标准-有可能进一步扩大医生改变的pLGG信心和采用率,同时加强目标产品概况在2025年11月SNO会议上的介绍和正在进行的出版工作18
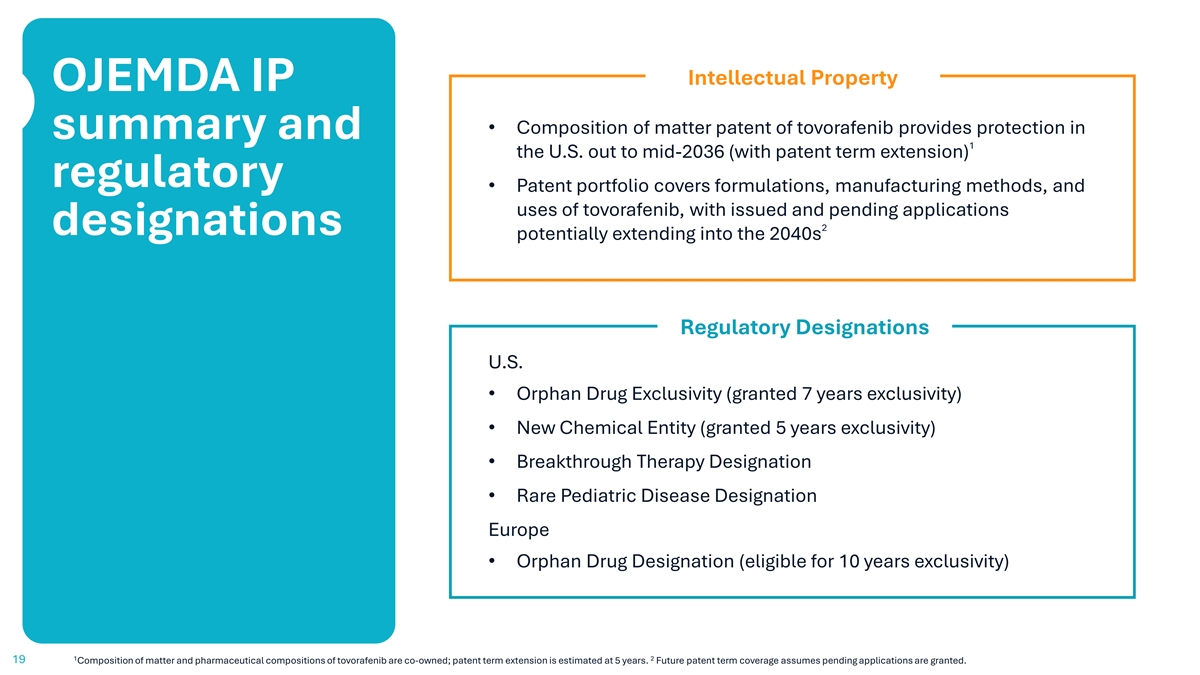
知识产权OJEMDA IP • Tovorafenib的物质组成专利提供了概述的保护和1美国到2036年中期(专利期限延长)的监管•专利组合涵盖了Tovorafenib的配方、制造方法和用途,已发布和待处理的申请2项指定可能延伸到2040年代的监管指定美国•孤儿药独占权(授予7年独占权)•新的化学实体(授予5年独占权)•突破性疗法指定•罕见儿科疾病指定欧洲•孤儿药指定(有资格获得10年独占权)1219托伏拉非尼的物质成分和药物成分是共同拥有的;专利期限延长估计为5年。未来的专利期限覆盖范围假设未决申请获得批准。

FIREFLY-1试验研究OJEMDA 2期FIREFLY-1试验的3年随访数据20
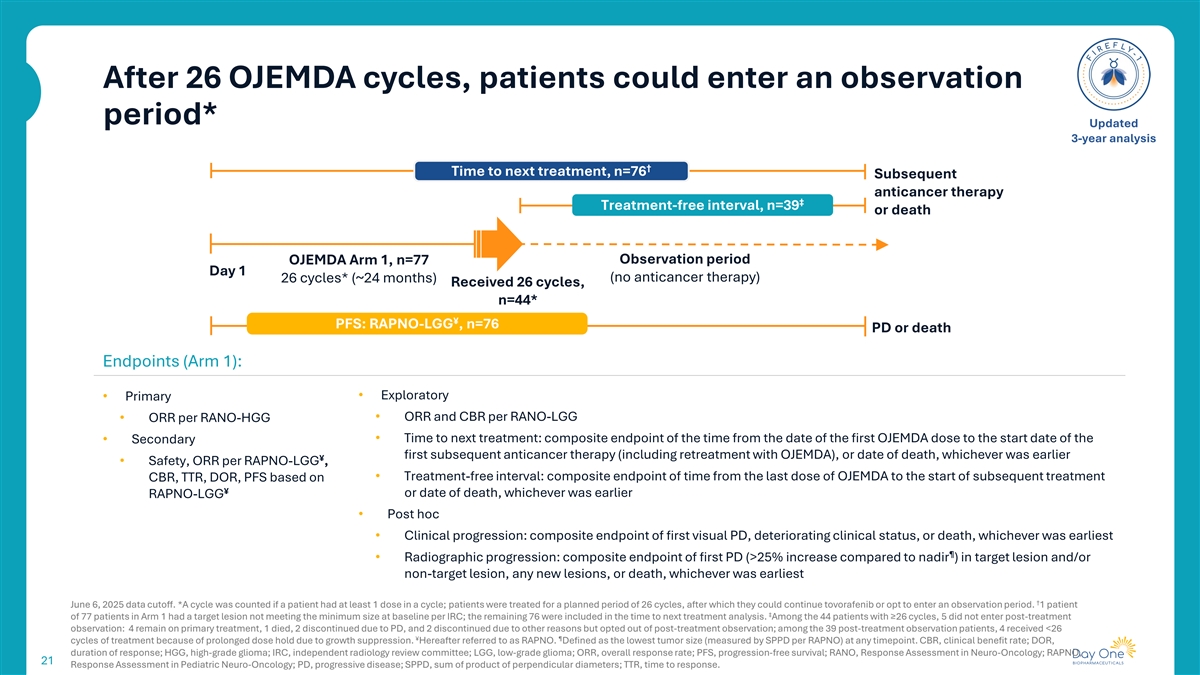
26个OJEMDA周期后,患者可进入观察期*更新3年分析↓到下一次治疗的时间,n = 76次后续抗癌治疗丨免治疗间隔期,n = 39次或死亡观察期OJEMDA Arm 1,n = 77天1(未进行抗癌治疗)26个周期*(~24个月)收到26个周期,n = 44*¥ PFS:RAPNO-LGG,n = 76 PD或死亡终点(第1组):•探索性•每RANO-LGG的主要• ORR和CBR •每RANO-HGG的ORR •到下一次治疗的时间:从第一次OJEMDA给药之日到开始•次要第一次后续抗癌治疗(包括用OJEMDA再治疗)之日的复合终点,或死亡日期,以较早者为准丨•安全性,每RAPNO-LGG的ORR,•免治疗间隔:从最后一次OJEMDA给药到开始后续治疗的复合终点时间CBR、TTR、DOR、PFS,基于¥或死亡日期,以较早的RAPNO-LGG •事后•临床进展:首次可视PD、临床状态恶化或死亡的复合终点,以最早者为准丨•影像学进展:目标病灶和/或非目标病灶、任何新病灶或死亡的首次PD(与最低点相比增加> 25%)的复合终点,以最早者为准↓ 2025年6月6日数据截止。*如果患者在一个周期内至少有1剂剂量,则计算一个周期;患者接受了26个周期的计划治疗,之后他们可以继续使用托沃非尼或选择进入观察期。Arm 1的77名患者中有1名患者的目标病灶不符合每个IRC基线时的最小大小;其余76名被纳入到下一次治疗分析的时间。44例≥ 26个周期的患者中,5例未进入治疗后观察:4例仍在初级治疗,1例死亡,2例因PD停药,2例因其他原因停药但选择退出治疗后观察;39例治疗后观察患者中,4例因生长抑制导致剂量保持时间延长,接受< 26丨节治疗。以下简称RAPNO。定义为在任何时间点的最低肿瘤大小(通过SPPD每个RAPNO测量)。CBR,临床受益率;DOR,缓解持续时间;HGG,高级别胶质瘤;IRC,独立放射学审评委员会;LGG,低级别胶质瘤;ORR,总缓解率;PFS,无进展生存期;RANO,神经肿瘤学中的缓解评估;RAPNO,小儿神经肿瘤学中的21缓解评估;PD,进行性疾病;SPPD,垂直直径乘积之和;TTR,缓解时间。
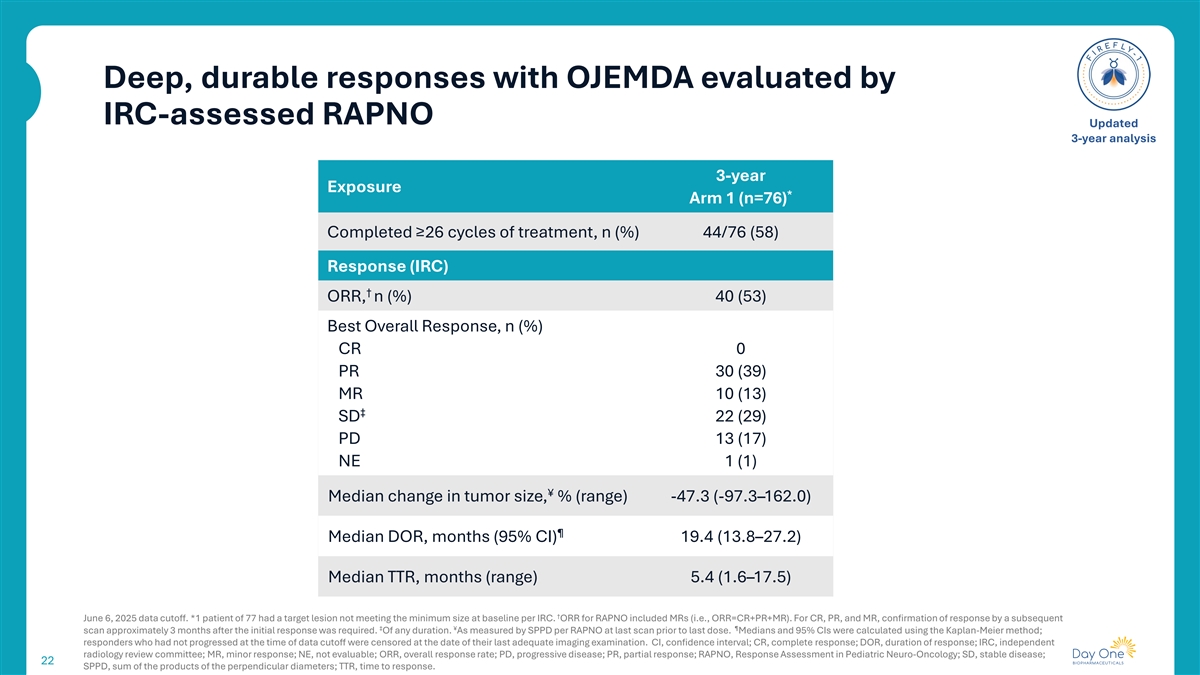
IRC评估的RAPNO更新的3年分析3年暴露评估的OJEMDA的深度、持久响应*Arm 1(n = 76)完成≥ 26个周期的治疗,n(%)44/76(58)应答(IRC)↓ ORR,n(%)40(53)最佳总应答,n(%)CRR 0 PR 30(39)MR 10(13)↓ SD 22(29)PD 13(17)NE1(1)¥肿瘤大小的中位变化,%(范围)-47.3(-97.3 – 162.0)丨中位DOR,月(95% CI)19.4(13.8 – 27.2)中位TTR,月(范围)5.4(1.6 – 17.5)↓ 2025年6月6日数据截止。*1例77例患者的目标病灶不符合每个IRC基线时的最小大小。RAPNO的ORR包括MRs(即ORR = CR + PR + MR)。对于CR、PR和MR,需要在初始响应大约3个月后,通过随后的↓丨丨扫描来确认响应。任何持续时间。根据在最后一次给药前最后一次扫描时每RAPNO的SPPD测量。使用Kaplan-Meier方法计算中位数和95%的CI;在数据截止时没有进展的响应者在他们最后一次充分的成像检查之日被检查。CI,置信区间;CR,完全应答;DOR,应答持续时间;IRC,独立放射学审查委员会;MR,轻微应答;NE,不可评估;ORR,总应答率;PD,进行性疾病;PR,部分应答;RAPNO,小儿神经肿瘤学中的应答评估;SD,疾病稳定;22 SPPD,垂直直径乘积之和;TTR,应答时间。
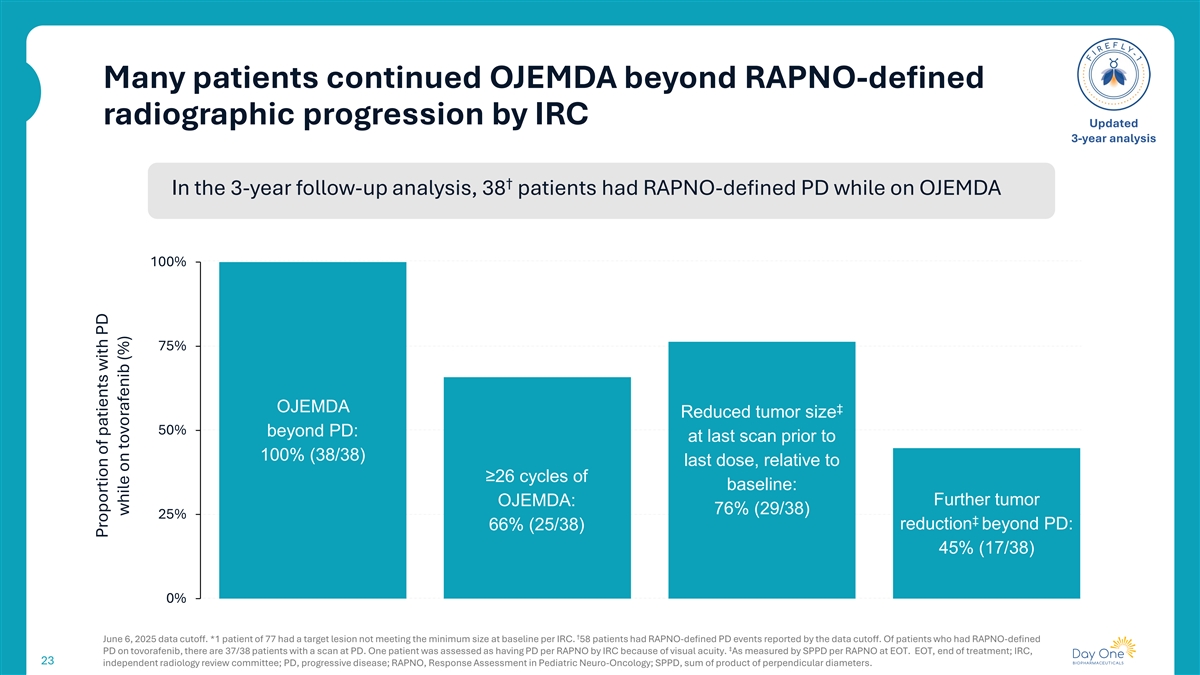
许多患者继续OJEMDA超过RAPNO定义的放射学进展IRC更新的3年分析↓在3年的随访分析中,38名患者在OJEMDA 100% 75% OJEMDA时发生RAPNO定义的PD相比较PD缩小50%:在100%(38/38)最后一次剂量之前的最后一次扫描中,相对于≥ 26个基线周期:进一步的肿瘤OJEMDA:76%(29/38)25% ⑥ 66%(25/38)超过PD的缩小:45%(17/38)0% ↓ 2025年6月6日数据截止。*1例77例患者的目标病灶不符合每个IRC基线时的最小大小。58名患者发生了数据截止报告的RAPNO定义的PD事件。在tovorafenib上有RAPNO-定义21.8PD的患者中,有37/38的患者在PD进行了扫描。一名患者因视力问题被IRC评估为每RAPNO均有PD。以EOT每RAPNO的SPPD衡量。EOT,结束治疗;IRC,23个独立的放射学审查委员会;PD,进行性疾病;RAPNO,儿科神经肿瘤学中的反应评估;SPPD,垂直直径的乘积之和。服用托沃拉非尼时PD患者占比(%)
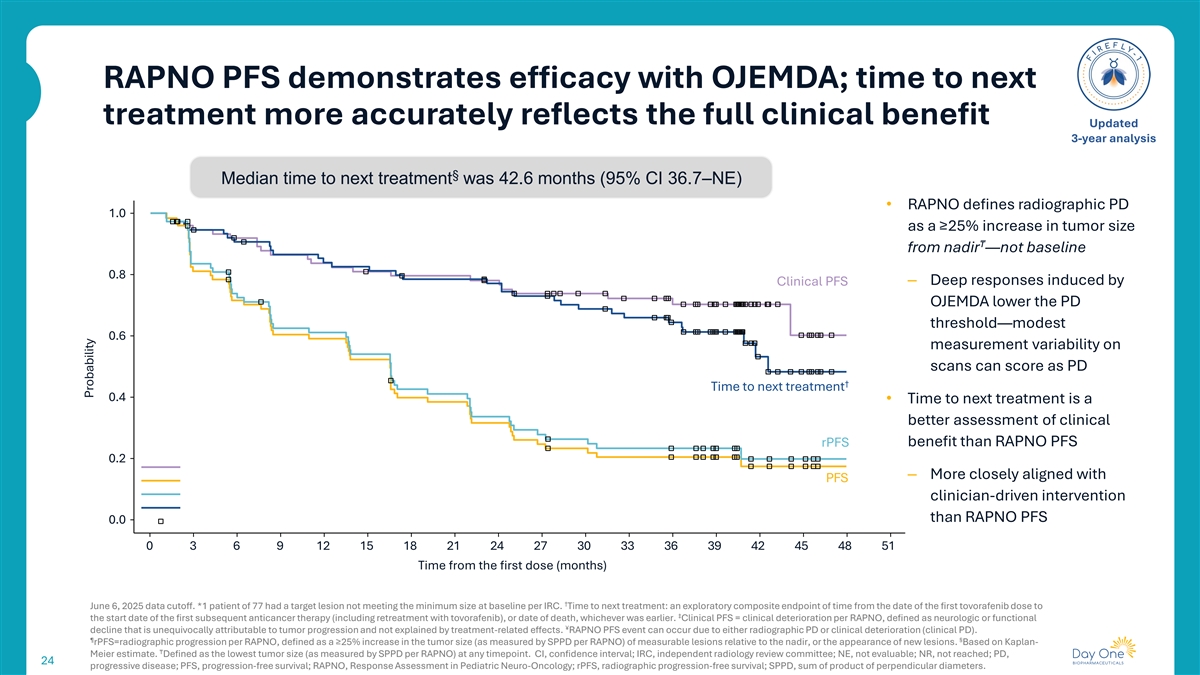
RAPNO PFS与OJEMDA一起证明疗效;到下一次治疗的时间更准确地反映了全部临床益处更新后的3年分析§到下一次治疗的中位时间为42.6个月(95% CI 36.7 – NE)• RAPNO将放射学PD 1.0定义为肿瘤大小从最低点增加≥ 25% ——而不是基线0.8–由临床PFS诱导的深度反应OJEMDA降低PD阈值——扫描时适度的0.6测量变异性可以评分As PD ↓到下一次治疗的时间0.4•到下一次治疗的时间比RAPNO PFS rPFS更能评估临床获益0.2 –比RAPNO PFS更接近于临床医生驱动的干预措施0.003691215182124273033363942454851从第一剂(月)起的时间截止至2025年6月6日。*1例77例患者的目标病灶不符合每个IRC基线时的最小大小。到下一次治疗的时间:从第一次托沃拉非尼给药日期到↓第一次后续抗癌治疗(包括托沃拉非尼再治疗)开始日期的探索性复合时间终点,或死亡日期,以较早者为准。临床PFS =每个RAPNO的临床恶化,定义为明确归因于肿瘤进展且不能用治疗相关效果解释的神经系统或功能性¥下降。由于影像学PD或临床恶化(临床PD),可能会发生RAPNO PFS事件。⑤ § rPFS =每RAPNO的影像学进展,定义为可测量病变的肿瘤大小(通过SPPD每RAPNO测量)相对于最低点增加≥ 25%,或出现新的病变。基于Kaplan-Meier估计。定义为在任何时间点的最低肿瘤大小(通过SPPD每个RAPNO测量)。CI,置信区间;IRC,独立放射学审评委员会;NE,不可评估;NR,未达到;PD,24进展疾病;PFS,无进展生存期;RAPNO,小儿神经肿瘤学中的反应评估;rPFS,放射学无进展生存期;SPPD,垂直直径乘积之和。概率
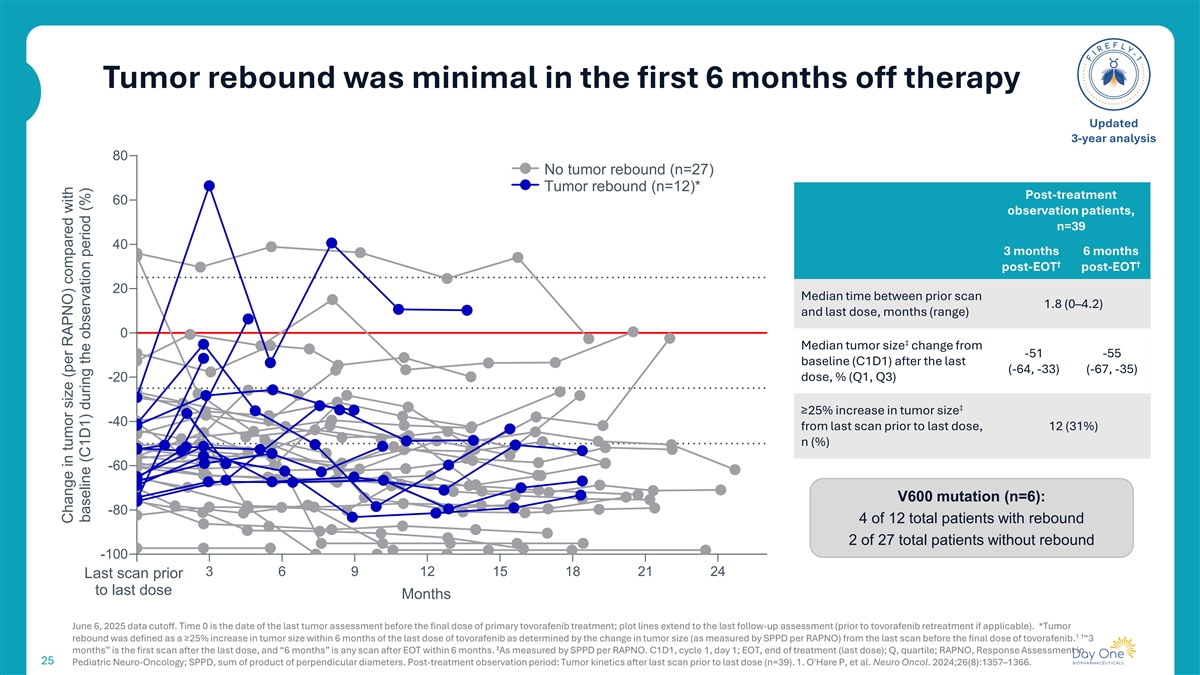
前6个月肿瘤反弹极少治疗后更新3年分析80无肿瘤反弹(n = 27)肿瘤反弹(n = 12)*治疗后60例观察患者,n = 39403个月6个月↓ ↓ EOT后EOT后20前次扫描1.8(0– 4.2)到最后一次给药之间的中位时间,月(量程)0相较于最后一次(-64,-33)(-67,-35)-20给药后-51-55基线(C1D1)的中位肿瘤大小变化,%(Q1,Q3)相较于最后一次给药前最后一次扫描肿瘤大小-40增加%(Q1,Q3)↓ ≥ 25%,12(31%)n(%)-60 V600突变(n = 6):-80 4 of 12 total patients with rebonance 2 of 27 total patients without rebonance-100 03691215182124 last scan before last dose months 2025年6月6日数据截止。时间0是最终剂量托沃拉非尼治疗前最后一次肿瘤评估的日期;情节线延伸到最后一次随访评估(如适用,在托沃拉非尼再治疗之前)。*肿瘤1 †反弹定义为在最后一剂托沃拉非尼后6个月内肿瘤大小增加≥ 25%,这是由最终剂量托沃拉非尼前最后一次扫描后的肿瘤大小变化(通过SPPD根据RAPNO测量)确定的。“3丨月”是最后一次给药后的首次扫描,“6个月”是6个月内EOT后的任何一次扫描。按每RAPNO的SPPD衡量。C1D1,周期1,第1天;EOT,治疗结束(最后一剂);Q,四分位数;RAPNO,25小儿神经肿瘤学中的反应评估;SPPD,垂直直径乘积之和。治疗后观察期:最后一次给药前最后一次扫描后的肿瘤动力学(n = 39)。1.奥黑尔P等人Neuro Oncol。2024;26(8):1357–1366.观察期肿瘤大小(每RAPNO)与基线(C1D1)对比变化(%)
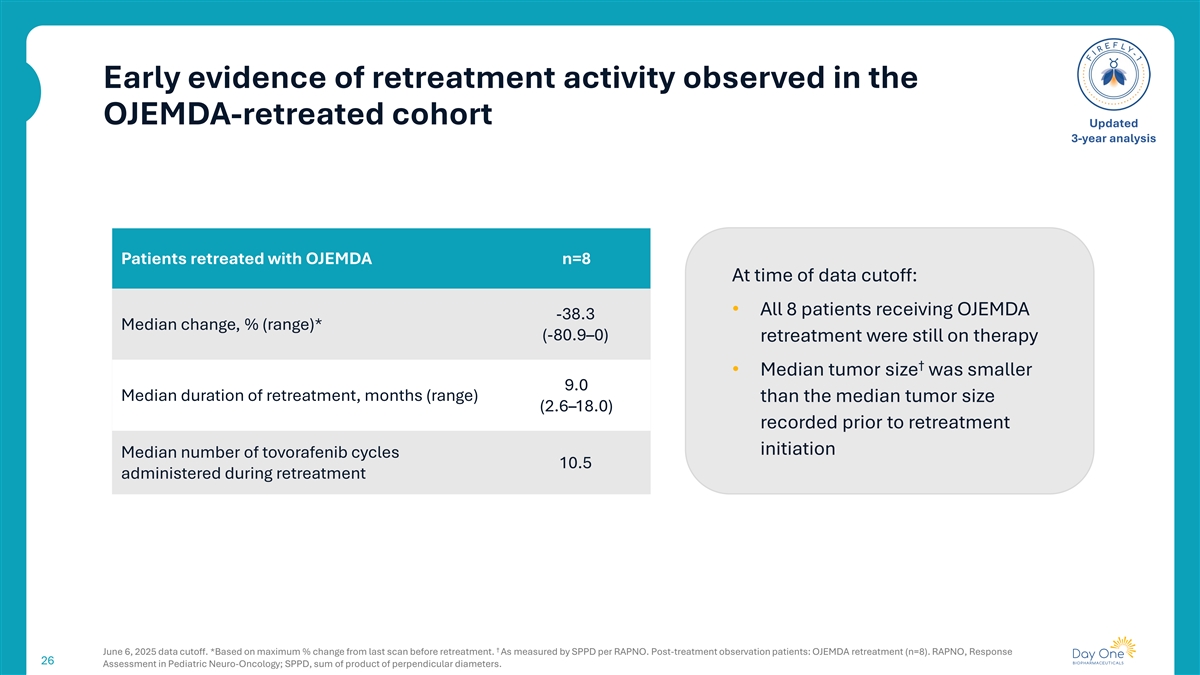
在OJEMDA-retreated队列中观察到的再治疗活动的早期证据更新的3年分析患者在数据截止时OJEMDA n = 8 retreated:•所有8名接受OJEMDA的患者-38.3中位变化,%(范围)*(-80.9 –0)再治疗仍在接受治疗↓ •中位肿瘤大小小于9.0中位再治疗持续时间,月(范围)比再治疗开始前记录的中位肿瘤大小(2.6 – 18.0)在再治疗期间给药的托沃拉非尼周期中位数10.5 ↓ 2025年6月6日数据截止。*基于最大百分比变化从上次扫描前再处理。按每RAPNO的SPPD衡量。治疗后观察患者:OJEMDA再治疗(n = 8)。RAPNO,Response 26 Assessment in Pediatric Neuro-Oncology;SPPD,垂直直径乘积之和。
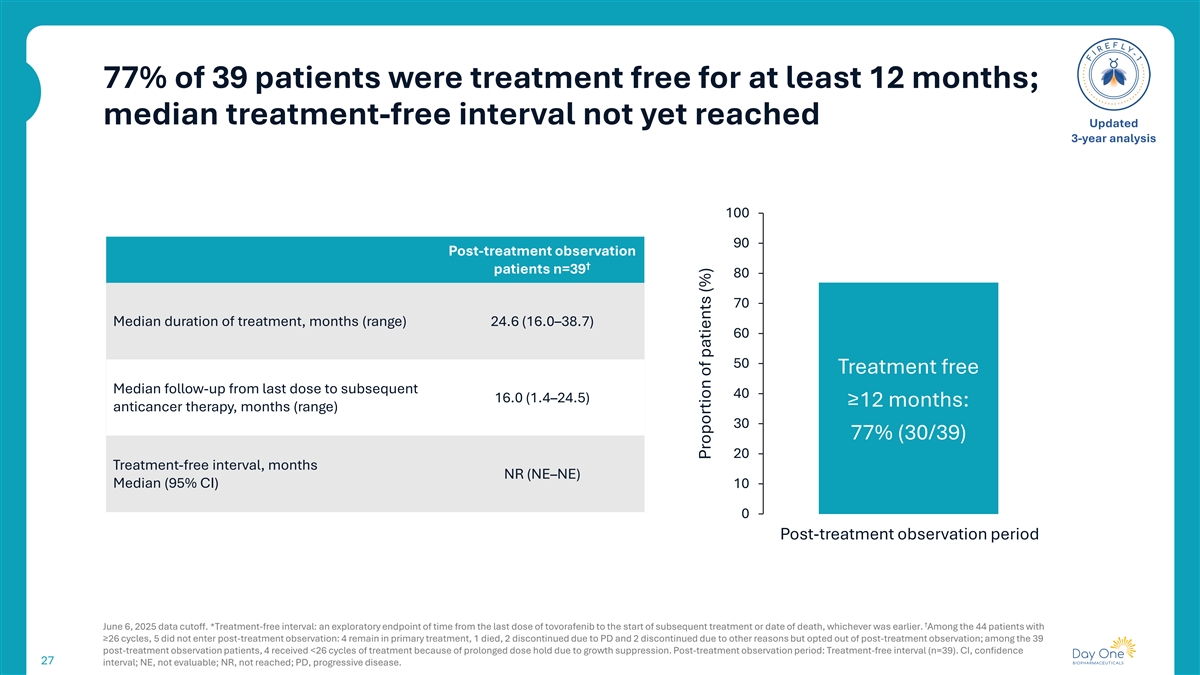
39例患者中77%至少12个月免费治疗;中位免费治疗间隔尚未达到更新的3年分析10090治疗后观察↓患者n = 398070中位治疗持续时间,月数(范围)24.6(16.0– 38.7)6050免费治疗从最后一次给药到随后的4016.0(1.4– 24.5)≥ 12个月的中位随访:抗癌治疗,月数(范围)3077%(30/39)20免费治疗间隔,月数NR(NE – NE)中位数(95% CI)100治疗后观察期↓ 2025年6月6日数据截止。*免治疗间隔期:从最后一剂托沃拉非尼到开始后续治疗或死亡日期的时间探索性终点,以较早者为准。44例≥ 26个周期的患者中,5例未进入治疗后观察:4例仍在初级治疗,1例死亡,2例因PD停药,2例因其他原因停药但选择退出治疗后观察;39例治疗后观察患者中,4例因生长抑制导致剂量保持时间延长,接受< 26个周期的治疗。治疗后观察期:免治间隔期(n = 39)。CI,置信27区间;NE,不可评估;NR,未达到;PD,进行性疾病。患者占比(%)
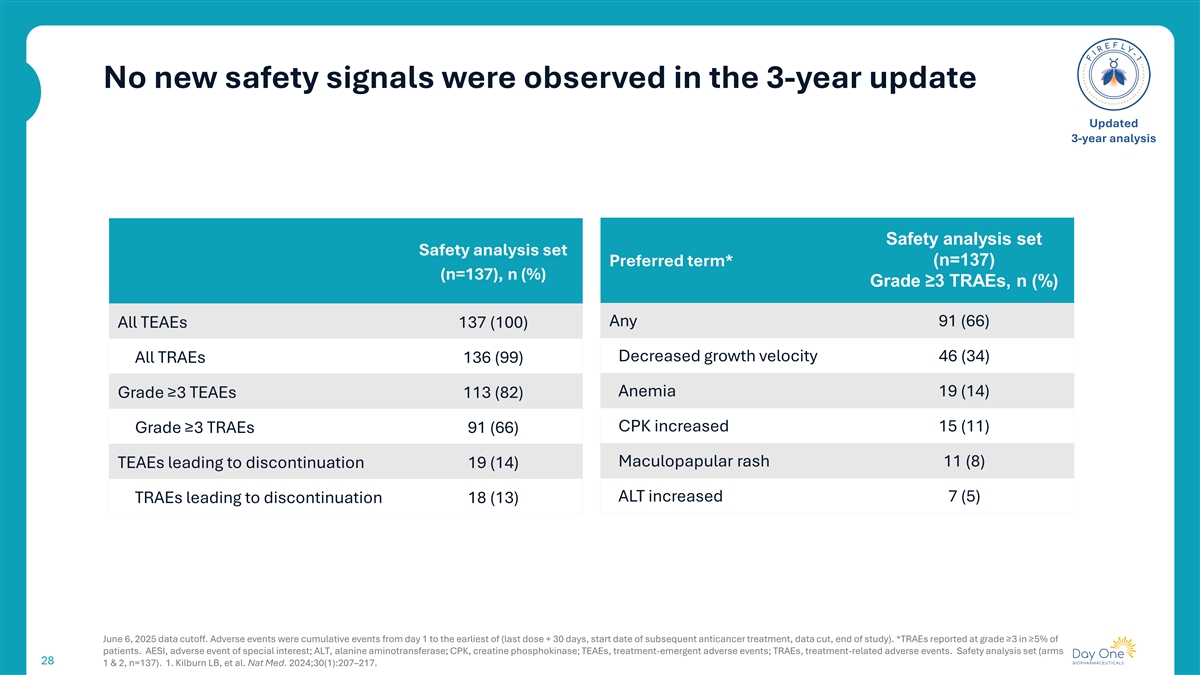
在3年更新更新3年分析中未观察到新的安全信号安全分析集安全分析集首选项*(n = 137)(n = 137),n(%)级≥ 3TRAEs,n(%)任意91(66)所有TEAEs 137(100)生长速度下降46(34)所有TEAEs 136(99)贫血19(14)级≥ 3TEAEs 113(82)CPK增加15(11)级≥ 3TRAEs 91(66)斑丘疹皮疹11(8)TEAEs导致停药19(14)ALT增加7(5)TRAEs导致停药18(13)2025年6月6日数据截止。不良事件为第1天至最早(最后一次剂量+ 30天、后续抗癌治疗开始日期、数据截取、研究结束)的累积事件。*TRAE在≥ 5%的患者中报告为≥ 3级。AESI,特别关注的不良事件;ALT,丙氨酸氨基转移酶;CPK,肌酸磷酸激酶;TEAEs,治疗中出现的不良事件;TRAEs,治疗相关的不良事件。安全分析集(臂281 & 2,n = 137)。1.Kilburn LB,et al. Nat Med. 2024;30(1):207 – 217。

FIREFLY-2 Tovorafenib在一线pLGG Bradon自11岁起与pLGG一起生活的关键3期试验29
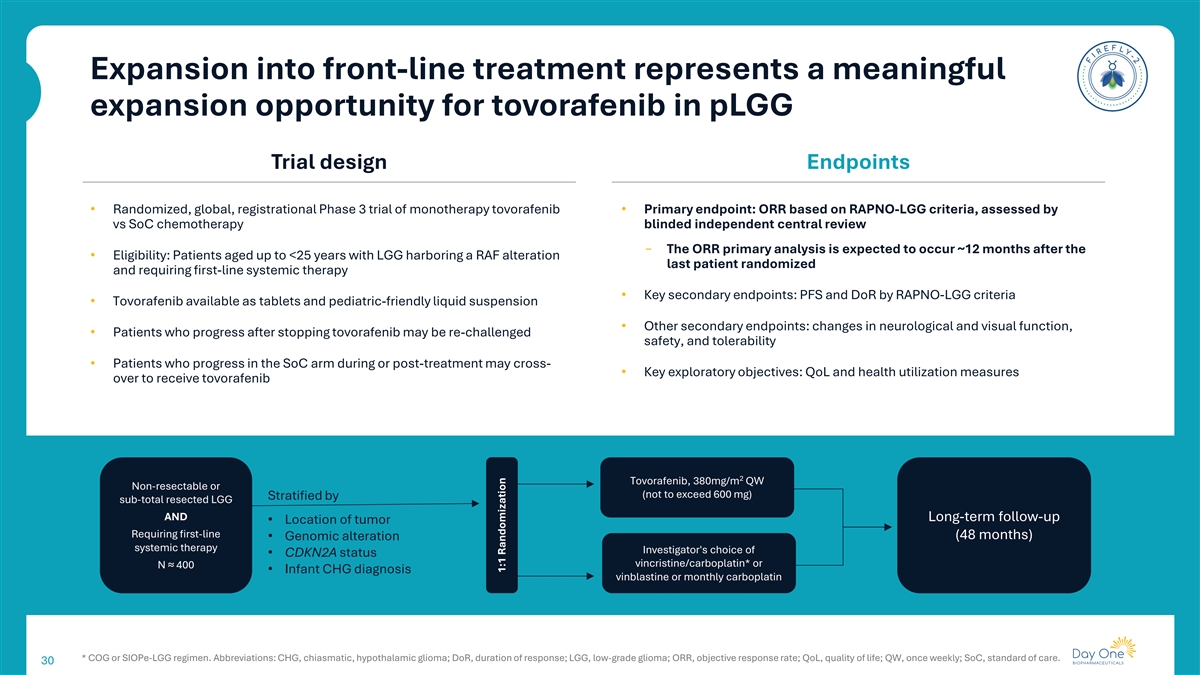
扩展到一线治疗代表了托沃拉非尼在pLGG试验设计终点的有意义的扩展机会•单药治疗托沃拉非尼的随机、全球、注册性3期试验•主要终点:基于RAPNO-LGG标准的ORR,通过vs SoC化疗盲法独立中心审评进行评估丨ORR主要分析预计将在•合格后约12个月发生:年龄达< 25岁的LGG伴有RAF改变的患者最后一名患者随机分配并需要一线全身治疗•关键次要终点:RAPNO-LGG标准的PFS和DOR •托沃拉非尼可作为片剂和儿科友好液体混悬液使用•其他次要终点:神经和视觉功能的变化,•停用托沃拉非尼后进展的患者可能会再次受到安全性挑战,和耐受性•在治疗期间或治疗后SoC组进展的患者可能跨越-•关键探索性目标:QOL和健康利用措施超过接受托沃拉非尼2托沃拉非尼、380mg/m QW不可切除或(不超过600mg)按次总切除LGG和长期随访进行分层•需要一线的肿瘤位置•基因组改变(48个月)全身治疗研究者选择• CDKN2A状态长春新碱/卡铂*或N ≈ 400 •婴幼儿CHG诊断长春碱或每月卡铂*COG或SIOPE-LGG方案。简称:CHG,chiasmatic,下丘脑胶质瘤;DOR,缓解持续时间;LGG,低级别胶质瘤;ORR,客观缓解率;QOL,生活质量;QW,每周一次;SoC,护理标准。301:1随机化

Emi-Le B7-H4靶向抗体-药物偶联物(ADC)31

Emi-Le代表了一个变革性机会,可以解决腺样囊性癌(ACC)患者6个未满足的需求2 • ACC是一种罕见的癌症,美国每年的发病率约为1,300例•复发性/转移性ACC通常表现为侵袭性特征;不存在2种已获批准的治疗方案Emi-Le • B7-H4在3例复发/转移性ACC1(Emiltatug Ledadotin)患者中高度且一致地过度表达• B7-H4也在其他成人和儿童肿瘤4型中表达潜在的first-in-class B7-在ACC中具有高度未满足的需求H4靶向ADC机会• Emi-Le是一种B7-H4定向ADC,利用靶点优化的分子5设计和专有的linker-payload(Dolasynthen)•在ACC-1和1,6患者中观察到可测量的抗肿瘤活性,明确定义的安全性特征支持加速临床开发12345 Hamilton EP等人2025年ASCO年会;腺样囊性癌研究基金会;Mota Siquera J等人2024年现代病理学;Dawidowicz M等人2024年癌症;Fessler等人2023年MOL Cancer Ther;6。632 Hamilton E et al 2025 ESMO乳腺癌。Emi-Le是Mersana Therapeutics的一款在研产品,等待已宣布的对Mersana的收购在Day One前完成。

DAY301 PTK7靶向抗体-药物偶联物(ADC)33

DAY301:靶向PTK7的下一代ADC实质性开发PTK7:临床-DAY301:潜在的首次和商业潜力验证ADC靶点类资产DAY301在ADC中具有高PTK7表达活性的新型ADC的抗肿瘤活性在1b期临床前模型中得到证明,设计了cofetuzumab pelidotin的多项成人和儿科1试验,以最大限度地提高治疗性肿瘤适应症窗口第一剂量队列清除2025年1月1 Cho BC,等人Ann Oncol。(34;Suppl 2):S460-S461,2023。34

PTK7:临床验证的ADC靶点下一代PTK7 ADC的潜在机会,治疗指数提高1 • cofetuzumab pelidotin的临床结果证明了PTK7靶向ADC的概念验证• Cofetuzumab pelidotin活性见于多种肿瘤类型:•卵巢(PT耐药):ORR 27%(n = 63)• TNBC:ORR 21%(n = 29)• NSCLC:ORR 19%(n = 31)• mDOR:卵巢(PT耐药)为4.2-5.7m/TNBC/NSCLC • mPFS:卵巢(PT耐药)为1.5-2.9m/TNBC/NSCLC • Aur0101程序受毒性限制,导致剂量强度和持续时间降低•具有优化特性和更好治疗指数的下一代产品可能会实现更大的临床疗效1 PF-06647020/ABBV-647的1b期研究。35

DAY301:潜在的first-in-class资产DAY301旨在最大限度地提高治疗指数并克服先前项目的限制•在多个临床前模型中观察到的可耐受剂量下的肿瘤消退•在赛诺毒理学研究中更高的HNSTD;具有已知安全性的有效载荷•高细胞通透性/旁观者效应;低流出(不是P-GP底物)•新型、高度亲水、可切割的接头•具有良好稳定性和可开发性的中高亲和力抗体•药物抗体比(DAR)为8,显示对实体瘤中的其他ADC有效• IP:Composition of Matter专利期限预计2044,一旦发布1)达美林M,等人。一种PTK7靶向抗体-药物偶联物可减少肿瘤起始细胞并诱导持续的肿瘤消退。Sci Transl Med. 2017。HNSTD,最高非剧毒剂量;P-GP,P-糖蛋白。36
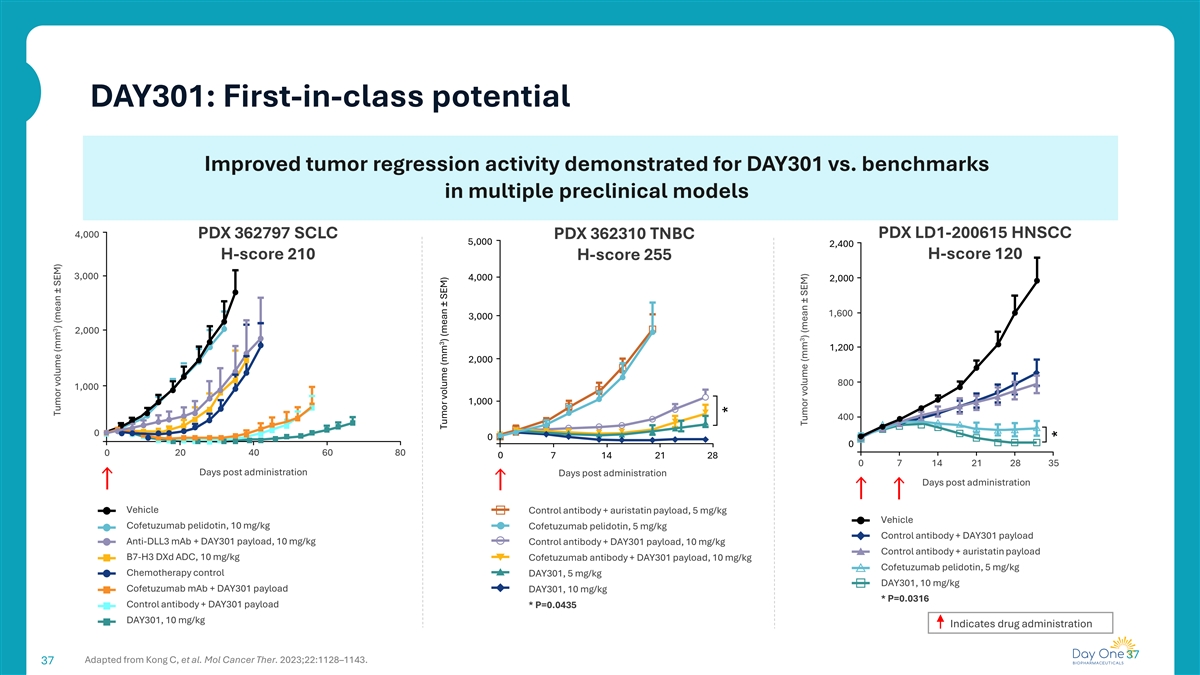
DAY301:一流的潜力提高了DAY301与多个临床前模型中的基准相比的肿瘤消退活性4,000 PDX 362797 SCLC PDX 362310 TNBC PDX LD1-200615 HNSCC 5,0002,400 H-score 120 H-score 210 H-score 2553,0004,0002,0001,6003,0002,00012002,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0001,0005 mg/kg对照抗体+ DAY301有效载荷抗DLL3单抗+ DAY301有效载荷,10 mg/kg对照抗体+ DAY301有效载荷,10 mg/kg对照抗体+奥氏他汀有效载荷B7-H3 DXD ADC,10 mg/kg科非妥珠单抗抗体+ DAY301有效载荷,10 mg/kg科非妥珠单抗培立多汀,5 mg/kg化疗对照DAY301,5 mg/kg DAY301,10 mg/kg科非妥珠单抗MAB + DAY301有效载荷,10 mg/kg*P = 0.03 16对照抗体+ DAY301有效载荷*P = 0.04 35 DAY301,10mg/kg表示药物给药37改编自Kong C,etal. mol cancer ther。2023;22:1128–1143.373肿瘤体积(mm)(均值± SEM)3肿瘤体积(mm)(均值± SEM)*3肿瘤体积(mm)(均值± SEM)*
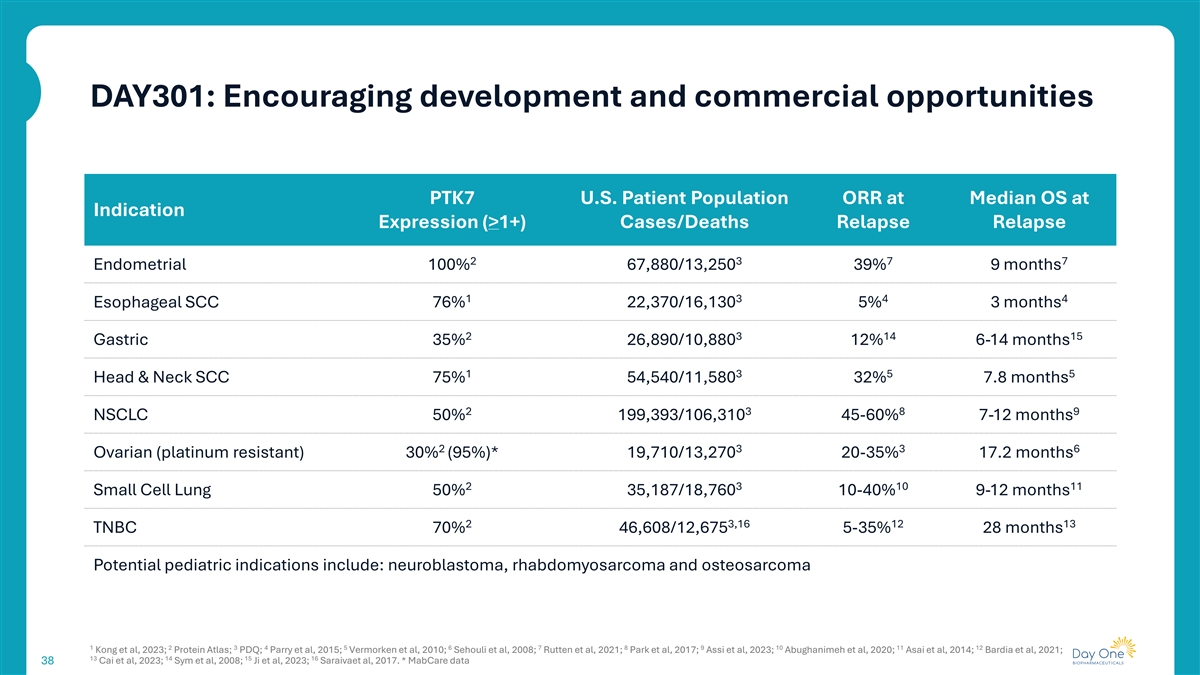
DAY301:鼓励发展和商业机会PTK7美国患者群体ORR在中位OS在适应症表达(> 1 +)病例/死亡复发复发23777子宫内膜100% 67,880/13,25039% 9个月1344食管SCC 76% 22,370/16,1305% 3个月231415胃35% 26,890/10,88012% 6-14个月1355头颈SCC 75% 54,540/11,58032% 7.8个月2389 NSCLC 50% 199,393/106,310 45-60 % 7-12个月2336卵巢(铂耐药)30%(95%)*19,710/13,270 20-35 % 17.2个月231011小细胞肺50% 35,187/18,760 10-40 % 9-12个月23,161213 TNBC 70% 46,608/12,6755-35 % 28个月潜在儿科适应症包括:神经母细胞瘤、横纹肌肉瘤和骨肉瘤123456789 101112 Kong等,2023;蛋白质图谱;PDQ;Parry等,2015;Vermorken等,2010;Sehouli等,2008;Rutten等,2021;Park等,2017;Assi等,2023;Abughanimeh等,2020;Asai等,2014;Bardia等,2021;13141516 Cai等,2023;SYM等,2008;Ji等,2023;Saraivae等,2017。*MABCare数据38
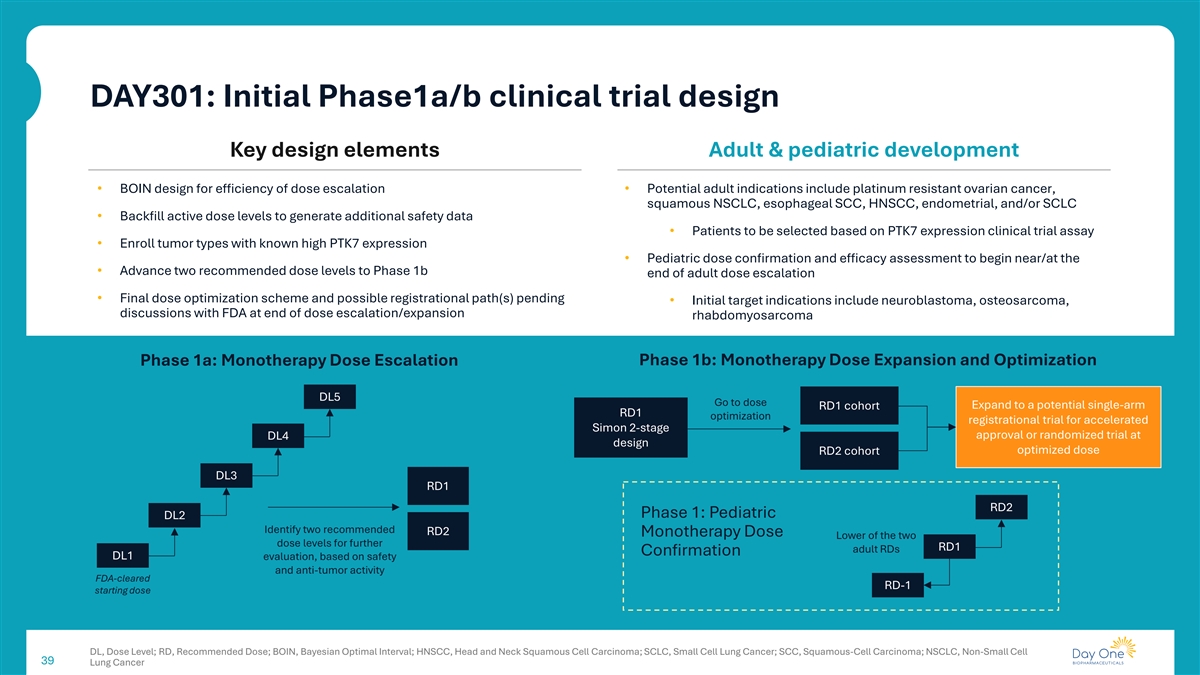
DAY301:初步1a/b期临床试验设计关键设计要素成人&儿科开发• BOIN设计提高剂量递增效率•潜在成人适应症包括铂耐药卵巢癌、鳞状NSCLC、食管SCC、HNSCC、子宫内膜、和/或SCLC •回填有效剂量水平以产生额外的安全性数据•将根据PTK7表达临床试验分析选择的患者•招募已知高PTK7表达的肿瘤类型•儿科剂量确认和疗效评估将在附近/在附近开始•将两个推荐的剂量水平推进到成人剂量递增的第1b阶段结束•最终剂量优化方案和可能的注册路径待定•初始目标适应症包括神经母细胞瘤、骨肉瘤、剂量递增/扩增结束时与FDA讨论横纹肌肉瘤1b期:单药治疗剂量扩增和优化1a期:单药治疗剂量递增DL5进入剂量扩增到潜在的单臂RD1队列RD1优化注册试验,用于加速Simon 2阶段批准或DL4设计优化剂量RD2队列DL3 RD1 RD2期的随机试验1期:儿科DL2确定两种推荐的RD2单药治疗剂量低于两种剂量水平,用于进一步的RD1成人RDs确认DL1评估,基于安全性和抗肿瘤活性FDA批准的RD-1起始剂量DL,剂量水平;RD,推荐剂量;BOIN,贝叶斯最佳间隔;HNSCC,头颈部鳞状细胞癌;SCLC,小细胞肺癌;SCC,鳞状细胞癌;NSCLC,非小细胞39肺癌

摘要40
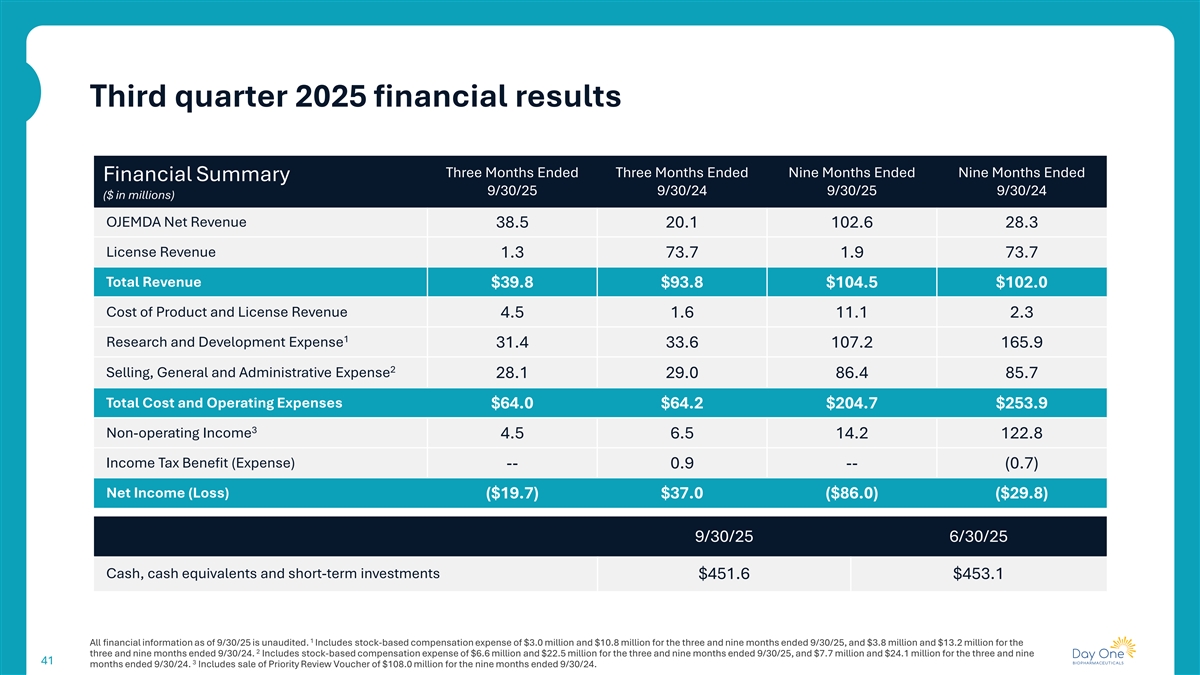
2025年第三季度财务业绩三个月结束三个月结束九个月结束九个月结束财务摘要9/30/259/30/249/30/259/30/24(百万美元)OJEMDA净收入38.52 0.1 102.628.3许可收入1.37 3.7 1.97 3.7总收入39.8美元93.8美元104.5美元102.0美元产品成本和许可收入4.51.61 1.1 2.31研发费用31.43 3.6 107.21 65.92销售,一般和行政费用28.12 9.08 6.485.7总成本和运营费用64.0美元64.2美元204.7美元253.9美元3非经营收入4.56.5 14.21 22.8所得税优惠(费用)-0.9--(0.7)净收入(亏损)(19.7美元)37.0美元(86.0美元)(29.8美元)9/30/256/30/25现金、现金等价物和短期投资451.6美元453.11截至9/30/25的所有财务信息均未经审计。包括截至9/30/25止三个月和九个月的股票薪酬费用300万美元和1080万美元,以及截至9/30/24止两个三个月和九个月的380万美元和1320万美元。包括截至9/30/25止三个月和九个月的基于股票的薪酬开支660万美元和2250万美元,以及截至9/30/24止三个月和九个413个月的770万美元和2410万美元。包括出售截至9/30/24止九个月的1.08亿美元优先审查凭证。

Day One为可持续增长和长期成功做好了充分准备在临床驱动OJEMDA开发管道上执行以实现收入增长FIREFLY-2和DAY301利用我们的开发并保持强大的资本商业化专业知识来定位,同时投资于进一步扩大我们的多个管道资产组合4242

附录43
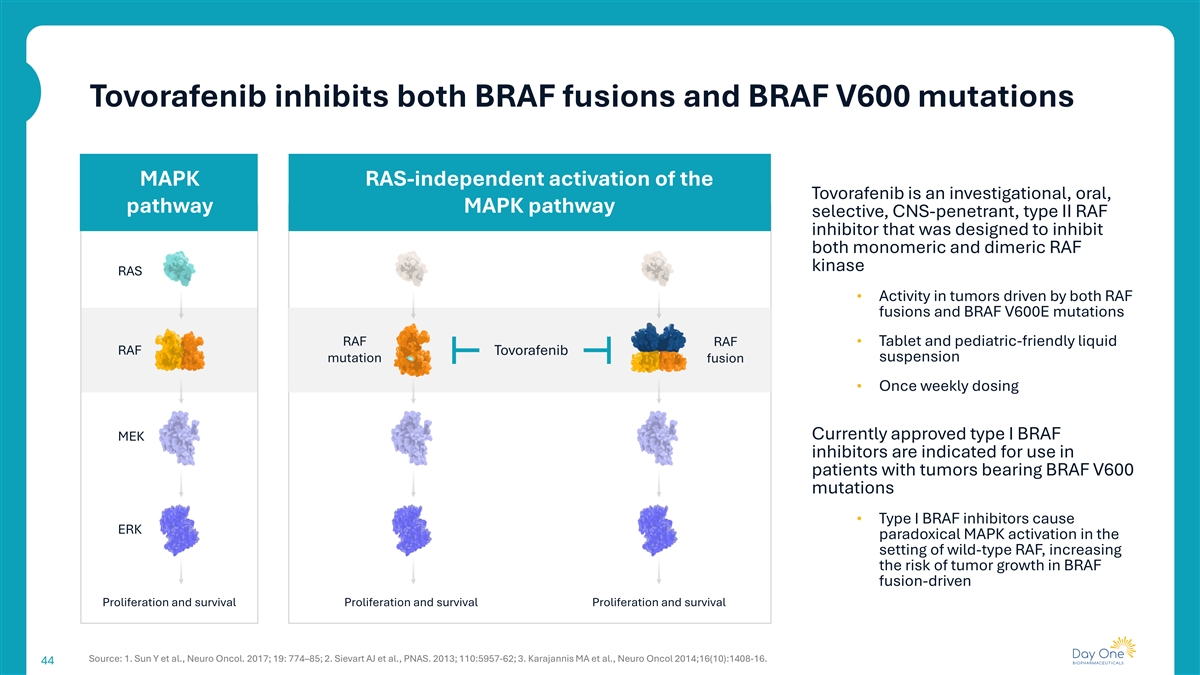
Tovorafenib抑制BRAF融合和BRAF V600突变MAPK RAS非依赖性激活Tovorafenib是一种研究性、口服、通路MAPK通路选择性、中枢神经系统渗透性、II型RAF抑制剂,旨在抑制单体和二聚体RAF激酶RAS •在RAF融合和BRAF V600E突变同时驱动的肿瘤中的活性RAF RAF •片剂和儿科友好液体RAF托沃拉非尼悬浮突变融合•每周一次给药目前批准的I型BRAF MEK抑制剂适用于携带BRAF V600突变的肿瘤患者• I型BRAF抑制剂在野生型RAF环境中引起ERK矛盾MAPK激活,增加BRAF融合驱动的肿瘤生长风险增殖和存活增殖和存活增殖和存活来源:1。Sun Y et al.,Neuro Oncol。2017; 19: 774–85; 2.Sievart AJ等,PNAS。2013; 110:5957-62; 3.Karajannis MA et al.,Neuro Oncol 2014;16(10):1408-16。44