
附件 99.1强大的科学有意义的药物改变生活纳斯达克:ETNB 2025年4月

免责声明本演示文稿包含联邦证券法含义内的“前瞻性陈述”,这些陈述受到重大风险和不确定性的影响,并基于估计和假设。除历史事实陈述外,本演示文稿中包含的所有陈述均为前瞻性陈述,包括关于我们的计划、目标、目标、战略、未来事件、与候选产品相关的计划或意图、潜在市场机会、市场规模估计、市场增长估计、市场份额估计、潜在临床益处、与其他疗法的互补益处、对pegozafermin(原BIO89-100)的组织学和安全性和耐受性的影响、pegozafermin的临床潜力、pegozafermin的潜在适应症、临床数据与其他适应症的潜在临床益处的关联、预期的时间、设计、终点,并进行我们未来和正在进行的pegozafermin临床试验,包括MASH伴晚期纤维化(F2-F3)和MASH伴代偿性肝硬化(F4)3期试验的预期组织学数据和SHTG 3期试验的预期顶线结果、预期里程碑的时间安排、监管会议的时间安排、成功的时间和可能性、管理层对未来运营的计划和目标以及预期产品开发努力的未来结果以及我们的流动性和资本资源,包括我们的现金状况。在某些情况下,您可以通过“可能”、“可能”、“将”、“目标”、“打算”、“应该”、“可能”、“可以”、“将”、“预期”、“相信”、“设计”、“估计”、“预测”、“潜在”、“计划”或这些术语的否定词来识别前瞻性陈述,以及旨在识别前瞻性陈述的类似表述。这些陈述涉及已知和未知的风险、不确定性和其他因素,这些因素可能导致我们的实际结果与本演示文稿中明示或暗示的前瞻性陈述存在重大差异,包括那些在“风险因素”标题下以及此类报告和随后提交给SEC的其他披露文件中更全面地描述了我们最近的10-K表格和10-Q表格的那些陈述。我们无法向您保证,我们将实现我们预期或预期的结果、收益或发展,或者,即使已基本实现,它们将导致后果或以预期的方式影响我们或我们的业务。前瞻性陈述不是历史事实,反映了我们目前对未来事件的看法。鉴于存在重大不确定性,您应该在这些风险和不确定性的背景下评估本演示文稿中所做的所有前瞻性陈述,而不是过分依赖这些前瞻性陈述作为对未来事件的预测。本演示文稿中的所有前瞻性陈述仅适用于作出之日,并受到本演示文稿中包含的警示性陈述的明确限定。除法律要求外,我们不打算公开更新或修改任何前瞻性陈述以反映后续事件或情况。我们从我们自己的内部估计和研究,以及行业和一般出版物,以及第三方进行的研究、调查和研究中获得了本演示文稿中使用的行业、市场和竞争地位数据。内部估计来自行业分析师和第三方来源发布的公开信息、我们的内部研究和我们的行业经验,并基于我们根据这些数据以及我们对行业和市场的了解做出的假设,我们认为这些假设是合理的。此外,虽然我们认为本演示文稿中包含的行业、市场和竞争地位数据是可靠的,并且基于合理的假设,但我们没有独立核实任何第三方信息,所有这些数据都涉及风险和不确定性,并且可能会基于各种因素而发生变化。这些数据涉及许多假设和限制,请注意不要对这些估计给予不应有的权重。本演示文稿讨论了正在进行临床前或临床评估且尚未获得美国食品和药物管理局或任何其他监管机构批准上市的候选产品。在临床研究报告中最终确定之前,此处提供的临床试验数据仍将受到临床现场审计和其他审查过程的调整。对于这些候选产品的安全性或有效性,不作任何陈述,以供正在研究这些候选产品的用途。1
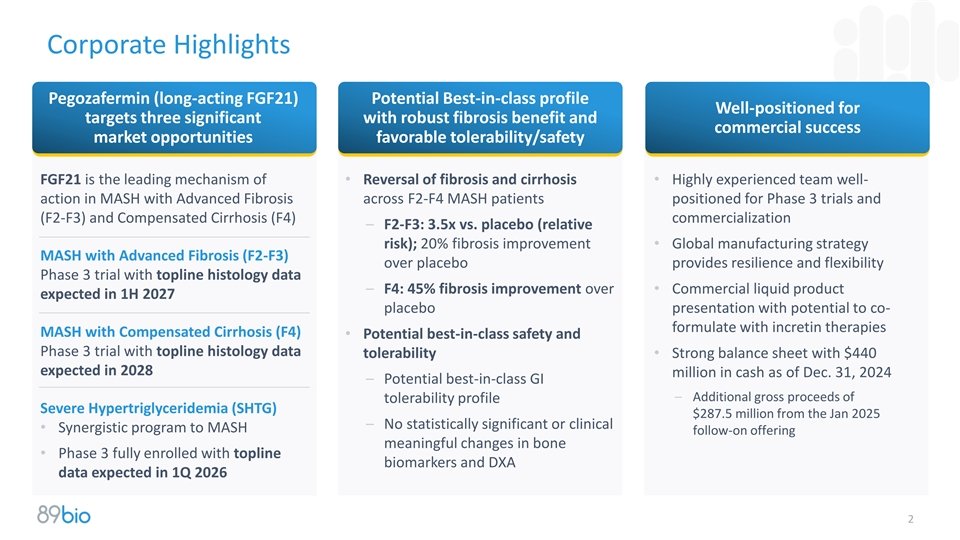
公司亮点Pegozafermin(长效FGF21)潜在的同类最佳概况为目标三做好准备具有强大的纤维化益处和商业成功市场机会有利的耐受性/安全性FGF21是•纤维化和肝硬化的逆转•在F2-F4 MASH患者中具有晚期纤维化的MASH中经验丰富的团队良好行动定位于3期试验和(F2-F3)和代偿性肝硬化(F4)商业化– F2-F3:3.5x vs.安慰剂(相对风险);20%的纤维化改善•与安慰剂相比,具有晚期纤维化的全球制造战略MASH(F2-F3)提供了韧性具有顶线组织学数据的和灵活性的3期试验– F4:纤维化改善45%比•商业液体产品预计在2027年上半年进行安慰剂展示,具有与肠促胰岛素疗法MASH伴代偿性肝硬化(F4)共同配制的潜力•潜在的同类最佳安全性和具有顶线组织学数据耐受性的3期试验•强劲的资产负债表,截至12月31日,预计现金为4.4亿美元,2028百万,2024年–潜在同类最佳GI –从2025年1月开始的耐受性概况严重高甘油三酯血症(SHTG)的额外总收益2.875亿美元–没有统计学意义或临床意义•为MASH后续提供有意义的骨骼变化的协同计划•预计在2026年第一季度完全注册顶线生物标志物和DXA数据的第3期2
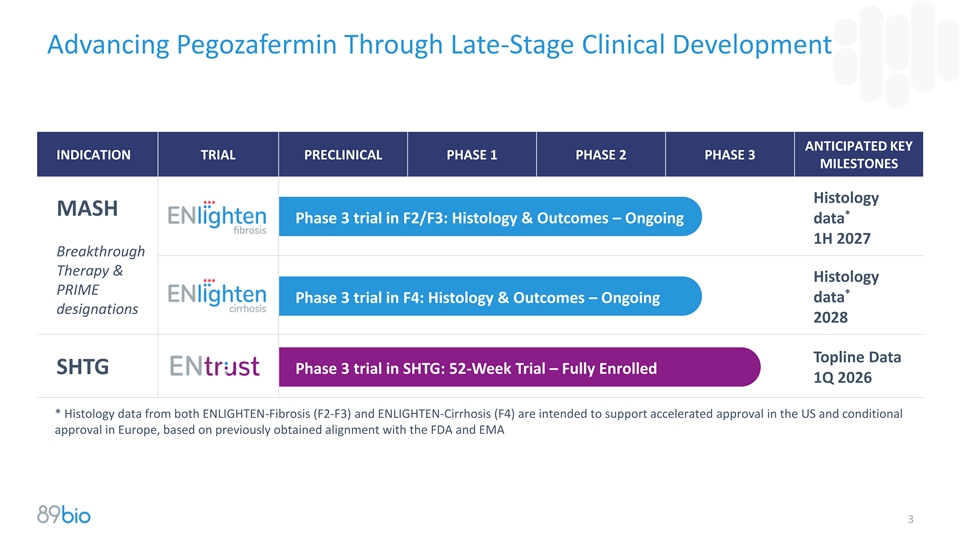
通过后期临床开发推进Pegozafermin预期关键适应症试验临床前阶段1阶段2阶段3里程碑组织学MASH*F2/F3的3期试验:组织学&结果–持续数据1H 2027突破性疗法&组织学PRIME*F4中的3期试验:组织学与结果–正在进行的数据指定2028 TOpline Data SHTG中的SHTG 3期试验:52周试验– 2026年第一季度全面入组*来自ENLIGHTEN纤维化(F2-F3)和ENLIGHTEN肝硬化(F4)的组织学数据旨在支持美国的加速批准和欧洲的有条件批准,基于先前获得的与FDA和EMA3的一致性
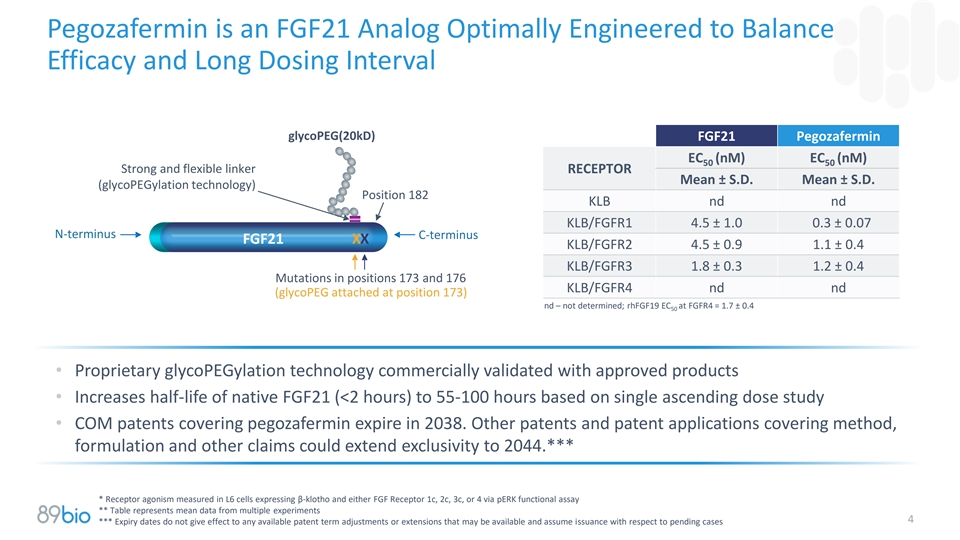
Pegozafermin是一种FGF21类似物,优化设计用于平衡疗效和长给药间隔glycoPEG(20kD)FGF21 Pegozafermin EC(nM)EC(nM)5050强柔性接头受体均值± SD均值± SD.(糖聚乙二醇化技术)位置182 KLB nd nd KLB/FGFR1 4.5 ± 1.0 0.3 ± 0.07 N端C端FGF21 XX KLB/FGFR2 4.5 ± 0.9 1.1 ± 0.4 KLB/FGFR3 1.8 ± 0.31.2 ± 0.4 173位突变和176 KLB/FGFR4 nd nd(glycoPEG附着在173位)nd –未确定;rhFGF19 EC at FGFR4 = 1.7 ± 0.450 •专有糖聚乙二醇化技术经批准产品商业验证•基于单次递增剂量研究将原生FGF21的半衰期(< 2小时)提高到55-100小时•涵盖pegozafermin的COM专利将于2038年到期。涵盖方法、配方和其他权利要求的其他专利和专利申请可将排他性延长至2044年。****通过pERK功能测定在表达β-klotho和任何一种FGF受体1c、2c、3c或4的L6细胞中测量受体激动性**表格表示来自多个实验的平均数据4***到期日不会使任何可用的专利期限调整或延期生效,这些调整或延期可能可用并承担与未决案件相关的发行
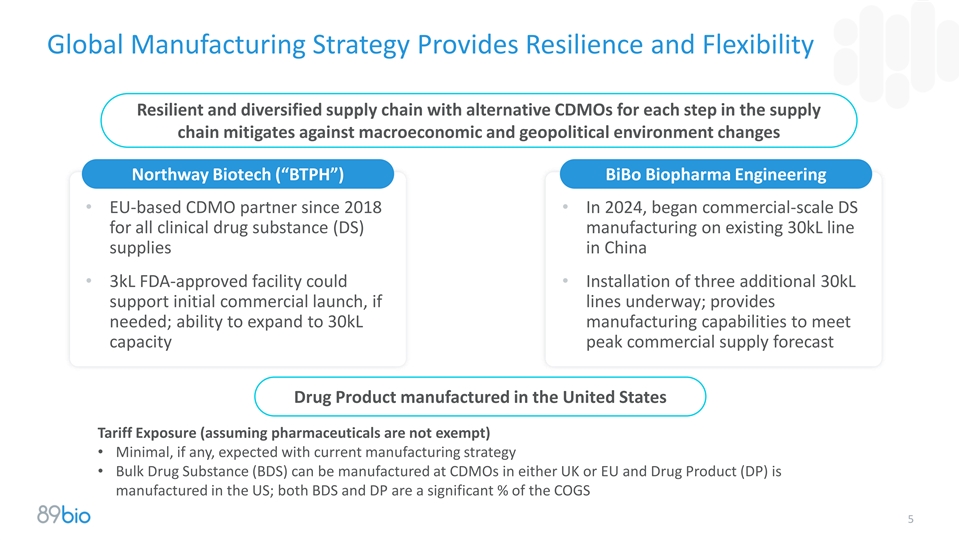
全球制造战略提供韧性和灵活性为供应链中的每个步骤提供替代CDMO的具有韧性的多元化供应链缓解了宏观经济和地缘政治环境变化的影响Northway Biotech(“BTPH”)BIBO Biopharma Engineering •自2018年以来位于欧盟的CDMO合作伙伴• 2024年,开始在中国现有的30kL线供应上为所有临床药物(DS)制造提供商业规模的DS • 3kL FDA批准的设施可以•安装三个额外的30kL支持初步商业启动,如果生产线正在进行中;提供所需;有能力扩展到30kL制造能力以满足产能峰值商业供应预测美国制造的药物产品关税风险(假设药品不豁免)•当前制造战略预期的最小(如果有的话)•大宗药物物质(BDS)可以在英国或欧盟的CDMO生产,药物产品(DP)在美国制造;BDS和DP都是COGS的重要百分比5

MASH中的机会
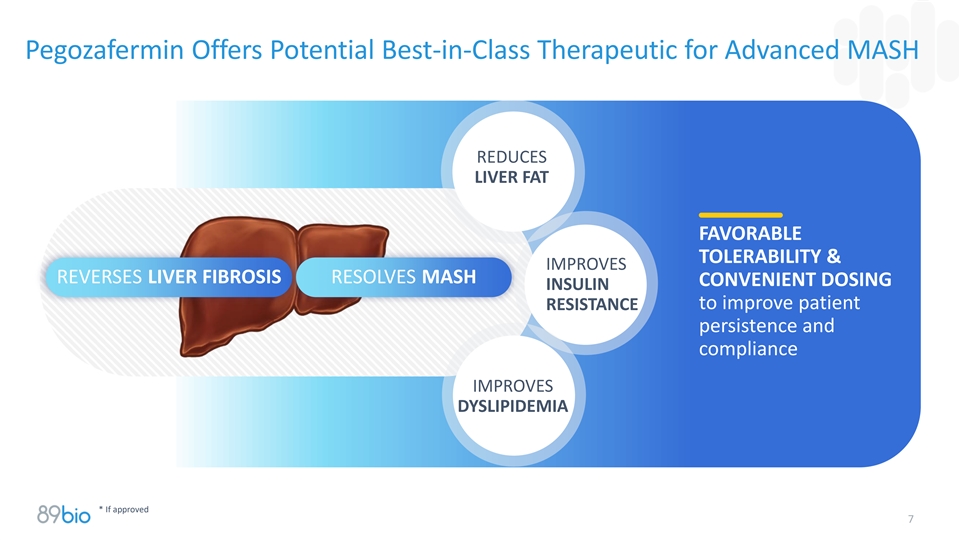
Pegozafermin为晚期MASH提供潜在的同类最佳疗法降低肝脏脂肪有利的耐受性&改善逆转肝脏纤维化解决MASH方便的剂量胰岛素以改善患者的耐药性持久性和依从性改善血脂障碍*如获批准7
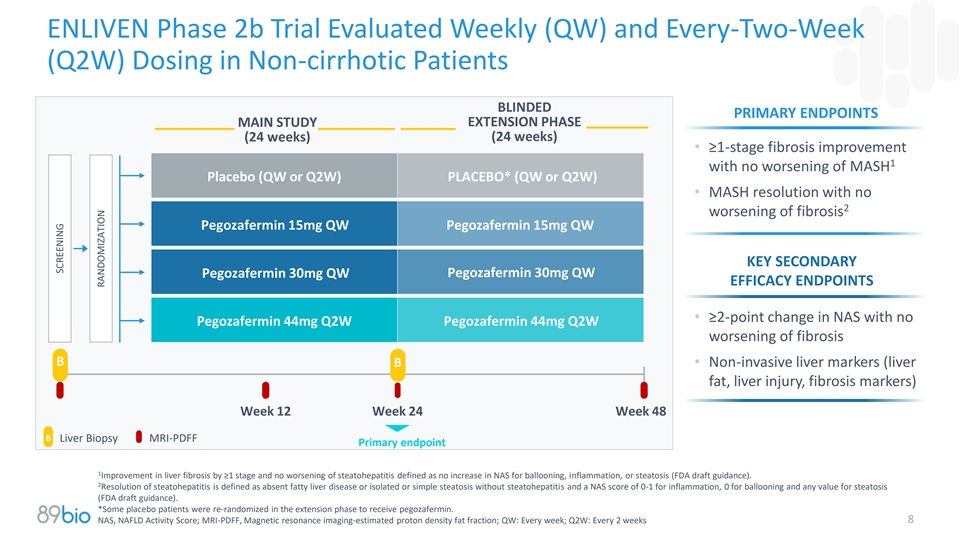
ENLIVEN 2b期试验在非肝硬化失明患者中评估每周(QW)和每两周(Q2W)给药主要研究延长阶段(24周)(24周)• ≥ 1期纤维化改善1无MASH安慰剂恶化(QW或Q2W)PLACEB PLO*ACEBO(QWQ2 ORW Q2W)• mASH分辨率伴无2纤维化恶化pegozafermin 15mg QW pegozafermin 15mg QW关键次要pegozafermin 30mg QW pegozafermin 30mg QW Efficacy endpoints • NAS ≥ 2点变化伴无pegozafermin 44mg Q2W pegozafermin 44mg Q2W纤维化恶化B B •非侵入性肝脏标志物(肝脂肪、肝损伤、纤维化标志物)第12周第24周第48周B肝活检MRI-PDFF主要终点1肝纤维化改善≥ 1阶段且脂肪性肝炎无恶化定义为球囊、炎症或脂肪变性的NAS无增加(FDA指导草案)。2脂肪性肝炎的消退定义为无脂肪性肝病或无脂肪性肝炎的孤立或单纯性脂肪变性,且炎症的NAS评分为0-1,球囊肿0,脂肪变性的任何值(FDA指导草案)。*部分安慰剂患者在延长阶段重新随机分配接受pegozafermin。8NAS,NAFLD活性评分;MRI-PDFF,磁共振成像-估算质子密度脂肪分数;QW:每周一次;Q2W:每2周一次筛查随机
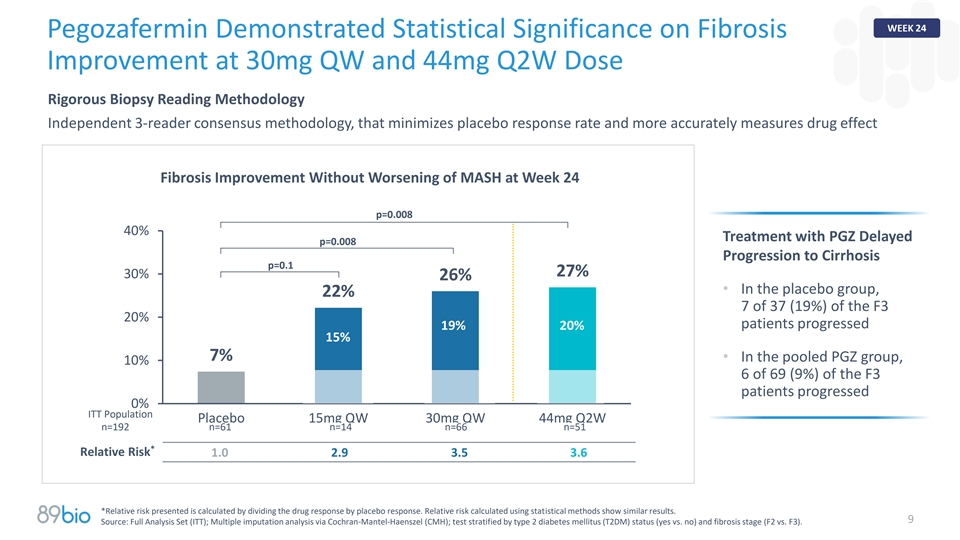
第24周Pegozafermin在30mg QW和44mg Q2W剂量下证明了纤维化改善的统计意义严格活检阅读方法独立的3-reader共识方法,该方法最大限度地降低安慰剂应答率并更准确地测量药物效应纤维化改善而第24周的MASH没有恶化p = 0.00840% PGZ治疗延迟p = 0.008进展为肝硬化p = 0.27% 30% 26% •在安慰剂组中,37名(19%)F3 20%患者中有22% 7名(19%)进展19% 20% 15% 7% •在合并的PGZ组中,69例F3患者中10% 6例(9%)进展0% ITT人群安慰剂15mg QW 30mg QW 44mg Q2W n = 192 n = 61 n = 14 n = 66 n = 51*相对风险1.0 2.9 3.5 3.6*呈现的相对风险是通过药物反应除以安慰剂反应来计算的。使用统计方法计算的相对风险显示了相似的结果。9来源:全分析集(ITT);通过Cochran-Mantel-Haenszel(CMH)进行多重归因分析;按2型糖尿病(T2DM)状态(yes vs. no)和纤维化阶段(F2 vs. F3)分层的试验。

非肝硬化(F2/F3)患者≥ 1期纤维化改善且MASH1未恶化的比较临床数据 Pegozafermin Efruxifermin Efimosfermin Survodutide Rezdiffra Tirzepatide Denifanstat VK2809索马鲁肽FGF21 FGF21 FGF21 GLP-1/胰高血糖素TR-β激动剂GLP-1/GIP FASN TR-β激动剂GLP-1 2b期2b期2b期2期2期3期2b期2b期3期24周24周48周52周52周52周52周72周23读写器面板2读写器2读写器单读写器2读写器2读写器单读写器2读写器2读写器2读写16% 15% 14% 12% 10% 2.4mg 30mg 44mg 28mg 50mg 300mg 4.8mg 6mg 80mg 100mg 10mg 15mg 50mg联合(n = 534)QW Q2W(n = 38)(n = 34)(n = 31)(n = 72)(n = 74)(n = 316)(n = 321)(n = 47)(n = 48)(n = 81)(n = 137)(n = 66)(n = 51)1 ≥ 1阶段纤维化改善,NAS无恶化。纤维化改善≥ 1阶段,NAFLD活性评分无恶化。2每张幻灯片由两名读者(一对)阅读,他们是从六种集中性病理中随机挑选出来的注:这些数据来自不同时间点的不同临床试验,在试验设计和患者群体方面存在差异。因此,无法进行跨试验比较,也没有进行过头部对10的临床试验。
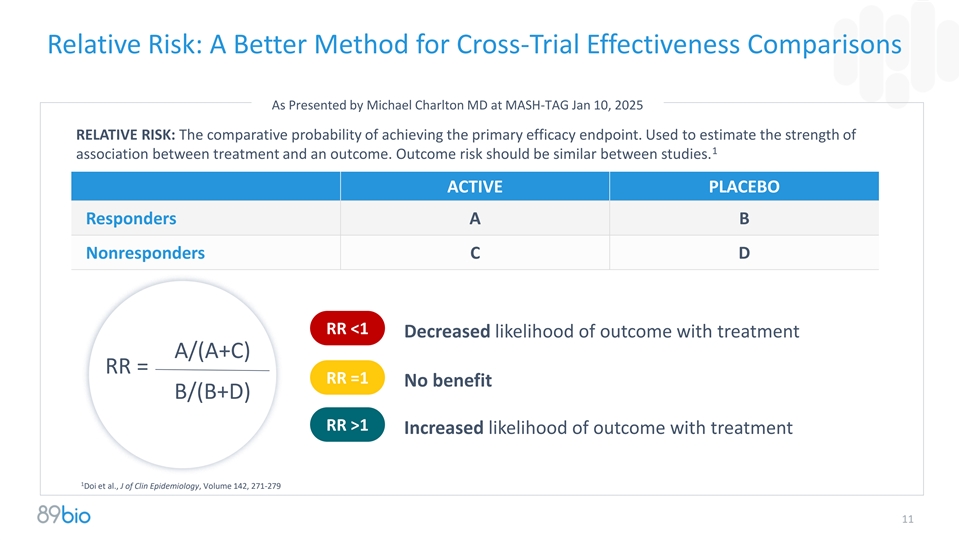
相对风险:由医学博士Michael Charlton在MASH-TAG 2025年1月10日提出的更好的跨试验有效性比较方法相对风险:达到主要疗效终点的比较概率。用于估计治疗与结果之间1个关联的强度。研究之间的结果风险应该是相似的。活动性placebo应答者A B无应答者C D RR < 1治疗结果的可能性降低A/(A + C)RR = RR = 1无获益B/(B + D)RR > 1治疗结果的可能性增加1 Doi等人,临床流行病学杂志J,第142卷,271-279 11
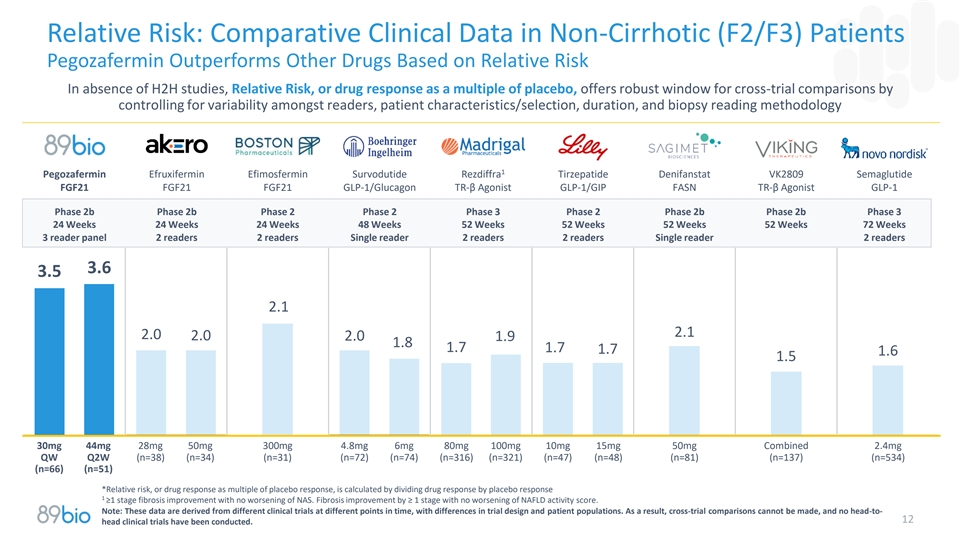
相对风险:基于在没有H2H研究、相对风险或作为安慰剂倍数的药物反应的情况下的相对风险,Pegozafermin在非肝硬化(F2/F3)患者中的比较临床数据优于其他药物,通过控制读者之间的变异性、患者特征/选择、持续时间、和活检读取方法1 Pegozafermin Efruxifermin Efimosfermin Survodutide Rezdiffra Tirzepatide Denifanstat VK2809 Semaglutide FGF21 FGF21 FGF21 GLP-1/胰高血糖素TR-β激动剂GLP-1/GIP FASN TR-β激动剂GLP-1 2b期2b期2b期2期3期2b期2b期3期24周24周48周52周52周52周52周52周72周3读写器面板2读写器2读写器单读写器2读写器2读写器单读写器2读写器3.6 3.5 2.1 2.0 2.0 2.0 2.0 1.9 1.8 1.7 1.7 1.7 1.7 1.6 1.5 30mg44mg28mg50m100mg 10mg 15mg 50mg联合2.4mg QW Q2W(n = 38)(n = 34)(n = 31)(n = 72)(n = 74)(n = 316)(n = 321)(n = 47)(n = 48)(n = 81)(n = 137)(n = 534)(n = 66)(n = 51)*相对风险,或药物反应作为安慰剂反应的倍数,通过将药物反应除以安慰剂反应1 ≥ 1阶段纤维化改善且NAS没有恶化来计算。纤维化改善≥ 1阶段,NAFLD活性评分无恶化。注:这些数据来源于不同时点的不同临床试验,在试验设计和患者人群方面存在差异。因此,无法进行跨试验比较,也没有进行过头部对12的临床试验。

Pegozafermin作为F2-F3 MASH的领先疗法基于MASH中的最高SUCRA评分(Hepatology Journal)比较药物疗法对纤维化复发和MASH解决的比较数据来源29项随机对照试验9,234名MASH患者来源:Souza、Matheus等人,2025年。“代谢性功能障碍相关性脂肪性肝炎纤维化回归和MASH分辨率的药理疗法比较:系统评价和网络荟萃分析。”肝病学,2月4日。https://doi.org/10.1097/HEP.0000000000001254。13
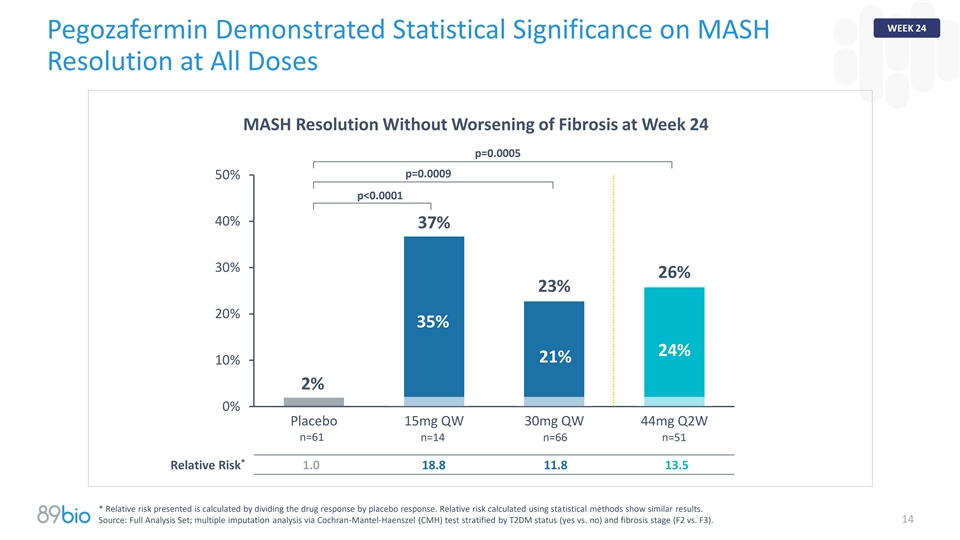
第24周Pegozafermin在所有剂量下均显示出MASH分辨率的统计意义MASH分辨率在第24周没有纤维化恶化p = 0.0005 p = 0.000950% p < 0.000140% 37% 30% 26% 23% 20% 35% 24% 21% 10% 2% 0%安慰剂15mg QW 30mg QW 44mg Q2W n = 61 n = 14 n = 66 n = 51*相对风险1.0 18.81 1.81 3.5*呈现的相对风险是通过将药物反应除以安慰剂反应来计算的。使用统计方法计算的相对风险显示了相似的结果。来源:全分析集;通过Cochran-Mantel-Haenszel(CMH)测试按T2DM状态(yes vs. no)和纤维化阶段(F2 vs. F3)分层的多重归纳分析。14

第24周Pegozafermin在第24周应答和ALT应答时的NAS和MRI-PDFF MASH分辨率的纤维化改善和MASH分辨率的联合终点均显示出统计意义30% 80%***60%***60%***20% 52% 20%***14% 40% 10% 20% 9% 0% 0% 0%安慰剂30mg QW 44mg Q2W安慰剂30mg QW 44mg Q2W n = 61 n = 66 n = 51 n = 61 n = 66 n = 51 n = 51 n = 66 n = 51来源:全分析集;通过Cochran-Mantel-Haenszel(CMH)试验进行多重归因分析,按T2DM状态(yes vs. no)和纤维化阶段(F2 vs. F3)分层。MRI-PDFF应答者定义为肝脏脂肪含量降低≥ 30%;ALT应答者定义为降低≥ 17U/L。15***p < 0.001对比安慰剂。患者患者
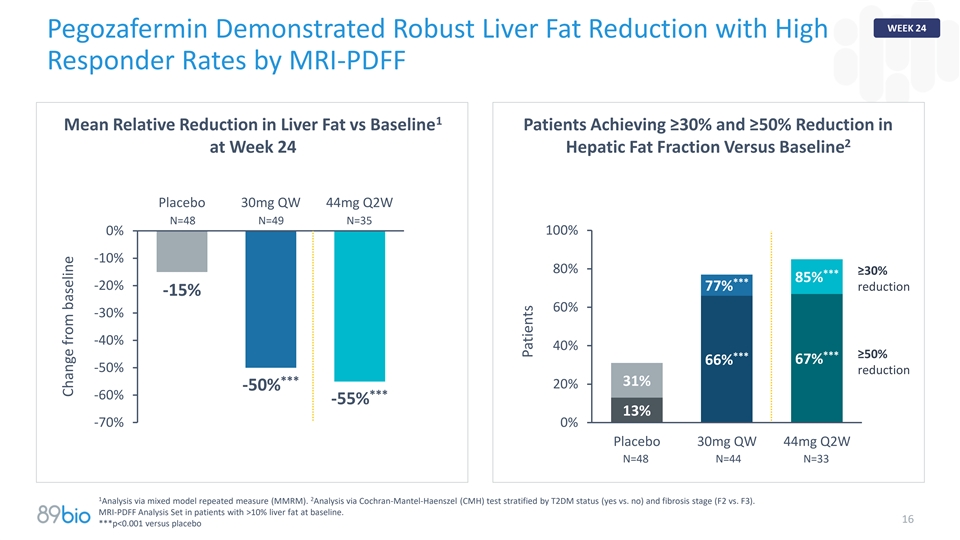
第24周pegozafermin通过MRI-PDFF 1显示出稳健的肝脏脂肪减少,应答率高1平均肝脂肪相对减少vs基线患者在第24周时达到≥ 30%和≥ 50%的减少2肝脂肪分数与基线安慰剂30mg QW 44mg Q2W N = 48 N = 49 N = 35 100% 0%-10 % 80% ≥ 30%***85%***-20 % 77%减少-15 % 60%-30 %-40 % 40%***≥50%***减少67% 66%-50 %***31% 20% -50%***-60 %-55 % 13%-70 %0%安慰剂30mg QW 44mg Q2W N = 48 N = 44 N = 3312通过混合模型重复测量(MMRM)进行分析。通过按T2DM状态(是vs.否)和纤维化阶段(F2 vs. F3)分层的Cochran-Mantel-Haenszel(CMH)测试进行分析。MRI-PDFF分析集在基线时肝脂肪> 10%的患者中。16***p < 0.001对比安慰剂与基线患者的变化

第24周Pegozafermin在肝损伤/炎症(ALT)标志物方面表现出显着改善和AST)第24周基线时ALT均值相对减少vs AST均值相对减少vs基线第24周基线安慰剂30mg QW 44mg Q2W安慰剂30mg QW 44mg Q2W n = 61 n = 66 n = 51 n = 61 n = 66 n = 510%-10 %-5 %-5 %-20 %-20 %-30 %-30 %***-32%***-34% -40% -40%***-39%***-42 %-50 %-50 % ALT******24% 59% 65% 1归一化1 ALT归一化定义为ALT在基线时≥ 30U/L(n = 133)且研究结束ALT < 30U/L的患者。来源:全分析集:通过具有重复测量(MMRM)的混合模型进行分析。以LS均值表示的数据。17***p < 0.001对比安慰剂。
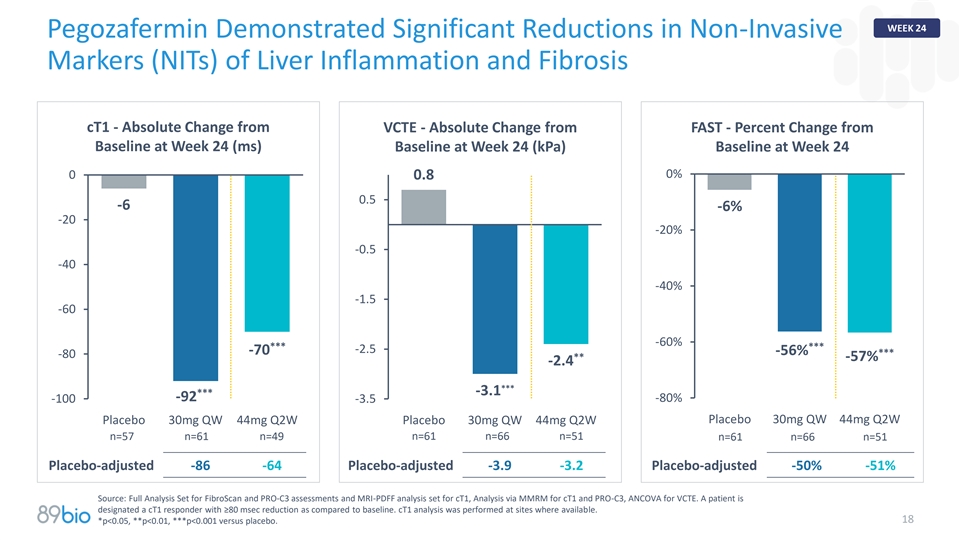
第24周Pegozafermin显示肝炎的非侵入性标志物(NITs)显着减少和纤维化CT1-与VCTE的绝对变化-与FAST的绝对变化-与第24周基线的百分比变化(ms)第24周基线(kPA)第24周基线00% 0.8 0.5-6-6 %-20-20 %-0.5-40-40 %-1.5-60-60 %******-2.5 -70 -56%***-80**-57% -2.4***-3.1***-92-100-3.5-80 %安慰剂30mg QW 44mg Q2W安慰剂30mg QW 44mg Q2W安慰剂30mg QW 44mg Q2W n = 57 n = 61 n = 49 n = 61 n = 66 n = 51 n = 61 n = 66 n = 51安慰剂调整-86-64安慰剂调整-3.9-3.2安慰剂调整-50 %-51 %来源:全分析集为CT1的FibroScan和PRO-C3评估和MRI-PDFF分析集,CT1和PRO-C3的MMRM分析,VCTE的ANCOVA。与基线相比,患者被指定为减少≥ 80毫秒的CT1应答者。在可用的地点进行CT1分析。18*p < 0.05,**p < 0.01,***p < 0.001对比安慰剂。

第24周Pegozafermin在非侵入性标志物(NITS)方面表现出显着改善纤维化ELF-与FIB-4的绝对变化-与PRO-C3的绝对变化-与第24周的第24周的基线变化百分比第24周的基线0.3 0.26% 0.2 0.15% 0.10.0-5 %-0.1-0.2-15 %-0.3*********-0.3 -0.3***-17% -18%***-0.3***-0.4-0.4-0.5-25 %安慰剂30mg QW 44mg Q2W安慰剂30mg QW 44mg Q2W安慰剂30mg QW 44mg Q2W n = 61 n = 66 n = 51 n = 61 n = 66 n = 51 n = 61 n = 66 n = 51安慰剂调整-0.5-0.5安慰剂调整-0.4-0.4安慰剂调整-25 %-24 %来源:全分析集。报告为LS的NITs意味着与基线相比有变化(绝对或%)19***p < 0.001对比安慰剂。
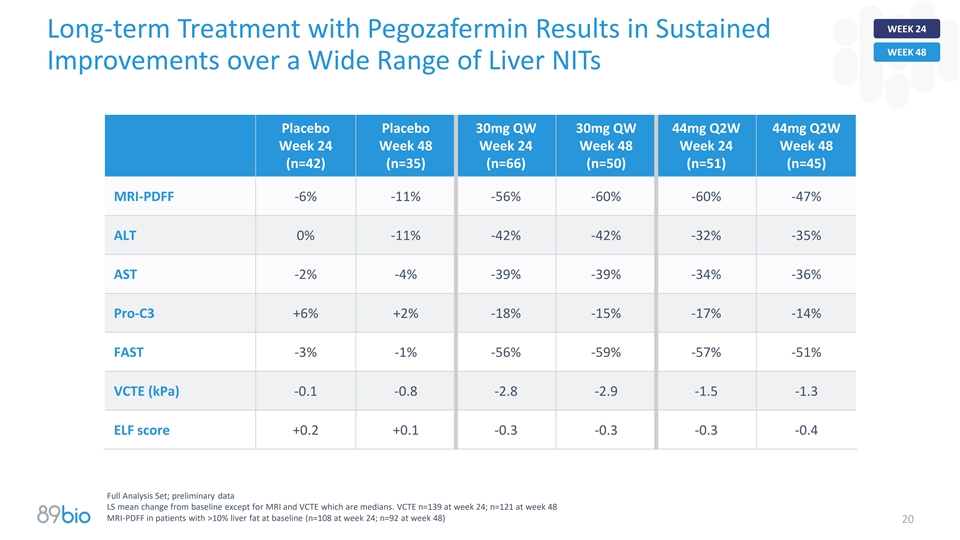
第24周Pegozafermin长期治疗导致持续的第48周改善范围广泛的肝脏NITs安慰剂安慰剂30mg QW 30mg QW 44mg Q2W 44mg Q2W第24周第48周第24周第48周第24周第24周第48周第48周(n = 42)(n = 35)(n = 66)(n = 50)(n = 51)(n = 45)MRI-PDFF-6 %-11 %-56 %-60 %-47 % ALT 0%-11 %-42 %-42 %-32 %-35 % AST-2 %-4 %-39 %-39 %-34 %-36 % Pro-C3 + 6% + 2%-18 %-15 %-17 %-14 % FAST-3 %-1 %-56 %-59 %-57集;初步数据LS均值较基线变化,但MRI和VCTE均为中位数。第24周时VCTE n = 139;第48周时n = 121 MRI-PDFF在基线时肝脂肪> 10%的患者中(第24周时n = 108;第48周时n = 92)20

GLP1 Pegozafermin在MASH患者中提供了GLP-1治疗的附加益处至第48周关键结果背景• Enliven的37名患者在GLP-1治疗之上接受GLP-1治疗Pegozafermin显示在基线– 25接受pegozafermin,在第24周与GLP-1加安慰剂相比,有12名以下患者,并在第48周接受安慰剂:•使用GLP-1的患者服用稳定剂量,为期至少6个月•纤维化改善,大多数患者服用•肝脂肪减少的索马鲁肽或度拉鲁肽;这些患者中的大多数还服用了额外的糖尿病•改善了肝脏健康药物•可接受的耐受性概况•患者在各组之间以及相对于完整研究人群具有可比的基线特征21
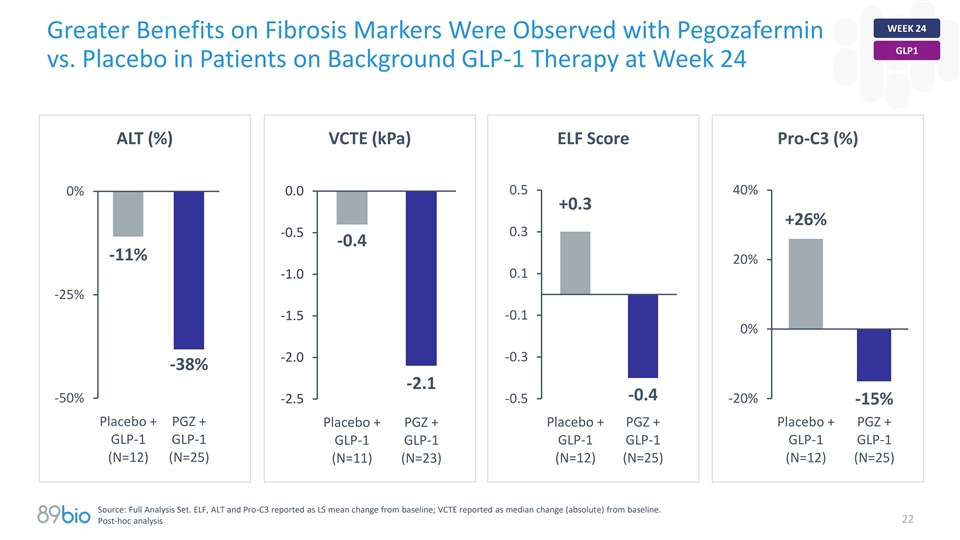
第24周ALT(%)VCTE(kPA)ELF评分pro-C3(%)0.540% 0% 0.0 + 0.3 + 26% 0.3-0.5-0.4-11 % 20%-1.0 0.1-25 %-1.5-0.1 0%-2.0-0.3-38 %-2.1-0.4-50 %-0.5-20 %-2.5-15 %安慰剂+ PGZ +安慰剂+ PGZ +安慰剂+ PGZ + GLP-1 GLP-1 GLP-1 GLP-1 GLP-1 GLP-1 GLP-1 GLP-1 GLP-1 GLP-1 GLP-1(N = 12ELF、ALT和Pro-C3报告为LS相对于基线的平均变化;VCTE报告为相对于基线的中位变化(绝对)。22事后分析

第24周接受背景GLP-1治疗的患者在第24周HBA1c甘油三酯(%)MRI-PDFF(%)脂联素(%)0% 00% 40% 0% 33%-0.1-20 %-10 % 30%-0.1-0.2-28 % 20%-40 %-20 %-0.3 10%-60 %-30 %-54 % 4%-0.4-29 %-0.4 0%-80 %-0.5-40 %安慰剂+ PGZ + PGZ +安慰剂+ PGZ +安慰剂+ PGZ + GLP-1 GLP-1 GLP-1 GLP-1 GLP-1脂联素报告为LS相对于基线的平均变化;HBA1c报告为相对于基线的中值变化(绝对);23 MRI-PDFF和TG报告为相对于基线的中值百分比变化。事后分析

F4 Pegozafermin在代偿性MASH肝硬化(F4)患者中提供了有希望的概况关键结果背景• ENLIVEN入组了14例MASH期F4患者,其中• 45%的Pegozafermin治疗患者发生了纤维化,其中12例患者*在改善≥ 1阶段没有MASH恶化的情况下进行了随访活检第24周•纤维化、肝损伤的NITs有所改善,并且•通过第48周观察到患者通常具有基线特征的肝脏脂肪,反映出良好代偿的肝硬化• F4中的安全性和耐受性特征与F2/F3人群相似*安慰剂N = 1,N = 11 PGZ(所有剂量)24
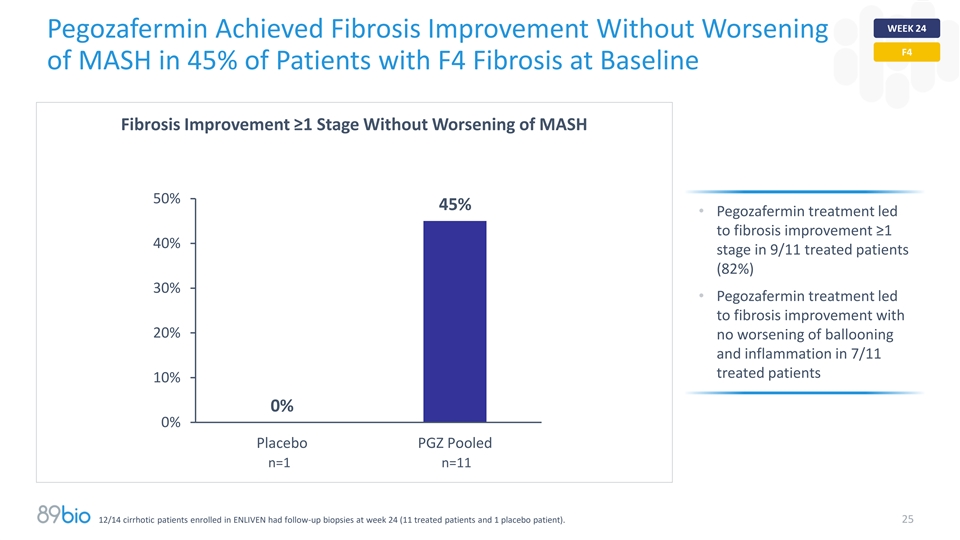
第24周Pegozafermin在基线纤维化改善≥ 1期且MASH没有恶化的情况下实现了MASH的F4的纤维化改善,占45%的F4患者50% 45% 45% • Pegozafermin治疗在9/11接受治疗的患者中导致纤维化改善≥ 140%阶段(82%)30% • Pegozafermin治疗在7/11接受治疗的患者中导致纤维化改善且20%没有球囊和炎症恶化10% 0% 0% 0%安慰剂PGZ汇集n = 1 n = 1112/14入组ENLIVEN的肝硬化患者在第24周进行了随访活检(11名接受治疗的患者和1名安慰剂患者)。25
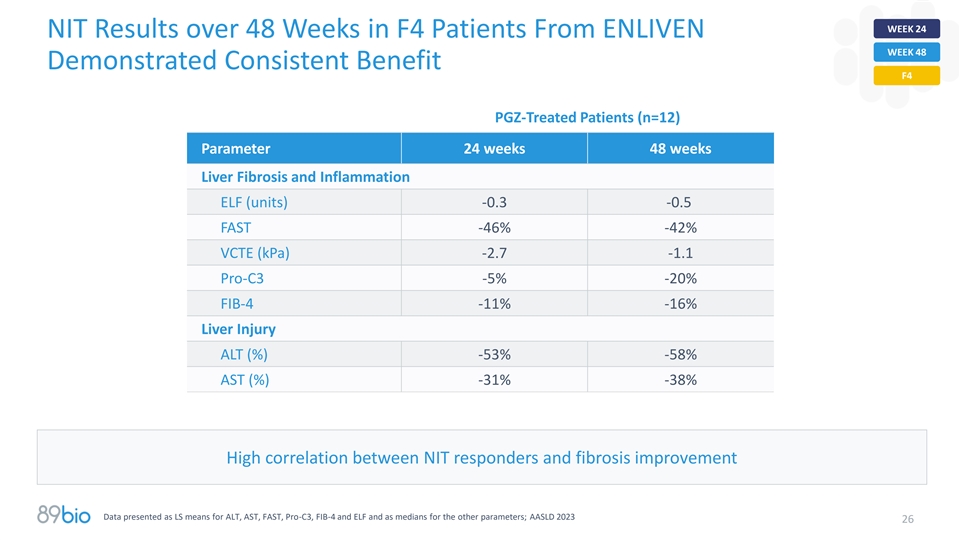
ELIVEN第48周起F4患者在48周内的第24周NIT结果显示,经PGZ治疗的患者(n = 12)参数24周48周肝纤维化和炎症ELF(单位)-0.3-0.5 FAST-46 %-42 % VCTE(kPA)-2.7-1.1 Pro-C3-5 %-20 % FIB-4-11 %-16 %肝损伤ALT(%)-53 %-58 % AST(%)-31 %-38 % NIT应答者与纤维化改善之间的高相关性数据以ALT、AST、FAST、Pro-C3、FIB-4和ELF的LS均值以及其他参数的中位数表示;AASLD
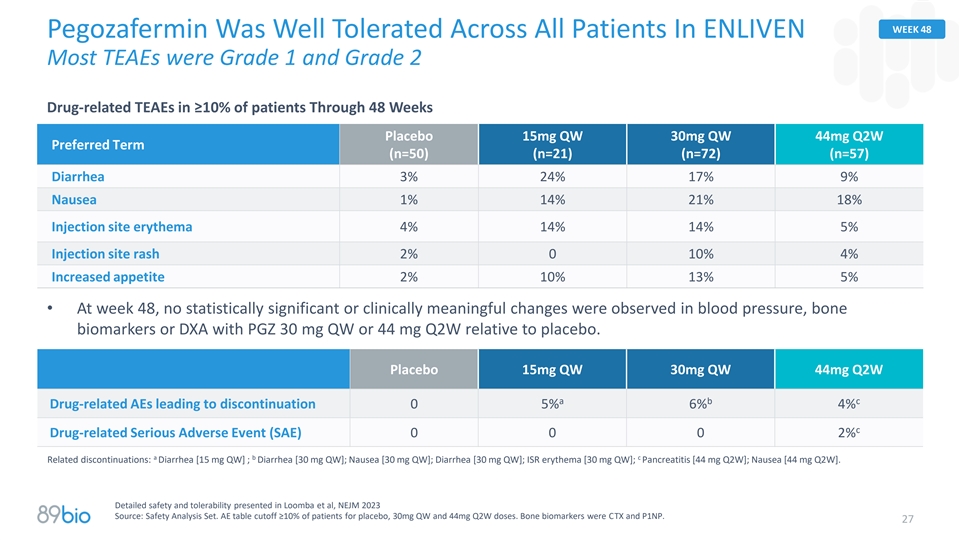
第48周Pegozafermin在Enliven的所有患者中均具有良好的耐受性大多数TEAEs在48周内≥ 10%的患者中为1级和2级药物相关TEAEs安慰剂15mg QW 30mg QW 44mg Q2W优选期限(n = 50)(n = 21)(n = 72)(n = 57)腹泻3% 24% 17% 9%恶心1% 14% 21% 18%注射部位红斑4% 14% 14% 5%注射部位皮疹2% 010% 4%食欲增加2% 10% 13% 5% •第48周,未观察到血压有统计学意义或临床意义的变化,骨生物标志物或DXA与PGZ 30mg QW或44mg Q2W相对于安慰剂。安慰剂15mg QW 30mg QW 44mg Q2W a b c药物相关AEs导致停药05% 6% 4% c药物相关严重不良事件(SAE)0002% a b c相关停药:腹泻[ 15mg QW ];腹泻[ 30mg QW ];恶心[ 30mg QW ];腹泻[ 30mg QW ];ISR红斑[ 30mg QW ];胰腺炎[ 44mg Q2W ];恶心[ 44mg Q2W ]。详细的安全性和耐受性介绍于Loomba等人,NEJM2023来源:安全分析集。AE-table截止≥ 10%的患者采用安慰剂,30mgQW和44mgQ2W剂量。骨生物标志物为CTX和P1NP。27

截至目前,基于骨生物标志物、骨矿物质密度和骨折风险的Pegozafermin计划中没有临床意义的骨效应1 •在2b期ENLIVEN试验中,通过30mg QW或44mg Q2W剂量治疗48周,与安慰剂相比,没有临床意义或统计学意义的骨生物标志物或DXA变化•在整个pegozafermin临床计划中,0.7%的pegozafermin治疗患者(N = 556)报告了骨折AEs,而2%的安慰剂患者(N = 101)–未报告脆性骨折2 • FRAX分析显示,10年的骨折风险明显低于3.0%的治疗阈值– pegozafermin为0.3%-0.7 %,而安慰剂为0.3% •对晚期纤维化和肝硬化患者有利的益处-风险1。骨生物标志物包括P1NP、CTX、Ostoecalcin 2。基于股骨颈BMD均值变化和平均ENLIVEN患者特征,使用FRAX工具计算得出。https://frax.shef.ac.uk/frax/28
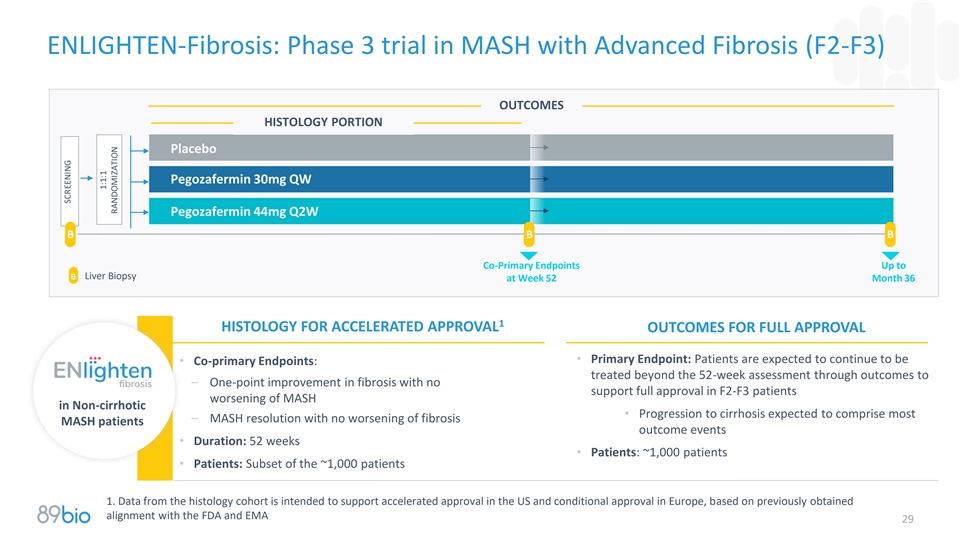
ENLIGHTEN-Fibrosis:MASH伴晚期纤维化(F2-F3)的3期试验结果显示组织学部分安慰剂Pegozafermin 30mg QW Pegozafermin 44mg Q2W B B共同主要终点至第52周的B肝活检361加速批准结果获得完全批准的组织学•主要终点:预计患者将继续•共同主要终点:在52周评估后通过结果治疗–在F2-F3患者中无支持完全批准的纤维化改善非肝硬化中的MASH恶化•进展为肝硬化预计会导致患者结局事件•持续时间:52周•患者:~1,000名患者•患者:~1,000名患者的子集1。组织学队列的数据旨在支持美国的加速批准和欧洲的有条件批准,这是基于先前获得的与FDA和EMA29的一致性筛选1:1:1随机分配

ENLIGHTEN-Fibrosis:F2/F3 MASH组织学结果在组织学和临床结果方面都有成功的潜力• FGF21类似物已证明稳健•在第24周和更长时间范围内从ENLIVEN证明的数据上建立在强大的纤维化回归和NIT纤维化回归基础上• Intercept的REGENERATE 3期试验的临床结果数据令人鼓舞• Pegozafermin在第24周显示纤维化改善并维持——尽管纤维化增量不大,约为10%,第48周Ocaliva的NIT数量®有向临床的趋势(p = 0.04)*结果获益– 3期试验中第12个月的活检可能显示出更强大的效果•第24周PGZ出现~20%的纤维化delta,这是一个好兆头,特别是考虑到有可能•稳健的统计设计,以确定更长的治疗改善的反应具有临床意义的delta • 3期对结果有很好的影响;REGENERATE验证进展为肝硬化是主要的结果事件*这些数据来源于不同时间点的不同临床试验,在试验设计和患者群体方面存在差异。因此,基于与不同试验的比较,无法确保我们正在进行的试验的通读。30
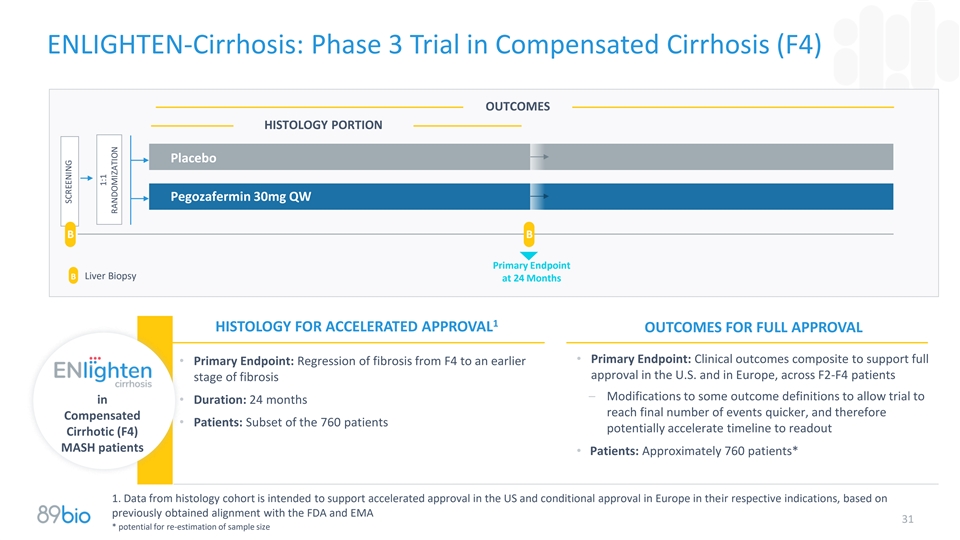
恩莱特-肝硬化:代偿性肝硬化(F4)的3期试验结果为24个月时的组织学部分安慰剂Pegozafermin 30mg QW B B主要终点B肝活检1组织学加速批准结果为完全批准•主要终点:临床结果综合以支持完全•主要终点:纤维化从F4回归到美国和欧洲更早的批准,跨越F2-F4患者的纤维化阶段–修改一些结果定义以允许试验进入•持续时间:24个月更快达到最终事件数,并因此获得补偿•患者:760名患者中的子集可能会加速读出肝硬化(F4)MASH患者的时间线•患者:约760名患者*1.基于先前获得的与FDA和EMA31的一致性,来自组织学队列的数据旨在支持在美国加速批准和在欧洲有条件批准各自的适应症*重新估计样本量的潜力筛选1:1随机分布
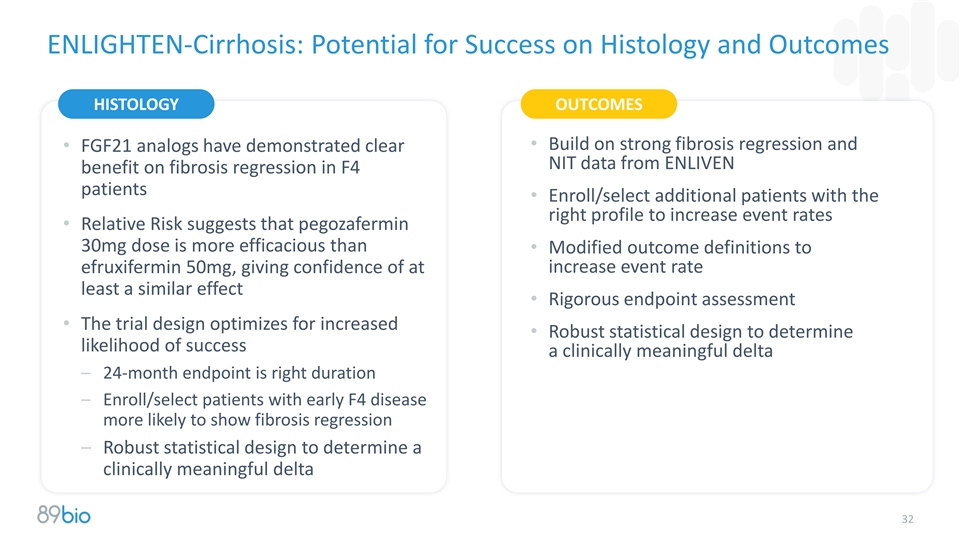
ENLIGHTEN-肝硬化:组织学上的成功潜力和结果组织学结果•建立在强大的纤维化消退和• FGF21类似物已证明来自ENLIVEN获益对F4患者纤维化消退的明确NIT数据•招募/选择更多具有正确特征的患者以增加事发率•相对风险表明,pegozafermin 30mg剂量比•修改结果定义为efruxifermin 50mg更有效,给予at increase事件发生率至少相似效果的信心•严格的终点评估•试验设计针对增加的情况进行优化•稳健的统计设计,以确定成功的可能性具有临床意义的delta – 24个月的终点是正确的持续时间–招募/选择更有可能表现出纤维化消退的早期F4疾病患者–稳健的统计设计,以确定具有临床意义的delta 32

解决晚期纤维化和肝硬化MASH实质性需求的潜力具有重大健康风险的庞大患者群体•预计到2035年,美国将有~1500万患者出现MASH(F2-F4);欧盟1 – F2-F3和F4流行率中的类似人数可能分别达到~10.7m和~3.6m,扣除基于GLP-1疗法的影响——尽管基于GLP-1疗法的广泛采用可能会降低MASH流行率,由于新的MASH特异性疗法(F2-3的CAGR为12%,F4的CAGR为14%),符合条件的确诊患者群体将会增加pegozafermin • Pegozafermin具有重要的市场机会,其独特的定位是满足晚期纤维化和代偿性肝硬化的需求——与代谢疗法相比,pegozafermin等有效的抗纤维化药物有望成为治疗晚期MASH的首选随着时间的推移,它可以减少脂肪并间接改善肝脏健康—— FGF21类在F4患者中显示出最有希望的数据,并可能主导这一市场—— Pegozafermin临床数据显示基于GLP-1的疗法的附加益处支持联合使用——耐受性/安全性和给药便利性预计将成为PGZ在商业市场上的关键差异化因素•大市场可能支持具有不同作用机制(MOA)的疗法和特定机制内的多种疗法(类似于T2DM或LDL治疗领域)——目前没有MOA可以“治愈”MASH1。来源:估算和预测来自Estes,et al. Hepatology 2018.并根据公司分析和市场研究从潜在GLP-1影响调整。33
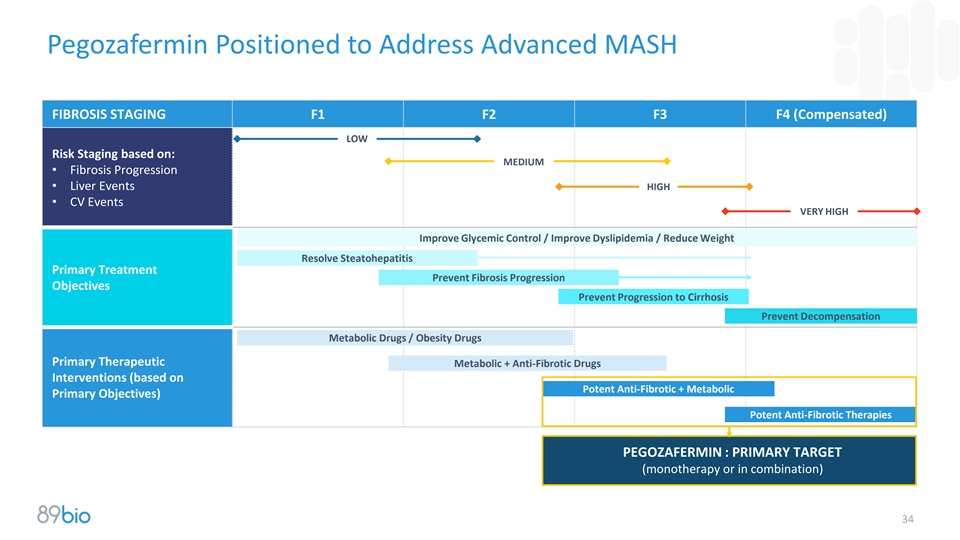
Pegozafermin定位于解决晚期MASH纤维化分期F1 F2 F3 F4(补偿)低风险分期基于:中•纤维化进展•肝事件高• CV事件非常高改善血糖控制/改善血脂异常/减轻体重解决脂肪性肝炎初级治疗预防纤维化进展目标预防进展为肝硬化预防失代偿代谢药物/肥胖药物初级治疗性代谢+抗纤维化药物干预(基于有效的抗纤维化+代谢的主要目标)有效的抗纤维化疗法Pegozafermin:首要目标(单一疗法或联合疗法)
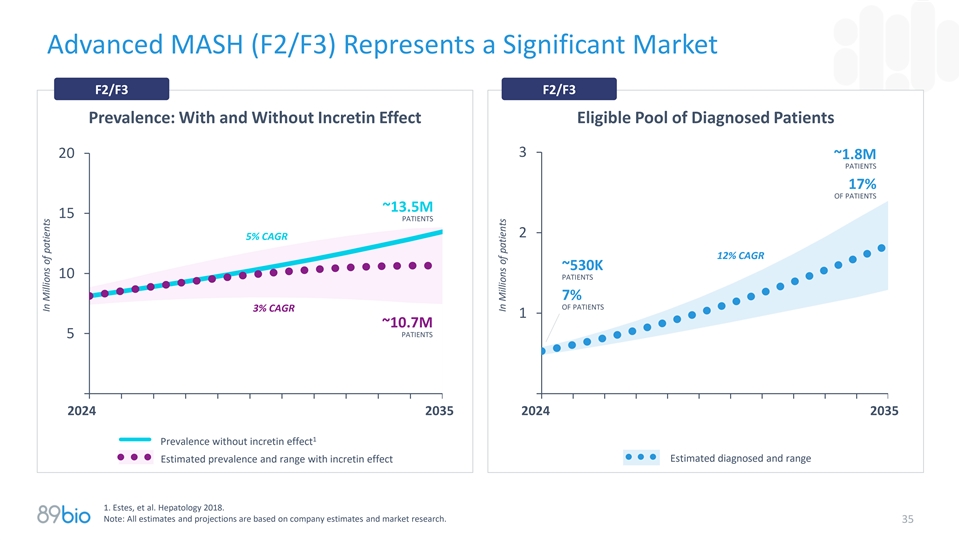
晚期MASH(F2/F3)代表了一个显着的市场F2/F3 F2/F3流行率:有和没有incretin效应的合格诊断患者池3 20~1.8m患者17%的患者~13.5m 15患者25% CAGR12 % CAGR12~530k 10患者7%的患者3% CAGR1~10.7m患者520242035202420351无促胰岛素作用的流行率估计诊断和范围估计有促胰岛素作用的患病率和范围1。Estes,et al. Hepatology 2018。注:所有估计和预测均基于公司估计和市场研究。百万患者中的35人百万患者中的35人
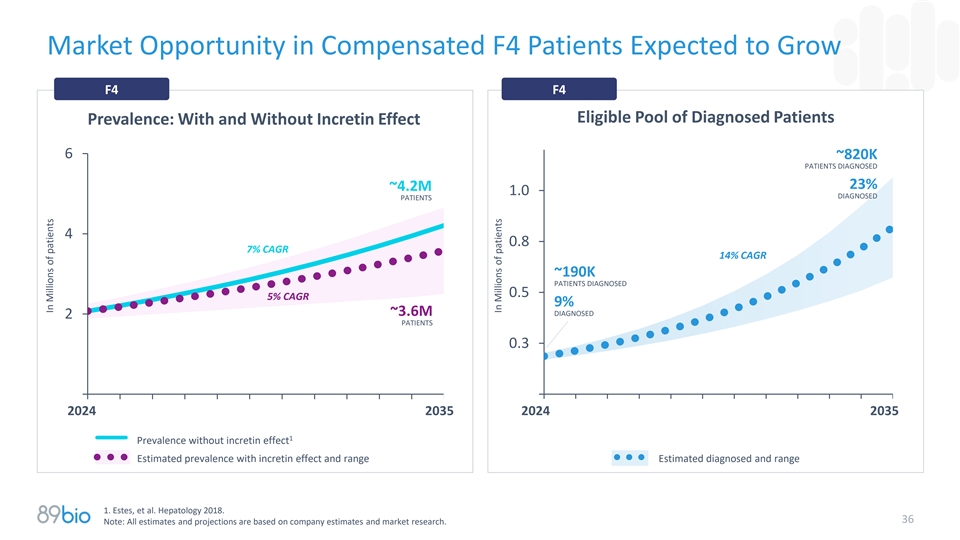
补偿后的预计生长F4患者中的市场机会F4符合条件的确诊患者池患病率:有或没有胰岛素效应6~820K患者诊断23%~4.2m 1.0诊断患者40.87% CAGR14 % CAGR14~190K患者诊断0.55% CAGR9 %~3.6m诊断2患者0.320242035202420351无胰岛素效应的患病率估计有胰岛素效应的患病率和范围估计诊断和范围1。Estes,et al. Hepatology 2018。36注:所有估计和预测均基于公司估计和市场研究。在百万患者中在百万患者中
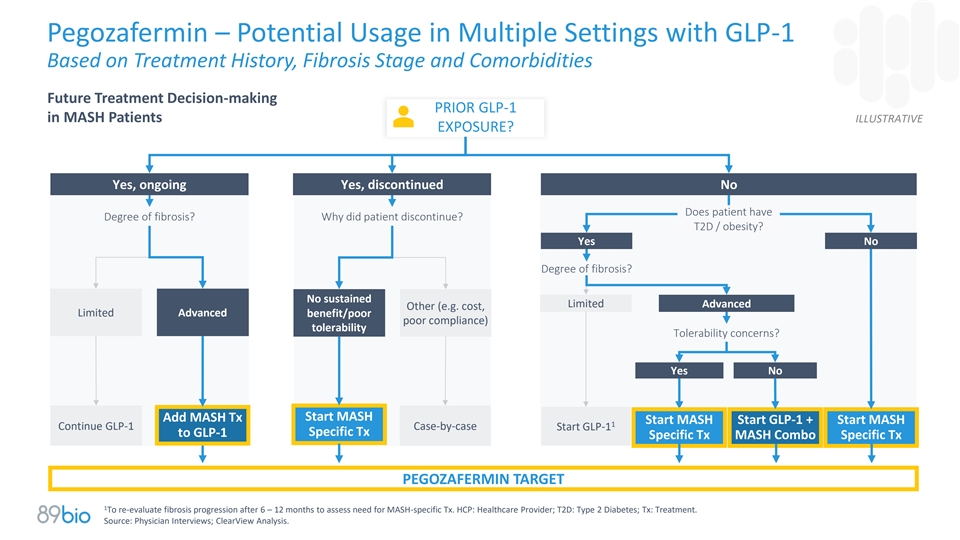
Pegozafermin –基于治疗史、纤维化阶段和合并症的GLP-1在多种环境中的潜在用途未来治疗决策之前GLP-1在MASH患者中的说明性暴露?是的,正在进行的是,停用的否患者是否有纤维化程度?患者为何停药?T2D/肥胖?有没有纤维化程度?没有持续的有限高级其他(例如成本、有限的高级效益/较差的依从性)耐受性耐受性问题?是否添加MASH TX开始MASH开始MASH开始GLP-1 +开始MASH 1继续GLP-1个案启动GLP-1特定TX至GLP-1特定TX MASH组合特定TX PEGOZAFERMIN目标1重新评估6 – 12个月后的纤维化进展,以评估对MASH特异性TX的需求。HCP:医疗保健提供者;T2D:2型糖尿病;TX:治疗。来源:医师访谈;ClearView分析。
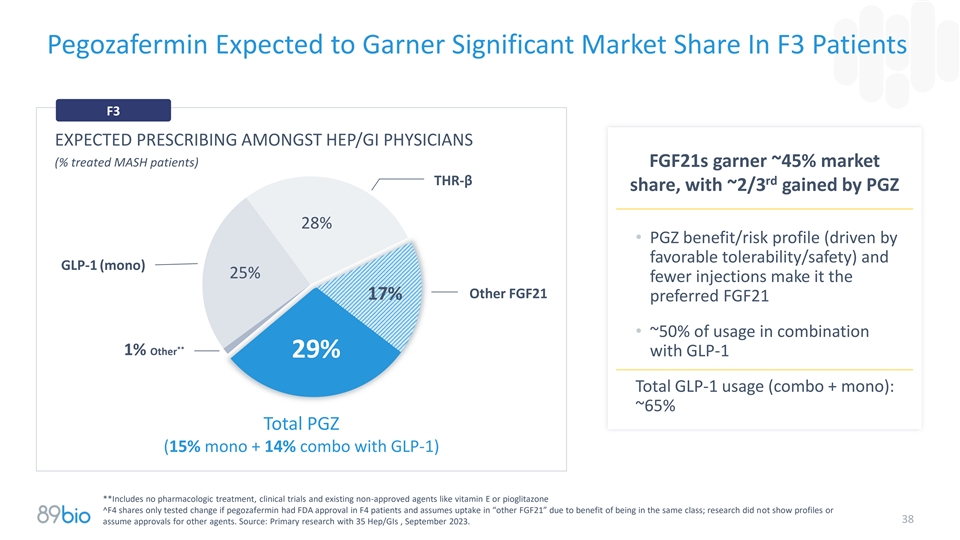
Pegozafermin预计将在F3患者中获得显着市场份额F3预计在HEP/GI医生中开处方(%治疗的MASH患者)FGF21s获得约45%的市场THR-β rd份额,PGZ获得约2/3的份额28% • PGZ益处/风险概况(由良好的耐受性/安全性驱动)和GLP-1(mono)注射减少25%使其成为其他FGF21 17%首选FGF21 •联合使用的约50%**1%其他与GLP-1 29% GLP-1总使用量(combo + mono):~65%总PGZ(15% mono + 14% combo与GLP-1)**不包括药物治疗,临床试验和现有的非批准药物如维生素E或吡格列酮^ F4股价仅在pegozafermin在F4患者中获得FDA批准并因同属一类获益而在“其他FGF21”中承担摄取的情况下测试变化;研究没有显示概况或38假设其他药物获得批准。资料来源:35Hep/GIS的初级研究,2023年9月。

Pegozafermin有望在已补偿的F4患者中获得显着市场份额^已补偿的F4预计在HEP/GI医生(%接受过MASH治疗的患者)中开处方的FGF21s获得~60%的市场THR-β份额,其中~60%通过PGZ GLP-1(mono)获得10% • PGZ益处/风险概况(由16%的良好耐受性/安全性驱动)和其他FGF21减少26%的注射使其成为**12%首选FGF21其他•与GLP-1联合使用的1/3 36% GLP-1总使用量(combo + mono):~45%总PGZ(24% mono + 12% combo with GLP-1)**不包括药物治疗,临床试验和现有的非批准药物如维生素E或吡格列酮^ F4仅在pegozafermin在F4患者中获得FDA批准并且由于同属一类获益而在“其他FGF21”中承担摄取的情况下测试变化;研究没有显示概况或39假设其他药物获得批准。资料来源:35Hep/GIS的初步研究,2023年9月。

耐受性/安全性和给药便利性预计将成为Pegozafermin在商业市场上的关键差异化因素•患者依从性和持久性的关键驱动因素包括药物耐受性/安全性和便利性,尤其是在无症状疾病适应症中1 – GI不良事件是基于促胰岛素类疗法依从性差的关键原因之一2 •医生在确定药物偏好时非常重视有利的耐受性/安全性特征– Pegozafermin在FGF21类中的市场份额翻了一番,从相似的耐受性/安全性特征到更好的耐受性/安全性特征与依氟西弗明–医生认为Pegozafermin在FGF21类中具有最有利的耐受性/安全性特征•已确认有超过150名MASH处方者的定量研究假设疗效相似,更好的耐受性/安全性导致Pegozafermin在F2-F4患者中的市场份额增加3 •给药便利性为患者和医生带来了有意义的益处—— > 60%的患者更喜欢每两周给药一次而不是每周给药——医生喜欢根据患者背景和偏好选择不同的给药方案(QW和Q2W)来优化治疗1。Gleason PP,et al. J Manag Care Spec Pharm。2024年8月;30(8):860 – 7. doi:10.18553/jmcp.2024.23332;Sikirica MV,et al. Diabetes Metab Syndr Obes。2017;10:403 – 12. doi:10.2147/DMSO.S141235;Zimner Rapuch S,et al. Diabetes Ther。2021年5月;12(5):1553 – 67. DOI:10.1007/s13300-021-01055-5。2.使用GI/Heps(2023)进行89bio市场研究;基于竞争对手Phase 2b数据出版物3数据的比较。Clearview和Trinity Research 404。对150名2型糖尿病患者的一级市场研究,2019年。
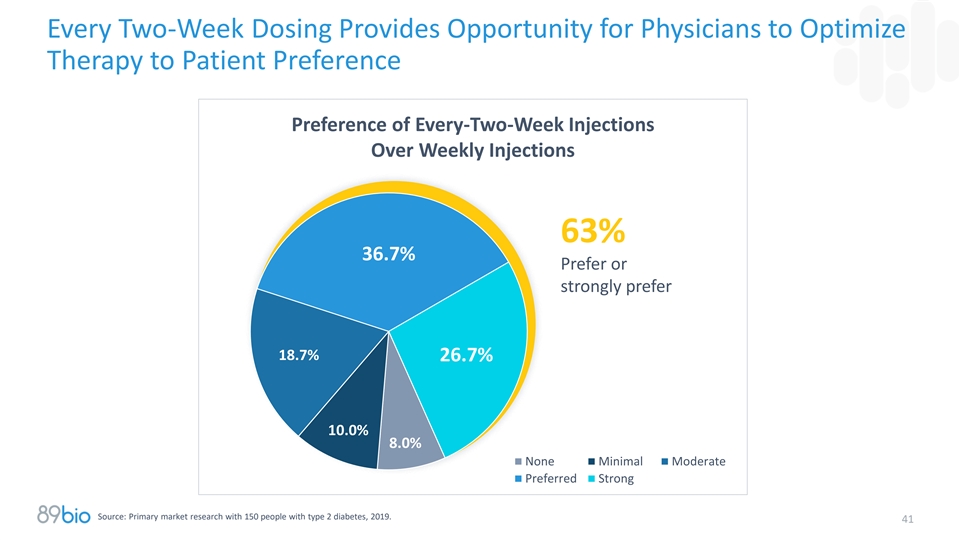
每两周给药为医生提供机会优化治疗患者偏好偏好每两周注射优于每周注射63% 36.7%偏好或强烈偏好18.7% 26.7% 10.0% 8.0%无最小中度首选强来源:对150名2型糖尿病患者的一级市场研究,2019年。41

重症高甘油三酯血症(SHTG)的机会

Pegozafermin可能为SHTG顶线结果提供一个重要的新治疗选择,预计2026年第一季度会有大量不断增长的患者群体,存在显着的健康风险;与MASH患者群体重叠• TG水平升高会增加急性胰腺炎的风险,心血管疾病和全因死亡率•有心血管风险因素的患者的心血管(CV)益处与TG降低相关的新证据具有广泛代谢益处的药物的重大市场机会• Pegozafermin具有独特的销售主张这对开药者很有意义–更有效地减少甘油三酯并改善肝脏脂肪和其他新陈代谢指标•分析师一致预期的峰值年销售额估计约为10亿美元(仅美国SHTG)临床项目大幅降低风险• 3期ENTRUST试验完成入组,共369名患者;预计2026年第一季度的顶线数据•将在第52周的研究揭盲后分析第26周空腹TG与安慰剂相比基线百分比变化的主要终点• 2期ENTRIGUE试验显示空腹TG SHTG项目与基线百分比变化的积极数据与MASH项目协同•开发:利用两个项目的安全数据库,以最大限度地减少整个项目的支出•商业:利用销售力量和基础设施成本43
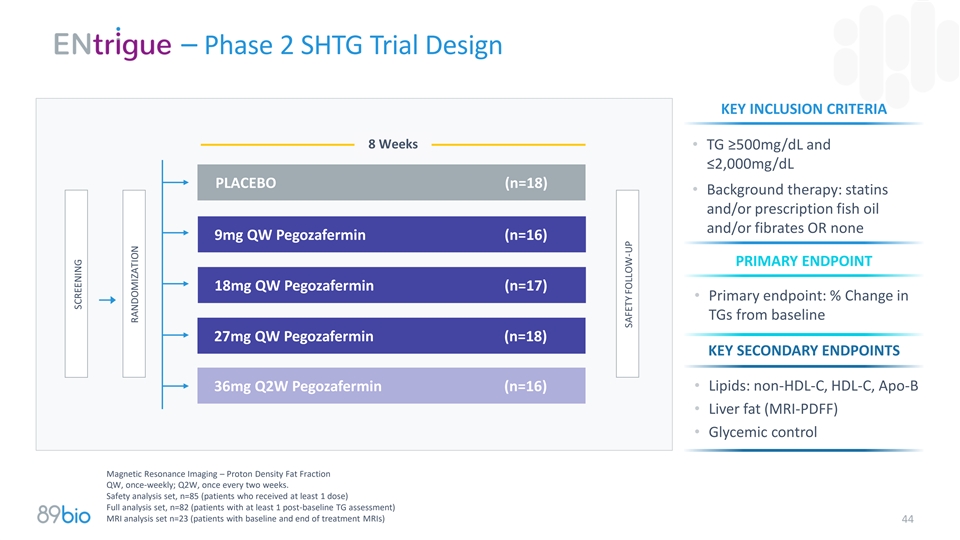
– 2期SHTG试验设计关键纳入标准8周• TG ≥ 500mg/dL且≤ 2,000mg/dL placebo(n = 18)•背景治疗:他汀类药物和/或处方鱼油和/或贝特类药物或无9mg QW Pegozafermin(n = 16)主要终点18mg QW Pegozafermin(n = 17)•主要终点:TGs较基线27mg QW Pegozafermin(n = 18)的变化百分比关键次要终点•脂质:非HDL-C、HDL-C、Apo-B 36mg Q2W Pegozafermin(n = 16)•肝脂肪(MRI-PDFF)•安全性分析集,n = 85(至少接受1剂的患者)全分析集,n = 82(至少有1次基线后TG评估的患者)MRI分析集n = 23(有基线和治疗结束MRI的患者)44筛查随机安全跟进
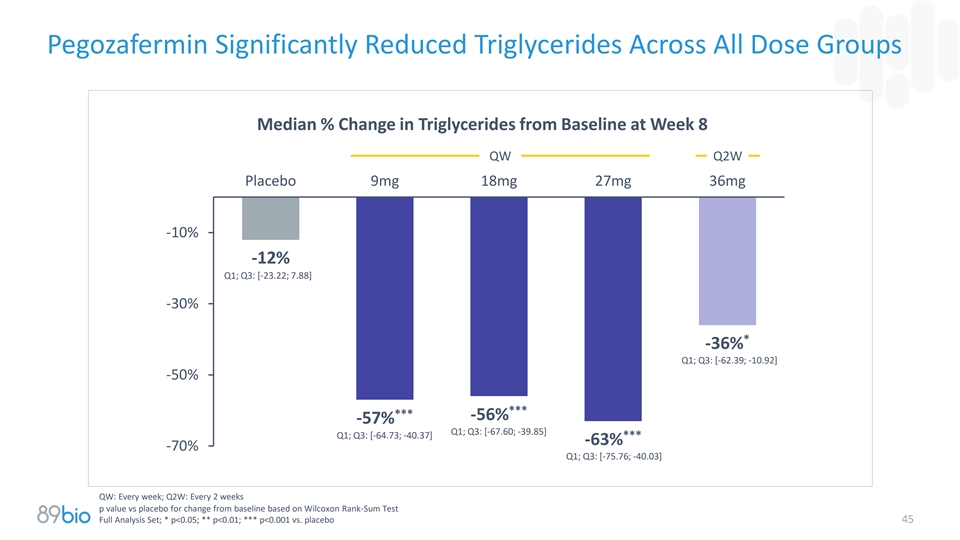
Pegozafermin显着降低所有剂量组的甘油三酯第8周QW Q2W安慰剂9mg18mg27mg36mg-10 %-12 % Q1甘油三酯较基线的中位%变化;Q3:[-23.22;7.88 ]-30 %*-36 % Q1;Q3:[-62.39;-10.92 ]-50 %******-56 %-57 % Q1;Q3:[-67.60;-39.85 ] Q1;Q3:[-64.73;-40.37 ]***-63 %-70 % Q1;Q3:[-75.76;-40.03 ] QW:每周;Q2W:每2周p值vs安慰剂基于Wilcoxon Rank-Sum测试全分析集的基线变化;*p < 0.05;**p < 0.01;***p < 0.001对比安慰剂45
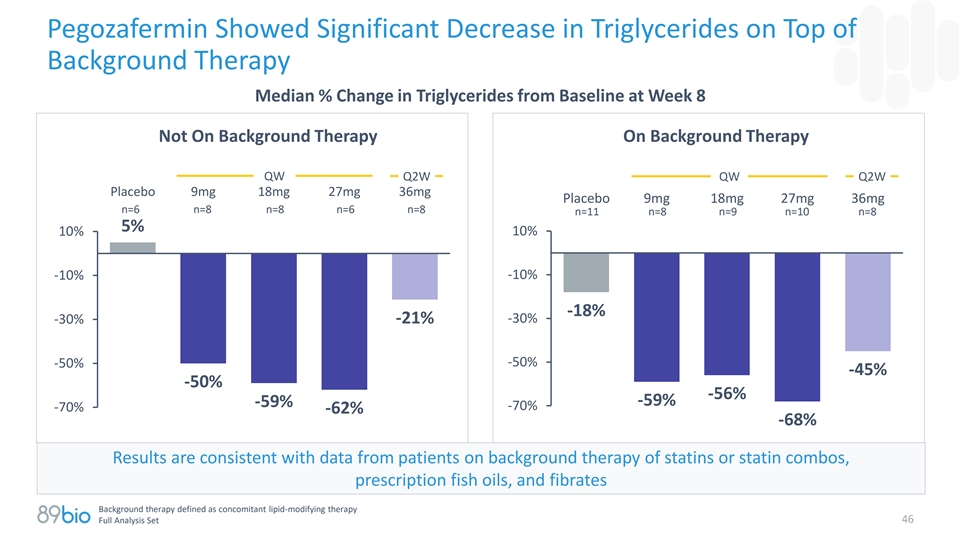
Pegozafermin在背景疗法之上显示甘油三酯显着下降第8周时甘油三酯与基线的中位%变化不在背景疗法上QW Q2W QW Q2W安慰剂9mg 18mg 27mg 36mg安慰剂9mg 18mg 27mg 36mg n = 6 n = 8 n = 8 n = 6 n = 8 n = 8 n = 11 n = 8 n = 9 n = 10 n = 85 10% 10%-10 %-10 %-18 %-30 %-21 %-50 %-50 %-45 %-50 %-56 %-59 %-59 %-70 %-70 %-62 %-68 %结果与他汀类药物或他汀类药物组合、处方鱼油背景疗法患者的数据一致,和贝特类背景疗法定义为伴随脂质修饰疗法46全分析集
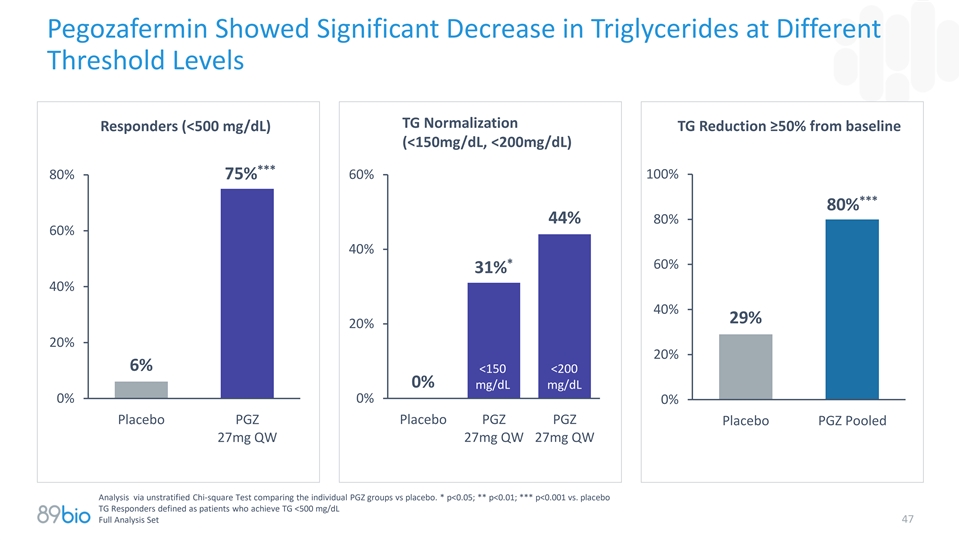
Pegozafermin显示在不同阈值水平下甘油三酯显著降低TG正常化TG较基线应答者降低≥ 50%(< 500mg/dL)(< 150mg/dL,< 200mg/dL)***60% 100% 80% 75%***80% 44% 80% 60% 40%*60% 31% 40% 40% 29% 20% 20% 20% 6% < 150 < 2000% mg/dL mg/dL 0% 0% 0%安慰剂PGZ安慰剂PGZ安慰剂PGZ通过未分层卡方试验比较个别PGZ组与安慰剂,汇集了27mg QW 27mg QW 27mg QW分析。*p < 0.05;**p < 0.01;***p < 0.001 vs.安慰剂TG应答者定义为达到TG < 500mg/dL的患者全分析集47
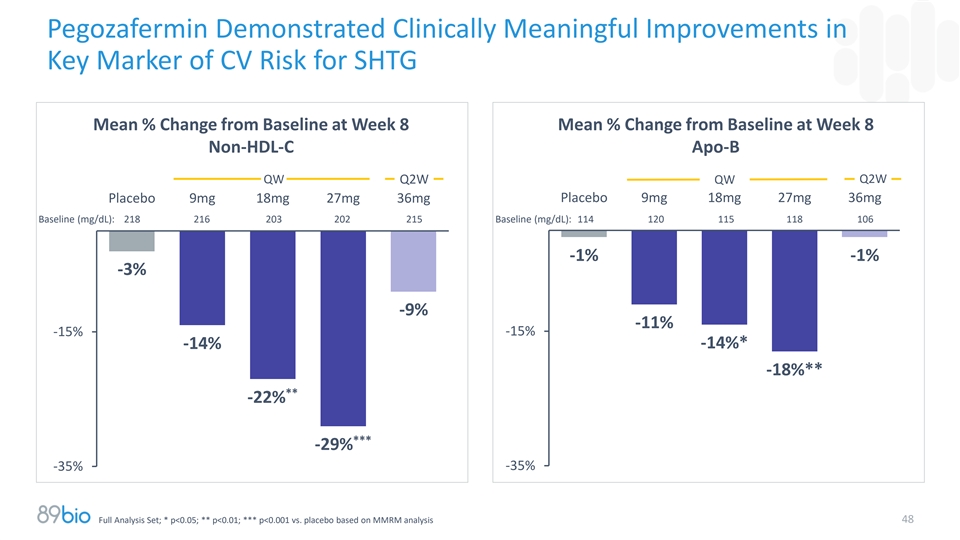
Pegozafermin在SHTG的CV风险关键标志物上显示出具有临床意义的改善第8周时较基线的平均百分比变化第8周时较基线的平均百分比变化非HDL-C Apo-B Q2W QW Q2W QW安慰剂9mg 18mg 27mg 36mg安慰剂9mg 18mg 27mg 36mg基线(mg/dL):218216203202215基线(mg/dL):114120115118106-1 %-1 %-3 %-9 %-11 %-15 %-15 %-14 %*-14% -18%****-22%***-29 %-35 %-35 %全分析集;*p < 0.05;**p < 0.01;***p < 0.001对比基于MMRM分析的安慰剂48
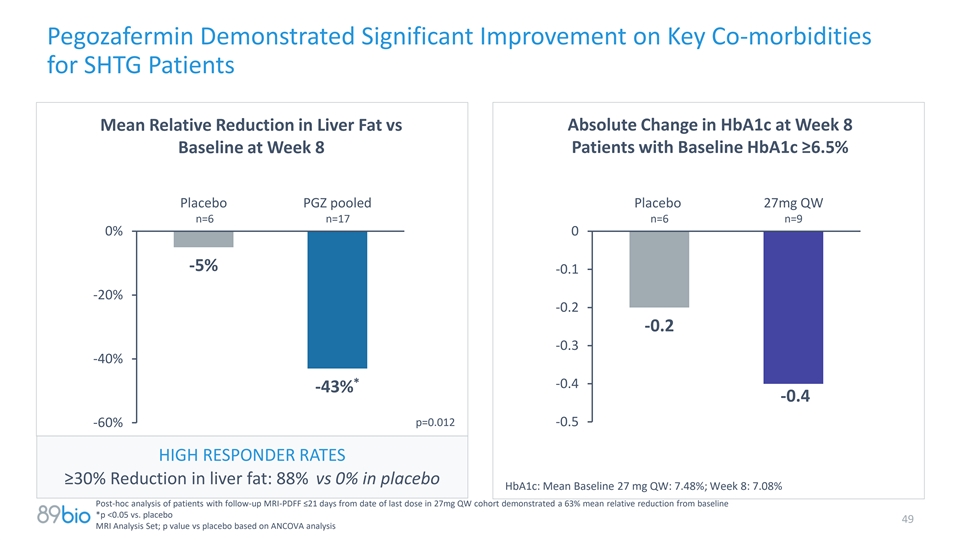
Pegozafermin在关键合并症方面表现出显着改善SHTG患者平均肝脂肪相对减少vs第8周基线HBA1c绝对变化第8周基线HBA1c ≥ 6.5%安慰剂PGZ合并安慰剂27mg QW n = 6 n = 17 n = 6 n = 90% 0-5 %-0.1-20 %-0.2-0.2-0.3-40 %*-0.4-43 %-0.4-60 % p = 0.012-0.5高反应率≥ 30%肝脏脂肪减少:88% vs安慰剂HBA1c:平均基线27 mg QW:7.48%;第8周:7.08%对27mg QW队列中随访MRI-PDFF ≤自最后一次给药之日起21天的患者的事后分析表明,平均相对减少从63%基线*p < 0.05 vs.安慰剂49 MRI分析集;基于ANCOVA分析的p值vs安慰剂

Pegozafermin在2期试验中表现出良好的安全性/耐受性•在≥ 7.5%的患者中观察到的与pegozafermin治疗相关的不良事件(AEs)的合并:–恶心(10%)、腹泻(9%)和注射部位反应(9%)与安慰剂(0%)–所有胃肠道(GI)AEs均为1级或2级•无3级或更高级别AEs •无治疗相关SAE;2次治疗相关的停药,剂量为27mg QW(均为2级)•无震颤或超敏AEs报告•无对血压或心率的不良影响50
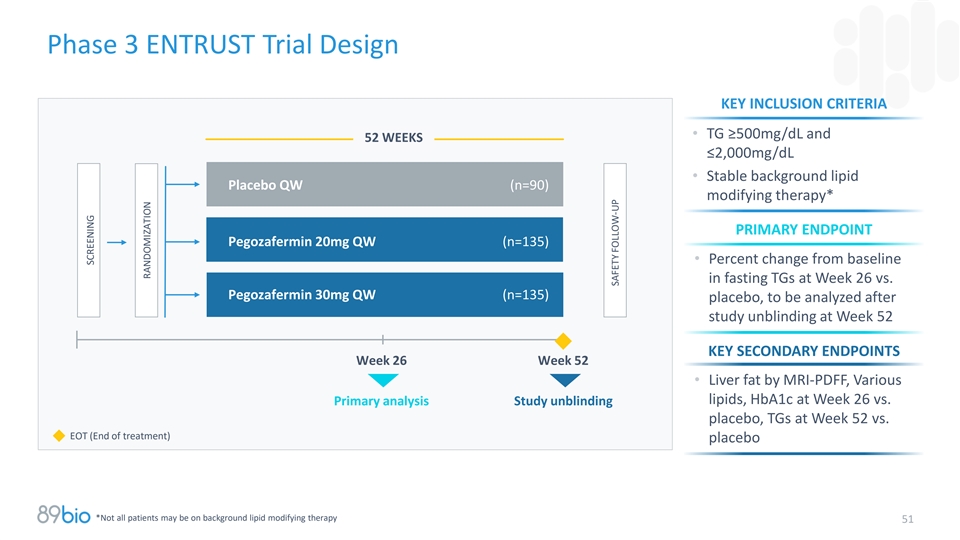
3期Entrust试验设计关键纳入标准• TG ≥ 500mg/dL且52周≤ 2,000mg/dL •稳定背景脂质安慰剂QW(n = 90)修饰疗法*主要终点Pegozafermin 20mg QW(n = 135)•第26周空腹TGs相对于基线的百分比变化与Pegozafermin 30mg QW(n = 135)安慰剂,将在第52周的研究揭盲后进行分析关键的次要终点第26周第52周•通过MRI-PDFF、各种脂质、第26周的HBA1c与主要分析研究揭盲安慰剂,第52周TGs对比EOT(治疗结束)安慰剂*并非所有患者都可能在接受背景脂质修饰疗法51筛查随机安全跟进
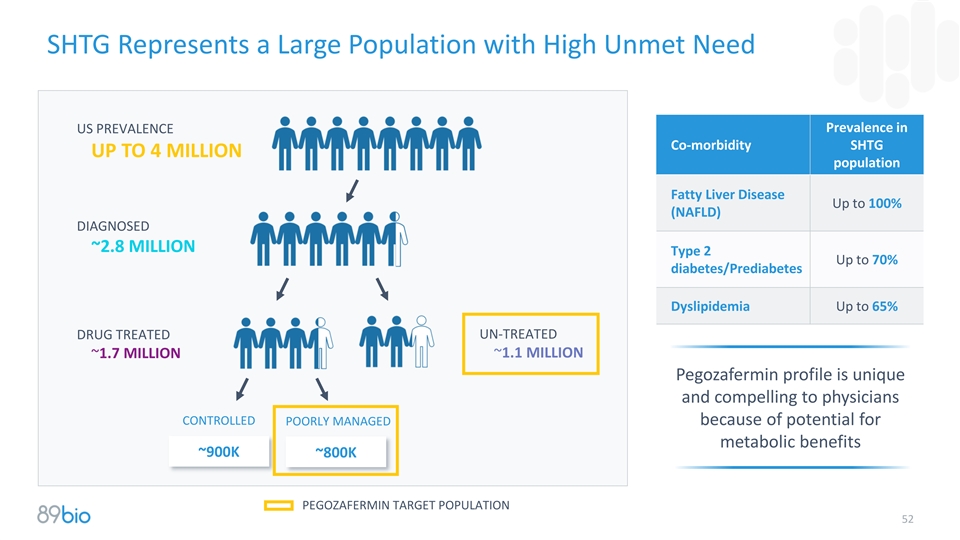
SHTG代表了美国未满足需求流行率高的大量人群合并症SHTG高达400万人群脂肪性肝病高达100%(NAFLD)诊断~280万2型高达70%糖尿病/前糖尿病血脂异常高达65%未治疗药物治疗~110万~170万Pegozafermin谱是独特的,对控制不当的医生来说很有吸引力,因为潜在的代谢益处~900k~800k PegoZafermin目标人群52
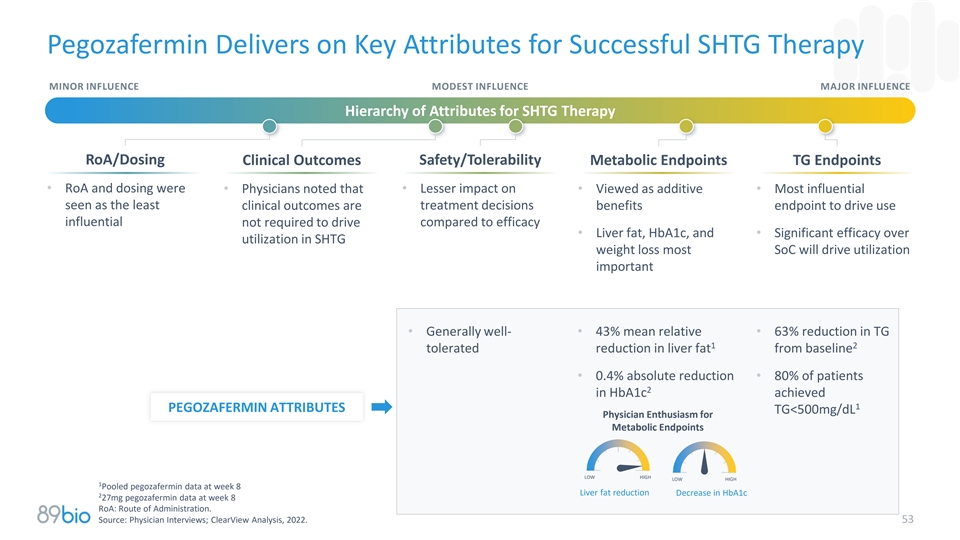
Pegozafermin提供成功SHTG治疗的关键属性轻微影响中等影响主要影响SHTG治疗ROA/给药临床结果安全性/耐受性代谢终点TG终点• ROA和给药•医生指出•对•被视为添加剂的影响较小•最有影响力的被视为最小的治疗决策临床结果是与疗效相比无需驱动的使用影响的益处终点•肝脂肪、HBA1c,和•在SHTG减肥中明显优于利用大多数SoC将推动利用重要•总体良好-• 43%的平均相对值• TG12耐受肝脏脂肪比基线减少63% •绝对减少0.4% • 80%的HBA1c患者2在第8周达到1 PEGOZAFERMIN ATTRIBUTES TG < 500mg/dL医生对代谢终点的热情低、高、低、高、1在第8周汇总的pegozafermin数据肝脂减少第8周HBA1c 2 27mg pegozafermin数据减少:给药途径。来源:医师访谈;ClearView分析,2022。53
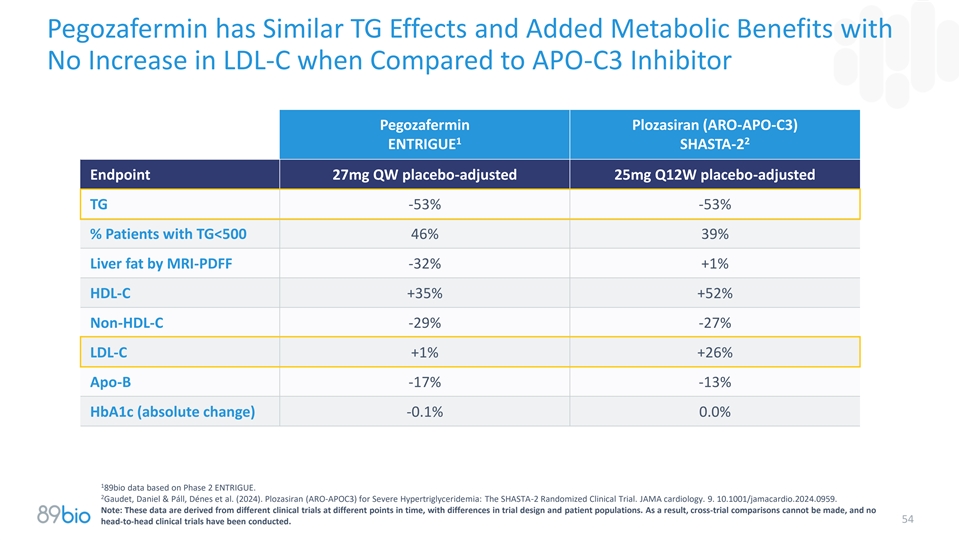
Pegozafermin与APO-C3抑制剂Pegozafermin Plozasiran(ARO-APO-C3)相比具有相似的TG效应,并增加了不增加LDL-C的代谢益处12输入SHASTA-2终点27mgQW安慰剂调整25mgQ12W安慰剂调整TG-53 %-53 %% TG < 50046% 39%肝脂肪MRI-PDFF-32 % + 1% HDL-C + 35% + 52%非HDL-C-29 %-27 % LDL-C + 1% + 26% APo-B-17 %-13 % HBA1c(绝对变化)-0.1 % 0.0% 1基于2期ENTRIGUG的89bio数据2 Gaudet,Daniel & P á ll,D é nes et al.(2024)。Plozasiran(ARO-APOC3)治疗严重高甘油三酯血症:SHASTA-2随机临床试验。JAMA心脏病学。9.10.1001/jamacardio.2024.0959。注:这些数据来源于不同时点的不同临床试验,在试验设计和患者人群方面存在差异。因此,无法进行跨试验比较,没有进行54项头对头临床试验。
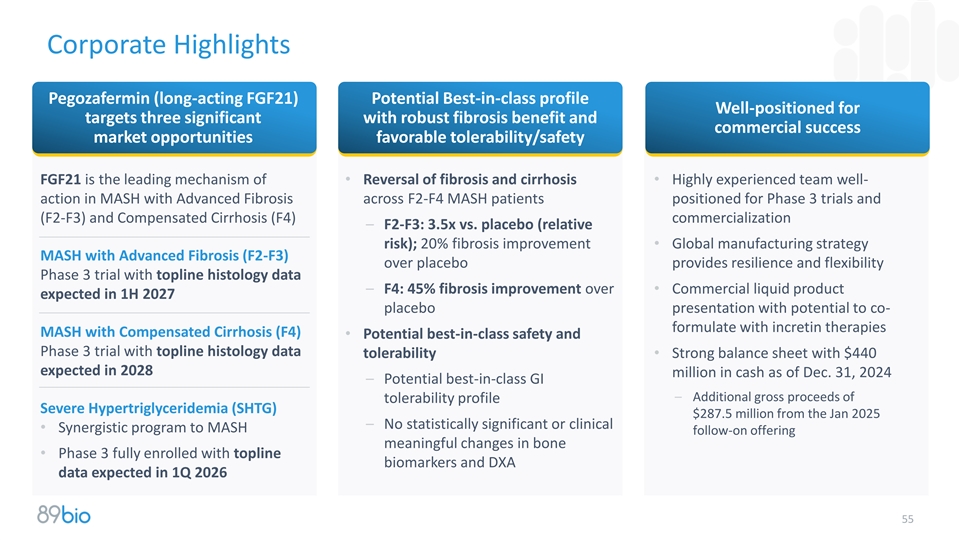
公司亮点Pegozafermin(长效FGF21)潜在的同类最佳概况为具有强大纤维化益处和商业成功市场机会的目标三做好准备有利的耐受性/安全性FGF21是•纤维化和肝硬化逆转的主要机制•在F2-F4 MASH患者的MASH中具有高度经验的团队良好行动,定位于3期试验和(F2-F3)和代偿性肝硬化(F4)商业化– F2-F3:3.5x vs.安慰剂(相对风险);20%的纤维化改善•与安慰剂相比,具有晚期纤维化(F2-F3)的全球制造战略MASH提供了韧性具有顶线组织学数据的和灵活性的3期试验– F4:纤维化改善45%比•商业液体产品预计在2027年上半年进行安慰剂展示,有可能与肠促胰岛素疗法MASH伴代偿性肝硬化(F4)共同配制•潜在的同类最佳安全性和具有顶线组织学数据耐受性的3期试验•强劲的资产负债表,预计截至12月31日的现金为4.4亿美元,2028,2024年–潜在同类最佳GI –从2025年1月开始的耐受性概况严重高甘油三酯血症(SHTG)的额外总收益2.875亿美元–没有统计学意义或临床意义•为MASH后续提供有意义的骨骼变化的协同计划•预计在2026年第一季度完全注册顶线生物标志物和DXA数据的第3阶段55

附录

经验丰富的管理团队将89bio定位为成功之举Ryan MartinsHank Mansbach,MD Francis Sarena Quoc Le-Nguyen Teresa Perney,PhD CTO CRR & QO CEO CMO COO CFO 20 +年生物制药20 +年生物技术和首席执行官,CCO经验20 +年生物制药C-Suite biotech执行CFO经验和领导制药经验和研发领导在战略、投资者商业、战略、技术运营、监管事务、临床开发以及担任COO、CSO和并购关系、财务、研发经验产品供应,以及产品开发医疗事务和公司治理卖方经验质量和质量保证57

Pegozafermin表现出高强效的FGF受体激动剂FGFR2 FGFR3 FGFR4 FGFR1 2000 3000 BIO89-100 BIO89-100 BIO89-100 BIO89-100 BIO89-100 26005500 FGF21 FGF21 1800 FGF21 FGF21 260022004500160022001400180035001800120014002500140010001000150080010006006006005006000.00010.1 1000.00010.1 1000.00010.1 1000.00010.1 1000.00010.1 100浓度(nM)浓度(nM)浓度(nM)FGF21 Pegozafermin EC(nM)EC(nM)5050受体均值± SD均值± SD KLL原生FGF21 KLB/FGFR2的影响4.5 ± 0.9 1.1 ± 0.4 KLB/FGFR3 1.8 ± 0.31.2 ± 0.4 KLB/FGFR4 nd nd nd –未确定;rhFGF19 EC在FGFR4 = 1.7 ± 0.450*通过pERK功能测定在表达β-klotho和任何一种FGF受体1c、2c、3c或4的L6细胞中测量受体激动性**数字表示来自单个实验的数据;表格表示来自多个实验的平均数据58 pERK pERK pERK pERK

ENLIVEN基线特征在各剂量组中平衡良好参数安慰剂15mg QW 30mg QW 44mg Q2W总平均值或%(n = 71)(n = 21)(n = 73)(n = 57)(n = 222)年龄(岁)5655555556女性55% 43% 69% 65% 61% 2 BMI(kg/m)38383536372型糖尿病69% 86% 62% 61% 66%纤维化阶段(% F3)66% 43% 64% 53% 60% NAFLD活动评分5.0 4.85.35.25.1肝脂肪含量(MRI-PDFF)16.7% 15.8% 16.7% 15.8% 16.4%肝硬度(VCTE,kPA)14.11 1.21 2.51 3.21 3.0 PRO-C3(ng/ml)5062545253ALT(U/L)5061605656 AST(U/L)4148474244HBA1c,总体(%)6.67.06.66.76.76.7甘油三酯(mg/dL)170186175165172基线特征在全分析集(n = 192)和安全集(n = 222)中一致来源:随机分析集。ALT、丙氨酸氨基转移酶;AST、天冬氨酸氨基转移酶;NAFLD、非酒精性脂肪肝病;PRO-C3、N端III型胶原蛋白前肽;VCTE、振动控制瞬时弹性成像。59
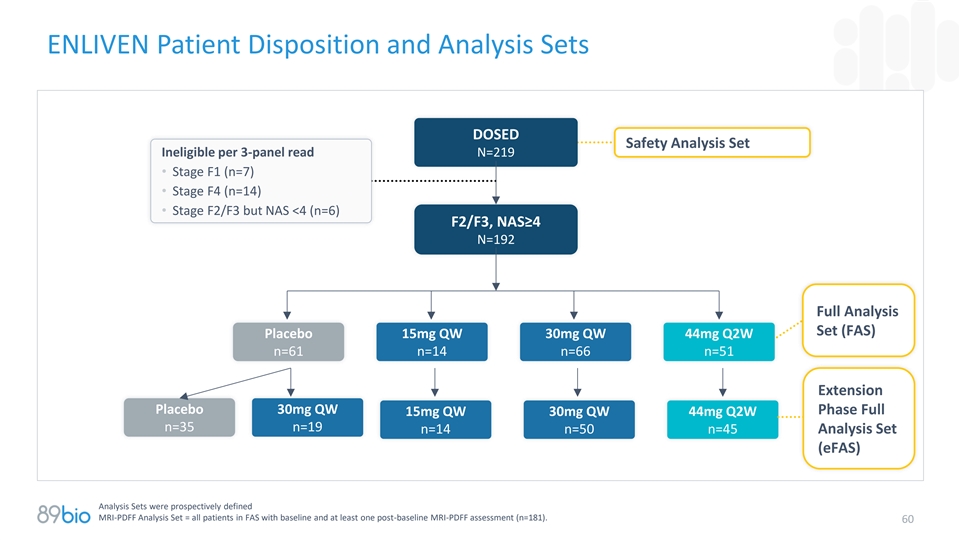
ENLIVEN患者处置和分析集DOSED安全性分析集不合格,每3个面板读数N = 219 • F1阶段(n = 7)• F4阶段(n = 14)• F2/F3阶段,但NAS < 4(n = 6)F2/F3,NAS ≥ 4 n = 192全分析集(FAS)安慰剂15mg QW 30mg QW 44mg Q2W n = 61 n = 14 n = 66 n = 51延长安慰剂30mg QW期全15mg QW 30mg QW 44mg Q2W n = 35 n = 19 n = 14 n = 50 n = 45分析集(eFAS)分析集前瞻性定义MRI-PDFF分析集=具有基线和60

ENLIVEN使用旨在减少组织学评分偏差和变异性的客观活检阅读方法所有生物能独立评分•病理学家在试验前和试验期间接受并分别接受特定于协议的协调培训病理学家病理学家病理学家# 1 # 2 # 3 •病理学家对患者视而不见,治疗和序列评分记录3中的3同意评分(完全一致)40-50 %•>99%由先验评分确定的最终评分记录3中的2同意评分(模式)40-50 %既定算法,而不是通过读者间讨论解决分歧评分记录中位或共识电话< 5% 61

奥贝胆酸MASH 3期方案的学习:单中心阅读器与3组共识改善纤维化≥ 1期而MASH分辨率不恶化且肝纤维化无恶化的比较MASH观察:•单阅读器对MASH分辨率的安慰剂反应比3组共识高出> 2倍•类似于ENLIVEN试验的安慰剂反应对纤维化改善和MASH分辨率的影响:• 3组共识突出了治疗增量,但抑制了绝对反应• 3组共识方法可在3期试验中重现低安慰剂反应REGENERATE再分析顶线,2022年7月。62

将缺失的组织学数据视为无反应者的敏感性分析证实了主要疗效结果的稳健性纤维化改善和MASH分辨率缺失数据=无反应者n = 192,第24周30mg QW 44mg Q2W纤维化改善而MASH效应大小不恶化(安慰剂调整)15% 16% p值0.01 90.015 MASH分辨率而不恶化纤维化效应大小(安慰剂调整)17% 20% p值0.00 190.0009来源:全分析集63
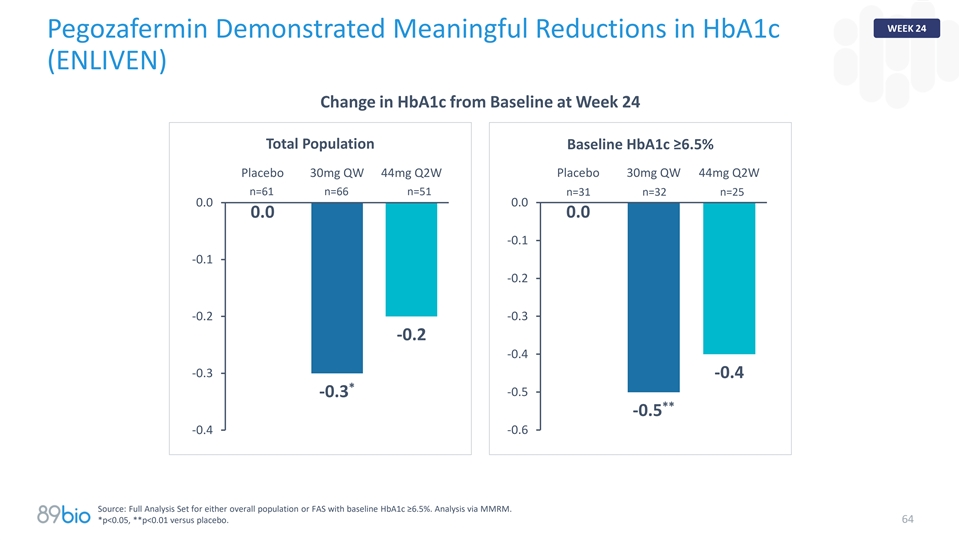
第24周Pegozafermin在第24周显示HBA1c(ENLIVEN)变化明显低于基线总人口基线HBA1c ≥ 6.5%安慰剂30mg QW 44mg Q2W安慰剂30mg QW 44mg Q2W n = 61 n = 66 n = 51 n = 31 n = 32 n = 250.0 0.0 0.0 0.0-0.1-0.1-0.2-0.2-0.2-0.3-0.2-0.4-0.3-0.4*-0.5 -0.3**-0.5-0.4-0.6来源:针对总体人群或基线HBA1c ≥ 6.5%的FAS的完整分析集。通过MMRM进行分析。64*p < 0.05,**p < 0.01对比安慰剂。
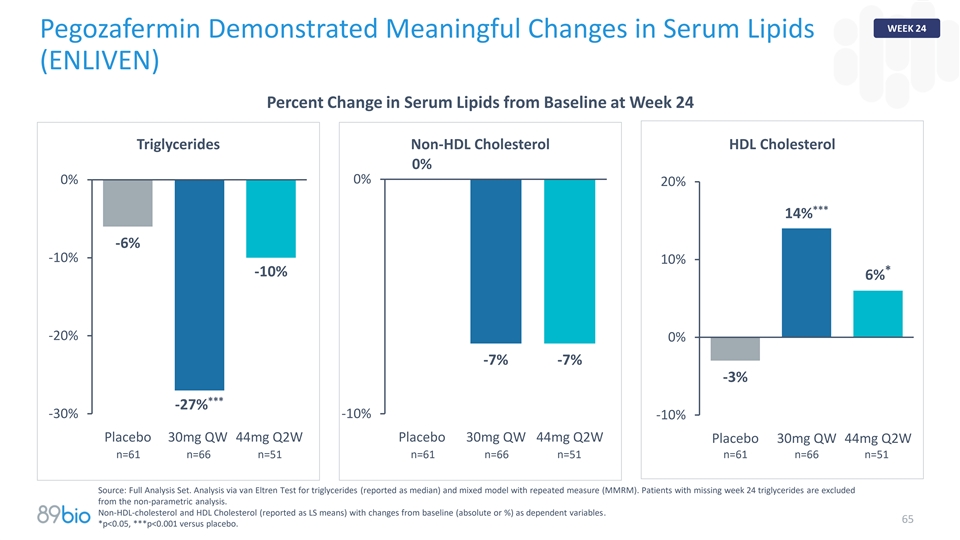
第24周Pegozafermin显示血清脂质(ENLIVEN)有意义的变化第24周血清脂质从基线变化百分比甘油三酯非HDL胆固醇HDL胆固醇0% 0% 0% 20%***14% -6% -10% 10%*-10% 6% -20% 0% -7% -7% -3%***-27 %-30 %-10 %-10 %安慰剂30mg QW 44mg Q2W安慰剂30mg QW 44mg Q2W安慰剂30mg QW 44mg Q2W n = 61 n = 66 n = 51 n = 61 n = 66 n = 51 n = 66 n = 51资料来源:全分析集。通过van Eltren试验分析甘油三酯(报告为中值)和具有重复测量(MMRM)的混合模型。缺少第24周甘油三酯的患者被排除在非参数分析之外。非高密度脂蛋白胆固醇和高密度脂蛋白胆固醇(报告为LS均值)与基线(绝对值或%)的变化为因变量。65*p < 0.05,***p < 0.001对比安慰剂。
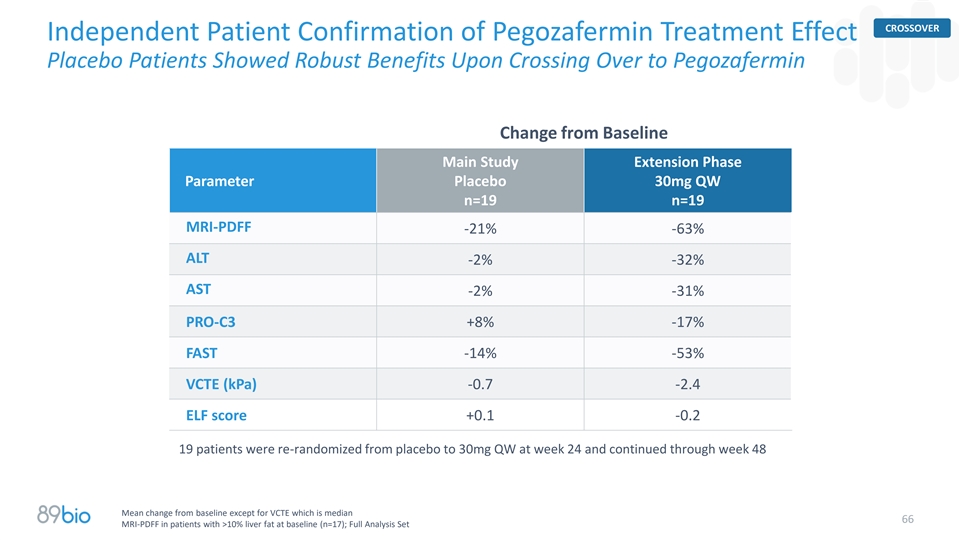
CrossSOVER独立患者确认Pegozafermin治疗效果安慰剂患者在从基线跨越到Pegozafermin变化时显示出强大的益处主要研究扩展阶段参数安慰剂30mg QW n = 19 n = 19 MRI-PDFF-21 %-63 % ALT-2 %-32 % AST-2 %-31 % PRO-C3 + 8%-17 % FAST-14 %-53 % VCTE(kPA)-0.7-2.4 ELF评分+ 0.1-0.2 19名患者在第24周从安慰剂重新随机分配到30mg QW,并持续到第48周,在基线时肝脂肪> 10%的患者中,除VCTE为中位66 MRI-PDFF(n = 17)外,均显示出与基线的平均变化;全分析集
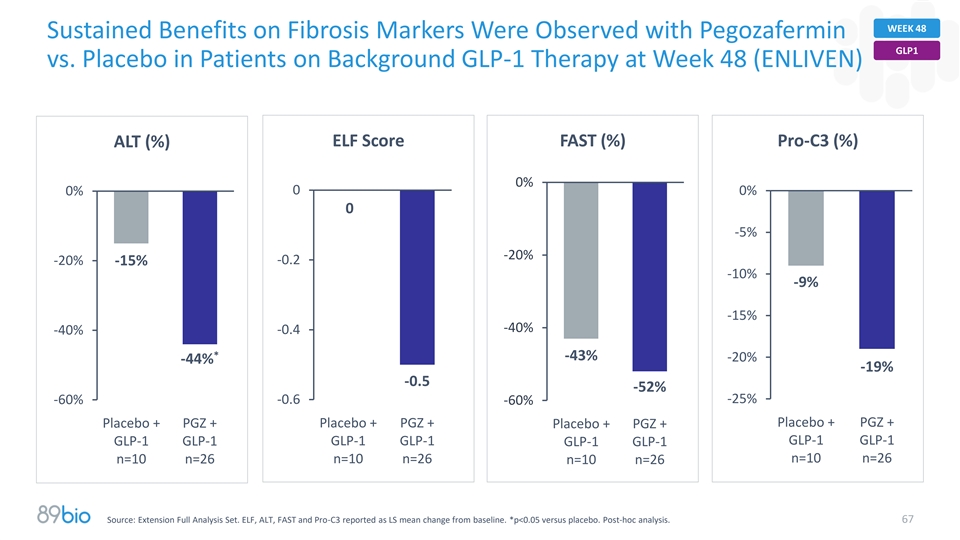
第48周在接受背景GLP-1治疗的患者中使用Pegozafermin GLP1与安慰剂观察到对纤维化标志物的持续益处第48周(ENLIVEN)ELF评分FAST(%)Pro-C3(%)ALT(%)0% 00% 0% 0-5 %-20 %-0.2-20 %-15 %-10 %-9 %-15 %-40 %-40 %-0.4*-43 %-20 %-44 %-19 %-0.5-52 %-60 %-0.6-25 %-60 %安慰剂+ PGZ +安慰剂+ PGZ +安慰剂+ PGZ + PLZ + GLP-1 GLP-1 GLP-1 GLP-1 GLP-1 GLP-1 GLP-1 GLP-1 n = 10 n = 26 n = 10 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n = 26 n =ELF、ALT、FAST和Pro-C3报告为LS较基线的均值变化。*p < 0.05对比安慰剂。事后分析。67

第48周在接受背景GLP-1治疗的患者中观察到Pegozafermin GLP1与安慰剂在第48周代谢标志物上的持续获益(ENLIVEN)MRI-PDFF(%)甘油三酯(%)LDL-C(%)安慰剂+ GLP-1 PGZ + GLP-1 PGZ + GLP-1安慰剂+ GLP-1 PGZ + GLP-1 n = 8 n = 17 n = 8 n = 18 n = 18 n = 180% 0% 0%-5 %-20 %-10 %-12 %-10 %-10 %-34 %-40 %-20 %-14 %-22 %-53 %-20 %-60 %-30 % 68来源:Extension Full Analysis Set。TG、LDL-C和MRI-PDFF报告为与基线相比的中值百分比变化。事后分析

Pegozafermin显示一致并在实现跨预指定亚组纤维化改善方面显着受益Pegozafermin 30mg QW Pegozafermin 44mg Q2W比例实现纤维化改善比例实现纤维化改善BL T2DM:是BL T2DM:是BL T2DM:无BL纤维化阶段:F2 BL纤维化阶段:F2 BL纤维化阶段:F2 BL纤维化阶段:F3 BL纤维化阶段:F3 BL MRI-PDFF:<中值(16%)BL MRI-PDFF:<中值…BL MRI-PDFF:≥中值(16%)BL MRI-PDFF:≥中值…BL ALT:正常BL ALT:正常BL ALT:> ULN BLT1020304050-10 0102030405060赞成Placebo赞成PEGOZAFERMIN赞成Placebo赞成PEGOZAFERMIN EST.比例差异(95% CI)EST.比例差异(95% CI)来源:全分析集ALT,丙氨酸氨基转移酶;BL,基线;MRI-PDFF,磁共振成像质子密度脂肪分数;NAS,非酒精性脂肪性肝病活动评分;MASH,非酒精性脂肪性肝炎;Q2W,每2周一次;QW,每周一次;T2DM,2型糖尿病;ULN,正常上限。69
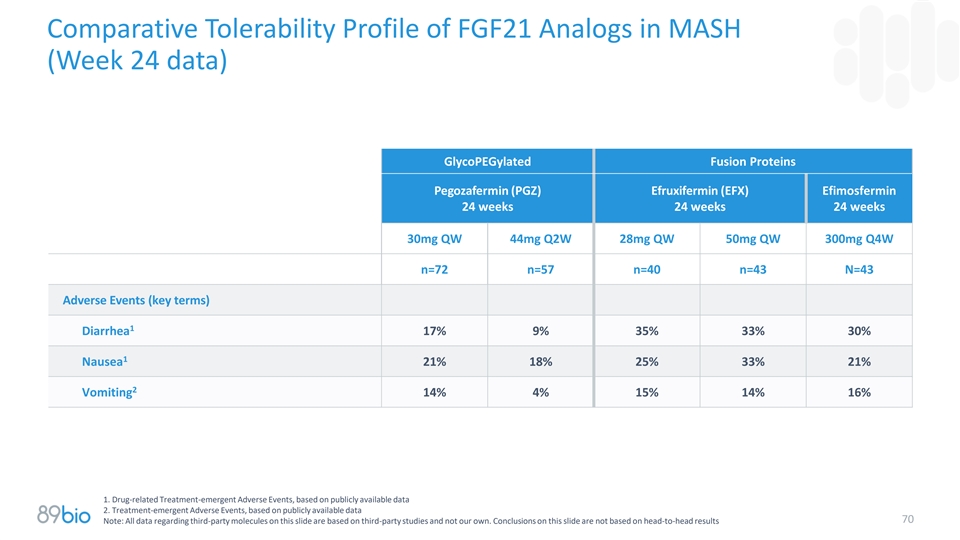
MASH中FGF21类似物的比较耐受性曲线(第24周数据)糖聚乙二醇化融合蛋白Pegozafermin(PGZ)Efruxifermin(EFX)Efimosfermin 24周24周24周30mg QW 44mg Q2W 28mg QW 50mg QW 300mg Q4W n = 72 n = 57 n = 40 n = 43 n = 43不良事件(关键项)1腹泻17% 9% 35% 33% 30% 1恶心21% 18% 25% 33% 21% 2呕吐14% 4% 15% 14% 16% 1。药物相关治疗-紧急不良事件,基于公开数据2。治疗紧急不良事件,基于公开数据70注:本幻灯片上有关第三方分子的所有数据均基于第三方研究,而不是我们自己的。关于这张幻灯片的结论不是基于头对头的结果

基于显示出良好耐受性/安全性的临床数据,Pegozafermin有望在FGF21类别中成为同类最佳;Pegozafermin Efruxifermin Efimosfermin临床数据N = 222;3个剂量测试N = 128;2个剂量测试N = 84;1个剂量测试2期设计(F2-F3)60% F3患者66% F3患者44% F3患者严格3面板活检阅读共识2读者2读者•第24周显着的纤维化改善和MASH分辨率功效•对众多非侵入性肝脏测试和代谢参数的显着影响纤维化改善3.5(30mg,QW)2.0(28mg,QW)2.1(300mg,Q4W)相对风险(F2-F3)*3.6(44mg,Q2W)2.0(50mg,QW)GLP-1的添加剂Yes Yes Not present benefit manifested Yes Yes No in F4患者•更高的GI事件发生率•更高的GI事件发生率•更低的GI事件发生率• BMD和骨骼的显着变化• BMD和BP数据未报告自• BMD或耐受性无显着变化和安全性生物标志物MASH研究骨生物标志物• BP的显着变化•骨的显着变化• BP无显着变化•多项研究中的震颤1期肥胖研究中的生物标志物*F2-F3患者的纤维化改善相对风险显示在每种候选药物的24周时间点ND =未披露注:这些数据来自不同时间点的不同临床试验,在试验设计和患者群体方面存在差异。因此,无法进行跨试验比较,也没有进行过头部对71的临床试验。
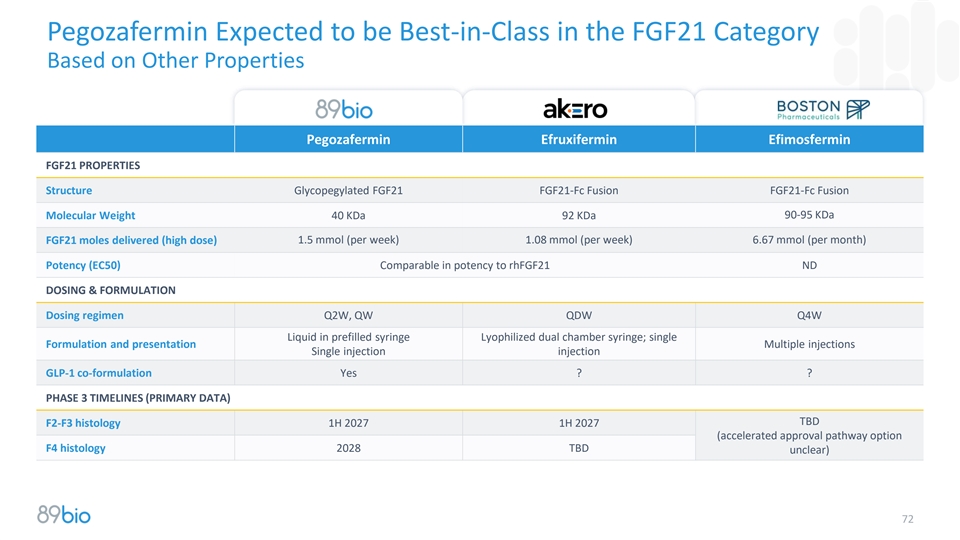
Pegozafermin基于其他特性有望在FGF21类别中获得同类最佳Pegozafermin Efruxifermin Efimosfermin FGF21特性Structure糖化FGF21 FGF21-FC融合FGF21-FC融合90-95 KDa分子量40KDa 92 KDa FGF21递送摩尔(高剂量)1.5mmol(每周)1.08mmol(每周)6.67mmol(每月)效力(EC50)与rhFGF21 ND给药&配方给药方案Q2W、QW QDW Q4W液体在预充式注射器冻干双腔注射器中的效力相当;?Phase 3 Timelines(Primary Data)TBD F2-F3组织学1H 2027 1H 2027(accelerated approval pathway option F4组织学2028 TBD unclear)72
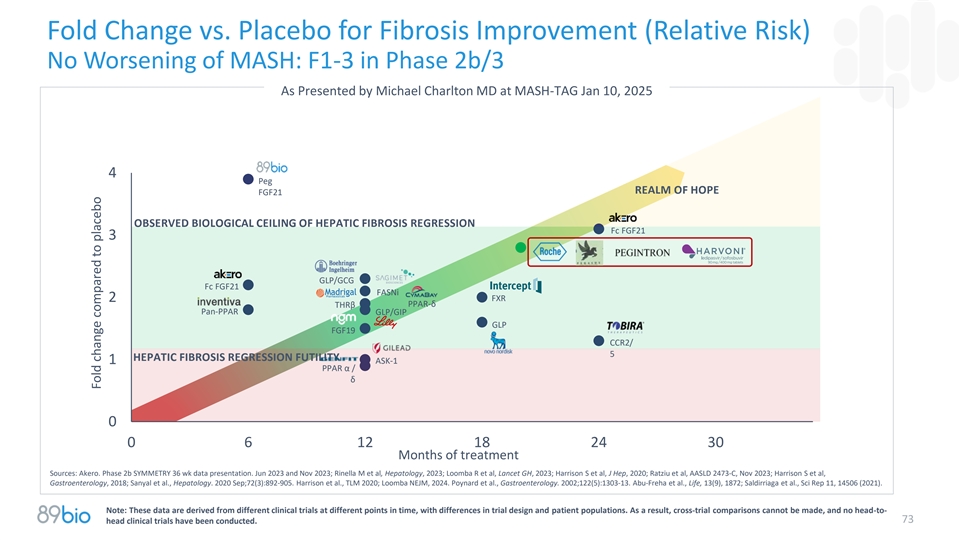
Fold change vs. Placebo for fibrosis improvement(relative risk)MASH No worsening of mASH:F1-3 in phase 2b/3 as presented by Michael Charlton MD at MASH-TAG Jan 10,20254 peg realm of hope FGF21 observed biological ceiling of hepatic fibrosis regression fc FGF21 3GLP/GCG Fc FGF21 FASNi FXR 2 PPAR-δ THR β pan-PPAR GLP/GIP GLP FGF19 CCR2/5 Hepatic fibrosis regression futility 1 ASK-1 PPAR α/δ 00612182430个月治疗来源:2b期SYMETRY36周数据演示。2023年6月和2023年11月;Rinella M等人,Hepatology,2023;Loomba R等人,Lancet GH,2023;Harrison S等人,J Hep,2020;Ratziu等人,AASLD 2473-C,2023年11月;Harrison S等人,Gastroenterology,2018;Sanyal等人,Hepatology。2020年9月;72(3):892-905。Harrison等,TLM 2020;Loomba NEJM,2024。Poynard et al.,Gastroenterology。2002;122(5):1303-13.Abu-Freha et al.,Life,13(9),1872;Saldirriaga et al.,Sci Rep 11,14506(2021)。注:这些数据来源于不同时点的不同临床试验,在试验设计和患者人群方面存在差异。因此,无法进行跨试验比较,也没有进行过头-73头临床试验。与安慰剂相比变化倍数