
附件 99.2 VAX-24婴儿2期剂量发现研究顶线结果2025年3月31日

前瞻性陈述本演示文稿包含1995年《私人证券诉讼改革法案》含义内的前瞻性陈述。这些声明包括但不限于,与Vaxcyte的候选疫苗和平台实现市场上任何婴儿肺炎球菌结合疫苗最广泛覆盖的能力有关的声明;VAX-24在婴儿中提供最广泛血清型和疾病覆盖的能力;VAX-31进一步扩大覆盖范围的能力;许可的先例标准;剩余的VAX-24婴儿2期研究数据读出和VAX-31婴儿2期研究读出的时间;启动的时间和VAX-31成人研究的数据读出;为Vaxcyte的候选疫苗提供潜在的同类最佳肺炎球菌结合疫苗特许经营需求的能力;肺炎球菌疫苗市场的增长和扩张;Vaxcyte疫苗的市场机会;Vaxcyte对其候选疫苗的谱覆盖率和监管路径的预期;以及其他非历史事实的陈述。“预期”、“相信”、“继续”、“可能”、“设计”、“估计”、“预期”、“打算”、“可能”、“计划”、“潜力”、“预测”、“项目”、“应该”、“目标”、“将”、“将”和类似表述旨在识别前瞻性陈述,尽管并非所有前瞻性陈述都包含这些识别词。这些前瞻性陈述基于Vaxcyte当前的预期,由于风险和不确定性,包括但不限于与Vaxcyte的产品开发计划相关的风险,包括开发时间表、化学、制造和控制以及相关制造活动的成功和时间安排;潜在的延迟或无法获得和维持对其候选疫苗所需的监管批准;临床前和临床开发过程固有的风险和不确定性;成功与否,所有开发活动和临床试验的成本和时间安排;以及足够的现金和其他资金来支持Vaxcyte的开发计划和其他运营费用,其中任何一项都可能对Vaxcyte的业务和运营产生重大不利影响。这些风险和其他风险在Vaxcyte提交给美国证券交易委员会(SEC)的文件中有更全面的描述,包括其于2025年2月25日向SEC提交的10-K表格年度报告,或Vaxcyte随后向SEC提交或提供给SEC的其他文件。TERM2不承担因新信息、未来事件或其预期变化而更新本新闻稿中包含的任何前瞻性陈述的义务或义务。2025年3月31日2

VAXCYTE使命声明我们肩负着设计高保真疫苗的全球使命,以保护人类免受细菌性疾病的后果。2025年3月31日3

•介绍和VAX-24婴儿研究结果概览议程• VAX-24婴儿第2阶段剂量发现研究顶线结果–处置和人口统计–安全性和耐受性数据–顶线免疫原性数据§剂量后3期IGG和中期OPA §剂量后4期中期IGG •婴儿第3阶段计划规划• PCV专营权和管道更新2025年3月31日4

简介及VAX-24婴儿研究结果概述2025年3月31日5

VAX-24 2期婴儿研究结果和平台证明有潜力实现对任何婴儿PCV的最广泛覆盖上市一线研究结果积极且符合目标的安全性和耐受性特征类似于护理标准VAX-24引发了大量的IGG、OPA和记忆反应,并且对疫苗中包含的当前流行的血清型表现特别好。随着我们在婴儿和成人中进入3期并引入我们的第三代PCV--VAX-XL 2025年3月31日6

肺炎球菌疾病(PD)对全球健康的影响仍然显着美国疾病预防控制中心将药物-在全球范围内,超过150,000名美国耐药肺炎链球菌是每年因肺炎球菌“严重威胁”而导致的主要住院病例肺炎是疫苗的一个原因。可预防的肺炎死亡。五岁以下儿童,每年造成约300,000人死亡。2025年3月31日7
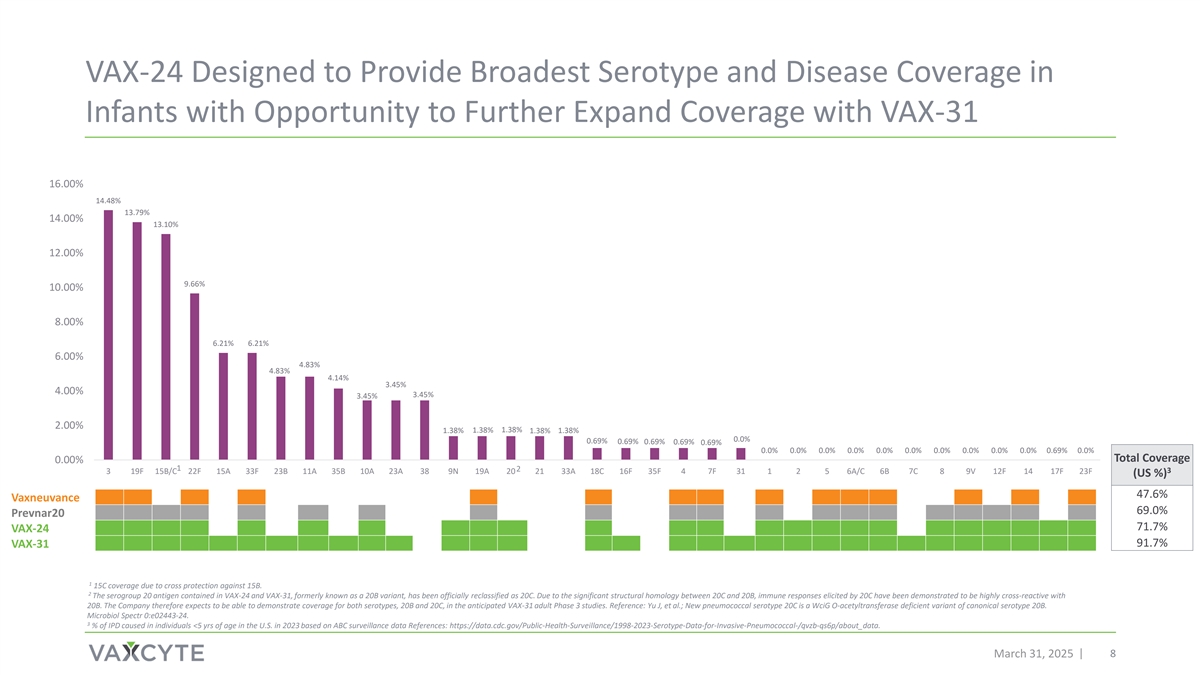
VAX-24旨在提供最广泛的血清型有机会进一步扩大VAX-31覆盖面的婴儿和疾病覆盖面16.00% 14.48% 13.79% 14.00% 13.10% 12.00% 9.66% 10.00% 8.00% 6.21% 6.21% 6.00% 4.83% 4.83% 4.14% 3.45% 4.00% 3.45% 3.45% 2.45% 2.00% 1.38% 1.38% 1.38% 1.38% 0.0% 0.69% 0.69% 0.69% 0.69% 0.69% 0.69% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0%Vaxneuvance 69.0% Prevnar20 71.7% VAX-24 91.7% VAX-31 1 15C覆盖因对15B的交叉保护。2 VAX-24和VAX-31中含有的血清群20抗原,原名为20B变异株,已被正式重新归类为20C。由于20C和20B之间具有显著的结构同源性,20C引发的免疫反应已被证明与20B具有高度的交叉反应。因此,该公司预计能够在预期的VAX-31成人3期研究中证明对20B和20C两种血清型的覆盖。参考资料:Yu J等;新型肺炎球菌血清型20C是典型血清型20B的WCIGO O-乙酰转移酶缺陷变异株。微生物光谱0:e02443-24。美国2023年基于ABC监测数据参考的< 5岁个人IPD的3%:https://data.cdc.gov/public-health-surveillance/1998-2023-Serotype-data-for-invasive-Pneumococcal-/qvzb-qs6p/about_data。2025年3月31日8

VAX-24婴儿2期剂量发现研究顶线结果2025年3月31日9

书房设计2025年3月31日10
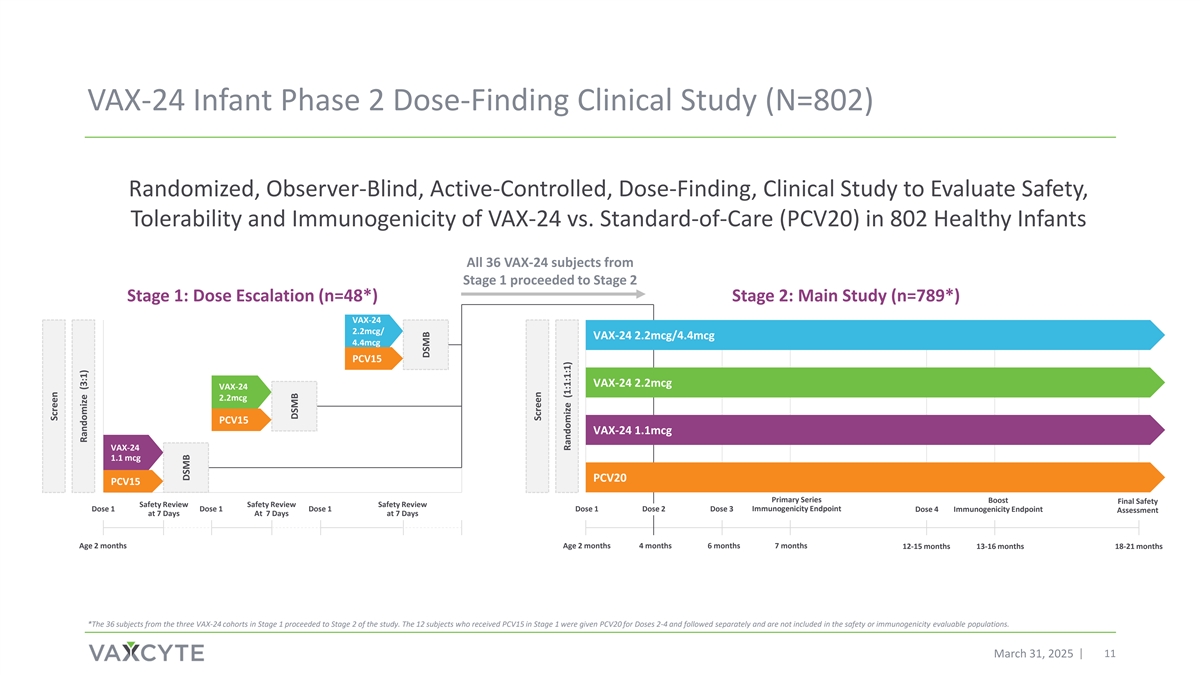
VAX-24婴儿2期剂量发现临床研究(N = 802)随机、观察者盲、主动对照、剂量发现,临床研究评估安全性,耐受性802名健康婴儿VAX-24与标准护理(PCV20)的免疫原性和免疫原性所有36名VAX-24受试者从第1阶段进入第2阶段第1阶段:剂量增加(n = 48*)第二阶段:主要研究(n = 789*)VAX-24 2.2mCG/VAX-24 2.2mCG/4.4mCG 4.4mCG PCV15 VAX-24 2.2mCG VAX-24 2.2mCG PCV15 VAX-24 1.1mCG VAX-24 1.1 mCG PCV20 PCV15 Primary Series Boost Final Safety Safety Review Safety Review Safety Review Dose 1 Dose 1 Dose 1 Dose 1 Dose 2 Dose 3 Immunogenicity Endpoint Dose 4 Immunogenicity Endpoint Assessment at 7 days at 7 days at 7 days at 7 days at 7 days at 7 days at 7 days at 7 days at 7 days at 7 d月12-15月13-16月18-21月*来自第1阶段的三个VAX-24队列的36名受试者进入了研究的第2阶段。1期接受PCV15的12名受试者给予PCV20剂量2-4并单独随访,不纳入安全性或免疫原性可评估人群。2025年3月31日11屏幕随机化(3:1)DSMB DSMB DSMB屏幕随机化(1:1:1:1)

在婴儿2期剂量发现研究中评估的三种VAX-24剂量与在VAX-24成人方案中评估的剂量相同14.5% 13.8% 13.1%美国儿童IPD9.7 % 6.2% 14.8% < 5岁3.5% 1.4% 1.4% 1.4% 0.7% 0.7% 0.7% 0.7% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 0.0% 23 19F 15B 22F 33F 11A 10A 19A 18C 7F 48 6B 12F 9V 14 23F 5 6A 1 9N 20C 17F 24.4(2.2mCg)PCV20 mCg低剂量(1.1mCg)中剂量VAX-24(2.2mCg)混合剂量4.4mcg mcg mcg mcg mcg mcg mcg 4.4mcg)•混合剂量包括根据流行病学相关性或剂量依赖性免疫反应的先前证据战略性选择的4.4mcg的七种血清型,以增加这些血清型产生非劣免疫反应的可能性。根据ABC监测数据参考:https://data.cdc.gov/public-health-surveillance/1998-2023-serotype-data-for-invasive-pneumococcal-/qvzb-qs6p/about_data,2023年美国< 5岁个体中IPD导致的百分比为1%。2 VAX-24和VAX-31中含有的血清群20抗原,原名20B变异株,已被正式重新归类为20C。有关血清群20的更多详细信息,请参见幻灯片7的脚注1。2025年3月31日12

处置和人口统计2025年3月31日13

研究处置VAX-24婴儿2期剂量发现研究1随机N = 802接种疫苗接种疫苗接种疫苗VAX-24低剂量VAX-24中剂量VAX-24混合剂量PCV20 N = 205 N = 201 N = 195 N = 188纳入安全人群纳入安全人群纳入安全人群纳入安全人群纳入安全人群N = 205 N = 201 N = 195 N = 188纳入IGG PD3纳入IGG PD3纳入IGG PD3纳入IGG PD3免疫原性人群免疫原性人群免疫原性人群免疫原性人群免疫原性人群免疫原性人群免疫原性人群2222 N = 151 N =152 N = 142 N = 129纳入中期IGG PD4纳入中期IGG PD4纳入中期IGG PD4纳入中期IGG PD4人群人群人群人群N = 110 N = 100 N = 101 N = 761在802名随机受试者中,12名接受PCV15接种剂量1,未纳入PCV20接种人群,1名在接种前退出。2所有队列的PD3免疫原性人群不包括停止研究或血液样本不可用或不合格的受试者。2025年3月31日14

各队列的人口统计数据总体平衡VAX-24低剂量VAX-24中剂量VAX-24混合剂量PCV20 205201195188受试者数量1中位年龄,天数(第一季度、第三季度)64(61,68)64(61,68)64(62,68)64(62,68)性别,n(%)113(55.1)103(51.2)94(48.2)87(46.3)女性92(44.9)98(48.8)101(51.8)101(53.7)男性种族,n(%)139(67.8)141(70.1)139(71.3)127(67.6)白黑38(18.5)35(17.4)29(14.9)31(16.5)3(1.5)0(0.0)5(2.6)2(1.1)亚洲0(0.0)0(0.0)0(0.0)夏威夷土著美洲印第安人或阿拉斯加原住民1(0.5)1(0.5)2(1.0)1(0.5)其他/多种族24(11.7)24(11.9)20(10.3)27(14.4)5.195.185.295.22中位体重,公斤(第一季度、第三季度)(4.77,5.63)(4.73,5.81)(4.80,5.72)(4.73,5.67)57.66 57.79 57.80 58.09中位长度,厘米(第一季度、第三季度)(55.88,59.18)(55.88,59.69)(55.88,59.69)中位孕龄,周(第一季度,393939(38,39)(38,39)(38,39)Q3)3.29 3.27 3.27 3.22出生体重中位数,kg(Q1,Q3)(2.93,3.60)(3.00,3.60)(2.97,3.63)(2.96,3.54)1 Q1 =第一四分位数或第25个百分位。Q3 =第三四分位数或第75个百分位。*美国印第安人种族的四个主题被编辑,以保持致盲。2025年3月31日15

安全容忍度数据2025年3月31日16

VAX-24在所有剂量组中均具有良好的耐受性,在三种主要剂量中的每一种后7天通过当地征求AEs 100%轻度90%中度80%重度70% 60% 50% 40% 30% 20% 10% 0%低中混合PCV20低中混合PCV20低中混合PCV20低中混合PCV20水肿*注射部位压痛红斑*发生1例重度水肿编辑维持致盲。2025年3月31日17

VAX-24在所有剂量组中的耐受性良好在三种主要剂量中的每一种后7天系统性地征求AEs 100% 90%轻型80%中度70%重度60% 50% 40% 30% 20% 10% 0%睡眠减少增加睡眠热*易怒降低了食欲。*发生1次严重发热编辑维持致盲。2025年3月31日18

VAX-24在所有剂量组中具有良好的耐受性在每个主要剂量后的7天内任何征求的AEE 100%严重中度轻度90% 80% 70% 60% 50% 40% 30% 20% 10% 0% PD1 PD2 PD3 PD1 PD2 PD3 PD1 PD2 PD3 PD3 PD1 PD2 PD2 PD3 PCV20 VAX-24低VAX-24中VAX-24混合2025年3月31日19
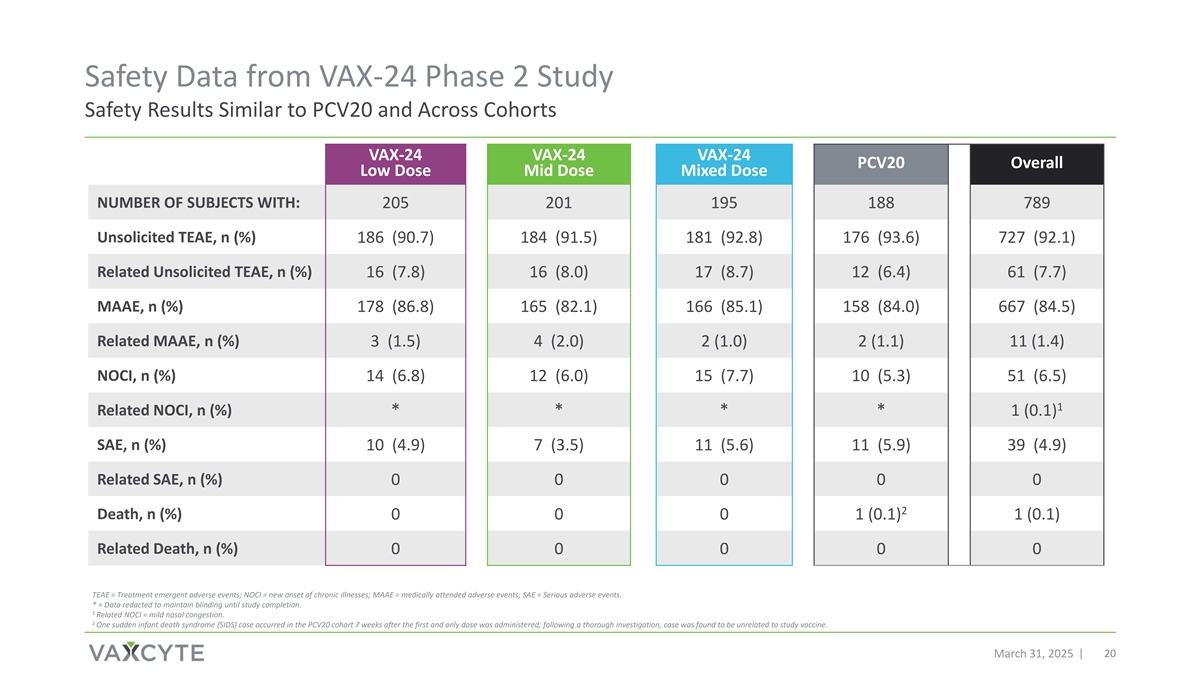
来自VAX-24 2期研究的安全性数据安全性结果与PCV20相似,并跨队列VAX-24 VAX-24 VAX-24 PCV20总体低剂量中剂量混合剂量受试者数量:205201195188789主动TEAEE,n(%)186(90.7)184(91.5)181(92.8)176(93.6)727(92.1)相关主动TEAEE,n(%)16(7.8)16(8.0)17(8.7)12(6.4)61(7.7)MAAEE,n(%)178(86.8)165(82.1)166(85.1)158(84.0)667(84.5)相关MAAEE,n(%)3(1.5)4(2.0)2(1.0)2n(%)14(6.8)12(6.0)15(7.7)10(5.3)51(6.5)1相关NOCI,n(%)****1(0.1)SAE,n(%)10(4.9)7(3.5)11(5.6)11(5.9)39(4.9)相关SAE,n(%)00002死亡,n(%)0001(0.1)1(0.1)相关死亡,n(%)000000 TEAEE =治疗中出现的不良事件;NOCI =慢性疾病的新发;MAAEE =就诊的不良事件;SAE =严重不良事件。*=数据被编辑以保持盲目性直到研究完成。1相关NOCI =轻度鼻塞。2 PCV20队列在第一剂也是唯一一剂给药7周后出现1例婴儿猝死综合征(SIDS)病例;经深入调查,发现该病例与研究疫苗无关。2025年3月31日20

顶线免疫原性数据2025年3月31日21

支持3期进展的婴儿2期免疫原性措施的标准和FDA对更广谱婴儿PCV许可的先例考虑1数据2期目标3期终点的总量次级免疫原性终点•对于常见STs:下限(LL)•对于常见STs:FDA评估了95% CI,用于较大的3期NI注册研究之间的差异• IGG抗体水平PD3(GMR)参与者达到基于实现血清转换的比例•功能性抗体水平PD3血清转换率(每个ST预先定义的IGG率>-10 %且PD4(OPA)2浓度≥ 0.35mCg/mL)>-15 %初级系列• IGG血清转化率PD4 •对于独特STs:对每个ST非劣效浓度阈值实现相同的IGG如上,但剂量后3(PD3)与ST相比最低•对于独特STs:在对照PCV中实现相同的IGG应答率,或如上实现“Prime”浓度阈值,但不包括ST3与在对照PCV中应答率最低的ST相比,不包括ST3的其他关键考虑因素•普通STs的循环病% •对于普通STs:FDA评估了更大的•对于普通STs:带有点的IGG GMRs •抗体反应的幅度3个3期NI注册研究,基于LL估计的每个ST加强剂量> 0.6 • IGG GMR > 0.5的95% CI的原发性不足程度对于每个ST •对于独特的ST:实现相同的IGG GMR非劣效性终点•对于独特的ST:与ST给药后4(PD4)阈值相比,与比较体内IGG GMC最低的ST相比,实现相同的IGG GMR阈值,或与比较体内PCV中IGG GMC最低的ST相比“boost”,不包括ST3 PCV,不包括ST3 CI =置信区间;IGG =免疫球蛋白G.1来源:2023年4月27日临床审查-Prevnar20.pdf和2022年6月17日临床审查(STN 125741/6)– VAXNEUVANCE。2 默沙东应用>-15 %的V114(Vaxneuvance)2期终点支持推进到3期(https://pmc.ncbi.nlm.nih.gov/articles/PMC7360095/)。2025年3月31日223基于我们对先例2期和3期研究的统计分析。

VAX-24在所有剂量中均表现出较高的总体血清转化率VAX-24低剂量VAX-24中剂量VAX-24混合剂量PCV20 100806040200 PCV20特有血清型常见的血清型IGG =免疫球蛋白G。VAX-24和VAX-31中所含的血清群20抗原,以前称为20B变体,已被正式重新归类为20C。有关血清群20的更多详细信息,请参见幻灯片7的脚注1。2025年3月31日23%的受试者预定IgG水平(> 0.35mCg/mL)3 19F 15B 22F 33F 11A 10A 19A 18C 7F 48 6B 12F 9V 14 23F 5 6A 1 9N 20C 17F 2
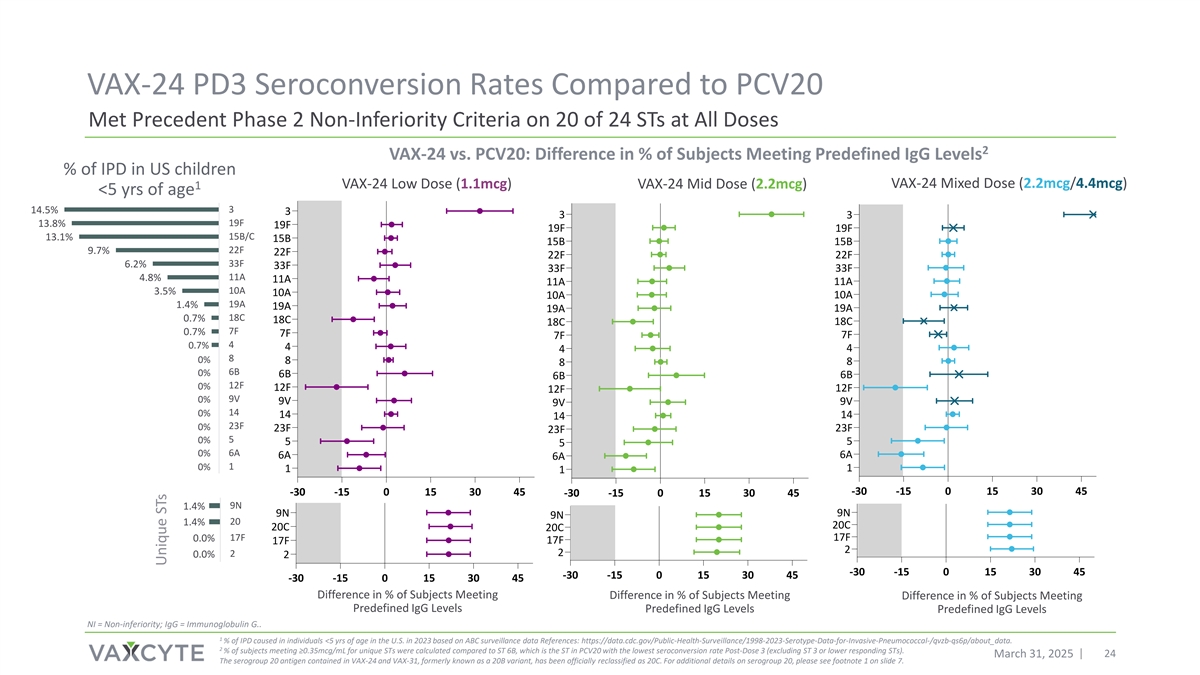
VAX-24与PCV20相比的PD3血清转换率在所有剂量的24个STs中的20个上达到了先前的2期非劣效性标准2 VAX-24与PCV20:符合预定义IGG水平%的受试者的差异美国儿童IPD的百分比VAX-24混合剂量(2.2mCg/4.4mCg)VAX-24低剂量(1.1mCg)VAX-24中剂量(2.2mCg)1 < 5岁314.5% 333 19F 13.8% 19F 19F 19F 15B/C 13.1% 15B 15B 22F 9.7% 22F 22F 33F 6.2% 33F 33F 11A 4.8% 11A 11A 11A 10A 3.5% 10A18C 18C 7F 0.7% 7F 7F 40.7% 44480% 888 6B 0% 6B 6B 6B 12F 0% 12F 12F 9F 0% 9V 9V 9V 140% 141414 23F 0% 23F 23F 23F 50% 5550% 6A 6A 6A 6A 0% 111115% 10% 5% 0%-30-15 0153045-30-15 0153045-30-15 0153045 9N 1.4% 9N 9N 201.4% 20C 20C 17F 17F 0.0% 17F 17F 220.0% 22-30-15 0153045-30-15 015304515% 10% 5% 0%-30-15 0153045受试者会议百分比差异受试者会议百分比差异受试者会议百分比差异预定义IGG水平预定义IGG水平预定义IGG水平预定义IGG水平NI =非劣效性;IGG =免疫球蛋白G.。根据ABC监测数据参考资料:https://data.cdc.gov/public-health-surveillance/1998-2023-serotype-data-for-invasive-pneumococcal-/qvzb-qs6p/about_data,2023年美国< 5岁个体中1%的IPD导致。2%的受试者满足≥ 0.35mCg/mL的独特STs与ST 6B进行比较计算,ST 6B是PCV20中剂量3后血清转化率最低的ST(不包括ST 3或更低应答STs)。2025年3月31日24日VAX-24和VAX-31中含有的血清群20抗原,原名为20B变异株,已被正式重新归类为20C。有关血清群20的更多详细信息,请参见幻灯片7的脚注1。独特的ST
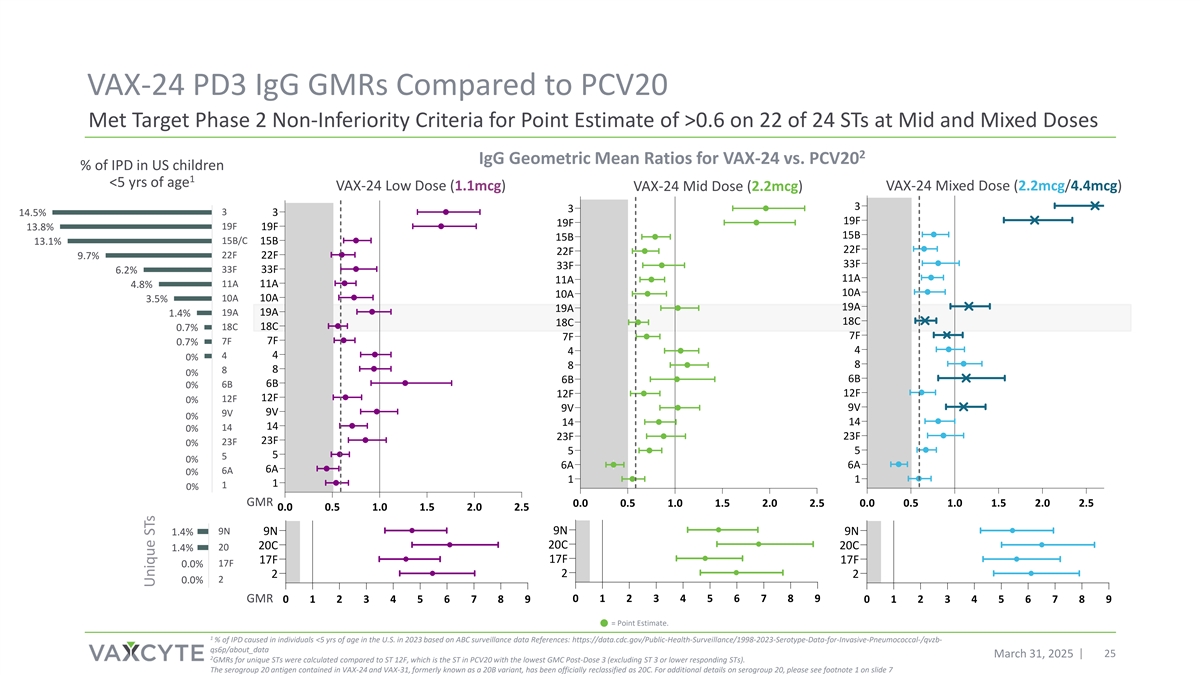
VAX-24 PD3 IGG GMRs与PCV20 Met Target Phase 2 Non-Inferiority Criteria for Point Estimate > 0.6 on 22 of 24 STs at Mid和混合剂量2 IGG几何平均比率美国1 < 5岁儿童IPD的VAX-24与PCV20 % VAX-24低剂量(1.1mCg)VAX-24中剂量(2.2mCg)VAX-24混合剂量(2.2mCg/4.4mCg)333314.5% 19F 19F 13.8% 19F 19F 15B 15B 15B/C 13.1% 15B 22F 22F 22F 9.7% 33F 33F 33F 6.2% 11A 4.8% 11A 11A 10A 10A 10A 10A 3.5% 19A 19A 19A 1.4% 18C 18C 0.7% 7F 7F 7F 0.7% 44440% 8880% 6B 6B 6B 0% 12F9V 0% 141414140% 23F 23F 23F 23F 0% 55550% 6A 6A 6A 6A 0% 11110% GMR 0.0 0.5 1.0 1.5 2.0 2.5 0.0 0.5 1.0 1.5 2.0 2.515% 10% 5% 0% 0.0 0.5 1.0 1.5 2.0 2.59N 9N 1.4% 9N 9N 20C 20C 1.4% 20 17F 17F 17F 0.0% 2220.0% GMR 01234567890123456789012345678915% 10% 5% 0% =点位估算。根据ABC监测数据参考:https://data.cdc.gov/public-health-surveillance/1998-2023-serotype-data-for-invasive-pneumococcal-/qvzb-qs6p/about_data2025年3月31日,美国2023年< 5岁个体中IPD的1%与ST 12F相比计算出252个独特ST的GMR,这是PCV20中GMC剂量后3最低的ST(不包括ST 3或更低响应ST)。VAX-24和VAX-31中含有的血清群20抗原,原名为20B变异株,已被正式重新归类为20C。有关血清群20的更多详细信息,请参见幻灯片7上的脚注1 Unique STs

VAX-24 PD3 OPAOPAGMT免疫反应是一个关键的次要终点– GMTS > 8与对IPD的有效性相关VAX-24低剂量VAX-24中剂量VAX-24混合剂量PCV20独特的血清型与PCV20常见的血清型VAX-24和VAX-31中所含的血清群20抗原,以前称为20B变体,已被正式重新分类为20C。有关血清群20的更多详细信息,请参见幻灯片7的脚注1。在这项OPA分析中研究了血清型20B。IGG =免疫球蛋白G. 2025年3月31日26 OPA GMTS(95% CI)1101001000100001000003 19F 15B 22F 33F 11A 10A 19A 18C 7F 48 6B 12F 9V 14 23F 5 6A 1 9N 20B 17F 2

PD4中期IGG免疫原性数据2025年3月31日27

VAX-24 PD4血清转换率在所有剂量中都有高IGG血清转换率VAX-24低剂量VAX-24中剂量VAX-24混合剂量PCV20 100806040200 PCV20非PCV20血清型中包含的血清型VAX-24和VAX-31中包含的血清群20抗原,以前称为20B变体,已正式重新分类为20C。有关血清群20的更多详细信息,请参见幻灯片7的脚注1。IGG =免疫球蛋白G. 2025年3月31日28%的受试者预定义IGG水平(> 0.35mCg/mL)3 19F 15B 22F 33F 11A 10A 19A 18C 7F 48 6B 12F 9V 14 23F 5 6A 1 9N 20C 17F 2

VAX-24显示出稳健的记忆反应– PD3与PD4 IGG GMCs在所有剂量下引发的稳健加强反应VAX-24中剂量后剂量3 VAX-24中剂量后剂量4血清型包含在PCV20非PCV20血清型中VAX-24和VAX-31中包含的血清群20抗原,以前称为20B变体,已被正式重新分类为20C。有关血清群20的更多详细信息,请参见幻灯片7的脚注1。IGG =免疫球蛋白G. 2025年3月31日29 IGG GMCs MCG/mLs(95% CI)05 10153 19F 15B 22F 33F 11A 10A 19A 18C 7F 48 6B 12F 9V 14 23F 5 6A 12 9N 17F 20C
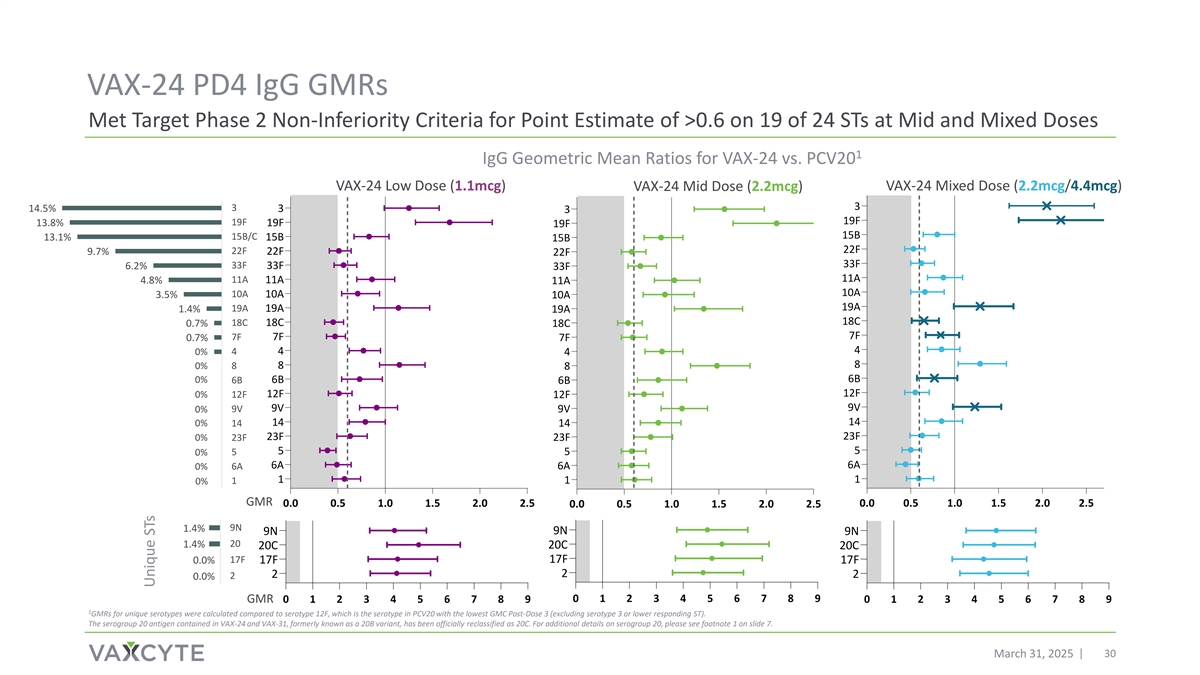
VAX-24 PD4 IGG GMRs在24个STs中的19个在中期达到了点估计> 0.6的目标阶段2非劣效性标准和混合剂量1 IGG几何平均比VAX-24对比PCV20 VAX-24低剂量(1.1mCg)VAX-24中剂量(2.2mCg)VAX-24混合剂量(2.2mCg/4.4mCg)314.5% 33 19F 19F 13.8% 19F 19F 15B 15B/C 13.1% 15B 15B 22F 22F 9.7% 22F 33F 33F 6.2% 33F 11A 4.8% 11A 11A 10A 10A 3.5% 10A 19A 19A 1.4% 19A 18C 18C 0.7% 18C 7F 7F 7F 0.7% 7F 440 % 4480% 888 6B 0% 6B 6B 6B 6B 12F 12F 0% 12F 12F 9V 9V 0%23F 550% 55 6A 6A 0% 6A 6A 1110% 115% 0% GMR 0.0 0.5 1.0 1.5 2.0 2.5 0.0 0.5 1.0 1.5 2.0 2.5 0.0 0.5 1.0 1.5 2.0 2.5 0.0 0.5 1.0 1.5 2.0 2.59N 1.4% 9N 9N 9N 201.4% 20C 20C 20C 17F 17F 0.0% 17F 17F 2220.0% 15% 10% 5% 0% 0123456789 GMR 012345678901 GMR针对独特的血清型与血清型12F进行了比较计算,后者是PCV20中GMC最低的剂量后3(不包括血清型3或更低应答ST)的血清型。VAX-24和VAX-31中含有的血清群20抗原,原名20B变异株,已被正式重新归类为20C。有关血清群20的更多详细信息,请参见幻灯片7的脚注1。2025年3月31日30款独特ST

规划婴儿第3期计划2025年3月31日31

VAX-24中剂量(2.2mCG)被选为推进基础,等待VAX-31第2阶段顶线数据读出,准备用于VAX-24的3期研究或VAX-31 PD3 IGG GMR PD3 IGG血清学转换PD4 IGG GMR占美国< 5岁儿童IPD的百分比33314.5% 3 19F 19F 19F 13.8% 19F 15B 15B 15B/C 13.1% 15B 22F 22F 22F 9.7% 22F 33F 33F 6.2% 33F 11A 11A 11A 4.8% 11A 10A 10A 10A 3.5% 10A 19A 19A 1.4% 19A 18C 18C 0.7% 18C 7F 8 7F 0.7% 7F 4440% 48 7F 80% 8 6B 6B 6B 0% 12F 12F 0% 12F 9V 9V 0% 9V 9V 14140 % 1414 23F 23F 23F 0% 23F 5550% 5 6A 0% 6A 6A 6A 10% 11115% 10% 5% 0%-30-30-15 01530450.0 0.5 1.0 1.5 2.0 2.5 0.0 0.5 1.0 1.5 2.0 2.5 9N 9N 9N 1.4% 9N 20C 2020C 1.4% 20C 17F 17F 0.0% 17F 17F 2220.0% 2-30-15 015304515% 10% 5% 0% 01234567890123456789主题会议百分比差异IGG几何均值比IGG几何均值比预先定义的IGG水平VAX-24和VAX-31中含有的血清群20抗原,以前称为20B变体,已被正式重新分类为20C。有关血清群20的更多详细信息,请参见幻灯片7的脚注1。2025年3月31日32款独特ST
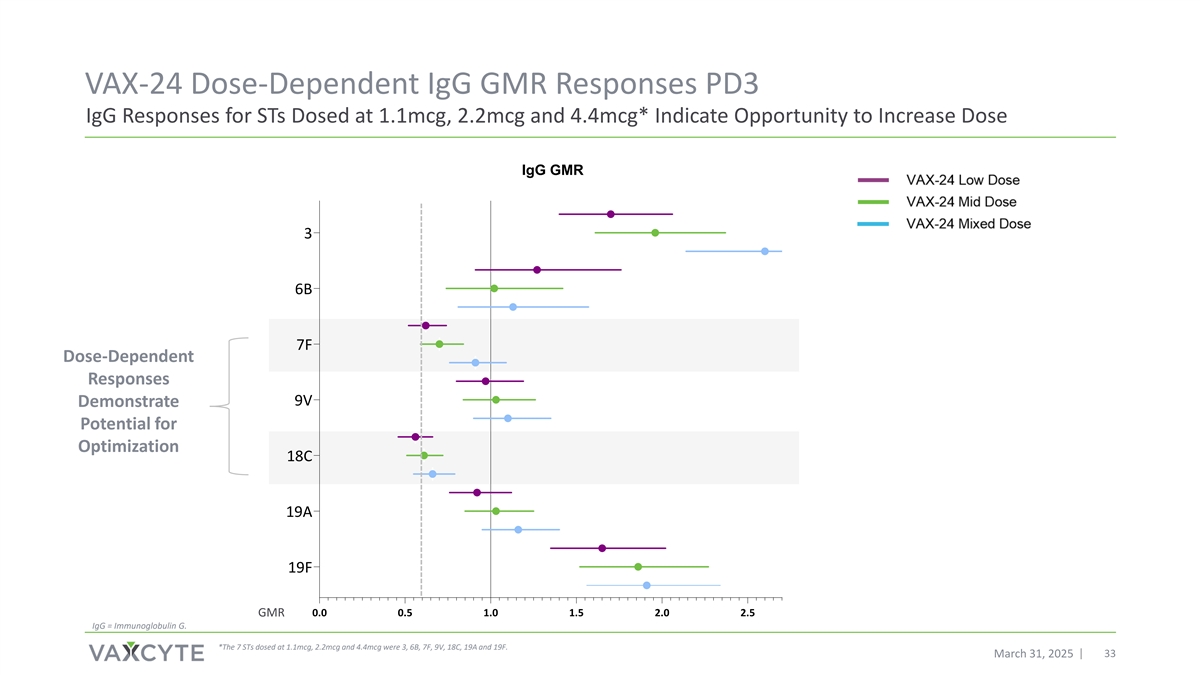
VAX-24剂量依赖性IGG GMR对剂量为1.1mCg、2.2mCg和4.4mCg的STs的PD3 IGG反应*指示机会增加剂量IGG GMR3 6B 7F剂量依赖性反应9V证明优化潜力18C 19A 19F GMR0.0 0.5 1.0 1.5 2.0 2.5 IGG =免疫球蛋白G。*在1.1mCg、2.2mCg和4.4mCg下给药的7种STs分别为3、6B、7F、9V、18C、19A和19F。2025年3月31日33

13个STs中剂量和混合剂量的IGG GMC在2.2mCg无载体抑制观察到表明有机会在剂量3后1个月增加剂量IGG几何平均浓度VAX-24中剂量VAX-24混合剂量VAX-24和VAX-31中包含的血清群20抗原,以前称为20B变体,已正式重新分类为20C。有关血清群20的更多详细信息,请参见幻灯片7的脚注1。342025年3月31日IGG GMCs MCG/ml(95% CI)0.11 10145 6A 8 10A 11A 12F 14 15B 22F 23F 33F 2 9N 17F 20C
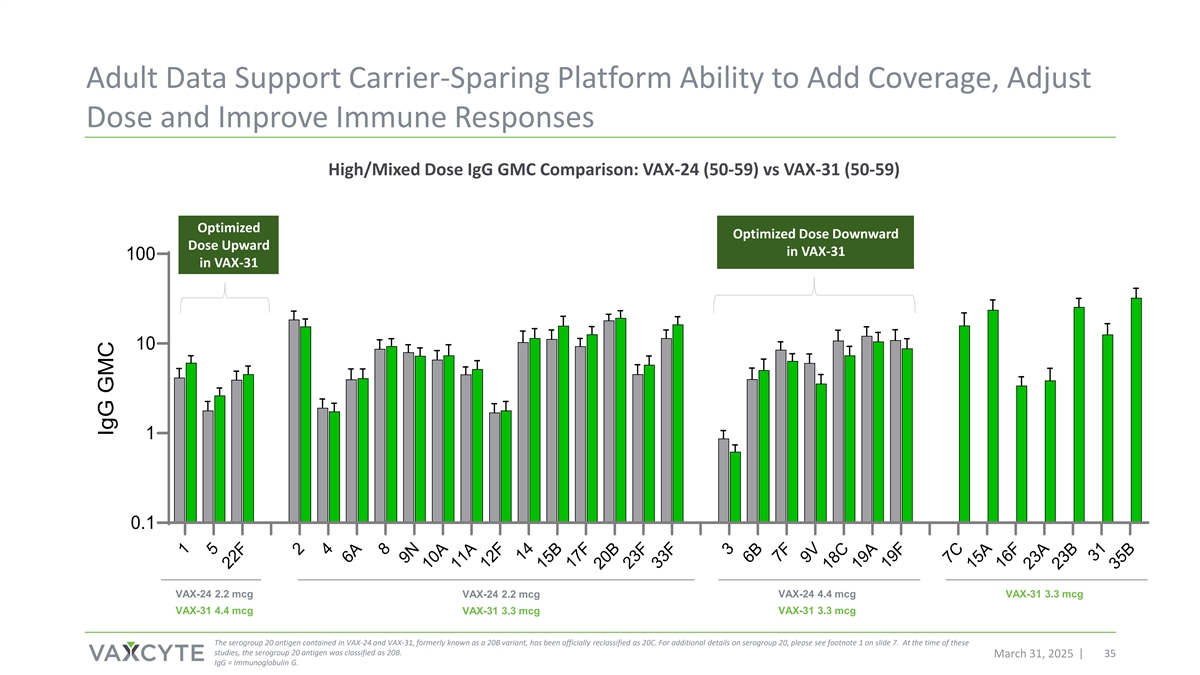
成人数据支持载体共享平台增加覆盖、调整剂量和改善免疫反应的Ability高/混合剂量IgG GMC比较:VAX-24(50-59)vs VAX-31(50-59)优化剂量VAX-31 100中向下剂量向上VAX-31 1010.1 VAX-24 2.2 mCG VAX-24 2.2 mCG VAX-24 4.4 mCG VAX-31 3.3 mCG VAX-31 4.4 mCG VAX-31 3.3 mCG VAX-31 3.3 mCG VAX-24和VAX-31中所含的血清群20抗原,原名为20B变体,已正式重新归类为20C。有关血清群20的更多详细信息,请参见幻灯片7的脚注1。在进行这些研究时,血清群20抗原被归类为20B。2025年3月31日35 IGG =免疫球蛋白G. 15 22F 24 6A 8 9N 10A 11A 12F 14 15B 17F 20B 23F 33F 3 6B 7F 9V 18C 19A 19F 7C 15A 16F 23A 23B 31 35B IGG GMC

VAX-24 2期婴儿研究结果和平台证明有潜力实现对任何婴儿PCV的最广泛覆盖上市一线研究结果积极且符合目标的安全性和耐受性特征类似于护理标准VAX-24引发了显着的IGG、OPA和记忆反应,并且对疫苗中包含的当前流行的血清型表现特别好显着、剂量依赖性免疫反应和几乎没有携带者抑制的证据观察到,随着我们在婴儿和成人中进入3期并引入我们的第三代PCV,我们坚信有可能提供最广谱PCV--VAX-XL 2025年3月31日36

PCV特许经营和管道更新2025年3月31日37

1临床开发下一步和预期里程碑成人和婴儿段人群研究性PCV关键预期里程碑的潜在同类最佳PCV特许经营权•在FDA第2阶段结束会议之后,在2025年年中启动第3阶段关键、VAX-31非劣效性研究,并在2026年公布一线安全性、31价PCV候选耐受性和免疫原性数据。•在2025年和2026年启动剩余的第3阶段研究,并在2026年和2027年公布这些研究的数据。成人•公布平衡的VAX-24 2期剂量发现研究数据,VAX-24包括最终安全性数据、完整的PD3 OPA数据,以及到2025年底的完整PD4 IGG和24价PCV候选药物OPA数据。•公布2026年年中VAX-31 2期剂量发现研究初级三剂量免疫31价PCV候选婴儿系列的顶线安全性、耐受性和免疫原性数据,最多9个月后有完整的加强数据。(一)截至2025年3月31日的指导意见2025年3月31日38
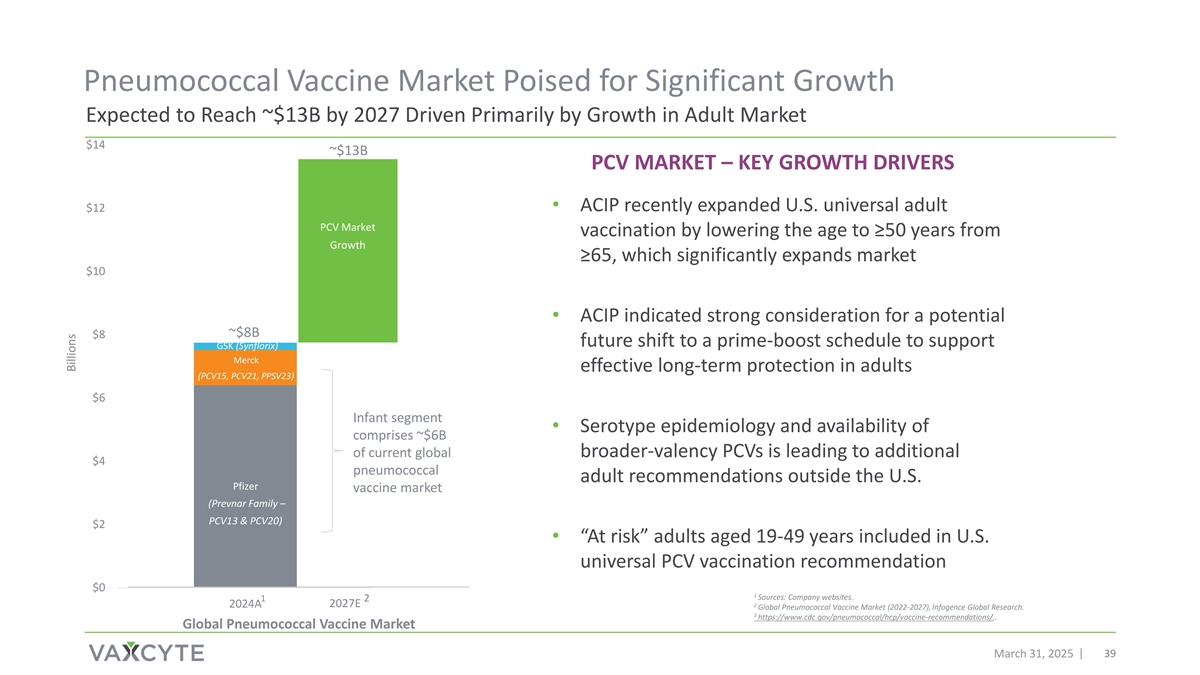
肺炎球菌疫苗市场有望实现显着增长,预计到2027年将达到~$ 13B,主要受成人市场增长的推动$ 14~$ 13B PCV市场–关键增长驱动因素$ 12 • ACIP最近扩大了美国通用成人其他PCV市场疫苗接种,将年龄从市场增长≥ 65岁降低到≥ 50岁,这显着扩大了市场增长$ 10 • ACIP表明强烈考虑未来潜在的~$ 8B $ 8转变为主要提振计划,以支持GSK(Synflorix)的默沙东在成人中提供有效的长期保护(PCV15、PCV21,PPSV23)6美元的婴儿部分•血清型流行病学和可用性包括目前全球范围内约6B美元的更广价PCV,这导致美国以外的肺炎球菌成人建议额外增加4美元的辉瑞疫苗市场(Prevnar Family – PCV13 & PCV20)2美元• 19-49岁“有风险”的成年人被纳入美国普遍PCV疫苗接种建议0美元1来源:公司网站。12 2024A 2027E 2全球肺炎球菌疫苗市场(2022-2027),Infogence全球研究。3 https://www.cdc.gov/pneumococal/hcp/vaccine-recommendations/,。全球肺炎球菌疫苗市场2025年3月31日39390亿

高保真疫苗管线广谱偶联及新型蛋白疫苗预防或治疗细菌性传染病临床前1期2期3期成人50 + 31价VAX-31婴儿PCV候选24价VAX-24婴儿PCV候选VAX-XL成人&婴儿VAX-XL PCV候选新型A组成人&婴儿VAX-A1链球菌疫苗新型治疗性VAX-成人PG牙周炎疫苗新型志贺氏菌疫苗VAX-GI成人&婴儿2025年3月31日40

管理层问答Grant Pickering Jim WassilAndrew Guggenhime首席执行官、董事执行副总裁兼首席总裁兼首席财务官和创始人运营官2025年3月31日41


附录幻灯片
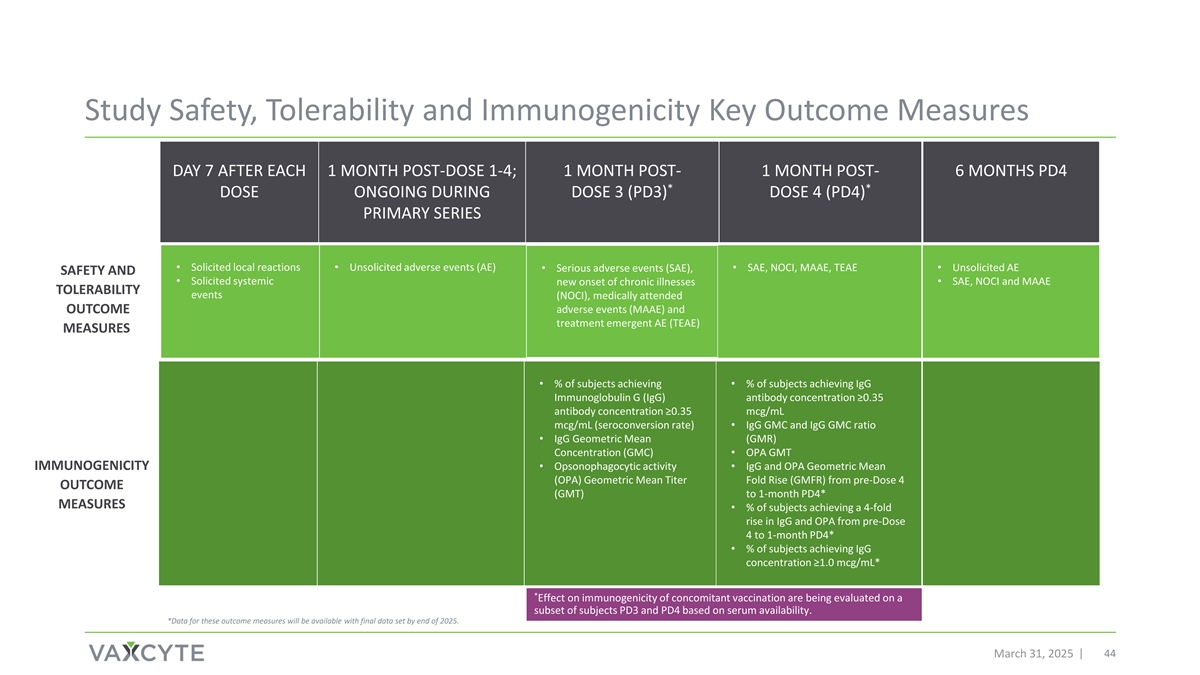
研究安全性、耐受性和免疫原性关键结果措施每日7后每1个月剂量后1-4;1个月后-1个月后-6个月PD4**DOSE 3(PD3)DOSE 4(PD4)Primary Series期间正在进行的剂量•征求当地反应•主动提出的不良事件(AEE)• SAE、NOCI、MAAEE、TEAEE •主动提出的AEE •严重不良事件(SAE)、安全性和•征求全身性新发慢性病• SAE、NOCI和MAAEE耐受性事件(NOCI),就诊的不良事件(MAAEE)和结果治疗紧急AEE(TEAEE)措施•%的受试者达到•%的受试者达到IGG免疫球蛋白G(IGG)抗体浓度≥ 0.35抗体浓度≥ 0.35 mCg/mL mCg/mL(血清转化率)• IGG GMC和IGG GMC比值• IGG几何平均(GMR)浓度(GMC)• OPA GMT免疫原性•调理吞噬细胞活性• IGG和OPA个月PD4的几何平均滴定倍数上升(GMFR)*措施•%的受试者实现了IGG的4倍增长和从pre-dose 4到1个月PD4的OPA*•%的受试者达到IGG浓度≥ 1.0mCg/mL**正在根据血清可用性对一部分受试者PD3和PD4进行评估,以评估伴随接种对免疫原性的影响。*到2025年底,这些成果措施的数据将与最终数据集一起提供。2025年3月31日44