由Good Works II Acquisition Corp.存档
根据1933年《证券法》第425条,
经修订并被视为依据
根据1934年《证券交易法》第14a-12条,
经修正
标的公司:Good Works II Acquisition Corp.
(委员会档案编号001-40585)
日期:2023年1月25日

下一代救生解决方案公司概览– 2023年1月

免责声明2 Direct Biologics本演示文稿(“演示文稿”)仅供参考,以帮助相关各方自行评估Direct Biologics,LLC(一家怀俄明州有限责任公司(“Direct Biologics”)B类单位的拟议发售(“发售”)。Good Works II Acquisition Corp.(“Good Works II”)与公司之间拟议的业务合并(“业务合并”)(“目的”)的完成,与公司本次发行相关,但不以此为条件,也不以此为条件。接受者接受本演示文稿,即承认并同意本演示文稿中所包含的所有信息都是保密的,接受者将仅为此目的分发、披露和使用此类信息,并且接受者不得以任何方式分发、披露或使用此类信息损害直接生物制剂或良好产品。此处包含的信息并非包罗万象,Good Works、Direct Biologics和IB Capital,LLC(“IBC”)或其任何关联公司或其任何控制人、高级职员、董事、雇员或代表均未就本演示文稿中包含的信息的准确性、完整性或可靠性作出任何明示或暗示的陈述或保证。你应就与本文所述事项有关的法律和相关事项咨询你自己的律师及税务和财务顾问,并通过接受本演示文稿,确认你不依赖本文所载的信息来作出任何决定。在此设想的任何交易中提供的任何证券均未根据经修订的1933年《证券法》(《证券法》)或任何适用的国家或外国证券法进行登记。在此设想的任何交易中提供的任何证券未经证券交易委员会(“SEC”)、任何州证券委员会或其他美国或外国监管机构的批准或不批准,将仅依据《证券法》规定的登记要求豁免和根据《证券法》颁布的规则和条例(包括《证券法》规定的条例D或S)提供和出售。本陈述不构成或不构成在任何国家或其他司法管辖区向在该国家或司法管辖区向其提出此种要约或邀约为非法的任何人发出的出售要约或邀约的一部分。本演示文稿中的某些陈述可被视为前瞻性陈述。前瞻性陈述通常涉及未来事件或Direct Biologics或Good Works的未来财务或经营业绩。例如,有关以下方面的陈述包括前瞻性陈述:Direct Biologics识别、开发和商业化候选产品的能力;关于Direct Biologics候选药物的研发活动、临床前或临床试验的启动、成本、时间、进展和结果;未来收入、费用、资本要求和额外融资需求;市场机会预测;公司候选产品的治疗潜力;融资和其他业务里程碑以及拟议业务合并对Good Works和Direct Biologics及相关筹资活动的潜在影响。在某些情况下,您可以通过诸如“可能”、“应该”、“预期”、“打算”、“将”、“估计”、“预期”、“相信”、“预测”、“计划”、“潜在”或“继续”等术语来识别前瞻性陈述,或者这些术语的否定词或它们的变体或类似术语。此类前瞻性陈述受风险、不确定性和其他因素的影响,这些因素可能导致实际结果与此类前瞻性陈述明示或暗示的结果大不相同。这些前瞻性陈述所依据的估计和假设虽然Good Works及其管理层和Direct Biologics及其管理层(视情况而定)认为是合理的,但本质上是不确定的。新的风险和不确定性可能不时出现,不可能预测所有的风险和不确定性。可能导致实际结果与当前预期存在重大差异的因素包括但不限于Direct Biologics管理层无法控制的各种因素,包括一般经济和地缘政治条件,以及与Direct Biologics等公司相关的因素,这些公司在生物制药行业从事临床前研究和其他研发活动,包括临床前研究和临床试验的时间或结果的不确定性, 竞争性候选产品的影响;获得足够材料供应的能力;产品接受和/或收到候选产品的监管批准,包括Covid-19大流行造成的任何延误和其他影响。本演示文稿中的任何内容都不应被视为任何人表示将实现本文所述的前瞻性陈述或将实现此类前瞻性陈述的任何预期结果。您不应依赖本演示文稿中的前瞻性陈述,这些陈述仅在发表之日发表,并通过参考本文中的警示性陈述对其全部内容进行限定。Good Works和Direct Biologics都不承担更新这些前瞻性陈述的责任。本介绍中所载的某些信息涉及或基于研究、出版物、调查和Direct Biologics自己的内部估计和研究。此外,本介绍中所包括的所有市场数据都涉及一些假设和限制,不能保证这些假设的准确性或可靠性。最后,尽管Direct Biologics相信其内部研究是可靠的,但此类研究尚未得到任何独立来源的证实。本演示文稿和在任何会议上传达的与您对业务组合的评估有关的任何信息都是严格保密的,不应在您的组织之外讨论。IBC是i-Bankers Securities,Inc.的附属公司,在与业务合并有关的筹资活动中担任配售代理(连同其附属公司、合伙人、董事、代理、雇员、代表和控制人,即“配售代理”)。配售代理仅作为Direct Biologics与潜在交易相关的配售代理(为免生疑问,不作为承销商、初始购买者、交易商或任何其他主要身份)行事。放置代理没有独立验证任何信息包含在这里或任何其他信息,已经或将提供给您。本协议或提供给你们的任何其他口头或书面信息中所载的任何内容都不是,也不应被视为配售代理、Good Works或Direct Biologics对过去或未来的任何承诺或陈述。在不受上述限制的情况下,任何配售代理、Good Works或Direct Biologics均不对本协议所载的任何信息或已经或将要提供给本协议的任何信息,或在此之前或之后采取或不采取的与本次潜在交易有关的任何行动向本协议所载的任何信息或任何潜在投资者或任何其他人承担责任。分发本演示文稿的唯一目的是考虑到成熟的潜在购买者,他们是合格投资者,包括机构投资者,他们是合格投资者,在投资、财务和商业事项方面有足够的知识和经验,并有能力就此目的进行自己的尽职调查和评估。本演示文稿并不旨在概述Good Works或Direct Biologics投资的所有条件、风险和其他属性。此处包含的信息将被提供给您的与此目的相关的任何其他信息所取代,并通过引用对其进行整体限定,包括您对Good Works和Direct Biologics的调查。提供Direct Biologics的B类单位的目的是为了完成拟议的业务合并,但不以完成拟议的业务合并为条件或条件。在这方面,Direct Biologics和Good Works打算达成业务合并或类似协议,而Good Works或一个即将成立的实体打算向SEC提交一份S-4表格的登记声明,据此,在交易完成后,每个B类单位将被注销,并转换为新成立的公司或在国家证券交易所上市的其他商业实体的若干股本。参加征求意见的人。Good Works及其董事和执行人员可被视为参与就拟议的业务合并向Good Works的股东征集代理权。这些董事和高管的名单以及他们在Good Works的权益描述载于Good Works于2021年7月13日首次公开发行的最终招股说明书中, 已向美国证券交易委员会提交,可在美国证券交易委员会网站www.sec.gov上免费查阅。有关这些参与者利益的更多信息将载于拟议业务合并的代理说明/招股说明书(如果有的话)。

发行摘要3直接生物制剂私募发行摘要发行人•直接生物制剂,有限责任公司发行规模•不超过1亿美元(包括500万美元的IB1(1)投资)预估值•5亿美元(较6.25亿美元的预期公开市场估值折让20%)潜在收益• 5000万美元(500万股)潜在收益取决于在2023年底之前达到第3阶段ExtingGuish试验的主要终点•3.5亿美元(3500万股)的潜在收益取决于BLA的批准到2024年底,ExoFlo TM或EUA证券•有限责任公司的股权(按每股10.00美元的隐含市价折让20%发行)投资细节•有限责任公司单位将在拟议的de-SPAC交易结束后交换为记名股票(受锁定期限制)• IB1(1)已在私募中投资500万美元时间•私募以滚动方式结束拟议中的de SPAC交易预计将于2023年上半年完成de SPAC交易综述• Direct Biologics已与Good Works II收购公司(Nasdaq:Good Works II)(GWII)签订业务合并的最终协议• Good Works II是一家SPAC,信托现金约为2500万美元,可能会进一步赎回,最低现金条件• Good Works II信托账户的资金(在赎回生效并支付所有交易费用和开支后),连同本次定向增发的净收益,至少7500万美元选定的缩写:BLA =生物制品许可证申请;EUA =紧急使用授权;IB1 = IB Investments 1 LLC。1 IB1(IB Investments 1 LLC)是I-Bankers Securities,Inc.的附属公司,由配售代理IB Capital,LLC的首席执行官所有。IB1的投资没有支付安置费。

直接生物制剂单位说明的私募发行前-美元(卖方权益)私募发行后-美元完全稀释后的直接生物制剂单位(百万)113.12 2.61 35.7每单位私募价格(较去SPAC交易价格折让20%)4.424.42美元私募目的价值(百万美元)500100美元600美元转换比率0.553 Good Works II股份说明的私募发行前-美元(卖方权益)私募发行后-美元Good Works II股份(百万)62.5 12.575.0每股价格私募(de-SPAC交易价格折让20%)8.008.00美元私募价值(百万美元)500100600美元De-SPAC交易价值De-SPAC交易每股价格价值用于De-SPAC交易(百万美元)10.00美元10.00美元625125美元750美元私募发行-详细概述4 Direct Biologics不包括在2023年底之前达到ExtingGuish 3期试验主要终点的5000万美元潜在收益,也不包括在2024年底之前达到ExoFlo TM的BLA批准或EUA的3.5亿美元潜在收益。
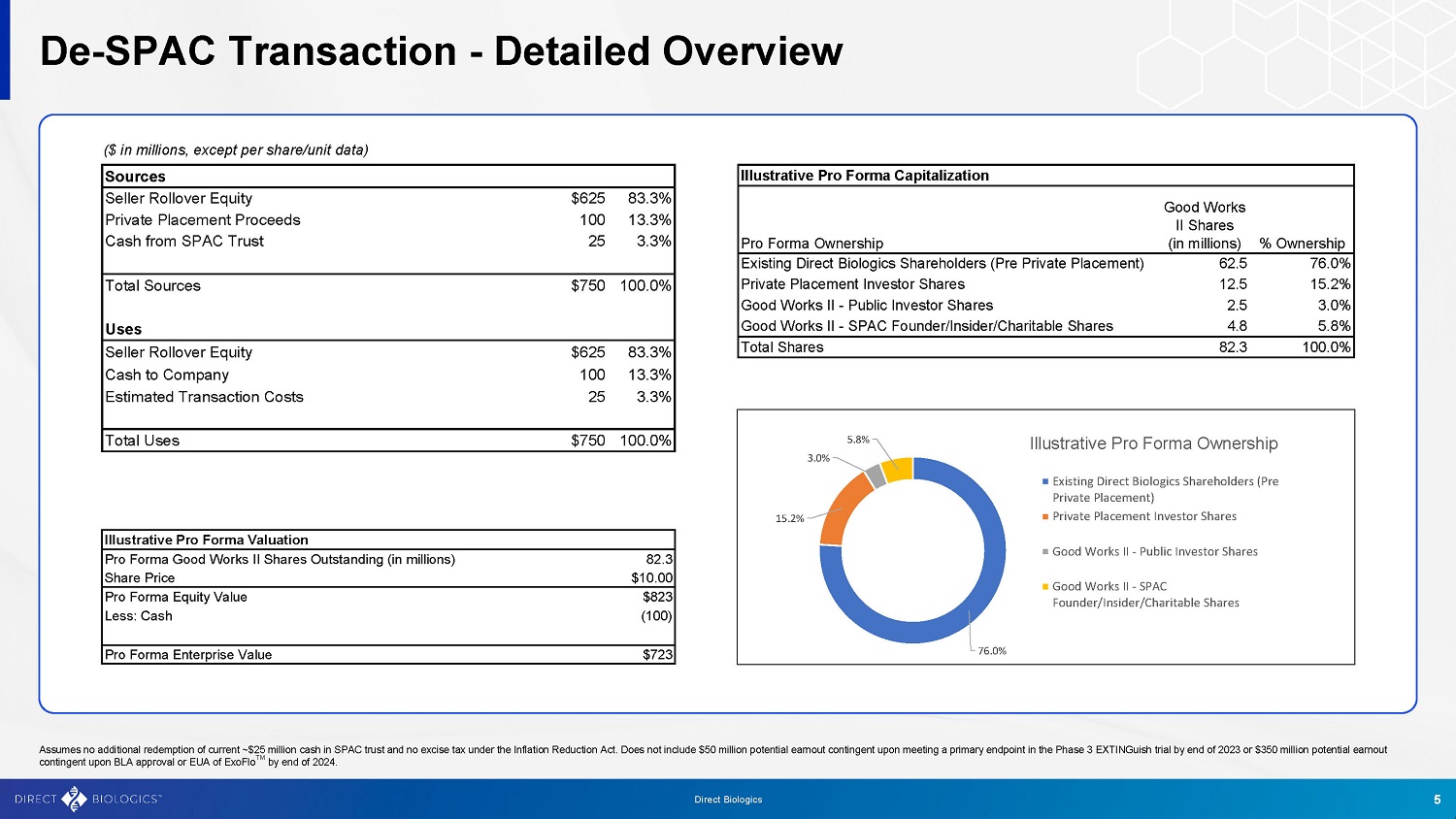
Sources卖方展期股权62583.3%私募股权收益10013.3% SPAC信托现金253.3%资源总计使用750100.0%卖方展期股权62583.3%公司现金10013.3%预计交易成本253.3%总计使用750100.0%说明性备考资本化Good W备考所有权Direct Biologics的现有股东(PriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPriPri72315.2% 3.0% 5.8%说明性形式所有权现有Direct Biologics股东(预私募)私募投资者Good Works II-公众投资者股份Good Works II-SPAC Founder/内部人士/慈善机构股份76.0% De SPAC交易-详细概述5 Direct Biologics假设不会额外赎回当前SPAC信托中的约2500万美元现金,也不会根据《降低通货膨胀率法案》征收消费税。不包括在2023年底之前达到ExtingGuish 3期试验主要终点的5000万美元潜在收益,或在2024年底之前获得ExoFlo TM的BLA批准或EUA的3.5亿美元潜在收益。(百万美元,每股/单位数据除外)

公司机密公司概况

概述谁是我们的使命价值主张后期生物技术公司专注于引导医学的下一个范式转变,其新的潜在治疗平台称为细胞外囊泡(EV);该平台包括一种干细胞疗法,没有细胞、DNA或线粒体,通过利用再生EV技术的自然力量,彻底改变全球患者的护理标准(SoC)ExoFlo TM的开发和商业化,ExoFlo TM是第一个MSC衍生的EV治疗候选者,在3期临床开发中,通过制造、研发和质量保证方面的专业知识,临床运营和监管事务7 Direct Biologics

Ali Betancourt,博士,首席科学官Amy Lightner,医学博士,首席医疗官Tim Moseley,博士,首席技术官John Vacalis,JD首席法务官执行副总裁 Jeff Mims 首席财务官 8 Direct Biologics JDJoe Schmidt总裁兼FounderTERM0 Mark Adams首席执行官兼Founder

主要投资亮点源自骨髓间充质干细胞(bmMSCs)的专有细胞外囊泡(EV)平台技术ExoFlo TM是一种从人bmMSCs中分离出来的候选治疗药物,其中含有生长因子和EV,包括外泌体9 Direct Biologics正在进行的Covid-19急性呼吸窘迫综合征(ARDS)的“ExtingGuish Covid-19”3期临床试验,随着计划于2023年提交生物制品许可申请(BLA)和紧急使用授权(EUA),ExoFlo在其他炎症和组织修复适应症方面未来潜在的广泛机会最近启动的研究性新药(IND)在溃疡性结肠炎和克罗恩病方面的临床试验以及在全因ARDS和腹部实体器官移植方面的近期临床试验

ExoFlo TM ExoFlo是一种先进的下一代生物制剂,利用公司专有的EV平台技术来源:从人类bmMSCs中分离的EV成分:含有1,000 +调节趋化因子和其他自然信号的脂质纳米囊泡,包括mRNA和miRNA机制:减少炎症,通过激活自我修复途径来修复组织,并在细胞水平上促进愈合选定的缩写:bmMSC =骨髓间充质干细胞;EV =细胞外囊泡;miRNA =微核糖核酸;mRNA =信使核糖核酸。10直接生物制剂

ExoFlo TM ExoFlo是一种有效的非细胞EV产品候选者,具有抗炎、非免疫原性,旨在绕过传统干细胞疗法的缺陷,EV绕过了传统干细胞疗法的缺陷• bmMSCs分泌的EV可以复制与MSCs相似的生物活性,而无需移植MSCs本身• ExoFlo中的EV体积小,可避免毛细血管血栓形成,但仍是强大的抗炎和非免疫原性治疗信号•电动汽车具有多种调节蛋白,可刺激正常愈合过程中的许多过程,级联电动汽车源自人类骨髓间充质干细胞,在免疫调节和再生中发挥着关键作用•临床医生越来越认识到,移植的骨髓间充质干细胞的机制不是在目标组织中植入或分化,而是被称为旁分泌信号的细胞间通讯• ExoFlo包含1000多种生长因子和趋化因子,包括外泌体,递送MSCs分泌的mRNA和miRNA • EV是抗炎反应、免疫调节、组织再生和修复的旁分泌介质EV调节免疫反应并促进组织修复• ExoFlo提供的分子和蛋白质信号已被证明可以刺激生物活性和直接细胞通讯•通过激活和招募局部细胞,ExoFlo可以减少过度活跃的炎症反应并恢复愈合选定的缩写:bmMSC =骨髓间充质干细胞;EV =细胞外囊泡;miRNA =微核糖核酸;mRNA =信使核糖核酸;MSC =间充质干细胞。11直接生物制剂

弗吉尼亚母亲在进入Covid-19诱导昏迷状态后与新生儿团聚(1)ExoFlo TM for Compassionate Use选定的缩写:EV =细胞外囊泡;FDA =食品和药物管理局;MSC =间充质干细胞。ExoFlo是一种研究性产品,其安全性和有效性将继续在正在进行或计划进行的临床试验中进行评估。上述经验可能不代表研究产品的其他经验或未来经验。ExoFlo尚未获准在任何司法管辖区使用,今后可能也不会使用。1请参阅https://www.fox5dc.com/news/virginia-mother-reunited-with-新生儿-after-going-in-coma-due-to-covid-19,其中包括更多信息。2请参阅https://my.clevelandclinic.org/patient-stories/581-男人-经历-世界上第一次-多器官-移植-治疗-罕见-阑尾-癌症,其中包括更多信息。Alma Zepeda Andy Voge Cleveland诊所进行了世界上首例全多器官移植治疗罕见的阑尾癌(2)”“安迪接受了由[克利夫兰诊所再生医学和外科中心的莱特纳博士]完善和实施的手术。她使用了MSC衍生的[ EV ],这是一种用于实体器官移植的……新疗法。”12直接生物制剂

临床管线ARDS GI ExoFlo TM适应症发现/临床前1期2期3期预期里程碑(1)由Covid-19诱发的中度至重度ARDS EXTINGuish COVid-19将于2022年第三季度开始第3期试验;计划于2022年第三季度开始和EUA于2023年提交全因ARDS EX ARDS于2023年第一季度启动Ph 2溃疡性结肠炎(2)于2022年第四季度启动Ph 1;预计于2023年第三季度完成Ph 1的注册(克罗恩病)(2)于2022年第四季度启动Ph 1;预计于2023年第三季度完成Ph 1的注册(3)于2023年第一季度启动实体腹部器官移植(3)于2023年第一季度启动扩展访问选定的缩写:ARDS =急性呼吸窘迫综合征;BLA =生物制品许可证申请;EUA =紧急使用授权。1仅为估计日期;实际里程碑可能大不相同。2医学上难治。3单独使用常规免疫抑制疗法有导致同种异体移植功能恶化的风险。13直接生物制剂
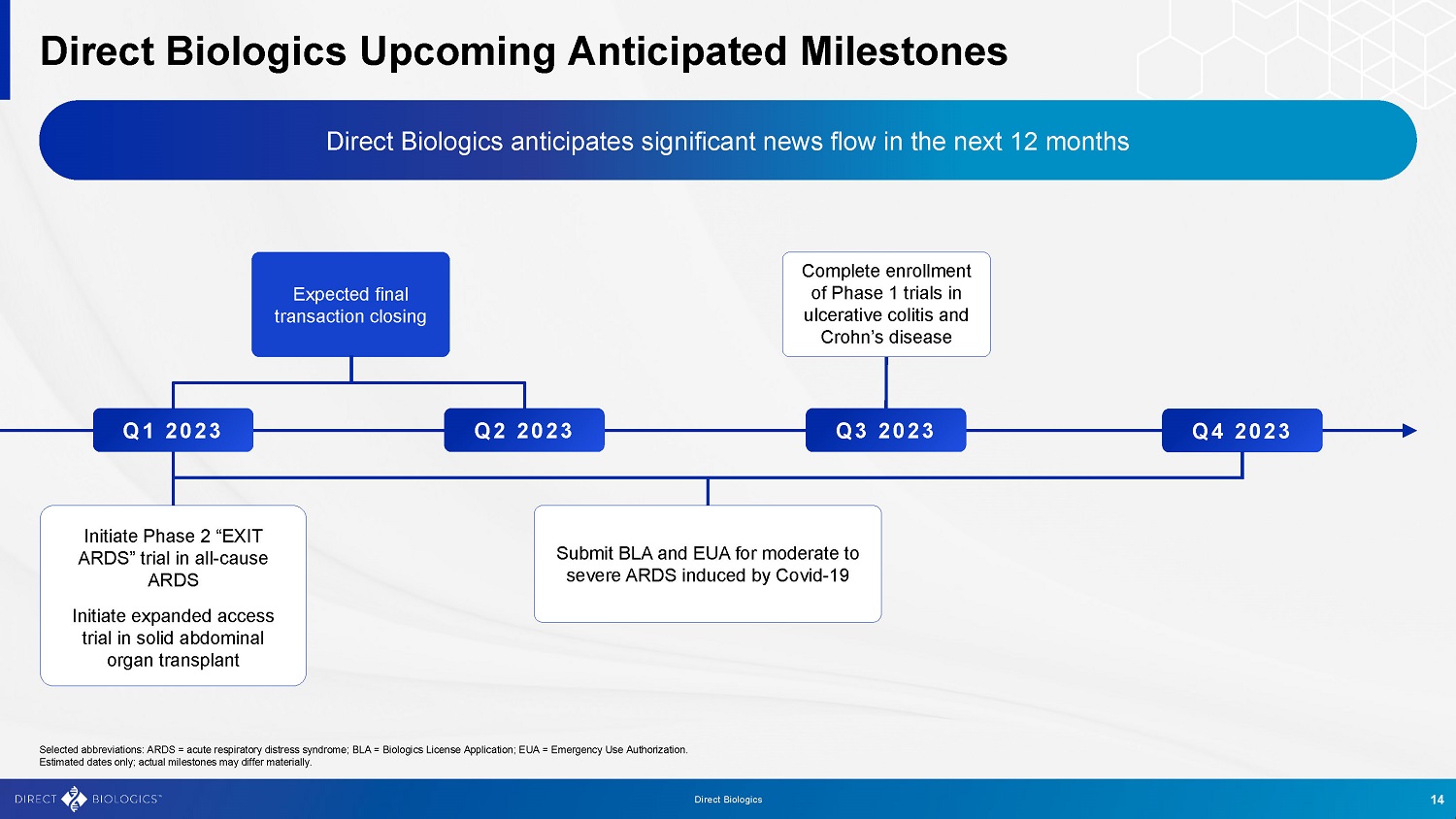
Direct Biologics即将迎来预期里程碑Direct Biologics预计未来12个月内会有大量新闻Q42023选定缩写:ARDS =急性呼吸窘迫综合征;BLA =生物制品许可证申请;EUA =紧急使用授权。仅为估计日期;实际里程碑可能大不相同。q 22023 q 32023提交BLA和EUA用于Covid-19诱发的中度至重度ARDS Init i i a nt i e ti a d t e P h P a h s a e s a e s e 12 tr i“a e x i n it a u r l d c e s r”a t t i r v i a e l c i n o l a i t l s-cause initiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiatiat腹腔实体器官移植中的p d a i n s e d a e s d a c cess试验Q 12023预期最终交易完成溃疡性结肠炎和克罗恩病的1期试验14直接生物制剂

治疗Covid-19所致ARDS的公司机密ExoFlo TM
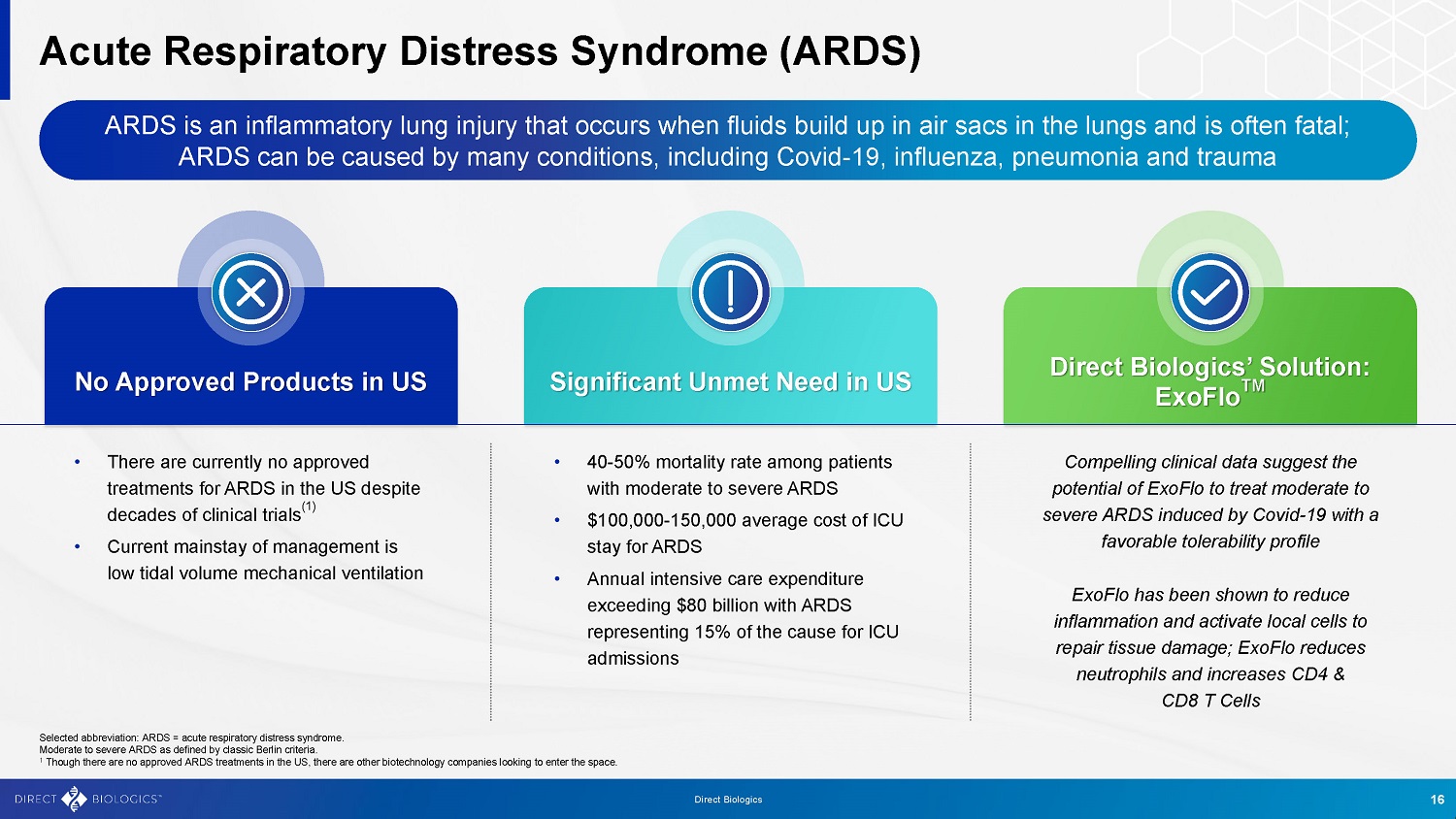
急性呼吸窘迫综合征(ARDS)ARDS是一种炎症性肺损伤,当液体在肺部气囊中积聚时会发生,通常会致命;ARDS可由多种疾病引起,包括Covid-19、流感,肺炎和创伤在美国未获批准产品美国直销生物制剂公司的解决方案存在重大未满足需求:ExoFlo TM •中重度ARDS患者的死亡率为40-50 % •治疗ARDS的ICU平均费用为100000至150000美元•每年的重症监护支出超过800亿美元,ARDS占ICU入院原因的15%,令人信服的临床数据表明,ExoFlo在治疗由Covid-19诱发的中度至重度ARDS方面具有潜力,且已被证明具有良好的耐受性并激活局部细胞以修复组织损伤;ExoFlo可减少中性粒细胞并增加CD4 & CD8 T细胞•尽管美国进行了数十年的临床试验,但目前还没有批准用于ARDS的治疗方法(1)•目前主要的治疗方法是低潮气量机械通气。选定的缩写:ARDS =急性呼吸窘迫综合征。按照柏林经典标准定义的中度至重度ARDS。1虽然美国还没有批准的ARDS治疗方法,但仍有其他生物技术公司希望进入这一领域。16直接生物制剂
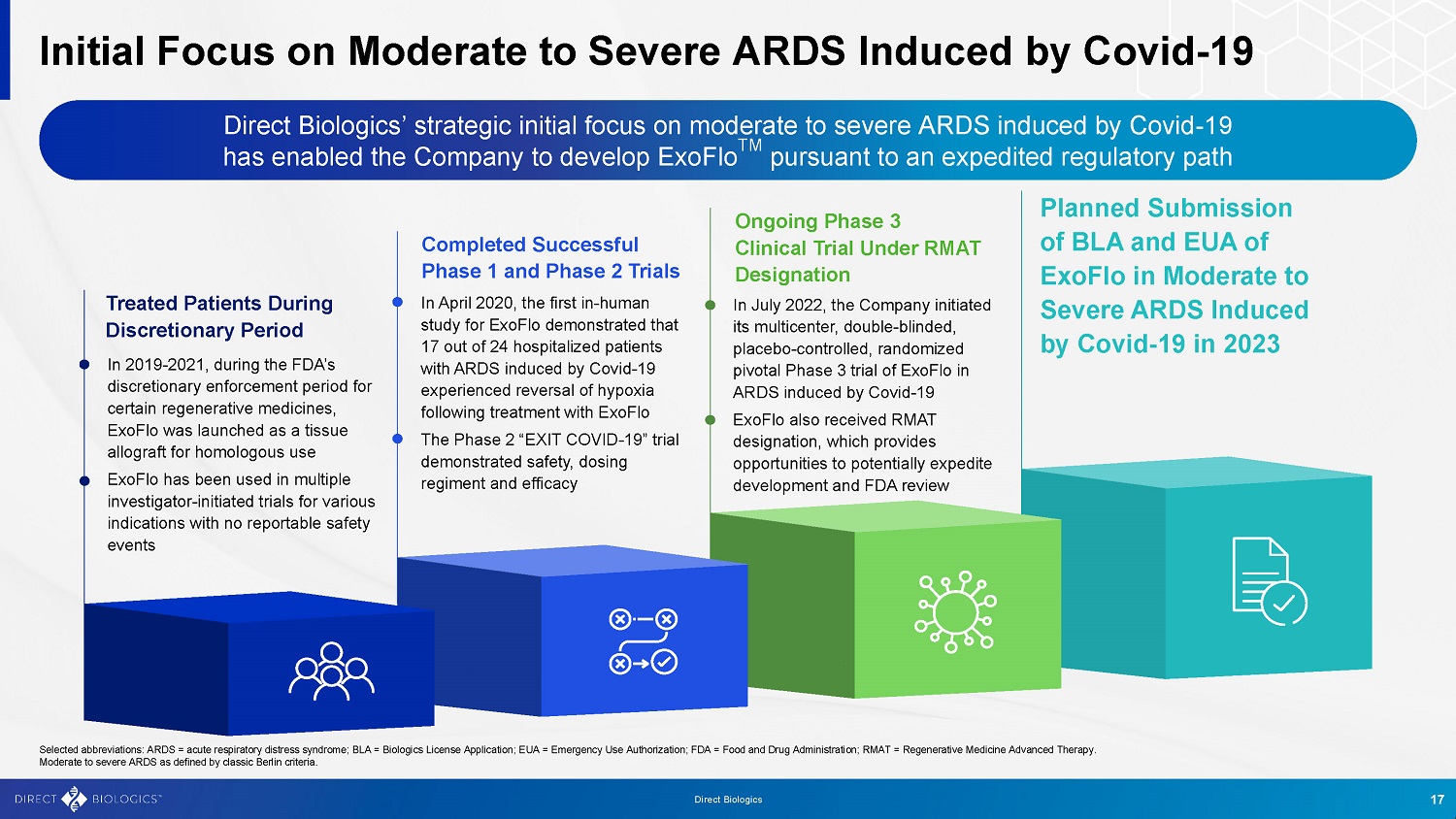
初步关注由Covid-19引起的中度至重度ARDS Direct Biologics最初的战略重点是由Covid-19引起的中度至重度ARDS,这使该公司能够根据加速监管路径开发ExoFlo TM,在酌情决定期内治疗患者• 2019-2021年,在FDA对某些再生药物的酌情执行期内,ExoFlo作为一种同种异体组织移植物上市• ExoFlo已被用于多个研究者发起的针对各种适应症的试验,没有可报告的安全性事件,成功完成了1期和2期试验• 2020年4月,ExoFlo的首次人体研究表明,在24名因Covid-19诱发的ARDS住院患者中,有17名在使用ExoFlo治疗后出现了缺氧逆转•“Exit Covid-19”2期试验证明了安全性、剂量组合和有效性,正在进行的RMAT指定的3期临床试验于2022年7月进行,公司启动了ExoFlo治疗Covid-19诱发的ARDS的多中心、双盲、安慰剂对照、随机关键3期试验• ExoFlo还获得了RMAT指定,这为潜在地加快开发和FDA审评提供了机会ExoFlo的BLA和EUA计划于2023年在Covid-19诱发的中度至重度ARDS中提交17 Direct Biologics选定缩写:ARDS =急性呼吸窘迫综合征;BLA =生物制品许可证申请;EUA =紧急使用授权;FDA =食品药品监督管理局;RMAT =再生医学高级疗法。按照柏林经典标准定义的中度至重度ARDS。
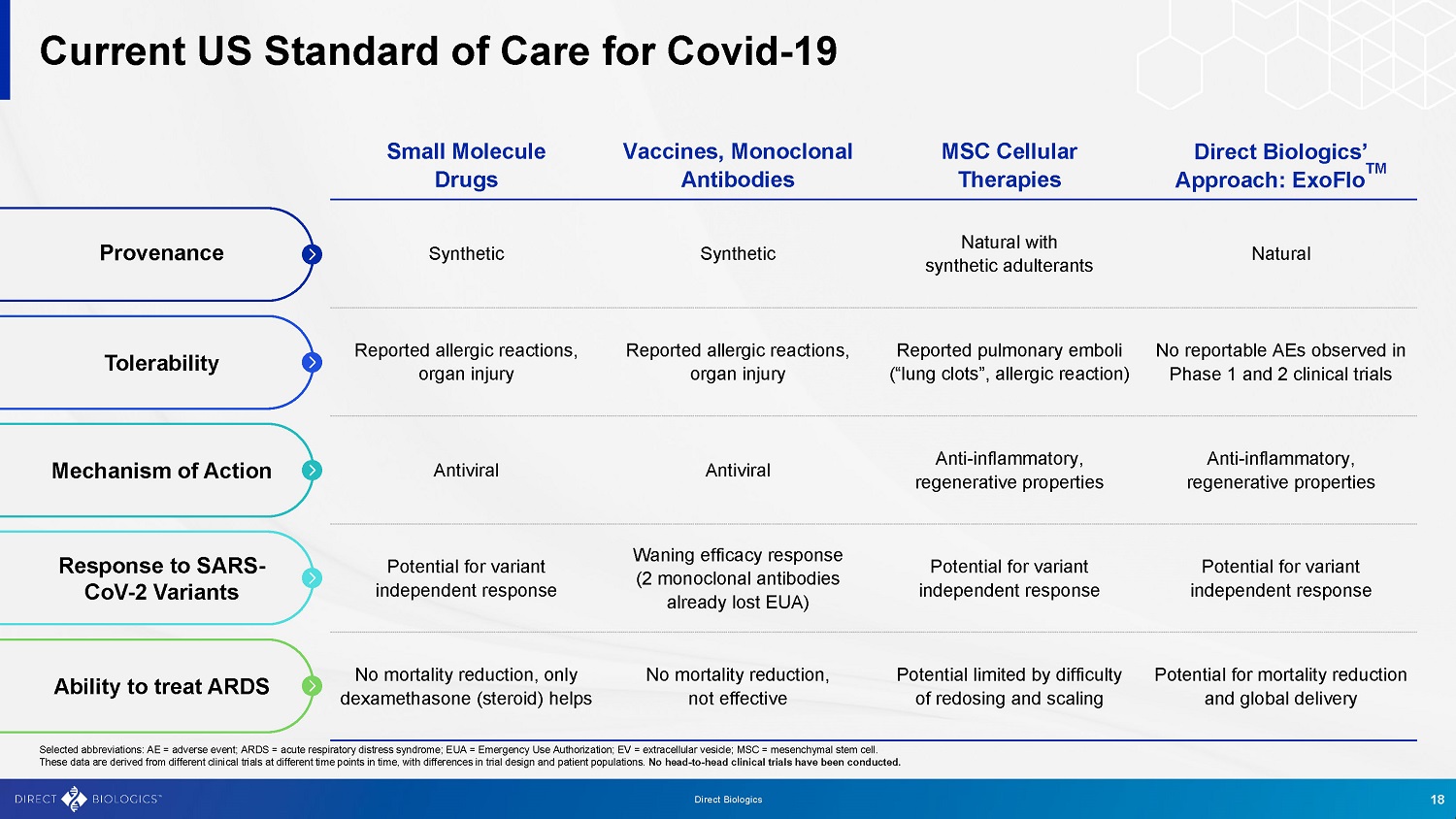
美国目前的Covid-19小分子药物疫苗、单克隆抗体MSC细胞疗法直接生物制剂的方法:ExoFlo TM合成合成天然与合成掺杂物天然报告的过敏反应、器官损伤报告的过敏反应、器官损伤报告的肺栓塞(“肺血栓”、过敏反应)在1期和2期临床试验中未观察到可报告的AE抗病毒抗病毒抗炎、再生特性抗炎、再生特性变异独立应答的潜在可能性减弱(2个单克隆抗体已经失去EUA)变异独立应答的可能性变异独立应答的可能性死亡率没有降低,仅有地塞米松(类固醇)有帮助不会降低死亡率,效果不佳受重新给药和缩放困难的限制降低死亡率的潜力和全球给药来源耐受性作用机制对SARS-CoV-2变体的反应能力治疗ARDS选定的简称:AE =不良事件;ARDS =急性呼吸窘迫综合征;EUA =紧急使用授权;EV =细胞外囊泡;MSC =间质干细胞。这些数据来自不同时间点的不同临床试验,试验设计和患者群体存在差异。没有进行过头对头的临床试验。18直接生物制剂

退出Covid-19:2期试验结果比较2期试验结果表明,ExoFlo TM治疗由Covid-19引起的ARDS的效果可能比Remdesivir和Tocilizumab更好。这些数据来自不同时间点的不同临床试验,试验设计和患者群体存在差异。没有进行过头对头的临床试验。1数据基于对基线时氧气需求与退出COVID-19的患者相似的亚组患者的事后分析。2 Beigel JH,et al. Remdesivir for the Treatment of Covid-19-Final Report。N Engl J Med。2020年11月5日;383(19):1813-1826。3 Rosas IO等人Tocilizumab在重症Covid-19肺炎住院患者中的应用。N Engl J Med。2021年4月22日;384(16):1503-1516。ExoFlo 30天死亡率Tocilizumab 28天死亡率(3)Remdesivir 29天死亡率(1)(2)ExoFlo 60天死亡率绝对风险降低-1.4 %-0.3 % 8.8% 17.7%相对风险降低-7.2 %-1.5 % 24.9% 37.6% 19直接生物制剂

ExoFlo TM中级人群扩大准入协议•由独立的DSMB对前50名患者进行安全性分析•没有与ExoFlo相关的SAE •还进行了特别疗效分析,结果显示26名患者出现了以下结果• 30天死亡率为25.8%,超过了45%至55%或更高的历史SoC死亡率• PaO2/FiO2的7天变化为+ 132 mmHg,反映氧合作用的改善• TTD中位数:6.8天•未插管患者的VFD:43.6天•未插管患者中进行插管的比例:8.3%数据读出(1)(2)迄今为止的正面数据•公司正在积极招募ExoFlo在成人Covid中的开放标签临床试验-根据FDA授权的扩大准入协议,19名中度至重度ARDS患者•一项单臂研究,符合条件的患者接受最多3剂大剂量的ExoFlo静脉注射,每72小时给药•终点包括60天死亡率、7天PaO2/FiO2、TTD、VFD的变化以及SAE的发生率•为每位患者评估安全性背景和方法开放标签,迄今为止,对Covid-19诱发的中度至重度ARDS患者的同情使用研究证明了这些患者的积极结果。选定的简称:ARDS =急性呼吸窘迫综合征;DSMB =数据和安全监测委员会;FDA =食品药品监督管理局;mmHg =毫米汞柱;PaO2/FiO2 =动脉血氧分压与吸入氧分数;SAE =严重不良事件;SoC =护理标准;TTD =出院时间;VFDs =无呼吸机天数。按照柏林经典标准定义的中度至重度ARDS。160由于疗效分析的时间安排,数据读出中未显示60天死亡率;60天死亡率预计在未来某个日期出现。2扩大准入试验的资格部分是根据由于疾病严重程度高而被排除在2期试验之外的患者而确定的。因此,扩大准入范围内的患者天生就有更严重的疾病。20直接生物制剂

公司机密附加ExoFlo TM临床试验
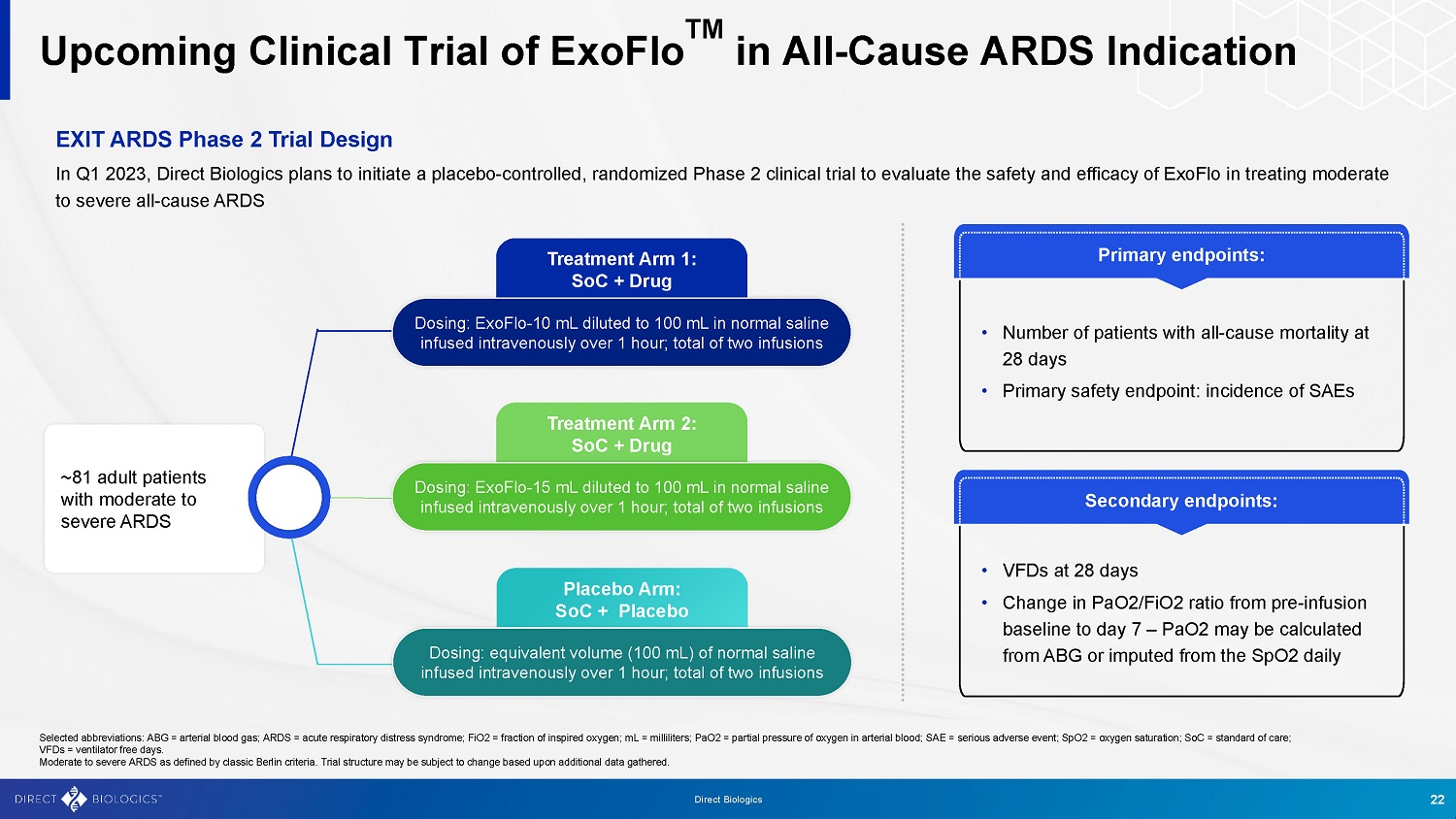
即将进行的ExoFlo TM在全因ARDS适应症退出ARDS中的临床试验2期设计,2023年第一季度,Direct Biologics计划启动一项安慰剂对照试验,评估安全性的随机2期临床试验ExoFlo治疗中度至重度全因ARDS的疗效及分析第1组:SoC +药物~81名成人中度至重度ARDS患者的剂量:ExoFlo-10mL稀释至100mL生理盐水,静脉输注超过1小时;共两次输液安慰剂组:SoC +安慰剂剂量:等量(100mL)生理盐水,静脉输注超过1小时;共两次输液治疗第2组:SoC +药物剂量:ExoFlo-15mL稀释至100mL生理盐水,静脉输注超过1小时;共两次输液次要终点:•28天时的VFD • PaO 2/FiO 2比率从输注前基线到第7天的变化– PaO 2可由ABG计算或从Spo2每日得出的主要终点:• 28天全因死亡率患者人数•主要安全终点:SAE发生率选定缩写:ABG =动脉血气;ARDS =急性呼吸窘迫综合征;FiO2 =吸氧分数;mL =毫升;PaO2 =动脉血氧分压;SAE =严重不良事件;SpO2 =氧饱和度;SoC =护理标准;VFDs =无呼吸机天数。按照柏林经典标准定义的中度至重度ARDS。审判结构可能会根据收集到的更多数据而改变。22直接生物制剂

ExoFlo TM的其他临床试验公司最近启动了溃疡性结肠炎和克罗恩病的临床试验;Direct Biologics计划在2023年第一季度启动一项扩大准入的试验,该试验涉及腹部实体器官移植1期:溃疡性结肠炎ExoFlo用于治疗难治性UC的开放标签1期试验•估计入组人数:10名成人参与者•分配:非随机扩大准入:扩大扩大扩大扩大扩大扩大准入,使用ExoFlo治疗单纯使用常规免疫抑制疗法可能导致同种异体移植功能恶化的实体腹部器官移植患者的开放标签试验•估计入组人数:20名成人参与者1期:克罗恩病ExoFlo的开放标签1期试验用于治疗医学上难治的克罗恩病•估计入组人数:10名成人参与者•分配:非随机结果测量:•中度至重度活动性UC患者中耐受静脉注射ExoFlo的受试者人数,这些受试者在70周内对一种或多种单克隆抗体无效或不耐受•中度至重度活动性UC患者中接受静脉注射ExoFlo的受试者中对一种或多种单克隆抗体无效或不耐受的受试者中的AE人数或更多单克隆抗体结果测量:•评估中度至重度活动性克罗恩病患者中静脉注射ExoFlo的可行性,这些患者在70周内对一种或多种单克隆抗体无效或不耐受;•评估中度至重度活动性克罗恩病患者中静脉注射ExoFlo的安全性,这些患者在70周内对一种或多种单克隆抗体无效或不耐受结果测量:• AE和SAE参与者人数选择的缩写:AE =不良事件;IV =静脉注射;mAbs =单克隆抗体;SAE =严重不良事件;UC =溃疡性结肠炎。审判结构可能会根据收集到的更多数据而改变。23直接生物制剂

制造业、知识产权和未来机会
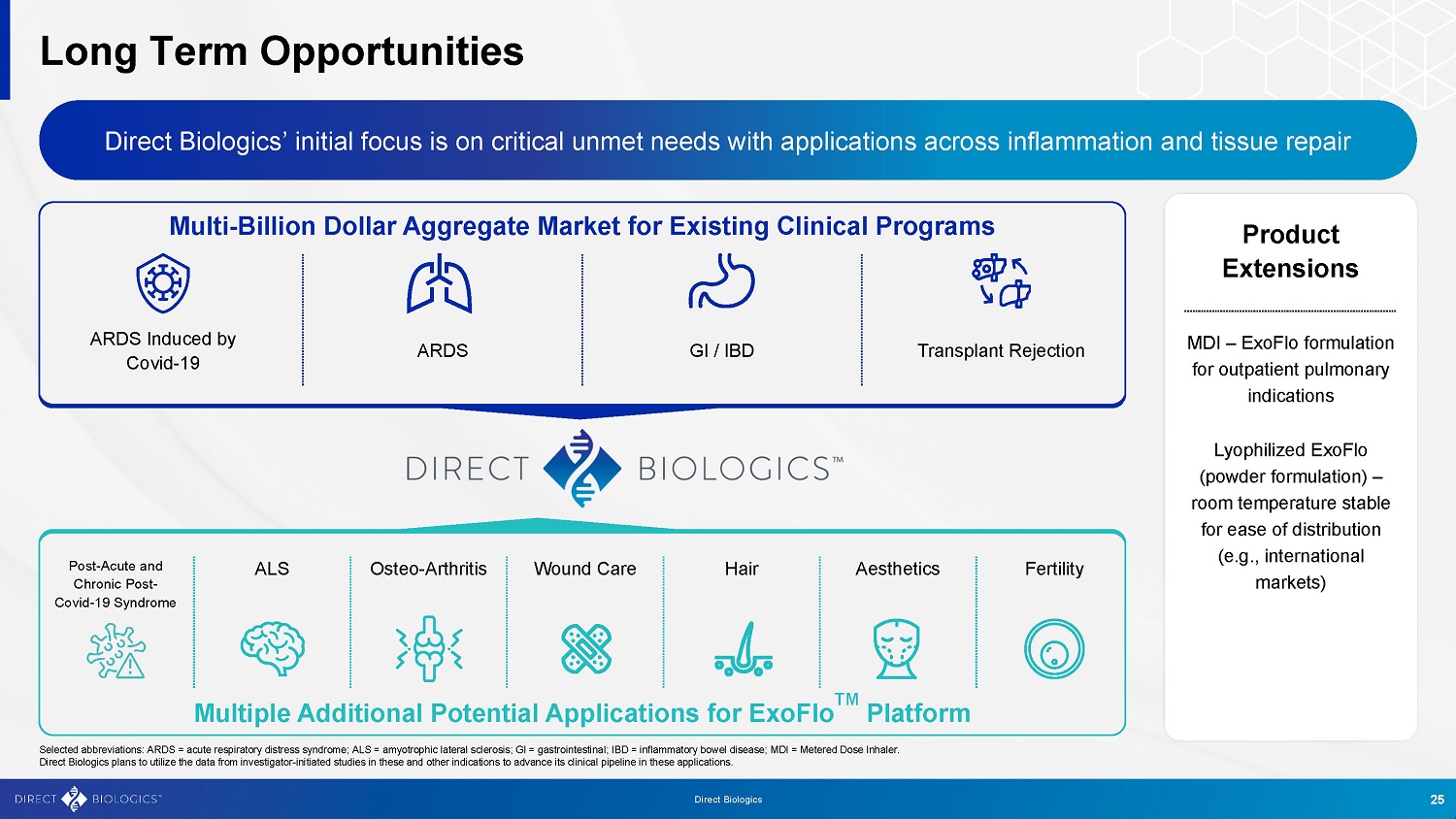
现有临床项目可带来数十亿美元的总体市场长期机遇Direct Biologics最初的重点是满足未满足的关键需求,其应用遍及炎症和组织修复MDI –用于门诊肺部适应症的ExoFlo制剂——冻干ExoFlo(粉末制剂)–室温稳定,便于分发(例如,国际市场)产品扩展ALS骨-关节炎伤口护理头发美学ExoFlo TM平台的多个附加潜在应用选择的缩写:ARDS =急性呼吸窘迫综合征;ALS =肌萎缩侧索硬化症;GI =胃肠道;IBD =炎症性肠病;MDI =计量吸入器。Direct Biologics计划利用研究者发起的这些和其他适应症研究的数据来推进其在这些应用中的临床管线。25种Covid-19综合征后急性和慢性ARDS GI/IBD移植排斥反应引起的ARDS直接生物学研究

可扩展的制造能力公司的专有EV技术可满足全球需求,包括满足FDA严格的制造要求,选定的缩写:bmMSC =骨髓间充质干细胞;cGMP =现行良好生产规范;EV =细胞外囊泡;FDA =食品药品监督管理局;GTP =良好组织规范;MSC =间充质干细胞;QC =质量控制。美国各地的cGMP生产设施,包括加州大学圣地亚哥分校新疗法中心的最先进的研发设施和圣路易斯的质量控制实验室,使用bmMSC衍生的电动汽车而不是移植MSC治疗,使得批次与批次之间的可变性最小,因为该产品可以来自单一供体,而不是从多个供体收获,在使用能够大规模生产ExoFlo TM的生物反应器开发专有技术方面取得了重大进展,显着提高电动汽车生产的产量,同时降低制造成本在美国和世界各地的特定司法管辖区广泛保护知识产权的关键商业秘密和专利组合Direct Biologics已经拥有大量的cGMP制造能力和ExoFlo的临床经验,ExoFlo是在FDA对某些再生药物的酌情执行期建立的,来自健康人体供体的细胞库符合GTP标准,并拥有FDA 26 Direct Biologics的主文件

Robust Intellectual Property 27 Direct Biologics选定的缩写:bmMSC =骨髓间充质干细胞;EV =细胞外囊泡;MSC =间充质干细胞;OUS =美国以外地区。Direct Biologics致力于通过采用多层次的方法来保持其竞争地位,其中包括提交和起诉美国和外国专利申请,保护专有技术----作为商业秘密的专利和商业秘密战略•专注于获得涵盖产品技术、制造和交付过程的专利,包括从bmMSCs和其他再生细胞提炼EV疗法的专有制造过程• EV技术平台受到美国和美国正在申请的各种专利的保护,以及严密保护的商业秘密•关键的商业秘密有助于保持制造过程的不公开•正在申请的专利涉及产品技术、制造和交付过程以及释放和稳定性分析•正在申请的其他专利申请为未来的机会获得一系列的覆盖范围待申请的专利实例•与MSC分泌物有关的应用、制造方法及其在治疗和预防包括伤口、皮肤疾病在内的各种疾病方面的用途,骨科疾病/损伤和脊柱疾病/损伤•与一种由MSC分泌组制剂和一种或多种生物分子选择性结合一种或多种微生物免疫原的组合物有关的应用,以及一种治疗微生物感染的方法•与一种分离富含血小板的外泌体的方法有关的应用,富血小板血浆来源的外泌体制剂和一种治疗骨科或脊柱病理的方法,包括施用富血小板血浆来源的外泌体•与治疗某些毛发和皮肤疾病的方法有关的应用•与细菌和病毒感染及随后的炎症相关疾病有关的应用

附录

5-6天内出院患者17/24 ExoFlo TM在疫情爆发初期进行的一项独立先导研究显示,Covid-19 1期临床试验诱导的ARDS治疗呈阳性结果。部分简称:ARDS =急性呼吸窘迫综合征;IND =研究性新药;IRB =机构审评委员会。试验起源• 2020年4月,独立研究者进行了一项IRB批准的临床试验,使用ExoFlo治疗24名因Covid-19患有中度至重度ARDS的患者•该独立试点研究证明,使用ExoFlo治疗后,缺氧现象会逆转•该试验的结果被用作1期数据,以支持Direct Biologic提交的IND,从而使公司能够直接进入“退出Covid-19”的2期试验结果•单次给药后,24例患者中有17例出现缺氧逆转•在5-6天内出院•单次剂量恢复的中位时间为50%,而瑞德西韦10天疗程(11天)恢复时间为50%

60天总死亡率(%)19.2% 50.0% 60天死亡率相对风险降低= 61.6% 60天死亡率绝对风险降低= 30.8% 60天总死亡率(%)22.3% 61.1% 60天死亡率相对风险降低= 63.5% 60天死亡率绝对风险降低= 38.8% 60天总死亡率(%)12.5% 25.0% 60天死亡率相对风险降低= 50.0% 60天死亡率绝对风险降低= 12.5% 2期退出COVID-19试验选定的缩写:AE=不良事件;ARDS =急性呼吸窘迫综合征;BiPAP =双水平气道正压;CPAP =持续气道正压;HFNC =高流量鼻插管;IP =腹膜内;mL =毫升;mmHg =毫米汞柱;MV =机械通气;NC =鼻插管;NHealth =美国国立卫生研究院;NR =未达到;NRB =未再呼吸;PaO2/FiO2 =动脉血氧分压与吸入氧分数;SAE =严重不良事件;SoC =护理标准;VFDs =无呼吸机天数。按照柏林经典标准定义的中度至重度ARDS。1低剂量治疗组与安慰剂组相比没有达到统计学意义。2生物统计学家通过非参数外推方法估计安慰剂31天。3这些亚组在第2阶段试验设计中没有预先指定,但将为关键的第3阶段的目的预先指定。60天总死亡率(%)29.4% 47.1% 60天死亡率相对风险降低= 37.6% 60天死亡率绝对风险降低= 17.7%中位出院时间(天)22 NR(31)(2)15 mL剂量IP减少住院时间约9天7天PaO2/FiO2(mmHg)的变化564915 mL剂量IP显示PaO2/FiO2无呼吸机天数7天变化更高(天)413415 mL剂量IP减少机械通气时间7.3天SAE 101644%在高剂量治疗中SAE减少组没有AE或SAE被认为可归因于ExoFlo结果(1)第2阶段退出的安全性和有效性终点COVID-19(N = 102)终点高剂量ExoFlo安慰剂试验设计双盲、安慰剂对照、随机临床试验,对102名Covid-19中度至重度ARDS成人患者进行了研究•以1:1:1的比例随机分为3个治疗组1。安慰剂+ SoC 2。低剂量ExoFlo-10 mL + SoC 3。高剂量的ExoFlo-15 mL + SoC •治疗包括一至两次60分钟的ExoFlo输注,间隔72小时给药•一线终点:60天死亡率、出院时间、PaO2/FiO2比率7天变化、VFD和SAE发生率• SoC是根据NiH指南定义的,由瑞德西韦组成,地塞米松和其他药物该试验降低了Covid-19中重度ARDS患者的多个临床相关终点,该试验采用高剂量ExoFlo TM治疗组30直接生物学组分析18-65岁(N = 70)中重度ARDS(采用CPAP、BiPAP和MV)患者的呼吸衰竭亚组分析(N = 70)18-65岁(N = 49)中重度ARDS(采用NC、NRB和HFNC)患者的亚组分析(N = 21)
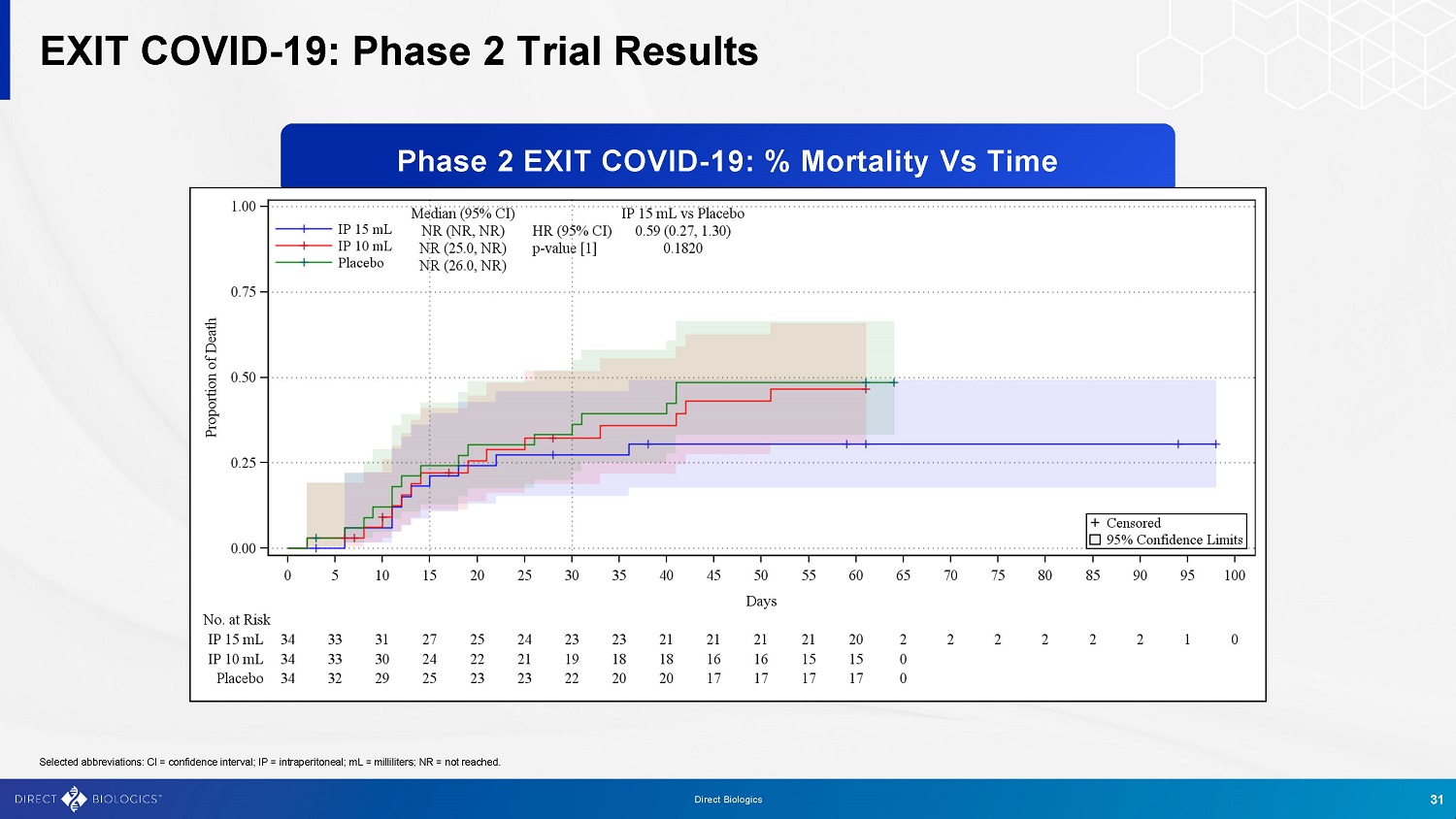
退出covid-19:2期试验结果选定的缩写:CI =置信区间;IP =腹膜内;mL =毫升;NR =未达到。第2阶段退出covid-19:死亡率与时间31直接生物制剂的比率
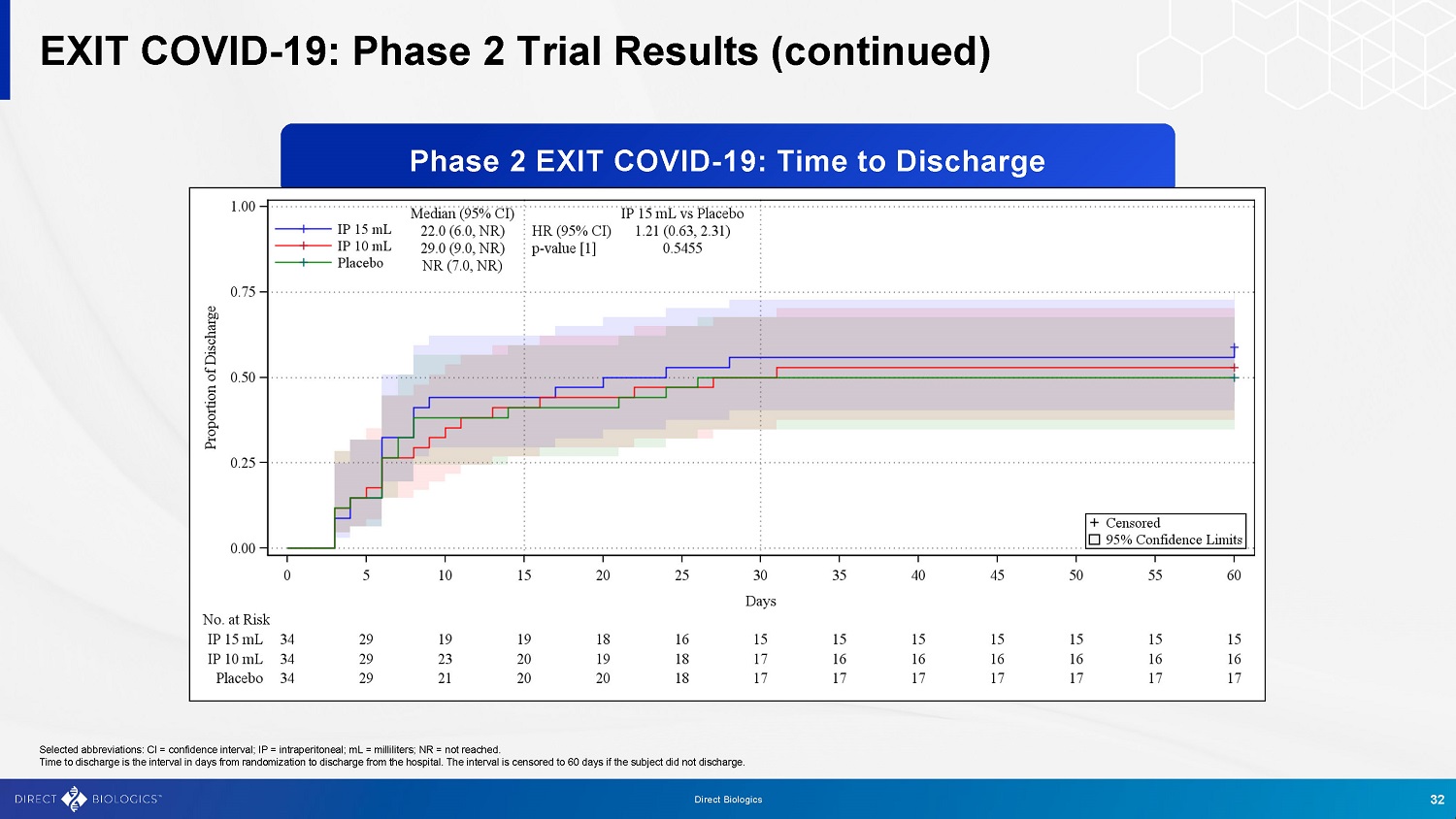
退出Covid-19:第2阶段试验结果(续)32 Direct Biologics选定的缩写:CI =置信区间;IP =腹膜内;mL =毫升;NR =未达到。出院时间是从随机分配到出院的间隔天数。如果受试者没有出院,间隔会被截断到60天。第2阶段退出covid-19:出院时间
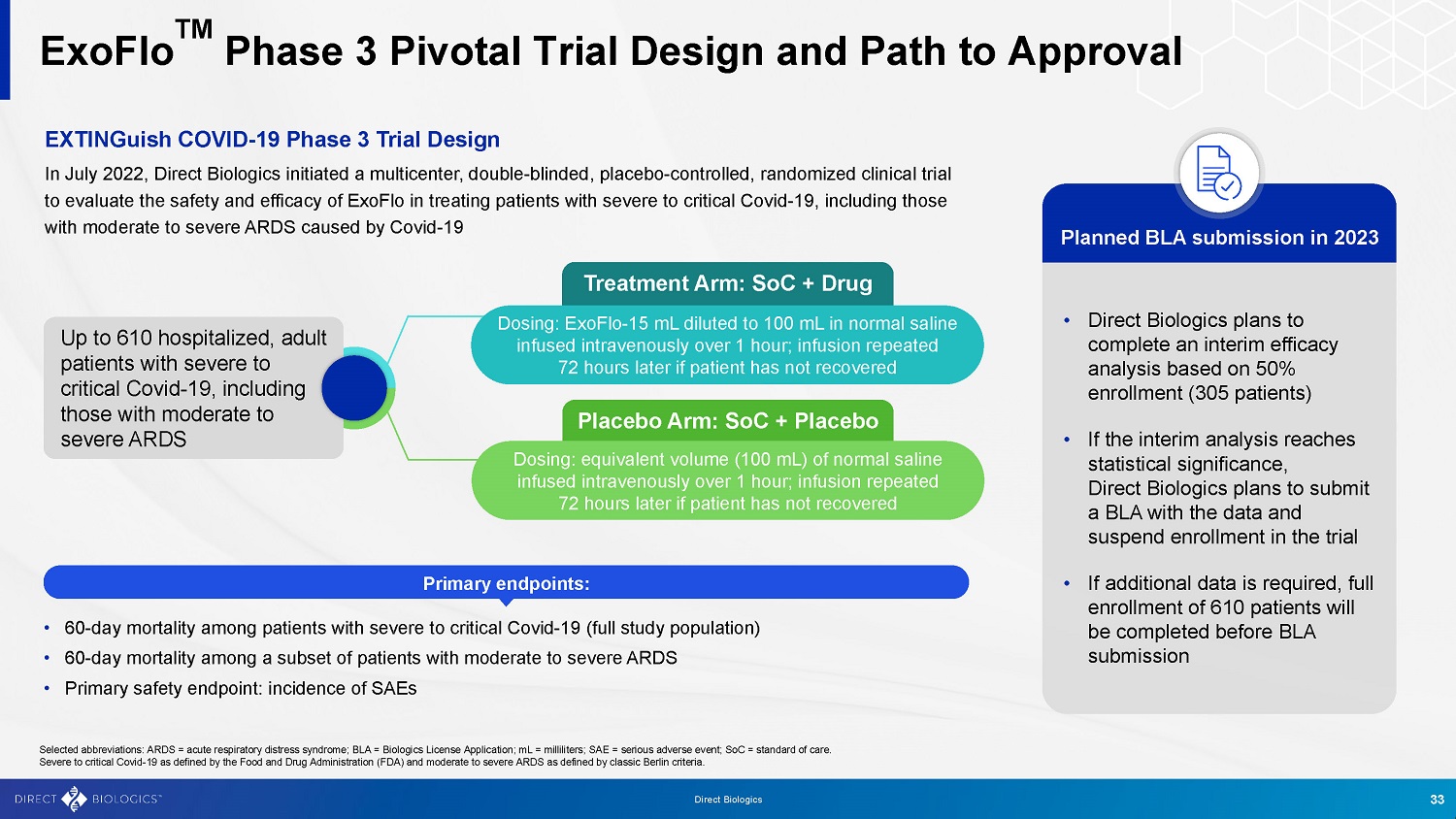
ExoFlo TM 3期关键试验设计和批准途径选定的缩写:ARDS =急性呼吸窘迫综合征;BLA =生物制剂许可证申请;mL =毫升;SAE =严重不良事件;SoC =护理标准。美国食品药品监督管理局(Food and Drug Administration)(FDA)定义的重症性Covid-19和柏林经典标准定义的中度至重度ARDS。2022年7月,Direct Biologics启动了一项多中心、双盲、安慰剂对照、随机临床试验,以评估ExoFlo治疗重症至危重Covid-19患者,包括由Covid-19引起的中度至重度ARDS患者的安全性和有效性,治疗范围:SoC +药物多达610名住院治疗的成年重症至危重Covid-19患者,包括中度至重度ARDS给药:ExoFlo-15 mL稀释至100 mL的生理盐水,静脉输注1小时以上;如果患者尚未恢复,则72小时后重复输注;安慰剂组:SoC +安慰剂给药:等量(100 mL)生理盐水,静脉输注1小时以上;72小时后重复输注如果患者尚未康复•重症至危重Covid-19患者(完整研究人群)的60天死亡率•一部分中度至重度ARDS患者的60天死亡率•主要安全终点:SAE的发生率• Direct Biologics计划根据50%的入组率(305名患者)完成一项中期疗效分析•如果中期分析达到统计学意义,Direct Biologics计划提交一份包含数据的BLA,并暂停该试验的入组•如果需要更多数据,将在提交BLA之前完成610名患者的全部入组计划于2023年提交BLA主要终点:33种直接生物制剂

AmnioWrap虽然不是公司的主要重点,但Direct Biologics的上市产品AmnioWrap目前是一种创收产品x基于胎盘的同种异体移植物,其中包含胶原蛋白细胞外基质和多种调节蛋白,包括生长因子、细胞因子和趋化因子x通过支持治疗急慢性伤口的愈合级联反应,满足皮肤和皮肤替代应用的多种临床需求x以三个品牌销售的技术1。AmnioWrap –一种尺寸适合眼部应用的单层羊膜同种异体移植2。AmnioWrap2 –一种三层羊膜同种异体移植物,非常适合门诊环境中的急性和慢性伤口应用(使用相应的Q码报销)3。AmnioWrap3 –一种三层羊膜同种异体移植物,尺寸适合手术放置;针对医院和ASC手术程序x AmnioWrap2产品正在销售中(预计在2023年初完成)x AmnioWrap3正在接受一项研究性试验的评估,该试验旨在预防和愈合切口疝x数十亿美元的潜在市场选定的缩写:ASC =门诊手术中心。34直接生物制剂