
洞察力丰富。赋予力量的精确度。Lunrestib MYTHIC临床试验更新2023年10月13日附件 99.1

议程欢迎和介绍Lloyd M. Segal,总裁兼首席执行官Lunresertib初步MYTHIC单药疗法和联合疗法临床试验结果Timothy Yap,MBBS,博士,FRCP,首席研究员,MYTHIC试验结论和Lunresertib开发计划Maria Koehler,医学博士,博士,首席医疗官即将到来的催化剂Lloyd M. Segal,总裁兼首席执行官问答Repare Therapeutics Leadership & Dr. Yap

本演示文稿中有关非历史事实的陈述属于1995年《私人证券诉讼改革法案》(经修订)含义内的“前瞻性陈述”。诸如“预期”、“相信”、“预期”、“打算”、“计划”、“潜在”、“项目”、“将”和“未来”等词语或类似的表达方式旨在识别前瞻性陈述。这些前瞻性陈述中的每一项都涉及重大风险和不确定性,可能导致实际结果与这些前瞻性陈述中明示或暗示的结果大不相同。本演示文稿中包含的前瞻性陈述包括但不限于关于我们当前和未来临床前研究和临床试验的启动、时间、进展和结果的陈述,具体包括我们的lunresertib(RP-6306)和camonsertib临床试验;计划更新和数据披露的预期时间;提交IND和其他监管文件的时间;为我们的候选产品寻求监管批准的时间和可能性;我们的候选产品的竞争格局;我们使用我们的SNIPRx平台识别和开发其他候选产品的能力;以及我们对费用和未来收入的估计,资本要求,现金跑道和额外融资的需要。这些前瞻性陈述反映了我们当前的信念和期望。许多因素可能造成当前预期与实际结果之间的差异,包括新冠疫情对我们业务和市场波动的持续时间和影响、在临床前或临床研究期间观察到的意外安全性或有效性数据、低于预期的临床站点激活率或临床试验注册率、预期或现有竞争的变化、监管环境的变化、意外诉讼或其他纠纷。这些风险和其他风险在我们提交给美国证券交易委员会(“SEC”)的文件中有更全面的描述,包括我们于2023年8月9日提交给SEC的10-Q表格季度报告中的“风险因素”部分,以及我们随后提交给SEC或提交给SEC的其他文件。本演示文稿中包含的所有前瞻性陈述仅在其发表之日发表。除法律要求外,我们不承担更新本文所载的任何前瞻性陈述以反映预期的任何变化的义务,即使有了新的信息。本演示文稿还包含独立方和我们就市场规模和增长所做的估计和其他统计数据,以及有关我们行业的其他数据。这些数据涉及许多假设和限制,请注意不要对这些估计给予不适当的权重。我们或任何其他人均不对此类数据的准确性或完整性作出任何陈述,也不承担在本陈述日期之后更新此类数据的任何义务。此外,对我们的未来表现和我们所经营的市场的未来表现的预测、假设和估计必然受到高度的不确定性和风险的影响。仅为方便起见,本演示文稿中的商标和商品名称可在不带®和™符号的情况下提及,但此类提及不应被解释为表明其各自所有者不会主张其权利的任何标志。

差异化且不断扩大的临床阶段管线Lunrestib:First-in-class口服PKMYT1抑制剂(1/2期)Camonsertib:ATR抑制剂(与罗氏合作)其他近期临床项目跨多种肿瘤类型的潜力专有CRISPR支持的SNIPRx平台专注于癌细胞内的基因组不稳定性和DNA损伤修复预计在2023年和2024年有多种临床催化剂到2026年开发下一代精准肿瘤治疗

Lunrestib:First-in-class,口服,小分子,PKMYT1抑制剂联合疗法在多种肿瘤类型和测试的基因型中实现了强大的抗肿瘤活性;在初步RP2D(N = 18)时总体应答率为33%;在最大的队列(妇科肿瘤)中观察到50%的RECIST应答(N = 10)在MYTHIC 1期试验中为单一疗法和camonsertib联合疗法建立的概念验证验证了来自专有SNIPRx平台的临床前协同假设和患者选择方法大的、基因组定义的潜在患者群体~90K可寻址人群,包括CCNE1、FBXW7和PPP2R1A口服单一疗法和联合疗法RP2D的安全性和耐受性特征令人鼓舞,推荐的2期剂量
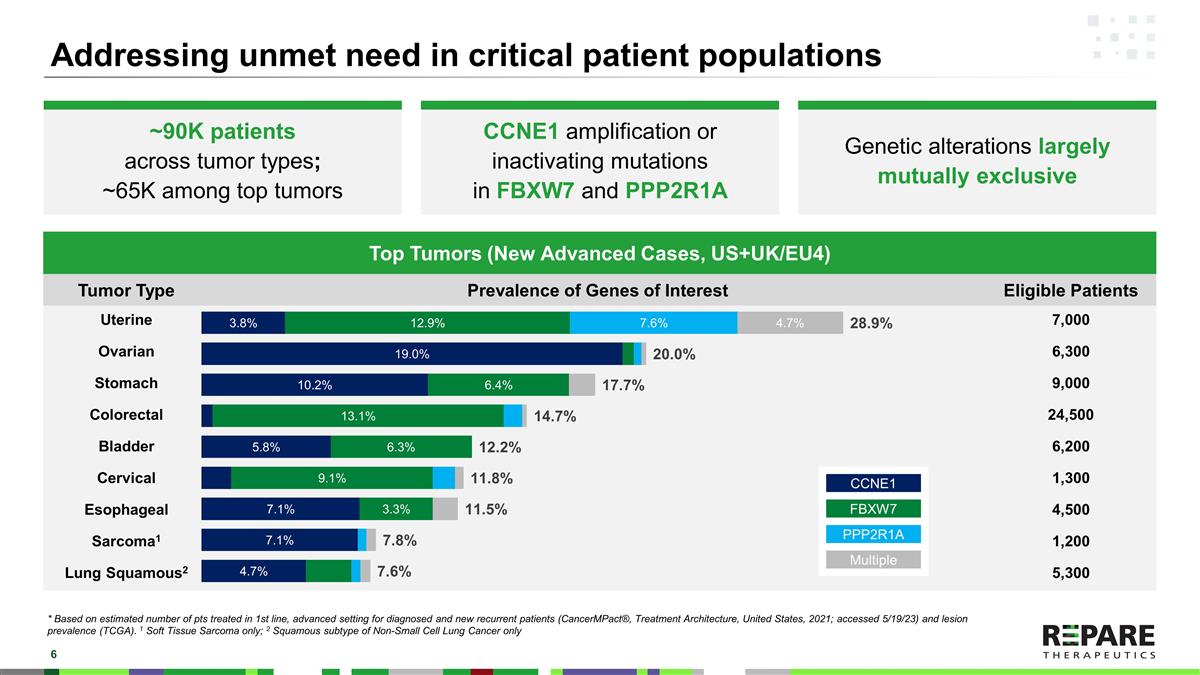
不同肿瘤类型的约90K名患者;顶级肿瘤中的约65K名CCNE1扩增或FBXW7和PPP2R1A失活突变基因改变在很大程度上是相互排斥的解决危重患者群体中未满足的需求顶级肿瘤(新晚期病例,美国+英国/EU4)顶级肿瘤(新晚期病例,美国+英国/EU4)感兴趣基因的肿瘤类型流行率合格患者子宫7,000卵巢6,300胃9000结肠直肠24,500膀胱6,200宫颈1,300食管4,500肉瘤1,200肺鳞片2,300 *基于在一线治疗的患者估计数量,诊断和新复发患者的晚期环境(CancerMPact ®,Treatment Architecture,美国,2021年;第5/19/23次访问)和病变发生率(TCGA)。1只软组织肉瘤;2只非小细胞肺癌鳞状亚型CCNE1 FBXW7 PPP2R1A Multiple

Lunrestib初步单药治疗&联合治疗临床试验结果Timothy Yap,MBBS,PhD,FRCP,MYTHIC试验首席研究员

研究主要研究者:Timothy Yap,MBBS,PhD,FRCP医学肿瘤学家和内科科学家,德克萨斯大学,MD安德森癌症中心教授,研究性癌症治疗学(1期项目)副总裁,治疗学部门临床开发主管主要研究集中于分子靶向剂和免疫疗法的首次人体和组合开发,以及通过使用新的预测和药效学生物标志物的临床研究加速它们的开发,主要兴趣包括用新的疗法,如ATR和PARP抑制剂,靶向DNA损伤反应,以及在英国伦敦帝国理工学院获得免疫学和传染病的新型免疫疗法学士学位和医学博士学位

演讲者:Timothy Yap,MBBS,PhD,FRCP我有以下相关财务关系需要披露:员工:德克萨斯大学MD安德森癌症中心,我是该中心的副总裁,治疗发现部门的临床开发主管,该部门在DDR和其他抑制剂方面拥有商业利益(IACS30380/ART0380被授权给Artios)顾问:艾伯维,Acrivon,天演药业,Almac,Aduro,Amphista,Artios,Astex,阿斯利康,Athena,Atrin,Avenzo,Avoro,Axiom,Baptist Health Systems,Bayer,Beigene,BioCity Pharma,Blueprint,Boxer,Bristol Myers Squibb,TERM0,Diffusion,Duke Street Bio,858 Therapeutics,EcoR1 Capital,Ellipses Pharma,EMD Serono,Entos,F-Star,Genesis Therapeutics,Genmab,Glenmark,GLG,Globe Life科学,GSK,Guidepoint,Ideaya Biosciences,Idience,Ignyta,天境生物,ImmuneSensor,Impact Therapeutics,Institut Gustave Roussy,Intelliphere,Jansen,Kyn,MEI pharma,Mereo,默沙东,Merit,Monte Rosa Therapeutics,Natera,Nested Therapeutics,Nexys,NimsVeeva,Versant,Vibliome,Voronoi Inc,Xinthera,Zai Labs和ZielBio资助/研究支持来自:Acrivon,Artios,阿斯利康,拜耳,Beigene,BioNTech,Blueprint,BMS,Boundless Bio,Clovis,Constellation,Cyteir,礼来,EMD Serono,Forbius,F-Star,GlaxoSmithKline,Genentech,Haihe,Ideaya ImmuneSensor,Insilico Medicine,Ionis,Ipsen,Jounce,Karyopharm,KSQ,Kyowa,默沙东,Mirati,Novartis,辉瑞,
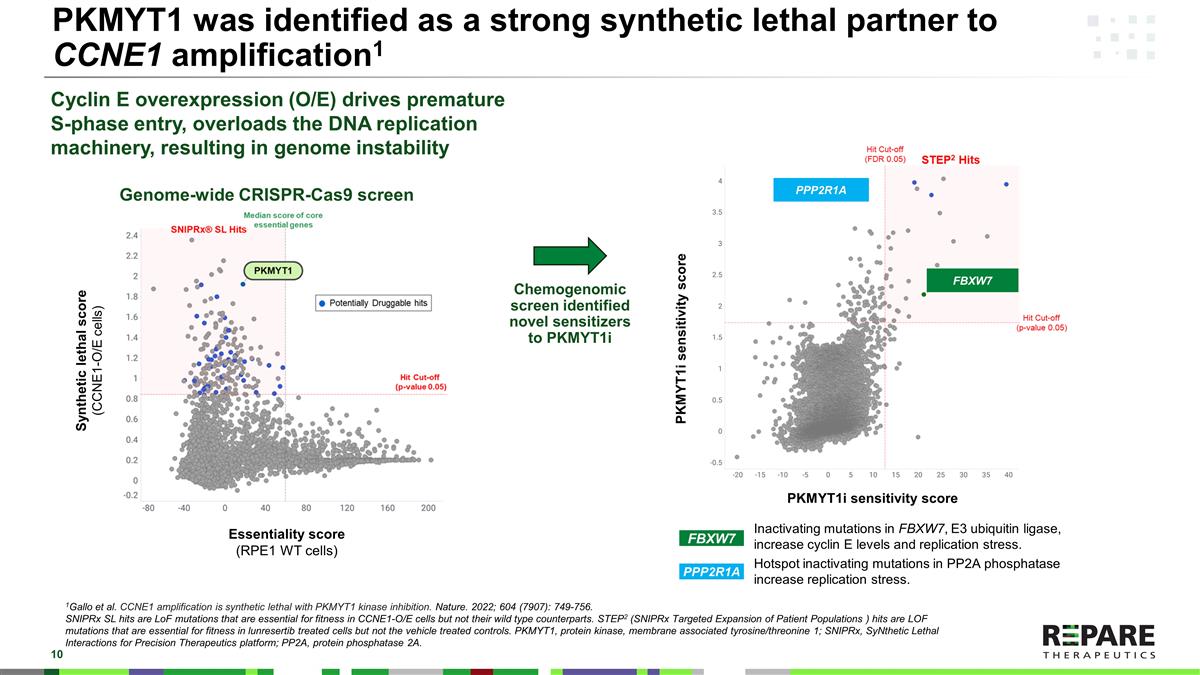
PKMYT1被鉴定为CCNE1扩增的强合成致死伙伴1Gallo等人,CCNE1扩增是具有PKMYT1激酶抑制作用的合成致死。自然。2022; 604 (7907): 749-756.SNIPRx SL hits是LoF突变,对于CCNE1-O/E细胞的适应性是必不可少的,但不是它们的野生型对应物。STEP2(SNIPRx Targeted Expansion of Patient Populations,简称SNIPRx)hits是一种LOF突变,对lunrestib处理过的细胞的适应性至关重要,但对载体处理过的对照细胞则不然。PKMYT1,蛋白激酶,膜相关酪氨酸/苏氨酸1;SNIPRx,SynNthetic Lethal Interactions for Precision Therapeutics平台;PP2A,蛋白磷酸酶2A。化学基因组筛选发现了新的致敏剂PKMYT1i FBXW7 PPP2R1A使FBXW7、E3泛素连接酶中的突变失活,增加细胞周期蛋白E水平和复制应激。PP2A磷酸酶热点失活突变增加复制应激。Cyclin E过表达(O/E)驱动过早进入S期,使DNA复制机制超负荷,导致基因组不稳定合成致死评分(CCNE1-O/E细胞)Essentiality评分(RPE1WT细胞)PPP2R1A FBXW7 PKMYT1i敏感性评分PKMYT1i敏感性评分全基因组CRISPR-Cas9筛选
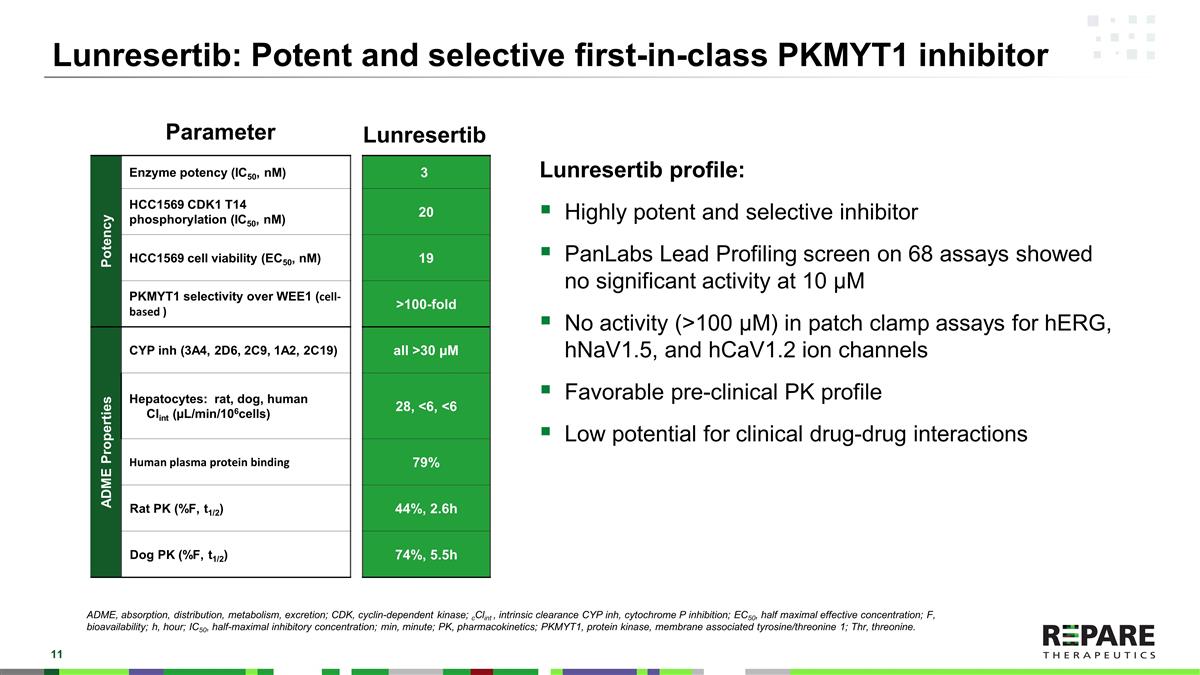
Lunrestib:强效和选择性first-in-class PKMYT1抑制剂Potency酶效力(IC50,nM)3 HCC1569 CDK1 T14磷酸化(IC50,nM)20 HCC1569细胞活力(EC50,nM)19 PKMYT1对WEE1的选择性(基于细胞的)> 100倍ADME特性CYP inh(3A4,2D6,2C9,1A2,2C19)均> 30 µ M肝细胞:大鼠、狗、人Clint(µ L/min/106细胞)28,< 6,< 6人血浆蛋白结合79%大鼠PK(% F,t1/2)44%,2.6h狗PK(% F,t1/2)74%,5.5h Lunresertib谱:高效选择性抑制剂PanLabs对68项试验的铅谱筛选显示,在10 µ M时无显著活性。在hERG、hNaV1.5和hCaV1.2离子通道的膜片钳法中无活性(> 100 µ M)。临床前良好的PK谱临床药物-药物相互作用的潜力低参数Lunresertib ADME、吸收、分布、代谢、排泄;CDK、细胞周期蛋白依赖性激酶;cClint、内在清除率CYP inh、细胞色素P抑制;EC50,半最大有效浓度;F,生物利用度;h,小时;IC50,半最大抑制浓度;分钟;PK,药代动力学;PKMYT1,蛋白激酶,膜相关酪氨酸
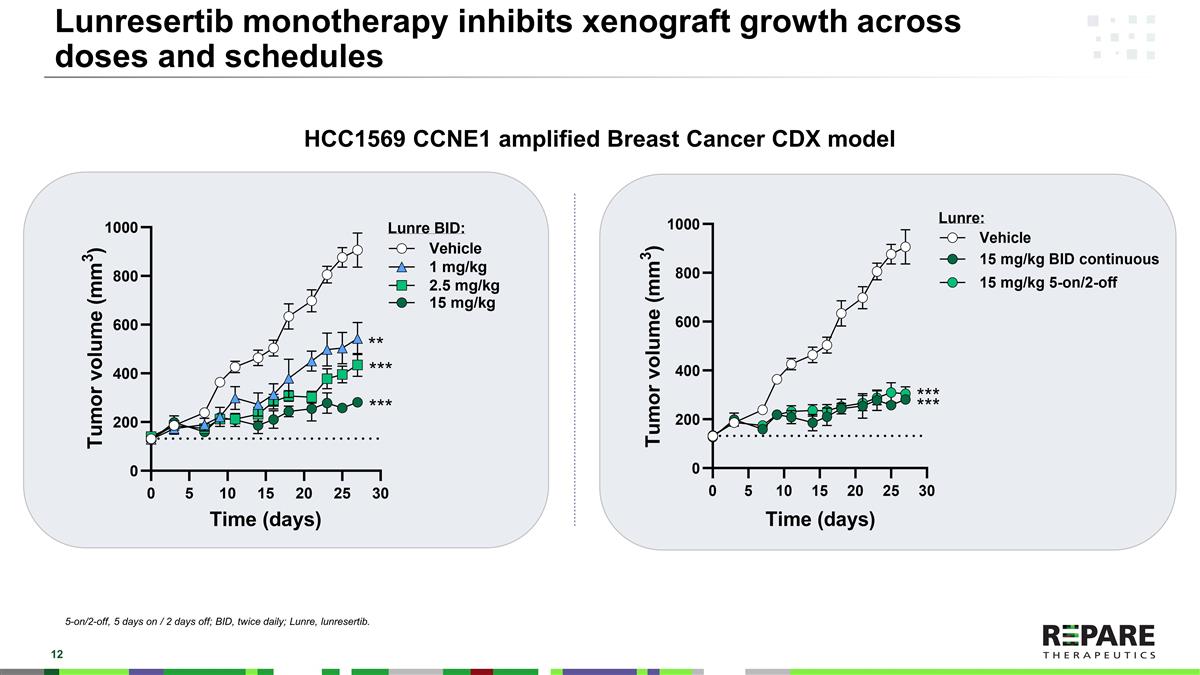
Lunresertib单药治疗抑制异种移植物生长的不同剂量和时间表HCC1569 CCNE1扩增的乳腺癌CDX模型5-on/2-off,5-day on/2-off,5 days on/2-day off;BID,每日两次;Lunre,lunresertib。
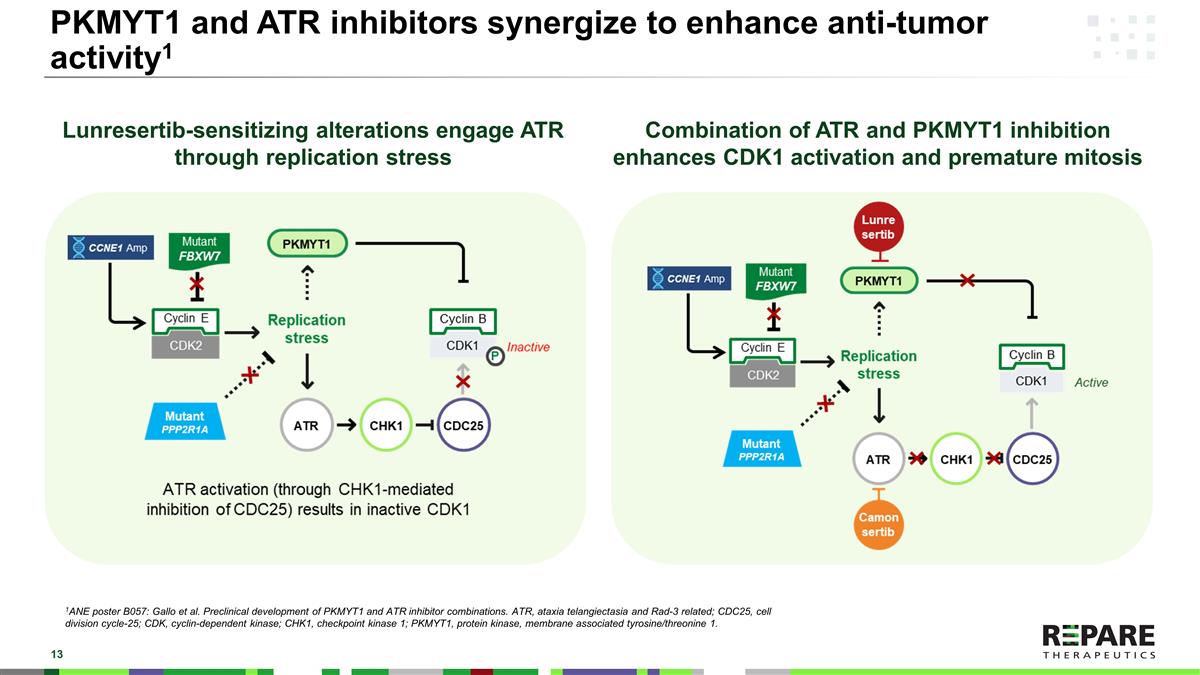
PKMYT1和ATR抑制剂协同增强抗肿瘤活性1 Lunrestib致敏改变通过复制应激与ATR结合ATR和PKMYT1抑制增强CDK1活化和过早有丝分裂1ANE海报B057:Gallo等人。PKMYT1和ATR抑制剂组合的临床前开发。ATR,共济失调毛细血管扩张症和Rad-3相关;CDC25,细胞分裂周期-25;CDK,细胞周期蛋白依赖性激酶;CHK1,检查点激酶1;PKMYT1,蛋白激酶,膜相关酪氨酸/苏氨酸1。
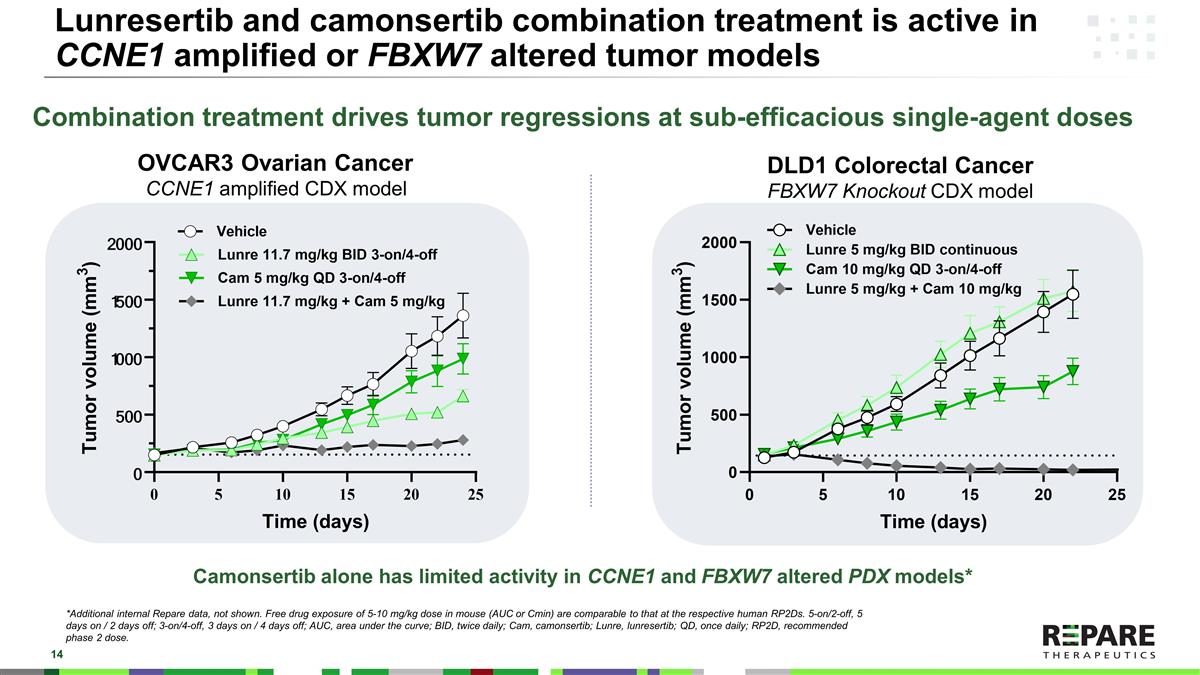
Lunresertib和camonsertib联合治疗在CCNE1扩增或FBXW7改变的肿瘤模型中是有效的联合治疗在无效的单药剂量下驱动肿瘤消退*其他内部Repare数据,未显示。小鼠体内5-10毫克/千克剂量的游离药物暴露(AUC或Cmin)与人类相应的RPTD相当。5-on/2-off,5 days on/2 days off;3-on/4-off,3 days on/4 days off;AUC,曲线下面积;BID,每日两次;Cam,camonsertib;Lunre,lunresertib;QD,每日一次;RP2D,推荐2期剂量。DLD1结直肠癌FBXW7敲除CDX模型OVCAR3卵巢癌CCNE1扩增CDX模型Camonsertib在CCNE1和FBXW7改变的PDX模型中的活性有限*
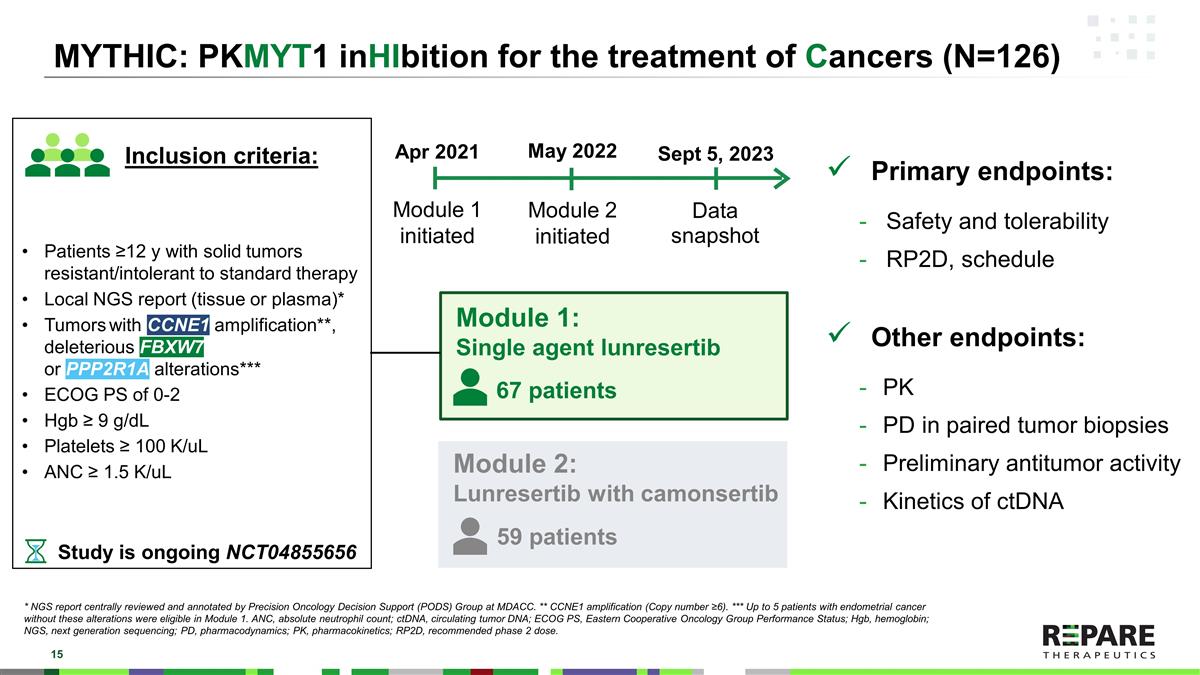
MYTHIC:PKMYT1用于治疗癌症(N = 126)模块1:单药lunresertib主要终点:安全性和耐受性RP2D,时间表其他终点:配对肿瘤活检中的PK PD初步抗肿瘤活性ctDNA模块1启动2021年4月数据快照2023年9月5日模块2:lunresertib与camonsertib模块2启动2022年5月研究正在进行NCT04855656 ≥ 12岁实体瘤患者对标准治疗耐药/不耐受局部NGS报告(组织或血浆)* CCNE1扩增的肿瘤* *,有害的FBXW7或PPP2R1A改变* * * ECOG PS的0-2 Hgb ≥ 9g/dL血小板≥ 100K/uL ANC ≥ 1.5K/uL纳入标准:67例59例* NGS报告由MDACC精准肿瘤学决策支持(PODS)组集中审查和注释。* * CCNE1扩增(拷贝数≥ 6)。* * *多达5名没有这些改变的子宫内膜癌患者符合第1单元的条件。ANC,中性粒细胞绝对计数;ctDNA,循环肿瘤DNA;ECOG PS,东部肿瘤协作组性能状态;Hgb,血红蛋白;NGS,下一代测序;PD,药效学;PK,药代动力学;RP2D,推荐2期剂量。
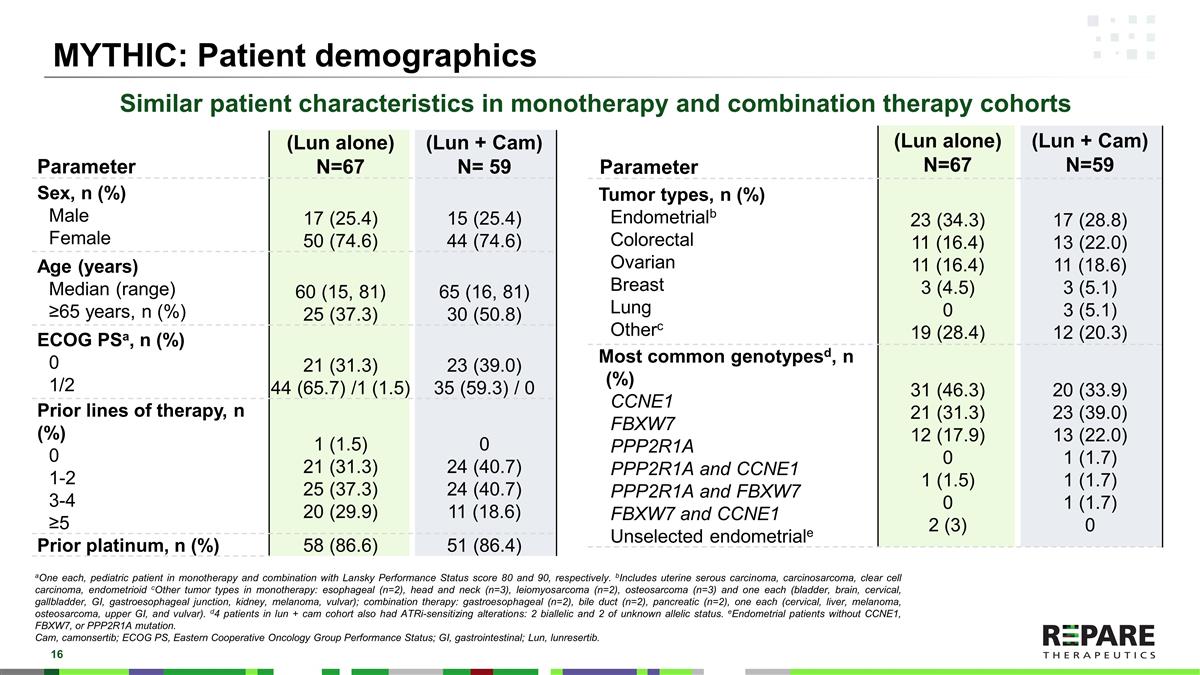
MyTHIC:患者人口统计学参数(单伦)N = 67(伦+凸轮)N = 59性别,n(%)男性女性17(25.4)50(74.6)15(25.4)44(74.6)年龄(岁)中值(范围)≥ 65岁,n(%)60(15,81)25(37.3)65(16,81)30(50.8)ECOG PSa,n(%)01/221(31.3)44(65.7)/1(1.5)23(39.0)35(59.3)/0先前治疗线,n(%)0 1-2 3-4 ≥ 51(1.5)21(31.3)25(37.3)20(29.9)024(40.7)24(40.7)11(18.6)先前铂,n(%)58(86.6)51(86.4)参数(单伦)N = 67(伦+凸轮)N = 59肿瘤类型,n(%)子宫内膜alb结直肠卵巢乳腺其他23(34.3)11(16.4)11(16.4)3(4.5)019(28.4)17(28.8)13(22.0)11(18.6)3(5.1)3(5.1)12(20.3)最常见的基因型d,n(%)CCNE1 FBXW7 PP-2R1A PP-2R1A和CCNE1 PP-2R1A和FBXW7 FBXW7和CCNE1未选择的子宫内膜31(46.3)21(31.3)12(17.9)01(1.5)02(3)20(33.9)23(39.0)13(22.0)1(1.7)1(1.7)1(1.7)1(1.7)0单一疗法和联合疗法队列的患者特征相似,单一疗法和Lansky联合疗法的儿童患者状态评分分别为80和90。b包括子宫浆液性癌、癌肉瘤、透明细胞癌、子宫内膜样细胞c单一疗法的其他肿瘤类型:食管(n = 2)、头颈部(n = 3)胃食管交界处、肾脏、黑色素瘤、外阴);联合治疗:胃食管(n = 2)、胆管(n = 2)、胰腺(n = 2),各1个(宫颈、肝脏、黑色素瘤、骨肉瘤、上GI和外阴)。lun + cam队列中的d4患者也有ATRi致敏改变:2个双等位基因和2个未知等位基因状态。没有CCNE1、FBXW7或PPP2R1A突变的子宫内膜患者。Cam,camonsertib;ECOG PS,东部肿瘤协作组表现状态;GI,胃肠;Lun,lunresertib。
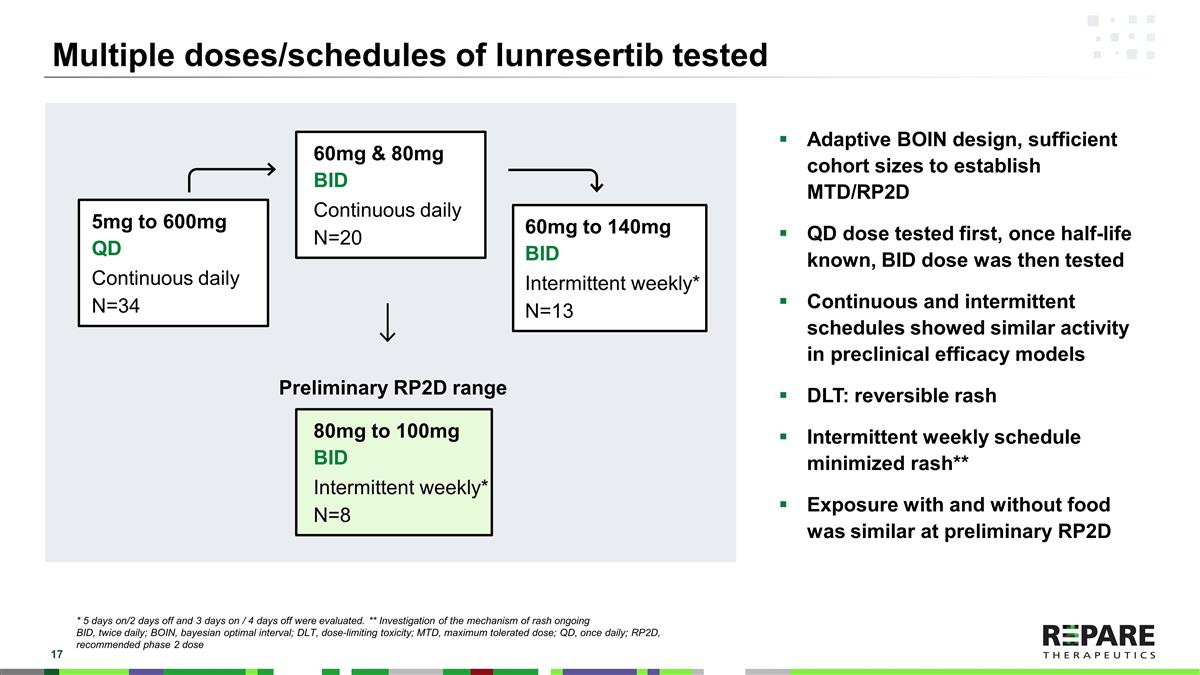
lunresertib的多剂量/时间表测试自适应BOIN设计,足够的队列规模确定MTD/RP2D QD剂量测试,一旦半衰期已知,然后测试BID剂量连续和间歇方案在临床前疗效模型DLT:可逆性皮疹中显示出相似的活性间歇性每周方案最大限度地减少皮疹* *在初步RP2D 5mg至600mg QD时,有和没有食物的接触相似连续每日N = 34 60mg和80mg BID连续每日N = 20 60mg至140mg BID间歇性每周* N = 13 80mg至100mg BID间歇性每周* N = 8初步RP2D范围* 5天/2天休息和3天/4天休息。* *皮疹持续BID机制研究,每日两次;BOIN,贝叶斯最佳间隔期;DLT,剂量限制性毒性;MTD,最大耐受剂量;QD,每日一次;RP2D,推荐2期剂量
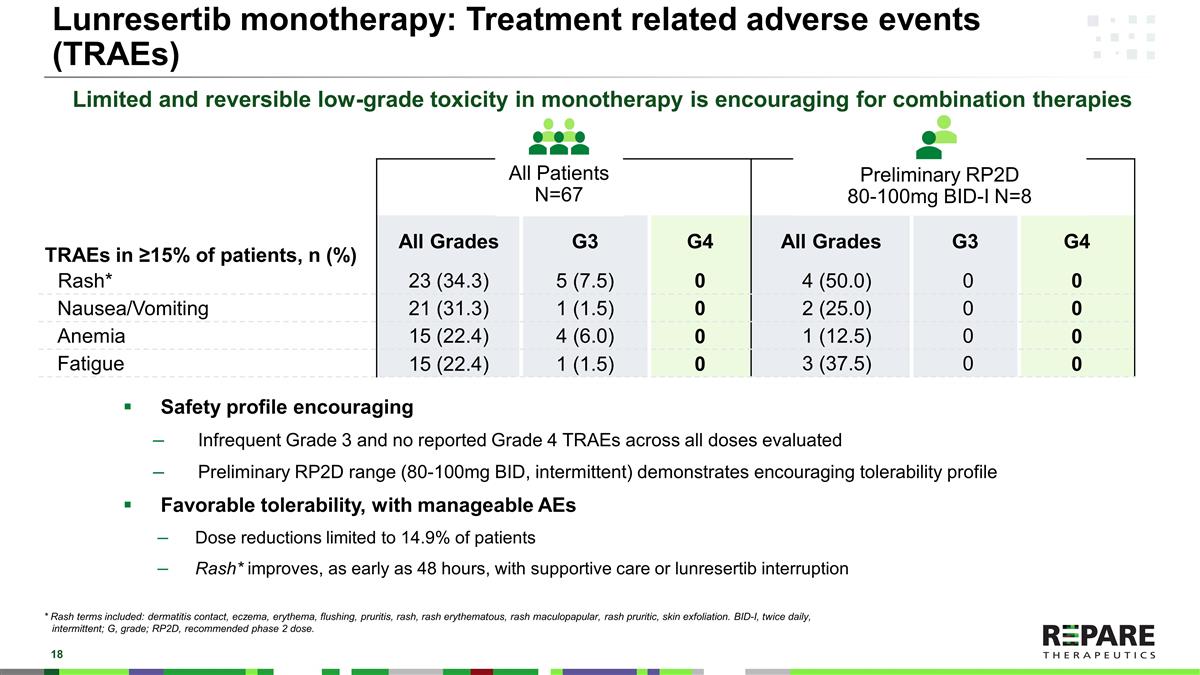
TRAE在≥ 15%的患者中,n(%)所有分级G3 G4所有分级G3 G4皮疹* 23(34.3)5(7.5)04(50.0)00恶心/呕吐21(31.3)1(1.5)02(25.0)00贫血15(22.4)4(6.0)01(12.5)00疲劳15(22.4)1(1.5)03(37.5)00 Lunrestib单药治疗:治疗相关不良事件(TRAE)安全性简介鼓励在所有评估剂量中不常见的3级和无报告的4级TRAE初步RP2D范围(80-100mg BID,间歇性)显示令人鼓舞的耐受性简介良好的耐受性,在可控的AE下剂量减少仅限于14.9%的患者皮疹*在支持治疗或lunresertib中断的情况下最早可在48小时内改善*皮疹术语包括:皮炎接触、湿疹、红斑、潮红、瘙痒、皮疹、红斑、皮疹斑丘疹、皮疹瘙痒、皮肤脱落。BID-I,每日两次,间歇性;G,等级;RP2D,推荐2期剂量。所有患者N = 67单一疗法中有限且可逆的低级别毒性对于联合疗法是令人鼓舞的初步RP2D 80-100mg BID-I N = 8
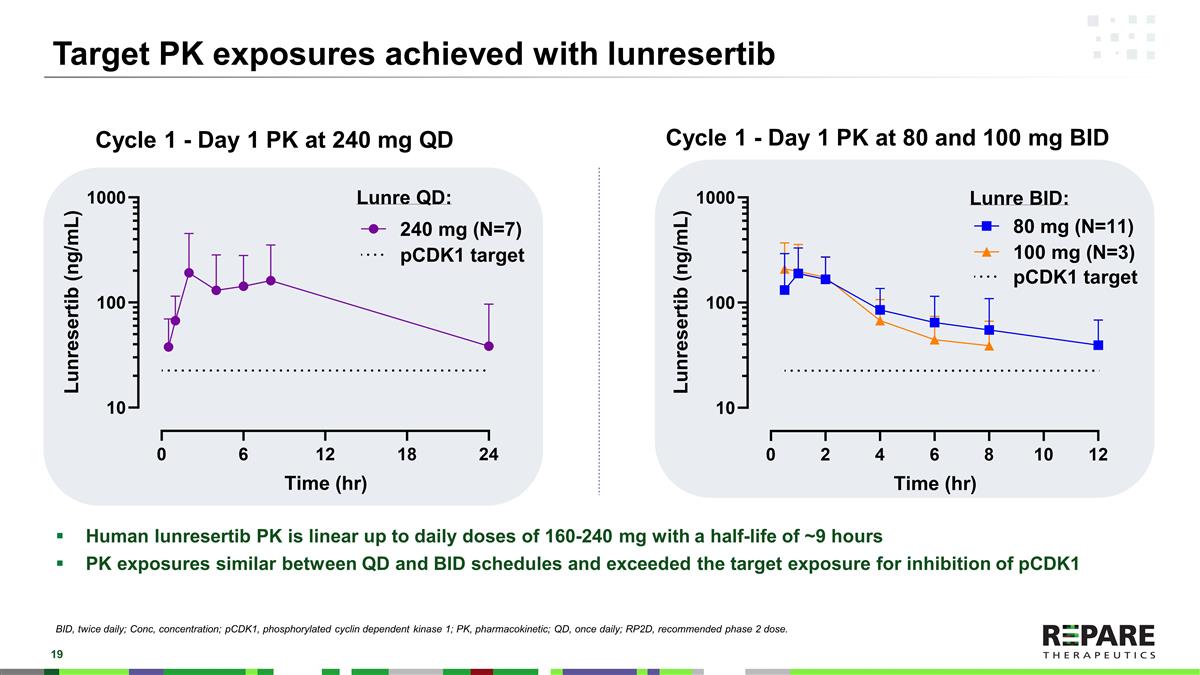
lunrestib达到的目标PK暴露Human lunrestib PK是线性的,每日剂量为160-240毫克,半衰期约为9小时PK暴露与QD和BID计划相似,超过了抑制pCDK1 BID的目标暴露,每日两次;conc,浓度;pCDK1,磷酸化细胞周期蛋白依赖性激酶1;PK,药代动力学;QD,每日一次;RP2D,推荐2期剂量。周期1-第1天PK,80和100毫克BID周期1-第1天PK,240毫克QD
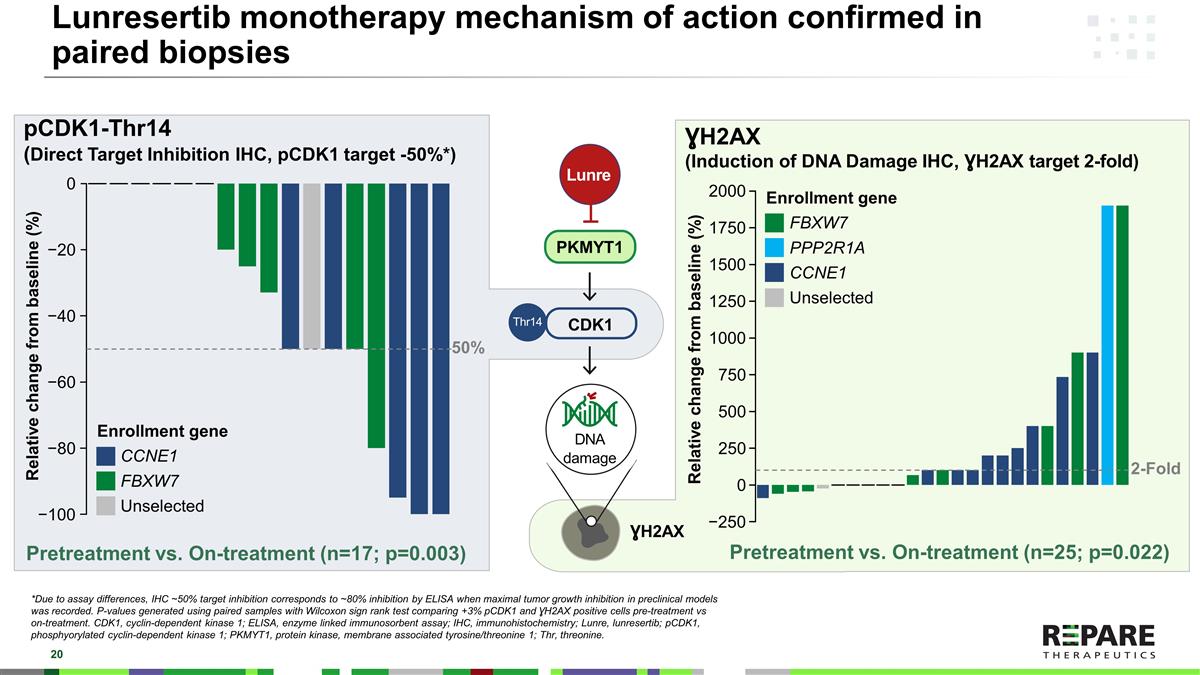
Lunrestib单药治疗机制在配对活检中证实pCDK1-Thr14(直接靶点抑制IHC,pCDK1靶点-50 % *)H2AX(诱导DNA损伤IHC,H2AX靶点2倍)H2AX PKMYT1 CDK1 Lunre Thr14 DNA损伤预处理vs.治疗中(n = 17;p = 0.003)预处理vs.治疗中(n = 25;p = 0.02 2)*由于试验差异,当记录到临床前模型中最大的肿瘤生长抑制时,IHC~50%的靶点抑制对应于~80%的ELISA抑制。用Wilcoxon符号秩检验的配对样本产生的P值比较+ 3% pCDK1和TERM1 H2AX阳性细胞处理前与处理中的比较。CDK1,细胞周期蛋白依赖性激酶1;ELISA,酶联免疫吸附试验;IHC,免疫组织化学;Lunre,lunrestib;pCDK1,磷酸化细胞周期蛋白依赖性激酶1;PKMYT1,蛋白激酶,膜相关酪氨酸/苏氨酸1;Thr,苏氨酸。相对于基线的相对变化(%)50% 0− 20 − 40 − 60 − 80 − 100入组基因CCNE1 FBXW7未选择入组基因FBXW7 PPP2R1A CCNE1未选择相对于基线的相对变化(%)2-Fold 2000 − 25012501000750500250017501500
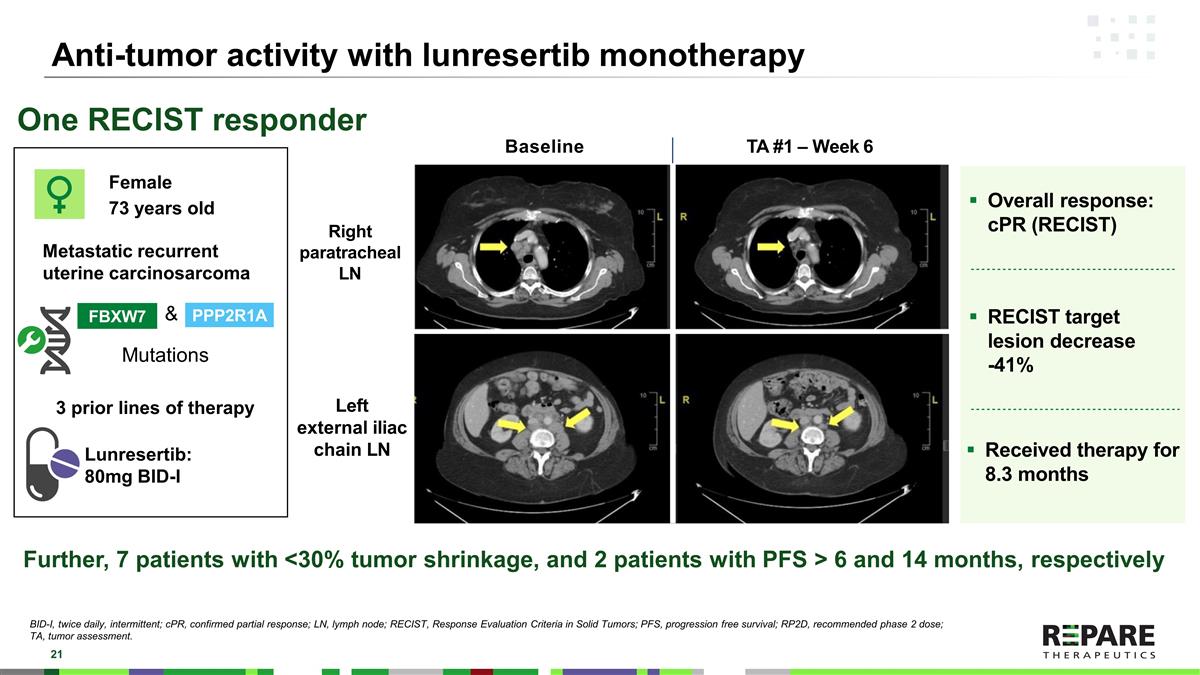
lunrestib单药治疗的抗肿瘤活性FBXW7 PPP2R1A基线左侧髂外链LN TA # 1 –第6周总体应答:cPR(RECIST)RECIST靶病变减少-41 %接受治疗8.3个月女性73岁转移性复发性子宫癌肉瘤&一个RECIST应答者突变此外,7例肿瘤缩小< 30%,2例PFS > 6个月和14个月,分别为Lunrestib:80mg BID-I右侧气管旁LN BID-I,每日两次,间歇性;cPR,确认部分应答;LN,淋巴结;RECIST,实体瘤应答评估标准;PFS,无进展生存期;RP2D,推荐2期剂量;3种先前的治疗方法
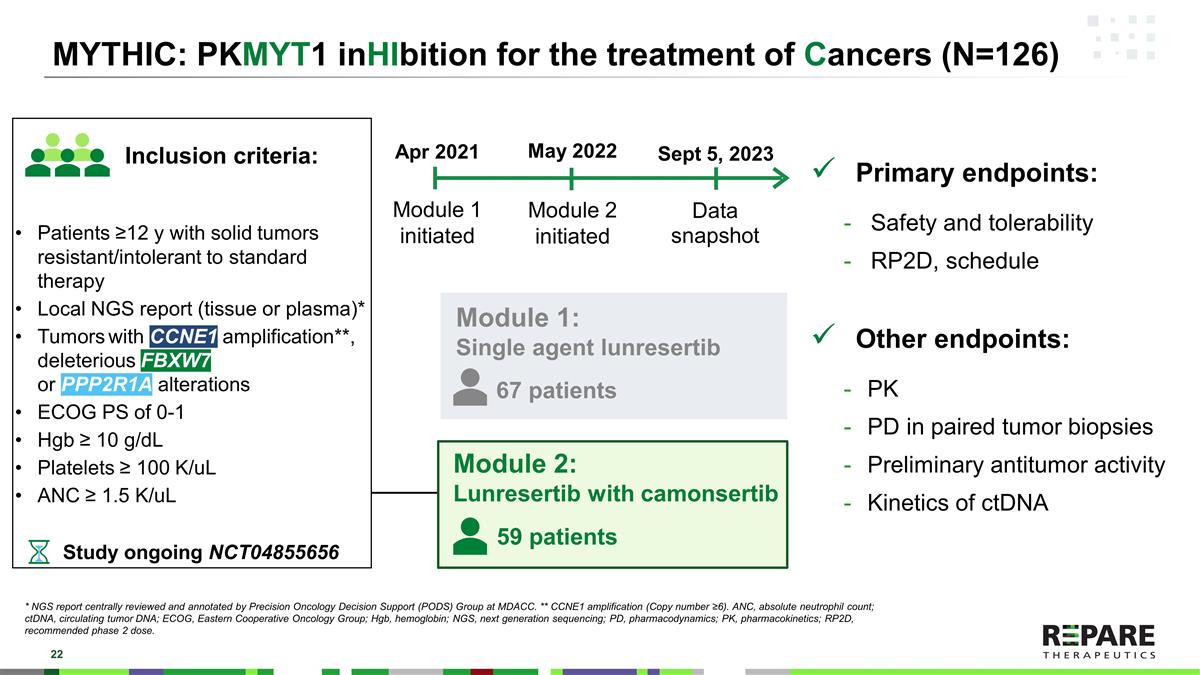
MYTHIC:PKMYT1治疗癌症(N = 126)模块1:单药lunresertib主要终点:安全性和耐受性RP2D,时间表其他终点:配对肿瘤活检中的PK PD初步抗肿瘤活性ctDNA模块1启动2021年4月数据快照2023年9月5日模块2:lunresertib与camonsertib模块2启动2022年5月正在进行的研究NCT04855656 ≥ 12岁实体瘤患者对标准治疗耐药/不耐受局部NGS报告(组织或血浆)* CCNE1扩增的肿瘤* *,0-1 Hgb ≥ 10 g/dL血小板ECOG PS ≥ 100K/uL ANC ≥ 1.5K/uL的有害FBXW7或PPP2R1A改变纳入标准:67例59例* NGS报告由MDACC精准肿瘤学决策支持(PODS)组集中审查和批注。* * CCNE1扩增(拷贝数≥ 6)。ANC,中性粒细胞绝对计数;ctDNA,循环肿瘤DNA;ECOG,东部肿瘤协作组;Hgb,血红蛋白;NGS,下一代测序;PD,药效学;PK,药代动力学;RP2D,推荐2期剂量。
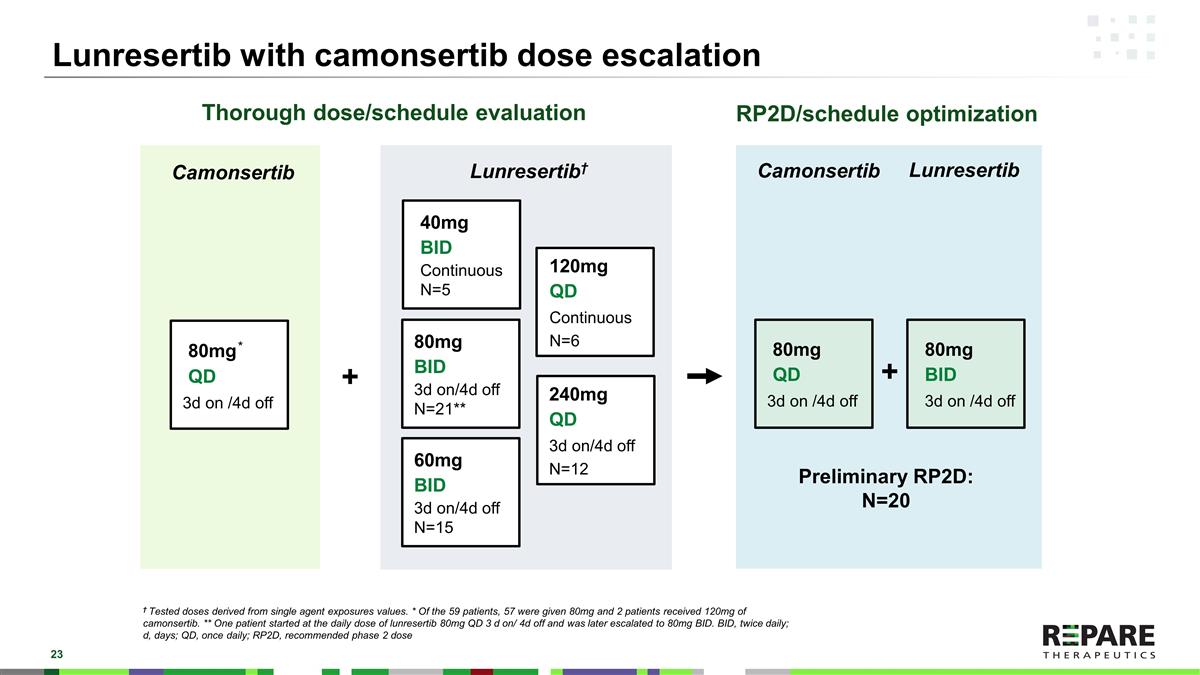
lunresertib with camonsertib dose escalation † Tested doses derived from single agent exposure values。* 59名病人中,57人服用80毫克,2人服用120毫克卡蒙塞替布。* *一名病人开始服用每日剂量的lunrestib 80mg QD,3天起/4天起,后来升至80mg BID。BID,每日两次;d,天;QD,每日一次;RP2D,推荐2期剂量彻底剂量/计划评估RP2D/计划优化120mg QD连续N = 6 40mg BID连续N = 5 80mg BID 3d on/4d off 240mg QD 3d on/4d off N = 12 80mg BID 3d on/4d off N = 21 * * Camonsertib 80mg QD 3d on/4d off 80mg * QD 3d on/4d off初步RP2D:N = 20 Camonsertib Lunresertib † Lunresertib + + 60mg BID 3d on/4d off N = 15
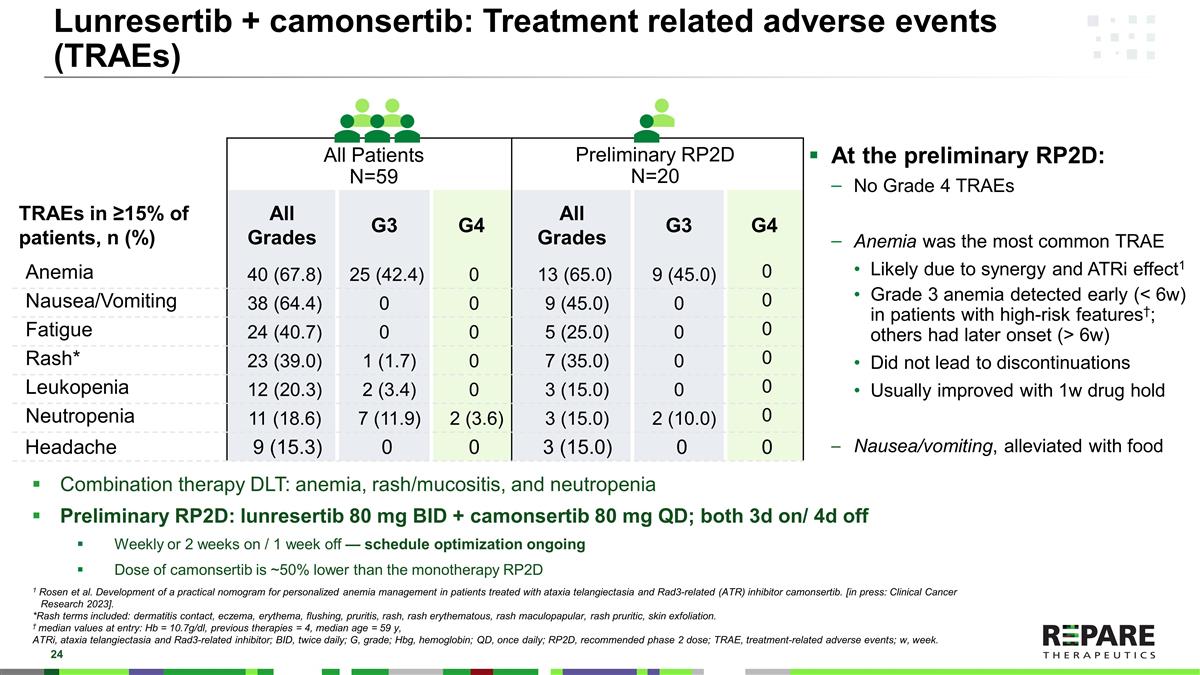
Lunresertib + camonsertib:≥ 15%的患者出现与治疗相关的不良事件(TRAEs),n(%)所有分级G3 G4所有分级G3 G4贫血40(67.8)25(42.4)013(65.0)9(45.0)0恶心/呕吐38(64.4)009(45.0)00疲劳24(40.7)005(25.0)00皮疹* 23(39.0)1(1.7)07(35.0)00白细胞减少12(20.3)2(3.4)03(15.0)00中性粒细胞减少11(18.6)7(11.9)2(3.6)3(15.0)2(10.0)0头痛9(15.3)003(15.0)00所有患者N = 59初步RP2D N = 20初步RP2D:无4级TRAE贫血最常见可能是由于协同作用和ATRi效应1在具有高危特征的患者中早期(< 6w)发现3级贫血;其他患者发病较晚(> 6w)未导致停药通常1w药物持有期改善恶心/呕吐,通过食物缓解联合疗法DLT:贫血、皮疹/粘膜炎,和中性粒细胞减少症初步RP2D:lunrestib 80 mg BID + camonsertib 80 mg QD;每周3天/4天或每周2周/1周—正在进行的方案优化camonsertib的剂量比单一疗法RP2D 1 Rosen等人。开发了一种实用的列线图,用于治疗共济失调毛细血管扩张症和Rad3相关(ATR)抑制剂camonsertib的患者的个性化贫血管理。[出版中:临床癌症研究2023 ]。*皮疹术语包括:皮炎接触、湿疹、红斑、潮红、瘙痒、皮疹、红斑、皮疹斑丘疹、皮疹瘙痒、皮肤脱落。†中位值:Hb = 10.7g/dl,既往治疗= 4,中位年龄= 59岁,ATRi,共济失调毛细血管扩张症和Rad3相关抑制剂;BID,每日两次;G,分级;Hbg,血红蛋白;QD,每日一次;RP2D,推荐2期剂量;TRAE,治疗相关不良事件;w,周。
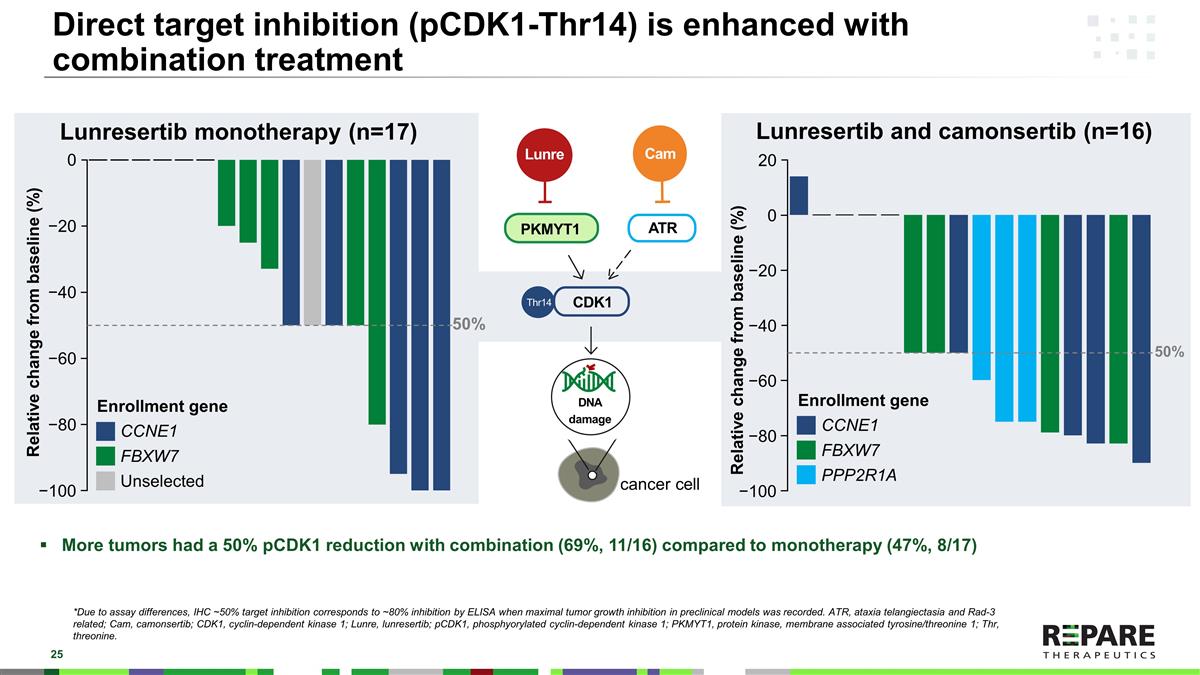
联合治疗可增强直接靶点抑制(pCDK1-Thr14)*由于试验差异,当临床前模型中记录到最大肿瘤生长抑制时,IHC~50%的靶点抑制与ELISA~80%的靶点抑制相对应。ATR、共济失调毛细血管扩张症和Rad-3相关;Cam、camonsertib;CDK1、细胞周期蛋白依赖性激酶1;Lunre、lunrestib;pCDK1、磷酸化细胞周期蛋白依赖性激酶1;PKMYT1、蛋白激酶、膜相关酪氨酸/苏氨酸1;Thr、苏氨酸。与单药治疗(47%,8/17)相比,联合治疗(69%,11/16)pCDK1降低50%的肿瘤更多Lunresertib单药治疗(n = 17)Lunresertib和camonsertib(n = 16)PKMYT1 CDK1癌细胞Thr14 DNA损伤ATR Lunre Enrollment基因CCNE1 FBXW7 PPP2R1A50 %相对于基线的相对变化(%)20 − 100 − 80 − 60 − 40 − 200相对于基线的相对变化(%)50% 0 − 20 − 40 − 60 − 80 − 100 Enrollment基因CCNE1 FBXW7 Unselected Cam
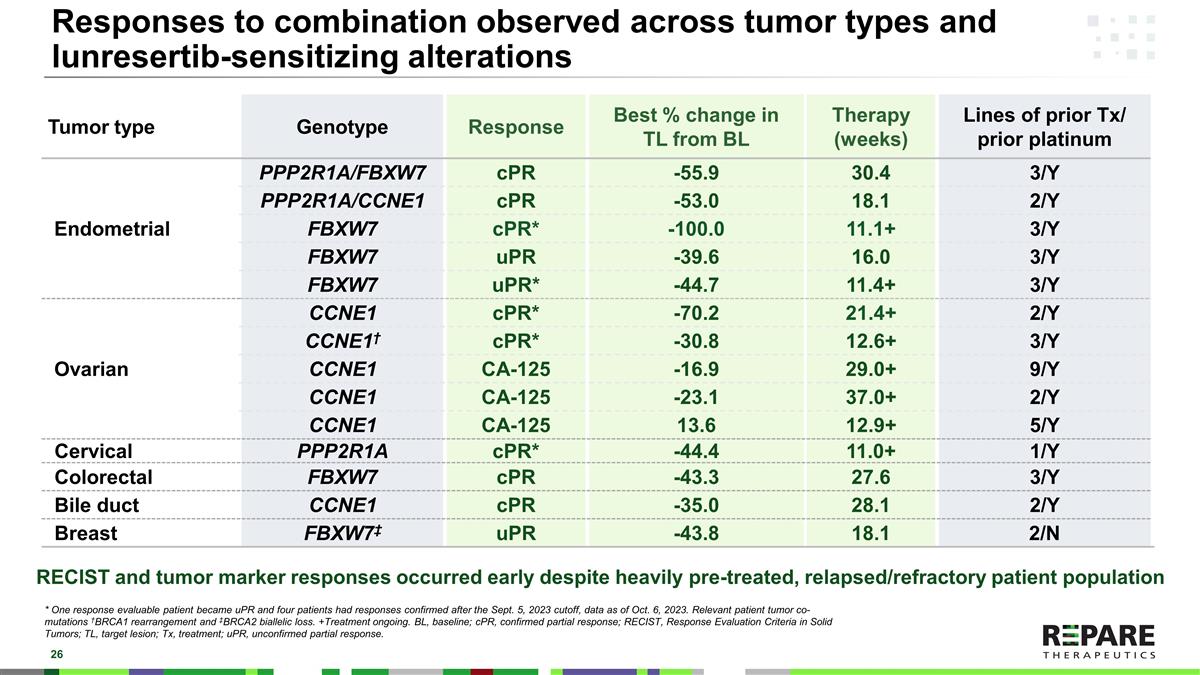
在肿瘤类型和lunrestib致敏改变中观察到的对组合的反应*一名可评估反应的患者成为uPR,四名患者在2023年9月5日截止日期后确认了反应,数据截至2023年10月6日。相关患者肿瘤共突变† BRCA1重排和TERM02双等位基因丢失。+治疗正在进行中。BL,基线;cPR,确认部分应答;RECIST,实体瘤的应答评估标准;TL,目标病变;Tx,治疗;uPR,未确认部分应答。RECIST和肿瘤标志物反应在早期发生,尽管经过了大量的预处理,复发/难治患者群体肿瘤类型基因型应答BL治疗后TL的最佳变化百分比(周)既往Tx/既往铂子宫内膜PPP2R1A/FBXW7 cPR-55.93 0.43/Y PPP2R1A/CCNE1 cPR-53.0 18.12/Y FBXW7 cPR *-100.0 11.1 + 3/Y FBXW7 uPR-39.6 16.03/Y FBXW7 uPR *-44.7 11.4 + 3/Y卵巢CCNE1 cPR *-70.2 21.4 + 2/Y CCNE1 † cPR *-30.81 2.6 + 3/Y CCNE1 CA-125-16.9 29.0 + 9/Y CCNE1 CA-125-23.1 37.0 + 2/Y
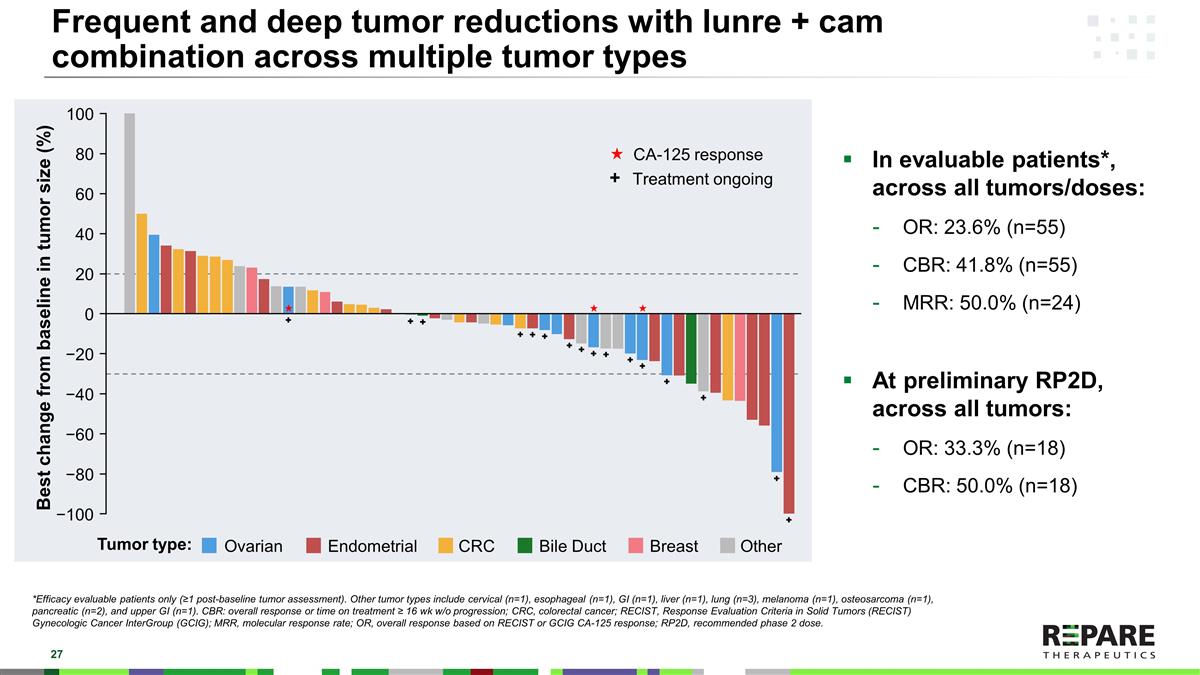
*仅限可评估疗效的患者(≥ 1例基线后肿瘤评估)。其他肿瘤类型包括颈椎(n = 1)、食管(n = 1)、胃肠道(n = 1)、肝脏(n = 1)、肺(n = 3)、黑色素瘤(n = 1)、骨肉瘤(n = 1)、胰腺(n = 2)和上胃肠道(n = 1)。CBR:总应答或治疗时间≥ 16周,无进展;CRC,结直肠癌;RECIST,实体肿瘤反应评估标准(RECIST)妇科癌间组(GCIG);MRR,分子应答率;OR,基于RECIST或GCIG CA-125应答的总应答;RP2D,推荐2期剂量。lunre + cam联合治疗多种肿瘤类型可评估的患者*,所有肿瘤/剂量:OR:23.6%(n = 55)CBR:41.8%(n = 55)MRR:50.0%(n = 24)初步RP2D,所有肿瘤:OR:33.3%(n = 18)CBR:50.0%(n = 18)CA-125反应治疗中+肿瘤类型:卵巢子宫内膜CRC胆管乳腺肿瘤大小与基线相比的其他最佳变化(%)100 − 80806040200 − 20 − 40 − 60 − 100
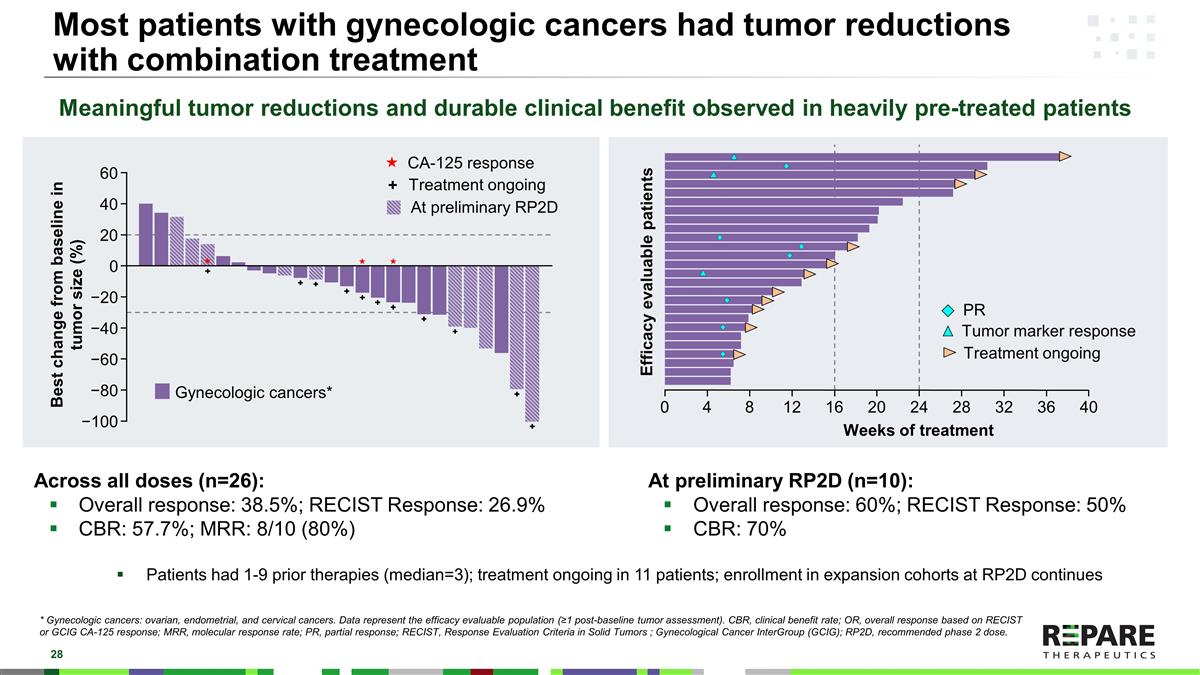
大多数妇科癌症患者在联合治疗下肿瘤缩小*妇科癌症:卵巢癌、子宫内膜癌和宫颈癌。数据代表疗效可评估人群(≥ 1个基线后肿瘤评估)。CBR,临床受益率;OR,基于RECIST或GCIG CA-125应答的总体应答;MRR,分子应答率;PR,部分应答;RECIST,实体瘤应答评估标准;妇科癌症组间(GCIG);RP2D,推荐2期剂量。在所有剂量(n = 26)中:总体应答率:38.5%;RECIST应答率:26.9% CBR:57.7%;MRR:8/10(80%)在初步RP2D(n = 10)时:总体应答率:60%;RECIST应答率:50% CBR:70%患者之前接受过1-9次治疗(中位数= 3);11名患者正在接受治疗;RP2D扩大队列的入组仍在继续有意义的肿瘤减少在接受大量预处理的患者中观察到的和持久的临床益处PR肿瘤标志物应答治疗进行中的妇科癌症*疗效可评估的患者治疗周数0481216202428323640肿瘤大小相对于基线的最佳变化(%)CA-125应答治疗进行中+ 6040200 − 20 − 40 − 60 − 80 − 100在初步RP2D
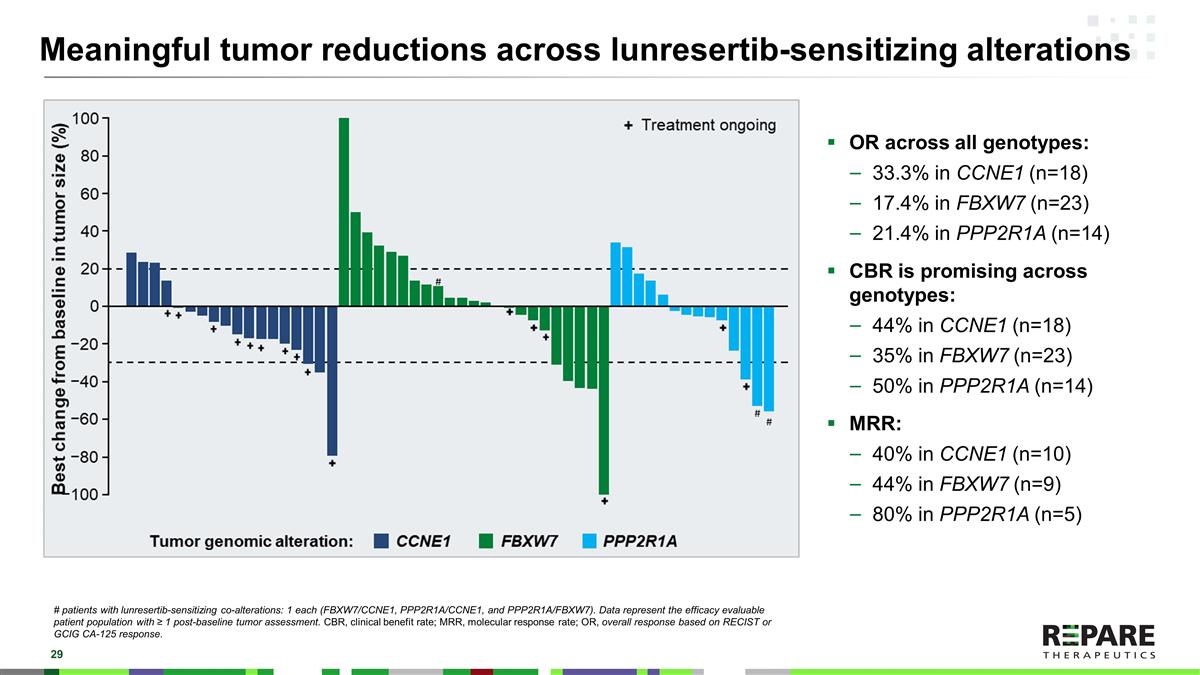
Lunrestib-sensitizing altations中有意义的肿瘤减少# Lunrestib-sensitizing co-altations患者:各1例(FBXW7/CCNE1、PPP2R1A/CCNE1和PPP2R1A/FBXW7)。数据表示具有≥ 1次基线后肿瘤评估的疗效可评估患者群体。CBR,临床受益率;MRR,分子反应率;OR,基于RECIST或GCIG CA-125反应的总体反应。所有基因型的OR:在CCNE1(n = 18)中占33.3%在FBXW7(n = 23)中占17.4%在PPP2R1A(n = 14)中占21.4% CBR在所有基因型中都很有希望:在CCNE1(n = 18)中占44%在FBXW7(n = 23)中占35%在PPP2R1A(n = 14)中占50% MRR:在CCNE1(n = 10)中占40%在FBXW7(n = 9)中占44%在PPP2R1A(n = 5)中占80%
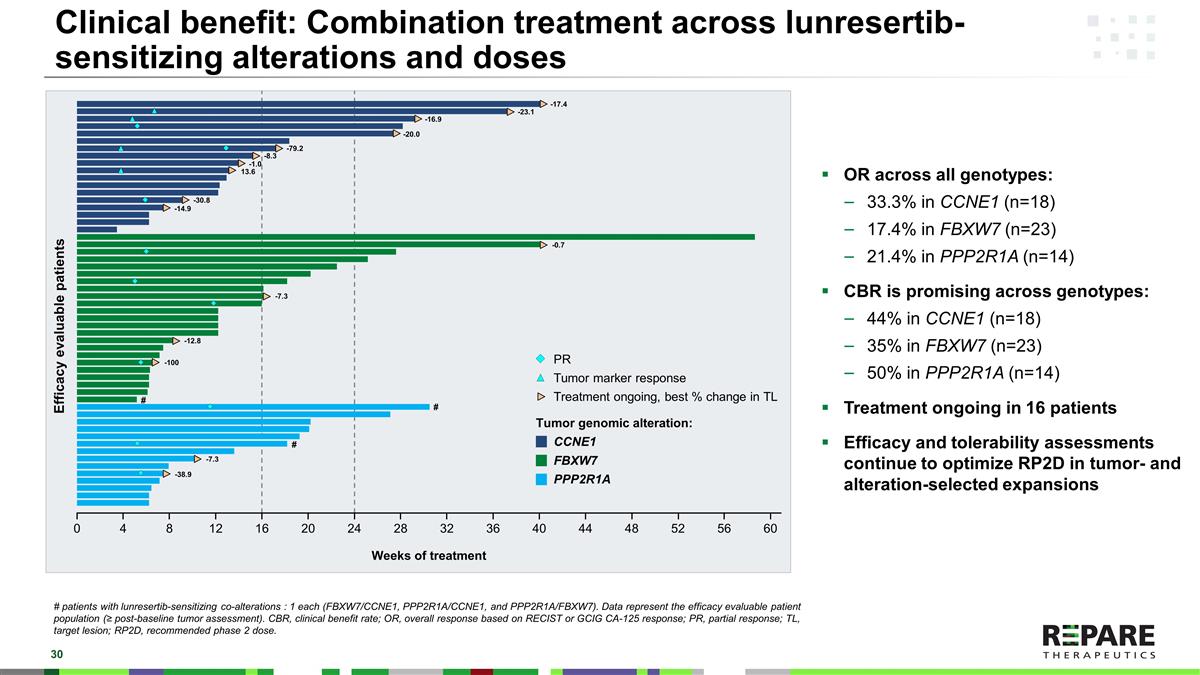
临床获益:在所有基因型中,针对lunrestib致敏改变和剂量的联合治疗:CCNE1(n = 18)为33.3%,FBXW7为17.4%,FBXW7(n = 23)为21.4%,PPP2R1A(n = 14)CBR在所有基因型中都很有希望:CCNE1为44%(n = 18),FBXW7为35%,PPP2R1A(n = 23),50%,PPP2R1A(n = 14),在16名患者中正在进行的治疗疗效和耐受性评估继续优化RP2D在肿瘤和改变选择的扩展中的疗效和耐受性评估#与lunrestib致敏共同改变的患者:各1名(FBXW7/CCNE1,PPP2R数据代表疗效可评估的患者群体(≥基线后肿瘤评估)。CBR,临床受益率;OR,基于RECIST或GCIG CA-125应答的总体应答;PR,部分应答;TL,目标病变;RP2D,推荐2期剂量。PR肿瘤标志物应答治疗正在进行,TL肿瘤基因组改变的最佳百分比变化:CCNE1 FBXW7 PPP2R1A-1.0-23.1-16.9-20.0-79.2-0.7-38.9-7.3-7.3-8.3 13.6-30.8-14.9-12.8-100-17.4治疗周疗效可评估患者04812162024283236404448525660 # # #
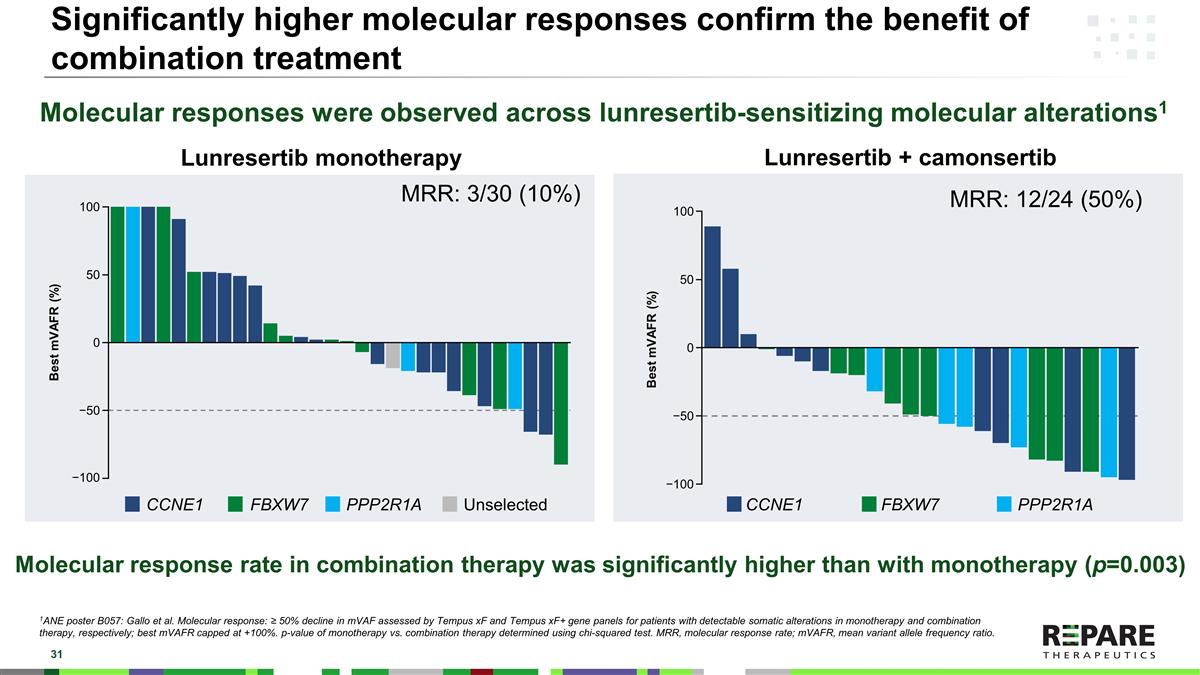
显著更高的分子反应证实了联合治疗的益处分子反应观察到了所有引起神经损伤的分子改变1 1ANE海报B057:Gallo等人。分子反应:Tempus xF和Tempus xF +基因组组评估的mVAF下降≥ 50%,分别用于单药治疗和联合治疗中可检测到的躯体改变的患者;最佳mVAFR上限为+ 100%。单药治疗与联合治疗的p值使用卡方检验确定。MRR,分子反应率;mVAFR,平均变异等位基因频率比。Lunresertib + camonsertib Lunresertib单药治疗的分子反应率显著高于单药治疗(p = 0.003)CCNE1 FBXW7 PPP2R1A MRR:12/24(50%)MRR:3/30(10%)CCNE1 FBXW7 PPP2R1A Unselected Best mVAFR(%)100500 − 50 − 100 Best mVAFR(%)100500 − 50 − 100
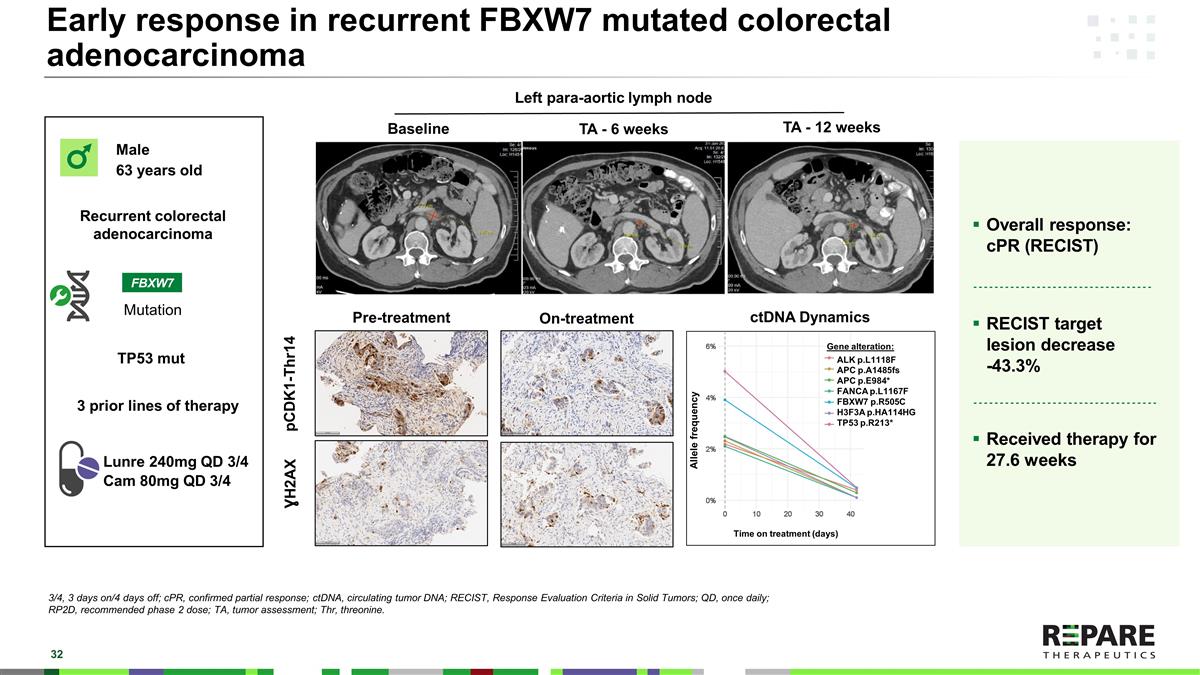
复发性FBXW7突变结直肠腺癌的早期反应FBXW7男性63岁复发性结直肠腺癌突变Lunre 240mg QD 3/4 Cam 80mg QD 3/4总体反应:cPR(RECIST)RECIST目标病灶减少-43.3 %接受治疗27.6周左主动脉旁淋巴结基线TA-6周TA-12周治疗前治疗中的ctDNA动态pCDK1-Thr14 H2AX基因改变:ALK p.L1118F APC p.A1485fs APC p.E984 * FANCA p.L1167F FBXW7 p.R505C H3F3A p.HHA实体瘤的反应评估标准;QD,每日一次;RP2D,推荐2期剂量;TA,肿瘤评估;Thr,苏氨酸。3个既往治疗线TP53 mut
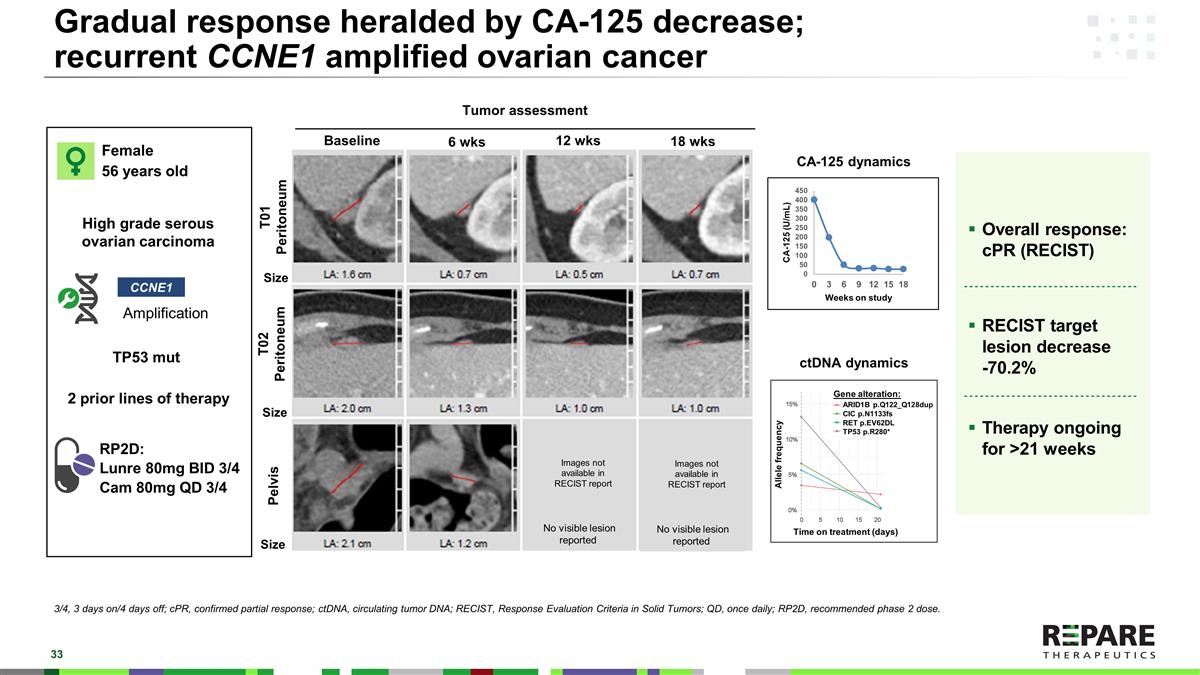
CA-125减少预示的逐渐缓解;复发性CCNE1扩增的卵巢癌总体缓解:cPR(RECIST)RECIST靶点病变减少-70.2 %治疗正在进行超过21周女性56岁高级别浆液性卵巢癌扩增RP2D:Lunre 80mg BID 3/4 Cam 80mg QD 3/4 CCNE1基线6周12周T01腹膜T02腹膜盆腔18周肿瘤评估大小大小RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D:RP2D实体瘤的反应评估标准;QD,每日一次;RP2D,推荐2期剂量。2个既往治疗线TP53 mut
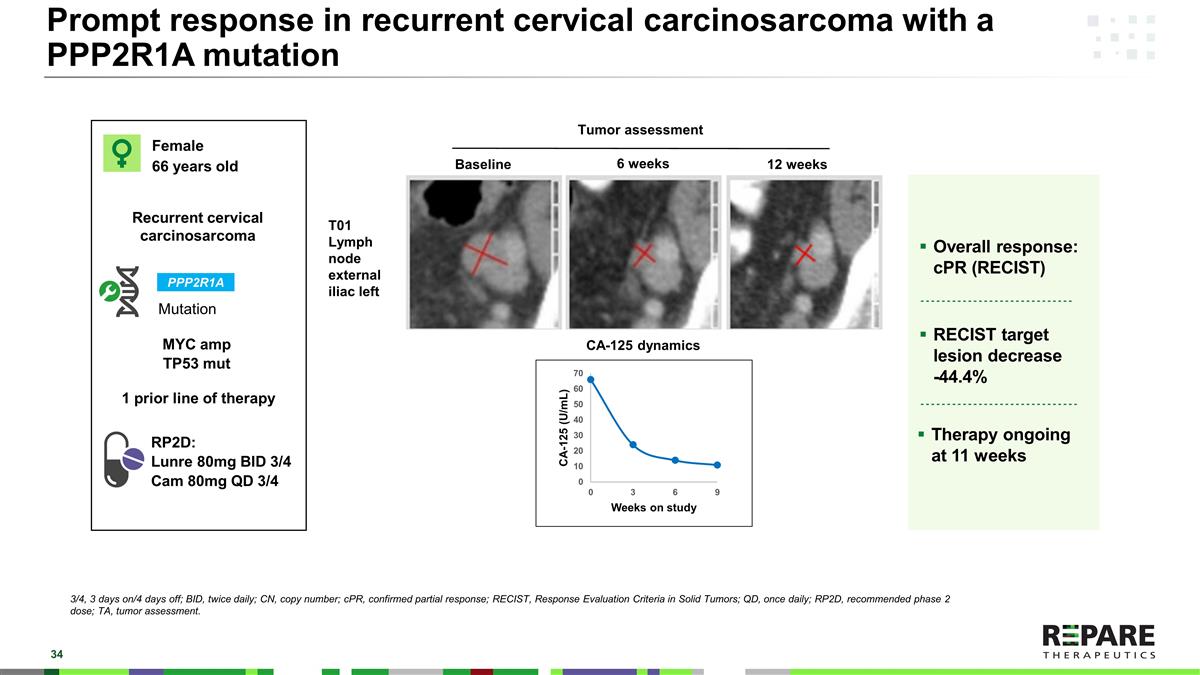
复发性宫颈癌肉瘤发生PPP2R1A突变时的快速反应女性66岁复发性宫颈癌肉瘤突变RP2D:Lunre 80mg BID 3/4 Cam 80mg QD 3/4 T01淋巴结左髂外PPP2R1A基线6周12周肿瘤评估CA-125动态总体反应:cPR(RECIST)RECIST目标病灶减少-44.4 %治疗持续11周3/4,3 days on/4 days off;BID,每日两次;CN,拷贝数;cPR,确认部分反应;RECIST,实体瘤反应评估标准;QD,每日一次;RP2D,推荐2期剂量;TA,肿瘤评估。1个先前的治疗线MYC amp TP53 mut

结论& Lunresertib发展计划Maria Koehler,医学博士,首席医疗官

Lunresertib:MYTHIC初步1期试验结果(M1:单一疗法)(M2:Camonsertib联合疗法)MONOTHERAPY安全、耐受性良好、抗肿瘤活性确定(N = 67)推荐2期剂量:80至100mg,每天两次,间歇性方案CAMONSERTIB联合疗法安全、耐受性良好、有希望的抗肿瘤活性跨越肿瘤和lunresertib致敏的基因组改变(N = 59)23.6% OR;41.8% CBR在可评估疗效的患者(N = 55)33.3% OR;50.0% CBR在初步RP2D范围内,在所有肿瘤中(N = 18)38.5% OR;在经过大量预处理的妇科癌症患者中为57.7% CBR(N = 26);在初步RP2D时有50%的RECIST应答(N = 10)初步推荐的2期剂量:Lunrestib 80mg每日两次,camonsertib 80mg每日一次,剂量/时间表优化持续OR,总体应答;CBR,临床受益率;RP2D,推荐的2期剂量。

Lunresertib + camonsertib联合疗法(补充数据)MYTHIC是一项剂量发现1期研究:初步确定RP2D范围,正在进行时间表优化。RP2D是重要的;只有18 pts在初步RP2D范围内被治疗。贫血是要缓解的主要耐受性问题。我们的经验*以及我们对贫血的新认识,为患者提供了一系列简单的解决方案。妇科癌症是迄今为止信号最强的最大试验人群。我们预计,随着患者人数的增加,在精制剂量和时间表下,信号将是强劲的。我们对其他多种肿瘤非常感兴趣。无数的机会,没有什么是不可能的。* Rosen等人开发了一种实用的列线图,用于治疗共济失调毛细血管扩张症和Rad3相关(ATR)抑制剂camonsertib的患者的个性化贫血管理。[出版中:临床癌症研究2023 ]。RP2D,推荐2期剂量。
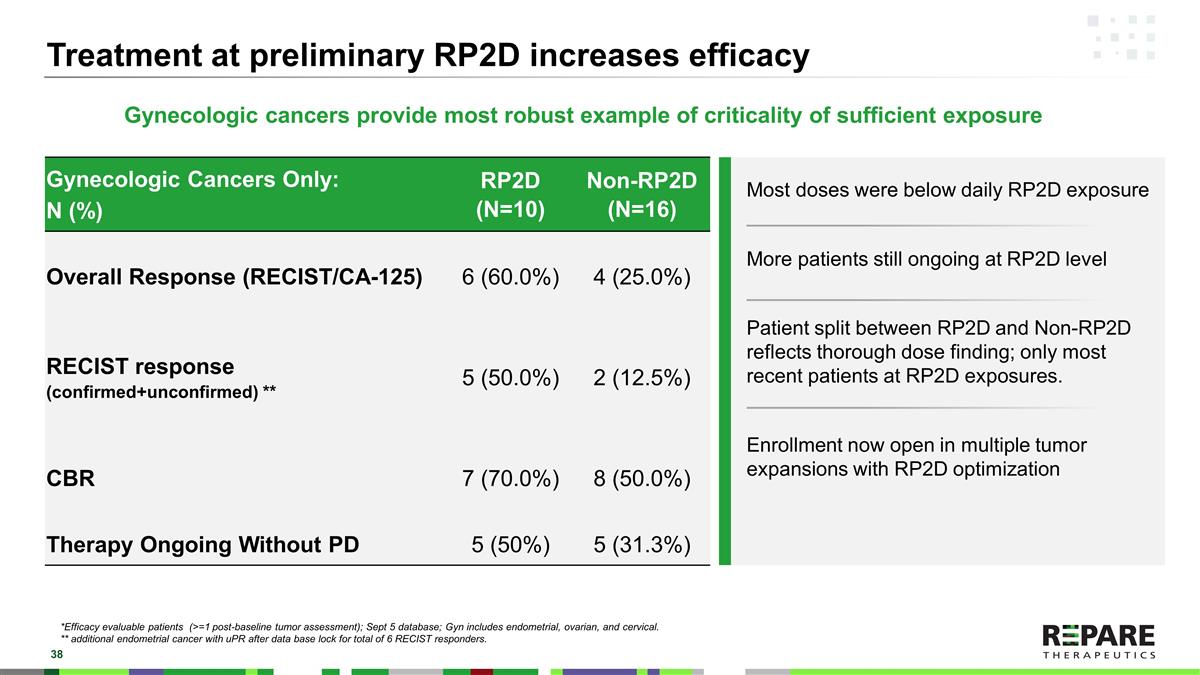
妇科癌症提供了充分暴露临界度的最可靠例证初步RP2D治疗可提高疗效仅妇科癌症:N(%)RP2D(N = 10)Non-RP2D(N = 16)总体应答(RECIST/CA-125)6(60.0%)4(25.0%)RECIST应答(确认+未确认)* * 5(50.0%)2(12.5%)CBR7(70.0%)8(50.0%)持续治疗无PD 5(50%)5(31.3%)*疗效可评估患者(> = 1个基线后肿瘤评估);9月5日数据库;Gyn包括子宫内膜、卵巢和宫颈。* *共有6名RECIST应答者在数据库锁定后可获得UPR的其他子宫内膜癌。大多数剂量低于每日RP2D暴露更多患者仍在RP2D水平患者在RP2D和非RP2D之间的差异反映了彻底的剂量发现;只有最近的大多数患者在RP2D暴露。使用RP2D优化的多个肿瘤扩展的注册现已开始
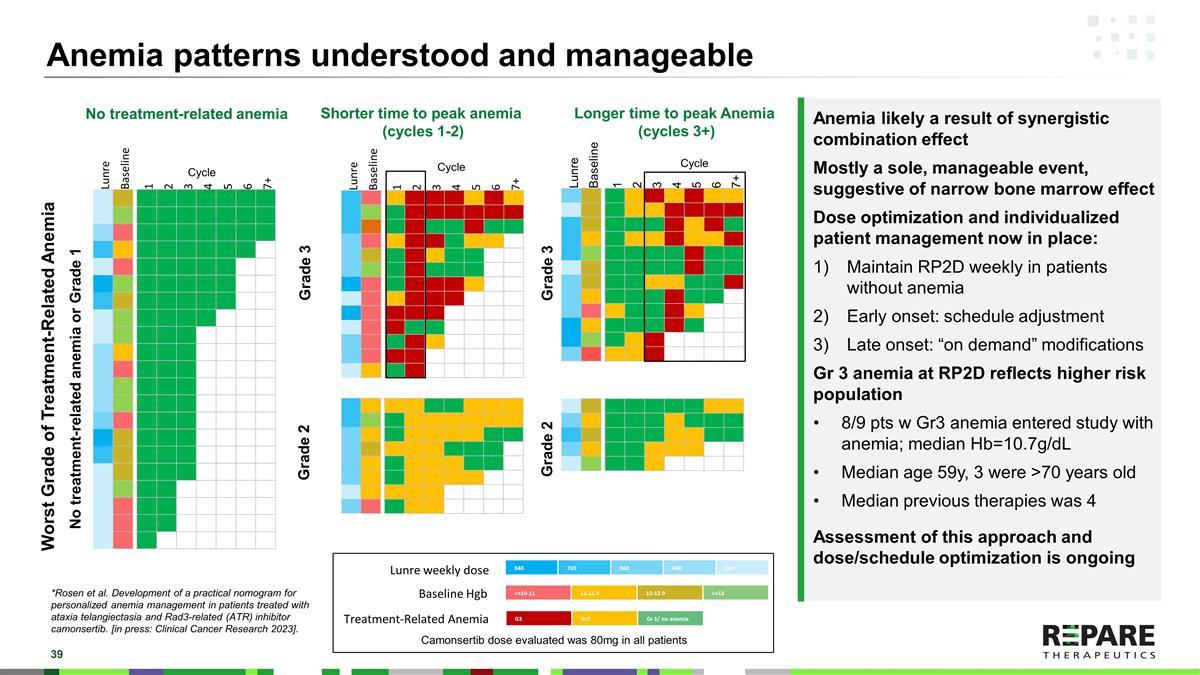
贫血可能是协同组合效应的结果大多数情况下是唯一的、可控的事件,提示骨髓效应狭窄。目前已实施剂量优化和个体化患者管理:无贫血患者每周维持RP2D发病早期:计划调整发病晚期:“按需”调整RP2D时的Gr3贫血反映了较高风险人群8/9 pts w Gr3贫血已进入贫血研究;中位Hb = 10.7g/dL中位年龄59岁,3人> 70岁中位数既往治疗是4对这种方法的评估和剂量/时间表的优化正在进行中了解贫血模式和可控制的最坏级别的治疗相关性贫血无治疗相关性贫血无治疗相关性贫血或1级3级2级贫血达到峰值时间较短(周期1-2)贫血达到峰值时间较长(周期3 +)3级2级840720560480360 Lunre每周剂量< = 10-11 11-11.9 12-12.9 > = 13基线Hgb G3 Gr2 Gr1/无贫血治疗相关性贫血Lunre基线1234567 + Lunre基线1234567 +周期周期周期Lunre基线1234567 + Camonsertib剂量在所有患者中评估为80mg * Rosen等人。开发实用列线图用于治疗共济失调毛细血管扩张症和Rad3相关(ATR)抑制剂camonsertib患者的个性化贫血治疗。[出版中:临床癌症研究2023 ]。
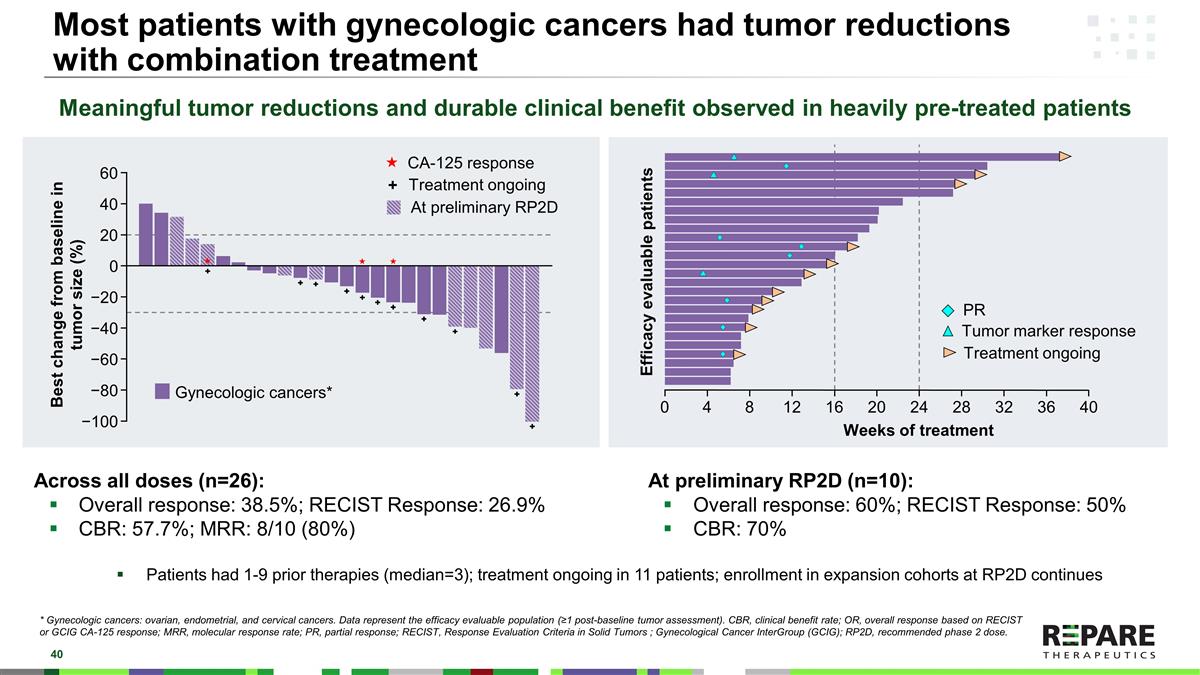
大多数妇科癌症患者在联合治疗下肿瘤缩小*妇科癌症:卵巢癌、子宫内膜癌和宫颈癌。数据代表疗效可评估人群(≥ 1个基线后肿瘤评估)。CBR,临床受益率;OR,基于RECIST或GCIG CA-125应答的总体应答;MRR,分子应答率;PR,部分应答;RECIST,实体瘤应答评估标准;妇科癌症组间(GCIG);RP2D,推荐2期剂量。在所有剂量(n = 26)中:总体应答率:38.5%;RECIST应答率:26.9% CBR:57.7%;MRR:8/10(80%)在初步RP2D(n = 10)时:总体应答率:60%;RECIST应答率:50% CBR:70%患者之前接受过1-9次治疗(中位数= 3);11名患者正在接受治疗;RP2D扩大队列的入组仍在继续有意义的肿瘤减少在接受大量预处理的患者中观察到的和持久的临床益处PR肿瘤标志物应答治疗进行中的妇科癌症*疗效可评估的患者治疗周数0481216202428323640肿瘤大小相对于基线的最佳变化(%)CA-125应答治疗进行中+ 6040200 − 20 − 40 − 60 − 80 − 100在初步RP2D
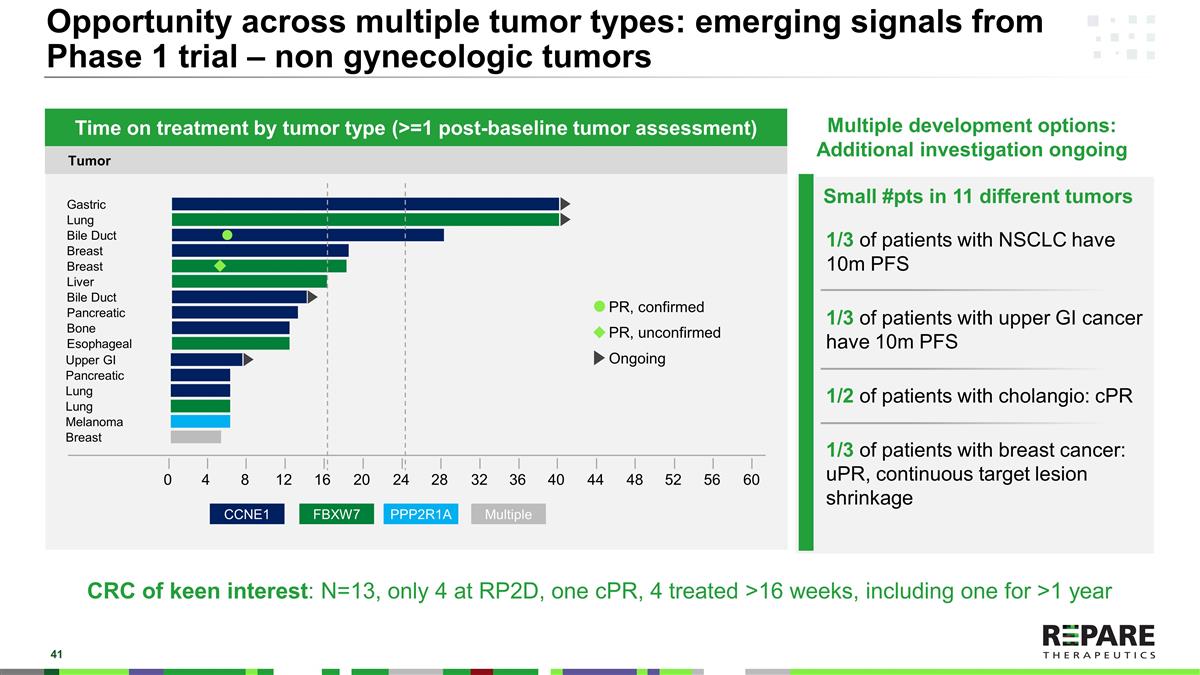
11种不同肿瘤中的小#患者1/3的NSCLC患者有10m PFS 1/3的上GI癌患者有10m PFS 1/2的胆管癌患者:cPR 1/3的乳腺癌患者:uPR,跨多个肿瘤类型的持续靶病变缩小机会:来自1期试验的新信号-非妇科肿瘤按肿瘤类型分类的治疗时间(> = 1个基线后肿瘤评估)多个开发选择:正在进行的额外研究多个PPP2R1A FBXW7 CCNE1 04812162024283236404448525660乳腺黑色素瘤肺肺肺胰腺上GI食管骨胰胆管肝乳腺胆管肺PR,确诊PR,未确诊正在进行的密切关注的肿瘤CRC:N = 13,仅4个RP2D,1个cPR,4个治疗> 16周,包括一年以上
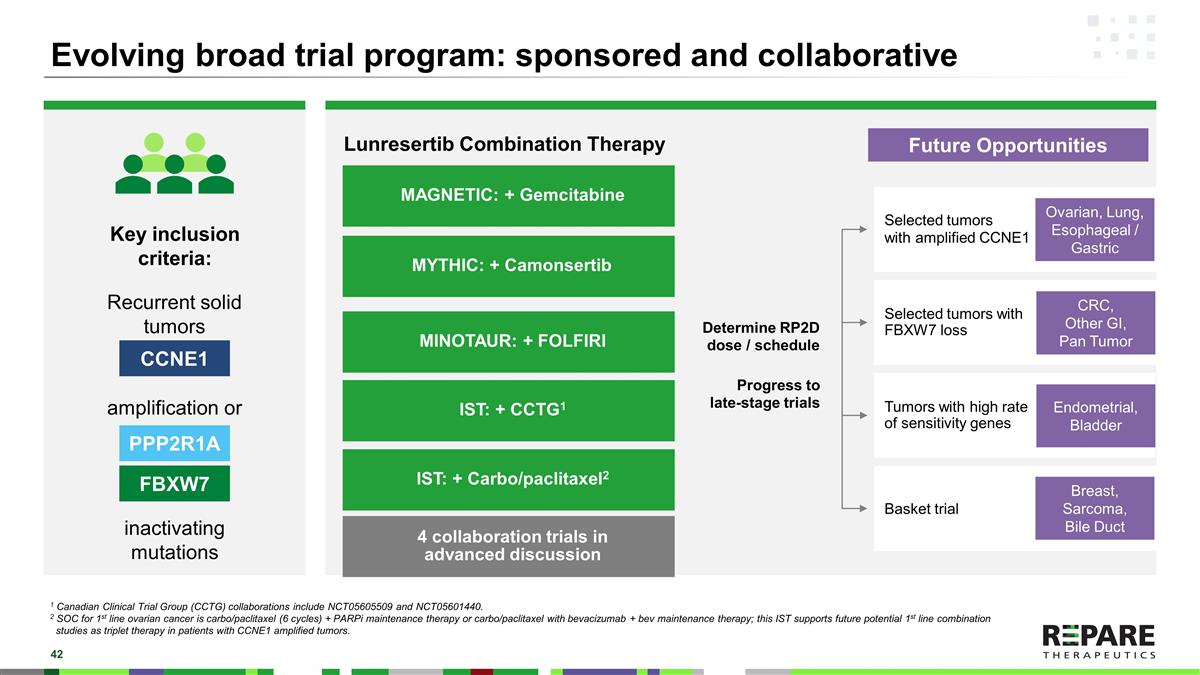
发展中的广泛试验项目:赞助和合作的PPP2R1A FBXW7复发性实体瘤关键纳入标准:CCNE1扩增或失活突变决定RP2D剂量/时间表后期试验进展MAGNETIC:+ Gemcitabine MYTHIC:+ Camonsertib MINOTAUR:+ FOLFIRI IST:+ CCTG1 IST:+ Carbo/paclitaxel2 Lunrestib联合治疗FBXW7缺失率高的肿瘤Basket trial 1 Canadian Clinical Trial Group(CCTG)合作的项目包括NCT05605509和NCT05601440。2一线卵巢癌的SOC是卡波/紫杉醇(6个周期)+ PARPi维持疗法或卡波/紫杉醇与贝伐珠单抗+ bev维持疗法;该IST支持未来潜在的一线联合研究,作为CCNE1扩增肿瘤患者的三联疗法。CCNE1扩增的卵巢、肺、食管/胃未来机会CRC、其他GI、泛肿瘤子宫内膜、膀胱乳腺、肉瘤、胆管4项合作试验在高级讨论中

随着MYTHIC的推进,肿瘤学和患者社区对加速lunresertib开发的新数据产生了高度兴趣MYTHIC试验:关键要点和后续步骤验证lunresertib作用机制和SNIPRx临床前患者选择方法安全性、耐受性和早期疗效信号在camonsertib联合治疗中得到证实50%的RECIST反应在camonsertib联合治疗中观察到,在最大的队列(妇科肿瘤)中,在初步RP2D中观察到10例RECIST反应,强调在其他肿瘤类型中的高机会,我们现在正在进行MYTHIC试验,以评估联合疗法在具有特定肿瘤类型和基因组改变的患者中的应用;预计在2024年下半年报告更多数据对贫血模式的清晰理解有助于方便患者的简单管理;2024年更新

即将到来的催化剂Lloyd M. Segal,总裁兼首席执行官
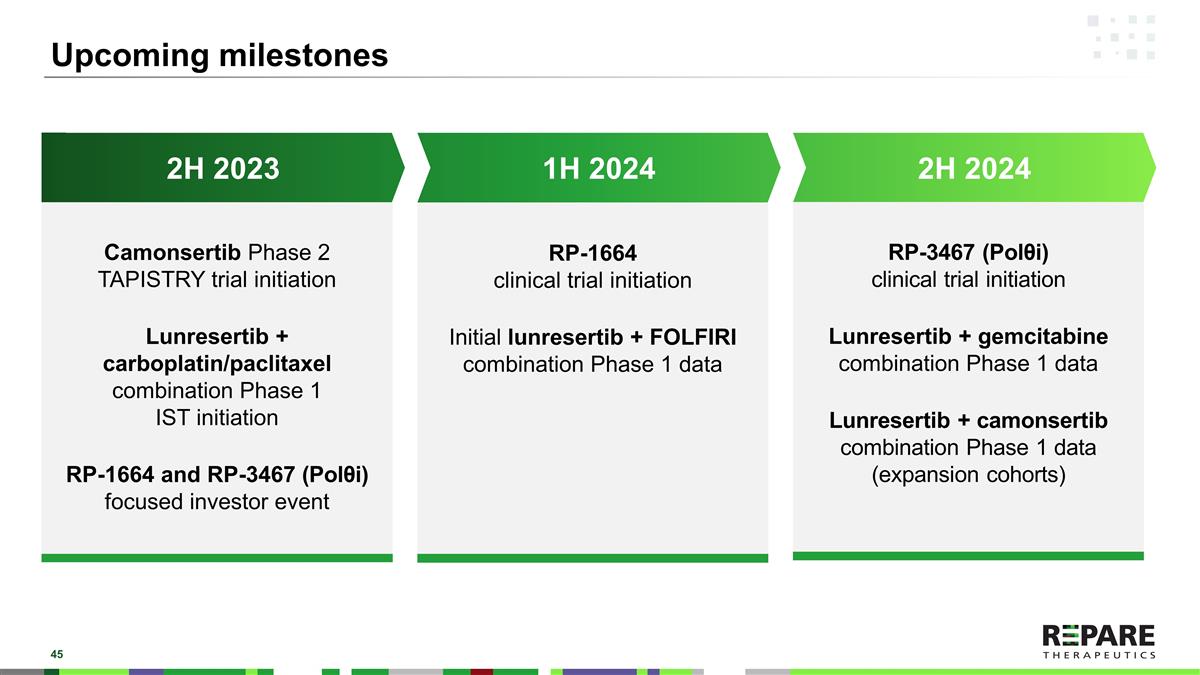
即将到来的里程碑2H 2024 2H 2023 1H 2024 Camonsertib 2期TAPISTRY试验启动Lunresertib +卡铂/紫杉醇组合1期IST启动RP-1664和RP-3467(Pol θ i)重点投资者事件RP-1664临床试验启动Initial lunresertib + FOLFIRI组合1期数据RP-3467(Pol θ i)临床试验启动Lunresertib +吉西他滨组合1期数据Lunresertib + camonsertib组合1期数据(扩展队列)

Lloyd M. Segal总裁兼首席执行官Timothy Yap,MBBS,博士,FRCP MYTHIC试验首席研究员Maria Koehler,医学博士,博士首席医疗官Steve Forte,注册会计师首席财务官 Mike Zinda,博士首席科学官

洞察力丰富。赋予力量的精确度。Lunresertib MYTHIC临床试验更新2023年10月13日