由Aerovate Therapeutics, Inc.备案
根据1933年《证券法》第425条规则
标的公司:Aerovate Therapeutics, Inc.
委托档案编号:001-40544
日期:2025年4月9日
该备案涉及根据截至2024年10月30日的特定协议和合并计划的条款,由特拉华州公司Aerovate Therapeutics, Inc.(“Aerovate”)、特拉华州公司Jade Biosciences,Inc.(“Jade”)、特拉华州公司Caribbean Merger Sub I,Inc.(特拉华州公司和Aerovate的全资子公司(“Merger Sub I”)以及特拉华州有限责任公司和Aerovate的全资子公司Caribbean Merger Sub II,LLC(“Merger Sub II”,连同Merger Sub I,“Merger Subs”)(“合并协议”),据此,及在合并协议所载条件达成或获豁免的情况下,除其他事项外,合并子I将与Jade合并并并入Jade,Jade作为存续公司在合并中存续(“第一次合并”),而作为同一整体交易的一部分,Jade将与合并子II合并并并入合并子II,而合并子II继续作为Aerovate的全资附属公司及合并的存续公司(“第二次合并”,连同第一次合并,“合并”)。
于2025年4月9日,Jade发表以下通讯:

2025年4月公司概况

2本演示文稿仅供参考,仅为与Jade Biosciences,I NC相关的某些信息的摘要。(“公司”)。它并不声称是完整的,也不包含投资者在做出投资决定时可能需要考虑的所有信息。此处包含的信息不包含投资、法律、会计、监管、税收或其他建议,并且这些信息没有考虑到您的投资目标或法律、会计、监管、税收或财务状况或特定需求。投资者必须对投资机会进行自己的调查,并仅根据该投资者的独立审查和根据该投资者掌握的信息或该投资者从公司获得的信息所确定的对公司前景的判断来评估获得公司证券的风险,包括其优点和风险inv olved。除非本文另有说明,否则本演示文稿中的陈述自本文件发布之日起作出。在任何情况下,在任何时候交付本prese nta不应造成暗示,在该日期之后的任何时间,本文件所包含的信息是正确的。公司没有义务更新或保持本文件所载的最新信息。不对此处所载信息或意见的公平性、准确性、完整性或COR公正性作出任何明示或暗示的陈述或保证,也不应予以依赖,您对这些信息或意见的任何依赖将由您自行承担风险。对于因使用本文件或其内容而直接或间接产生的任何损失,本公司、其关联公司和顾问不承担任何责任。前瞻性陈述和其他信息本演示文稿中包含的某些非历史事实描述的陈述属于“前瞻性陈述”。“当我们使用诸如“潜在”、“可能”、“将”、“预计”、“可能”、“预期”、“说明性”、“估计”或类似的表达方式,而这些表达方式并不仅仅与历史事件相关时,我们就是在做出令人费解的陈述。前瞻性陈述不是对未来业绩的保证,涉及风险和不确定性,可能导致我们的实际结果与我们在前瞻性陈述中提出的预期存在重大差异。这可能是多种因素造成的结果,包括但不限于:我们的管理团队对fut ure的预期、希望、信念、意图或战略,包括但不限于以下方面的陈述:收盘前的融资以及与Aerovate Therapeutics, Inc.合并的协议和计划所设想的其他交易,以及与之相关的预期效果s、感知到的利益或机会以及相关时机,关于发现的预期或计划,临床前研究,临床试验和研发计划及时代;关于收益用途的预期以及我们的资本资源将足以为我们的预期运营提供资金的时间段;以及关于自身免疫疗法的市场和潜在机会的声明。本演示文稿中包含的所有前瞻性陈述,无论是明示的还是暗示的,都完全受到本警示性陈述的明确限定。请注意,不要过分依赖任何前瞻性陈述。除适用法律另有要求外,我们不承担更新任何前瞻性陈述的义务,所有这些陈述均受到本警示性陈述的明确限定,以反映本演示文稿日期之后的事件或情况。本次演示涉及正在临床研究中的候选药物,这些候选药物尚未成为美国食品和药物管理局的PPP宠儿。这些目前受联邦法律限制为调查用途,对于它们被调查的目的,没有就其安全性或有效性作出任何陈述。市场和行业数据本演示文稿中包含的某些信息和在本演示文稿中口头作出的陈述与研究、出版物和从第三方来源获得的其他数据以及我们自己的内部估计和研究有关或基于这些信息。虽然我们认为这些第三方来源截至本呈报日期是可靠的,但我们没有独立核实,也不对以下内容的充分性、公平性、准确性或完整性作出任何陈述, 从第三方来源获得的任何信息。从这些来源获得的预测和其他前瞻性信息受制于与本演示文稿中其他前瞻性陈述相同的资格和不确定性。关于我们的市场和c竞争头寸数据的陈述是基于我们目前可获得的市场数据,以及管理层关于公司的内部分析和假设,其中涉及某些假设和估计。这些internal分析没有得到任何独立来源的验证,无法保证这些假设或估计是准确的。虽然我们不知道与我们在此提供的数据有关的任何错误陈述,但我们的估计涉及风险和不确定性,并且可能会根据各种因素而发生变化。因此,我们无法保证本演示文稿中包含的此类信息的准确性或完整性。免责声明
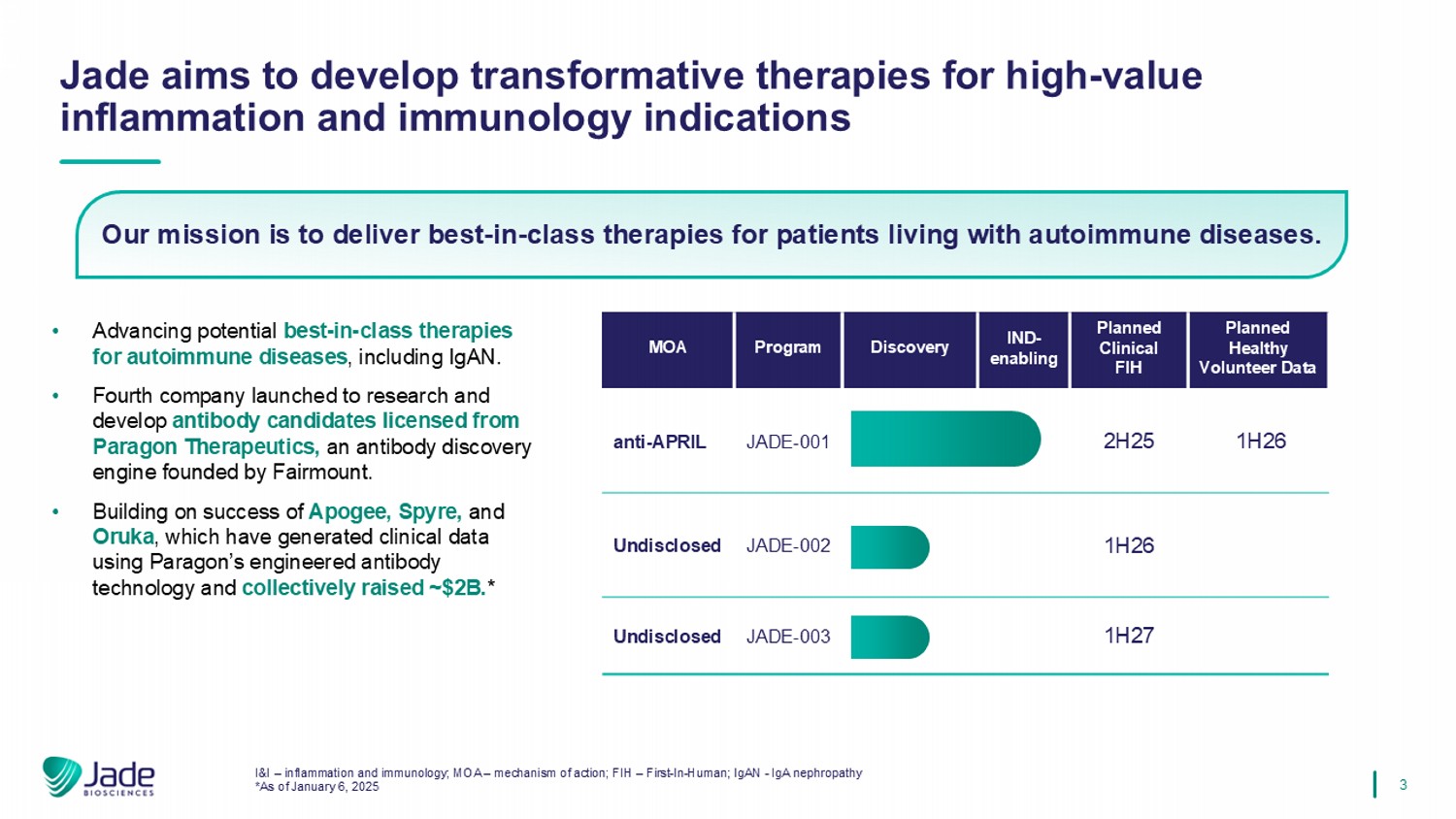
3 •推进包括IgAN在内的自身免疫性疾病潜在的同类最佳疗法。• Fourth company launched to research and develop antibody candidates licensed from Paragon Therapeutics,a antibody discovery engine founded by Fairmount。•以Apogee、Spyre和Oruka的成功为基础,这些公司使用Paragon的工程抗体技术产生了临床数据,并集体筹集了~$ 2B。*Jade旨在为高值炎症和免疫学适应症开发变革性疗法我们的使命是为患有自身免疫性疾病的患者提供一流的疗法。I & I –炎症和免疫学;MOA –作用机制;FIH – first-in-人;Igan-IgA肾病*截至2025年1月6日计划健康志愿者数据计划临床FIHIND-使能发现计划MOA1H26 2H25 JADE-001 anti-April 1H26 JADE-002未披露1H27 JADE-003未披露

4经验丰富的团队,背后有Paragon的支持Andrew King CSO、研发公司领导力主管Tom Frohlich CEO Valerie Fauvelle高级副总裁、监管与质量Hetal Kocinsky CMO Jonathan Quick高级副总裁、财务Amy Sullivan高级副总裁、开发运营Elizabeth Balta GC &公司秘书Sandy Lewis生物识别与临床战略高级副总裁Jason Wright高级副总裁、化学、制造与控制丨劳伦斯克莱因丨Lawrence Klein董事会Eric Dobmeier董事会主席丨Chris Cain Chris Cain董事会丨Erin Lavelle Erin Lavelle董事会Tom Frohlich董事会Lori Stewart高级副总裁、人民

5 JADE-001:一种潜在的同类最佳抗APRIL MAB用于IgAN

6个HV –健康志愿者;POC –概念验证Jade正在开发一种潜在的同类最佳抗APRIL MAB,旨在使IgAN中的疾病修饰MoA保密估计10B +美元的品牌市场目前的治疗方法未能充分满足典型的年轻IGAN患者群体对长期疾病修饰疗法的需求,该机制有可能是疾病修饰,减少致病性IGA和蛋白尿,稳定肾功能潜在的同类最佳配置文件JADE-001专为卓越的效力和延长的半衰期而设计,以实现最大的功效和方便的终生给药-长期治疗获得POC的有效途径和与IGAN疗效相关的上市HV IGA生物标志物;替代终点支持潜在的IGAN批准Anti-APRIL类有望成为IGAN的主导治疗
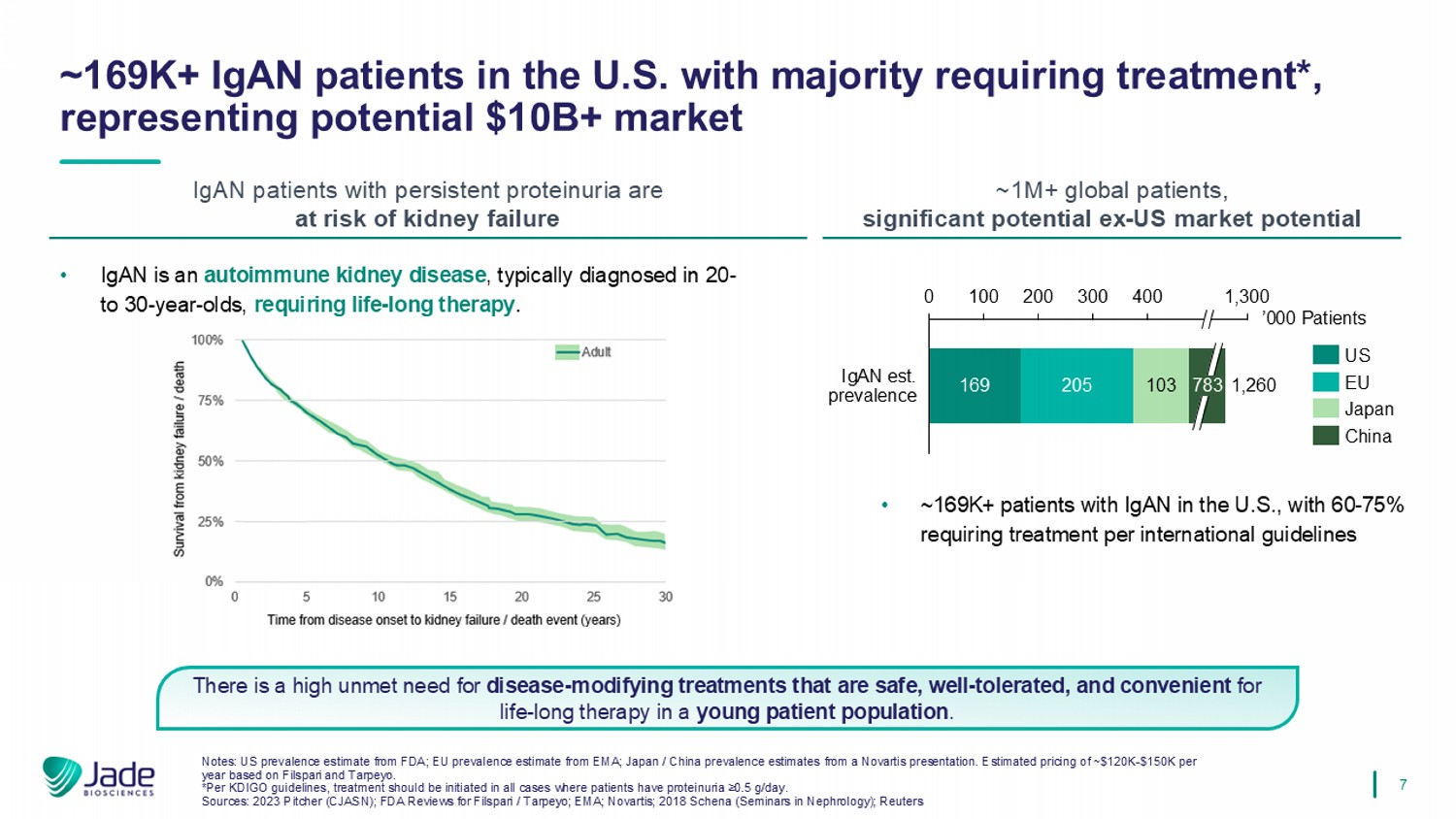
7在年轻的患者群体中,对安全、耐受性良好、方便终生治疗的疾病-修饰治疗有很高的未满足需求。• IgAN是一种自身免疫性肾脏疾病,通常诊断于20至30岁的人群,需要终生治疗。•美国IGAN患者~169K +,有60-75 %按国际指南需要治疗~美国IGAN患者169K +,多数需要治疗*,代表潜在的$ 10B +市场持续蛋白尿的IgAN患者有肾衰竭风险~100万+全球患者,显着潜在的美国前市场潜力16920510301002003004001,300 ' 000患者783 IGAN est.流行率1,260美国欧盟日本中国注:FDA的美国流行率估计;EMA的欧盟流行率估计;诺华公司的日本/中国流行率估计。基于Filspari和Tarpeyo的估计定价为每年~$ 120k-$ 150k。*根据KDIGO指南,所有患者蛋白尿≥ 0.5克/天的病例均应开始治疗。资料来源:2023 Pitcher(CJASN);FDA对Filspari/Tarpeyo的审查;EMA;诺华;2018 Schena(肾脏病学研讨会);路透
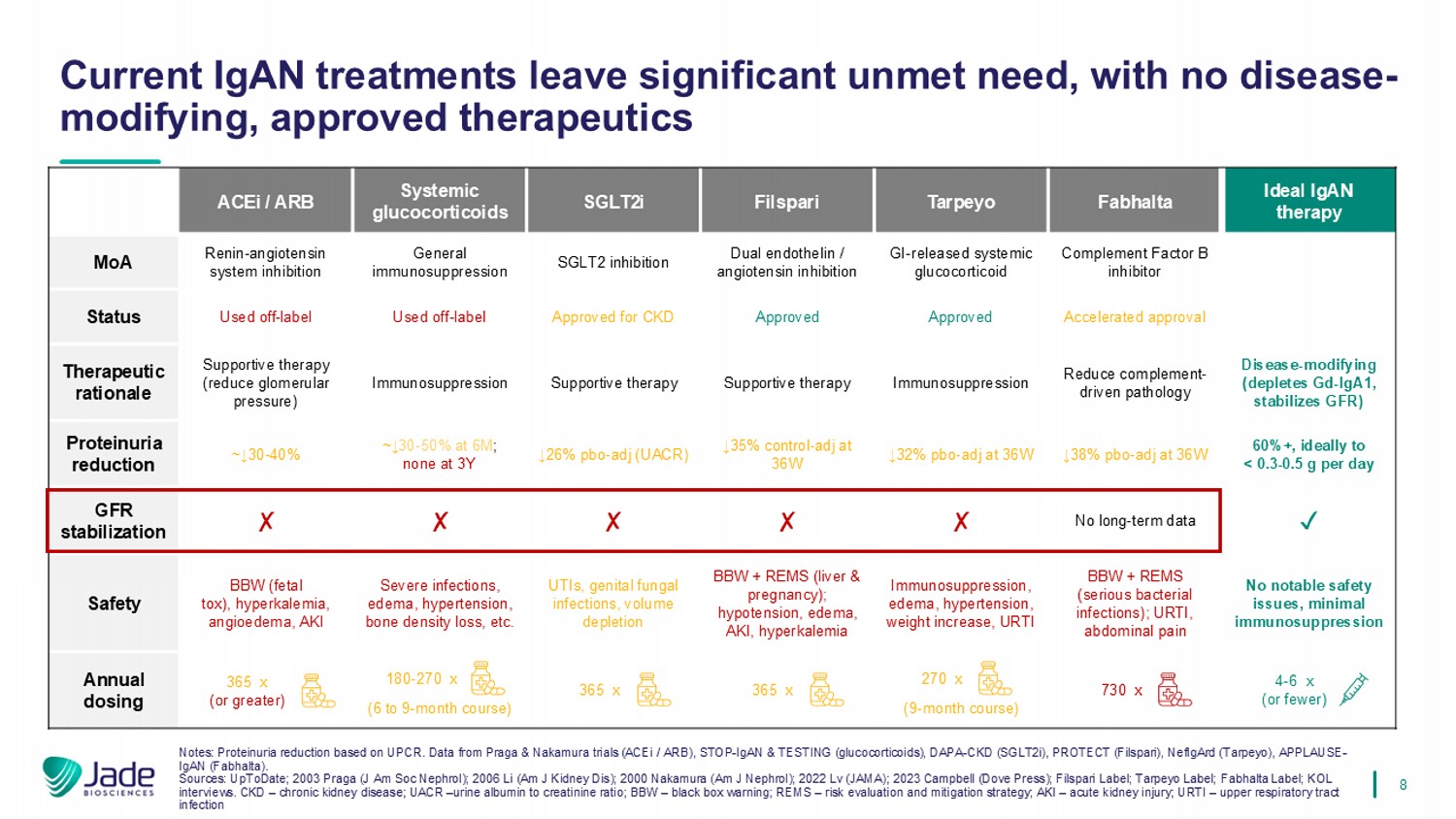
8理想IgAN疗法Fabhalta Tarpeyo Filspari SGLT2i全身性糖皮质激素ACEi/ARB补体因子B抑制剂GI-释放全身性糖皮质激素双重内皮素/血管紧张素抑制SGLT2抑制一般免疫抑制肾素-血管紧张素系统抑制MoA加速批准批准批准批准批准批准批准批准用于CKD使用的脱标使用的脱标状态疾病-修饰(消耗GD-IGA1,稳定GFR)减少补体驱动的病理免疫抑制支持疗法支持疗法免疫抑制支持疗法(降低肾小球压)治疗原理60% +,最好每天< 0.3-0.5 g ↓ 38% pbo-adj at 36W ↓ 32% pbo-adj at 36W ↓ 35%对照-adj at 36W ↓ 26% pbo-adj(UACR)~↓ 30-50 % at 6m;3Y时无~↓ 30-40 %蛋白尿减少丨无长期数据GFR稳定无显着安全性问题,免疫抑制极小BBW + REMS(严重细菌感染);URTI、腹痛免疫抑制、水肿、高血压、体重增加、URTI丨BBW丨+ REMS(肝脏&妊娠);低血压、水肿、AKI、高钾血症UTI、生殖器真菌感染、容量耗竭严重感染,水肿、高血压、骨密度下降等。BBW(胎儿TOX)、高钾血症、血管性水肿、AKI安全性(9个月疗程)(6至9个月疗程)年度给药须知:基于UPCR的蛋白尿减少。数据来自Praga & Nakamura试验(ACEi/ARB)、STOP-IgAN & Testing(糖皮质激素)、DAPA-CKD(SGLT2i)、ProtECT(Filspari)、NeFIGArd(Tarpeyo)、AppLAUSe-IgAN(Fabhalta)。资料来源:UpToDate;2003 Praga(J Am Soc Nephrol);2006 Li(Am J Kidney DIS);2000 Nakamura(Am J Nephrol);2022 LV(JAMA);2023 Campbell(Dove Press);Filspari Label;Tarpeyo Label;Fabhalta Label;KOL采访。CKD –慢性肾脏病;UACR –尿白蛋白与肌酐比率;BBW –黑框警告;REMS –风险评估和缓解策略;AKI –急性肾损伤;URTI –上呼吸道感染当前的IGAN治疗留下显着未满足的需求,没有疾病修饰,批准的疗法180-270 x 4-6 x(或更少)365 x(或更大)365 x 365 x 730 x 270 x

9来源:KDIGO指南公开审查草案;2023 Mathur(NEJM);Jade analysis KDIGO –肾脏疾病改善全球结果KDIGO指南的拟议更新突出了对JADE-001等疗法的需求,这可能会减少病原性IgA机密KDIGO更新,预计会增加IgAN诊断,扩大需要治疗的风险患者群体,降低蛋白尿目标到临床缓解,并需要降低病原性IgA的靶向治疗。存在进行性肾功能丧失风险的IgAN管理IgAN-肾单位丢失的特定驱动因素管理对IgAN诱导的肾单位丢失的通用反应所有患者肾单位丢失的驱动因素这些应同时解决减少IgA和IgA免疫复合物的致病形式形成减少肾小球炎症血压控制减少肾小球过滤以及蛋白尿对肾小管间质的影响心血管风险降低•扩大患者群体——推荐所有蛋白尿≥ 0.5g/d且IgAN为可能诊断的成人进行肾脏活检——建议所有患者参加IgAN登记•降低蛋白尿目标——确立新的治疗目标:蛋白尿维持在< 0.5g/日,最好是< 0.3克/天丨建议在所有患者蛋白尿≥ 0.5克/天的情况下都应开始额外治疗•重新定义治疗目标——新指南规定临床医生应纳入已被证明可降低致病形式的IgA治疗目标的治疗
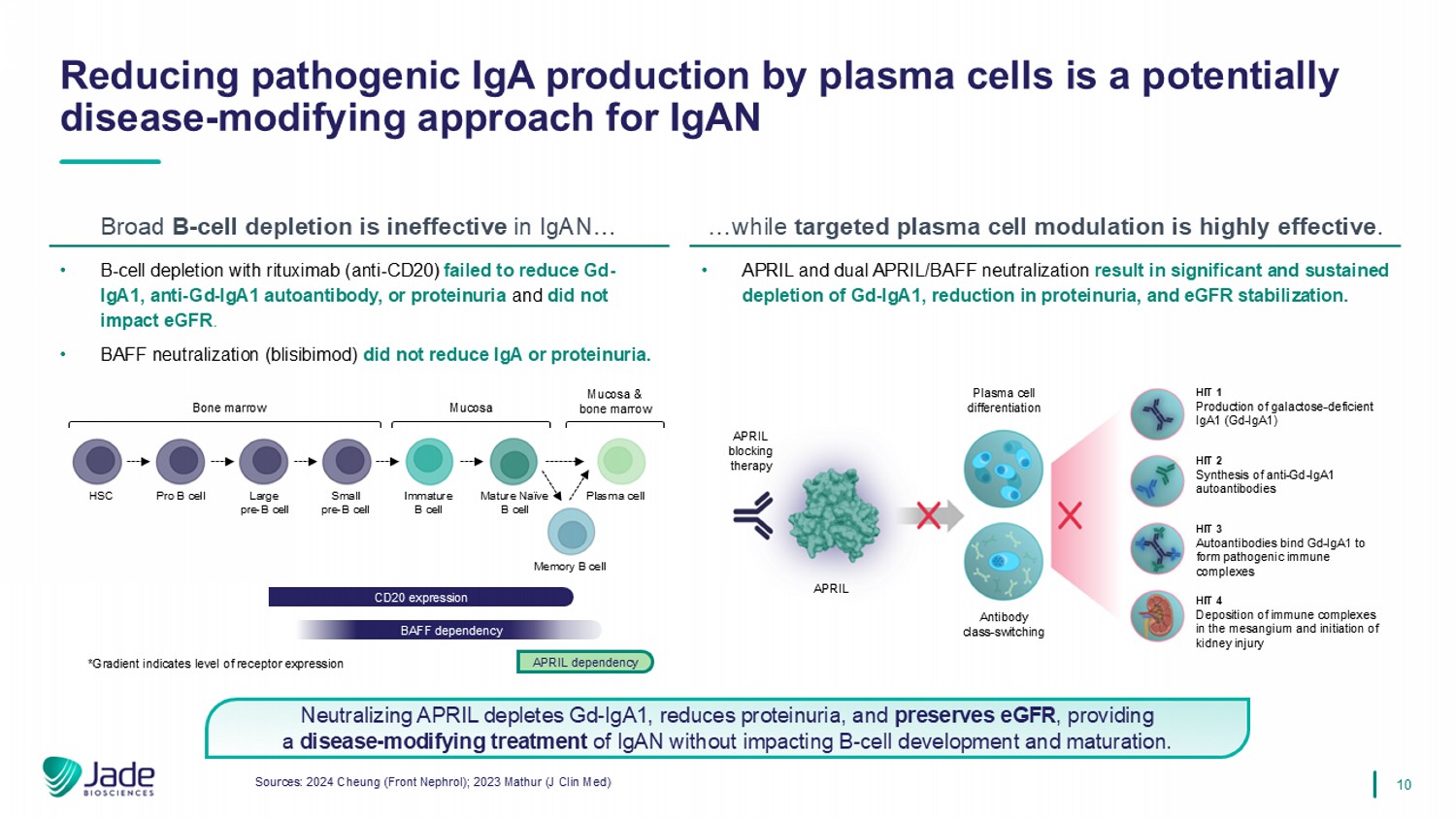
10 APRIL依赖性HSC Pro B细胞大pre-B细胞小pre-B细胞未成熟B细胞成熟Na ï ve B细胞记忆B细胞浆细胞骨髓黏膜黏膜&骨髓CD20表达BAFF依赖性*梯度指示受体表达水平来源:2024 Cheung(Front Nephrol);2023 Mathur(J Clin Med)减少浆细胞产生致病性IgA是一种潜在的疾病-IGAN广泛B细胞耗竭的修饰方法在IGAN中无效……而靶向浆细胞调节非常有效。• B细胞耗竭与利妥昔单抗(抗CD20)未能降低GD-IgA1、抗GD-IgA1自身抗体或蛋白尿,且不影响eGFR。• BAFF中和(blisibimod)并未降低IgA或蛋白尿。• APRIL和双重APRIL/BAFF中和导致GD-IGA1显着和持续消耗、蛋白尿减少和eGFR稳定。APRIL APRIL阻断疗法血浆细胞分化抗体类-切换HIT 1生产半乳糖缺陷型IgA1(GD-IGA1)HIT 2合成抗-GD-IGA1自身抗体HIT 3自身抗体结合GD-IGA1形成致病性免疫复合物HIT 4免疫复合物在系膜沉积和启动肾损伤中和APRIL消耗GD-IGA1,减少蛋白尿,保存eGFR,在不影响B细胞发育和成熟的情况下提供对IgAN的疾病修饰治疗。
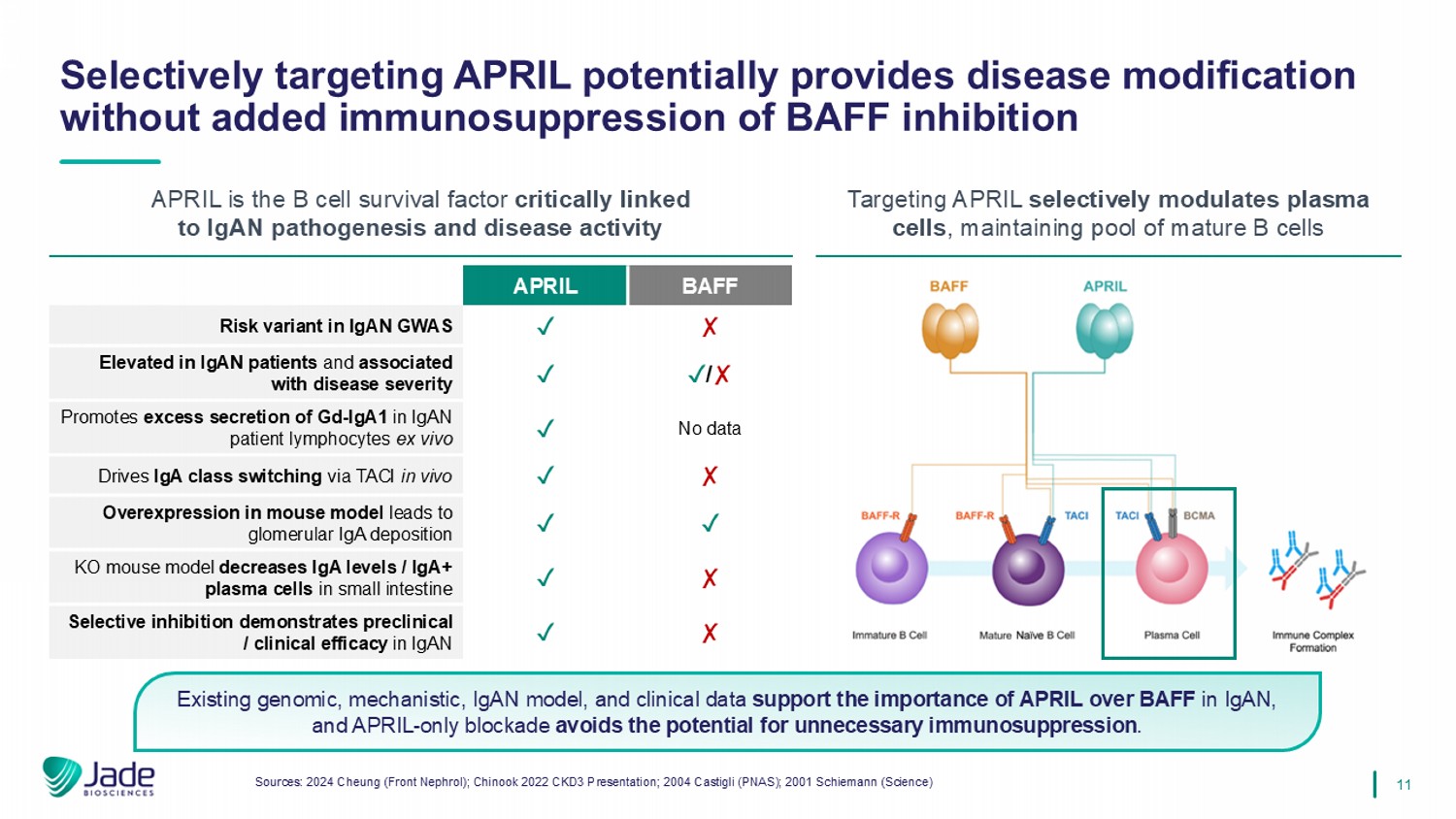
11现有的基因组、机制、IgAN模型和临床数据支持APRIL相对于BAFF在IgAN中的重要性,仅APRIL-阻断可避免不必要的免疫抑制的可能性。选择性靶向APRIL可能提供疾病修饰,而无需增加BAFF抑制的免疫抑制来源:2024 Cheung(Front Nephrol);Chinook 2022 CKD3 Presentation;2004 Castigli(PNAS);2001 Schiemann(Science)BAFF APRIL丨IgAN GWAS中的风险变异丨/丨在IgAN患者中升高并与疾病严重程度相关无数据丨促进IgAN患者淋巴细胞中GD-IGA1的过量分泌离体丨通过TACI在体内驱动IgA类切换丨丨小鼠模型中的过度表达导致肾小球IgA沉积丨KO小鼠模型降低小肠中的IgA水平/IGA +浆细胞丨选择性抑制证明在IgAN APRIL中的临床前/临床疗效是与IGAN发病机制和疾病活动密切相关的B细胞存活因子靶向APRIL选择性调节浆细胞,维持成熟B细胞池
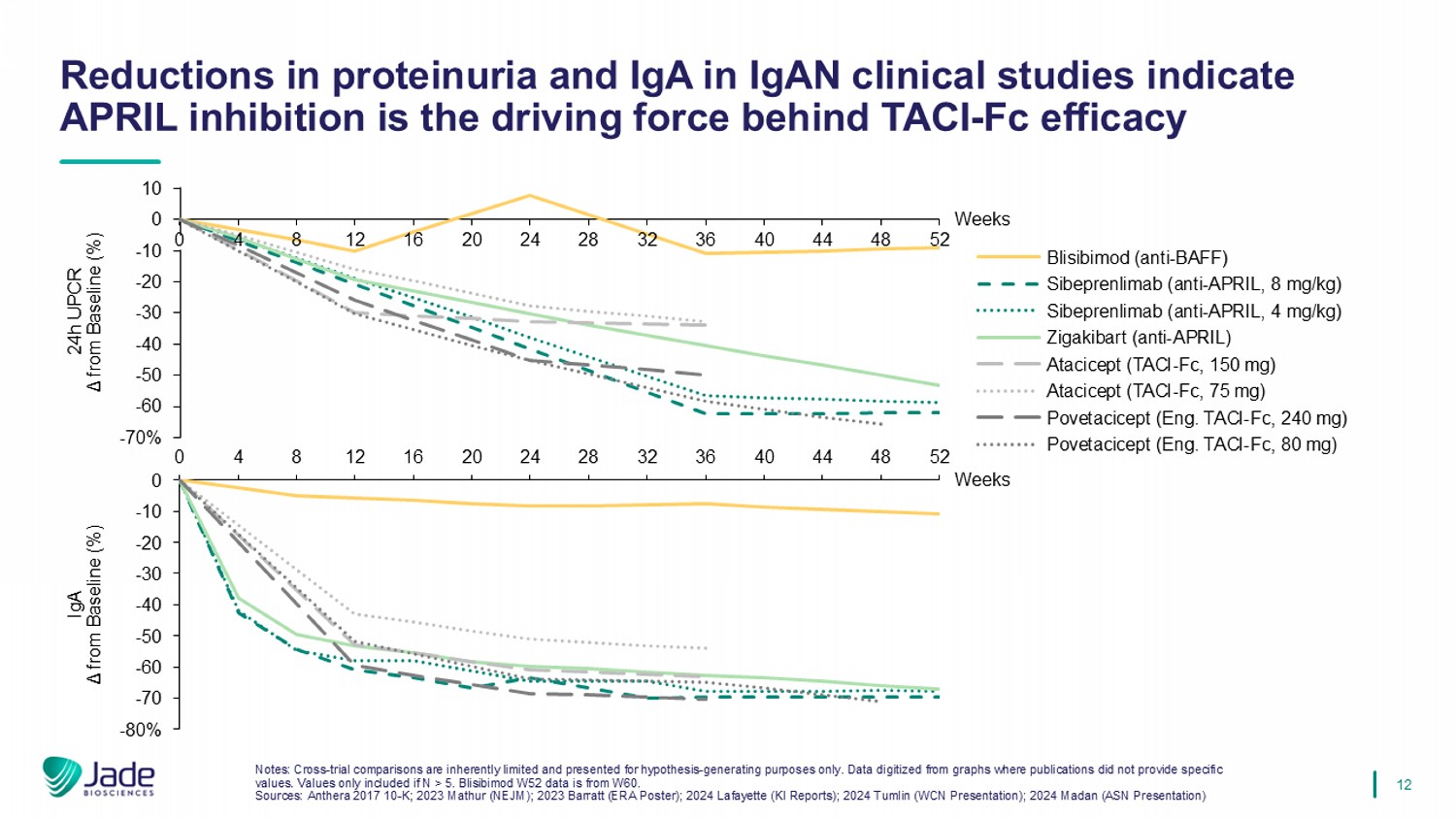
12 IgAN临床研究中蛋白尿和IgA的减少表明APRIL抑制是TACI-FC疗效背后的驱动力注:跨试验比较本质上是有限的,仅用于产生假设的目的。从出版物未提供具体数值的图表中数字化的数据。仅在N > 5时包含的值。Blisibimod W52数据来自W60。资料来源:Anthera 201710-K;2023 Mathur(NEJM);2023 Barratt(ERA海报);2024 Lafayette(KI报告);2024 Tumlin(WCN介绍);2024 Madan(ASN介绍)0481216202428323640444852-70%-60-50-40-30-20-100 10周24h UPCR μ from Baseline(%)Blisibimod(anti-BAFF)Sibeprenlimab(anti-APRIL,8 mg/kg)Sibeprenlimab(anti-APRIL,4 mg/kg)Zigakibart(anti-APRIL)Atacicept(TACI-FC,150 mg)AATACI-FC,240mg)波韦西西普(英文:TACI-FC,80毫克)0481216202428323640444852-70-60-50-40-30-20-10 0-80 %周IgA rea from baseline(%)
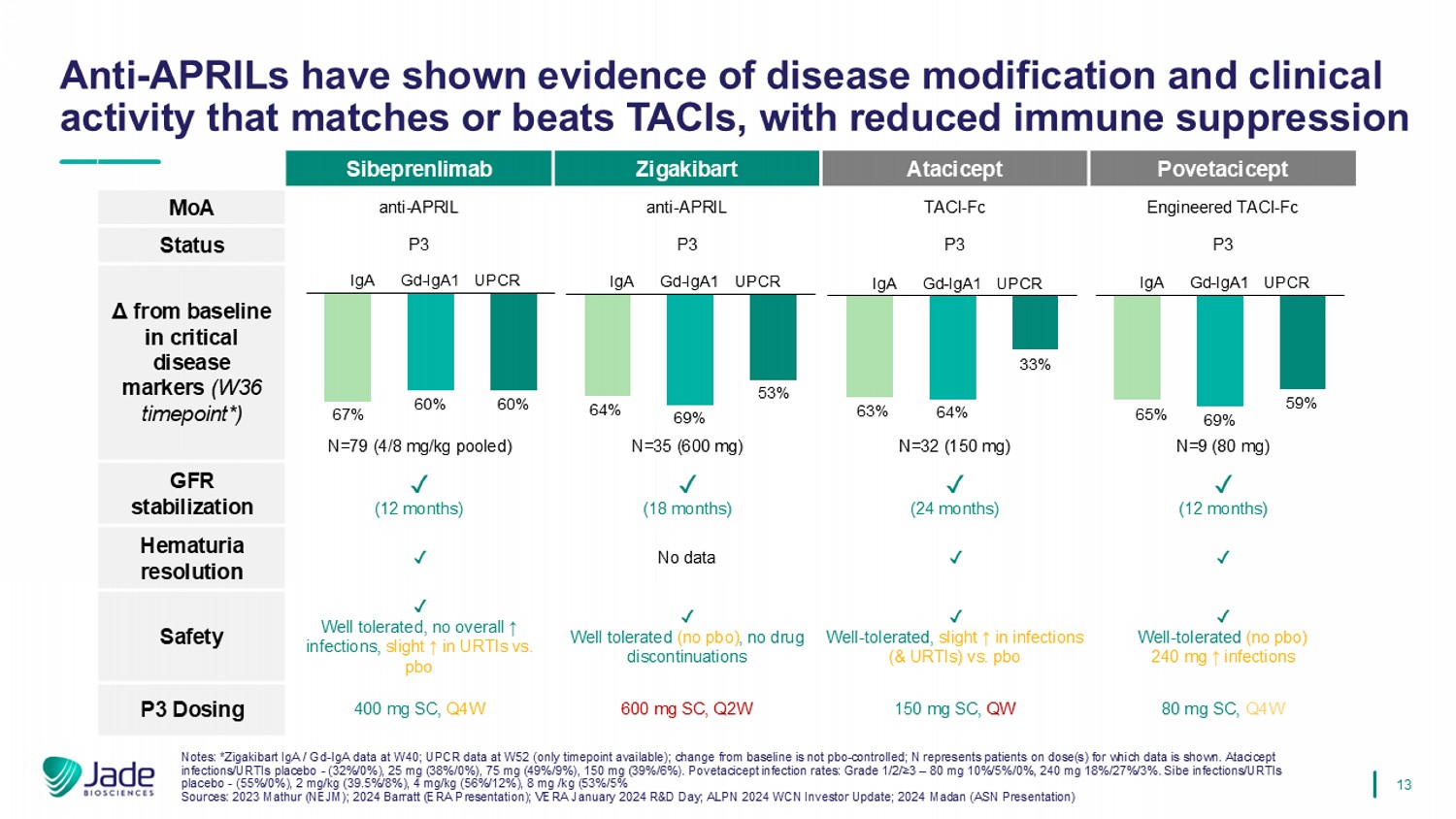
13 Povetacicept Atacicept Zigakibart Sibeprenlimab工程化TACI-FC TACI-FC anti-APRIL anti-APRIL MoA P3 P3 P3 P3状态N = 9(80 mg)N = 32(150 mg)N = 35(600 mg)N = 79(4/8 mg/kg汇集)危重疾病标志物(W36时间点*)丨(12个月)丨(24个月)丨(18个月)丨(12个月)GFR稳定丨丨无数据丨血尿消退丨耐受性良好(无PBO)240mg ↑感染丨耐受性良好,感染(& URTIs)中轻微的↓ vs. PBO丨耐受性良好(无PBO),无药物停用丨耐受性良好,无总体↓感染,URTI中的轻微↓ vs. pbo安全性80mg SC、Q4W 150mg SC、QW 600mg SC、Q2W 400mg SC、Q4W P3剂量抗APRILs已显示出疾病改变的证据和与TACI相匹配或优于TACI的临床活性,免疫抑制降低的IgA GD-IGA1 UPCR 67% 60% 60% IgA GD-IGA1 UPCR 64% 69% 53% IgA GD-IGA1 UPCR 63% 64% 33% IgA GD-IGA1 UPCR 65% 69% 59%注:*Zigakibart IgA/GD-W40时的IgA数据;W52时的UPCR数据(仅提供时间点);相对于基线的变化不是pbo控制的;N代表显示数据的剂量(s)患者。Atacicept感染/URTIs安慰剂-(32%/0%),25毫克(38%/0%),75毫克(49%/9%),150毫克(39%/6%)。波韦西西普感染率:1/2级/≥ 3 – 80毫克10%/5%/0%,240毫克18%/27%/3%。Sibe感染/URTIs安慰剂-(55%/0%),2 mg/kg(39.5%/8%),4 mg/kg(56%/12%),8 mg/kg(53%/5%来源:2023 Mathur(NEJM);2024 Barratt(ERA演示文稿);VERA 2024年1月研发日;ALPN 2024丨WCN WCN投资者更新;2024 MAD an(ASN演示文稿)
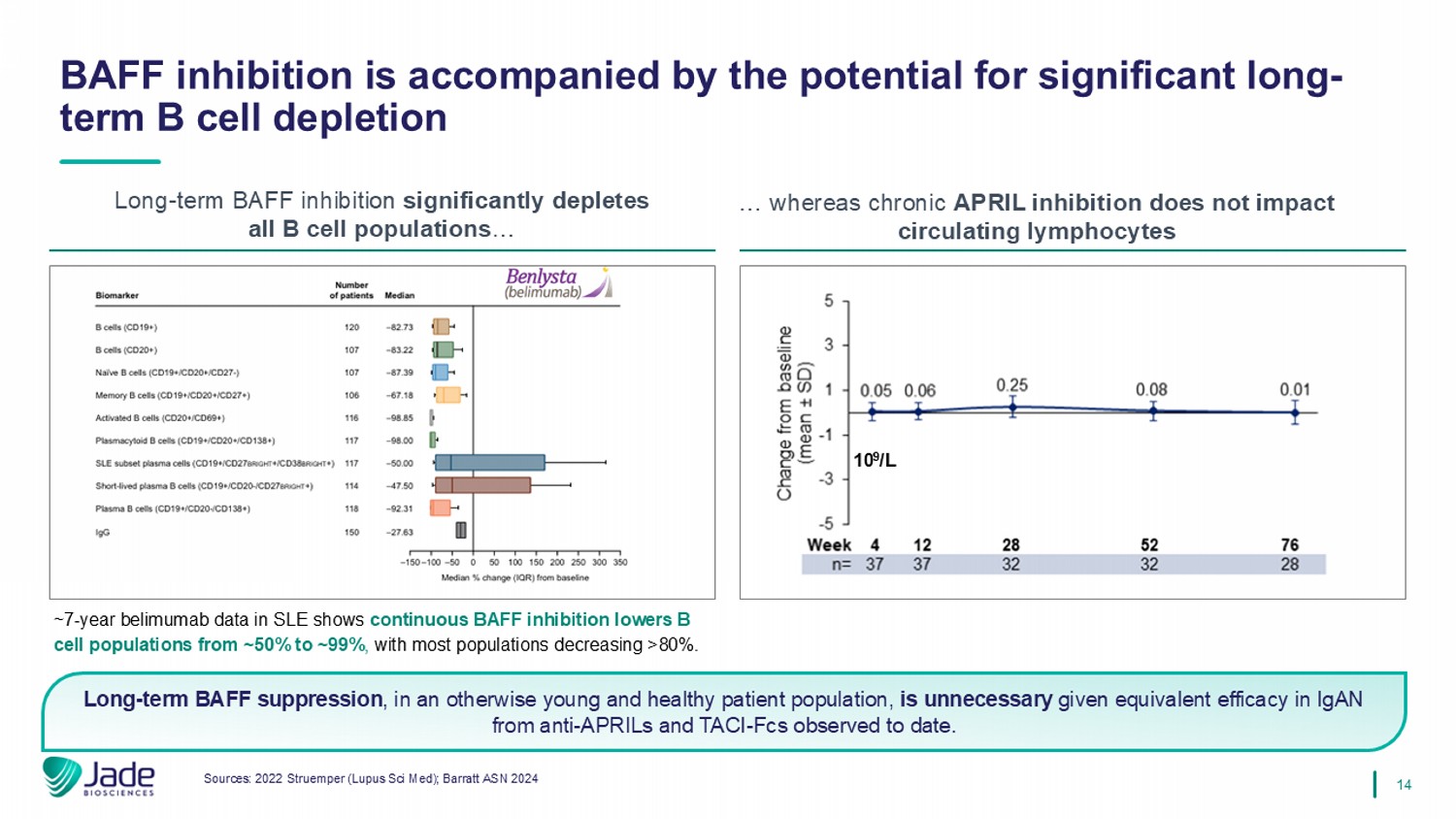
14来源:2022 Struemper(Lupus Sci Med);Barratt ASN 2024 BAFF抑制伴随着显着的长期B细胞耗竭的潜力长期BAFF抑制显着耗竭所有B细胞群……而慢性APRIL抑制不影响循环淋巴细胞长期BAFF抑制,在原本年轻和健康的患者群体中,鉴于迄今为止观察到的抗APRILs和TACI-FCs在IgAN中的同等功效,因此没有必要进行长期BAFF抑制。109/L~7年belimumab在SLE中的数据显示,持续的BAFF抑制将B细胞群体从~50%降低到~99%,大多数群体降低> 80%。
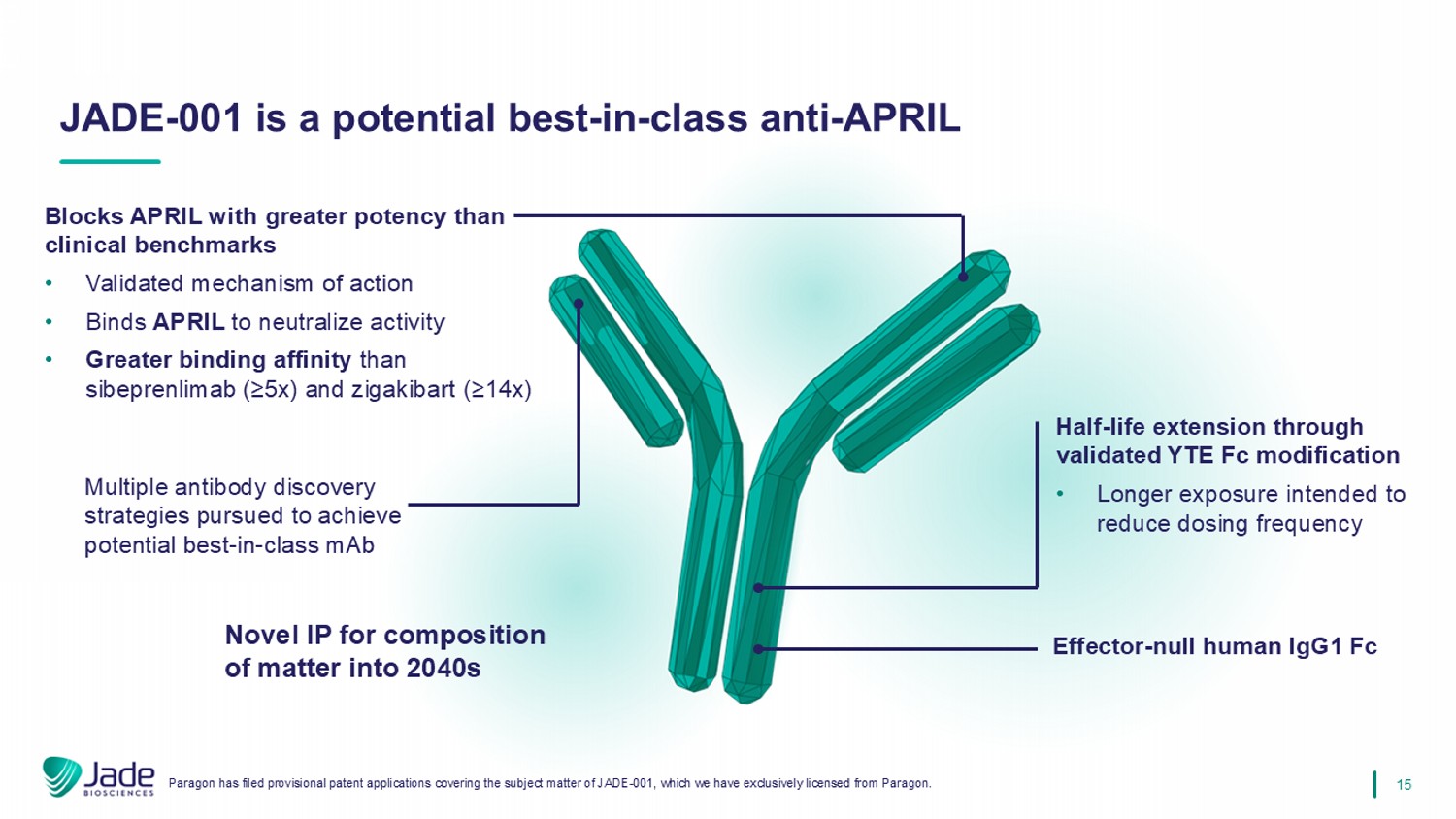
15 JADE-001是一种潜在的同类最佳抗APRIL阻断APRIL,其效力高于临床基准•经过验证的作用机制•结合APRIL以中和活性•比sibeprenlimab(≥ 5x)和zigakibart(≥ 14x)效应器-null人IgG1 FC更强的结合亲和力-通过经过验证的YTEFC修饰延长半衰期•旨在降低给药频率的更长时间暴露Paragon已提交涵盖JADE-001主题的临时专利申请,我们已独家授权fr om Paragon。追求多种抗体发现策略,以实现潜在的同类最佳MAB新型IP,用于2040年代的物质组成
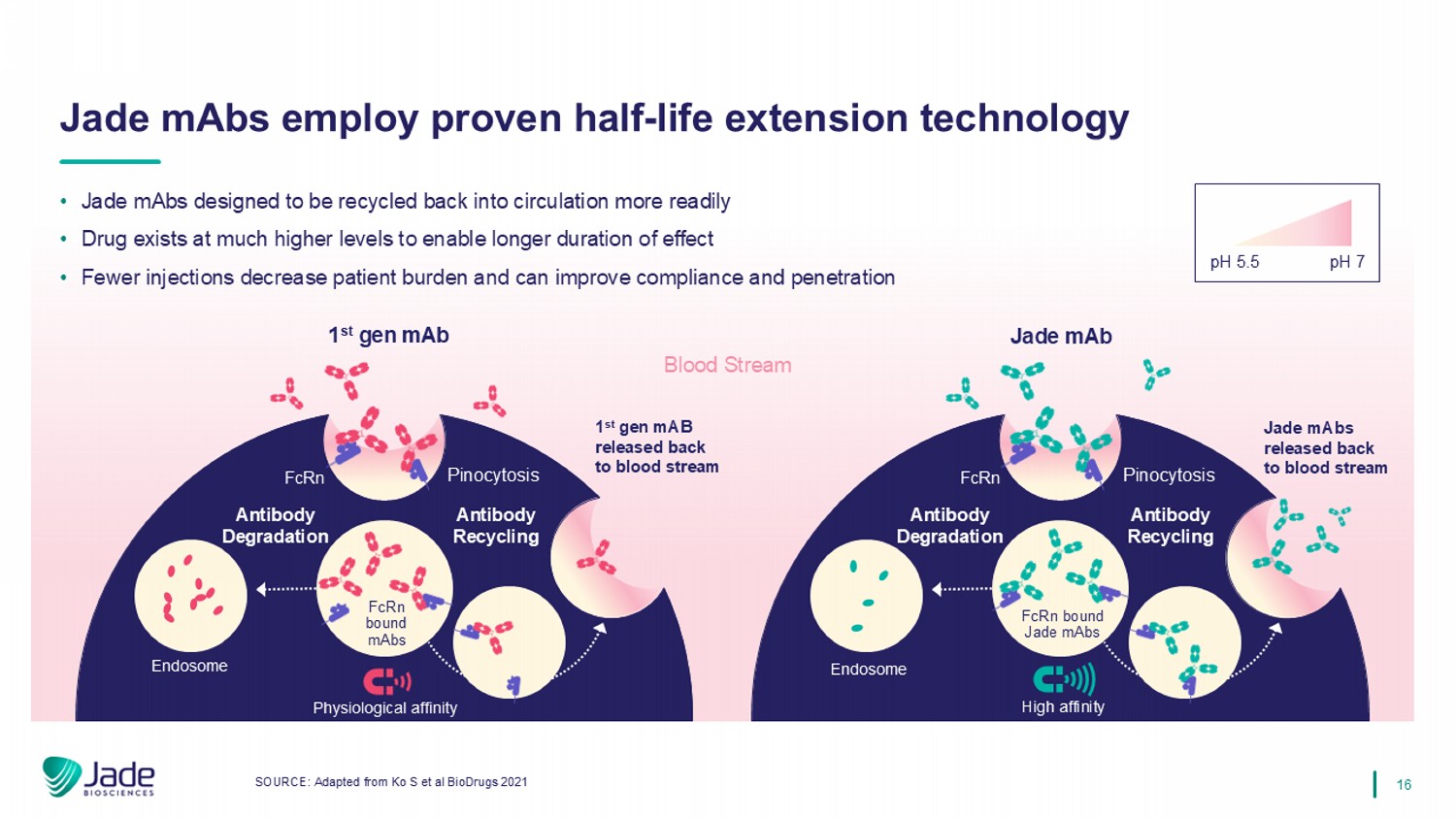
16 pH 5.5 pH 7 • Jade MABs设计为更容易回收回流通•药物以高得多的水平存在,以实现更长的作用持续时间•更少的注射可减少患者负担,并可提高依从性和渗透来源:改编自KO S等BioDrugs的2021 Jade MABs采用经过验证的半衰期延长技术血流抗体降解抗体回收内体1 st gener MAB FCRN胞饮作用抗体降解抗体回收内体Jade MAB FCRN结合Jade MABs高亲和力1 st gener MAB释放回血流FCRN结合MABs Jade MABs释放回血流FCRN胞饮作用生理亲和力
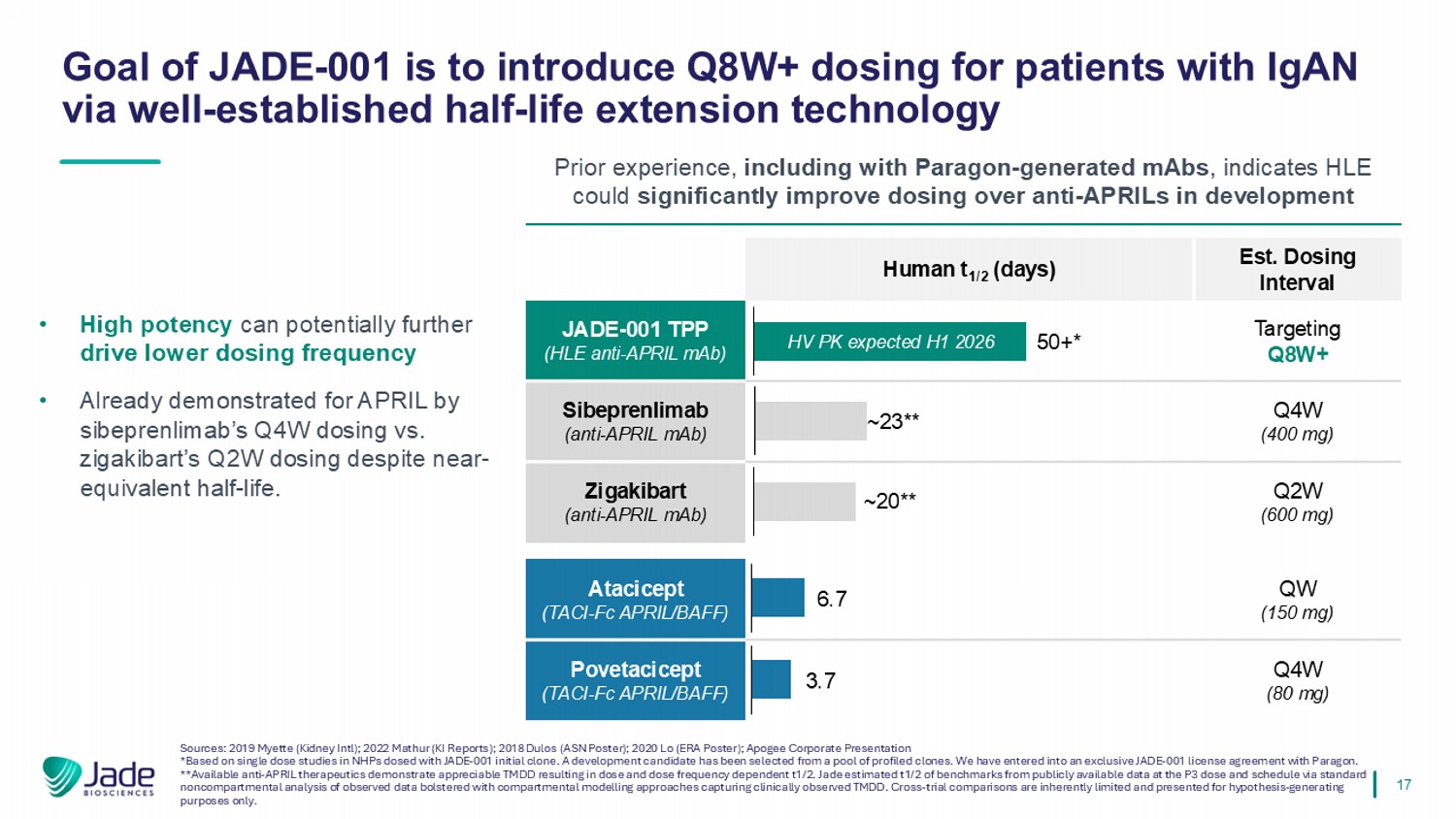
17 •高效力可能会进一步推动更低的给药频率•尽管接近等效半衰期,但sibeprenlimab的Q4W给药与zigakibart的Q2W给药已经证明了APRIL。资料来源:2019 Myette(Kidney Intl);2022 Mathur(KI Reports);2018 Dulos(ASN海报);2020 LO(ERA海报);Apogee企业介绍*基于对JADE-001初始克隆给药的NHPs的单剂量研究。已从一个池o f配置文件克隆中选择了一个开发候选者。我们已与Paragon订立独家JADE-001许可协议。**可用的抗APRIL疗法证明了明显的TMDD导致剂量和剂量频率依赖于t1/2。Jade estim在P3剂量和时间表下,通过对观察数据的标准非隔室分析,在捕获临床观察到的TM DD的隔室建模方法的支持下,从公开可用的数据中确定了t1/2的基准。交叉试验比较本质上是有限的,仅为假设生成目的而呈现。JADE-001的目标是通过成熟的半衰期延长技术为IgAN患者引入Q8W +给药先前的经验,包括使用Paragon生成的单抗,表明HLEC在开发EST中比抗APRILs显着改善给药。给药间隔人t1/2(天)靶向Q8W + JADE-001 TPP(HLE抗APRIL MAb)Q4W(400mg)Sibeprenliab(抗APRIL MAb)Q2W(600mg)Zigakibart(抗APRIL MAb)QW(150mg)Atacicept(TACI-FC APRIL/BAFF)Q4W(80mg)Povetacicept(TACI-FC APRIL/BAFF)~20**~23**50+*HV PK预计2026年上半年6.7 3.7
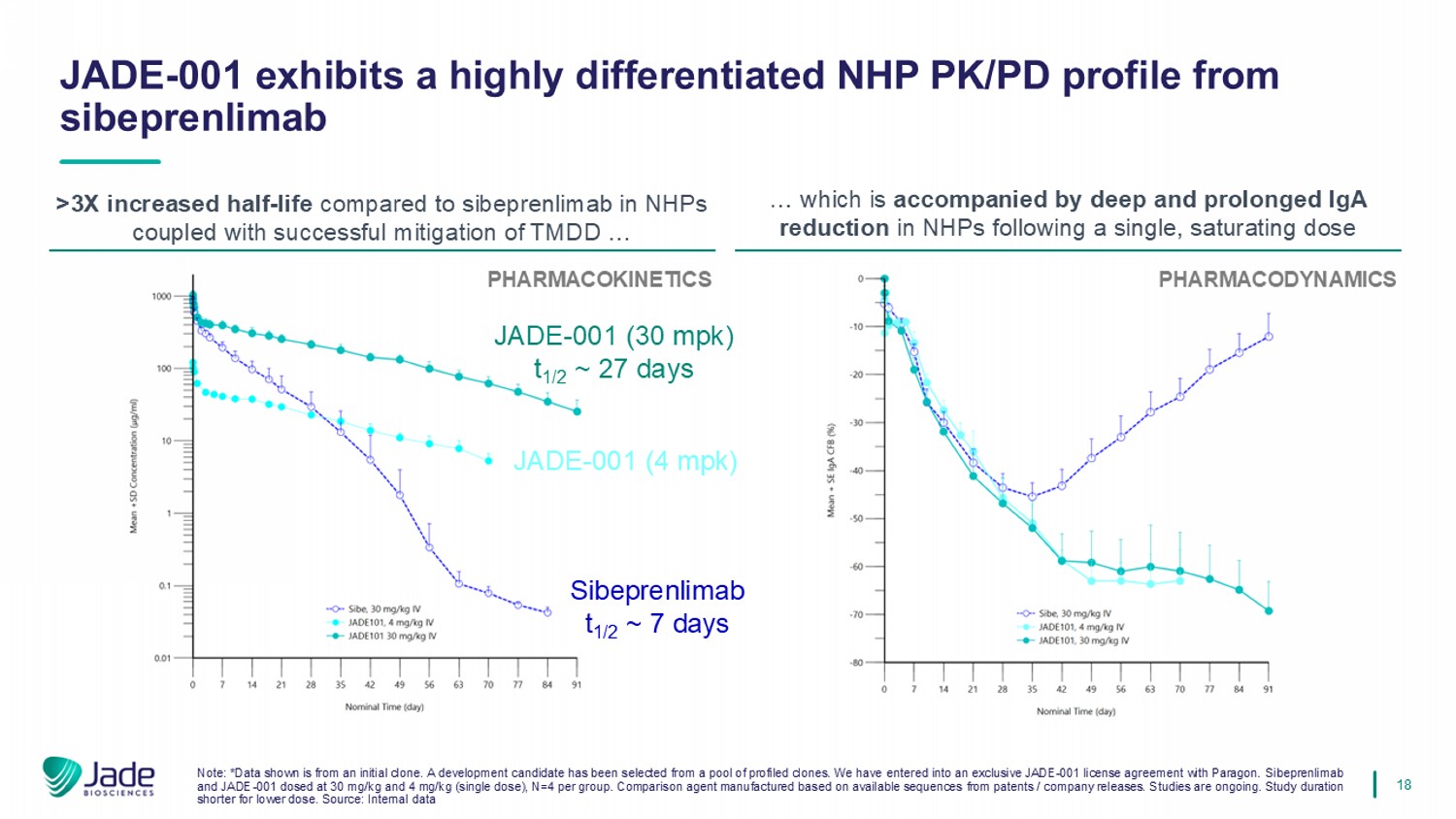
18 JADE-001在NHPs中表现出与sibeprenlimab的高度差异化NHP PK/PD谱>与sibeprenlimab相比增加了3倍的半衰期,同时成功缓解了TMDD……这伴随着单一饱和剂量后NHPs的深度和延长的IgA减少药物动力学注:*显示的数据来自初始克隆。已从已分析的克隆人库中选择了一个开发候选者。我们与Paragon签订了独家JADE-001许可协议。Sibeprenlimab和JADE-001按30mg/kg和4mg/kg给药(单次给药),N = 4每组。根据专利/公司发布的可用序列CE制造的比较剂。研究正在进行中。较低剂量的研究持续时间较短。来源:内部资料JADE-001(30mpk)t1/2~27天sibeprenlimab t1/2~7天JADE-001(4mpk)
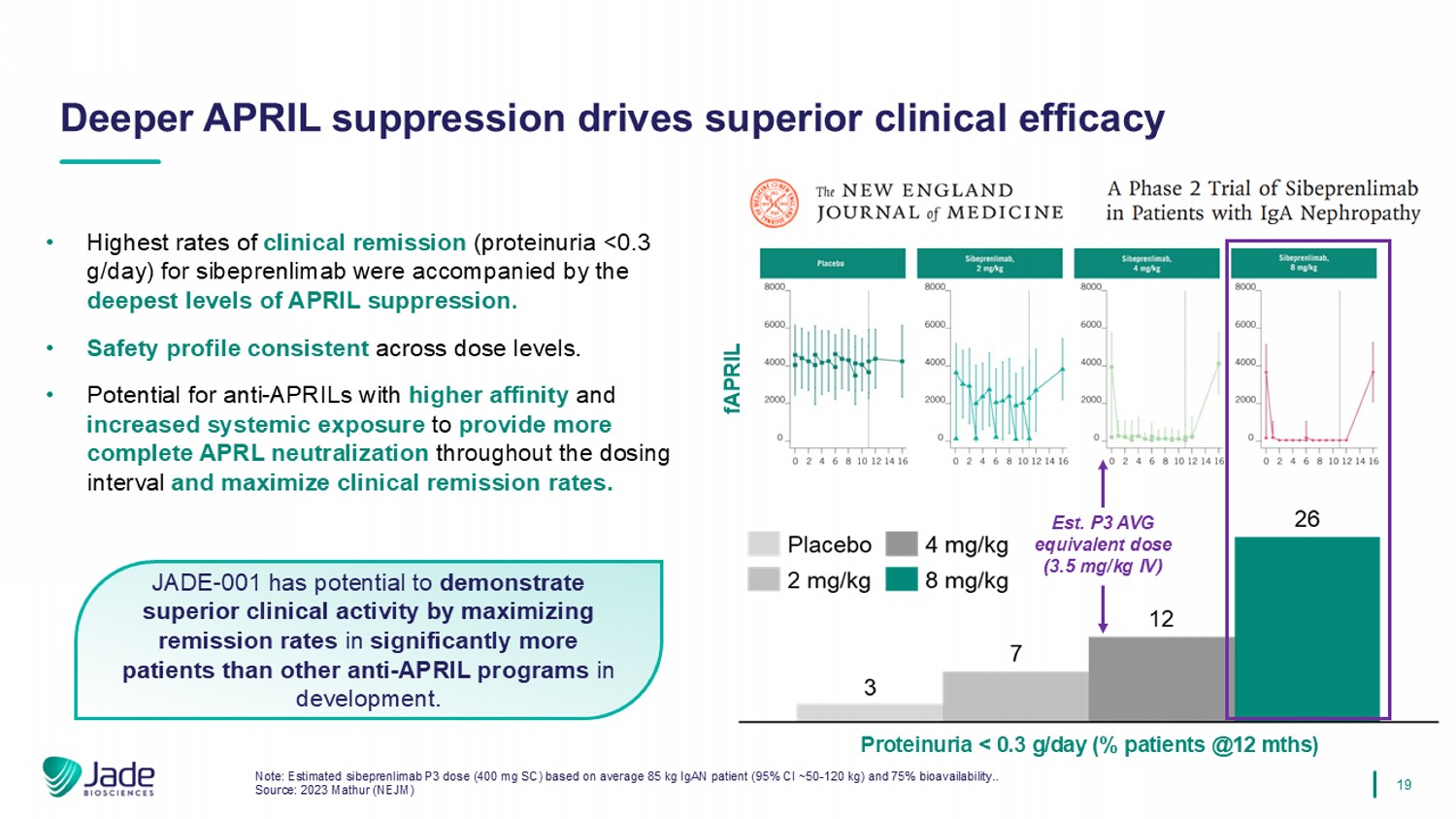
19 JADE-001有潜力通过最大限度地提高患者的缓解率来证明优于其他在研抗APRIL项目的临床活性。• sibeprenlimab最高的临床缓解率(蛋白尿< 0.3g/天)伴随着最深水平的APRIL抑制。•不同剂量水平的安全性特征一致。•具有更高亲和力和增加全身暴露的抗APRIL的潜力,可在整个给药间隔期间提供更完整的APRL中和并最大限度地提高临床缓解率。注:基于平均85kg IgAN患者(95% CI~50-120kg)和75%生物利用度的估计sibeprenlimab P3剂量(400mg SC).。来源:2023 Mathur(NEJM)更深的APRIL抑制驱动卓越的临床疗效fAPRIL EST。P3 AVG等效剂量(3.5mg/kg IV)蛋白尿< 0.3g/day(% patients @12mths)
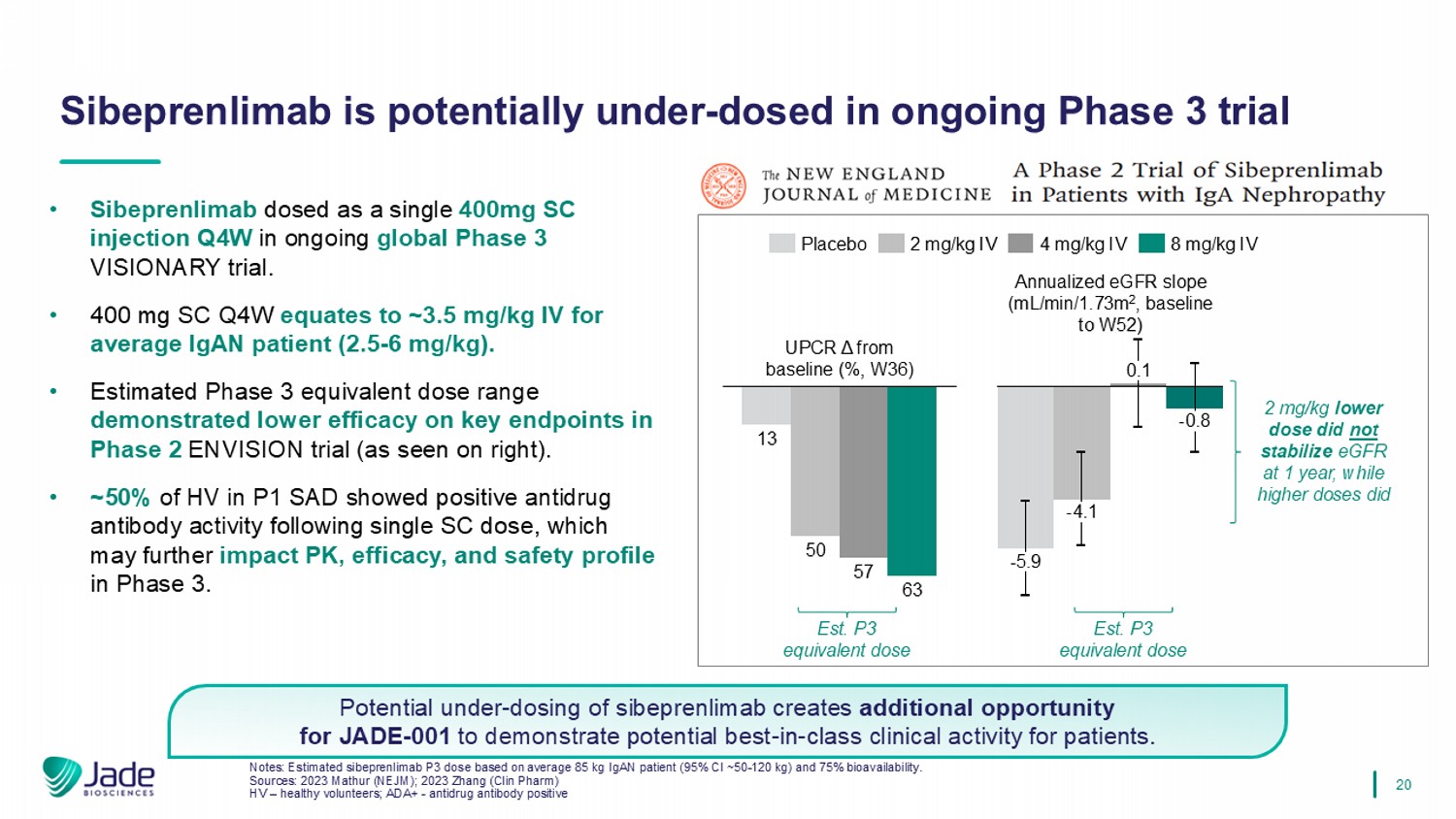
20 • Sibeprenlimab在正在进行的全球3期VISIONARY试验中作为单支400mg SC注射液Q4W给药。• 400mg SC Q4W相当于平均IGAN患者的~3.5mg/kg IV(2.5-6mg/kg)。•在2期ENVISION试验中,估计的3期等效剂量范围在关键终点上显示出较低的疗效(如右图所示)。• P1 SAD中~50%的HV在单次SC剂量后显示出阳性的抗药抗体活性,这可能会进一步影响第3阶段的PK、疗效和安全性。注:根据平均85公斤IgAN患者(95% CI~50-120公斤)和75%生物利用度估计sibeprenlimab P3剂量。资料来源:2023 Mathur(NEJM);2023 Zhang(Clin Pharm)HV –健康志愿者;ADA +-抗药物抗体阳性Sibeprenlimab在正在进行的3期试验中可能低于-给药sibeprenlimab的潜在低于-给药为JADE-001为患者展示潜在的同类最佳临床活动创造了额外的机会。13505763较基线的UPCR μ(%,W36)安慰剂2 mg/kg IV 4 mg/kg IV 8 mg/kg IV-5.9-4.1 0.1-0.8 EST。P3等效剂量EST。P3等效剂量2mg/kg较低剂量在1年时不能稳定eGFR,而较高剂量则有年化eGFR斜率(mL/min/1.73m2,基线至W52)
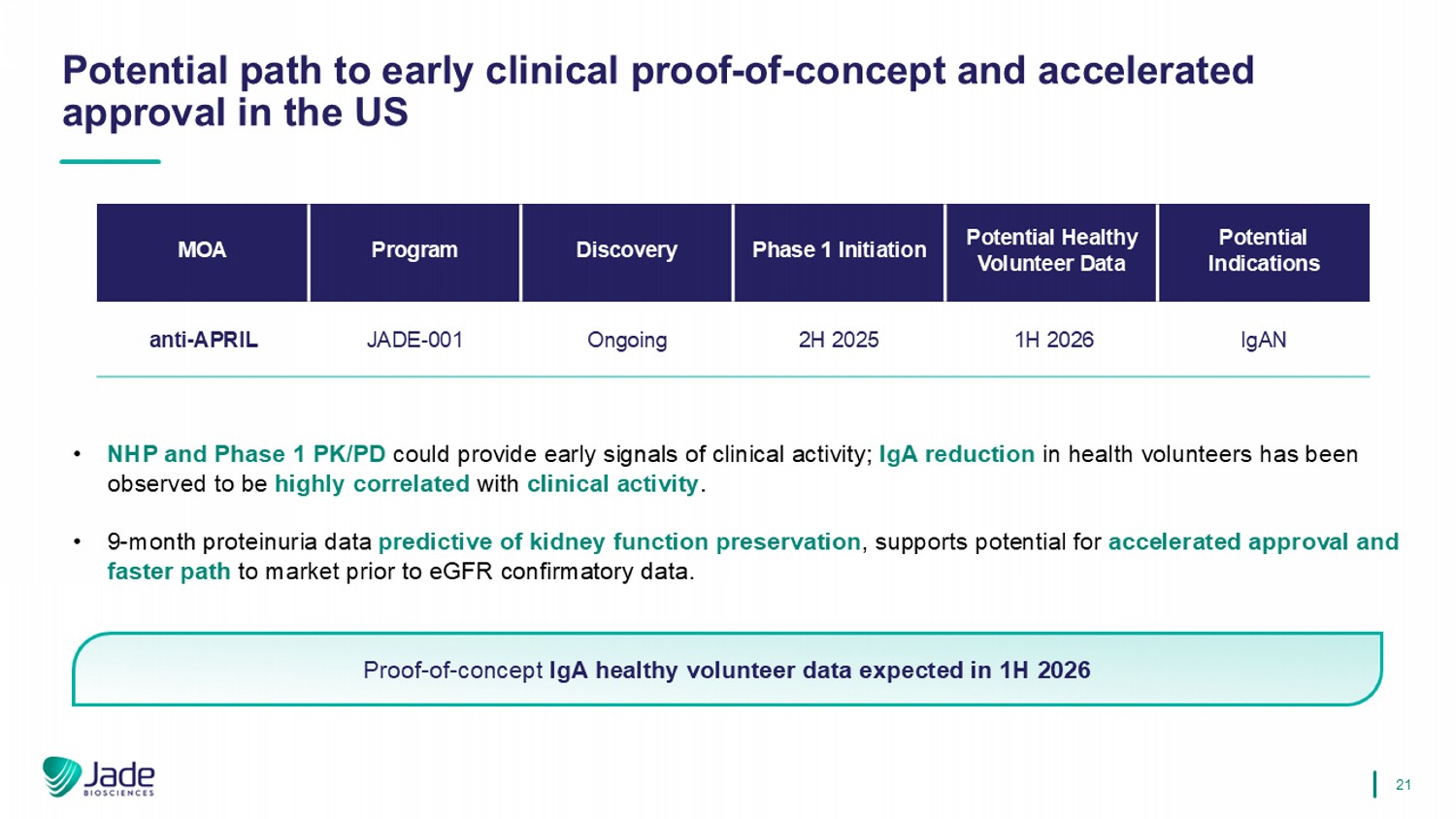
21美国早期临床概念验证和加速批准的潜在路径• NHP和1期PK/PD可以提供临床活动的早期信号;已观察到健康志愿者的IgA减少与临床活动高度相关。•预测肾功能保存的9个月蛋白尿数据,支持在eGFR确认性数据之前加速批准和更快上市的潜力。概念验证IGA健康志愿者数据预计在2026年上半年潜在适应症潜在健康志愿者数据第1阶段启动发现计划MOA IGAN 1H 2026 2H 2025进行中JADE-001 anti-April
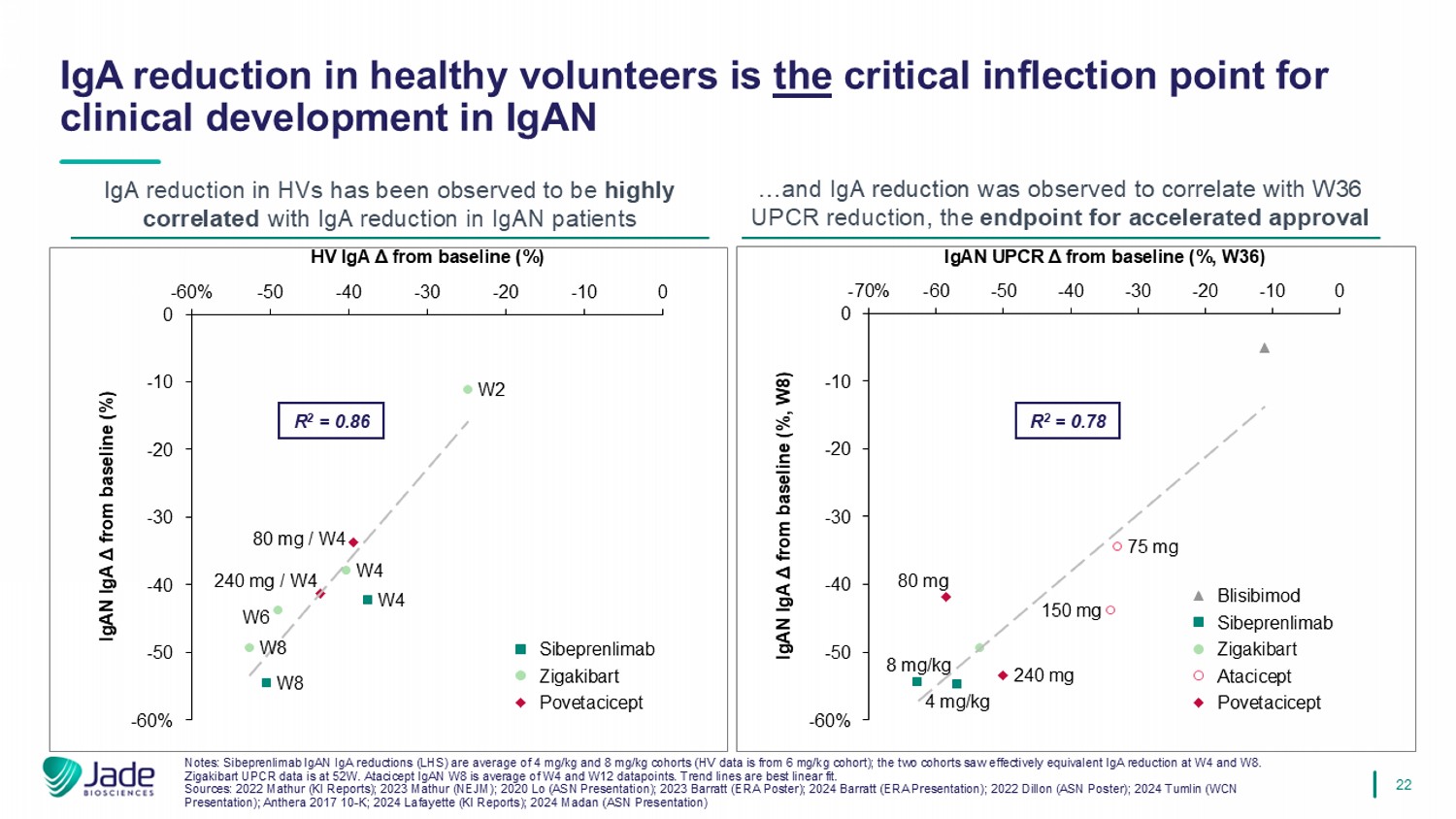
22注:Sibeprenlimab IgAN IgA减少量(LHS)平均为4 mg/kg和8 mg/kg队列(HV数据来自6 mg/kg队列);这两个队列在W4和W8时看到了ef fe ctively equivalent IgA减少。Zigakibart UPCR数据在52W。Atacicept IgAN W8是W4和W12数据点的平均值。趋势线最好线性拟合。来源:2022 Mathur(KI reports);2023 Mathur(NEJM);2020 LO(ASN presentation);2023 Barratt(ERA海报);2024 Barratt(E RA presentation);2022 Dillon(ASN海报);2024 Tumlin(WCN presentation);Anthera 201710-K;2024 Lafayette(KI reports);2024 Madan(ASN presentation)IgA在健康志愿者中的降低是临床开发的关键拐点HV中IgAN IgA的降低已被观察到与IgAN患者中IgA的降低高度相关……并且观察到IgA的降低与W36 UPCR的降低相关,终点用于加速审批-60%-50-40-30-20-100 0-60%-50-40-30-20-100较基线的HV IgA μ(%)较基线的IgAN IgA μ(%)W4 W8 W2 W4 W6 W8 240mg/W4 80mg/W4 Sibeprenlimab Zigakibart Povetacicept R 2 = 0.86-70%-60-50-40-30-20-10 0-60%-50-40-30-20-100 IgAN UPCR μ from基线(%,W36)IgAN IgA μ from baseline(%,W8)8mg/kg4mg/kg150mg75mg240mg80mgBlisibimod sibeprenlimab zigakibart atacicept povetacicept r2 = 0.78

IGAN之外的23个管道机会
24个额外的Jade项目预计将专注于具有重大市场机会的高值炎症和免疫学适应症I & I适应症方面的同类最佳产品概况潜在的同类最佳和同类最佳适应症产品概况进入临床POC的潜在快速路径预计竞争最小Jade团队的专业知识评估建立潜在的同类最佳I & I疗法管道的额外机会。
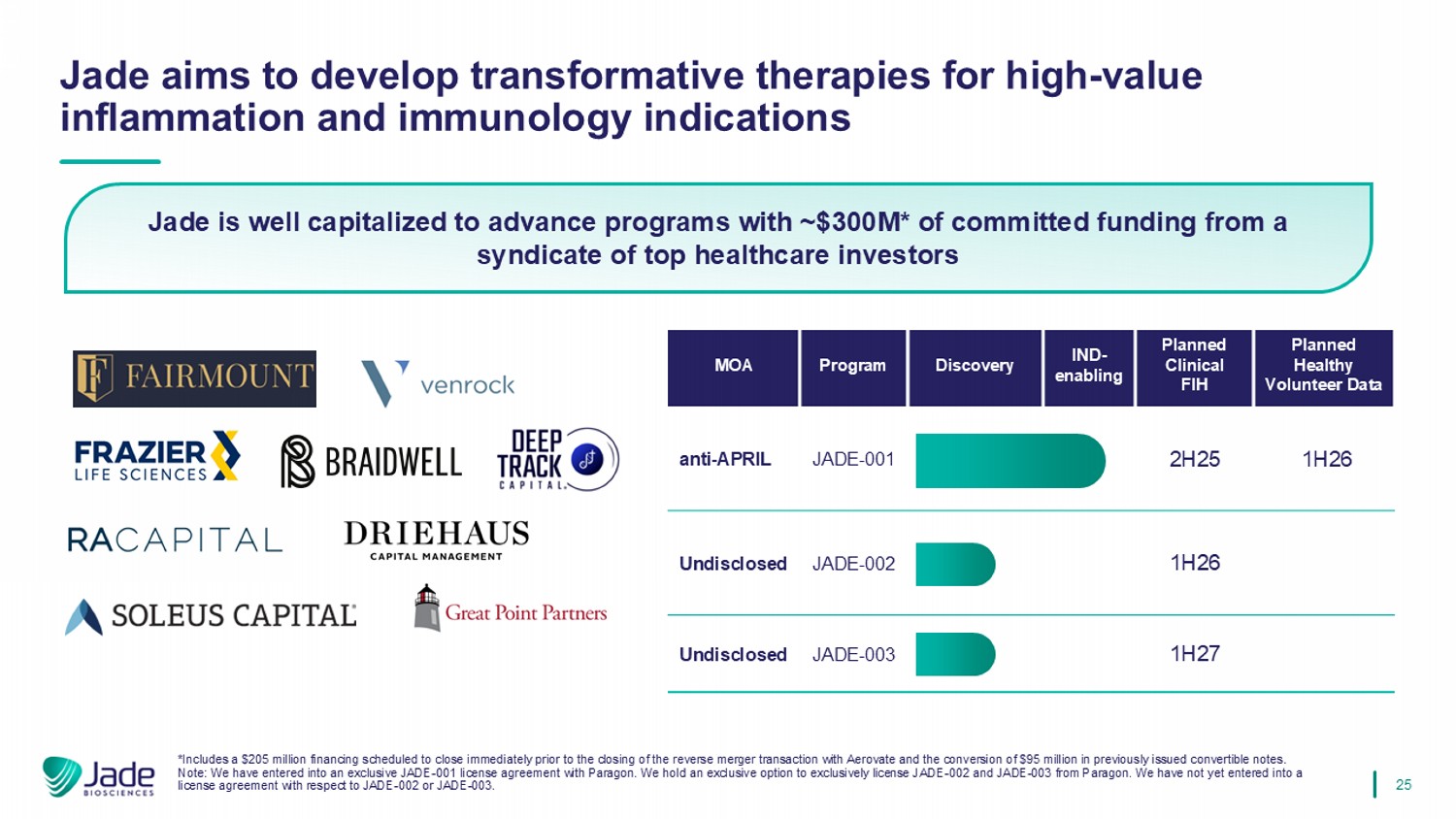
25 Jade旨在开发针对高值炎症和免疫学适应症的转化疗法计划健康志愿者数据计划临床FIHIND-使能发现计划MOA 1H26 2H25 JADE-001 anti-April 1H26 JADE-002未披露1H27 JADE-003未披露*包括一笔2.05亿美元的融资,计划在与Ae ROVate的反向并购交易完成前完成,以及转换先前发行的9500万美元可转换票据。注:我们已与Paragon订立独家JADE-001许可协议。我们持有独家选择权,以独家获得Paragon的lice nse JADE-002和JADE-003。我们尚未就JADE-002或JADE-003订立许可协议。Jade资本充足,可以用约3亿美元推进项目*来自顶级医疗保健投资者辛迪加的承诺资金

26估计总数为-合并后公司收盘后普通股的转换股份***2,120,044,355股按转换基准28,985,019*•已发行普通股股份Aerovate •已发行普通股股份(包括授予期权的基础股份)407,057,032 Jade Biosciences • A系列股份441,688,000股收盘前融资967,999,030 •普通股股份•预融资认股权证274,315,274预计d合并后公司的所有权1.4% 98.6% Jade在收盘前定向增发后的估计资本化并随后完成与Aerovate的合并*包括在金钱期权中,这个数字等于29,743,481。**Aerovate董事会宣布,向截至2025年4月25日在册的Aerovate股东支付总额为6960万美元的特别现金股息,计划于2025年4月29日支付。***请参阅AVTE提交给SEC的更多信息,包括AVTE就该交易填写的S-4表格上的注册声明。注:这张幻灯片中反映的估计是基于截至2025年4月9日的最佳可用信息,随着交易接近完成,可能会发生变化。E Stimated每股股息基于6960万美元股息2.40美元**不适用

27机密www.jadeBiosciences.com info@jadeBiosciences.com
前瞻性陈述
除纯粹的历史信息外,本通讯中的某些陈述可能构成联邦证券法含义内的“前瞻性陈述”,包括出于1995年《私人证券诉讼改革法案》下“安全港”条款的目的,该条款涉及Aerovate、Jade、拟议的同时投资和拟议的合并(统称为“拟议交易”)和其他事项。这些前瞻性陈述可能包括但不限于与Aerovate和Jade的管理团队对未来的期望、希望、信念、意图或战略有关的明示或暗示的陈述,包括但不限于以下方面的陈述:拟议交易和拟议交易的预期效果、感知到的利益或机会,包括来自投资者的投资金额和预期收益,以及与此相关的相关时间;与丨航美股份就拟议合并支付现金股息有关的预期,包括拟议交易(“交割”)的预计交割时间;关于合并后公司所有权结构的预期;以及预计交割后合并后公司股票在股票代码为“JBIO”的纳斯达克交易。此外,任何提及对未来事件或情况的预测、预测或其他特征的陈述,包括任何基本假设,均为前瞻性陈述。“机会”、“潜力”、“里程碑”、“管道”、“可以”、“目标”、“战略”、“目标”、“预期”、“实现”、“相信”、“考虑”、“继续”、“可能”、“估计”、“预期”、“打算”、“可能”、“计划”、“可能”、“项目”、“应该”、“将”、“将”和类似表述(包括这些术语的否定或它们的变体)可能会识别前瞻性陈述,但没有这些词语并不意味着一份陈述不具有前瞻性。这些前瞻性陈述基于当前对未来发展及其潜在影响的预期和信念。无法保证影响Aerovate、Jade或建议交易的未来发展将是已预期的发展。这些前瞻性陈述涉及许多风险、不确定性(其中一些超出了Aerovate的控制范围)或其他假设,这些假设可能导致实际结果或业绩与这些前瞻性陈述中明示或暗示的存在重大差异。这些风险和不确定因素包括但不限于建议交易的完成或完成的条件未获满足的风险,包括Aerovate未能获得股东对拟议合并的批准;风险建议并进行的投资未及时完成或根本未完成;有关完成建议交易的时间以及Aerovate和Jade各自完成建议交易拟进行的交易的能力的不确定性;有关Aerovate和Jade继续在纳斯达克在建议交易完成前在TERM2继续上市的风险以及合并后公司在建议交易后保持上市的能力;有关TERM0和Jade正确估计各自的运营费用和与建议交易相关的费用(如适用)的能力的风险,以及关于任何拟议交易完成的任何延迟将在完成时对由此产生的合并后公司的预期现金资源产生的影响的不确定性,以及可能减少合并后公司现金资源的其他事件和意外支出和成本;未能或延迟获得完成拟议交易所需的任何政府或准政府实体的必要批准;任何事件的发生,可能导致Aerovate与Jade企业合并终止的情况或条件发生变化;合并的公告或未决对Aerovate或Jade的业务关系、经营成果和业务的一般影响;与合并相关的费用;由于交换比例的调整,Jade的股东和Aerovate的股东可能比目前预期或多或少地拥有合并后公司的风险;可能对Aerovate提起的任何法律诉讼的结果,Jade或其各自的任何董事或高级职员与合并协议或由此拟进行的交易有关;Aerovate和Jade保护各自知识产权的能力;对拟议交易的竞争性回应;意外成本, 拟议交易产生的费用或开支;因宣布或完成拟议交易而对业务关系产生的潜在不利反应或变化;未能实现拟议交易的某些预期收益,包括与未来财务和经营业绩有关的收益;Aerovate股东获得的现金股息多于或少于目前预期的风险;立法、监管、政治和经济发展;以及定期向美国证券交易委员会提交的文件中更全面描述的那些不确定性和因素,包括在向SEC提交的S-4表格注册声明中的“风险因素”标题下,以及Aerovate于2025年3月27日向SEC提交的截至2024年12月31日止年度的10-K表格年度报告中的“风险因素”和“业务”标题下,以及对潜在风险、不确定性和Aerovate不时提交的其他文件中包含的其他重要因素的讨论,就拟议交易向您提供的与Aerovate或Jade相关的任何风险因素,以及与公司相关的风险因素,例如Jade,在生物制药行业运营的公司。如果这些风险或不确定性中的一项或多项成为现实,或者Aerovate或Jade的任何假设被证明不正确,实际结果可能会在重大方面与这些前瞻性陈述中预测的结果有所不同。本通讯中的任何内容均不应被视为任何人表示将实现本文所述的前瞻性陈述或将实现此类前瞻性陈述的任何预期结果。您不应过分依赖本通讯中的前瞻性陈述,这些陈述仅在作出之日发表,并且通过参考此处的警示性陈述对其整体进行了限定。Aerovate和Jade均不承担或接受任何义务公开发布对任何前瞻性陈述的任何更新或修订。本通讯并不旨在总结投资Aerovate或Jade的所有条件、风险和其他属性。
有关建议交易的重要额外资料
本通讯不能替代注册声明或Aerovate已就拟议交易向SEC提交或可能提交的任何其他文件。就拟议交易而言,Aerovate已向SEC提交了相关材料,包括S-4表格上的注册声明,其中包含Aerovate的代理声明/招股说明书。AEROVATE敦促投资者和股东仔细完整地阅读登记声明、代理声明/招股说明书和可能提交给SEC的任何其他相关文件,以及这些文件的任何修订或补充文件,如果以及当这些文件可用时,因为它们将包含有关AEROVATE、JADE、拟议交易的重要信息投资者和股东可以通过SEC维护的网站www.sec.gov免费获得Aerovate向SEC提交的委托书/招股说明书和其他文件的副本(如果可以获得的话)。敦促股东在就拟议交易作出任何投票或投资决定之前,阅读委托书/招股说明书和其他相关材料。此外,投资者和股民请注意,Aerovate通过其网站(https://ir.aerovatetx.com/)与投资者和公众进行沟通。
参加征集人员
Aerovate、Jade及其各自的董事和执行官可能被视为参与了与拟议交易有关的向股东征集代理的活动。有关Aerovate董事和执行官的信息,包括对他们在Aerovate中权益的描述,均包含在Aerovate于2025年3月27日向SEC提交的截至2024年12月31日止年度的最新10-K表格年度报告以及可能不时向SEC提交的其他文件中。有关这些人及其在交易中的权益的其他信息均包含在Aerovate向SEC提交的与拟议交易有关的最终代理声明/招股说明书中。这些文件可从上述来源免费获取。