
附件 99.2 Mirum制药:在罕见病中改变生活M iru m t o ac q u ir e b lu e ja y t h e r ap e u t ic s d e c e m b e r 2025

前瞻性陈述本演示文稿包含基于我们管理层的信念和假设以及管理层目前可获得的信息的前瞻性陈述。前瞻性陈述包括本演示文稿中除历史事实陈述之外的所有陈述,包括有关我们可能收购Bluejay Therapeutics(“Bluejay”)的信息、我们的业务战略、目标和机会,包括LIVMARLI、CHOLBAM、CTEXLI或雪诺二醇的未来机会以及临床和监管里程碑、我们的候选产品以及如果完成对Bluejay的收购我们可能获得的候选产品。前瞻性陈述受已知和未知风险、不确定性、假设和其他因素的影响,这些因素可能导致我们的实际结果、业绩或成就与我们的前瞻性陈述所预期或暗示的存在重大不利差异,包括但不限于:我们对Bluejay的收购因任何原因未能完成;Bluejay对其产品候选者正在进行的研究的结果、注册、进行和进展;我们对我们的产品候选者正在进行和计划进行的研究的结果、注册、进行和进展,包括新获得许可的产品候选者,以及我们将LIVMARLI商业化的计划和期望,美国和世界其他地区的CHOLBAM和CTEXLI;我们的商业战略、商业化计划和开发计划的成本,我们进行的任何商业化的财务影响或收入;估计受我们寻求或Bluejay寻求治疗的疾病或相关疾病影响的患者人数以及适合使用我们的商业产品进行治疗的患者人数;LIVMARLI、CHOLBAM和CTEXLI(或其他品牌下的钱杜醇片)以及我们的任何候选产品(包括volixibat和MRM-3379)的潜在临床益处;我们的预期增长,包括如果收购完成,Bluejay及其运营的潜在整合;我们有能力为我们和Bluejay的产品候选者获得必要的监管批准或对任何监管考虑的结果的预测,以及如果获得批准,我们的产品的市场接受度;我们对第三方临床研究组织、制造商、供应商和分销商的依赖;设计、实施,我们临床试验的时间表和结果;竞争性产品和疗法的影响;我们获得必要额外资本的能力;我们吸引和留住关键员工的能力;我们管理组织增长和复杂性的能力;我们维护、保护和增强我们的知识产权的能力;以及我们继续遵守适用法律法规的能力。请参阅我们不时向美国证券交易委员会(SEC)提交的10-K表格年度报告、10-Q表格季度报告和其他文件(可在http://www.sec.gov上查阅)中标题为“风险因素”的部分,以讨论可能导致我们的实际结果与我们的前瞻性陈述中明示或暗示的结果存在重大差异的重要因素。你不应该依赖前瞻性陈述作为对未来事件的预测。我们和任何其他人均不对前瞻性陈述的准确性和完整性承担责任。我们不承担在本演示文稿发布之日后更新任何前瞻性陈述的义务,除非法律可能要求。本演示文稿还包含独立方和我们就市场规模和增长做出的估计和其他统计数据,以及有关我们行业的其他数据。这些数据涉及一些假设和限制,Mirum对这些估计的准确性不作任何表示。对我们经营所在市场未来表现的预测、假设和估计必然会受到高度的不确定性和风险。此处包含的商标是其所有者的财产,仅用于参考目的。本演示文稿讨论了正在进行临床研究且尚未获得美国食品和药物管理局或其他相关监管机构批准上市的候选产品。对于这些候选产品用于正在研究此类候选产品的用途的安全性或有效性,不作任何陈述。本演示不应构成出售要约或购买任何证券的要约邀请,也不应在根据任何此类司法管辖区的证券法进行注册或获得资格或豁免之前,在此类要约、邀请或出售将是非法的任何州或司法管辖区进行任何证券出售。2
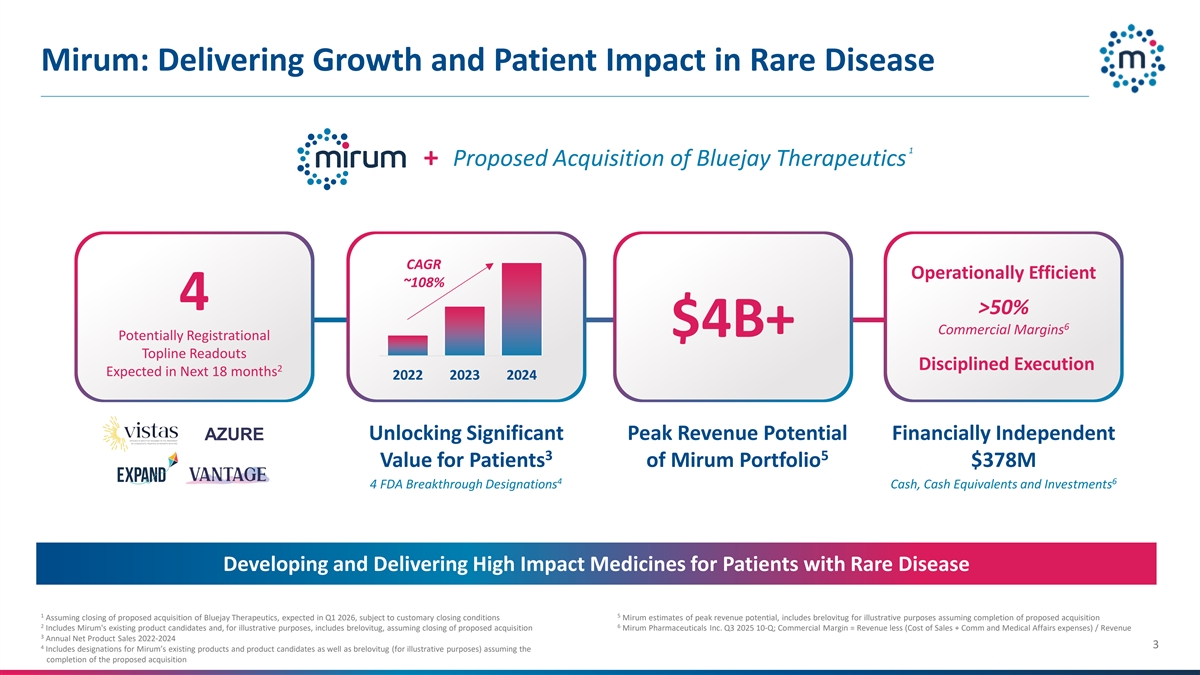
Mirum:在罕见病领域提供增长和患者影响1 +拟议收购Bluejay Therapeutics复合年增长率运营效率~108% 4 > 50% 6商业利润率$ 4b +潜在的注册顶线读数纪律严明的执行2预计在未来18个月内202220232024 AZURE解锁显着的峰值收入潜力财务独立35为Mirum投资组合的患者带来价值3.78亿美元464 FDA突破性指定现金、现金等价物和投资开发和提供针对罕见病患者的高影响药物15假设完成拟议收购Bluejay Therapeutics,预计在2026年第一季度,根据惯例成交条件,Mirum对收入峰值潜力的估计,为说明目的包括brelovitug,假设拟议收购完成26包括Mirum现有的候选产品,为说明目的,包括brelovitug,假设拟议收购完成Mirum制药 Inc. 2025年第三季度10-Q;商业利润率=收入减去(销售成本+通讯和医疗事务费用)/收入3年净产品销售额2022-2024 43包括对Mirum现有产品和候选产品的指定以及brelovitug(用于说明目的),假设拟议收购完成
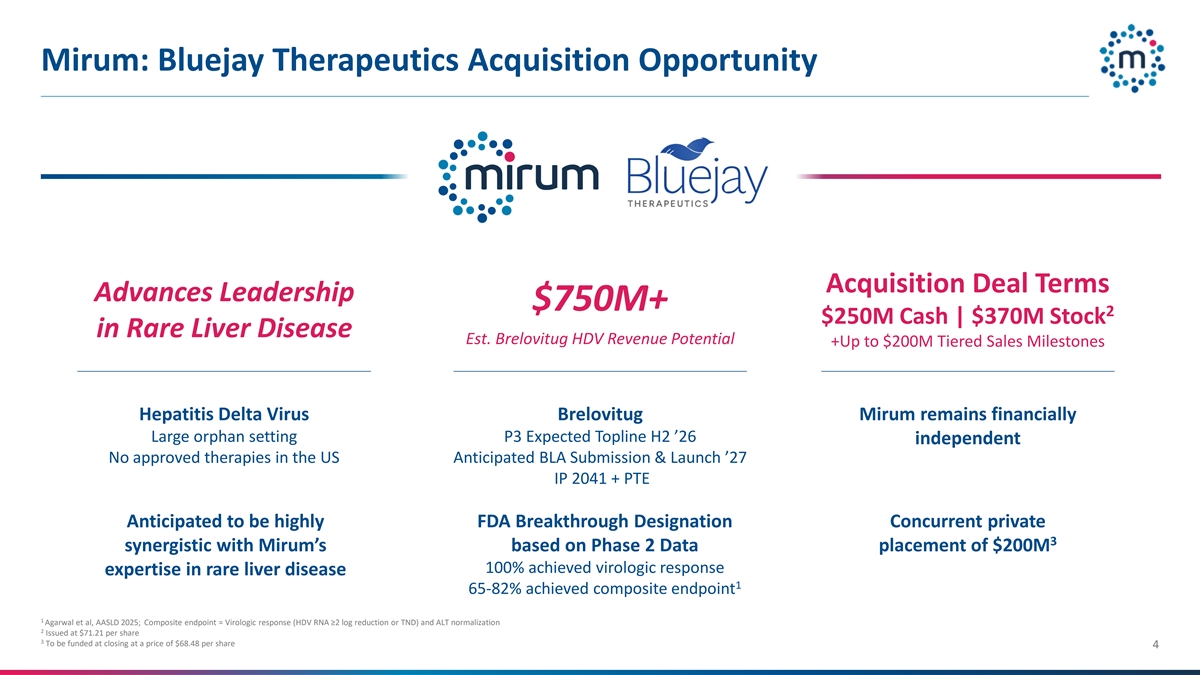
Mirum:Bluejay Therapeutics收购机会收购交易条款推进领导层7.5亿美元+ 2 2.5亿美元现金| 3.7亿美元罕见肝病EST股票。brelovitug HDV收入潜力+高达2亿美元的分层销售里程碑Hepatitis Delta病毒brelovitug Mirum在财务上仍然是大型孤儿设置P3预期顶线H2’26独立无批准疗法在美国预期BLA提交和推出' 27 IP 2041 + PTE预计将高度FDA突破性指定并发Private 3协同Mirum的基于2期数据放置的2亿美元100%实现了罕见肝病的病毒学应答专业知识1 65-82 %实现了复合终点1 Agarwal等人,AASLD 2025;Composite endpoint =病毒学应答(HDV RNA ≥ 2对数减少或TND)和ALT正常化2以每股71.21美元的价格发行3将在收盘时以每股68.48美元的价格融资4
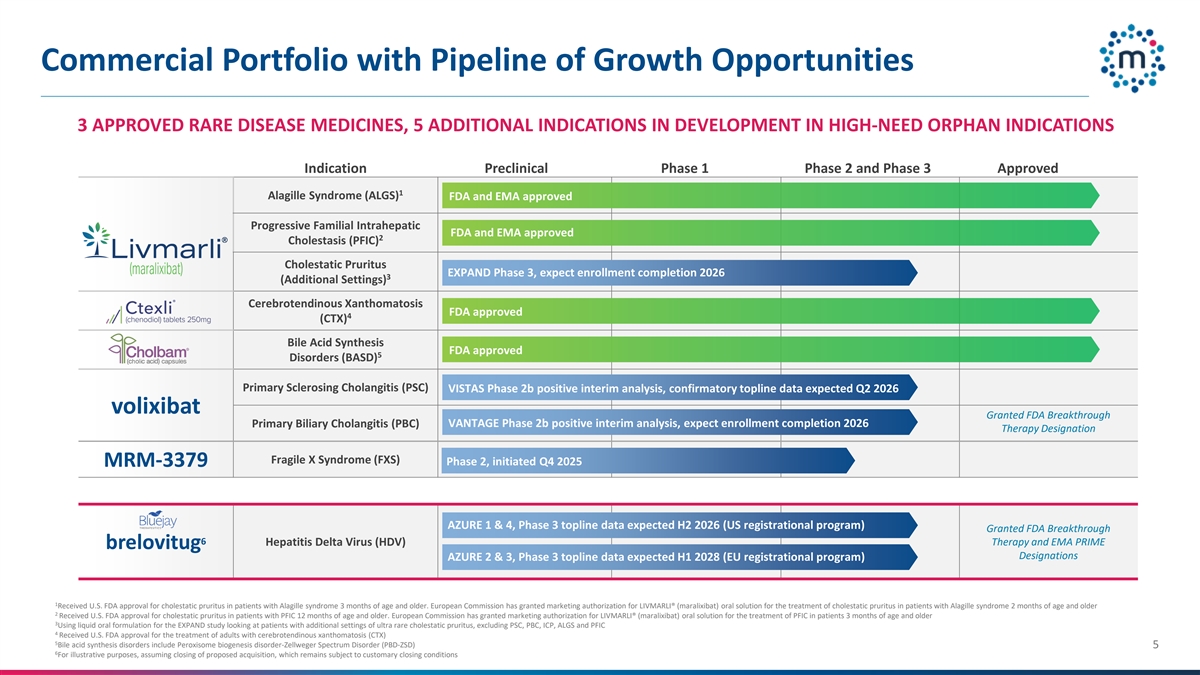
具有增长机会管道的商业组合3个已获批准的罕见病药物,5个开发中的其他适应症在高需要的孤儿适应症中的开发阶段临床前1期2和3期批准1个Alagille综合征(ALGS)FDA和EMA批准的进展性家族性肝内FDA和EMA批准的2个胆汁淤积症(PFIC)胆汁淤积性瘙痒扩展3期,预计注册完成20263(其他设置)®脑腱性黄瘤病FDA批准4(CTX)胆酸合成FDA批准5 Disorders(BASD)原发性硬化性胆管炎(PSC)VISTAS 2b期阳性中期分析,验证性顶线数据预计2026年第二季度volixibat授予FDA突破性原发性胆汁性胆管炎(PBC)VANTAGE 2b期阳性中期分析,预计注册完成2026年治疗指定脆性X综合征(FXS)第2期,启动2025年Q4 MRM-3379 AZURE 1 & 4,第3期顶线数据预计H2 2026(美国注册计划)授予FDA突破性6德尔塔肝炎病毒(HDV)治疗和EMA PRIME brelovitug指定AZURE 2 & 3,第3期顶线数据预计2028年上半年(欧盟注册计划)1获得美国FDA批准,用于3个月及以上Alagille综合征患者的胆汁淤积性瘙痒症。欧盟委员会已授予LIVMARLI上市许可®(maralixibat)口服溶液治疗2个月及以上Alagille综合征患者的胆汁淤积性瘙痒2获得美国FDA批准,用于PFIC12个月及以上患者的胆汁淤积性瘙痒症。欧盟委员会已授予LIVMARLI上市许可®(maralixibat)口服溶液用于治疗3个月及以上患者的PFIC 3使用液体口服制剂进行扩大研究,该研究着眼于具有额外环境的超罕见胆汁淤积性瘙痒症患者,不包括PSC、PBC、ICP、ALGS和PFIC4获得美国FDA批准,用于治疗成人脑腱性黄瘤病(CTX)5胆汁酸合成障碍包括过氧化物酶体生物发生障碍-齐薇格谱障碍(PBD-ZSD)56为说明目的,假设拟议收购完成,该收购仍受惯例完成条件的约束
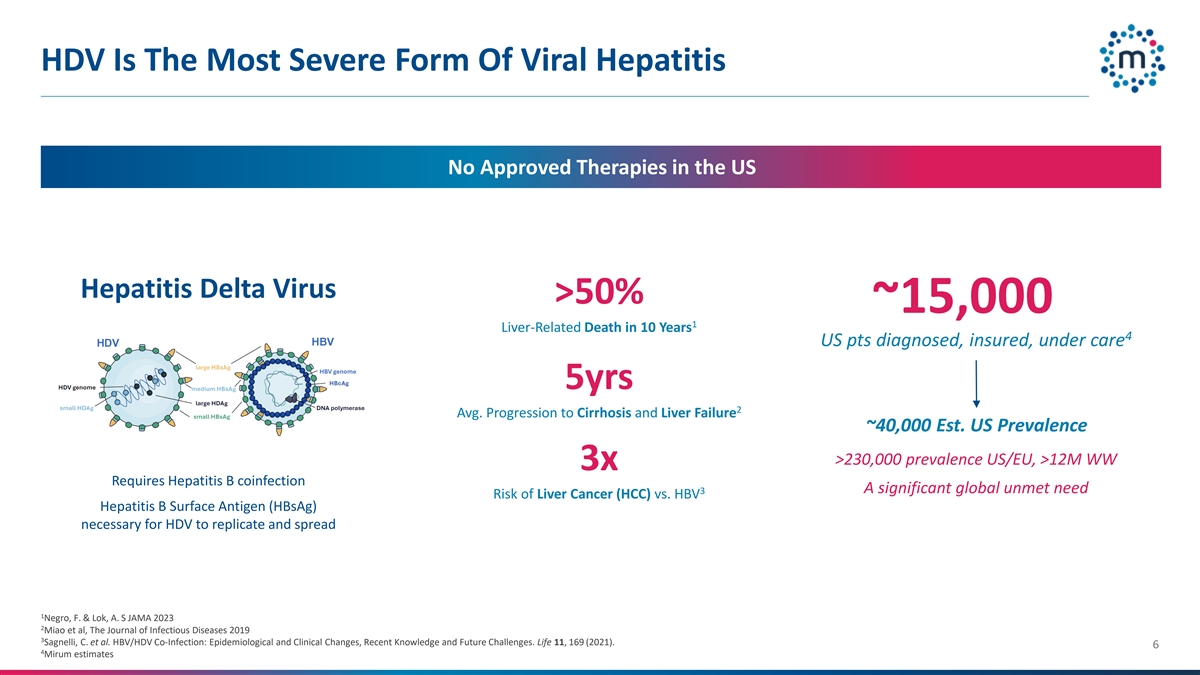
HDV是美国最严重的病毒性肝炎形式,没有批准的治疗方法,美国肝炎德尔塔病毒> 50%~15,000~10年1例肝脏相关死亡4名美国患者诊断、投保、接受护理5年2平均。进展为肝硬化和肝衰竭~40000 EST。美国流行率> 23万流行率美国/欧盟,> 12M WW 3x需要乙肝合并感染3肝癌(HCC)vs. HBV乙肝表面抗原(HBSAG)复制和传播所必需的全球显着未满足需求风险1 Negro,F. & Lok,A.S JAMA2023 2 Miao et al,the Journal of Infectious Diseases 20193 Sagnelli,C. et al. HBV/HDV合并感染:流行病学和临床变化、近期知识和未来挑战。生命11,169(2021)。64 Mirum估计
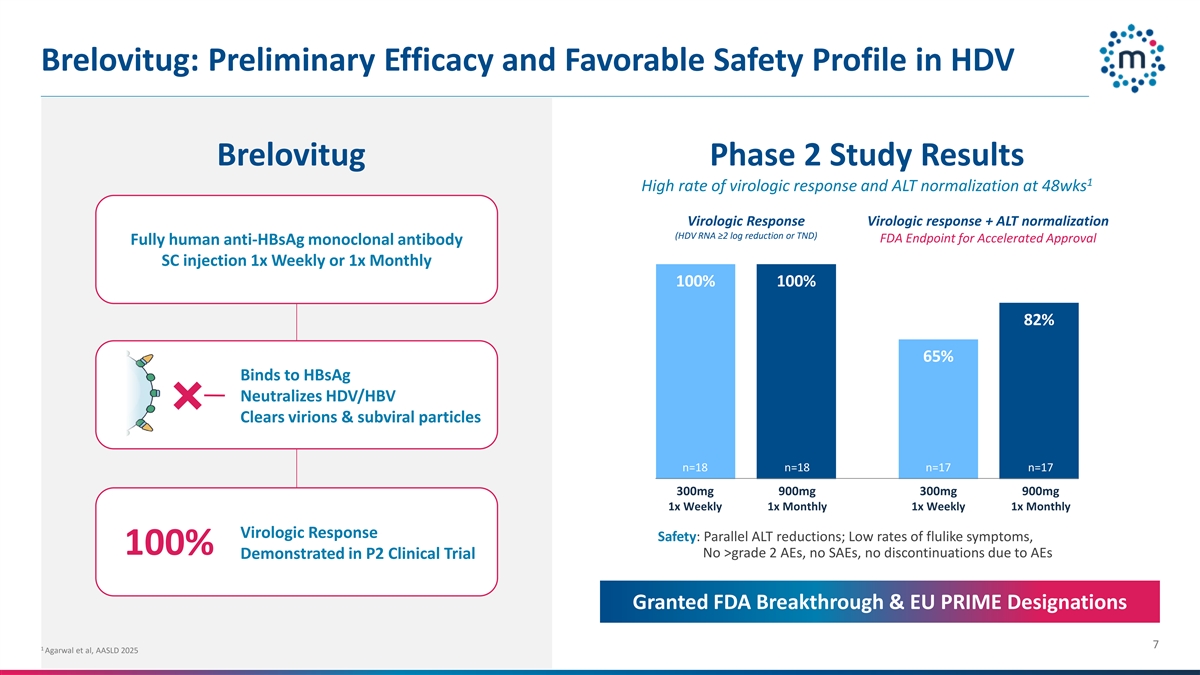
brelovitug:在HDV brelovitug 2期研究中的初步疗效和良好的安全性结果1 48wks时病毒学应答和ALT正常化的高率病毒学应答+ ALT正常化(丨HDV丨RNA ≥ 2 log减少或TND)FDA加速批准终点全人源抗HBSAg单克隆抗体SC注射液1次每周或1次每月100% 82% 65%与HBSAg结合可中和TERM0TERM/HBV清除病毒粒子&亚病毒颗粒n = 18 n = 18 n = 17 n = 17 300mg900mg300mg900mg1x周1x月1x周1x月1x月1x病毒学应答安全性:平行ALT减少;流感样症状发生率低,100% no > 2级AEs,no SAE,no discontinuations due to AEs demonstrated in P2 clinical trial granted FDA breakthrough & EU prime designations 71 Agarwal et al,AASLD 2025
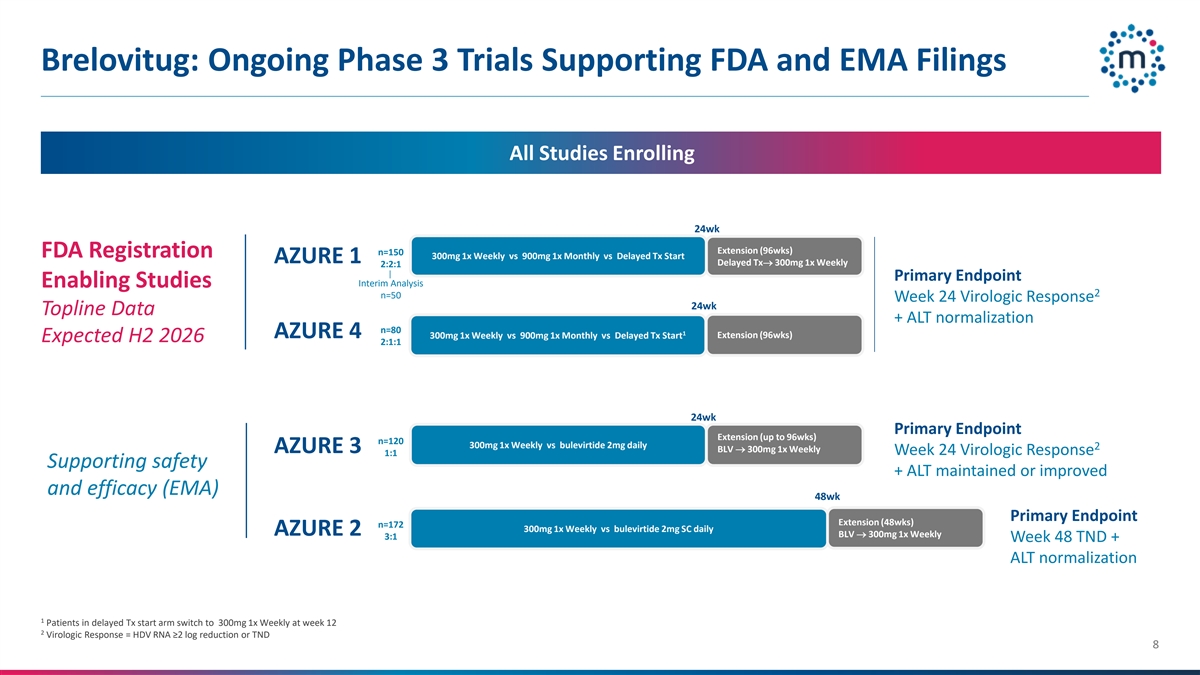
Brelovitug:正在进行的支持FDA的3期试验和EMA备案的所有研究均招募24wk延期(96wks)n = 150 FDA注册300mg每周1x vs 900mg每月1x vs延迟的TX开始AZURE 1延迟的TX → 300mg每周1x 2:2:1主要终点中期分析使能研究2 n = 50周24病毒学应答24wk顶线数据+ ALT正常化n = 801 AZURE 4 300mg每周1x vs 900mg每月1x vs延迟的TX开始延长(96wks)预计2026年下半年2:1:1 24wk主要终点延长(最多96wks)n = 120 300mg每周1x vs Bulevirtide每日2mg 2 BLV → 300mg每周1x AZURE 3周24病毒学应答1:1支持+ ALT维持或改善且疗效(EMA)48wk主要终点延长(48wks)n = 172 300mg 1x周vs布列韦肽2mg SC每日AZURE 2 BLV → 300mg 1x周3:1周48 TND + ALT正常化1延迟TX患者在第12周开始臂切换至300mg 1x周2病毒学应答= TERM0 RNA ≥ 2 log减少或TND 8
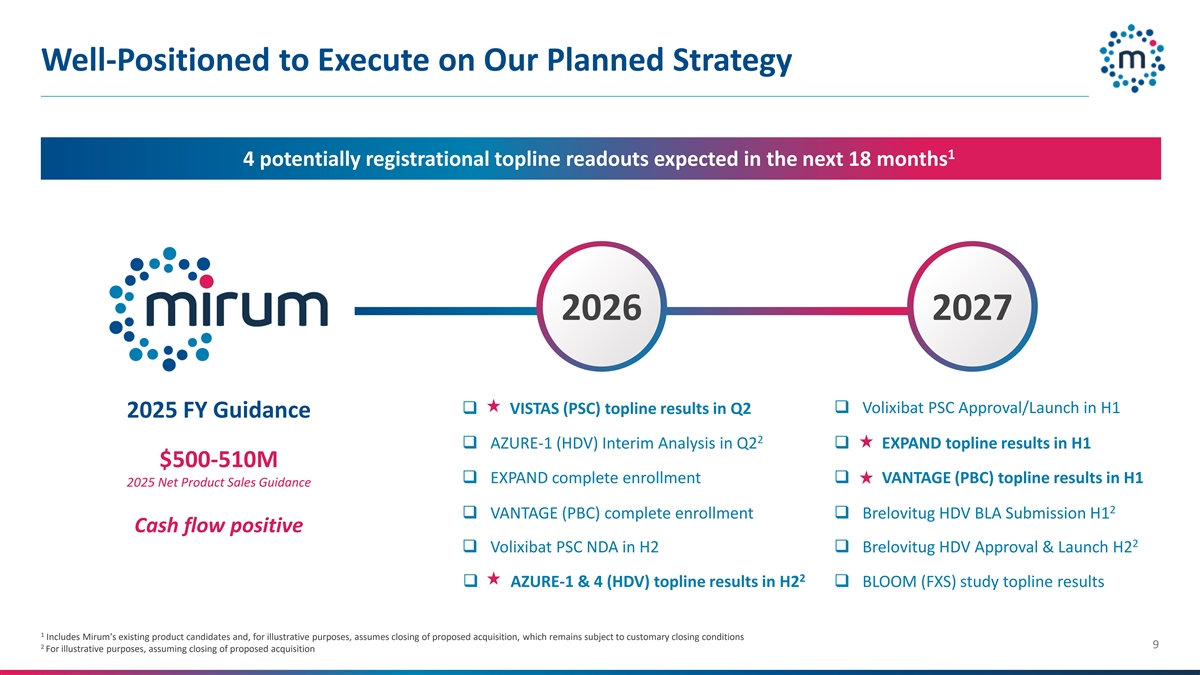
有能力执行我们计划的战略14预计在未来18个月内有4个潜在的注册顶线读数20262027 q VISTAS(PSC)顶线结果Q2 q Volixibat PSC批准/在2025年上半年推出财政年度指导2 q AZURE-1(HDV)中期分析Q2扩大顶线结果H1 $ 500-5.1亿q扩大完全入学q VANTAGE(PBC)顶线结果2025年上半年净产品销售指导2 q VANTAGE(PBC)完全入学q brelovitug丨HDV丨BLA提交H1现金流正2 q Volixibat PSC NDA in H2q brelovitug丨HDV HDV批准&在H2q BLOOM(FXS)研究中,顶线结果1包括Mirum现有的候选产品,为说明目的,假设拟议收购已完成,但仍受惯例成交条件29为说明目的,假设拟议收购已完成

谢谢你©2025 Mirum Pharmaceuticals, Inc.版权所有。本演示文稿中出现的所有服务标记、商标和商号均为其各自所有者的财产。仅为方便起见,本演示文稿中提及的商标和商号出现时没有®和符号,但这些引用无意以任何方式表明,我们不会根据适用法律在最大程度上主张我们的权利,或适用许可人对这些商标和商号的权利。此处的信息仅供参考,代表Mirum制药,Inc.截至本演示文稿发布之日(或如果特别注明,则截至较早日期)的当前观点。