
附件 99.1 美第奇新星生物技术公司介绍2025年3月

前瞻性陈述本演示文稿中非历史性的陈述构成1995年《私人证券诉讼改革法案》安全港条款含义内的前瞻性陈述。这些前瞻性陈述包括关于美第奇新星生物技术的临床试验支持其候选产品的安全性和有效性以及此类候选产品的潜在新颖性的陈述,例如疾病治疗、临床试验的计划和目标以及产品开发、战略、未来业绩、预期、假设、财务状况、流动性和资本资源。这些前瞻性陈述包括但不限于关于MN-166和MN-001未来发展和功效的陈述。这些前瞻性陈述可能在前面、后面或以其他方式包含“相信”、“预期”、“预期”、“打算”、“估计”、“项目”、“可以”、“可以”、“可能”、“将”、“将”、“将”、“考虑”、“计划”或类似的表达方式。这些前瞻性陈述涉及许多风险和不确定性,可能导致实际结果或事件与此类前瞻性陈述明示或暗示的结果或事件存在重大差异。可能导致实际结果或事件与这些前瞻性陈述中明示或暗示的结果或事件存在重大差异的因素包括但不限于为MN-166和MN-001的开发获得未来合作伙伴或授予资金的风险,以及在需要时筹集足够资金为美第奇新星生物技术的运营和对临床开发的贡献提供资金的风险、临床试验中固有的风险和不确定性,包括与旨在满足FDA指导的临床试验相关的潜在成本、预期时间和风险,以及考虑到这些因素、产品开发和商业化风险的进一步开发的可行性,与美第奇新星生物技术依赖其MN-166和MN-001候选产品成功相关的风险、临床试验结果是否能够预测产品开发最终阶段结果的不确定性、延迟或未能获得或维持监管批准的风险、与依赖第三方赞助和资助临床试验相关的风险、与产品候选者的知识产权相关的风险以及捍卫和执行此类知识产权的能力,美第奇新星生物技术所依赖的进行临床试验和制造候选产品的第三方未能按预期表现的风险,由于临床试验的开始、注册、完成或分析的延迟或有关临床试验设计的充分性或临床试验的执行的重大问题而导致的成本增加和延迟的风险,以及预计向监管机构备案的时间安排,美第奇新星生物技术与第三方的合作,可用于完成产品开发计划的资金以及MediciNov a在需要时为项目获得第三方资金并筹集足够资金的能力,以及美第奇新星生物技术向Securi关系和交易委员会提交的文件中描述的其他风险和不确定性,包括其截至2024年12月31日止年度的10-K表格年度报告及其随后的10-Q和8-K表格定期报告。美第奇新星生物技术不承担任何修改或更新这些前瞻性陈述的意图或义务。©MediciNova, Inc. 2

美第奇新星生物技术概览丨美国办事处:圣地亚哥;日本办事处:东京•在TSE JASDAQ(4875)和NASDAQ(MNOV)双重上市丨生物制药公司开发后期候选药物•多个后期管道(2/3期、2期)•完善的安全概况丨专注于未满足的医疗需求• MN-166(ibudilast):神经退行性疾病、脑肿瘤• MN-001(tipelukast):代谢性疾病(高脂血症/T2DM、NAFLD(MAFLD))丨资本高效模式•运营现金消耗~1200万美元/年•外包项目的特许权使用费收入(丨赛诺菲赛诺菲/健赞)• MNOV的大部分资金©MediciNova, Inc. 3

MNOV核心管道1期2期3期适应症MN-166(布洛司特)*ALS(肌萎缩侧索硬化症)*孤儿病,快速通道**脑肿瘤(胶质母细胞瘤脑转移)**快速通道急性肺损伤/严重肺炎MN-001(替泊鲁司特)52型DM + Hyper TG + NAFLD SAR 444836(AAV基因疗法)外授权给赛诺菲/健赞5 PKU(苯丙酮尿症)©MediciNova, Inc. 4

学术界合作项目•所有非核心项目均由公共/政府机构全额资助,由来自美国、英国、澳大利亚和加拿大知名机构的学术界研究人员运营•完成后,MNOV拥有零开发费用的监管申请的完全权利• MNOV然后在监管备案后拥有商业化的独家权利©MediciNova, Inc. 5

MN-166伊布迪司特6

MN-166概述CODEMN-166描述小分子化学名称依布迪司特给药途径口服静脉注射作用机制多MOAs(MOA)MIF(巨噬细胞抑制因子)抑制剂PDE(磷酸二酯酶)3、4、10、11抑制剂TLR4(Toll-like-Receptor 4)抑制剂临床效果降低神经炎症神经保护肿瘤微环境修饰©MediciNova, Inc. 7

首个2期ALS研究(MN-166-ALS-1201)的阳性结果研究摘要•单中心(PI:Dr. Brooks,Carolina Neuromuscular ALS MDA中心),R(1:2),PCT,DB后OLE •目标ALS患者(ALS病史~5年),接受利鲁唑治疗•治疗:60毫克/天MN-166或安慰剂X6个月后6个月OLE •共51名患者入组R =随机,PCT =安慰剂对照,DB =双盲,OLE = open-Label-Extension Responder Anlaysis Outcome Responder Category Placebo(n = 16)MN-166(n = 33)+ Riluzole + Riluzole ALSFRS-R较基线稳定或改善2/16(12.5%)7/33(21.2%)ALSAQ-5 4/16(25%)17/33(51.5%)(QOL)MMT 4/16(25%)11/33(33.3%)(肌力)结果:MN-166治疗组更多的响应者©MediciNova, Inc. Ref:Oskarsson B,et al. Neurodegener Dis Manag。2021年12月;11(6)8

正在进行的2/3期ALS研究(COMBAT-ALS/MN-166-ALS-2301)研究地点:美国和加拿大的多中心研究设计:R(1:1)、PCT、DB研究,然后是OLE目标患者:早期ALS(18个月内有ALS病史)剂量:100mg/天或安慰剂治疗持续时间:12个月DB,6个月OLE大小:N = 230(随机)主要终点:12个月时ALSFRS-R评分与基线的变化和生存时间(全球等级测试)二级肌肉力量(HHD)、生活质量(ALSAQ-5)应答者分析(ALSFRS-R)终点:生存时间、安全性和耐受性研究状态:截至2024年12月,共228人入组,193个随机©MediciNova, Inc. 9

即将进行的NIH资助扩大准入ALS研究(SEA-NOBI-ALS)赞助商:NIHNINDS(美国国家神经系统疾病和脑卒中研究所)资助金额:2200万美元牵头PI:Mayo Clinic Oskarsson博士研究地点:美国多中心(约20个地点)研究设计:开放标签研究目标患者:晚期ALS患者(ALS病史> 36个月)或VC(呼吸功能)< 50%剂量:60毫克/天治疗持续时间:6个月大小:N = 200原发性血浆NFL(神经丝光)浓度终点:ALSFRS-R评分次级ALSAQ-5(QOL),神经QOL,炎性细胞因子测定终点:研究状态:计划于2025年第二季度入组首例患者©MediciNova, Inc. 10
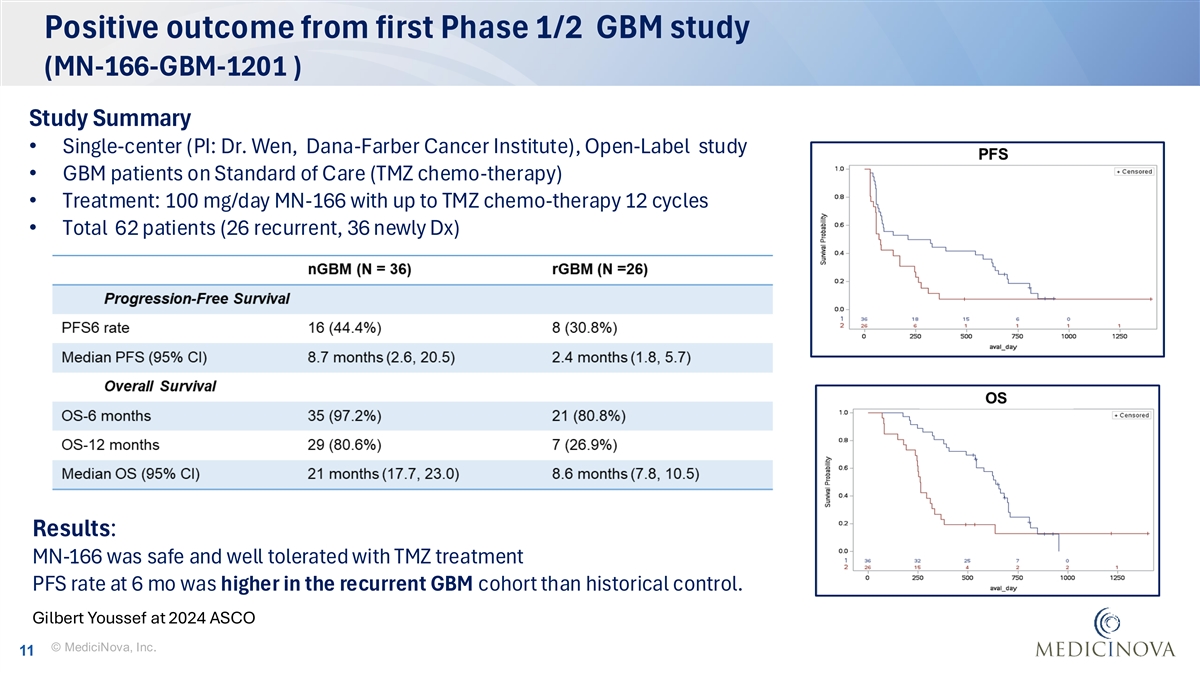
首个1/2期GBM研究(MN-166-GBM-1201)的阳性结果研究摘要•单中心(PI:Dr. Wen,Dana-Farber Cancer Institute),开放标签研究• GBM患者接受标准护理(TMZ化疗)•治疗:100mg/天MN-166与高达TMZ化疗12个周期•共有62名患者(26名复发,36名新DX)结果:MN-166在复发的GBM队列中使用TMZ治疗6个月时安全性和耐受性良好的PFS率高于历史对照。吉尔伯特·优素福在2024年ASCO©MediciNova, Inc. 11
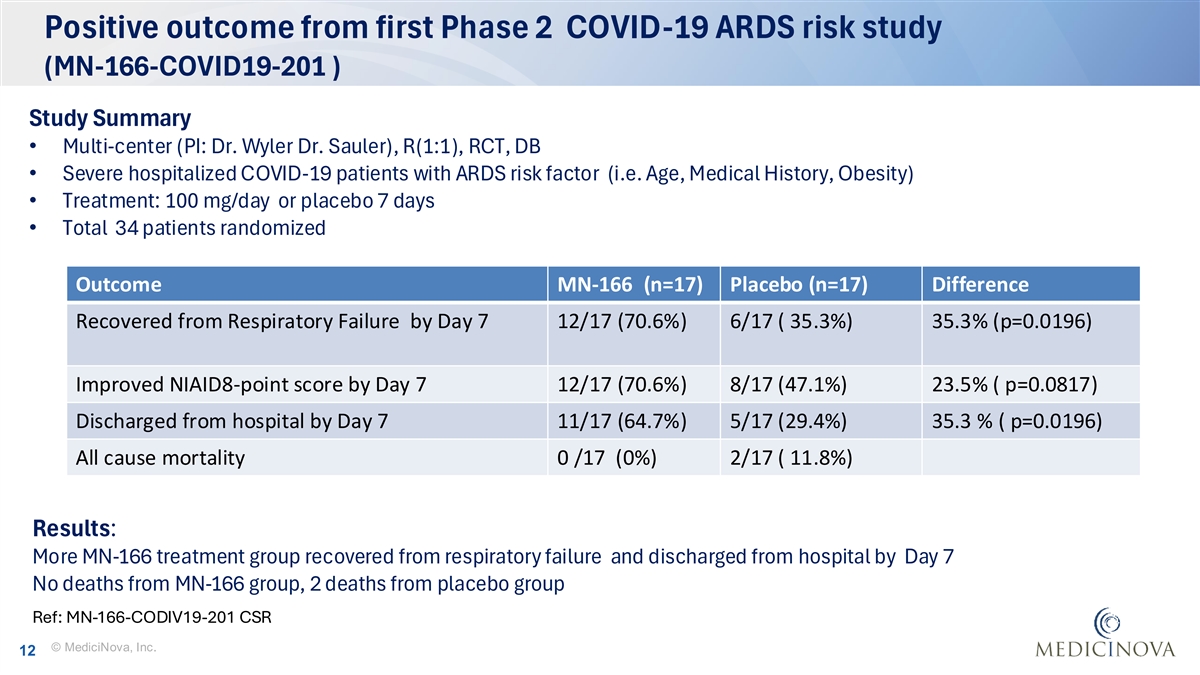
首个2期新冠肺炎ARDS风险研究(MN-166-COVID 19-201)的阳性结果研究摘要•多中心(PI:Dr. Wyler Dr. Sauler)、R(1:1)、RCT、DB •具有ARDS风险因素(即年龄、病史、肥胖)•治疗:100mg/天或安慰剂7天•共有34名患者随机结果MN-166(n = 17)安慰剂(n = 17)到第7天呼吸衰竭恢复的差异12/17(70.6%)6/17(35.3%)35.3%(p = 0.0 196)到第7天改善NIAID8分12/17(70.6%)8/17(47.1%)23.5%(p = 0.08 17)到第7天出院11/17(64.7%)5/17(29.4%)35.3%(p = 0.0 196)全因死亡率0/17(0%)2/17(11.8%)结果:更多MN-166治疗组呼吸衰竭康复出院到第7天MN-166组无死亡,安慰剂组死亡2例Ref:MN-166-CODIV19-201 CSR©MediciNova, Inc. 12

MN-001 Tipelukast 13

MN-001概述CODEMN-001描述小分子化学名称Tipelukast给药路线口服作用机制多MOA(MOA)白三烯& 5-脂氧合酶(5-LO)通路抑制剂PDE(磷酸二酯酶)3,4抑制剂临床效果抗炎降低血清甘油三酯降低CD36表达,抑制花生四烯酸摄取进入肝细胞©MediciNova, Inc. 14
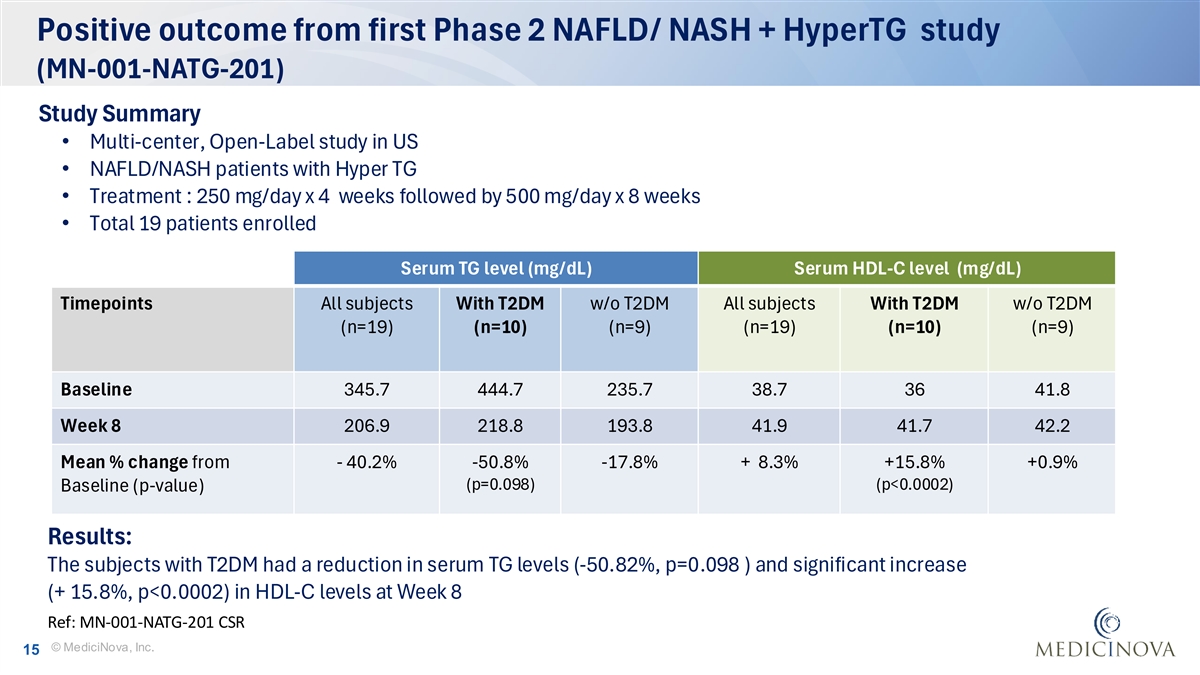
首个2期NAFLD/NASH + HyperTG研究(MN-001-NATG-201)研究结果阳性•多中心,美国• NAFLD/NASH超TG患者的开放标签研究•治疗:250mg/天x4周后500mg/天x8周•共有19名患者入组血清TG水平(mg/dL)血清HDL-C水平(mg/dL)时间点所有T2DM w/o T2DM受试者所有T2DM w/o T2DM受试者(n = 19)(n = 10)(n = 19)(n = 10)(n = 9)基线345.74 44.72 35.7 38.73 641.8第8周206.92 18.81 93.84 1.94 1.74 2.2平均百分比变化-40.2%-50.8 %-17.8 % + 8.3% + 15.8% + 0.9%(p = 0.098)(p < 0.0002)基线(p值)(-50.82 %,p = 0.098)且第8周HDL-C水平显著上升(+ 15.8%,p < 0.0002)Ref:MN-001-NATG-201 CSR©MediciNova, Inc. 15

正在进行的2期HyperTG + T2DM + NAFLD研究(MN-001-NATG-202)研究地点:美国2个研究设计中心:R(1:1)、PCT、DB研究• Jubilee临床研究中心o PI:Dr. Shin • South Texas Research Institute o PI:Dr. Patil目标患者:HyperTG + T2DM + NAFLD剂量:500mg/天或安慰剂治疗持续时间:24周大小:N = 40(随机)第24周Fibroscan对照衰减参数评分较基线的变化主要终点:第24周空腹血清TG水平较基线的变化二级评估MN-001终点的安全性和耐受性:评估MN-001对血脂谱(即HDL-C、LDL-C、总胆固醇水平)的影响研究现状:截至2024年12月,共43例入组,26例随机©MediciNova, Inc. 16

联系人:Yuichi Iwaki,医学博士,David H. Crean,博士谢谢!首席执行官/总裁首席商务官iwaki@medicinova.com crean@medicinova.com©MediciNova, Inc. 17