附件 99.1

为RAS/MAPK通路驱动的癌症提供新疗法企业介绍| 2025年9月

2前瞻性陈述本演示文稿包括有关(其中包括)Verastem肿瘤学(“公司”)的项目和产品候选者、战略、未来计划和前景的前瞻性陈述,包括与AVMAPKI FAKZYNJA CO-PACK(阿伐替尼胶囊;defactinib片)作为KRAS突变复发性低级别浆液性卵巢癌(LGSOC)成人患者的治疗药物的批准和商业化、合作的预期结果和益处,包括与GenFleet Therapeutics(Shanghai),Inc.(GenFleet)的合作,包括开展与VS相关的第1/2a期研究-7375,RAMP 301 3期试验结果的注册状态和潜力,以确认RAMP 201研究特定于KRAS突变患者的结果并扩大适应症,而无论KRAS突变状态如何,我们计划和待进行的临床试验的结构,公司各种临床试验的潜在cl值,包括RAMP 201J、RAMP 203、RAMP 205、RAMP 301和VS-7375试验,开始和完成试验的时间,包括顶线数据报告,与监管机构的互动,临床开发的时间表和适应症、监管提交、候选产品商业化的潜力和时间以及涉及公司的LED化合物的额外开发计划的潜力以及我们的候选药物的潜在市场机会和估计的潜在市场。“预期”、“相信”、“估计”、“预期”、“可能”、“计划”、“目标”、“潜力”、“将”、“可能”、“应该”、“继续”、“可以”和类似表述旨在识别前瞻性陈述,尽管并非所有前瞻性陈述都包含这些识别词。每份前瞻性陈述都受到风险和不确定性的影响,这些风险和不确定性可能导致实际结果与此类陈述中明示或暗示的结果存在重大差异。适用的风险和不确定性包括风险和不确定性,除其他外,涉及以下方面:开发elo pment的成功和我们的候选产品的潜在商业化,包括阿武托替尼与其他化合物联合使用,包括defactinib、LUMAKRAS和其他;研发中固有的不确定性,例如clin ica l试验的阴性或意外结果,可能向任何司法管辖区的监管机构提交的我们的产品候选者申请的发生或时间;任何司法管辖区的监管机构是否以及何时可能批准可能为我们的产品候选者提交的任何此类申请,如果获得批准,我们的产品候选者是否会在这些司法管辖区获得商业成功;我们为我们的pro duc t候选者获得、维护和执行专利和其他知识产权保护的能力;任何法律诉讼的范围、时间和结果;监管机构关于trial de sig n的决定,标签和其他可能影响我们的产品候选者的时间、可用性或商业潜力的事项;Whet她对我们的产品候选者的临床前测试和临床试验的初步或中期数据将预测正在进行或以后的临床试验的结果或成功;时间,我们的产品候选者的报销范围和报销率;我们的候选药物的市场机会是基于内部和第三方的估计,这可能会证明b e不正确;第三方付款人(包括政府机构)可能不会报销;可能存在影响我们的产品候选者的竞争性发展;数据可能无法在预期时获得;临床试验的注册可能会使ger超出预期,这可能会延迟我们的开发计划,包括美国食品药品监督管理局(FDA)的审查延迟;我们的RAMP 301试验可能无法确认RAMP 201试验特定于在KRAS突变复发性LGSOC成人患者中使用AVMAPKI FAKZYNJA CO-PACK的结果的风险;与初步和中期数据相关的风险,这些数据可能不能代表更成熟的数据,包括在治疗持续时间方面的数据;我们的候选产品将导致不良安全性事件和/或额外的数据或分析可能会产生意想不到的担忧,或导致与其功效水平相比无法管理的安全性特征;我们可能无法成功验证,develo p a nd获得监管机构对我们的产品候选者的伴随诊断测试的批准,这些产品候选者需要或将在商业上从此类测试中受益, 或在这样做时遇到重大延误;成熟的RAMP201数据和与FDA的相关讨论可能不支持LGSOC中阿武托替尼和德法替尼组合的新药申请提交范围,包括关于Kirsten大鼠肉瘤病毒癌基因同源物(KRAS)野生型(KRAS wT);我们的候选产品可能会遇到制造或供应中断或故障;我们的任何第三方合同研究组织、c ontract制造组织、临床站点或承包商,其中包括,我们所依赖的人未能充分履行职责;我们面临实质性竞争,这可能导致其他人在我们的产品候选者之前开发或商业化产品或比我们更成功,这可能导致我们的产品候选者的市场份额或市场潜力减少;我们将无法成功启动或完成我们的产品候选者的临床开发和最终商业化;我们的产品候选者的研发和商业化将花费比计划更长的时间或成本更高,包括由于进行了额外的研究或我们关于执行此类商业化的决定;我们可能没有足够的现金为我们的预期运营提供资金,包括我们的某些产品开发方案ram s;我们可能无法吸引和留住高素质的人员;我们或中外制药有限公司可能无法根据阿伏托替尼许可协议充分履行职责;我们的候选产品的总目标和目标市场可能比我们预先估计的要小;我们或Secura Bio,Inc.将无法根据与Secura Bio,Inc.,Inc. luding就里程碑付款达成的资产购买协议充分履行义务;我们将无法看到我们根据与GenFleet的合作和期权协议已有并可能继续进行的付款的投资回报,或者GenFleet将无法根据协议充分履行义务;我们可能无法以优惠条款建立新的或扩大现有合作或合作伙伴关系,包括在我们的候选产品的内部许可方面,或根本没有;我们可能无法通过产品许可、共同促销安排、公共或私募股权、债务融资或其他方式获得足够的融资;我们将不会为我们的产品候选者寻求或提交监管文件;由于最近总统行政当局的变化以及FDA劳动力的显着减少和FDA预算的有力削减,我们可能会对FDA从事可能影响我们业务的各种活动的能力产生重大影响,包括常规监管和监督活动;以及我们的候选产品可能不会获得监管批准,成为商业上成功的产品,或导致向患者提供新的治疗方案。其他风险和不确定性包括公司于2025年3月20日向美国证券交易委员会(SEC)提交的截至2024年12月31日止年度的M1 0-K年度报告中“风险因素”标题下确定的风险和不确定性,以及随后向SEC提交的任何文件中确定的风险和不确定性,可在www.sec.gov和www.verastem.com上查阅。本演示文稿中的前瞻性陈述仅在本演示文稿的原始日期发表,我们不承担更新或修改任何这些陈述的义务,无论是由于新信息、未来事件或其他原因,除非法律要求。使用非GAAP财务指标本演示文稿包含对我们的非GAAP运营费用的引用,这是一种财务指标,未按照美国公认会计原则(GAAP)计算。这一非GAAP财务指标不包括根据GAAP确定的相应财务指标中的某些金额或费用。管理层认为,结合公司的GAAP财务报表,这一非GAAP信息对投资者很有用,因为它为公司的经营业绩提供了更大的透明度和期间可比性,并可以增强投资者识别公司业务经营趋势的能力。除其他因素外,管理层使用这一衡量标准来评估和分析运营结果和趋势,并做出财务和运营决策。非GAAP信息不是根据一套全面的会计规则编制的,应仅用于补充对根据GAAP报告的公司经营业绩的理解,而不是孤立地或替代或优于根据GAAP编制和呈报的财务信息ati。此外, 这种非GAAP财务指标不太可能与其他公司提供的非GAAP信息具有可比性。确定不包括在非公认会计准则财务指标中的金额是管理层判断的问题,除其他因素外,取决于基本费用或收入金额的性质。这种非GAAP财务指标与最具可比性的GAAP财务指标之间的对账情况集中在本演示文稿中出现这种非GAAP数字的幻灯片的脚注中。第三方来源本演示文稿中包含的某些信息,包括行业和市场数据以及其他统计信息,是根据研究、出版物、调查和从第三方来源获得的其他数据以及公司自己的实习生估计和研究得出或基于的。虽然公司相信这些第三方来源在本演示文稿之日是可靠的,但它没有独立核实,也不对从第三方来源获得的任何信息的充分性、公平性、准确性或完整性作出任何陈述。此外,本演示文稿中包含的所有市场数据均涉及麻木的假设和限制,无法保证此类假设的准确性或可靠性免责声明

33商业产品和管道定位于提供长期股东价值•商业启动的早期执行强劲• 2025年5月批准AVMAPKI FAKZYNJA CO-PACK,比PDUFA行动日期提前六周•首个FDA批准的治疗方法,特别是f或KRAS-突变的复发性低级别浆液性卵巢癌(LGSOC),在NCCN指南中列为2A类•推进我们在RAS/MAPK通路驱动的癌症中的新型早期管道• VS-7375,一种口服KRAS G12D(ON/OFF)抑制剂:在中国以外的晚期KRAS G12D突变实体瘤患者中启动1/2a期试验;来自中国合作伙伴的令人鼓舞的初步安全性和有效性结果•最大限度地发挥avutometinib联合defactinib在其他晚期实体瘤中的协同潜力• RAMP 205:一线转移性胰腺癌;DL1实现83%的确认ORR(10/12)• RAMP 203:晚期KRAS G12C突变非小细胞肺癌;在三联体联合队列中未观察到DLT •现有现金、投资、和预期的未来产品销售为我们提供了强劲的财务状况和进入2026年下半年的跑道PDUFA:处方药用户费用法案;KR AS:Kirsten大鼠肉瘤病毒;MAPK:丝裂原激活的P rotein K酶;FDA:食品和药物管理局;NCCN:国家综合癌症网络;DL:剂量水平:ORR:客观反应率:DLT:剂量限制性毒性

4 AVMAPKI FAKZYNJA CO-PACK商业发布开局强劲FDA于2025年5月8日批准,比PDUFA行动日期RAS/MAPK通路定向MOA提前近两个月• AVMAPKI提供RAF和MEK的双重抑制• FAKZYNJA介导活化RAF/MEK的耐药性•它们一起提供了对RAS/MAPK通路中驱动生长和耐药性的信号传导的更完整的阻断,具有临床意义的反应率和较长的治疗持续时间• 44% ORR,3.3-31.1个月mDOR可管理的安全性允许治疗直到大多数患者的进展方便,两种口服给药治疗•新型间歇给药方案更多信息请查看完整的处方信息上市前六周实现净产品收入210万美元MOA:作用机制;RAF:快速加速纤维肉瘤;MEK,丝裂原激活的细胞外信号调节激酶;mDOR:中位应答持续时间
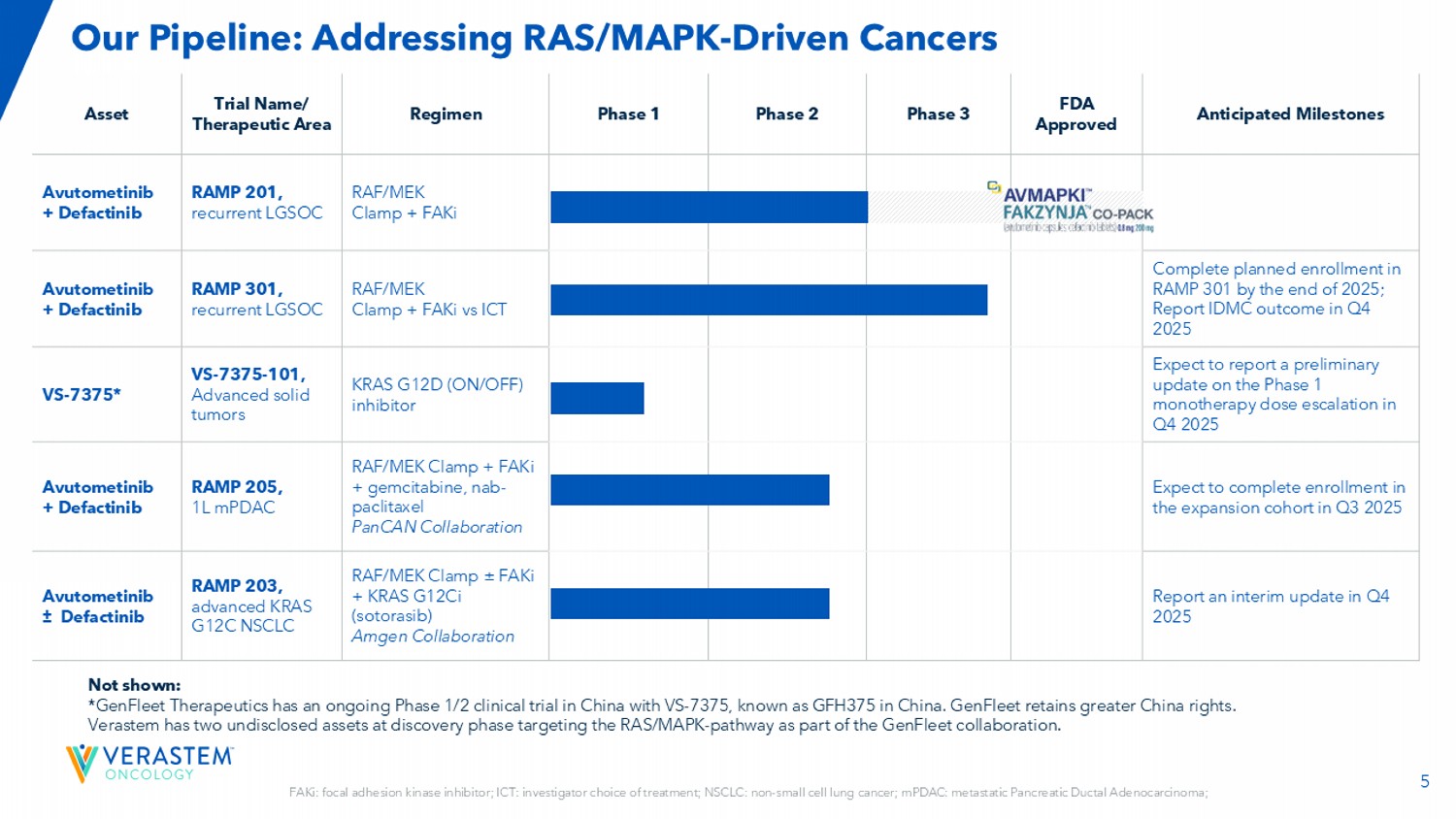
5个预期里程碑FDA批准3期2期1期方案试验名称/治疗领域资产RAF/MEK钳+ FAKi RAMP 201,复发性LGSOC阿武托替尼+ Defactinib 2025年底完成RAMP 301的计划入组;2025年Q4报告IDMC结果RAF/MEK钳+ FAKi vs ICT RAMP 301,复发性LGSOC阿武托替尼+ Defactinib预计在2025年Q4报告1期单药治疗剂量递增的初步更新KRAS G12D(ON/OFF)抑制剂VS-7375-101,晚期实体瘤VS-7375*预计2025年Q3完成RAF/MEK钳+ FAKi +吉西他滨扩增队列入组,NAB-紫杉醇PANCAN协同RAMP 205,1L mPDAC阿武托替尼+ Defactinib报告中期更新2025年Q4 RAF/MEK钳± FAKi + KRAS G12CI(Sotorasib)安进协同RAMP 203,NSCLC晚期KRAS G12C阿伐替尼“Defactinib FAKi:粘着斑激酶抑制剂;ICT:研究者的治疗选择;NSCLC:非小细胞肺癌;mPDAC:转移性胰腺导管腺癌;我们的管道:治疗RAS/MAPK驱动的癌症未显示:*GenFleet Therapeutics在中国正在进行VS-7375的1/2期临床试验,在中国被称为GFH375。GenFleet保留更大的中国权利。作为GenFleet合作的一部分,Verastem有两项针对RAS/MAPK-通路的处于发现阶段的未披露资产。

6 x报告了正在进行的RAMP 205试验的更新数据,以及推荐2期剂量(RPTD)的选定剂量1级队列x接近完成RPTD RAMP 205的29名患者扩展队列的入组:阿武托替尼+ Defactinib + SOC化疗1L mPDAC x完成KRAS G12C抑制剂的入组,先前治疗的1期B部分双联队列x完成了三联组合RAMP 203的计划剂量水平评估队列的入组:阿武托替尼+索托拉西±德法替尼在晚期NSCLC的KRAS G12C中实现了设定于2025年的关键研发里程碑,最大限度地发挥阿武托替尼+德法替尼在其他晚期实体瘤中的协同潜力x美国IND在美国的1/2a期试验中申请并批准了x剂量的首例患者x GenFleet报告了来自中国的更新1期临床数据x在1L和2L mPDAC中获得FDA快速通道指定VS-7375,口服KRAS G12D(ON/OFF)抑制剂Advance新型、早期管线研发:研发。IND:研究性新药

7在1H25实现了所有关键里程碑,有望在2H25交付RAMP 301到2025年底完成3期验证性研究的计划入组。2025年Q4报告IDMC推荐。RAMP 201J报告2025年第四季度在日本进行的2期临床试验的初步数据。RAMP 203报告2025年第四季度双联和三联组合的中期数据更新。RAMP 205将于2025年Q3在扩展队列中完成注册。产品发布•有效到达HCP •与患者接触•确保无缝访问VS-7375-101预计将在2025年第四季度报告1期单药治疗剂量递增的初步更新。在2025年第四季度启动各种剂量递增组合队列。IDMC:独立数据监测委员会;HCPs:医疗保健专业人员

8在美国商业推出用于KRAS-突变复发性LGSOC FDA批准日期:2025年5月8日
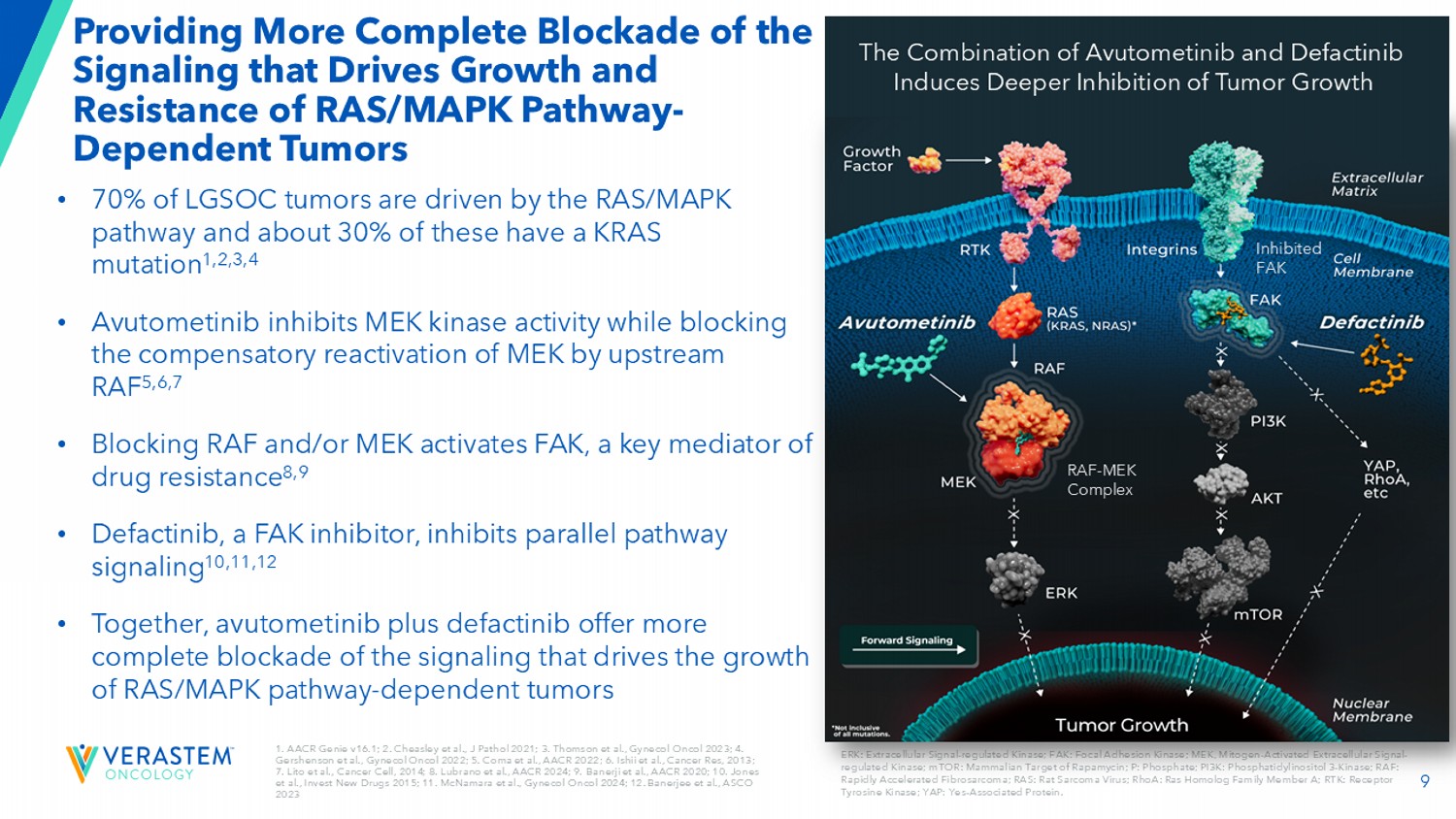
9 1.AACR Genie v16.1;2。Cheasley等,J Pathol 2021;3。Thomson et al.,Gynecol Oncol 2023;4。Gershenson等,Gynecol Oncol 2022;5。Coma et al.,AACR 2022;6。Ishii et al.,Cancer Res,2013;7。Lito et al.,Cancer Cell,2014;8。Lubrano等人,AACR 2024;9。Banerji等人,AACR 2020;10。Jones et al.,invest new drugs 2015;11。McNamara等人,Gynecol Oncol 2024;12。Banerjee等人,ASCO2023提供了更完整的阻断驱动RAS/MAPK通路生长和耐药的信号传导-dependent tumors ERK:胞外信号调节激酶;FAK:局灶性粘附激酶;MEK,丝裂原激活的胞外信号调节激酶;mTOR:Rapamycin的哺乳动物靶点;P:磷酸盐;PI3K:磷脂酰肌醇3-激酶;RAF:快速加速纤维肉瘤;RAS:大鼠肉瘤病毒;RhoA:RAS同源家族成员A;RTK:受体酪氨酸激酶;YAP:是-相关蛋白。• 70%的LGSOC肿瘤由RAS/MAPK通路驱动,其中约30%具有KRAS突变1,2,3,4• Avutometinib抑制MEK激酶活性,同时阻断上游RAF对MEK的代偿性再激活5,6,7•阻断RAF和/或MEK可激活FAK-耐药性的关键介质8,9 • Defactinib,一种FAK-抑制剂,可抑制平行通路信号传导10,11,12 •一起,阿伏托替尼加defactinib提供更完整的阻断驱动RAS/MAPK通路依赖性肿瘤生长的信号RAF-MEK复合物抑制FAKAvutometinib和defactinib联合诱导更深的抑制肿瘤生长

10复发性LGSOC对有效和可容忍疗法的高度未满足需求•美国发病率/流行率:1k-2k 1/6k-8k 2 • LGSOC影响年轻女性,诊断峰值在20-30至50-60岁之间出现双峰;不成比例地影响健康、生育,和长期生活质量3,4 • 80-90%的患者将经历复发5 •目前的护理标准提供了低到中等的应答率(6-13%)6,7,8•从诊断开始的总生存期(OS)中位数为~10年9:KRAS-突变-~12年10和KRAS野生型:~7年101。Verastem DOF;2。美国癌症统计。2024年访问;3。Slomovitz Gynecol Oncol 2020;4。Manning-Geist B et al. Clin Cancer Res 2022;28(20):4456-4465;5。巴拜尔2022/p1/para1/ln6,7;6。Gershenson Gynecol Oncol 2022;7。Slomovitz Gynecol Oncol 2020;8。Monk 2020/p3758/table2/footnote-b;9 Banerjee SN)。J Clin Oncol。41.No 16 _ Suppl(June 1,2023)5515-5515;10。Manning-Geist B et al. Clin Cancer Res 2022;28(20):4456-4465;calculated using figures in Gershenson Gynecol Oncol 2022。当你被告知自己复发时,精神负荷很大。你在想,好吧,我第一次治疗要做什么?现在我要重复一遍。而且还会有什么东西可以让我服用一秒钟,或者第三次复发吗?
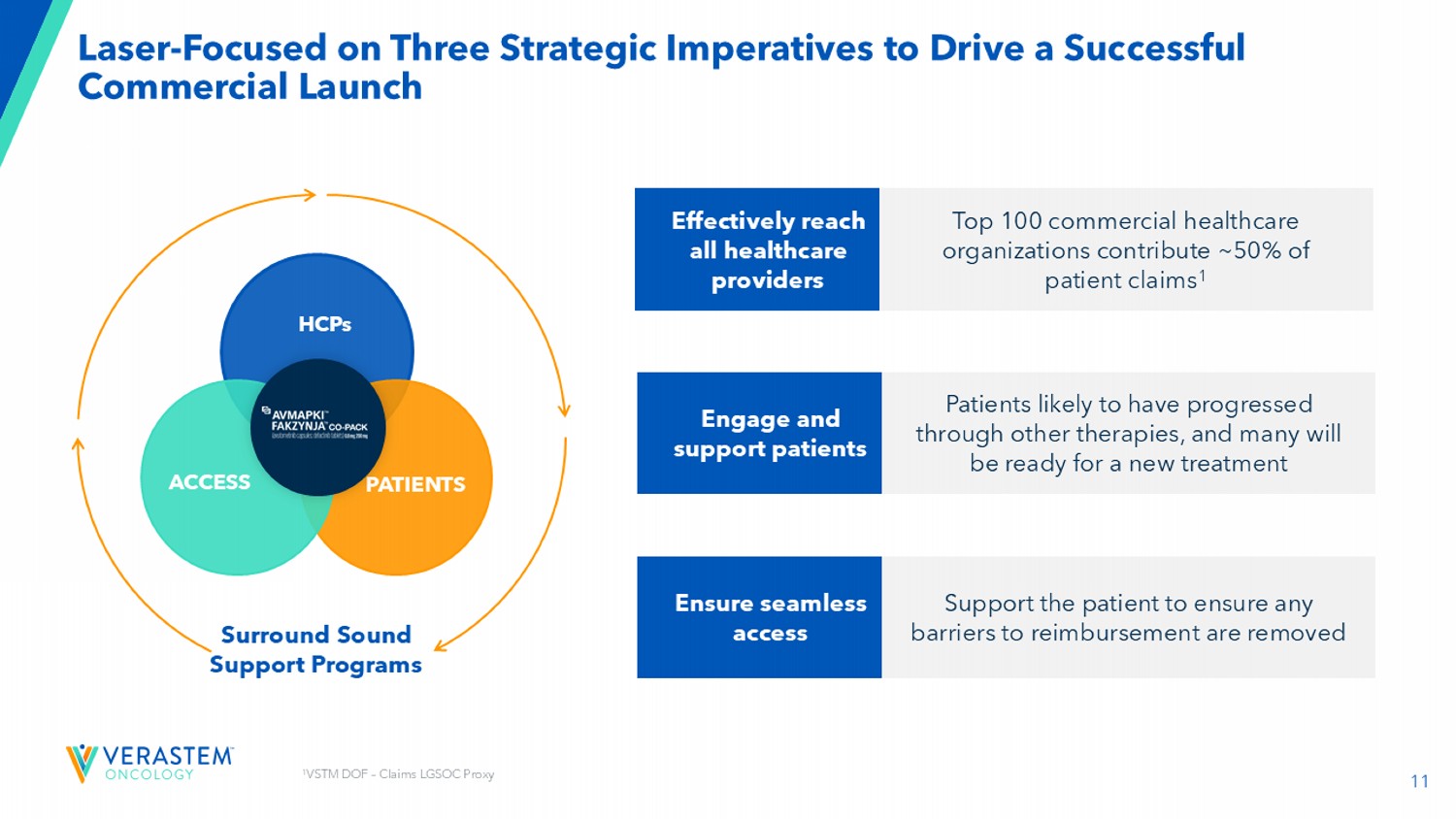
11 Laser-专注于推动成功商业启动的三个战略要务有效覆盖所有医疗保健提供者吸引和支持患者确保无缝访问百强商业医疗保健组织贡献~50%的患者索赔1患者可能已经通过其他疗法取得了进展,许多人将准备好接受新的治疗支持患者以确保消除任何报销障碍环绕声支持计划HCP患者访问1 VSTM DOF –索赔L G SOC Proxy

12令人鼓舞的发布势头加强了推动成功的战略要务在上市的前六周内实现了210万美元的净产品收入首位患者接受了产品:2025年5月22日x首次-专门针对KRAS患者的首次批准治疗-比PDUFA日期提前近两个月的突变复发性LGSOC x紧急、未满足的患者需求和重大的市场机会x经验丰富且充满活力的现场团队x两年的发布准备x高医生热情和参与度x有效的数字环绕声和高网站流量x广泛的付款人教育
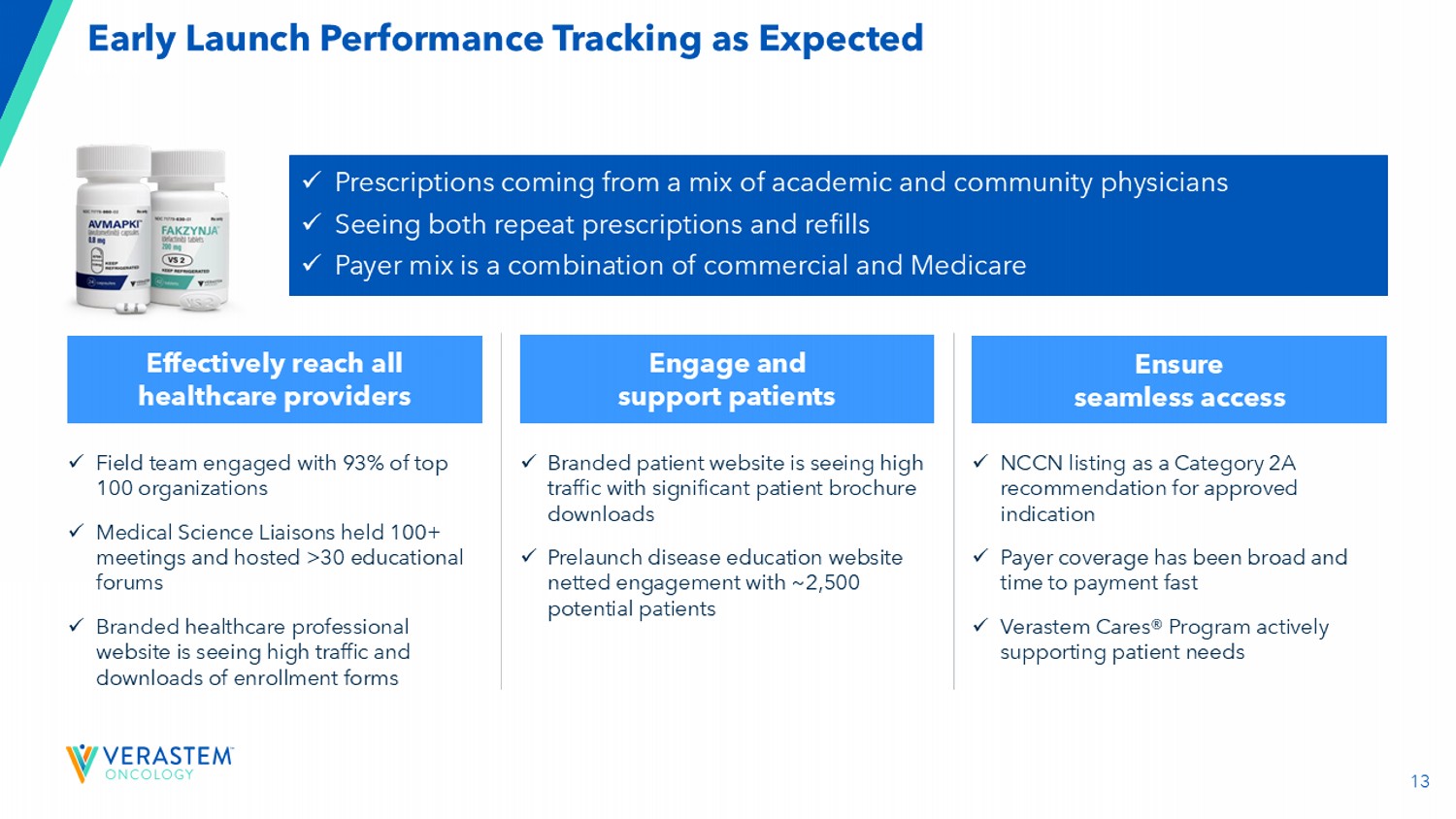
13按预期提前启动绩效跟踪x来自学术和社区医生混合的处方x看到重复处方和补充x付款人组合是商业和医疗保险的结合有效地覆盖所有医疗保健提供者参与和支持患者确保无缝访问x与93%的百强组织合作的现场团队x医学科学联络员举行了100多次会议并主持了> 30场教育论坛x品牌医疗保健专业网站的访问量很高入组表格和下载量x品牌患者网站的访问量很高,患者手册下载量很大x PreLaunch疾病教育网站净参与约2,500名潜在患者x NCCN列为已获批准适应症的2A类推荐x付款人覆盖范围很广,付款时间很快x Verastem关心®方案积极支持患者需求
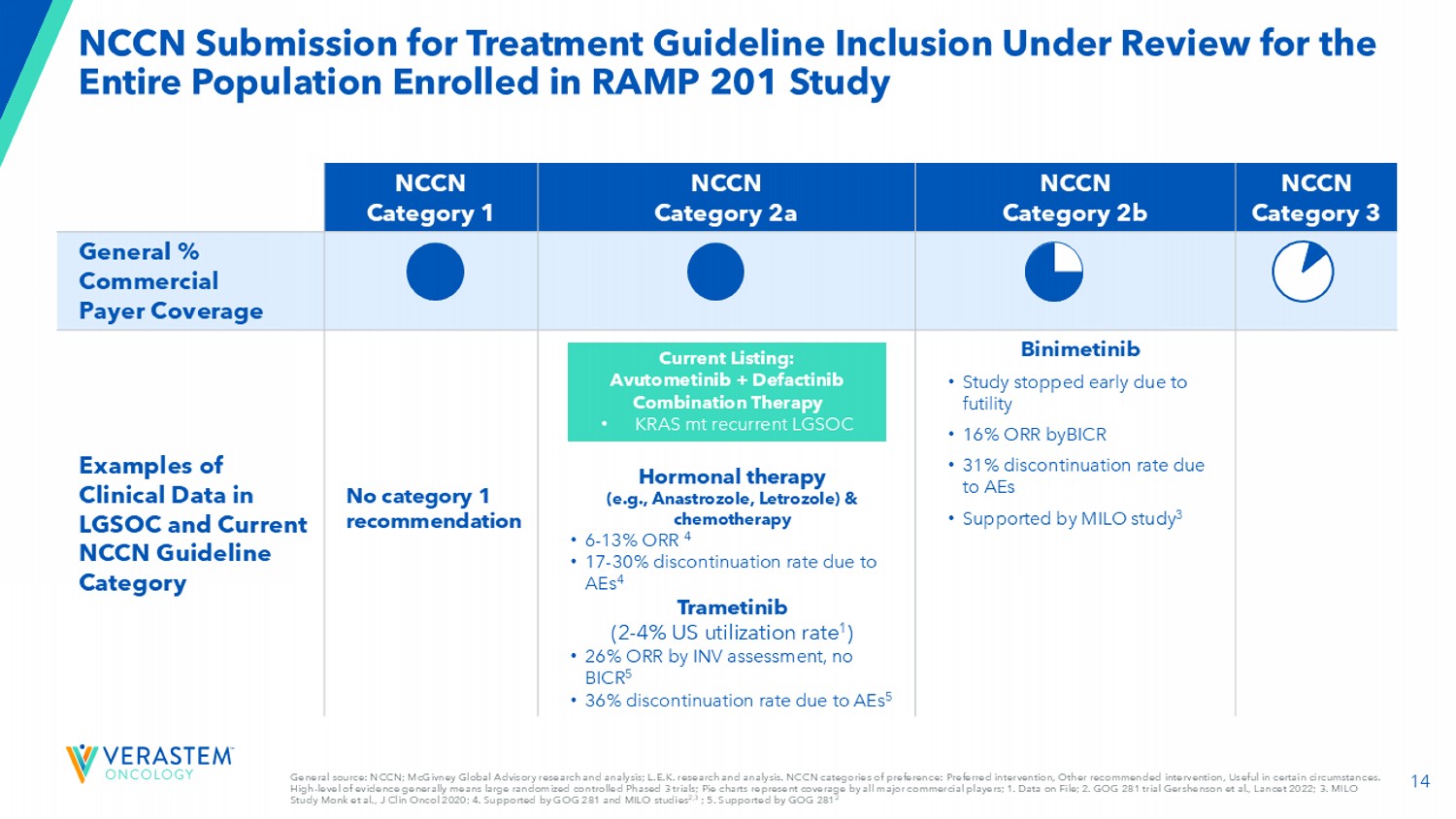
14 NCCN提交治疗指南纳入正在审查中的RAMP 201研究入组的整个人群NCCN第3类NCCN第2b类NCCN第2a类NCCN第1类一般%商业付款人覆盖范围Binimetinib •研究因无效而提前停止• 16% ORR byBICR • 31%停药率因AES •支持MILO研究3激素疗法(例如阿那曲唑、来曲唑)和化疗• 6-13 % ORR 4 • 17-30 %停药率因AES 4曲美替尼(2-4 %美国使用率1)• 26% ORR通过INV评估,无BICR 5 • 36%的停药率因AES 5无1类推荐LGSOC中的临床数据示例和当前的NCCN指南类别一般来源:NCCN;麦吉夫尼全球咨询研究和分析;L.E.K.研究和分析。NCCN类别优选enc e:优选干预,其他推荐干预,特定情况下有用。高水平的证据通常意味着大型随机对照3期试验;饼图代表所有主要c商业参与者的覆盖范围;1。档案上的数据;2。GOG281试验Gershenson等人,Lancet 2022;3。MILO Study Monk et al.,J Clin Oncol 2020;4。支持GOG 281和MILO研究2,3;5。GOG2812支持2当前上市:阿武托替尼+ Defactinib联合疗法• KRAS mT复发性LGSOC

15 LGSOC的持续医疗进展
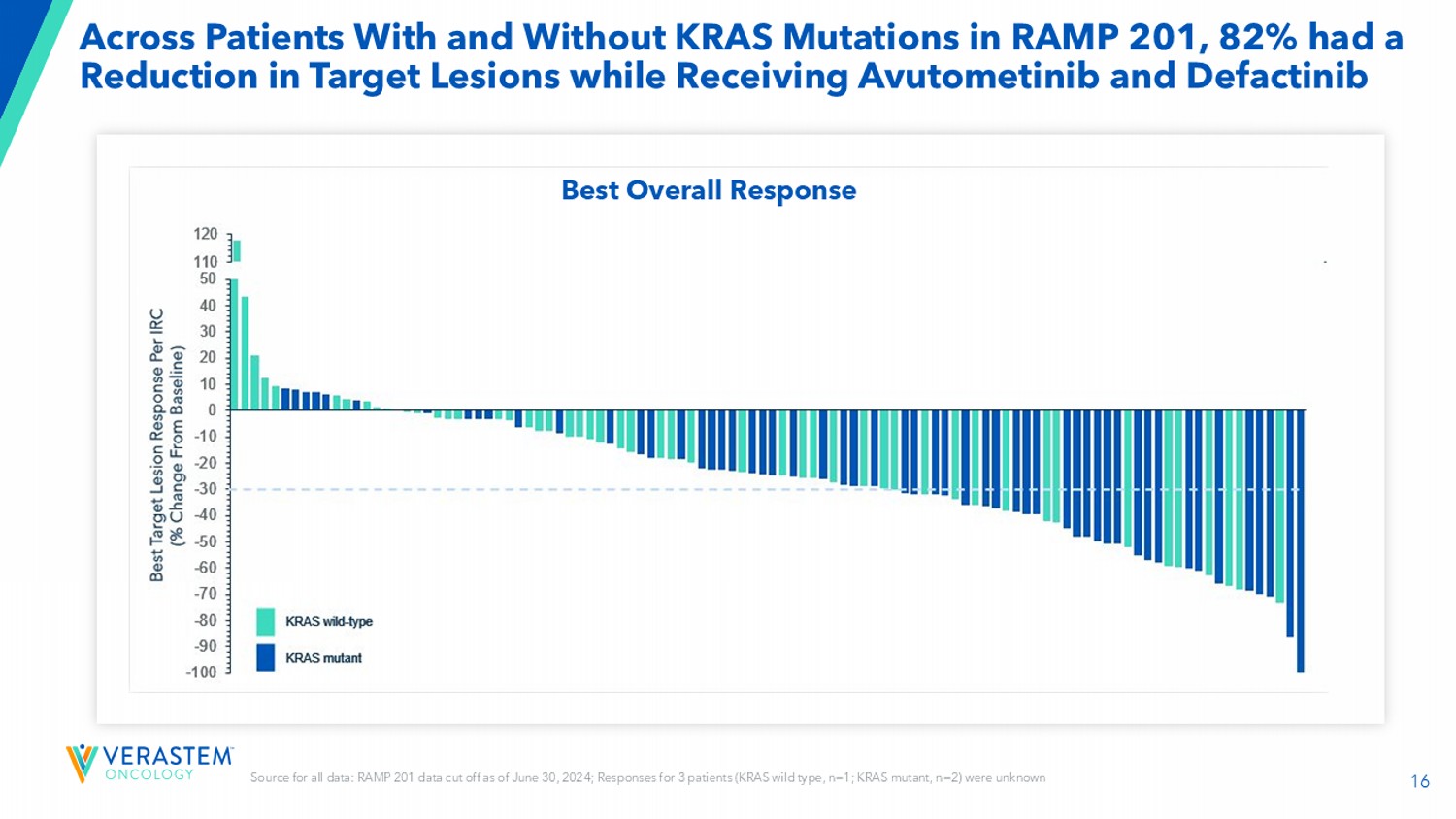
16在RAMP 201中有和没有KRAS突变的患者中,82%的患者在接受Avutometinib和Defactinib时目标病变减少所有数据来源:RAMP 201数据截止至2024年6月30日;3名患者(KRAS野生型,n = 1;KRAS突变体,n = 2)的反应是未知的最佳总体反应
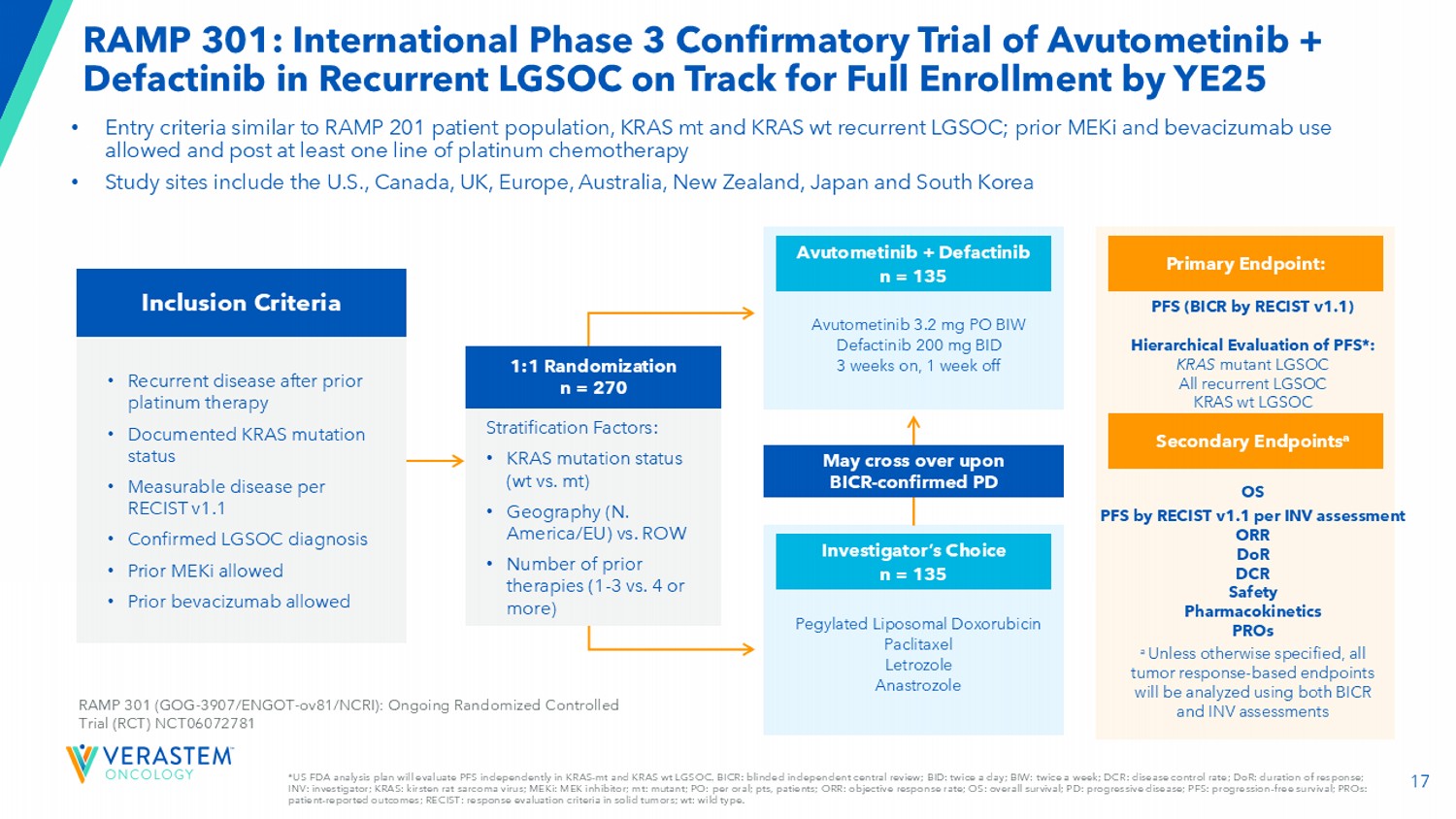
17*美国FDA分析计划将在KRAS-MT和KRAS wT LGSOC中独立评估PFS。BICR:盲法独立中心审评;BID:每天两次;BIW:每周两次;DCR:疾病控制率;DOR:应答持续时间;INV:研究者;KRAS:kirsten大鼠肉瘤病毒;MEKi:MEK抑制剂;MT:突变体;PO:每次口服;pts,患者;ORR:客观缓解率;OS:总生存期;PD:进行性di sease;PFS:无进展生存期;PRO:患者报告的结局;RECIST:实体瘤的应答评估标准;WT:野生型。RAMP 301:Avutometinib + Defactinib在复发性LGSOC中的国际3期确认性试验在YE25前进入全面入组的轨道•进入标准类似于RAMP 201患者群体、KRAS MT和KRAS WT复发性LGSOC;允许先前使用MEKi和贝伐珠单抗并至少在一线铂化疗后•研究地点包括美国、加拿大、英国、欧洲、澳大利亚、新西兰,日本和韩国纳入标准•既往铂类治疗后的复发性疾病•记录的KRAS突变状态•根据RECIST v1.1可测量的疾病•确认LGSOC诊断•允许先前使用MEKI •允许先前使用贝伐珠单抗RAMP 301(GOG-3907/ENGOT-OV81/NCRI):正在进行的随机对照试验(RCT)NCT06072781聚乙二醇脂质体多柔比星紫杉醇来曲唑阿那曲唑研究者的选择n = 135阿伐替尼3.2 mg PO BIW Defactinib 200 mg BID3周后,停用1周阿伐替尼+德法替尼n = 135可能在BICR-确诊的PD PFS(BICR by RECIST V1.1)上发生交叉从而对PFS进行分级评估*:KRAS突变体LGSOC所有复发性LGSOC KRAS WT LGSOC主要终点:OS PFS by RECIST V1.1 per INV评估ORR DOR DCR安全药代动力学PRO次要终点a除非另有说明,所有基于肿瘤反应的终点将使用BICR和INV评估进行分析1:1随机化n = 270个分层因素:• KRAS突变状态(WT vs. MT)•地理(北美/欧盟)vs. ROW •先前治疗的数量(1-3 vs. 4或更多)

18 LGSOC临床计划的下一步报告2025年Q4在日本进行的RAMP 201J 2期临床试验的初始数据2025年底前完成RAMP 301 3期验证性研究的计划入组继续推进日本和欧洲的监管路径2025年Q4公布RAMP 301的IDMC推荐结果

VS-7375,口服KRAS G12D(ON/OFF)抑制剂19
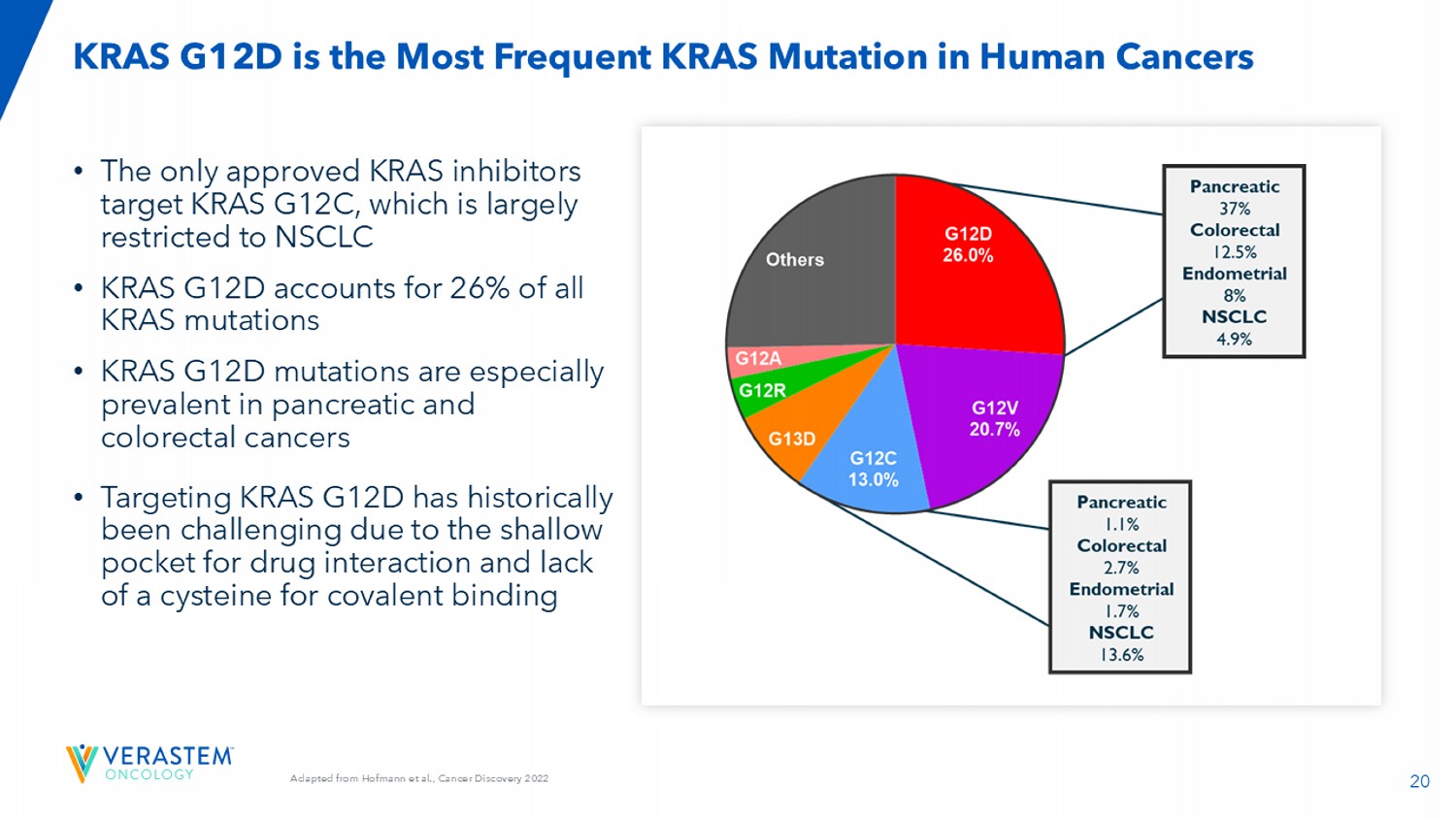
20改编自Hofmann等人,Cancer Discovery 2022 •唯一获批的KRAS抑制剂靶向KRAS G12C,主要局限于NSCLC • KRAS G12D占所有KRAS突变的26% • KRAS G12D突变在胰腺癌和结直肠癌中尤其普遍•靶向KRAS G12D历来具有挑战性,因为药物相互作用的口袋较浅,且缺乏用于共价结合的半胱氨酸KRAS G12D是人类癌症中最常见的KRAS突变
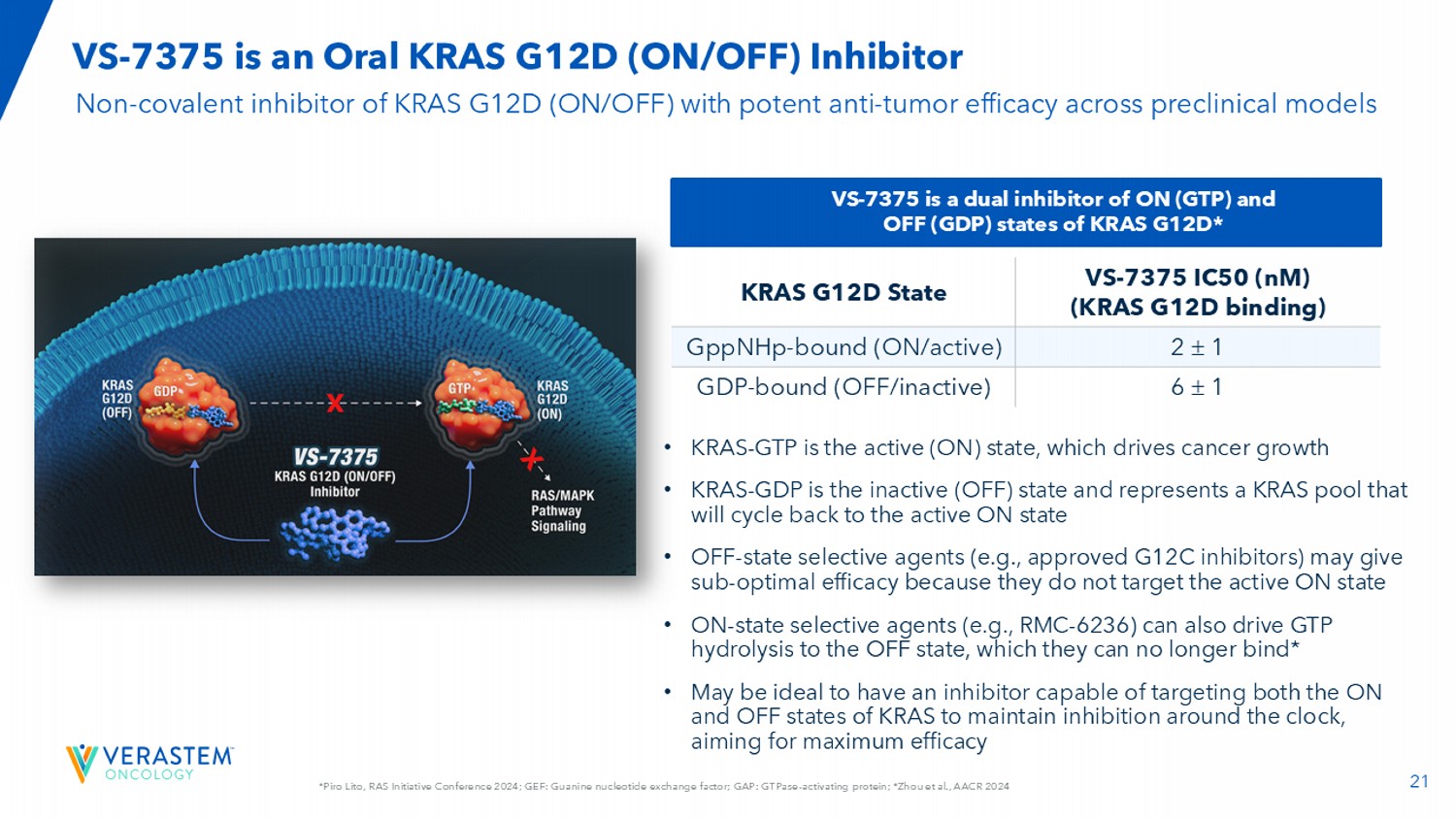
21*Piro Lito,RAS Initiative Conference 2024;GEF:鸟嘌呤核苷酸交换因子;GAP:GTP酶-激活蛋白;*周等人,AACR 2024 VS-7375是一种口服KRAS G12D(ON/OFF)抑制剂VS-7375 IC50(NM)(KRAS G12D结合)KRAS G12D状态21 GPPNHp结合(ON/活性)61 GDP结合(OFF/非活性)VS-7375是KRAS G12D的ON(GTP)和OFF(GDP)状态的双重抑制剂*KRAS G12D(ON/OFF)的非共价抑制剂,跨临床前模型具有有效的抗肿瘤功效• KRAS-GTP为活性(ON)状态,推动癌症增长• KRAS-GDP是非活性(OFF)状态,代表一个KRAS池,它将循环回到活性的ON状态• OFF状态选择剂(例如,已批准的G12C抑制剂)可能会产生次优的疗效,因为它们不针对活性的ON状态• ON状态选择剂(例如,RMC-6236)也可以驱动GTP水解到OFF状态,他们不能再绑定了*•可能理想的是拥有一种能够同时针对KRAS的ON和OFF状态的抑制剂,以全天候保持抑制,以最大的功效为目标
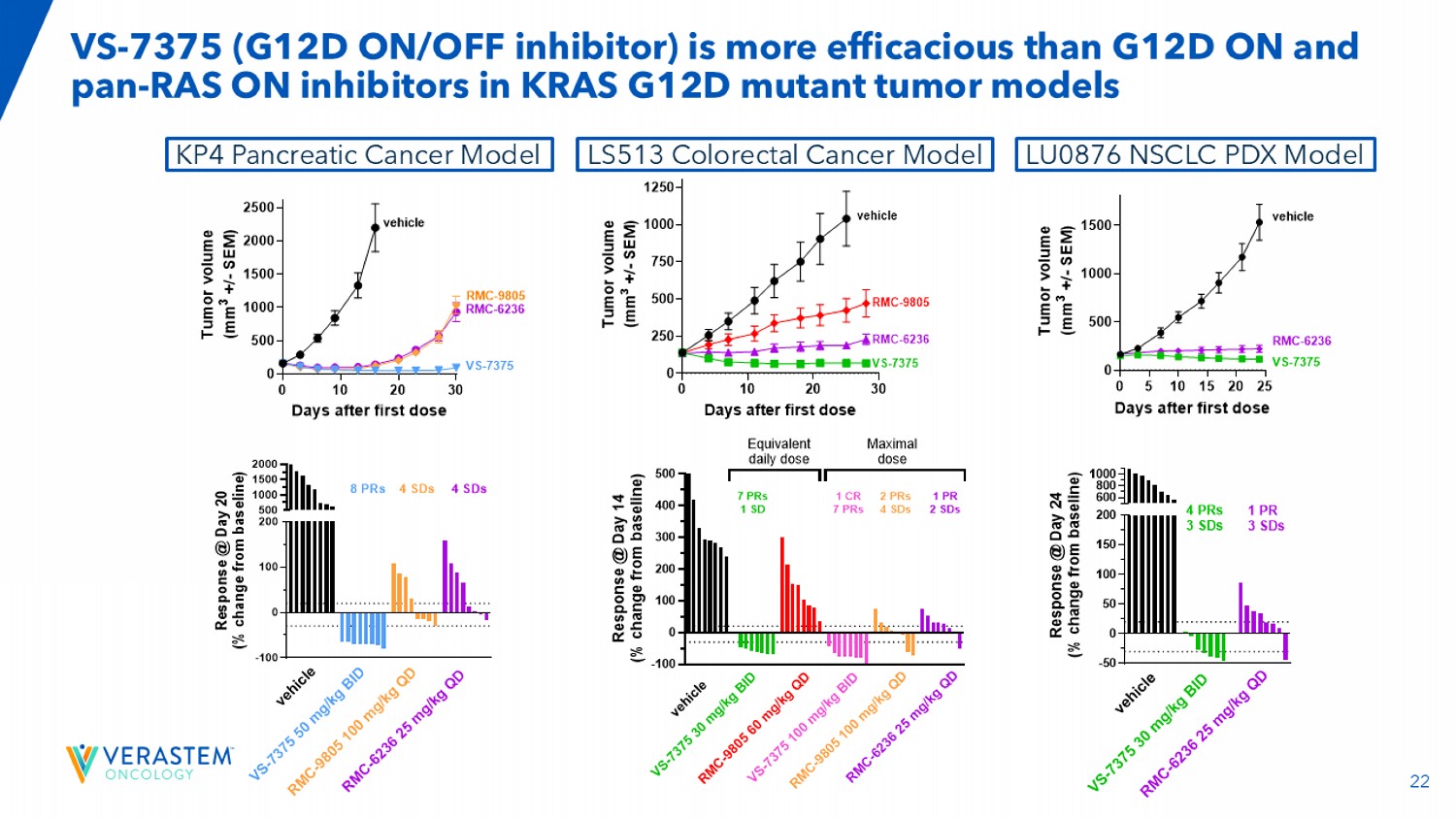
22 VS-7375(G12D ON/OFF抑制剂)比G12D ON更有效KRAS G12D突变肿瘤模型KP4胰腺癌模型LU0876 NSCLC PDX模型中的PAN-RAS ON抑制剂-100 0100200500100015002000 R e s p o n s e @ d a y 20(% c h a n g e f r o m b a s e l i n e)v e h i c l e r m c-9805100 m g/k g Q D V s-737550 m g/k g b i d 4 SDs r m c-623625 m g/k g q d 8 PRs 4 SDs 010203005001000150020002500天首次给药后T u m o r v o l u m e(m m 3 +/-s e m)车辆VS-7375 50mg/kg BID RMC-9805 100mg/kg QD RMC-6236 25mg/kg 丨QD车辆RMC-9805 RMC-6236 VS-7375-100 0100200300400500 R e s p o n s e @ d a y 14(% c h a n g e f r o m b a s e l i n e)v e h i c l e r m c-9805100 m g/k g q d v s-737530 m g/k g b i d 7 PRs 1 sd r m c-623625 m g/k g q d 1 pr 2 sd 2 PRs 4 sd r m c-980560 m g/k g q d v s-7375100 m g/k g b i d 1 CR7 PRs等效日剂量最大剂量0102030025050075010001250天后首次给药T u m o r v o l u m e(m m 3 +/-s e m)载体RMC-9805 RMC-6236 VS-7375载体VS-7375 30mg/kg BID po RMC-9805 60mg/kg QD po RMC-6236 25mg/kg QD po LS513结直肠癌模型
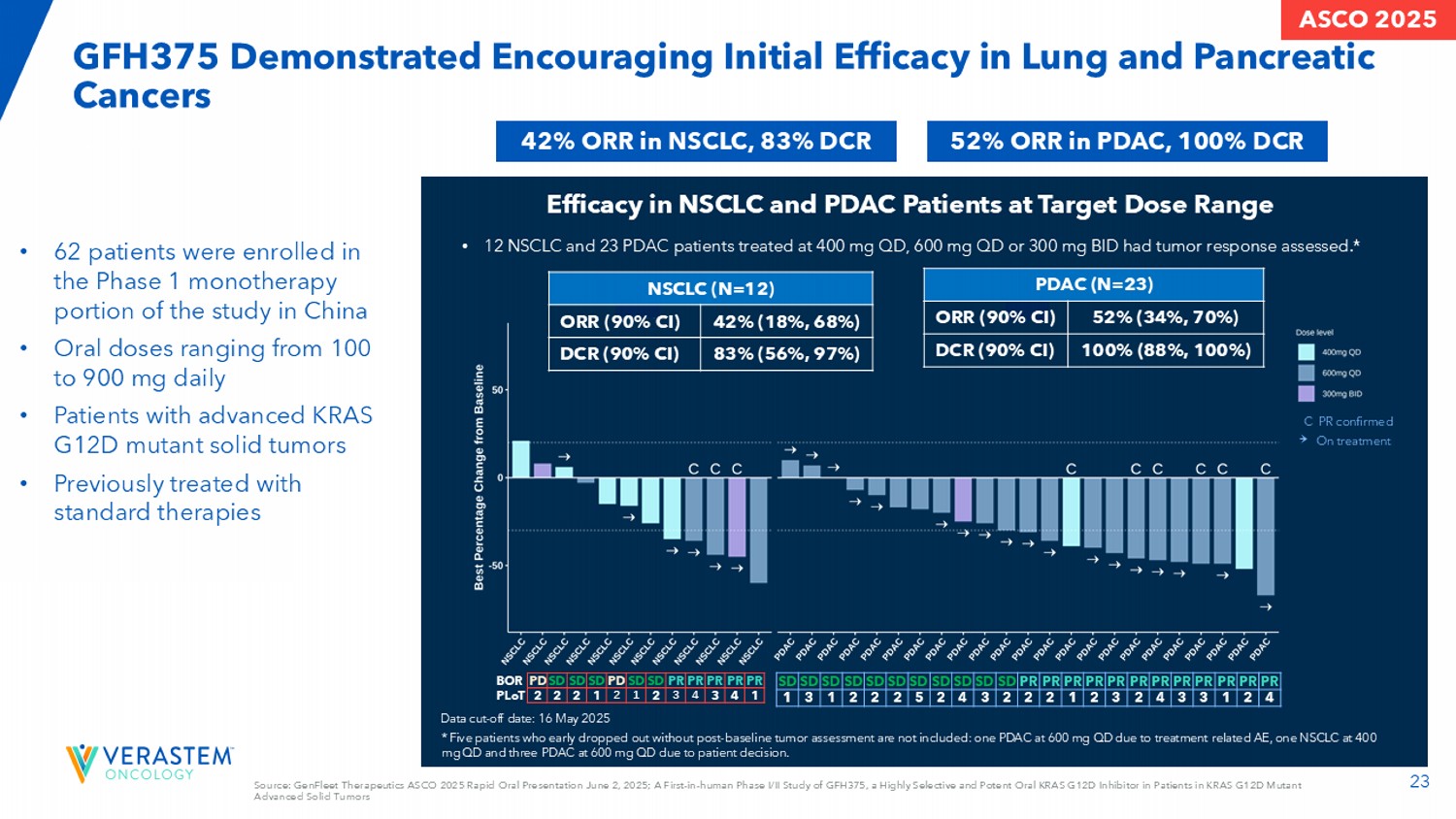
23 GFH375在肺癌和胰腺癌中显示出令人鼓舞的初步疗效来源:GenFleet Therapeutics ASCO 2025快速口头报告2025年6月2日;GFH375的首次人体I/II期研究,GFH375是一种在KRAS G12D突变晚期实体瘤患者中的高选择性和d强效口服KRAS G12D抑制剂,PDAC中的ORR为52%,NSCLC中的ORR为100% DCR为42%,83% DCR • 62名患者在中国研究的1期单药治疗部分入组•每日口服剂量范围为100-900mg •晚期KRAS G12D突变实体瘤患者•既往接受标准疗法治疗的C PR确认治疗NSCLC(N = 12)42%(18%,68%)ORR(90% CI)83%(56%,97%)DCR(90% CI)PDAC(N = 23)52%(34%,70%)ORR(90% CI)100%(88%,100%)DCR(90% CI)PR PR PR PR PR PR PR SD PD SD SD PD PD BOR14343212222 PLOT PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR PR SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD S*提前退学的5名患者未纳入基线后肿瘤评估的不包括:1例600mg QD的PDAC是由于治疗相关AEE,1例NSCLC是400mg QD,3例是600mg QD的PDAC是由于患者的决定。在靶向剂量范围的NSCLC和PDAC患者中的疗效• 12名NSCLC和23名PDAC患者在400mg QD、600mg QD或300mg BID治疗时评估了肿瘤反应。*ASCO 2025
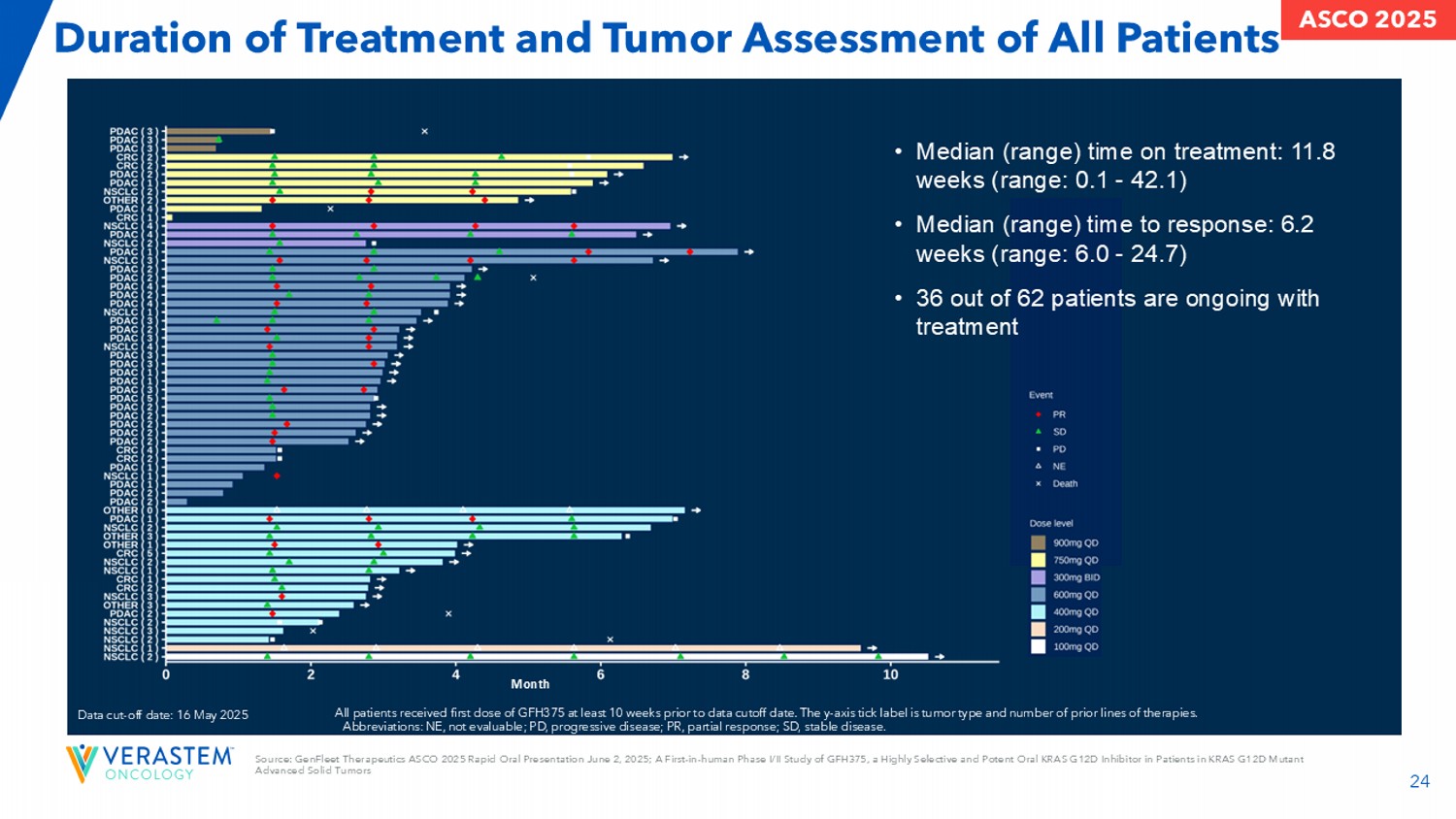
24所有患者的治疗持续时间和肿瘤评估月数据截止日期:2025年5月16日所有患者至少在数据截止日期前10周接受第一剂GFH375。y轴蜱标记为肿瘤类型和先前治疗的线数。简称:NE,不可评估;PD,进行性疾病;PR,p动脉应答;SD,病情稳定。•中位(范围)治疗时间:11.8周(范围:0.1-42.1)•中位(范围)反应时间:6.2周(范围:6.0-24.7)• 62名患者中有36名正在接受治疗来源:GenFleet Therapeutics ASCO 2025快速口头介绍2025年6月2日;GFH375的首次人体I/II期研究,GFH375是一种在KRAS G12D突变晚期实体瘤ASCO 2025患者中的高度选择性d强效口服KRAS G12D抑制剂
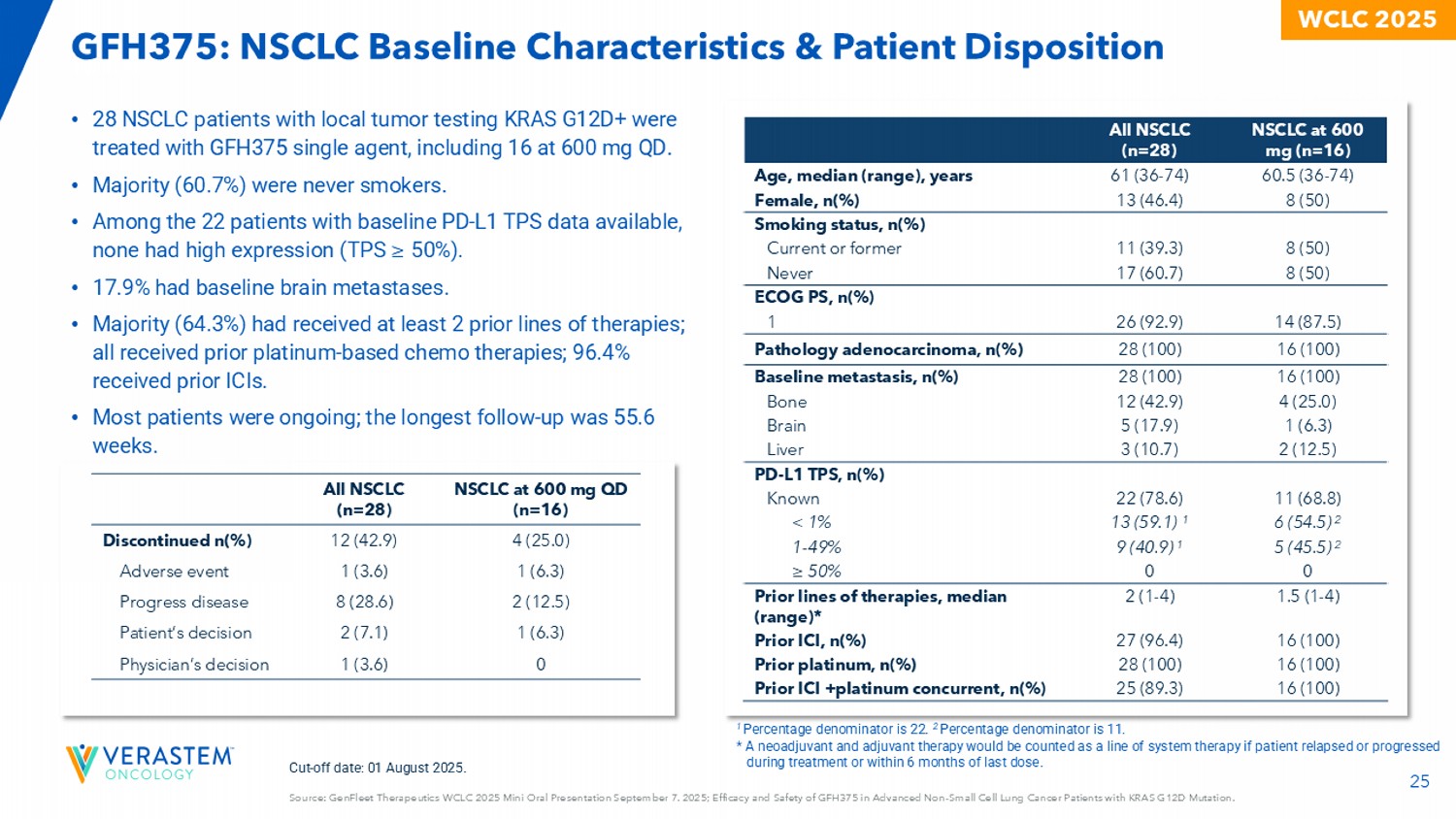
25来源:GenFleet Therapeutics WCLC 2025迷你口头报告9月7日。2025;GFH375在KRAS G12D突变的晚期N对小细胞肺癌患者中的疗效和安全性。WCLC 2025截标日期:2025年8月1日。NSCLC at 600mg QD(n = 16)所有NSCLC(n = 28)4(25.0)12(42.9)停用n(%)1(6.3)1(3.6)不良事件2(12.5)8(28.6)进展疾病1(6.3)2(7.1)患者决定01(3.6)医师决定• 28例NSCLC患者局部肿瘤检测KRAS G12D +采用GFH375单药治疗,其中16例600mg QD。丨•大多数人(60.7%)从不吸烟。•在有基线PD-L1 TPS数据可得的22例患者中,无一例高表达(TPS ≥ 50%)。• 17.9%有基线脑转移。•大多数人(64.3%)曾接受过至少2种既往治疗;所有人都曾接受过铂类化疗;96.4%曾接受过ICI。•大多数患者正在进行中;最长随访时间为55.6周。NSCLC at 600mg(n = 16)All NSCLC(n = 28)60.5(36-74)61(36-74)Age,median(range),years 8(50)13(46.4)female,n(%)smoking status,n(%)8(50)11(39.3)current or former 8(50)17(60.7)never ECOG PS,n(%)14(87.5)26(92.9)116(100)28(100)病理腺癌,n(%)16(100)28(100)基线转移,n(%)4(25.0)12(42.9)bone 1(6.3)5(17.9)brain 2(12.5)3(10.7)liver PD-L1 TPS,n(%)11(68.8)22(78.6)已知6(54.5)213(59.1)1 < 1% 5(45.5)29(40.9)11-49% 00 ≥ 50% 1.5(1-4)2(1-4)既往治疗线,中位数(范围)*16(100)27(96.4)前ICI,n(%)16(100)28(100)前铂,n(%)16(100)25(89.3)前ICI +铂并发,n(%)1个百分比分母为22。2个百分比分母为11。*如果患者在治疗期间或最后一次给药后6个月内出现复发或进展,新辅助和辅助治疗将被算作系统治疗的一条线。GFH375:NSCLC基线特征&患者倾向
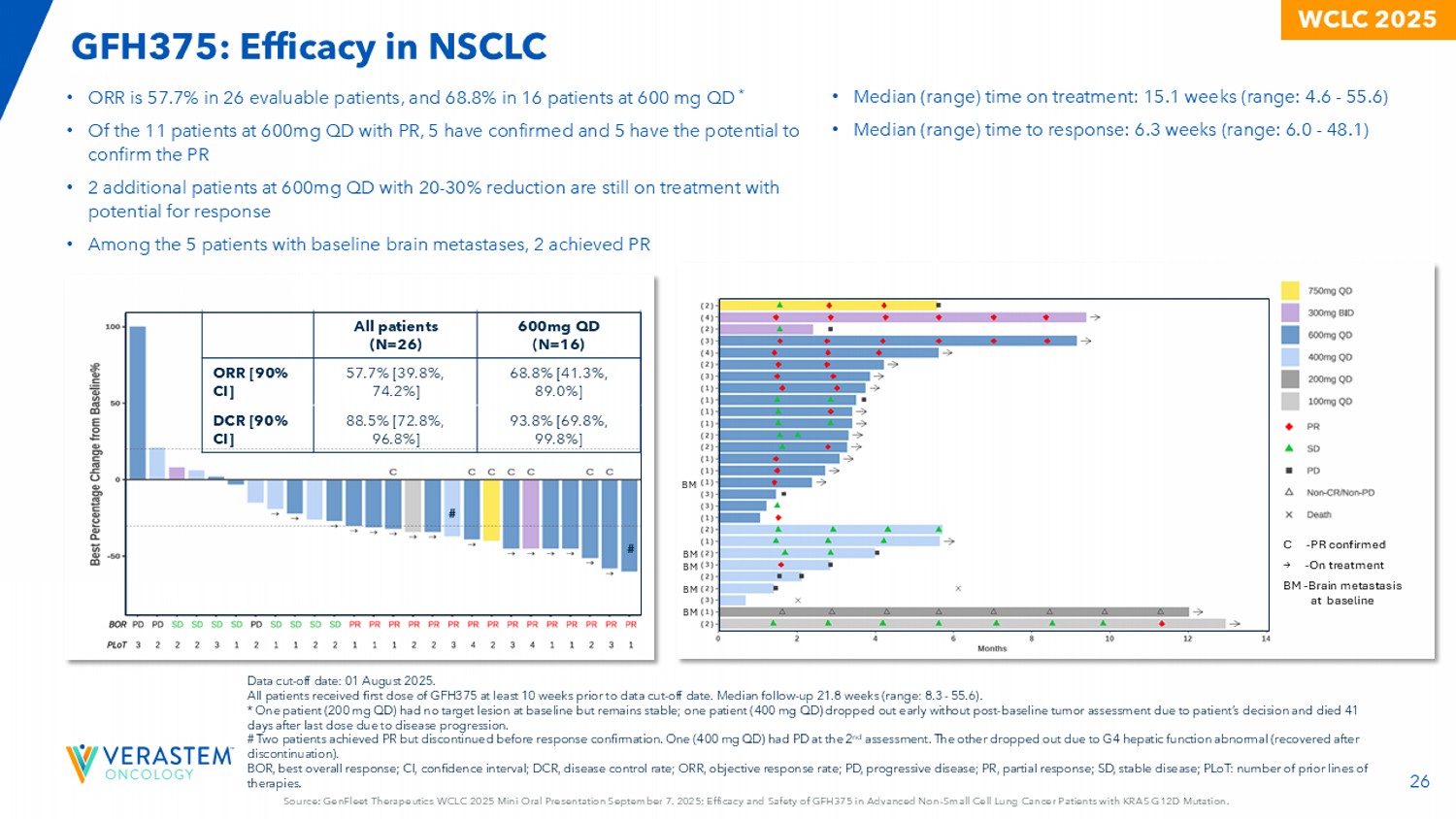
26来源:GenFleet Therapeutics WCLC 2025迷你口头报告9月7日。2025;GFH375在KRAS G12D突变的晚期N对小细胞肺癌患者中的疗效和安全性。WCLC2025 600mg QD(N = 16)所有患者(N = 26)68.8% [ 41.3%,89.0% ] 57.7% [ 39.8%,74.2% ] ORR [ 90% CI ] 93.8% [ 69.8%,99.8% ] 88.5% [ 72.8%,96.8% ] DCR [ 90% CI ] • ORR在26名可评估患者中为57.7%,在600 mg QD时为68.8%*•在11例600mg QD PR患者中,5例已确诊,5例有可能确认PR •另有2例600mg QD且降低20-30 %的患者仍在接受治疗,可能有反应•在5例基线脑转移患者中,2例达到PR # # •中位(范围)治疗时间:15.1周(范围:4.6-55.6)•中位(范围)反应时间:6.3周(范围:6.0-48.1)C-PR确诊→-治疗BM-基线BM BM BM BM时脑转移数据截止日期:2025年8月1日。所有患者至少在数据截止日期前10周接受第一剂GFH375。中位随访-随访21.8周(范围:8.3-55.6)。*1名患者(200mg QD)在基线时无目标病变但保持稳定;1名患者(400mg QD)因患者决定未进行基线后肿瘤评估而提前退出,并因疾病进展在最后一次给药后41天后死亡。#两名患者实现PR,但在反应确认前停用。1例(400mg QD)在第2次评估时发生PD。另一例因G4肝功能异常退出(停药后康复)。BOR,最佳总应答;CI,置信区间;DCR,疾病控制率;ORR,客观应答率;PD,进行性di sease;PR,部分应答;SD,疾病稳定;PLOT:既往治疗线数。GFH375:在NSCLC中的疗效
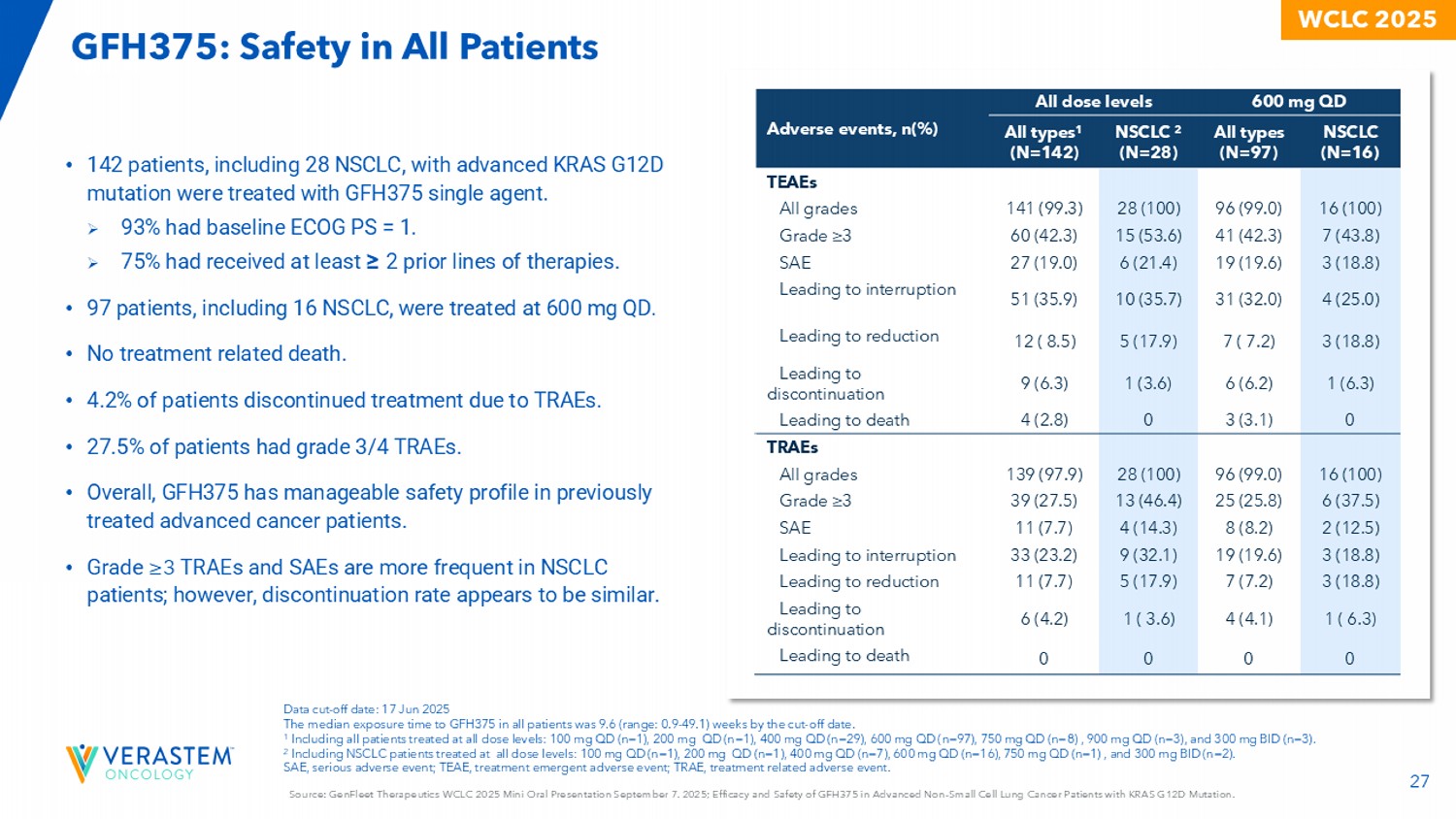
27 WCLC 2025 GFH375:所有患者的安全性来源:GenFleet Therapeutics WCLC 2025迷你口头报告9月7日。2025;GFH375在KRAS G12D突变的晚期N对小细胞肺癌患者中的疗效和安全性。•采用GFH375单药治疗晚期KRAS G12D突变的142例NSCLC患者,其中28例。» 93%的基线ECOG PS = 1。» 75%的人至少接受过≥ 2个既往线的治疗。• 97例患者,其中NSCLC 16例,接受600mg QD治疗。•无治疗相关死亡。• 4.2%的患者因TRAE停止治疗。• 27.5%的患者有3/4级TRAE。•总体而言,GFH375在既往接受过治疗的晚期癌症患者中具有可控的安全性。• ≥ 3级TRAE和SAE在NSCLC患者中更常见;然而,停药率似乎相似。600mg QD所有剂量水平的不良事件,n(%)NSCLC(N = 16)所有类型(N = 97)NSCLC 2(N = 28)所有类型1(N = 142)TEAEs 16(100)96(99.0)28(100)141(99.3)所有等级7(43.8)41(42.3)15(53.6)60(42.3)等级≥ 33(18.8)19(19.6)6(21.4)27(19.0)SAE 4(25.0)31(32.0)10(35.7)51(35.9)导致中断3(18.8)7(7.2)5(17.9)12(8.5)导致减少1(6.3)6(6.2)1(3.6)9(6.3)导致停药03(3.1)04(2.8)导致死亡TRAEs 16(100)96(99.0)28(37.5)25(25.8)13(46.4)39(27.5)级≥ 32(12.5)8(8.2)4(14.3)11(7.7)SAE 3(18.8)19(19.6)9(32.1)33(23.2)导致中断3(18.8)7(7.2)5(17.9)11(7.7)导致减少1(6.3)4(4.1)1(3.6)6(4.2)导致停药0000导致死亡数据c截止日期:2025年6月17日截止日期,所有患者对GFH375的中位暴露时间为9.6(范围:0.9-49.1)周。1包括在所有剂量水平下接受治疗的所有患者:100mg QD(n = 1),200mg QD(n = 1),400mg QD(n = 29),600mg QD(n = 97),750m g QD(n = 8),900mg QD(n = 3),300mg BID(n = 3)。2包括所有剂量水平治疗的NSCLC患者:100mg QD(n = 1)、200mg QD(n = 1)、400mg QD(n = 7)、600mg QD(n = 16)、750mg QD(n = 1)、300mg BID(n = 2)。SAE,严重不良事件;TEAEE,治疗紧急不良事件;TRAE,治疗相关不良事件。

28 WCLC 2025来源:GenFleet Therapeutics WCLC 2025迷你口头报告9月7日。2025;GFH375在KRAS G12D突变的晚期N对小细胞肺癌患者中的疗效和安全性。GFH375:所有患者的安全性•未观察到新的安全信号。•最常见的TRAE是胃肠道AEs(腹泻、呕吐和恶心)和血液学AEs(贫血和中性粒细胞减少),主要为1/2级,可通过支持性药物控制。•最常见的G3/4TRAEs为中性粒细胞减少症(6.3%)和贫血(4.2%)。• NSCLC患者中多发AEs的发生率更高,这可能是由于之前使用过ICI。» 96.4%的NSCLC患者在GFH375治疗前接受过ICI。从最后一次ICI给药到首次给药GFH375的中位时间为2.8个月(范围:1.0-40.0);ICI治疗的中位时间为4.3个月(范围:0.7– 26.5)。0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100%最常见的TRAE(≥ 10%的所有患者)1级2级3级4级5级ALT,丙氨酸转氨酶;AST,天冬氨酸转移酶;TRAE,治疗相关不良事件;白细胞,白细胞。左栏:所有患者(N = 142)右栏:NSCLC(N = 28)
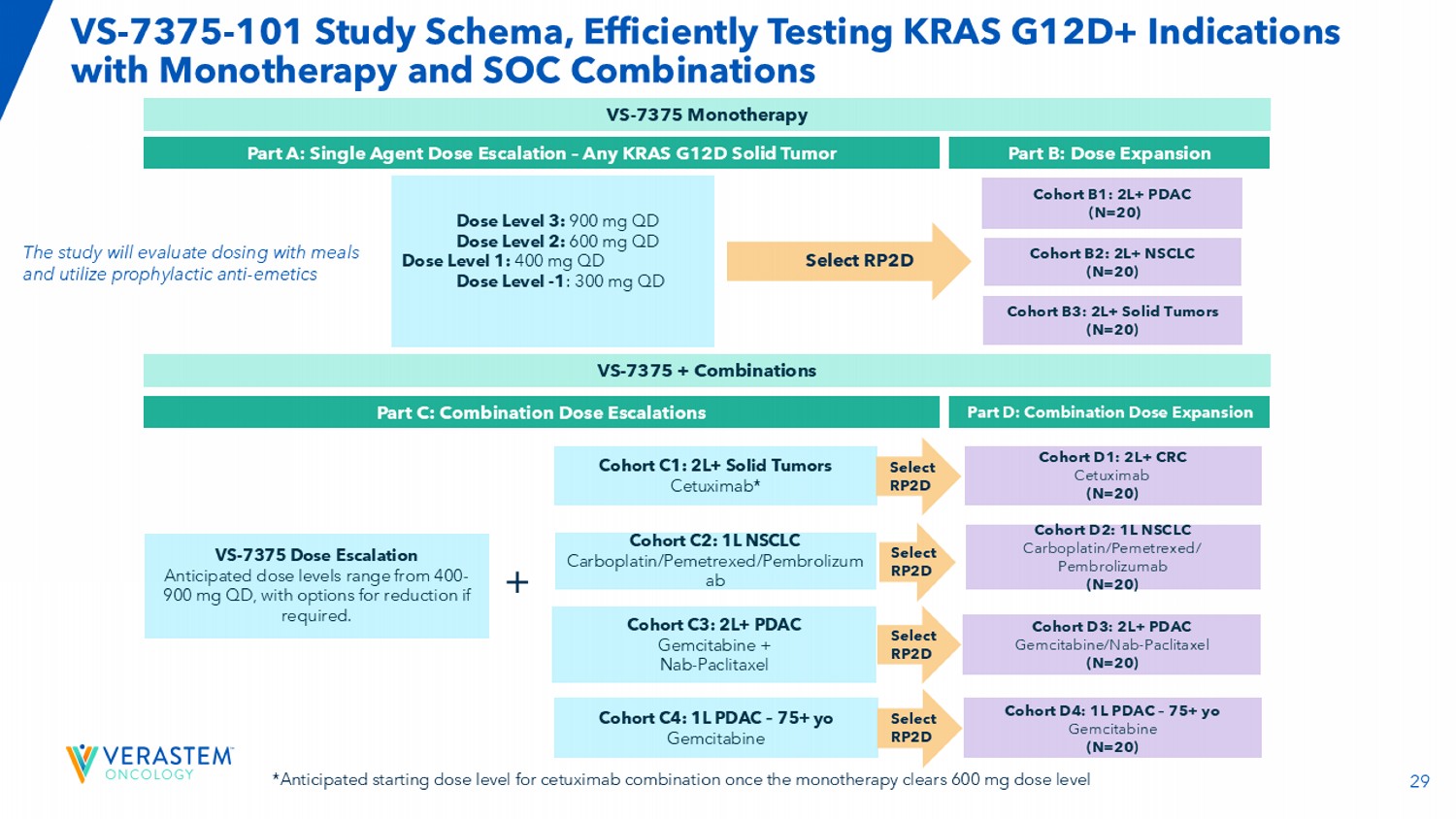
29 VS-7375-101学习图式,单一疗法高效检测KRAS G12D +适应症和SOC组合第A部分:单药剂量递增–任意KRAS G12D实体瘤队列B1:2L + PDAC(N = 20)队列D1:2L + CRC西妥昔单抗(N = 20)VS-7375 +组合第B部分:剂量扩展第C部分:联合剂量递增第D部分:联合剂量扩展剂量第3级:900mg QD剂量第2级:600mg QD剂量第1级:400mg QD剂量水平-1:300mg QD队列B2:2L + NSCLC(N = 20)队列B3:2L +实体瘤(N = 20)VS-7375剂量递增如有需要,可选择减持。+队列C1:2L +实体瘤西妥昔单抗*队列D2:1L NSCLC卡铂/培美曲塞/pembrolizumab(N = 20)选择RPTD选择RPTD队列C3:2L + PDAC吉西他滨+ NAB-紫杉醇队列D3:2L + PDAC吉西他滨/NAB-紫杉醇(N = 20)选择RPTD选择RPTD队列C4:1L PDAC – 75 + yo吉西他滨队列D4:1L PDAC – 75 + yo吉西他滨(N = 20)选择RPTD队列C2:1L NSCLC卡铂/培美曲塞/pembrolizum ab该研究将评估随餐给药并利用预防性止吐药*一旦单一疗法清除600mg剂量水平VS-7375单一疗法,西妥昔单抗联合用药的预期起始剂量水平

30 •有效的起始剂量:• 400毫克起始剂量在FIH研究中得到单一疗法疗效/安全性的支持•评估GI副作用缓解:•使用预防性止吐药•评估有食物和没有食物的剂量•评估额外的配方•多个、高价值的适应症策略:• PDAC和NSCLC中的单一疗法扩展队列•与西妥昔单抗联合队列治疗CRC,化疗治疗PDAC,化疗加I-O治疗NSCLC •扩展到美国以外的地区加速开发方法建立在初步的首次人体研究结果之上评估单一疗法和组合的多臂临床研究FDA参与计划•授予快速通道指定:• KRAS G12D局部晚期或转移性PDAC患者的一线治疗和• KRAS G12D局部晚期或mPDAC患者在2025年7月至少接受过一种既往标准系统疗法线•计划寻求突破性疗法指定•在FDA投入下加速临床开发

31 VS的下一步-7375临床计划预计将在2025年第四季度报告1期单药治疗剂量递增的初步更新。以1期单药治疗剂量递增结果为准,在PDAC、NSCLC和其他实体瘤中启动单药治疗扩展队列。分别于2025年Q4启动与西妥昔单抗、化疗、化疗联合检查点抑制剂治疗CRC、PDAC、NSCLC的剂量递增队列。以VS-7375的联合剂量递增队列结果为准,在CRC、PDAC和NSCLC中启动联合扩大队列。

RAMP 205的顶线数据:阿武托替尼+德法替尼+一线转移性胰腺癌的护理标准
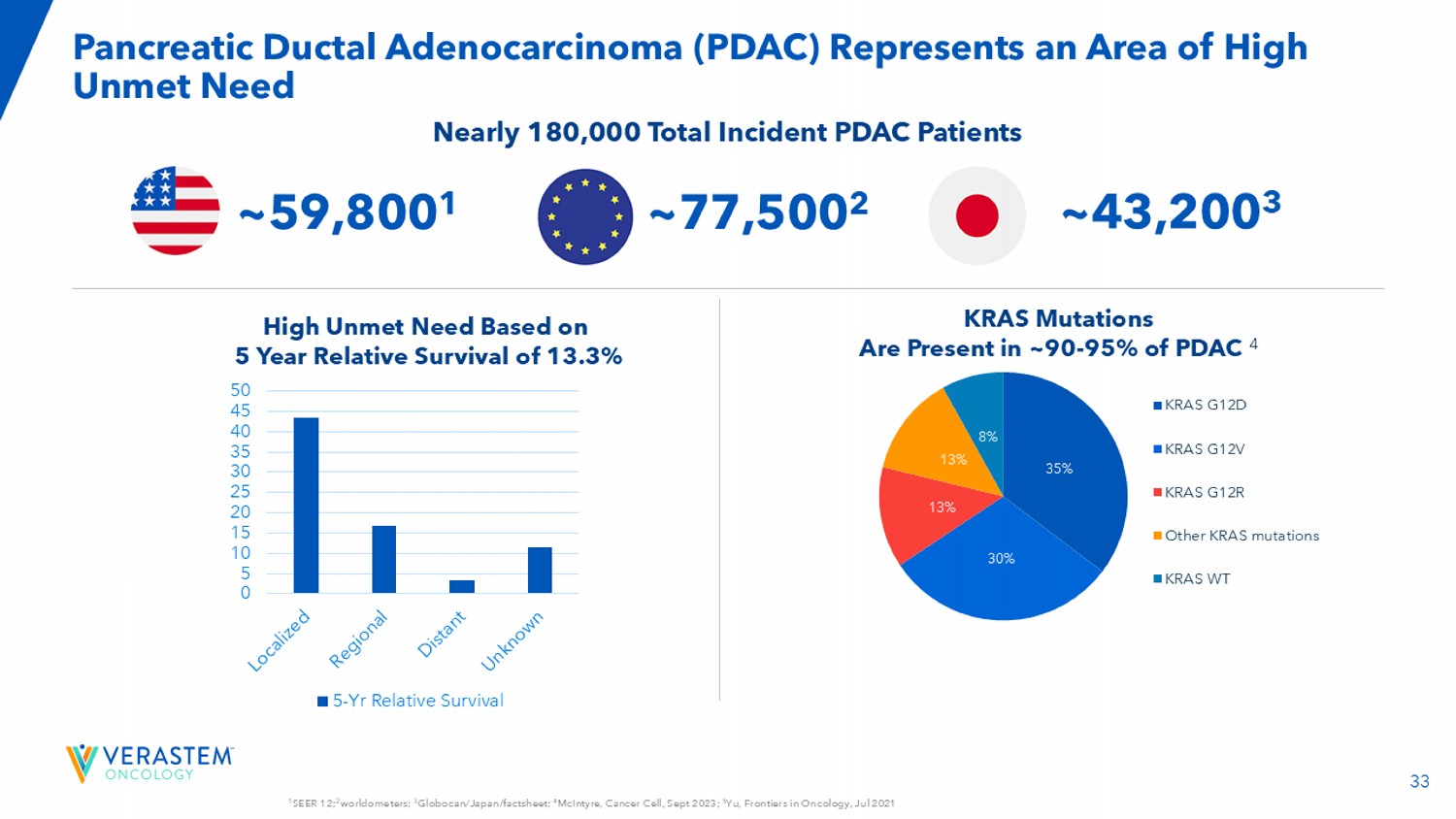
331个SEER 12;2个世界计;3个Globocan/Japan/factsheet;4个McIntyre,Cancer Cell,2023年9月;5个Yu,Frontiers in Oncology,2021年7月胰腺导管腺癌(PDAC)代表了一个高未满足需求的领域05 101520253035404550个5年相对生存期KRAS突变存在于~90-95 %的PDAC 4个基于13.3%的5年相对生存期的高未满足需求近180,000名总事件PDAC患者35% 30% 13% 13% 8% KRAS G12D KRAS G12V KRAS G12R其他KRAS突变KRAS WT-59,8001~43,2003~77,5002
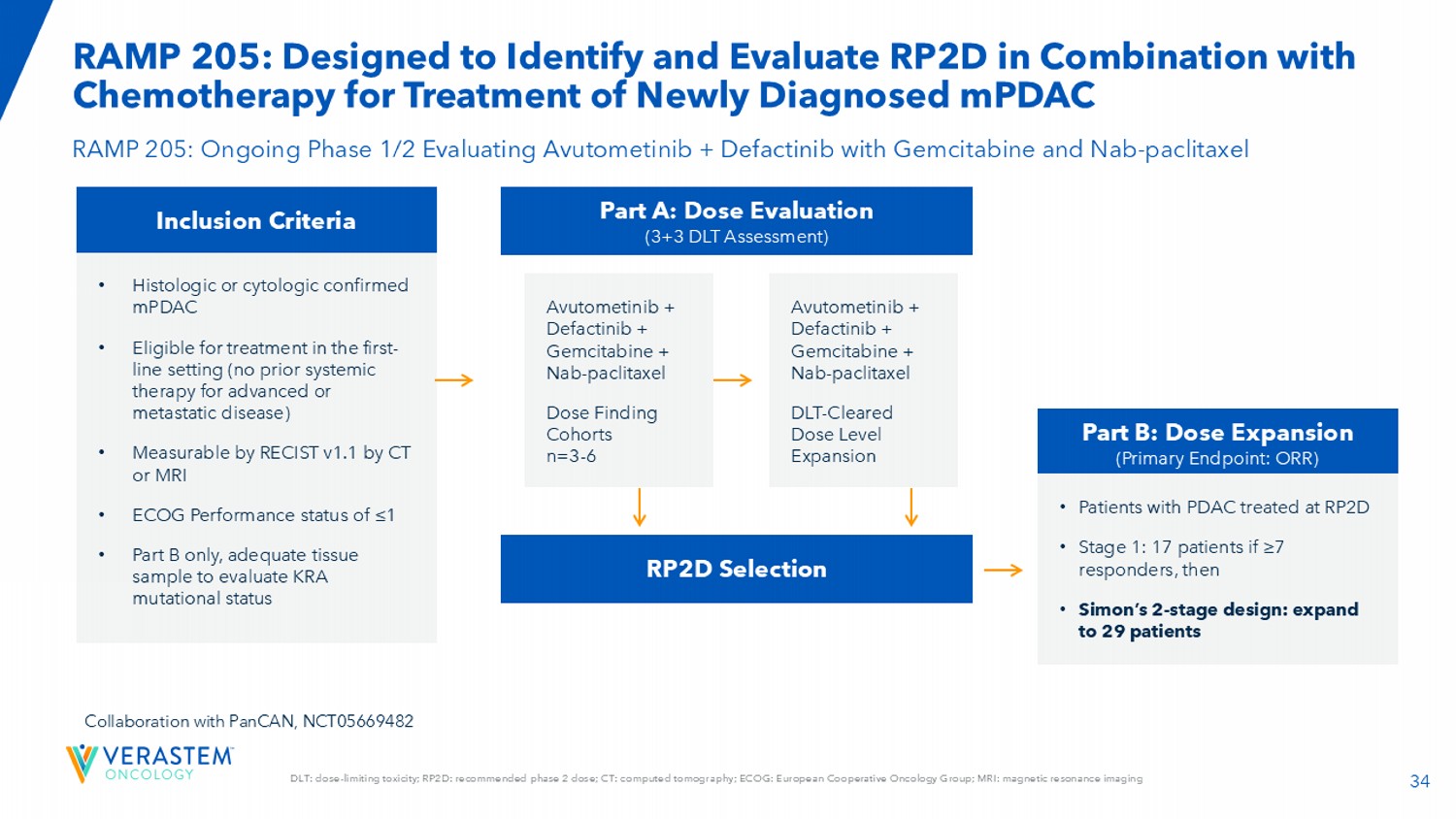
34 DLT:剂量限制性毒性;RPTD:推荐的2期剂量;CT:计算机断层扫描;ECOG:欧洲合作肿瘤学小组;MRI:磁共振成像RAMP 205:旨在识别和评估RPTD联合化疗治疗新诊断的mPDAC RAMP 205:正在进行的1/2期评估阿伏托替尼+ Defactinib联合吉西他滨和NAB-紫杉醇纳入标准•组织学或细胞学证实的mPDAC •符合一线治疗条件(既往未对晚期或转移性疾病进行全身治疗)•可通过RECIST v1.1通过CT或MRI测量• ECOG性能状态≤ 1 •仅B部分,有足够的组织样本来评估与PanCAN的KRA突变状态协作,NCT05669482 Part A:Dose Evaluation(3 + 3 DLT Assessment)RPTD Selection Part B:Dose Expansion(Primary Endpoint:ORR)Avutometinib + Defactinib + Gemcitabine + NAB-紫杉醇剂量发现队列n = 3-6 avutometinib + Defactinib + Gemcitabine + NAB-紫杉醇DLT-Cleared Dose Level Expansion • PDAC患者在RPTD接受治疗•1期:17患者如果≥ 7有应答,那么• Simon的2期设计:扩大到29名患者
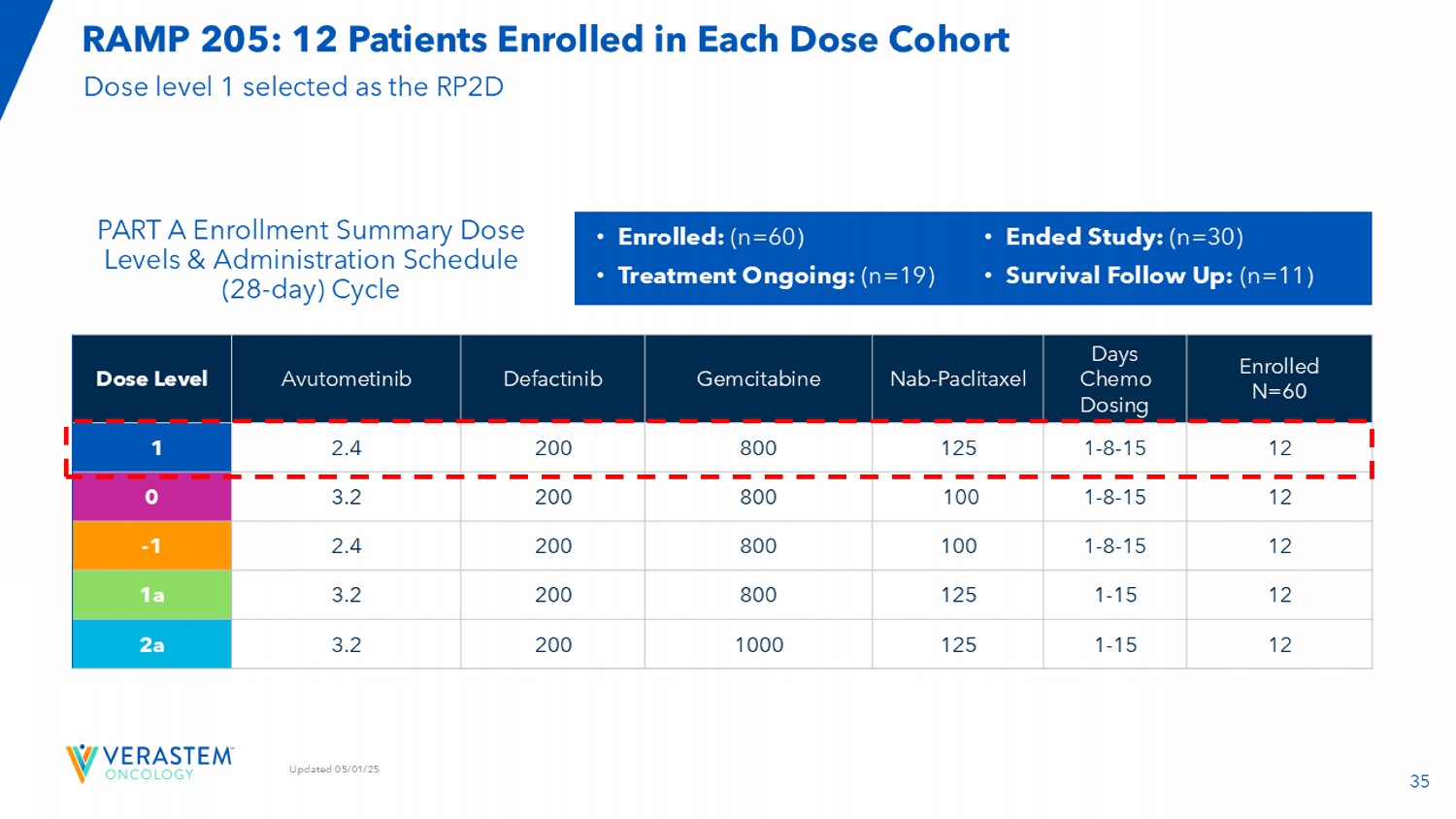
35更新05/01/25入组N = 60天化疗给药NAB-紫杉醇吉西他滨Defactinib阿伐替尼剂量水平12 1-8-151258002002.41 121-8-15 1008002003.20121-8-15 1008002002.4-1121-151258002003.21a121-1512510002003.2a部分A入组汇总剂量水平和给药时间表(28天)周期RAMP 205:每个剂量队列入组12名患者•入组:(n = 60)•正在进行的治疗:(n = 19)•已结束的研究:(n = 30)•生存随访:(n = 11)选择剂量水平1作为RPTD
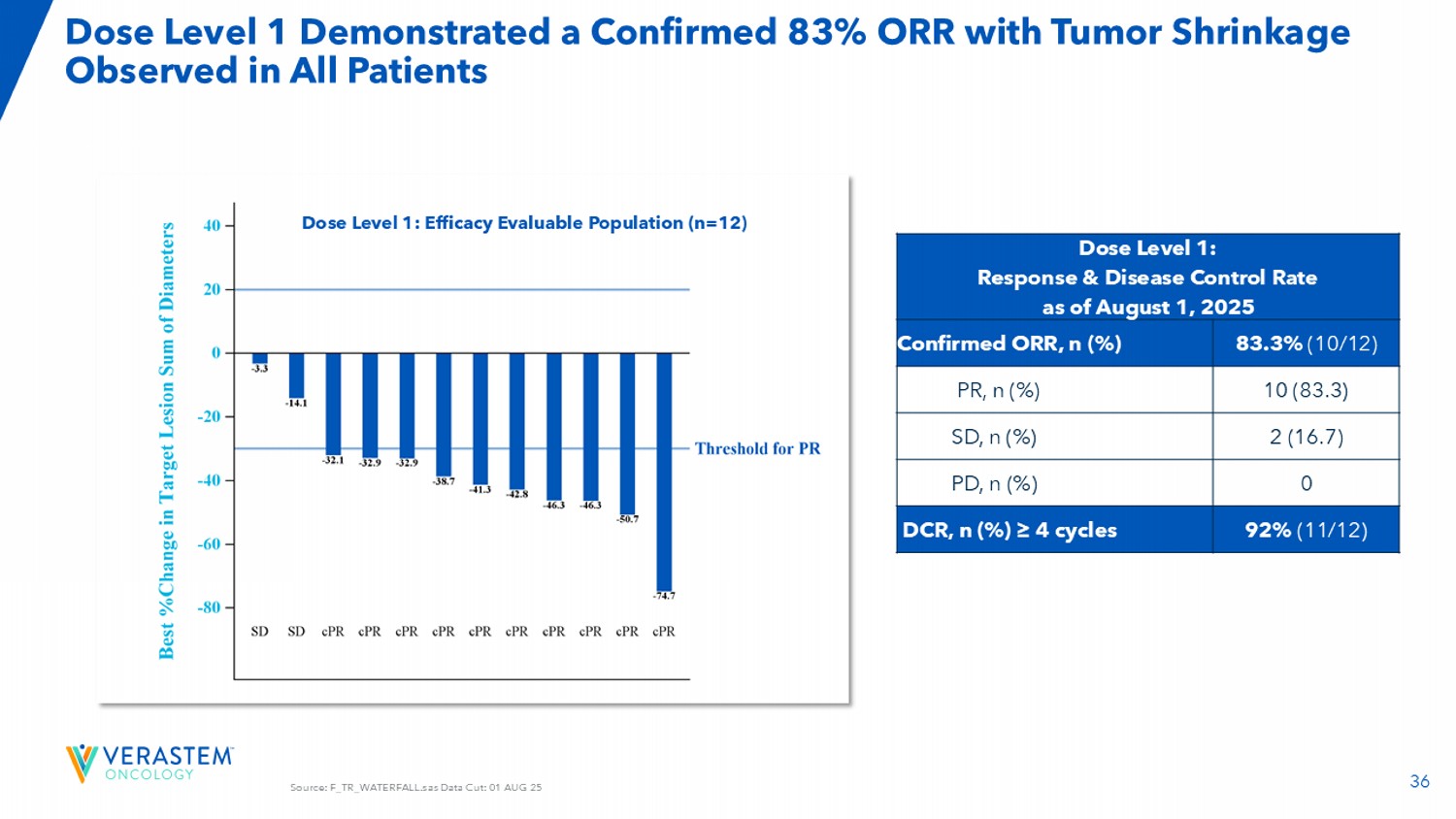
36资料来源:F _ TR _ WATERFALL.SAS数据截取:01 AUG25剂量水平1显示确诊83% ORR,在所有患者中观察到肿瘤缩小剂量水平1:截至2025年8月1日的反应和疾病控制率83.3%(10/12)确诊ORR,n(%)10(83.3)PR,n(%)2(16.7)SD,n(%)0 PD,n(%)92%(11/12)DCR,n(%)≥ 4个周期剂量水平1:疗效可评价人群(n = 12)
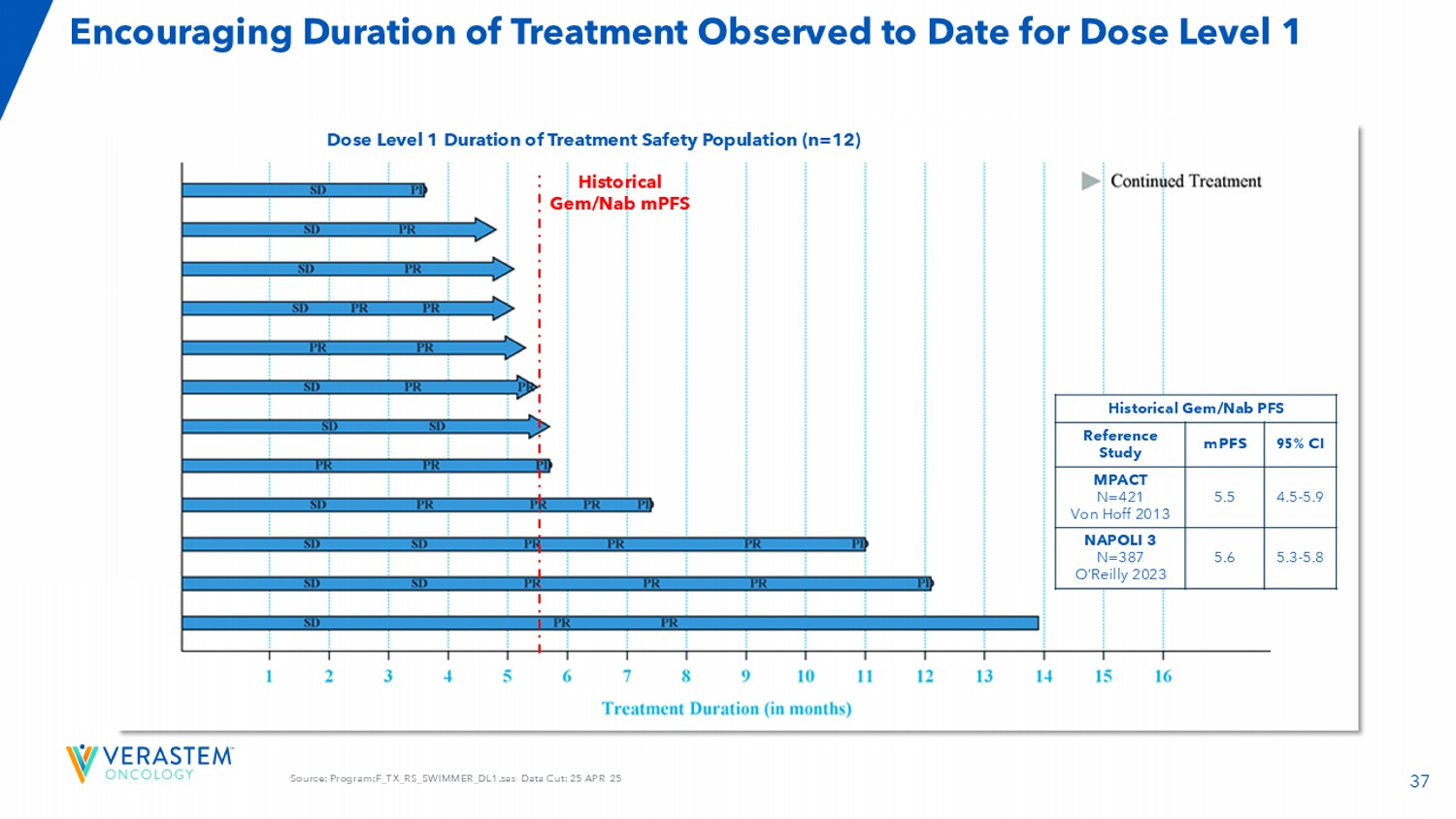
37来源:程序:F _ TX _ RS _ SWIMMER _ DL1.SAS数据截取:25日4月25日鼓励治疗持续时间迄今为止观察到的剂量1级剂量1级治疗持续时间安全人群(n = 12)历史GEM/NAB PFS 95% CI MPFS参考研究4.5-5.9 5.5 MPACT N = 421 von hoff 2013年5.3-5.85.6 NAPOLI 3 n = 387 o'reilly 2023年历史GEM/NAB MPFS
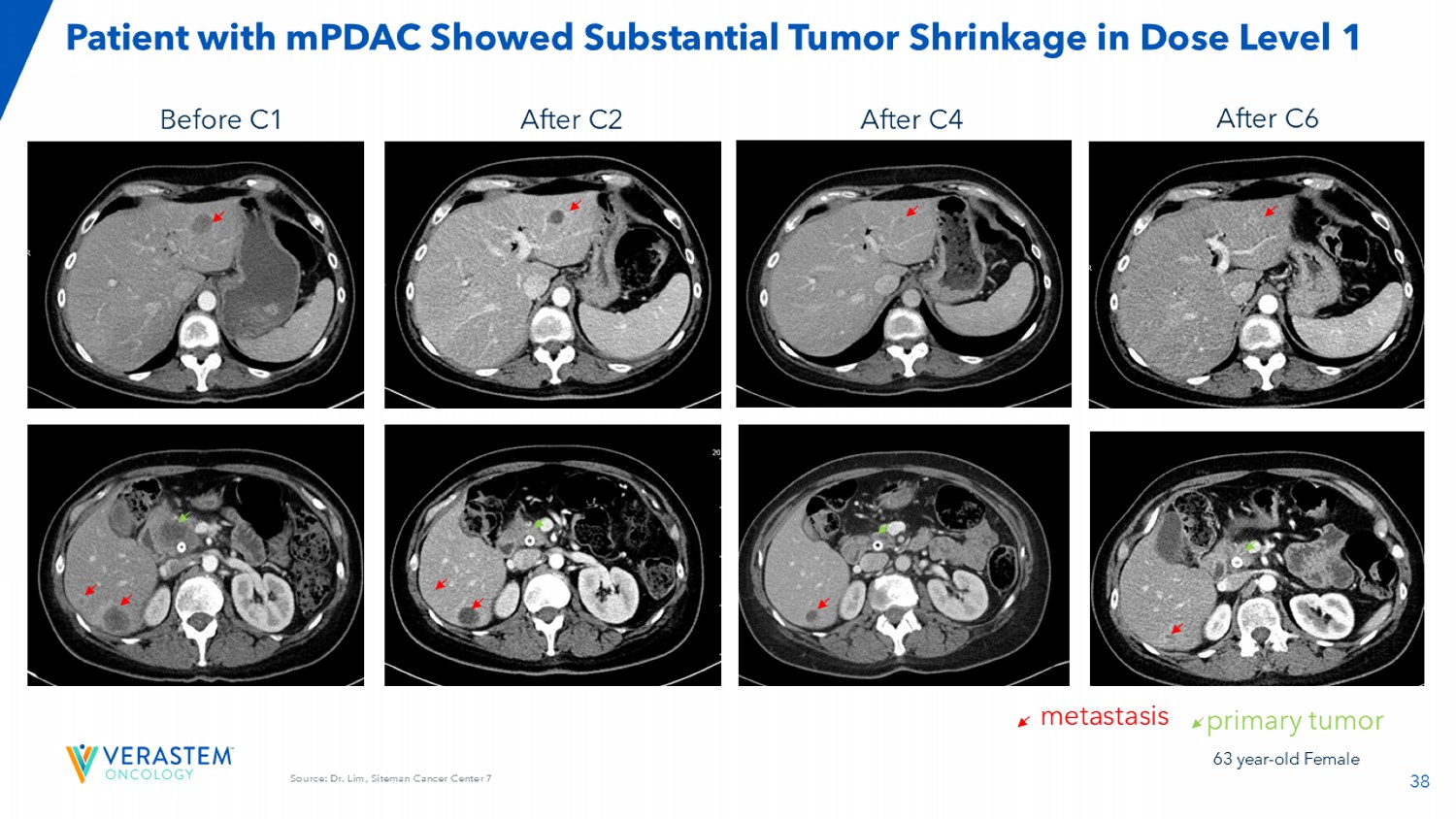
38来源:Siteman癌症中心Lim医生7名mPDAC患者在C6转移原发性肿瘤C4后C2后C1前剂量水平1显示肿瘤明显缩小63岁女性
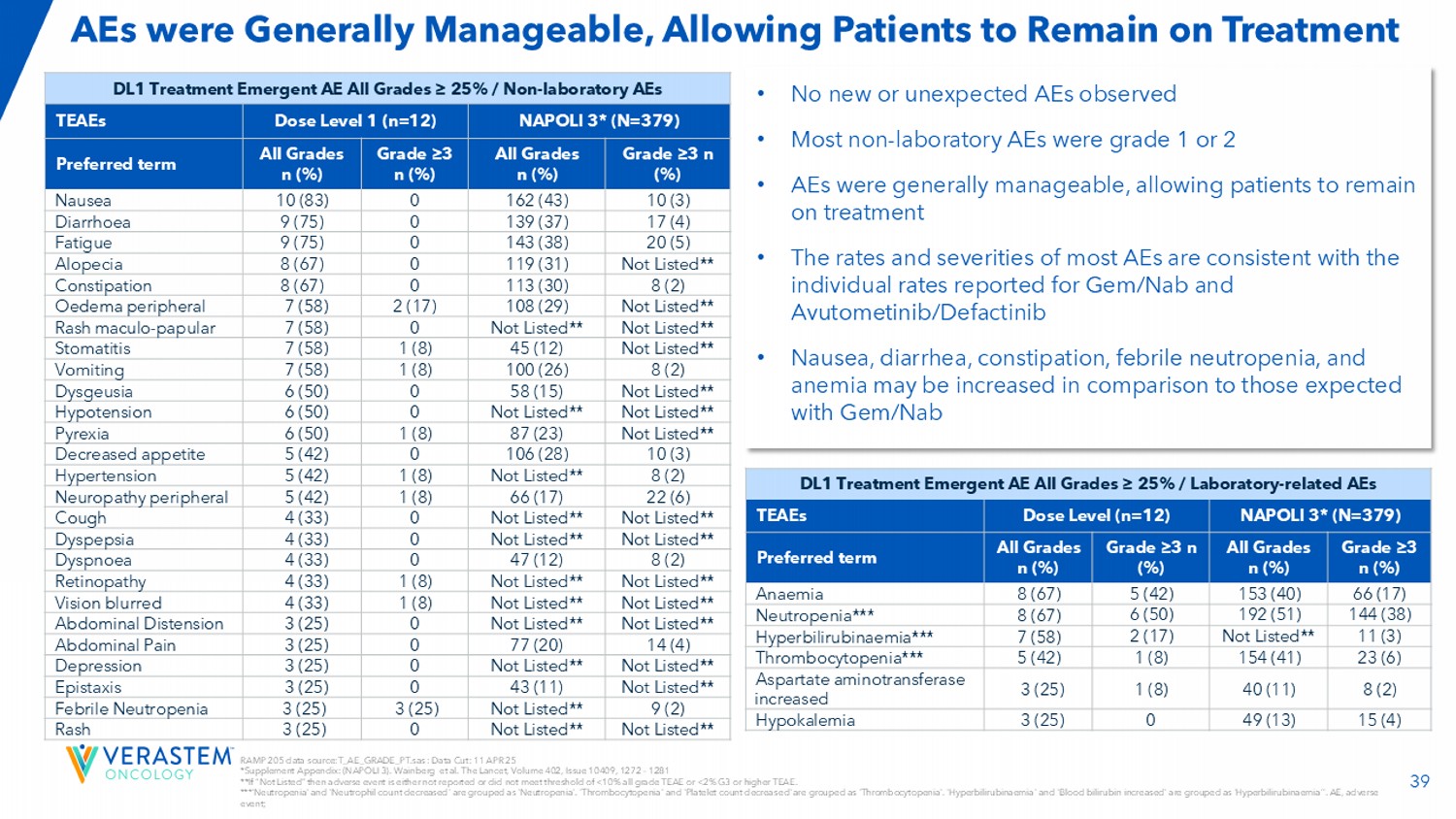
39起AEs总体上是可管理的,允许患者继续接受治疗DL1治疗紧急AEs所有等级≥ 25%/非实验室AEs NAPOLI3*(n = 379)剂量水平1(n = 12)TEAEs等级≥ 3 n(%)所有等级n(%)等级≥ 3 n(%)所有等级n(%)优选期限10(3)162(43)010(83)恶心17(4)139(37)09(75)腹泻20(5)143(38)09(75)疲劳未列**119(31)08(67)脱发8(2)113(30)08(67)便秘未上市**108(29)2(17)7(58)水肿外设未上市**未上市**07(58)疹斑-丘疹性未上市**45(12)1(8)7(58)口炎8(2)100(26)1(8)7(58)呕吐未列**58(15)06(50)味觉障碍未上市**未上市**06(50)低血压未上市**87(23)1(8)6(50)发热10(3)106(28)05(42)食欲下降8(2)未列**1(8)5(42)高血压22(6)66(17)1(8)5(42)神经病变外周未列**未上市**04(33)咳嗽未上市**未上市**04(33)消化不良8(2)47(12)04(33)呼吸困难未上市**未上市**1(8)4(33)视网膜病变未上市**未上市**1(8)4(33)视力模糊未上市**未上市**03(25)腹胀14(4)77(20)03(25)腹痛未上市**未上市**03(25)抑郁症未上市**43(11)03(25)鼻出血9(2)未上市**3(25)3(25)热性中性粒细胞减少症未上市**未上市**03(25)皮疹•未观察到新的或意外的AEs •大多数非实验室AEs为1或2级• AEs总体上是可控的,允许患者继续接受治疗•大多数AEs的发生率和严重程度与报告的GEM/NAB和Avutometinib/Defactinib的个体发生率一致•恶心、腹泻、便秘、发热性中性粒细胞减少症,与GEM/NAB DL1治疗紧急AEs所有等级≥ 25%/实验室相关AEs NAPOLI3相比,贫血可能会增加*(n = 379)剂量水平(n = 12)TEAEs等级≥ 3 n(%)所有等级n(%)等级≥ 3 n(%)所有等级n(%)优选期限66(17)153(40)5(42)8(67)贫血144(38)192(51)6(50)8(67)中性粒细胞减少***11(3)未上市**2(17)7(58)高胆红素血症***23(6)154(41)1(8)5(42)血小板减少症***8(2)40(11)1(8)3(25)天冬氨酸氨基转移酶增加15(4)49(13)03(25)低钾血症RAMP 205数据来源:T _ AE _ GRADE _ PT.SAS:数据截止:25年4月11日*补充附录:(NAPOLI 3)。Wainberg et al. The Lancet,Volume 402,Issue 10409,1272 – 1281**如果“未列入清单”,那么不良事件要么没有报告,要么没有达到< 10%所有等级TEAEE或< 2% G3或hig her TEAEE的阈值。***中性粒细胞减少症‘和’中性粒细胞计数下降‘被归为’中性粒细胞减少症'。‘血小板减少’和‘血小板计数减少’被归为‘血小板减少’。‘高胆红素血症’和‘血胆红素增高’归为‘高胆红素血症’。AEE,不良事件;

RAMP 205的40个下一步2025年第三季度RPTD上完成RAMP 205最多29名患者的入组

阿武托替尼± Defactinib联合索托拉西(G12Ci)治疗KRAS G12C突变型NSCLC
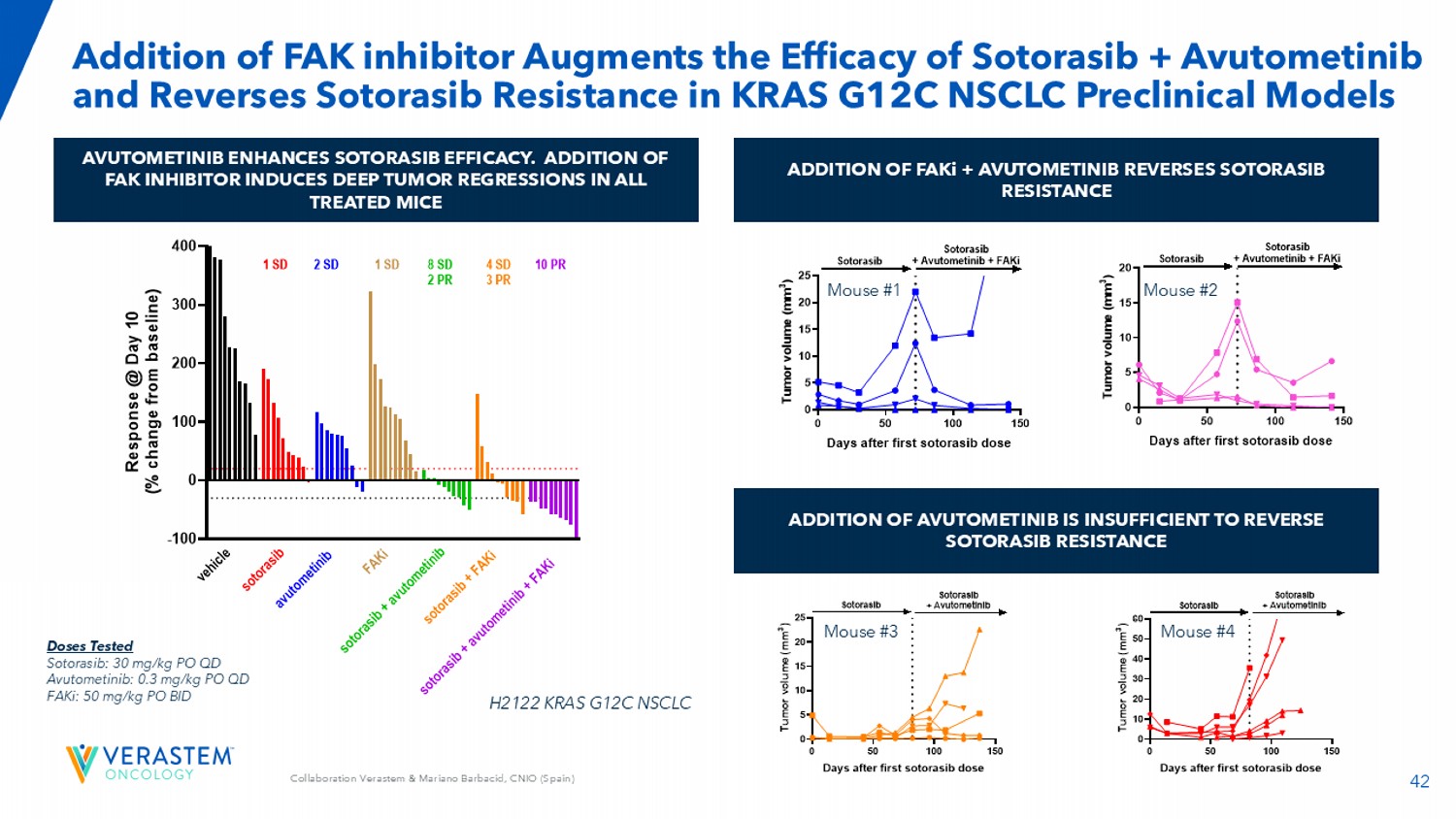
42合作Verastem & Mariano Barbacid,CNIO(西班牙)添加FAK抑制剂增强Sotorasib +阿武托替尼的疗效,并在KRAS G12C NSCLC临床前模型中逆转Sotorasib耐药AVUTOMETINIB增强SOTORASIB效率。FAK抑制剂的添加导致所有治疗小鼠的深层肿瘤消退FAKI + AVUTOMETINIB的添加逆转SOTORASIB耐药性AVUTOMETINIB的添加不足以逆转SOTORASIB耐药性-100 0100200300400在第10天的反应R e s p o n s e @ d a y 10(% c h a n g e f r o m b a s e i n e)v e h i c l e 10 PR a v u t o m e t i n i b f a k is o t o r a s i b s o t o r a s i b + a v u t o m e t i n i b s o t o r a s i b + f a k i s o t o r a s i b + a v u t o m e t i n i b + f a k i 2 SD 1 SD1 SD 8 SD 2 PR 4 SD 3 PR剂量测试Sotorasib:30mg/kg PO QD avutometinib:0.3mg/kg PO QDFAKI:50mg/kg PO BID H2122 KRAS G12C NSCLC 0501001500510152025 days after first sotorasib dose T u m o r v o l u m e(mm3)Sotorasib + avutometinib + FAKiSotorasib 0501001500510152025 days after first sotorasib dose T u m o r v o l u m e(mm3)Sotorasib + avutometinib Sotorasib小鼠# 1小鼠# 2小鼠# 3小鼠# 4
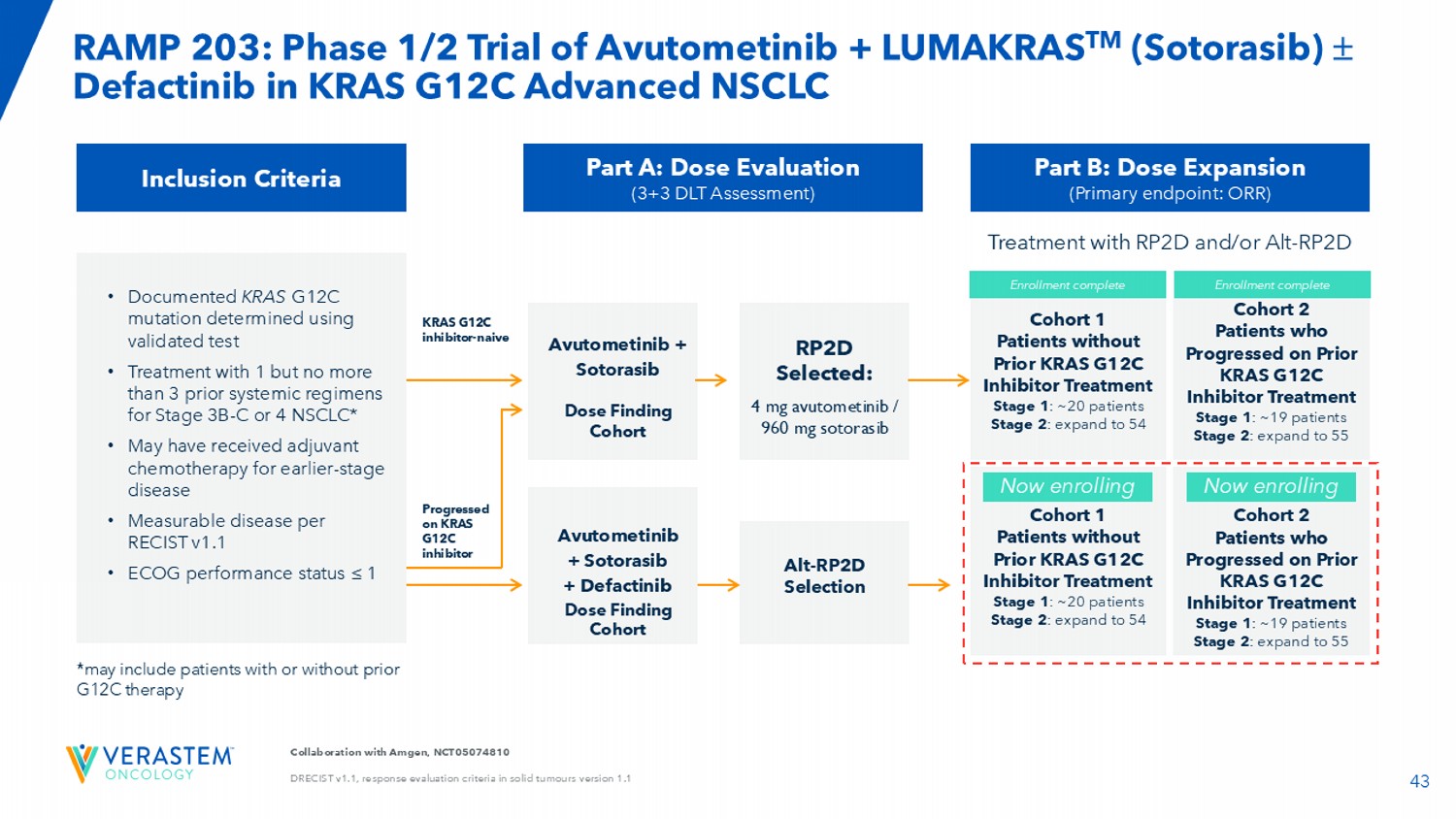
43与安进合作,NCT05074810 DRECIST V1.1,1.1版RAMP 203在实体瘤中的反应评估标准:阿武托替尼+ LUMAKRAS TM(Sotorasib)Defactinib在KRAS G12C晚期NSCLC纳入标准中的1/2期试验•使用经过验证的试验确定的记录的KRAS G12C突变•使用1个但不超过3个既往系统方案治疗3B-C或4期NSCLC*•可能接受过辅助化疗用于早期疾病•根据RECIST v1.1可测量的疾病• ECOG性能状态≤ 1 Part A:剂量评估(3 + 3 DLT评估)Avutometinib + Sotorasib剂量发现队列Part B:剂量扩展(主要终点:ORR)RPTD选择:4 mg a vutometinib/960 mg sotorasib阿伏托替尼+ Sotorasib + Defactinib剂量发现队列Alt-RPTD选择KRAS G12C抑制剂-naive在KRAS G12C抑制剂队列1患者上取得进展无既往KRAS G12C抑制剂治疗第1阶段:~20名患者第2阶段:扩大至54名队列2患者在既往KRAS G12C抑制剂治疗中取得进展第1阶段:~19名患者第2阶段:扩大至55名队列1患者无既往KRAS G12C抑制剂治疗第1阶段:~20名患者第2阶段:扩大至54名队列2患者在既往KRAS G12C抑制剂治疗中取得进展第1阶段:~19名患者第2阶段:扩大至55名入组完成*可能包括患有或没有先前的G12C治疗RPTD和/或Alt-RPTD治疗现已入组现已入组入组完成

44 RAMP 203:在先前接受过G12C抑制剂三联体联合治疗的患者的第一个三联体联合队列中未观察到剂量限制毒性(DLTs)更新:•截至2024年11月21日,数据截止,三名先前在G12C抑制剂上出现癌症进展的患者接受了sotorasib 960 mg每日连续给药和avutometinib 3.2 mg每周两次(BIW)加defactinib 200 mg每日两次(BID)的三联体联合治疗。阿武托替尼和迪法替尼按四周中的三周给药。• 3名患者中有2名在首次扫描时显示出至少20%的初始肿瘤减少。截至数据截止,这三名患者均仍在接受治疗。• 2025年Q1完成三联组合计划剂量水平评估队列入组。Doublet组合更新:•如先前报道,avutometinib与sotorasib的doublet组合已完成G12C抑制剂治疗-NA ï ve Stage 1 Part B队列的入组(n = 28)。•于2025年第1季度完成KRAS G12C抑制剂、先前治疗的第1阶段B部分双联队列的入组。•继续跟踪纳入双联队列的患者,以获得安全性和有效性结果(既有先前治疗的队列,也有未接受治疗的队列)。

45 RAMP 203的下一步报告2025年Q4双联和三联组合的疗效和安全性结果的临时更新

46预期里程碑和财务46
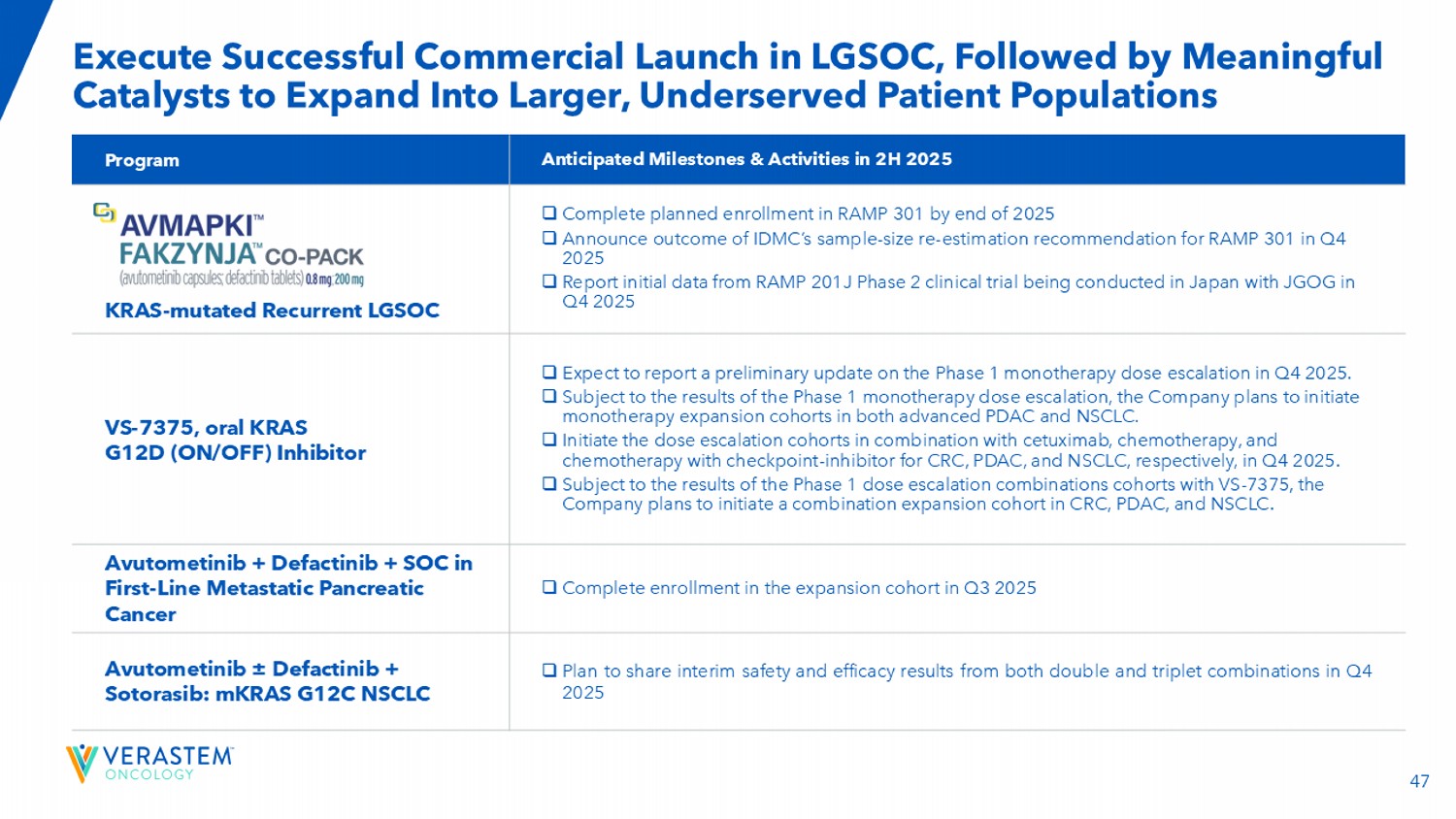
47在LGSOC中执行成功的商业启动,随后是有意义的催化剂,以扩展到更大的、服务不足的患者群体,预计在2H 2025计划中的里程碑和活动□到2025年底完成RAMP 301的计划入组□宣布IDMC在2025年第四季度对RAMP 301进行样本量重新估计建议的结果□报告RAMP 201J 2期临床试验的初步数据,该试验于2025年第四季度在日本与JGOG进行KRAS-突变的复发性LGSOC □预计将在2025年第四季度报告1期单药治疗剂量递增的初步更新。□以1期单药治疗剂量递增结果为准,公司计划在晚期PDAC和NSCLC中启动单药治疗扩展队列。□于2025年Q4分别启动与西妥昔单抗、化疗、化疗联合检查点抑制剂治疗CRC、PDAC、NSCLC的剂量递增队列。□以VS-7375的1期剂量递增组合队列结果为准,公司计划在CRC、PDAC和NSCLC中启动组合扩展队列。□ 2025年Q3完成拓展队列入组阿伐替尼+ Defactinib + SOC在一线转移性胰腺癌中的应用□计划于2025年Q4分享双联和三联组合的中期安全性和有效性结果Avutometinib ± Defactinib + Sotorasib:mKRAS G12C NSCLC VS-7375,口服KRAS G12D(ON/OFF)抑制剂

48*2025年第二季度GAAP运营费用4590万美元减去2025年第二季度基于股票的薪酬费用341万美元= 2025年第一季度非GAAP运营费用4249万美元。**不包括未行使的认股权证(行权时1410万股)和未行使的预融资认股权证(行权时980万股)。截至2025年6月30日止季度的主要财务统计数据1.643亿美元现金,现金等价物和短期投资210万美元产品净收入4590万美元GAAP运营费用4250万美元*Non-GAAP运营费用6150万**已发行股票Oberland Finance Credit Facility •高达1.5亿美元可用于一系列票据• 7500万美元未偿票据本金•在实现预先确定的里程碑时,公司可选择剩余的7500万美元•在FDA批准avutometinib和defactinib用于治疗LGSOC时提供2500万美元的分支•在过去六个月收入至少为5500万美元时提供5000万美元的分支•浮动利率,有下限和上限•到2031年1月只支付利息•没有财务契约

谢谢!
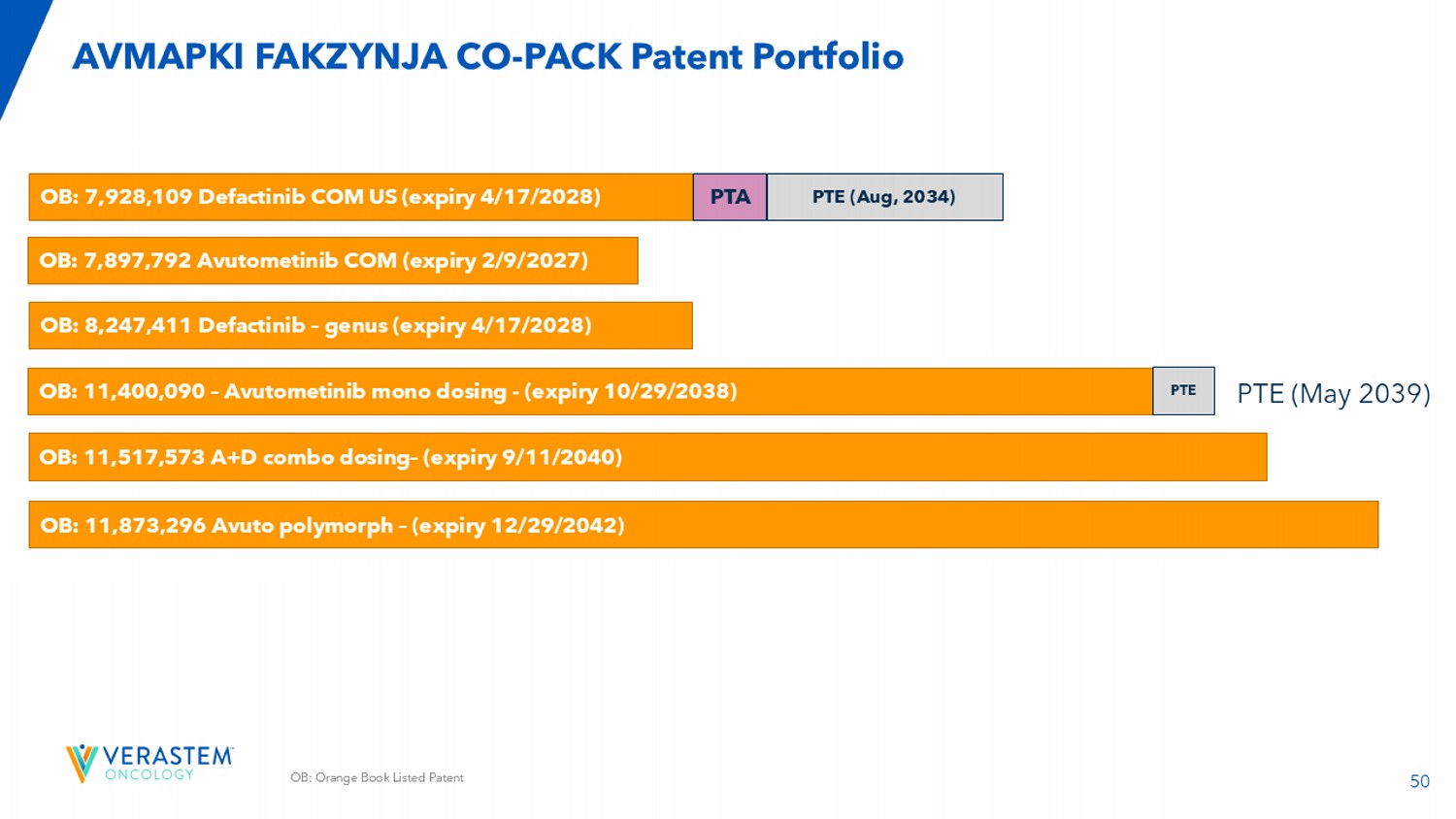
50 OB:橙皮书上市专利AVMAPKI FAKZYNJA CO-Pack专利组合OB:7,897,792 Avutometinib COM(2027年2月9日到期)OB:11,400,090 – Avutometinib单药给药-(2038年10月29日到期)PTE OB:7,928,109 Defactinib COM US(2028年4月17日到期)PTA PTE(2034年8月)OB:8,247,411 Defactinib – genus(2028年4月17日到期)OB:11,517,573 A + D组合给药–(2040年9月11日到期)OB:11,873,296 Avuto polymorph –(expire

51位经验丰富的高级管理团队Cathy Carew首席组织a l有效性官Colleen Mockbee监管事务和发展全球主管Nate Sanburn首席商务官Dan Calkins 首席财务官 Matt Ros首席运营官Mike Crowther首席商务与战略官Jonathan Pachter博士、首席科学官John Hayslip医学博士、首席医疗官Daniel Paterson总裁兼首席执行官•负责人–人力资源协作• Ironwood、ActiveBiotics、Dynogen、Tufts Health Plan • OncXerna首席开发官兼监管高级副总裁•礼来肿瘤学全球监管主管•副总裁,礼来肿瘤学合作和后期BD主管•印第安纳大学国家基因载体实验室•技术会计顾问-CFGI •普华永道会计师事务所• FORE Biotherapeut ics首席执行官• Epizyme执行副总裁& CSBO • COO,赛诺菲-健赞• BMS • CBO,Minerva Biotechnolog ies •临时美国主管和美国营销副总裁,Kite Pharma,TERM2 • Celgene •癌症生物学主管– OSI(现为Astellas)•先灵葆• CMO,I-MAB • 内克塔治疗,艾伯维•肯塔基大学Markey癌症中心•首席执行官,The DNA Repair Co.(now on-Q-ity)• PharMetrics(now IMS)• Axion以往经验
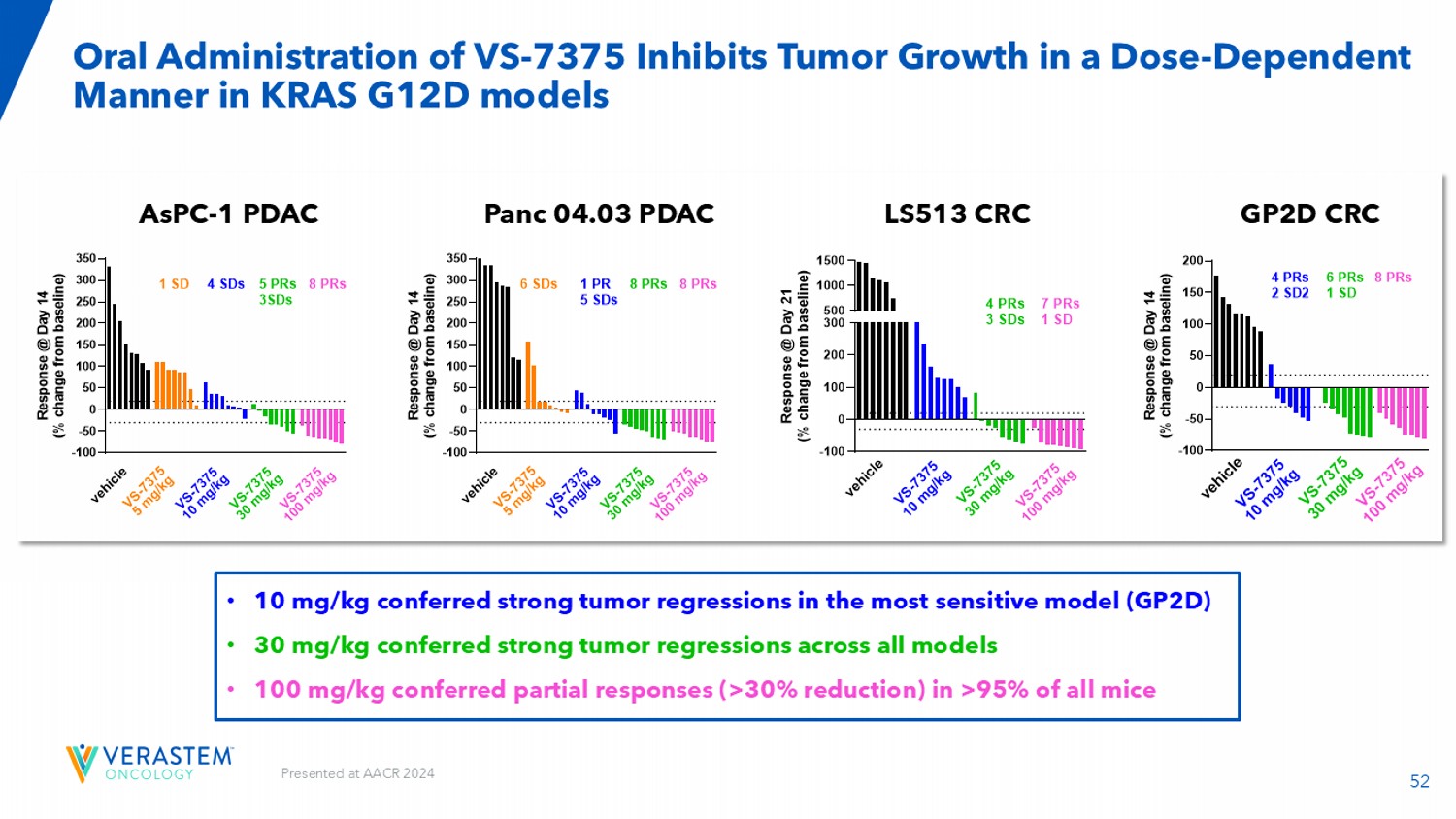
52口服VS-7375在KRAS G12D模型ASPC-1 PDAC PANC 04.03 PDAC GPMD CRC LS513 CRC-100-50 050100150200250300350 R e s p o n s e @ d a y 14(% c h a n g e f r o m b a s e l i n e)v e h i c l e v s-737510 m g/k g V s-737530 m g/k g V s-7375100 m g/k g 6 SDs 1 PR 5 SDs 8 PRs 8 PRs V s-73755 m g/k g-100-50 050100150200250300350 R e s p o n s e @ d a y 14(% c h a n g e f r o m b a s e l i n e)v e h i cl e v s-737510 m g/k g v s-737530 m g/k g v s-7375100 m g/k g v s-73755m g/k g 1 SD 4 SDs 5 PRs 3SDs 8 PRs-100 010020030050010001500 R e s p o n s e @ d a y 21(% c h a n g e f ro m b a s e l i n e)v e h i c l e v s-737510 m g/k g v s-737530 m g/k g v s-7375100 m g/k g v s-7375100 m g/k g 4 PRs 3 SDs 7 PRs 1 SD在AACR 2024上发表• 10 mg/kg在最敏感模型(GPTD)中赋予强烈的肿瘤回归•30 mg/kg在所有模型中赋予强烈的肿瘤回归•100 mg/kg在> 95%的所有小鼠中赋予部分应答(> 30%减少)

400和600mg的53个剂量水平QD在几乎所有患者中实现了稳态目标暴露,在小鼠中人当量为100mg/kg(在所有模型中所有小鼠为PR)在小鼠中人当量为30mg/kg(在所有模型中为肿瘤消退)在小鼠中人当量为10mg/kg(在大多数敏感模型中为肿瘤消退)
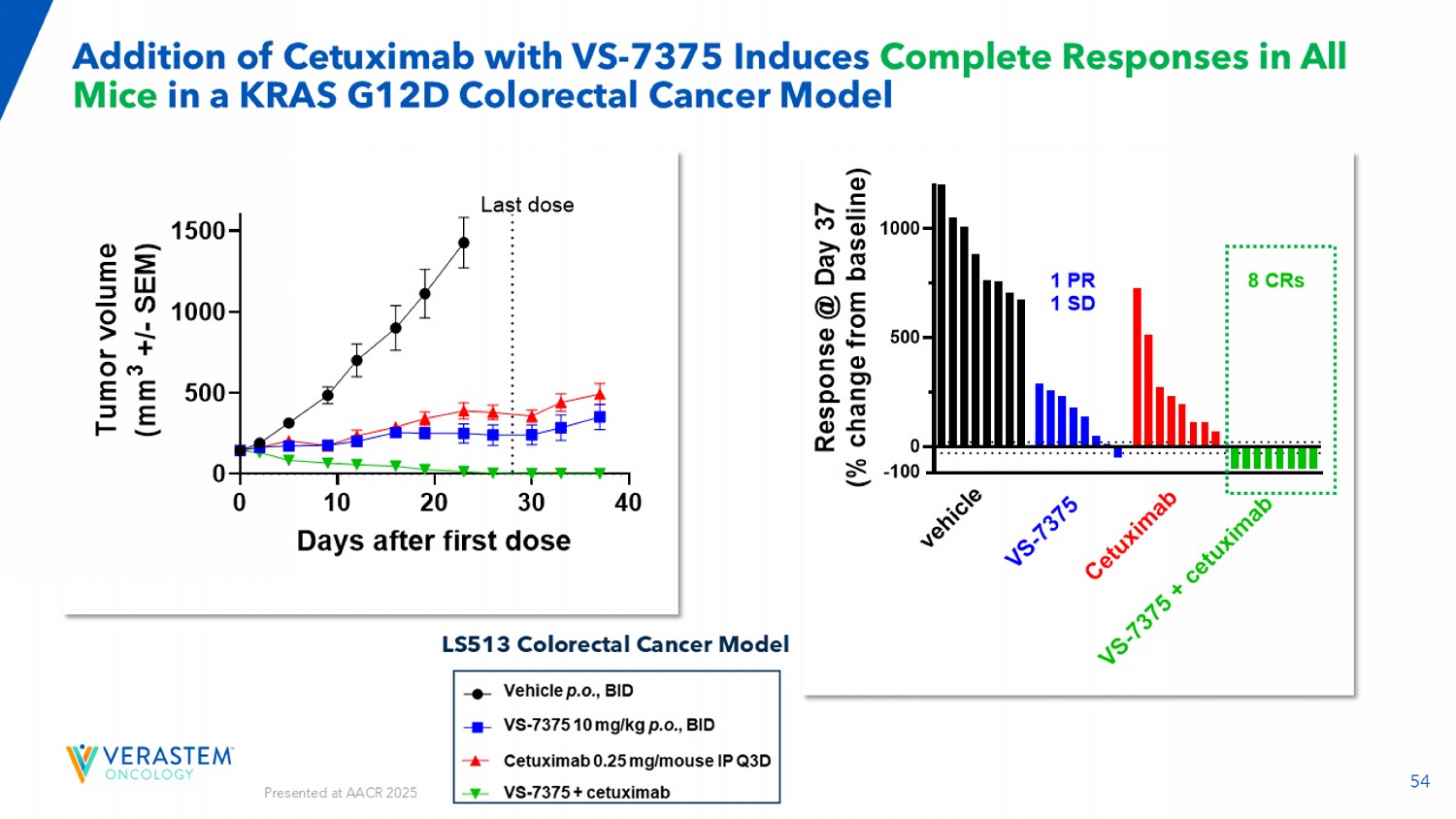
54在KRAS G12D结直肠癌模型LS513结直肠癌模型中添加VS-7375的西妥昔单抗诱导所有小鼠的完全反应010203040050010001500肿瘤生长天数首剂后T u m o r v o l u m e(m m 3 +/-s e m)载体GFH375西妥昔单抗GFH375 +西妥昔单抗最后一剂05001000 R e s p o n s e @ d a y 37(% c h a n g e f r o m b a s e i n e)v e h i c l e v s-7 375 c e t u x i m a b v s-7 375 + c e t u x i m a b 1 PR 1 SD 8 CRs-100在AACR 2025上发表
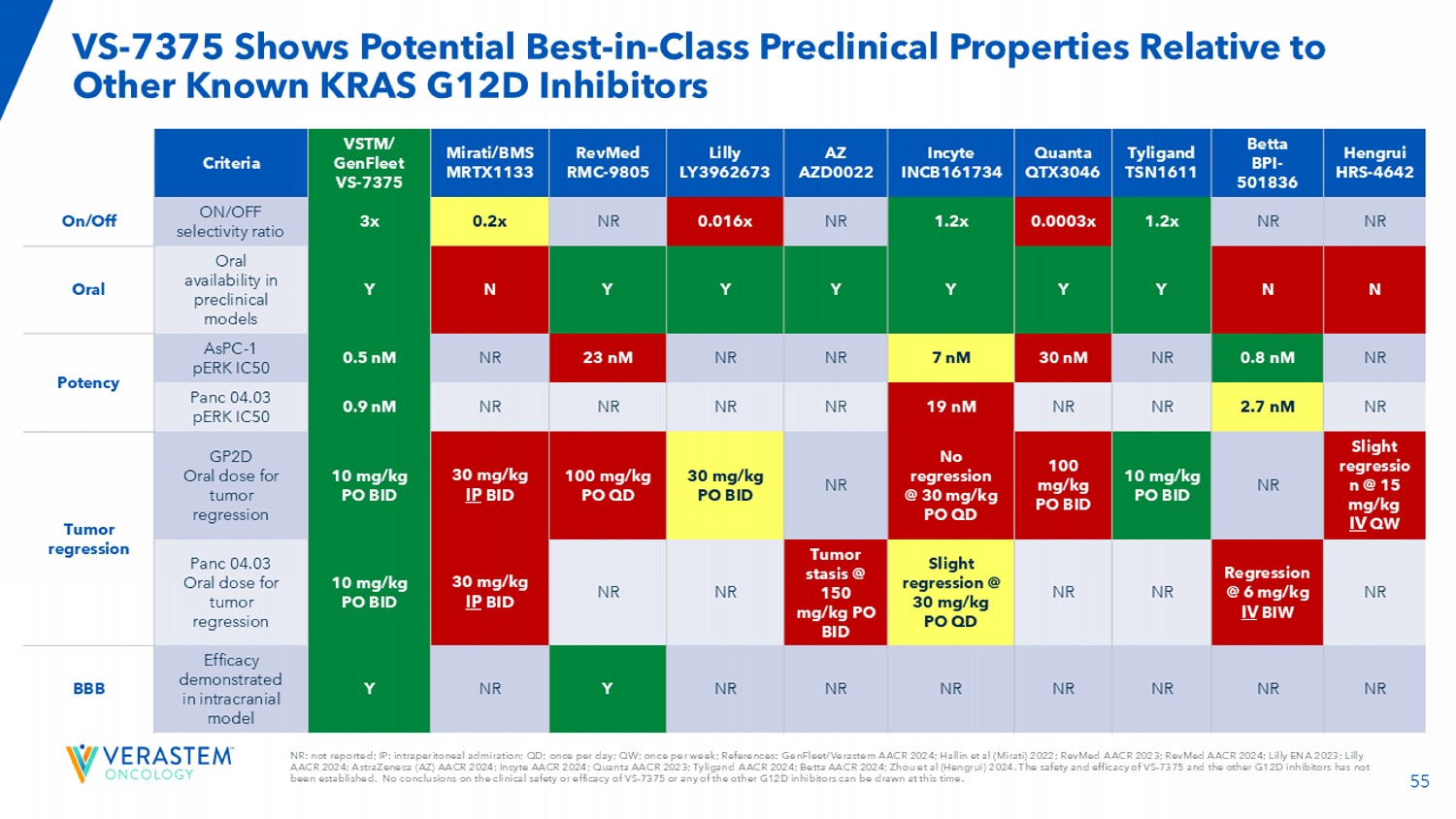
55 NR:未报告;IP:腹膜内钦佩;QD;每天一次;QW;每周一次;参考文献:GenFleet/Verastem AACR 2024;Hallin et al(Mirati)2022;RevMed AACR 2023;RevMed AACR 2024;Lilly ENA 2023;Lilly AACR 2024;因塞特医疗 AACR 2024;Quanta AACR 2023;Tyligand AACR 2024;Betta AACR 2024;Zhou et al(恒瑞)2024。VS-7375和其他G12D抑制剂的安全性和有效性尚未确定。目前无法就VS-7375或任何其他G12D抑制剂的临床安全性或有效性得出结论。VS-7375相对于其他已知的KRAS G12D抑制剂显示出潜在的同类最佳临床前性能恒瑞HRS-4642 Betta BPI-501836 Tyligand TSN1611 Quanta QTX3046 因塞特医疗 INCB161734 AZ AZD0022 Lilly LY3962673 RevMed RMC-9805 Mirati/BMS MRTX1133丨VSTM丨/GenFleet VS-7375标准NRNRR 1.2x 0.0003x 1.2x NR0.016x NR0.2x 3x开/关选择性比开/关N N Y Y Y Y Y Y Y N Y临床前模型中的口服可用性口服NR0.8 nM NR30 nM 7 nM NR23效价NR2.7 nM NRR NR19 nM NRR NR0.9 nM panc 04.03 pERK IC50轻微回归n @15mg/kg IV QW NR10 mg/kg PO BID 100mg/kg PO BID无回归@30mg/kg PO QD NR30 mg/kg PO BID 100mg/kg PO 丨QD 30mg/kg IP BID 10mg/kg PO BID GPTD口服剂量用于肿瘤消退肿瘤消退NR消退@6mg/kg IV BIW NR NR轻微消退@30mg/kg PO QD肿瘤瘀滞@150mg/kg PO BID NR NR 30mg/kg IP BID10mg/kg PO BID PANC 04.03口服剂量用于肿瘤消退NR NR NR NR NR NR NR Y NR Y在颅内BBB模型中的疗效证明