
附件 99.1 SER-155第1b期1份读数2024年9月12日

免责声明前瞻性陈述本通讯包含1995年《私人证券诉讼改革法案》含义内的前瞻性陈述。本通讯中包含的与历史事实无关的所有陈述应被视为前瞻性陈述,包括关于我们的任何产品或候选产品的潜在益处的陈述;SER-155的最终安全性和有效性数据;研究结果;寻求FDA反馈的计划;临床数据和临床试验;我们与SER-155开发相关的意图;我们寻求突破性治疗指定的意图;活体生物治疗药物预防或减少感染的能力;或上述任何陈述的时间安排以及其他非历史事实的陈述。这些前瞻性陈述是基于管理层目前的预期。这些陈述既不是承诺也不是保证,而是涉及已知和未知的风险、不确定性和其他可能导致我们的实际结果、业绩或成就与前瞻性陈述中明示或暗示的任何未来结果、业绩或成就存在重大差异的重要因素,包括但不限于:(1)我们蒙受了重大损失,目前没有盈利,可能永远不会盈利;(2)我们对额外资金的需求;(3)我们的经营亏损历史;(4)我们的债务协议中的限制;(5)我们对治疗干预的新颖方法;(6)我们依赖第三方来进行我们的临床试验和制造我们的候选产品;(7)我们将面临的竞争;(8)与我们的临床试验相关的风险;(9)FDA是否授予突破性疗法指定;(10)我们保护我们知识产权的能力;(11)我们留住关键人员和管理我们的增长的能力;及(12)与Soci é t é des Produits Nestl é S.A就向SPN出售VOWST业务的购买协议项下拟议交易相关的风险。我们于2024年8月13日向SEC提交的10-Q表格季度报告中“风险因素”标题下讨论的这些和其他重要因素,以及我们向SEC提交的其他报告,可能会导致实际结果与本通讯中的前瞻性陈述所表明的结果存在重大差异。任何此类前瞻性陈述均代表管理层截至本通讯发布之日的估计。虽然我们可能会选择在未来某个时候更新此类前瞻性陈述,但我们不承担这样做的任何义务,即使后续事件导致我们的观点发生变化。这些前瞻性陈述不应被视为代表我们在本通讯日期之后的任何日期的观点。赛里斯治疗公司 © 202422

免责声明关于此次交易的重要信息以及在哪里可以找到与涉及赛里斯治疗公司(“Seres”)和Soci é t é des Produits Nestl é S.A.(“SPN”)的拟议交易有关的信息,Seres向美国证券交易委员会(“SEC”)提交了最终代理声明。Seres还可能就拟议交易向SEC提交其他相关材料。从2024年8月26日开始,Seres向其股东邮寄了最终的代理声明。请投资者和Seres的股东在可获得最终代理声明和其他相关材料时仔细并完整地阅读它们,因为它们包含或将包含有关Seres和拟议交易的重要信息。投资者可以在SEC网站www.sec.gov或在Seres网站ir.seretherapeutics.com上免费获得Seres向SEC提交的这些材料(如果有)和其他文件的副本。征集的参与者Seres及其某些董事、执行官和其他管理层成员及雇员可被视为就拟议交易向其股东征集代理的参与者。根据SEC的规则,可能被视为与拟议交易有关的Seres股东征集参与者的相关信息载于Seres于2024年8月26日向SEC提交的股东大会最终代理声明中,提议的交易将提交给Seres的股东批准。您还可以在Seres于2024年3月5日向SEC提交的截至2023年12月31日的财政年度的10-K表格年度报告中找到有关Seres董事和执行官的更多信息,Seres于2024年3月5日向SEC提交的2024年年度股东大会的最终代理声明,以及随后提交的8-K表格当前报告和10-Q表格季度报告中的最终代理声明。赛里斯治疗公司 © 202433
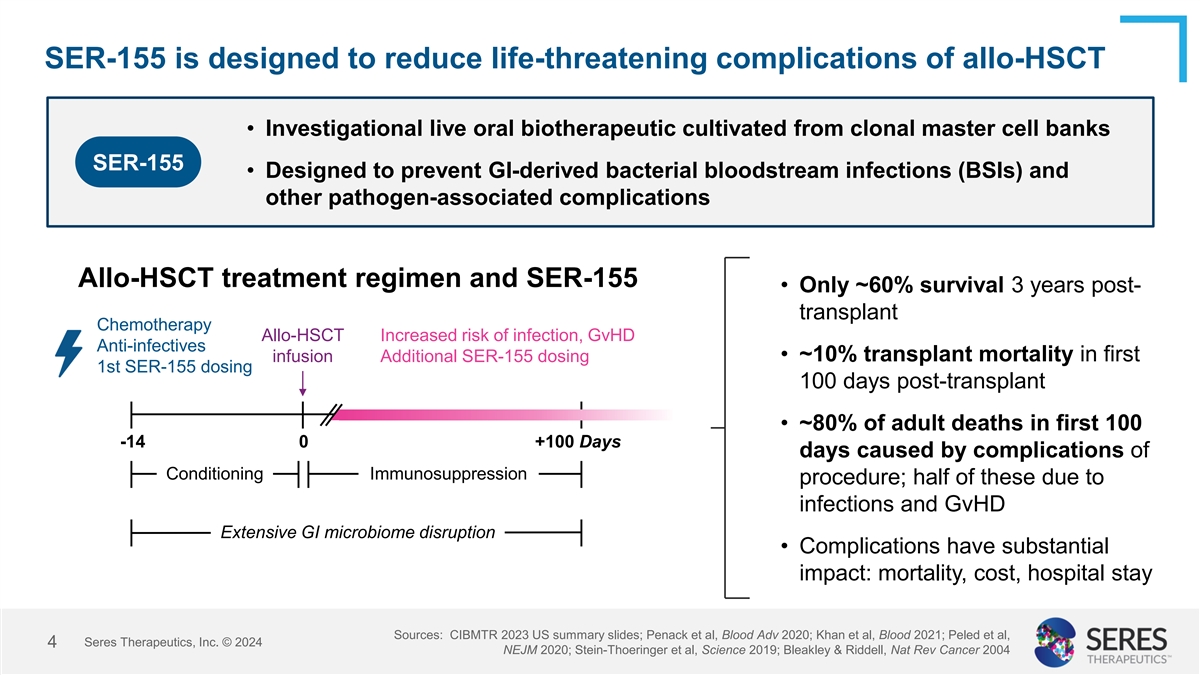
SER-155旨在减少allo-HSCT危及生命的并发症•从克隆主细胞库SER-155培养的研究性活口服生物治疗•旨在预防GI衍生的细菌血流感染(BSI)和其他与病原体相关的并发症Allo-HSCT治疗方案和SER-155 •移植化疗后Allo-HSCT 3年仅有~60%的生存率增加感染风险,GVHD抗感染药•首次输注额外SER-155给药第1次SER-155给药移植后100天移植死亡率~10% •前100-14 0 + 100天成人死亡的约80%是由条件性免疫抑制程序的并发症引起的;其中一半是由于感染和GVHD广泛的GI微生物组破坏•并发症具有重大影响:死亡率、成本、住院时间来源:CIBMTR 2023美国摘要幻灯片;Penack等人,Blood Adv 2020;Khan等人,Blood 2021;Peled等人,赛里斯治疗公司 © 20244 NEJM 2020;Stein-Thoeringer等人,Science 2019;Bleakley & Riddell,Nat Rev Cancer 2004

SER-155 1b期研究评估了成人allo-HSCT受体COHORT 1 COHORT 2开放标签(n = 15入组)的安全性、药理学和有效性(n = 15入组)安慰剂对照1:1(n = 45入组)SER-155 SER-155安慰剂结果报告于2023年5月结果于2024年9月公布主要终点:通过HSCT第100天的关键次要终点:•安全性和耐受性•血流感染(BSI)、胃肠道感染和急性GVHD ≥ 2级的发生率• SER-155细菌株植入•热性中性粒细胞减少症的发生率和持续时间•细菌病原体丰度于2023年12月获得美国FDA快速通道指定;打算追求突破性治疗指定丨Seres Therapeutics,Inc.丨© 赛里斯治疗公司
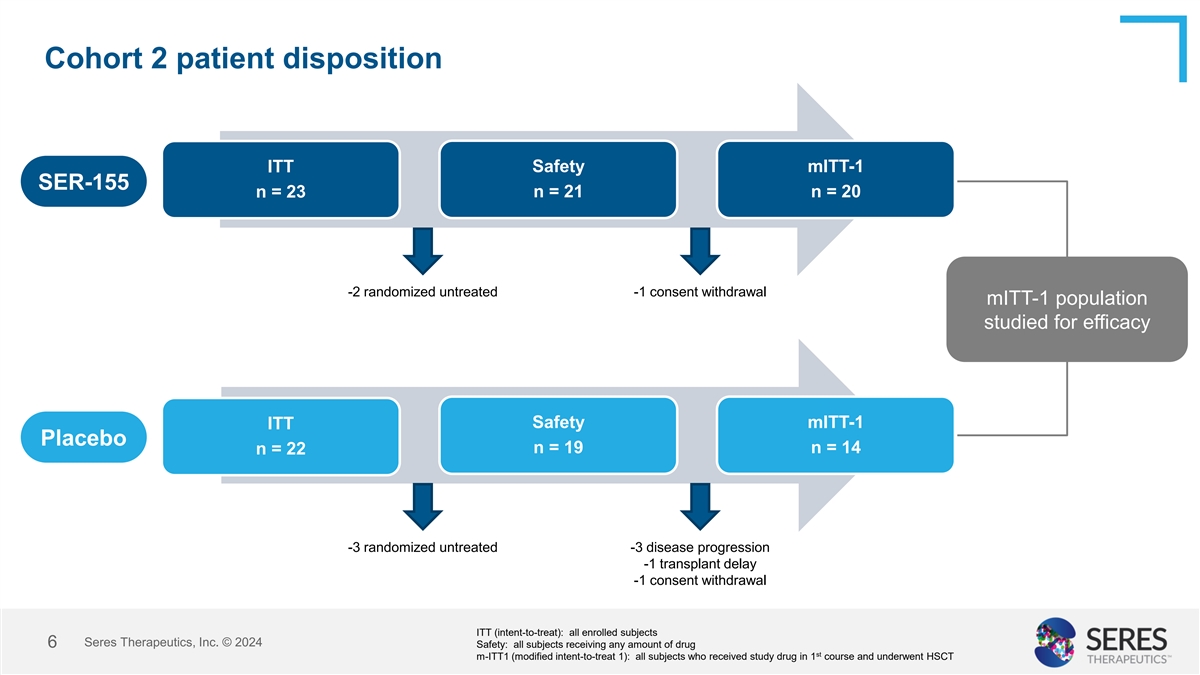
队列2患者处置ITT安全性mITT-1 SER-155 n = 23 n = 21 n = 20-2随机未经治疗-1同意撤回mITT-1人群的疗效安全性研究mITT-1丨ITT丨安慰剂n = 19 n = 14 n = 22-3随机未经治疗-3疾病进展-1移植延迟-1同意撤回ITT(意向治疗):所有入组受试者丨Seres Therapeutics,Inc. 赛里斯治疗公司 © 20246安全性:所有受试者接受任何数量的药物ST m-ITT1(改良意向治疗1):所有受试者在1个疗程内接受研究药物并接受HSCT
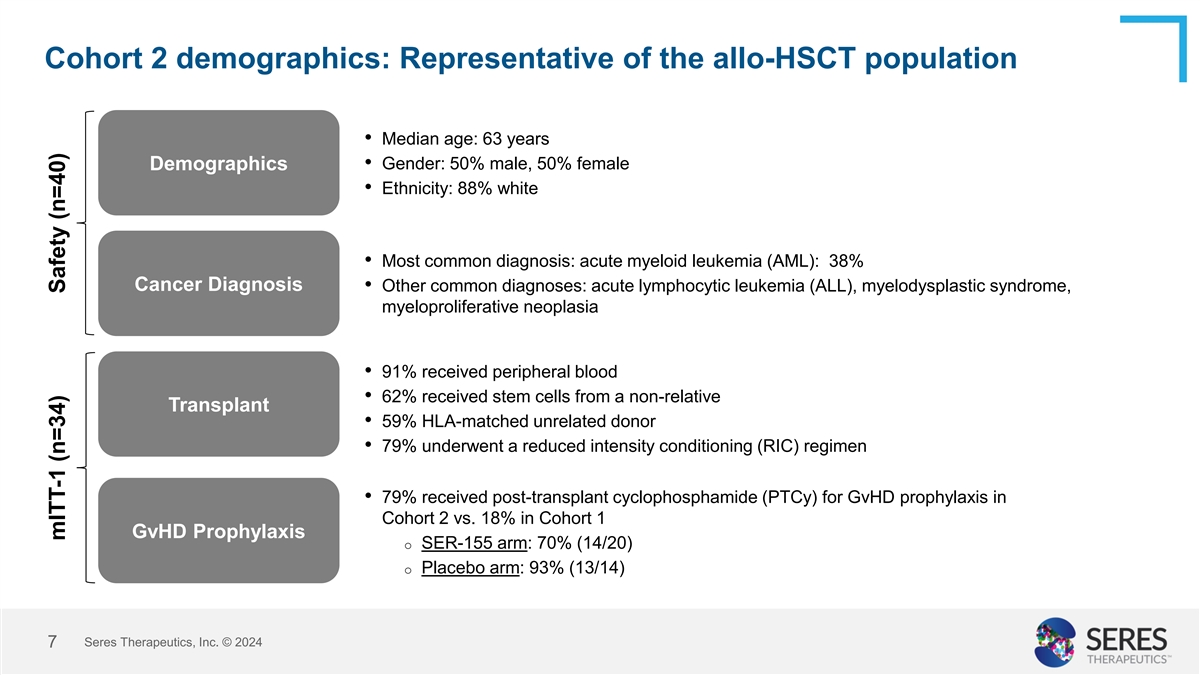
队列2人口统计:具有代表性的allo-HSCT人群•中位年龄:63岁人口统计•性别:50%为男性,50%为女性•种族:88%为白人•最常见诊断:急性髓细胞白血病(AML):38%为癌症诊断•其他常见诊断:急性淋巴细胞白血病(ALL)、骨髓增生异常综合征,骨髓增生性肿瘤• 91%接受外周血• 62%接受非亲属移植的干细胞• 59% HLA匹配的无关供体•79%接受了降低强度条件调节(RIC)方案•79%接受了移植后环磷酰胺(PTCY)用于队列2中的GVHD预防,而在队列1中接受了18%的GVHD预防o SER-155臂:70%(14/20)o安慰剂臂:93%(13/14)赛里斯治疗公司 © 20247 mITT-1(n = 34)安全性(n = 40)
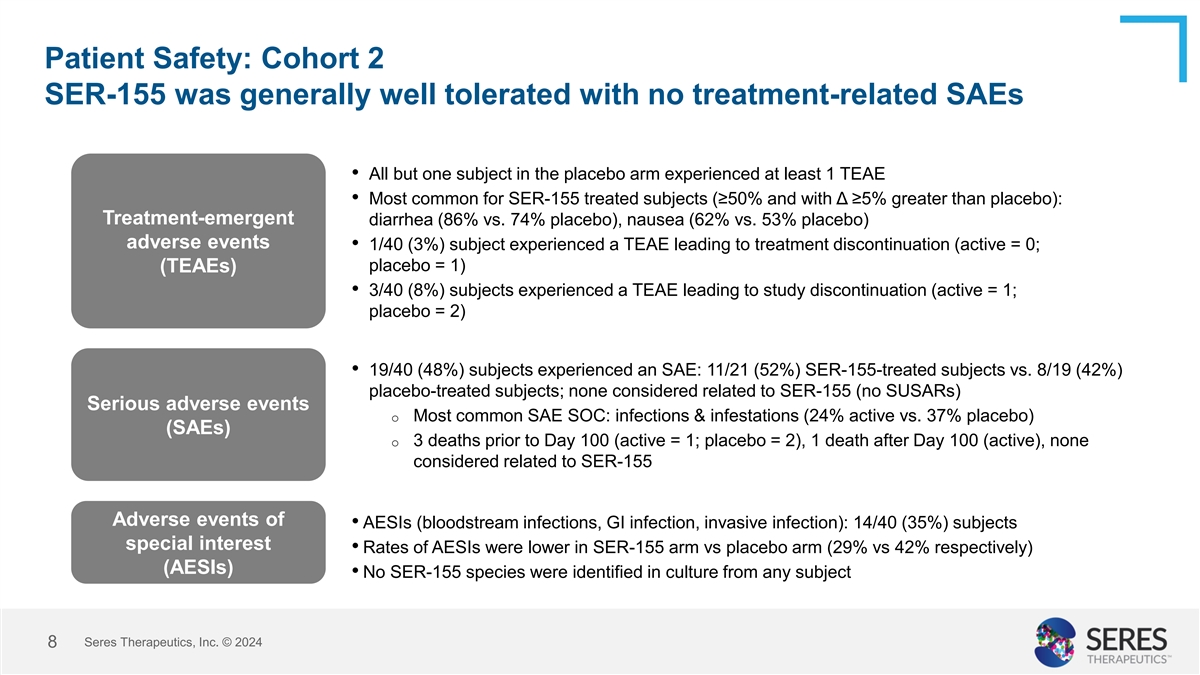
患者安全性:队列2 SER-155总体耐受性良好,没有与治疗相关的SAE •安慰剂组中除一名受试者外,所有受试者都经历了至少1次TEAE •最常见的是SER-155治疗受试者(≥ 50%,且与安慰剂相比β ≥ 5%):治疗后出现的腹泻(86% vs. 74%的安慰剂),恶心(62% vs. 53%安慰剂)不良事件• 1/40(3%)受试者经历了导致停止治疗的TEAES(active = 0;安慰剂= 1)(TEAEs)• 3/40(8%)受试者经历了导致研究停止的TEAES(active = 1;安慰剂= 2)• 19/40(48%)受试者经历了SAE:11/21(52%)SER-155治疗受试者vs. 8/19(42%)安慰剂治疗受试者;没有被认为与SER-155(无SUSAR)相关的严重不良事件o最常见的SAE SOC:感染和感染(24%活性vs. 37%安慰剂)(SAEs)o第100天之前有3例死亡(active = 1;安慰剂= 2),1例在第100天(活跃)后死亡,未考虑与SER-155不良事件相关• AESIs(血流感染、GI感染、侵袭性感染):14/40(35%)受试者特别感兴趣• SER-155组与安慰剂组的AESIs发生率更低(分别为29%和42%)(AESIs)•未在任何受试者的培养中鉴定出SER-155物种赛里斯治疗公司 © 20248

疗效:SER-155给药有利,细菌BSI和全身抗生素暴露均显着*减少;较低的发热性中性粒细胞减少SER-155治疗的血流感染受试者与安慰剂的细菌性血流感染显着减少SER-155治疗的发热性中性粒细胞减少受试者与安慰剂的发热性中性粒细胞减少发生率数值较低所有GI感染均为CDI * *;SER-155治疗的4名受试者(20%)安慰剂中2名GI感染受试者(14.3%)在HSCT第0-100天发生GI感染两组受试者均未发生≥ 3级急性GVHD;每组急性GVHD 2名受试者发生2级急性GVHD SER-155治疗受试者与安慰剂抗菌/抗菌暴露相比,SER-155治疗受试者全身抗菌药物/抗菌药物的平均累积暴露率(天数)显着降低SER-155治疗受试者与安慰剂的累积暴露率*未应用多重调整赛里斯治疗公司 © 20249 * * CDI:艰难梭菌感染探索性次要疗效
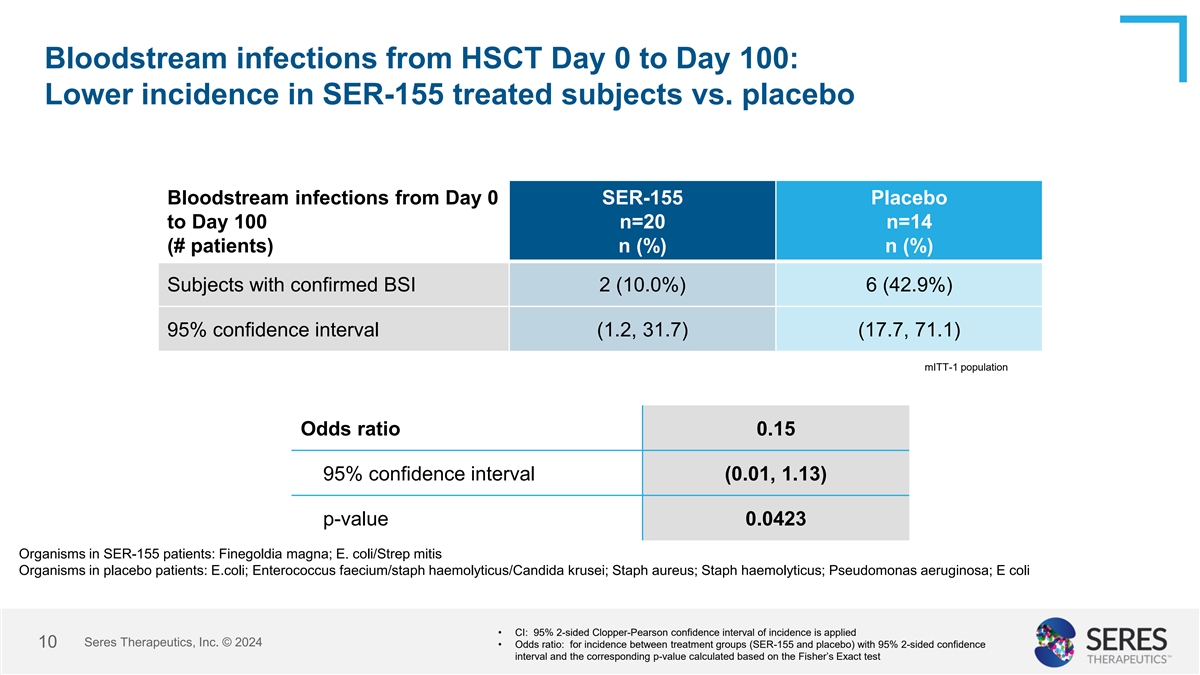
HSCT第0天至第100天的血流感染:SER-155治疗受试者的发病率低于安慰剂从第0天SER-155安慰剂到第100天的血流感染n = 20 n = 14(#患者)n(%)n(%)BSI2确诊受试者(10.0%)6(42.9%)95%置信区间(1.2,31.7)(17.7,71.1)mITT-1人群优势比0.1595%置信区间(0.01,1.13)SER-155患者中p值0.04 23生物体:大非高丽菌;安慰剂患者中的大肠杆菌/Strep mitis生物体:大肠杆菌;粪肠球菌/溶血性葡萄球菌/克鲁塞念珠菌;金黄色葡萄球菌;溶血性葡萄球菌;铜绿假单胞菌;大肠杆菌• CI:应用95% 2面Clopper-Pearson发病率置信区间,赛里斯治疗公司 © 202410 •优势比:用于治疗组(SER-155和安慰剂)之间的发病率,95% 2面置信区间和基于Fisher精确检验计算的相应p值
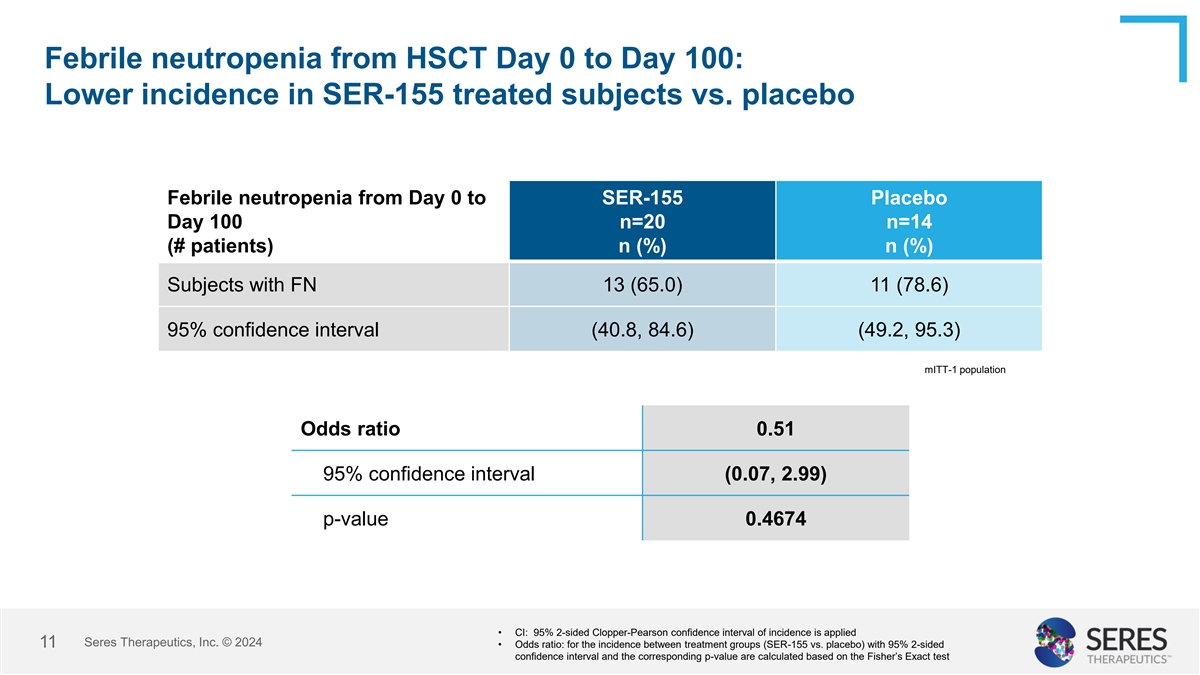
从HSCT第0天到第100天的热性中性粒细胞减少:从第0天到SER-155安慰剂第100天,SER-155治疗受试者的发病率低于安慰剂热性中性粒细胞减少n = 20 n = 14(#患者)n(%)n(%)受试者有FN 13(65.0)11(78.6)95%置信区间(40.8,84.6)(49.2,95.3)mITT-1人群优势比0.5 95%置信区间(0.07,2.99)p值0.4674 • CI:95%的2面Clopper-Pearson发病率置信区间应用了丨Seres Therapeutics 丨赛里斯治疗,Inc. © 202411 •优势比:对于95% 2边置信区间的治疗组(SER-155 vs.安慰剂)之间的发生率,根据Fisher精确检验计算出相应的p值

通过HSCT第100天累计暴露于全身性抗菌药物/抗菌药物:SER-155治疗受试者与安慰剂相比发生率更低累计抗菌或SER-155安慰剂抗菌暴露n = 20 n = 14(HSCT天数)n(%)n(%)均值(SD)9.2(5.44)21.1(20.31)中值9.01 4.0 min,最大值0,190,74 mITT-1人群均值差(95% CI)-11.9(-23.85,-0.04)p值0.04 94 •累计暴露是受试者在HSCT第0天至第100天期间接受全身性抗菌药物和/或抗菌药物的所有天数的总和;每天计数一次,无论服用了多少种药物赛里斯治疗,Inc. © 202412 •基于独立样本的95%置信区间和p值SER-155与安慰剂平均天数差异的t检验
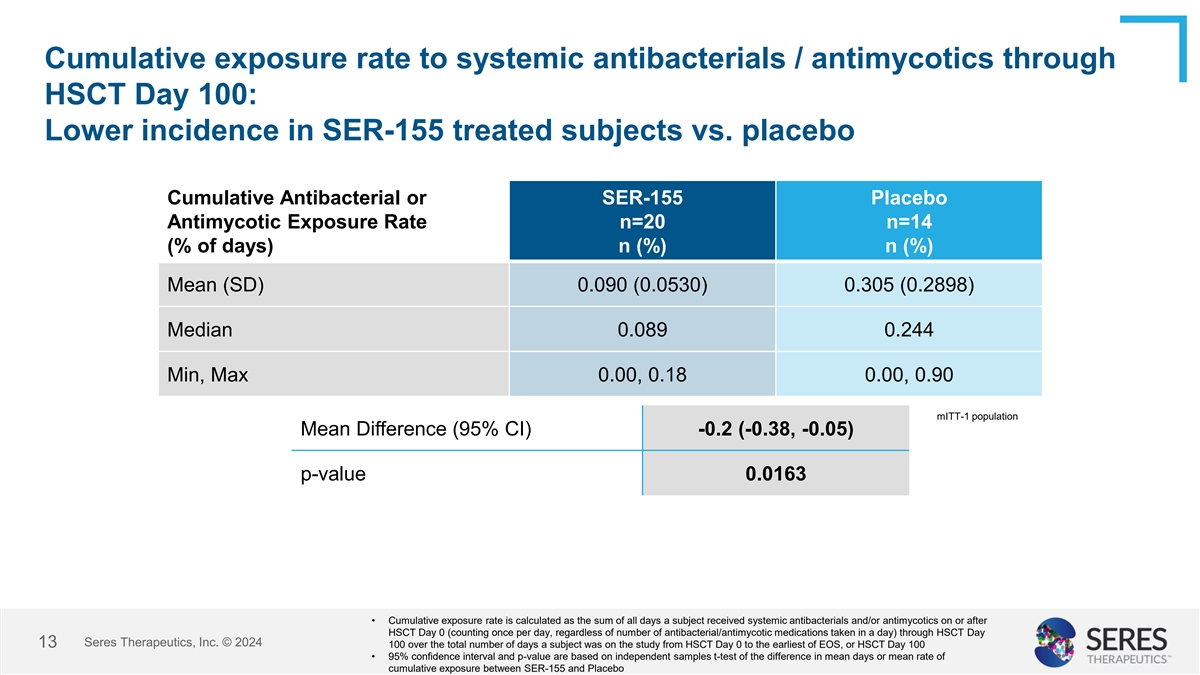
通过HSCT第100天接受全身性抗菌药物/抗菌药物的累积暴露率:SER-155治疗受试者与安慰剂相比发生率更低累积抗菌或SER-155安慰剂抗菌药物暴露率n = 20 n = 14(% of days)n(%)n(%)mean(SD)0.090(0.05 30)0.305(0.2898)中值0.08 90.24 4 min,Max 0.00,0.18 0.00,0.90 mITT-1人群均值差(95% CI)-0.2(-0.38,-0.05)p值0.0163 •累积暴露率计算为受试者在HSCT第0天或之后接受全身性抗菌药物和/或抗菌药物的所有天数的总和(每天计数一次,无论一天内服用了多少抗菌/抗真菌药物)通过HSCT Day(HSCT Day 0至EOS最早,或HSCT Day 100)进行研究的总天数内的赛里斯治疗公司 © 202413100 • 95%置信区间和p值基于SER-155与安慰剂之间平均暴露天数或平均累积暴露率差异的独立样本t检验
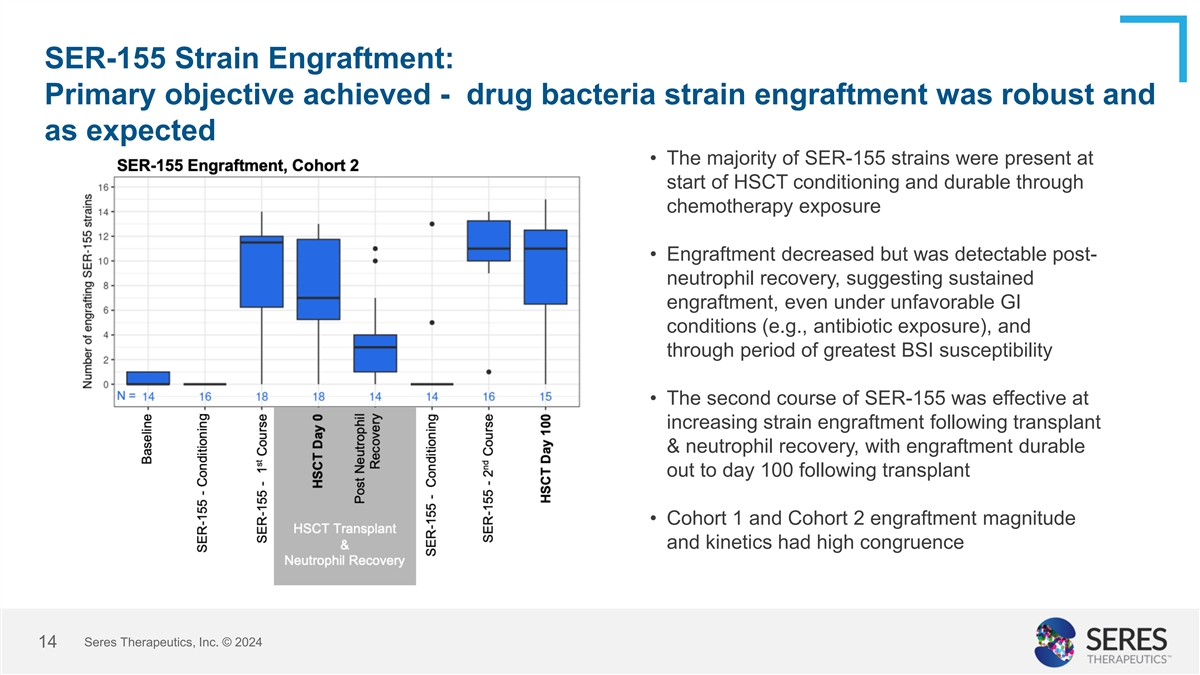
SER-155毒株植入:实现了主要目标-药物细菌菌株植入稳健且符合预期•大多数SER-155毒株在HSCT调理开始时就存在,并通过化疗暴露而持久•植入减少,但在中性粒细胞恢复后可检测到,这表明即使在不利的GI条件下(例如抗生素暴露)也可持续植入,并在BSI最大易感期度过• SER-155的第二个疗程在移植后增加毒株植入&中性粒细胞恢复方面有效,移植后可持续植入至第100天•队列1和队列2的植入幅度和动力学具有高一致性赛里斯治疗公司 © 202414
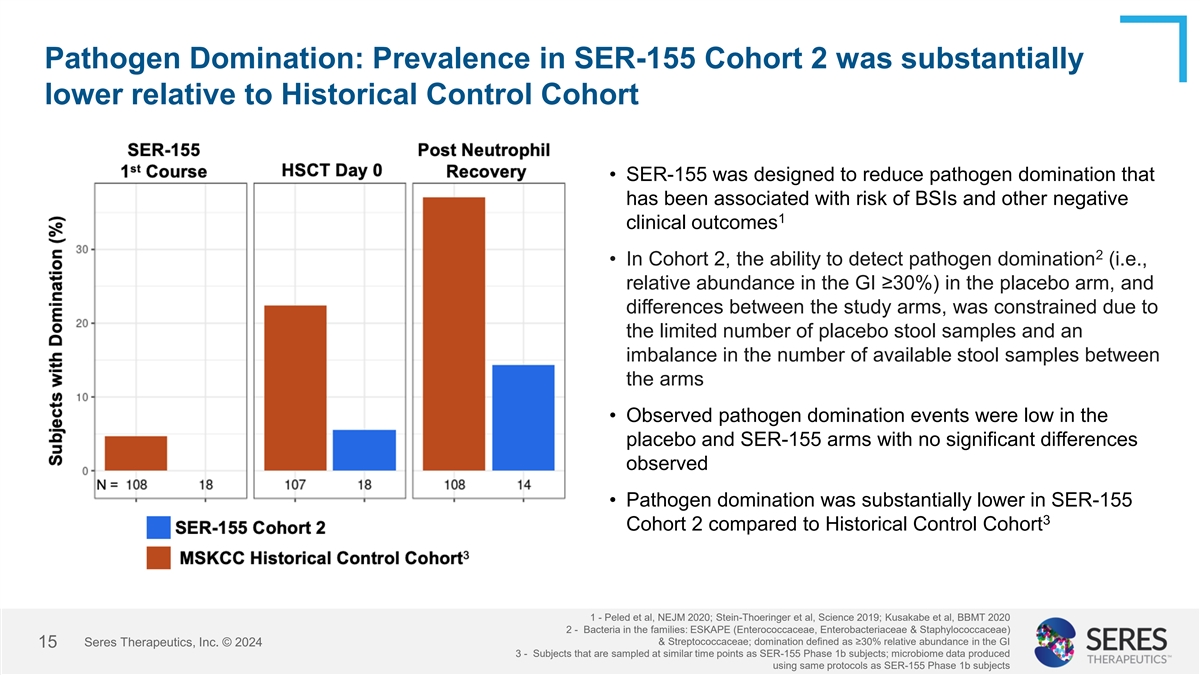
病原体支配:相对于历史对照队列,SER-155队列2的流行率显着降低• SER-155旨在降低与BSI风险和其他阴性1临床结果相关的病原体支配2 •在队列2中,检测安慰剂组病原体支配(即GI中的相对丰度≥ 30%)的能力,以及研究组之间的差异,由于安慰剂粪便样本数量有限以及两组间可用粪便样本数量不平衡•在安慰剂和SER-155组中观察到的病原体支配事件较低,未观察到显着差异•与历史对照队列1相比,SER-155 3队列2中的病原体支配显着降低-Peled等人,NEJM 2020;Stein-Thoeringer等人,Science 2019;Kusakabe等人,BBMT 20202-家族中的细菌:ESKAPE(肠球菌科、肠杆菌科和葡萄球菌)&链球菌科;支配定义为GI中≥ 30%的相对丰度赛里斯治疗,Inc. © 2024153-在与SER-155 1b期受试者相似的时间点采样的受试者;使用与SER-155 1b期受试者相同的协议生成的微生物组数据

摘要和下一步Seres与FDA就推进1期结果进行接触支持Seres的SER-155 allo-HSCT计划战略追求SER-155和其他活体生物治疗药物以预防严重细菌感染•打算在额外的患者中评估SER-155 •考虑到与感染血流感染相关的严重细菌高风险未满足的医疗需求的人群,寻求突破性治疗指定•解决多种医学问题的机会•寻求额外指定(具有SER-155和指定的孤儿药脆弱患者群体,合格的传染病产品)额外管道计划赛里斯治疗公司 © 202416