
2023年9月公司介绍附件 99.1

本演示文稿包含联邦证券法所指的有关Sana Biotechnology, Inc.(“公司”、“我们”、“我们”或“我们的”)的前瞻性陈述。除历史事实陈述外,本演示文稿中的所有陈述,包括(其中包括)关于公司战略、预期、现金流线和未来财务状况、未来运营和前景的陈述,均为前瞻性陈述。在某些情况下,你可以通过诸如“目标”、“预期”、“假设”、“相信”、“考虑”、“继续”、“可能”、“设计”、“到期”、“估计”、“预期”、“目标”、“打算”、“可能”、“目标”、“计划”、“定位”、“潜力”、“预测”、“寻求”、“应该”、“目标”、“将”、“将”等类似表达方式来识别前瞻性陈述,这些表达方式是对未来事件和未来趋势的预测或指示,或者这些术语或其他类似术语的否定。这些前瞻性陈述主要基于公司目前对未来事件和财务趋势的预期、估计、预测和预测,公司认为这些事件和财务趋势可能会影响公司的财务状况、经营业绩、业务战略和财务需求。鉴于这些前瞻性陈述中的重大不确定性,您不应依赖前瞻性陈述作为对未来事件的预测。这些陈述受到风险和不确定性的影响,这些风险和不确定性可能导致实际结果发生重大变化,其中包括药物开发中固有的风险,例如与公司当前和未来研发计划、临床前研究和临床试验的启动、成本、时间、进展和结果相关的风险。有关可能影响公司实际业绩的风险因素的详细讨论,请参阅公司在SEC报告中确定的风险因素,包括其日期为2023年8月3日的10-Q季度报告。除法律要求外,本公司不承担以任何理由公开更新任何前瞻性陈述的义务。关于前瞻性陈述的注意事项

萨那的目标是修复或替换体内的任何细胞。技术解决基本障碍:低免疫(HIP)技术:克服同种异体细胞的免疫排斥Fusogen技术:以细胞特异性方式在体内递送基因组修饰试剂克服同种异体细胞的免疫排斥有可能改变细胞治疗:同种异体CAR T细胞临床表现类似自体CAR T细胞可改变血液系统恶性肿瘤的治疗方法释放干细胞衍生疗法(如胰岛细胞)治疗1型糖尿病潜力的关键2023年有两个明确的临床概念验证机会:SC291:细胞持久性和临床疗效HIP原发性胰岛在1型糖尿病患者中的研究结果将提供CAR T细胞和基于干细胞的平台的见解——克服同种异体基因的能力和自身免疫细胞排斥Pipeline准备在未来几年提供多个临床数据读数:低免疫异基因CAR T细胞:SC291(CD19肿瘤学)、SC291(CD19自身免疫)、SC262(CD22)、SC255(BCMA),以及再生医学:SC451(1型糖尿病)和SC379(中枢神经系统疾病)体内融合原平台:SG299平衡表允许多个数据读数的潜力工程细胞即药物Sana Biotechnology

Pipeline准备在未来几年提供多个临床数据读数Sana的平台、技术和项目1IST,研究者赞助的试验。缩写:ALL,急性淋巴细胞白血病;CLL,慢性淋巴细胞白血病;HD,亨廷顿病;IND,研究新药;NHL,非霍奇金淋巴瘤;PMD,Pelizaeus-Merzbacher病;SCD,镰状细胞病;SPMS,继发性进展性多发性硬化症。候选产品机制潜在适应症潜在临床里程碑202420232024 SC291(HIP)靶向CD19的同种异体CAR T NHL/ALL/CLL HIP原代胰岛细胞11型糖尿病SC291(HIP)靶向CD19的同种异体CAR T自身免疫SG299(Fusogen)体内CAR T(CD8/CD19)NHL/ALL/CLL SC262(HIP)靶向CD22的同种异体CAR T NHL/ALL/CLL SC451(HIP)干细胞衍生胰岛细胞1型糖尿病SC255(HIP)靶向BCMA的同种异体CAR T多发性骨髓瘤SC379胶质祖细胞PMD,HD,SPMS SG239(Fusogen)体内CAR T(CD8/BCMA)多发性骨髓瘤SG242(Fusogen)体内CAR T(CD4/CD19)NHL/ALL/CLL SG221(Fusogen)体内CAR T(CD4/BCMA)多发性骨髓瘤SG233(Fusogen)体内CAR T(CD8/CD22)NHL/ALL/CLL SG418(Fusogen)体内造血干细胞SCD、β-Thalessemia IND备案临床数据
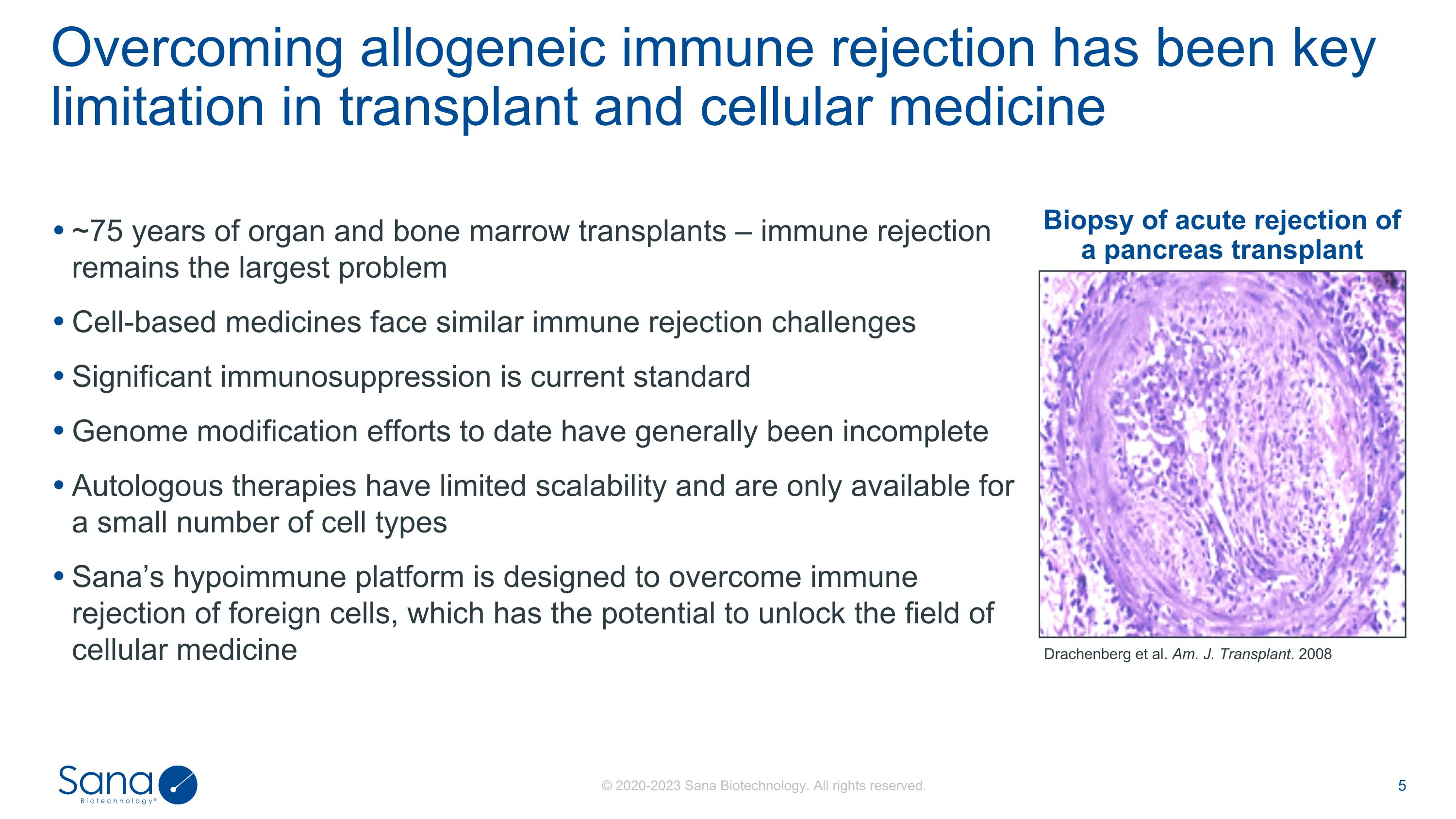
器官和骨髓移植约75年——免疫排斥仍是最大问题基于细胞的药物面临类似的免疫排斥挑战重要的免疫抑制是目前的标准基因组修饰工作迄今普遍不完整自体疗法的可扩展性有限,仅适用于少数几种细胞类型Sana的低免疫平台旨在克服外来细胞的免疫排斥,这有可能打开细胞医学领域克服异体免疫排斥一直是移植和细胞医学领域的关键限制,Drachenberg等人。J.移植。2008年胰腺移植急性排斥反应活检
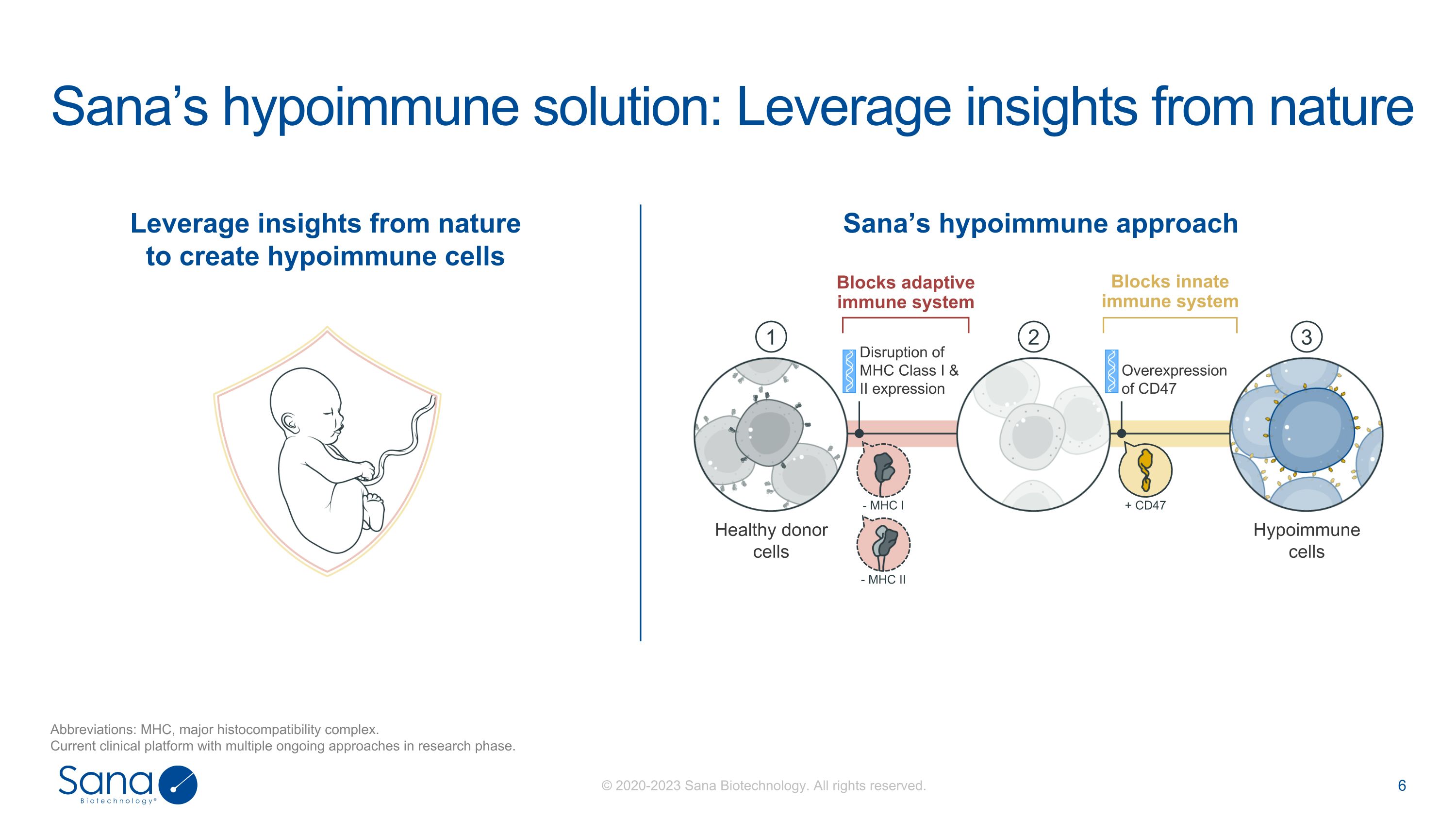
Sana的低免疫解决方案:利用来自自然的洞见缩写:MHC,主要组织相容性复合体。目前的临床平台与多个正在进行的方法在研究阶段。利用来自大自然的洞见创造低免疫细胞Sana的低免疫方法+ CD47-MHC I-MHC II健康供体细胞低免疫细胞MHC I和II类表达的破坏CD47的过度表达123阻断适应性免疫系统阻断先天免疫系统
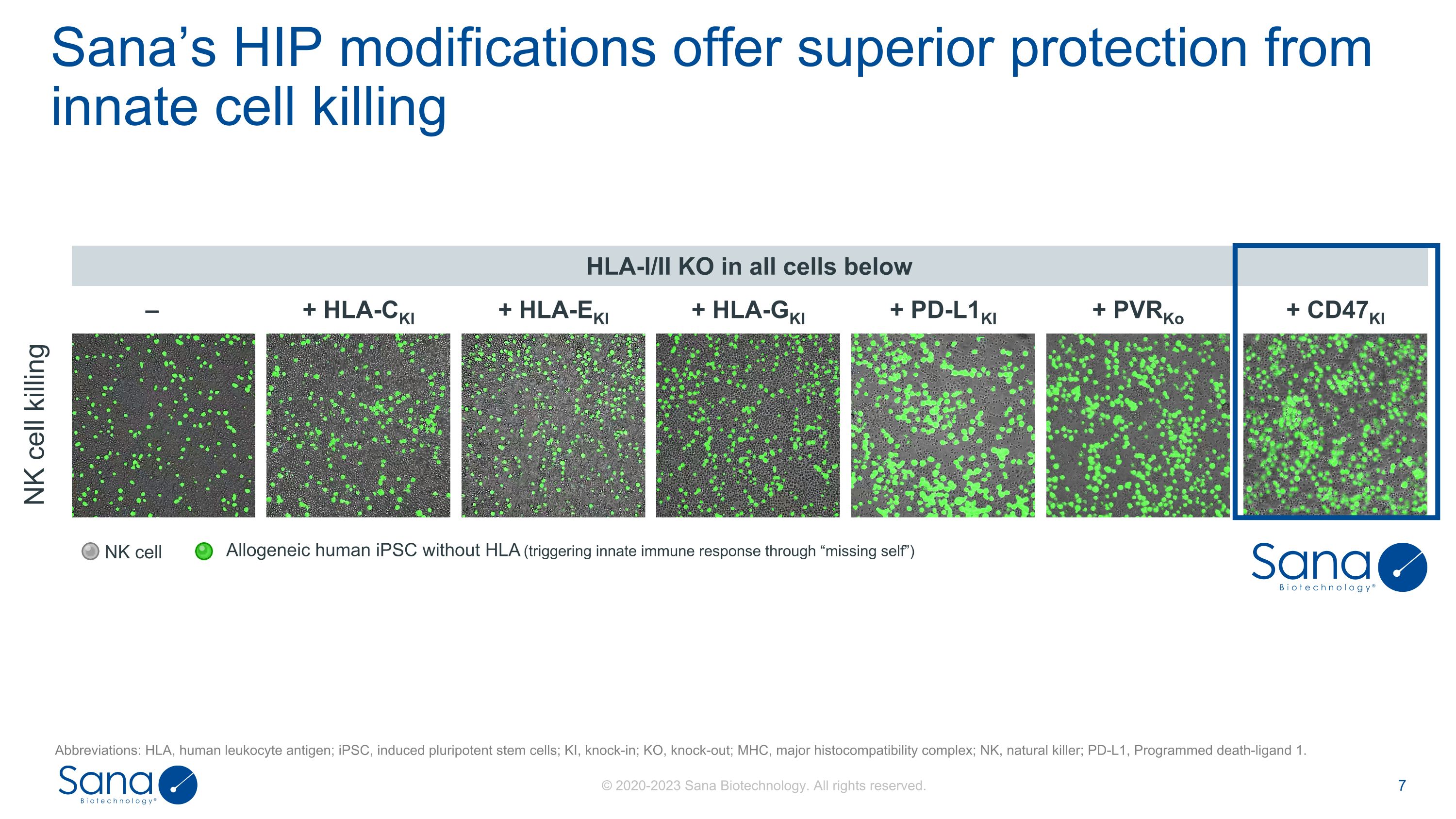
+ CD47KI + PD-L1KI + HLA-EKI + HLA-GKI + HLA-CKI HLA-I/II KO in all cells below – + PVRKo Sana’s HIP modifies provide excellent protection from innate cell killing Allogenic human iPSC without HLA(triggering innate immune response through“missing self”)abbreviations:HLA,人类白细胞抗原;iPSC,诱导多能干细胞;KI,knock-in;KO,knock-out;MHC,主要组织相容性复合体;NK,自然杀伤;PD-L1,程序性死亡配体1。NK细胞杀伤NK细胞
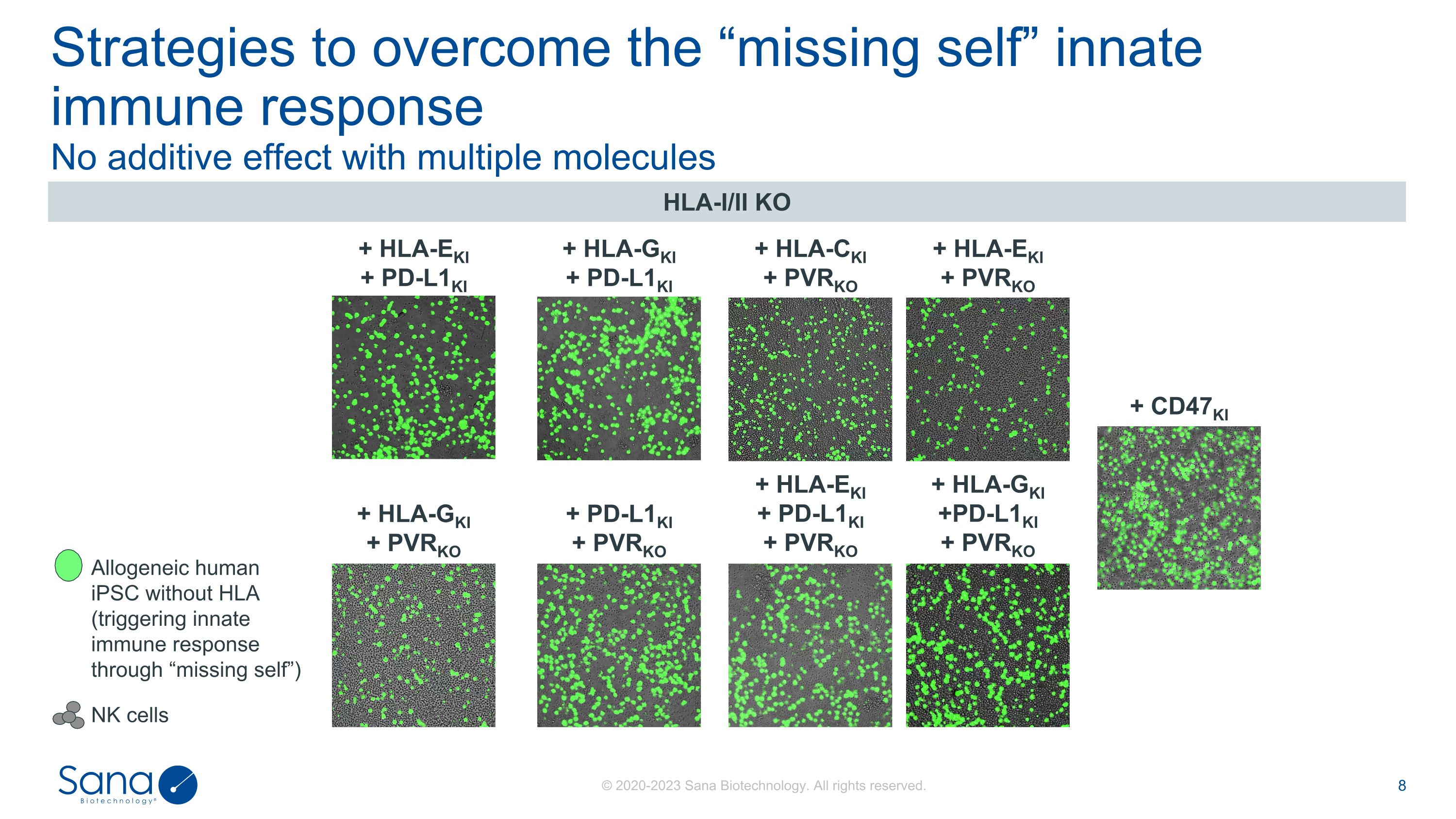
多分子无累加效应克服“缺失自我”先天免疫应答的策略HLA-I/II KO + CD47KI + HLA-CKI + PVRKO + HLA-EKI + PD-L1KI + PVRKO + PVRKO + HLA-GKI + PD-L1KI + PVRKO + PVRKO + HLA-GKI + HLA-GKI + PVRKO + HLA-EKI + PD-L1KI + PD-L1KI + PVRKO + HLA-GKI + PD-L1KI无HLA的同种异体人iPSC(通过“缺失自我”触发先天免疫应答)NK细胞
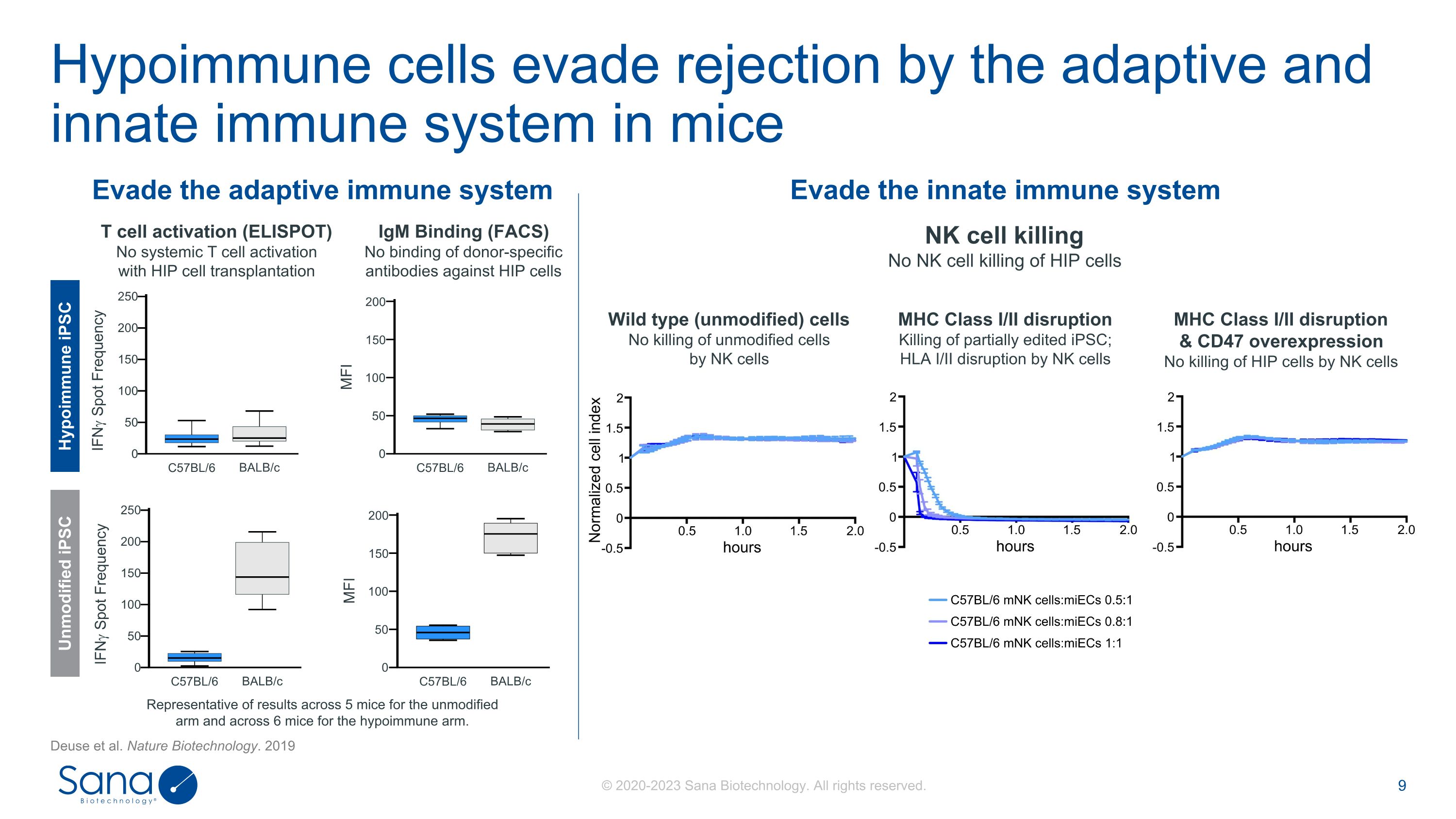
低免疫细胞通过小鼠的适应性和先天免疫系统逃避排斥Deuse等Nature Biotechnology。2019年T细胞活化(ELISPOT)HIP细胞移植无全身性T细胞活化IgM Binding(FACS)无针对HIP细胞的供体特异性抗体NK细胞杀伤HIP细胞野生型(未修饰)细胞NK细胞杀伤未修饰细胞NK细胞MHC I/II类破坏NK细胞杀伤未修饰细胞部分编辑的iPSC;HLA I/II类破坏NK细胞MHC I/II类破坏& CD47过表达NK细胞杀伤HIP细胞NK细胞未修饰的5只小鼠和低免疫的6只小鼠的代表性结果。低免疫性iPSC C57BL/6 BALB/c MFI 200150010050 C57BL/6 BALB/c IFN Spot Frequency 250200010050150 Unmodified iPSC C57BL/6 BALB/c MFI 200150010050 C57BL/6 BALB/c IFN Spot Frequency 250200010050150 Evade the adaptive immunity system Evade the innate immunity system
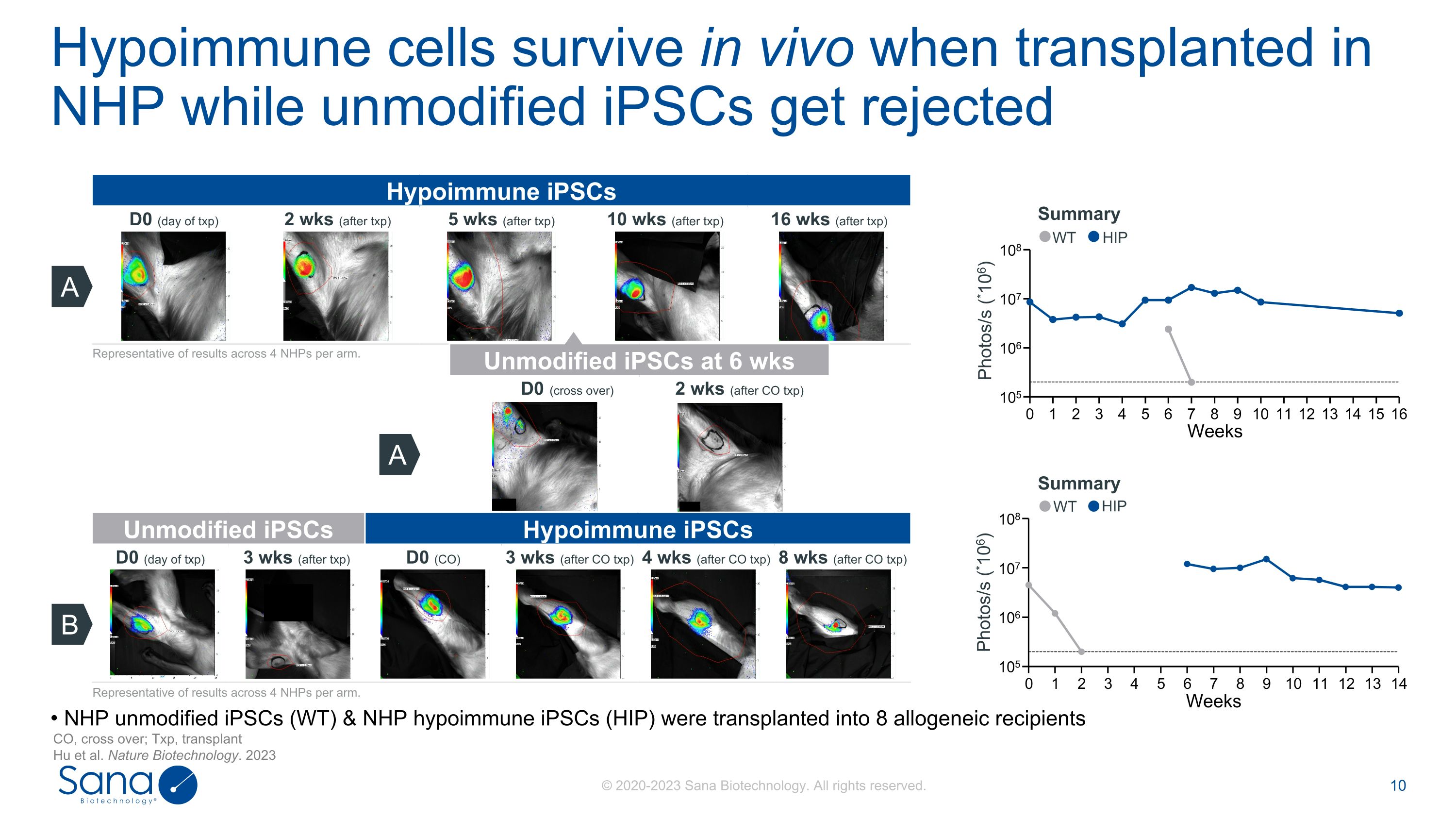
低免疫细胞在移植到NHP时在体内存活,而未修饰的iPSC被排斥CO,crossover;Txp,transplant Hu等人。Nature Biotechnology。2023 A Photos/s(* 106)0123456789 1011121314105106107108 Weeks Hypoimmune iPSCs D0(day of txp)2 wks(after txp)5 wks(after txp)10 wks(after txp)16 wks(after txp)0123456789 10111213141516105 106107108 Weeks Photos/s(* 106)Summary A Unmodified iPSCs at 6 wks D0(cross over)2 wks(after CO txp)NHP unmodified iPSCs(WT)& NHP hypoimmune iPSCs(HIP)被移植到8个同种异体每组4个国家卫生计划成果的代表。未修改的iPSCs低免疫iPSCs D0(txp日)3 wks(after txp)D0(CO)3 wks(after CO txp)4 wks(after CO txp)8 wks(after CO txp)B代表每组4个NHP的结果。WT WT HIP HIP
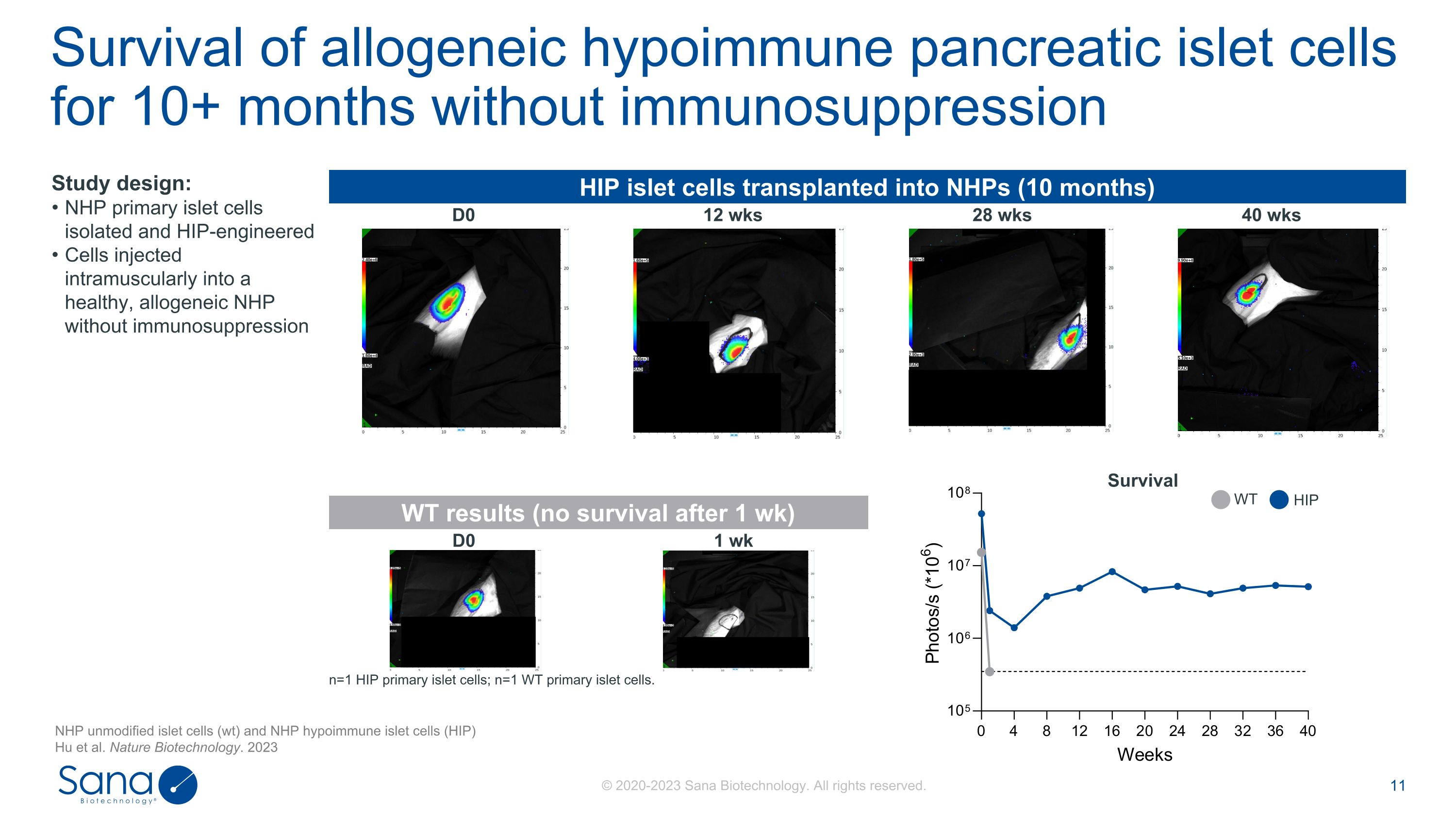
HIP胰岛细胞移植到NHPs(10个月)D0 12周28周40周WT结果(1周后无存活)D0 1周n = 1个HIP原代胰岛细胞;n = 1个WT原代胰岛细胞。无免疫抑制的同种异体低免疫胰岛细胞存活10 +月研究设计:NHP原代胰岛细胞分离和HIP工程细胞肌肉注射到无免疫抑制的健康同种异体NHP中存活NHP未修饰的胰岛细胞(wt)和NHP低免疫胰岛细胞(HIP)Hu等人。Nature Biotechnology。2023年HIP WT
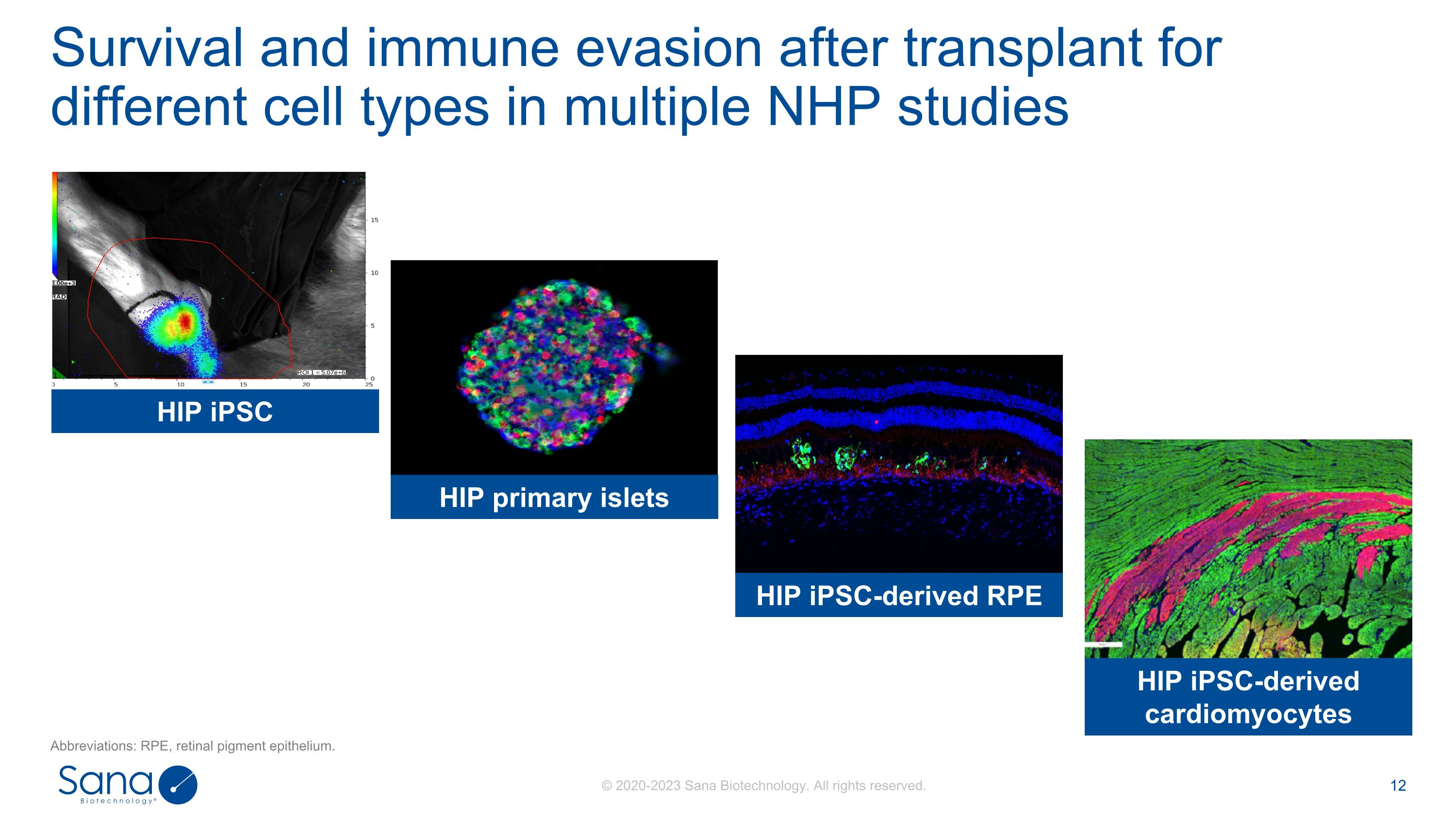
多项NHP研究中不同细胞类型移植后的存活和免疫逃避简称:RPE,视网膜色素上皮。HIP原发性胰岛HIP iPSC-derived RPE HIP iPSC-derived心肌细胞HIP iPSC

萨那的团队开创了低免疫技术
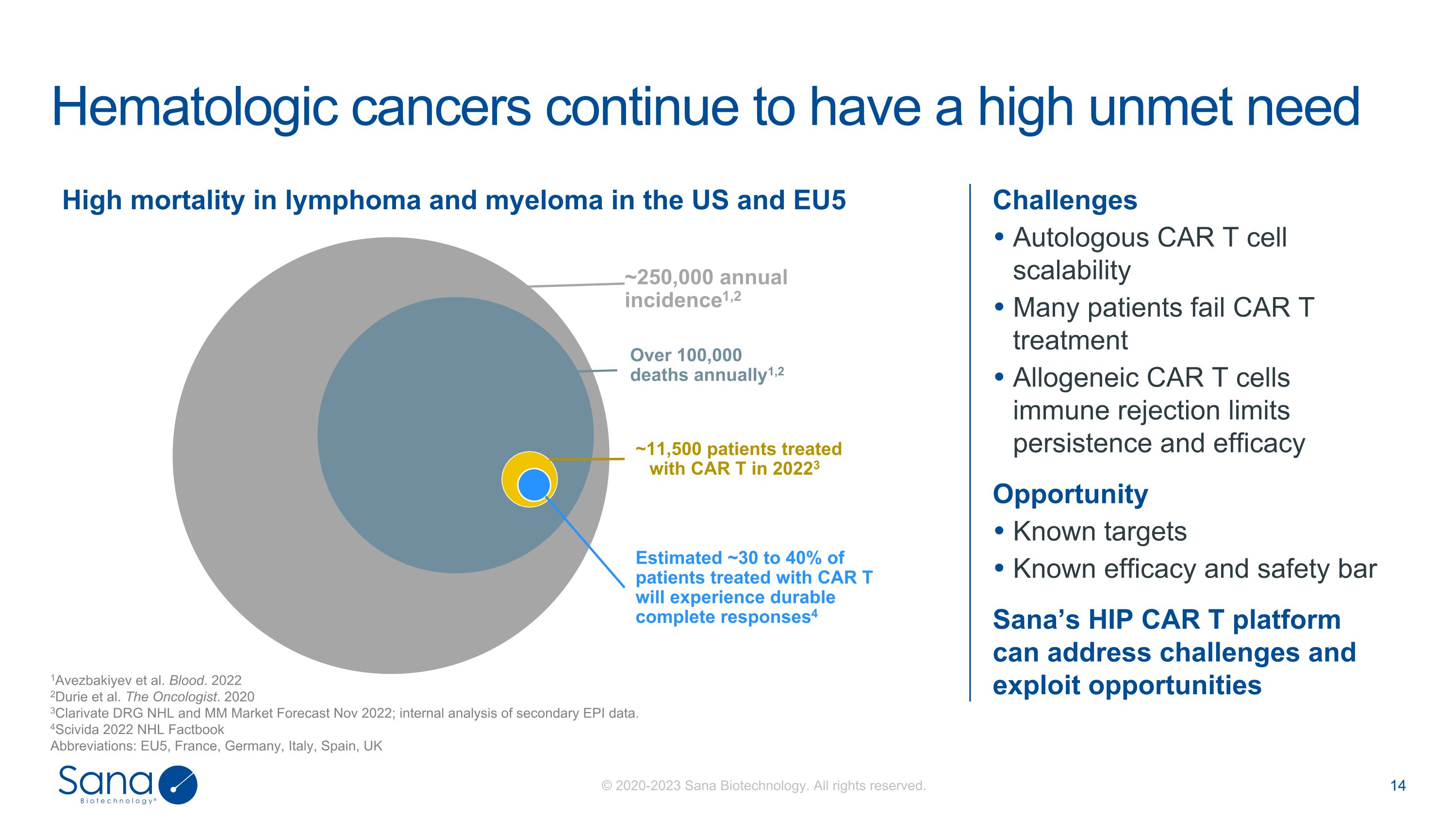
挑战自体CAR T细胞可扩展性许多患者CAR T治疗失败同种异体CAR T细胞免疫排斥限制持久性和有效性机会已知目标已知的有效性和安全性,Sana的HIP CAR T平台可以应对挑战并利用机遇1Avezbakiyev等人的血液仍有很高的未满足需求。2022 2Durie et al. The Oncologist。2020年3Clarivate DRG NHL和MM市场预测2022年11月;二级EPI数据的内部分析。4Scivida 2022 NHL Factbook缩略语:EU5、法国、德国、意大利、西班牙、英国美国淋巴瘤和骨髓瘤死亡率高,每年发病率EU5~250,000,2每年死亡人数超过100,000人1,2~11,500名接受CAR T治疗的患者在20223年估计约30%至40%接受CAR T治疗的患者将经历持久的完全缓解4
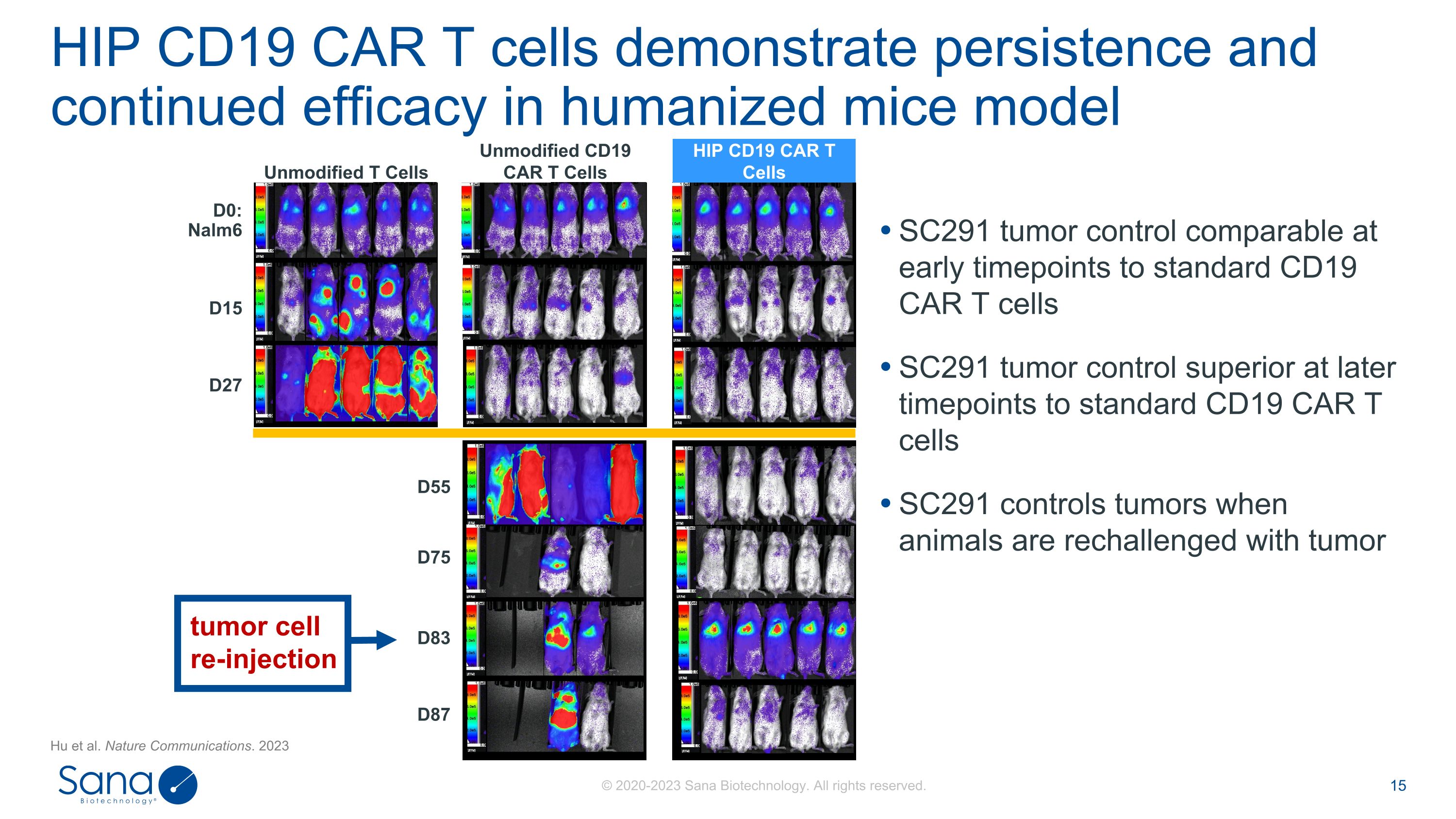
D55 D87 D75 D83 SC291在早期时间点的肿瘤控制与标准CD19 CAR T细胞相当SC291在后期时间点的肿瘤控制优于标准CD19 CAR T细胞SC291在用肿瘤HIP再攻击动物时控制肿瘤CD19 CAR T细胞在人源化小鼠模型D0:Nalm6 D15 D27未修饰的CD19 CAR T细胞未修饰的T细胞HIP CD19 CAR T细胞肿瘤细胞再注射中表现出持续和持续的疗效。Nature Communications。2023
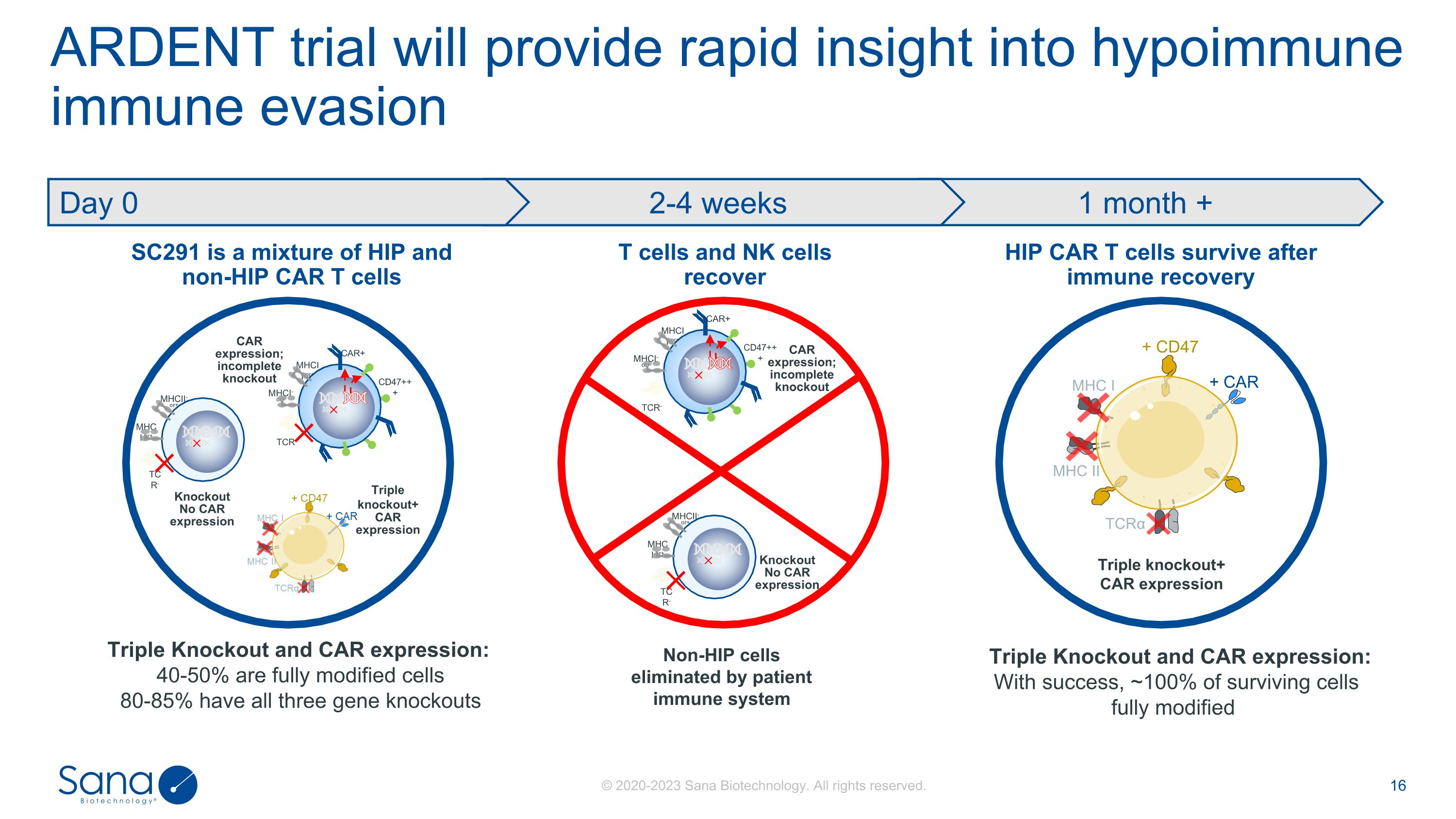
ARDENT试验将提供快速洞察低免疫免疫逃避SC291是HIP和非HIP CAR T细胞的混合物HIP CAR T细胞存活后免疫恢复T细胞和NK细胞恢复Triple Knockout和CAR表达:40-50 %是完全修饰的细胞80-85 %具有全部三种基因敲除Non-HIP细胞被患者免疫系统清除三重敲除+ CAR表达CAR表达;不完全敲除MHCI-或+ TCR-CAR + CD47 +++ MHCI-或+ MHCI-或+ MHCI-或+ TCR-MHCI-或+敲除无CAR表达三重敲除+ CAR表达MHC I MHCII TCR α + CAR + CD47 1个月+ 2-4周第0天CAR表达;不完全敲除MHCI-或+ TCR-CAR + CD47 +++ MHCI-或+ MHCI-或+ TCR-MHCI-或+敲除无CAR表达三重敲除和CAR表达:成功后
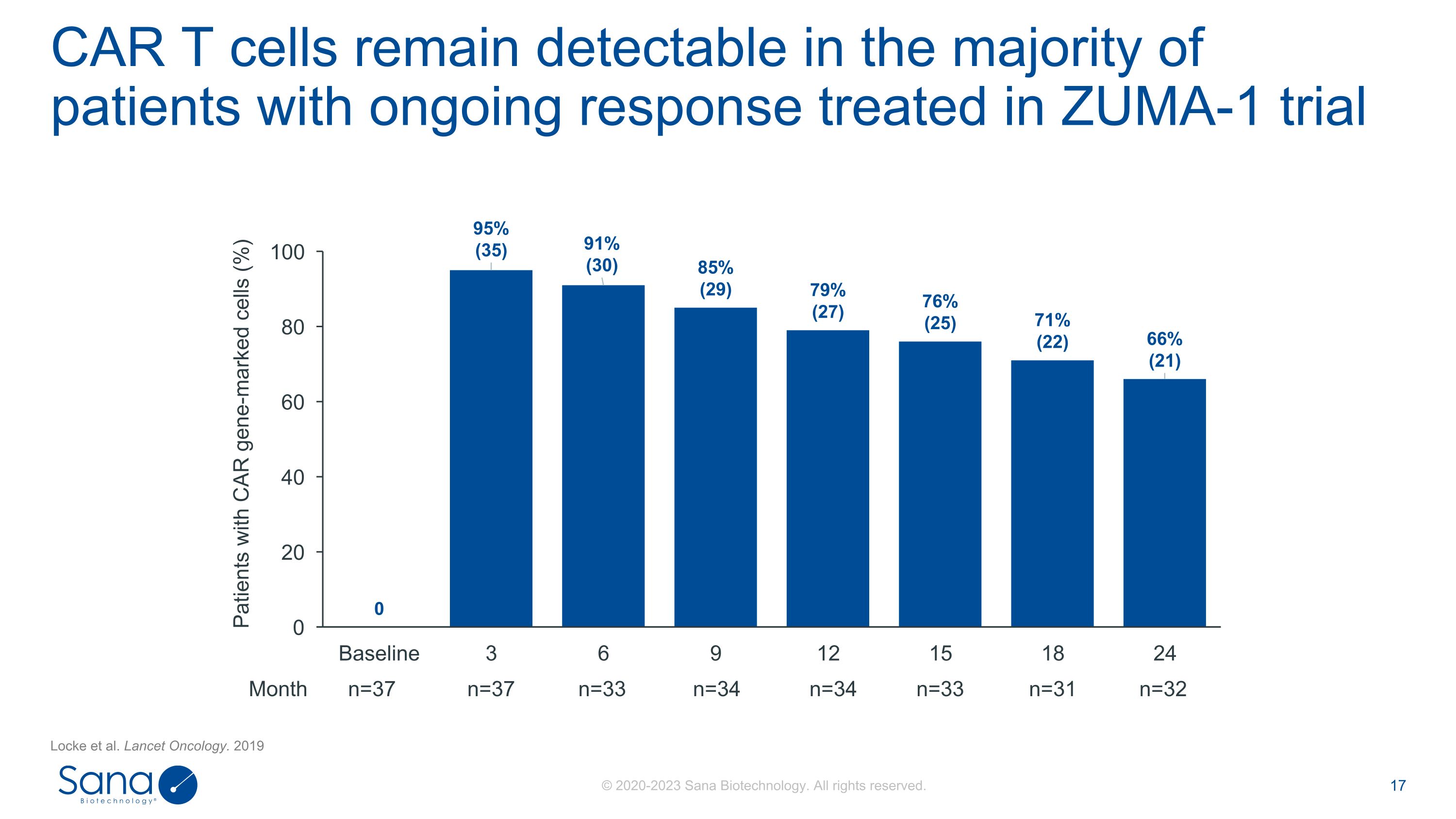
洛克等人。柳叶刀肿瘤学。2019 CAR T细胞在ZUMA-1试验治疗的大多数持续应答患者中仍可检测到CAR基因标记细胞患者(%)月n = 37 n = 37 n = 33 n = 34 n = 34 n = 33 n = 31 n = 32

SC291:Sana的CD19 HIP同种异体CAR T 2023年首次临床数据数据显示CAR T细胞持久性与长期完全应答(CRs)率相关1改善持久性可导致同类最佳的同种异体CAR T平台CAR T持久性潜在疗效结果≤ 1个月可比现有Allo CAR T2至3个月同类最佳Allo CAR T3至6个月可比Auto CAR T ≥ 6个月优于Auto CAR T同种异体HIP CAR T细胞MHC I MHC II TCR α + CD19 CAR + CD47 1Porter等人。科学转化医学。2015

CAR T细胞具有改变自身免疫性疾病的潜力,就像它们在血癌中一样B细胞耗竭程度与临床获益相关CD19 CAR T细胞治疗导致深度B细胞耗竭提供持久长期缓解的潜力SC291具有改变患者结果的规模和潜力概况来自肿瘤学研究的可供使用的近期跨多个疾病的PoC研究针对多个自身免疫性疾病的B细胞靶向验证改编自Zhang等人的免疫学前沿。2023;Oh et al. Immune Network。2023;Lee et al. Nature reviews Drug Discovery。2021 Field has spent 25 + years identifying系统性红斑狼疮(SLE)Lupus Nephritis Vasculitis(肉芽肿病伴多血管炎&显微镜下多血管炎)Neuromyelitis optical spectrum Pemphigus Relapsing and progressive MS Rematoid关节炎Sjogren syndrome NMDAR脑炎血小板减少性紫癜淀粉样变性硬皮病自身免疫性溶血性贫血慢性免疫性脱髓鞘性多根神经病免疫介导的坏死性肌病膜性肾病
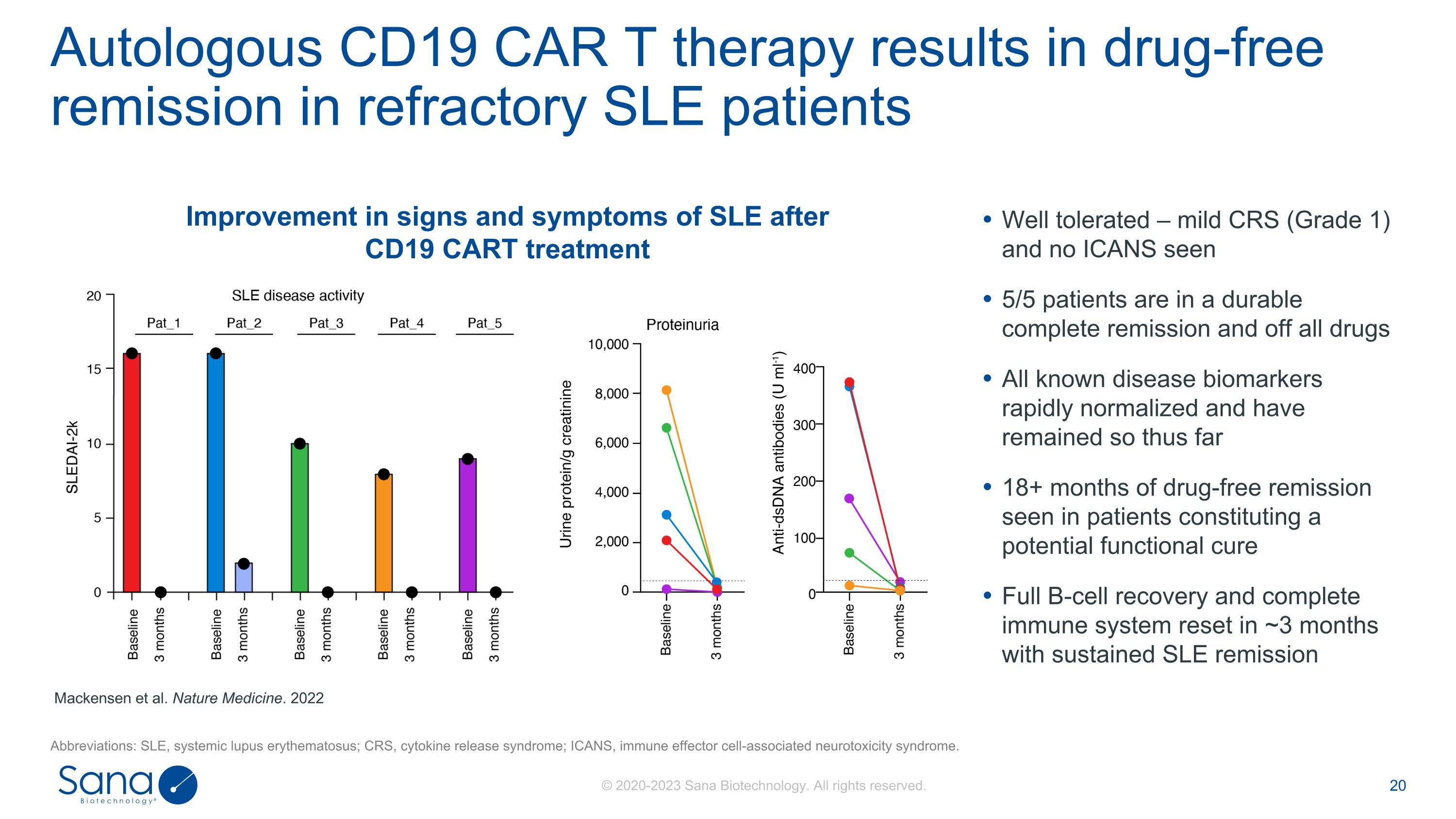
自体CD19 CAR T治疗导致难治性SLE患者无药物缓解简称:SLE,系统性红斑狼疮;CRS,细胞因子释放综合征;ICANS,免疫效应细胞相关神经毒性综合征。Mackensen等人,《自然医学》杂志。2022 CD19 CART治疗后SLE体征和症状的改善耐受性良好——轻度CRS(1级)和未见ICANS 5/5的患者处于持久完全缓解状态,并停用所有药物所有已知的疾病生物标志物迅速正常化,迄今保持18个月以上无药物缓解,在构成潜在功能性治愈的患者中观察到完全B细胞恢复和完全免疫系统在约3个月内复位,SLE持续缓解

SC291候选产品提供了解决各种自身免疫性疾病中大量未满足需求的潜力SC291:CD19 HIP异体CAR T用于治疗自身免疫性疾病异体HIP CAR T细胞MHC I MHC II TCR α + CD19 CAR + CD47 > 75不同类型的自身免疫性疾病具有高度未满足需求和潜在的B细胞病理狼疮性肾炎在美国仅影响~10万人利用SC291 1期供应获得潜在的快速临床路径预计2023年Q4提交IND,2024年获得临床数据
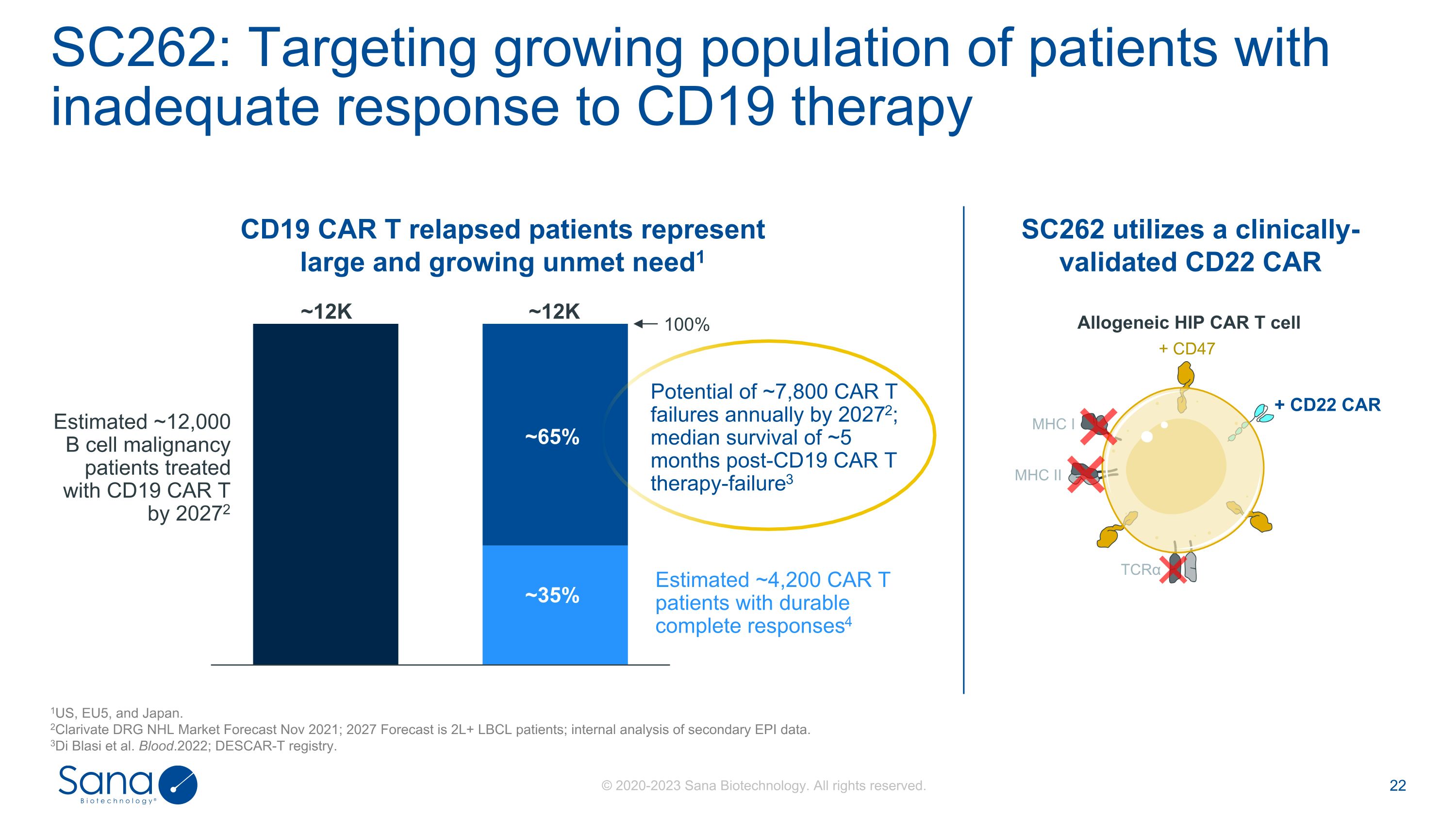
SC262:针对越来越多对CD19疗法1US、EU5和日本反应不足的患者。2Clarivate DRG NHL市场预测2021年11月;2027年预测为2L + LBCL患者;二次EPI数据的内部分析。3Di Blasi et al. Blood.2022;DESCAR-T registry。~65%~35% 100%~12K~12K到20272年CAR T失败的可能性为每年~7800例;CD19 CAR T治疗失败后的中位生存期为~5个月3到20272年估计约有12000例B细胞恶性肿瘤患者接受CD19 CAR T治疗估计约有4200例CAR T患者具有持久的完全应答4同种异体HIP CAR T细胞CD19 CAR T复发患者代表巨大且不断增长的未满足需求1 SC262利用经临床验证的CD22 CAR MHC I MHC II TCR α + CD47 + CD22 CAR
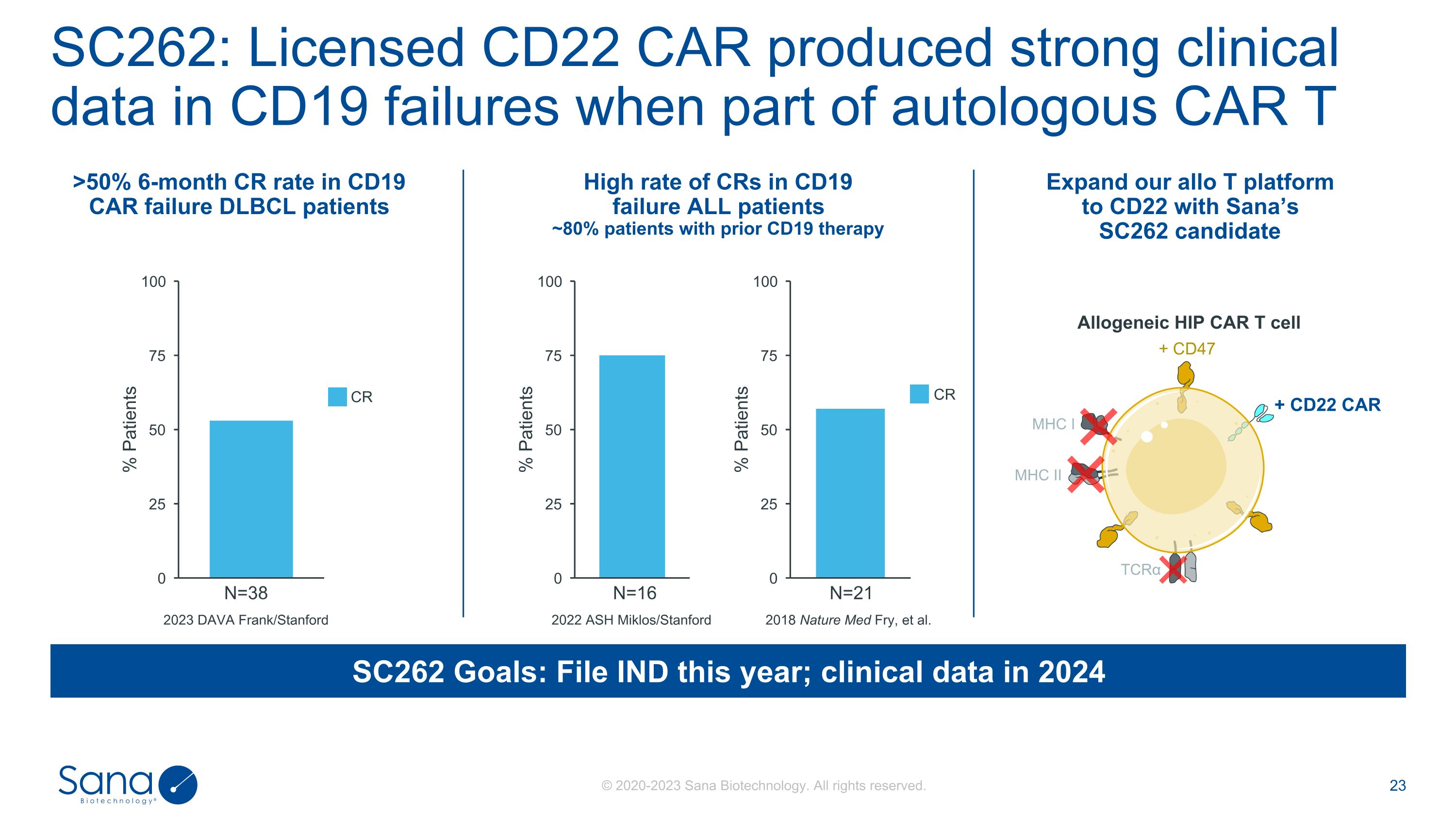
2023 DAVA Frank/Stanford SC262目标:今年提交IND;2024年临床数据N = 38 SC262:当部分自体CAR T N = 16N = 21 > 50% CD19 CAR失败DLBCL患者6个月CR率> 50%时,许可CD22 CAR在CD19失败中产生强有力的临床数据CD19失败ALL患者中CR率高~80%已接受CD19治疗的患者2022 ASH Miklos/Stanford 2018 Nature Med Fry,et al. Expand our allo T platform to CD22 with Sana的SC262候选异基因HIP CAR T细胞MHC I MHC II + CD47 + CD22 CAR TCR α CR CR
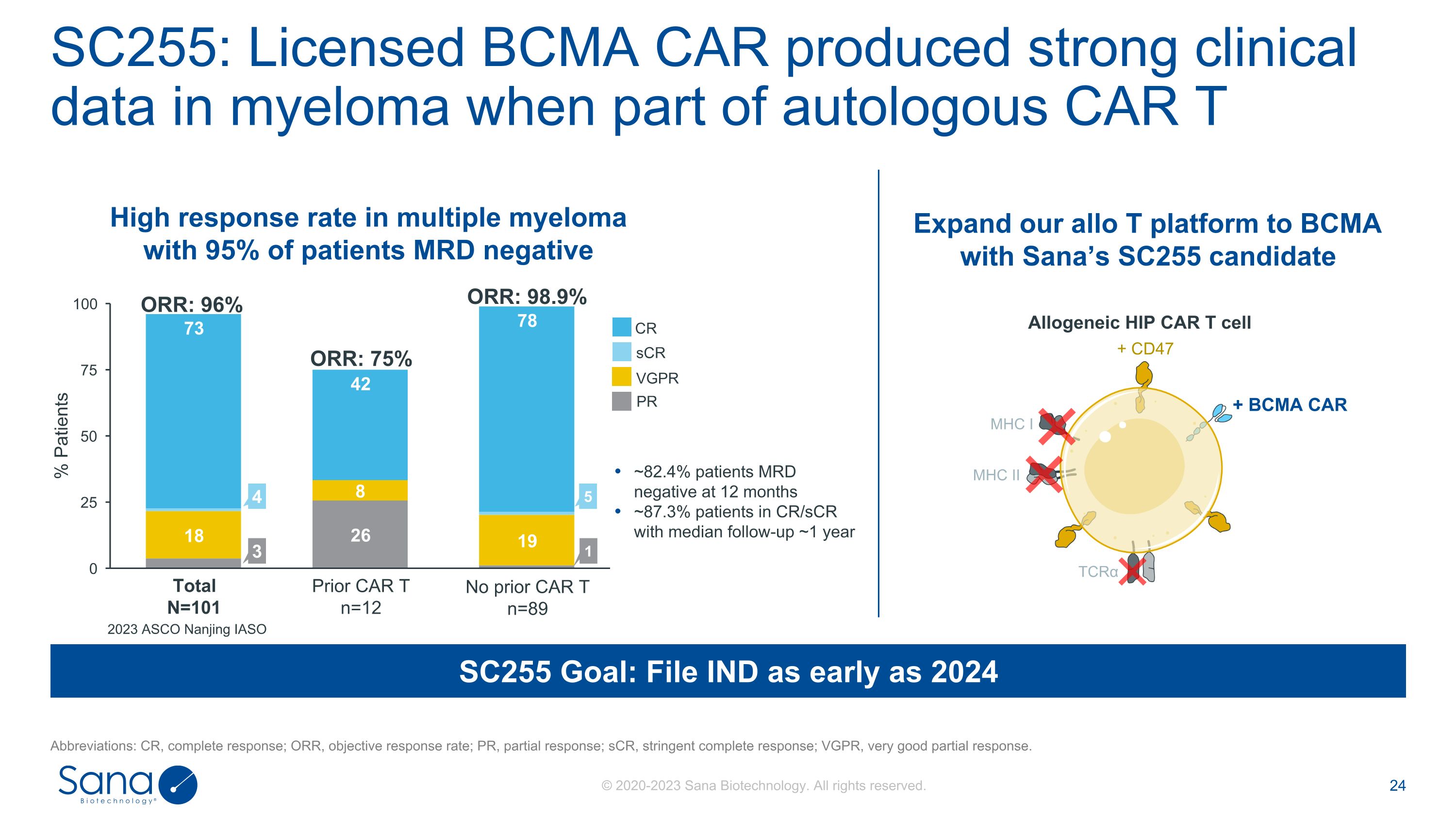
SC255:Licensed BCMA CAR produced strong clinical data in myeloma when part of autologous CAR T43 ORR:98.9% 5 ORR:96% ORR:75% Total N = 101 SC255 Goal:File IND as early as 2024 Prior CAR T n = 12 No prior CAR T n = 891~82.4% patients MRD negative at 12 months~87.3% patients in CR/sCR with median follow-up~1 ye2023 ASCO Nanjing IASO Expand our allo T platform to BCMA with Sana’s SC255 candidate 95% patients MRD negative allogeneHIP CAR T cell客观应答率;PR,部分应答;sCR,严格完全应答;VGPR,非常好的部分应答。MHC I MHC II TCR α + BCMA CAR + CD47 CR sCR VGPR PR
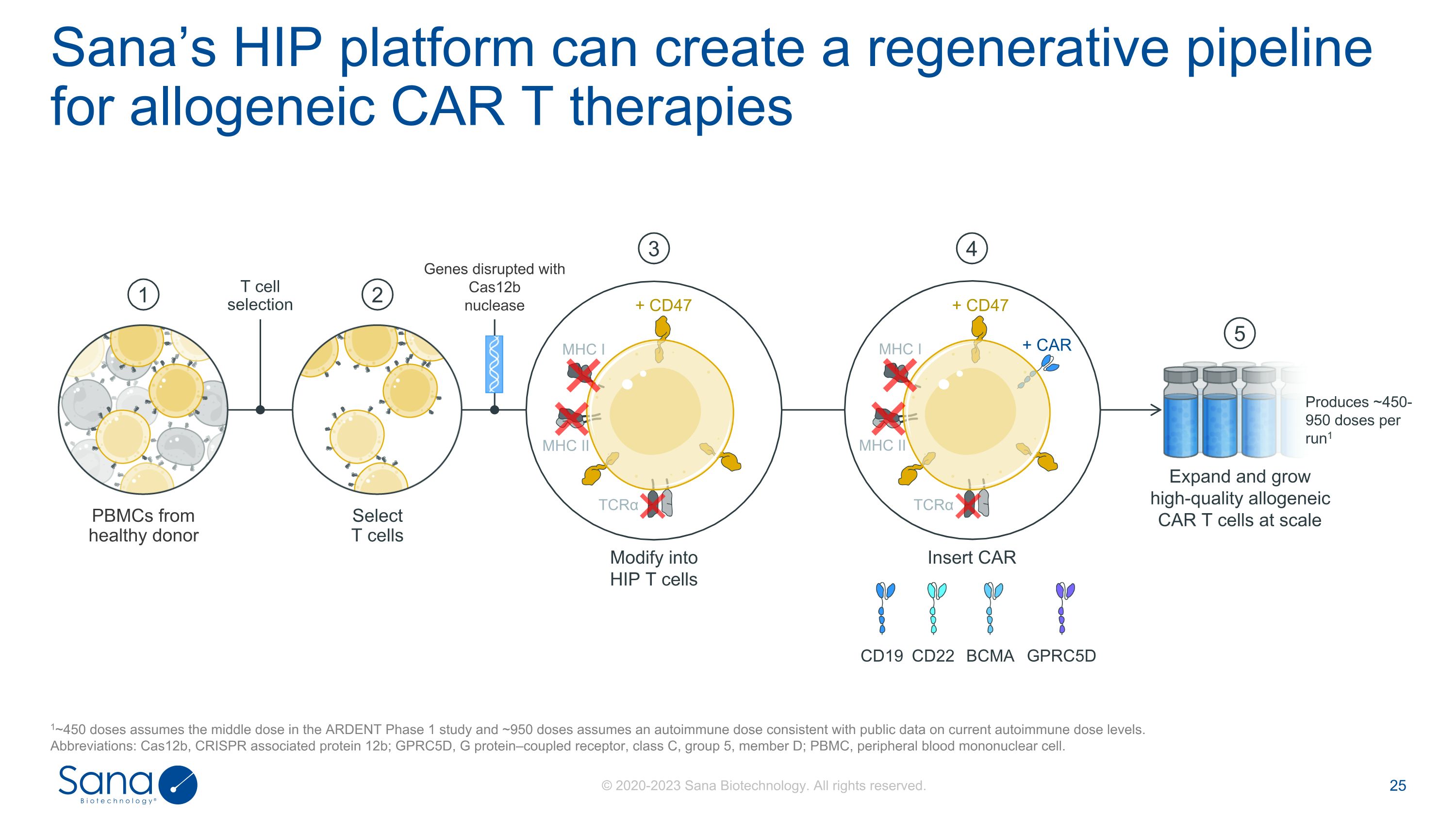
Sana的HIP平台可以为同种异体CAR T疗法创建一个再生管道。在ARDENT 1期研究中,1~450剂假设的是中间剂量,而约950剂假设的是与当前自身免疫剂量水平的公开数据一致的自身免疫剂量。缩写:Cas12b,CRISPR相关蛋白12b;GPRC5D,G蛋白偶联受体,C类,第5组,成员D;PBMC,外周血单个核细胞。来自健康供体的PBMC 12选择T细胞T细胞选择扩展和生长高质量的同种异体CAR T细胞5修饰为HIP T细胞3用Cas12b核酸酶破坏基因插入CAR4 CD22 CD19 BCMA GPRC5D产生~450-950剂量每run1 + CD47 MHC I MHC II TCR α MHC I MHC II TCR α + CAR + CD47

胰腺中产生胰岛素的β细胞的自身免疫性破坏引起的疾病;导致无法控制血糖的结果1型糖尿病是一个巨大的未满足需求,美国有190万患者,欧洲有240万患者2长期并发症:终末器官损伤,包括心脏病发作、中风、失明和肾衰竭SC451的目标是在没有外源性胰岛素或免疫抑制的情况下血糖正常1型糖尿病代表一个巨大的未满足需求,生命损失约15年1Rawshani等人。柳叶刀。2018年2Clarivate 1型糖尿病前景与预测,2022年12月;二级EPI数据的内部分析。数码相机/科学图片库
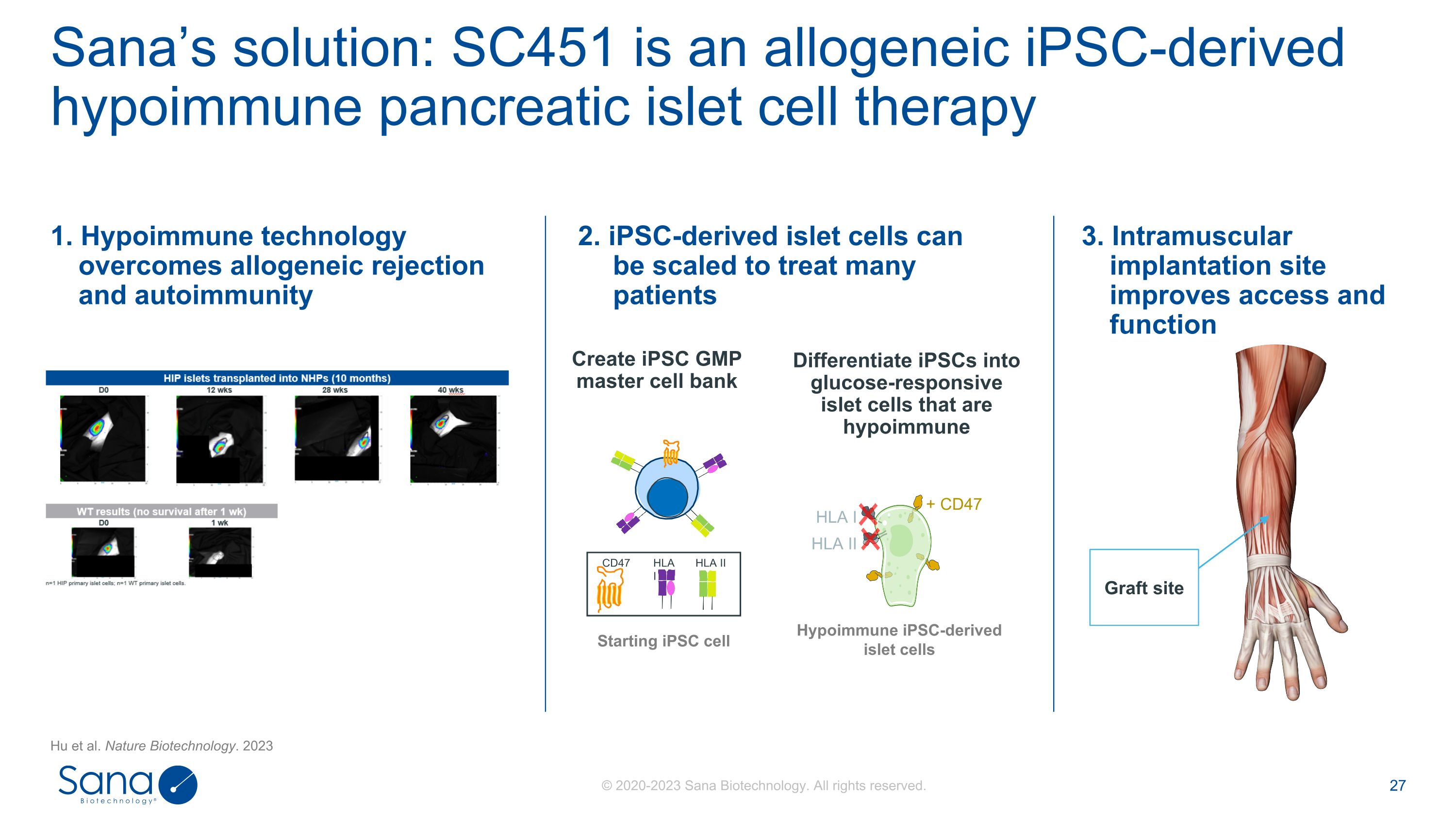
Sana的解决方案:SC451是一种同种异体iPSC衍生的低免疫胰岛细胞疗法Hu et al. Nature Biotechnology。2023将iPSC分化为低免疫+ CD47 HLA I HLA II的葡萄糖反应性胰岛细胞低免疫iPSC衍生的胰岛细胞创建iPSC GMP主细胞库启动iPSC细胞CD47 HLA I HLA II 1。低免疫技术克服异体排斥和自身免疫3。肌内植入部位改善通路和功能2. iPSC衍生的胰岛细胞可缩放治疗许多患者移植部位
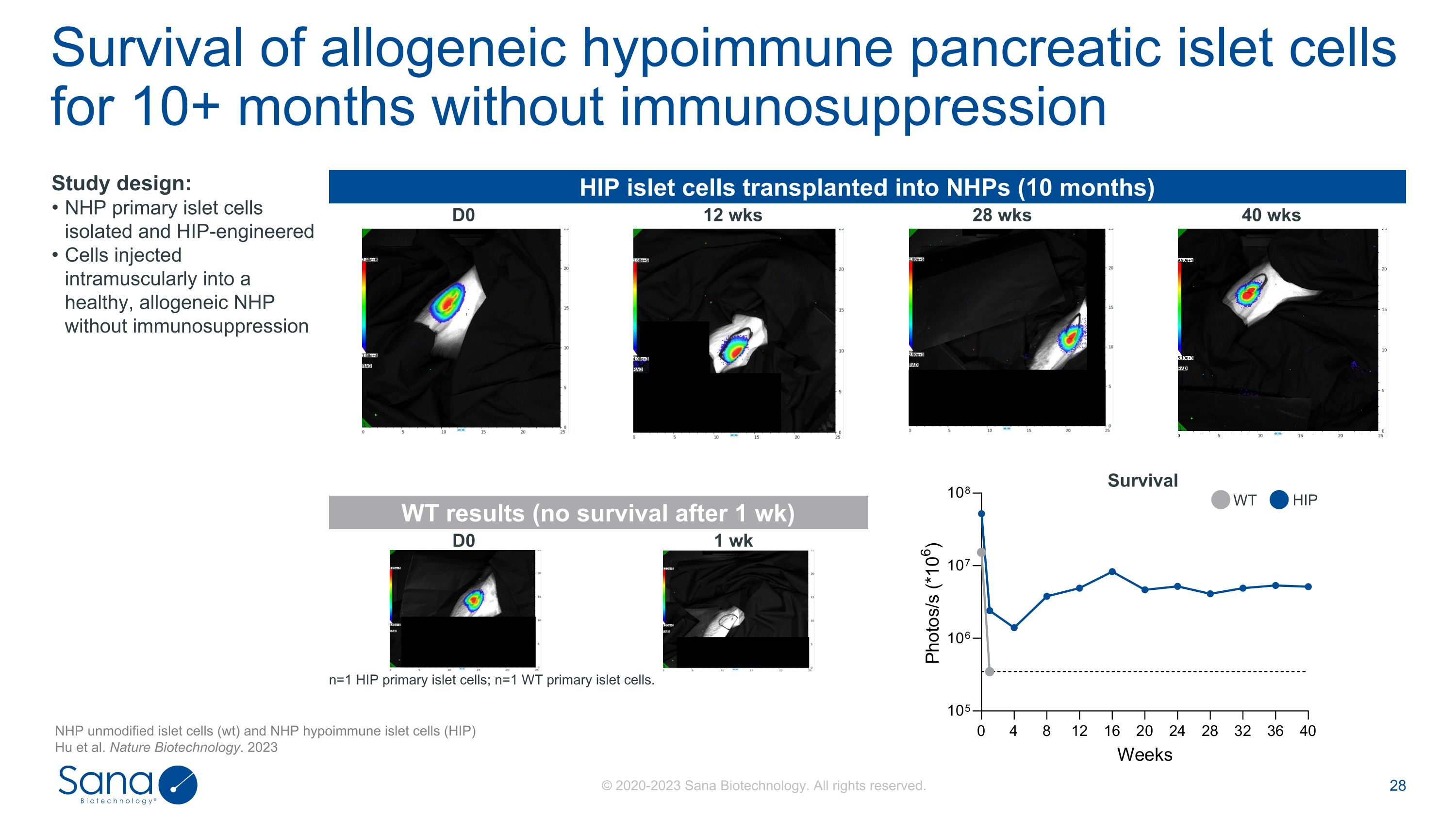
HIP胰岛细胞移植到NHPs(10个月)D0 12周28周40周WT结果(1周后无存活)D0 1周n = 1个HIP原代胰岛细胞;n = 1个WT原代胰岛细胞。无免疫抑制的同种异体低免疫胰岛细胞存活10 +月研究设计:NHP原代胰岛细胞分离和HIP工程细胞肌肉注射到无免疫抑制的健康同种异体NHP中存活NHP未修饰的胰岛细胞(wt)和NHP低免疫胰岛细胞(HIP)Hu等人。Nature Biotechnology。2023年WT HIP
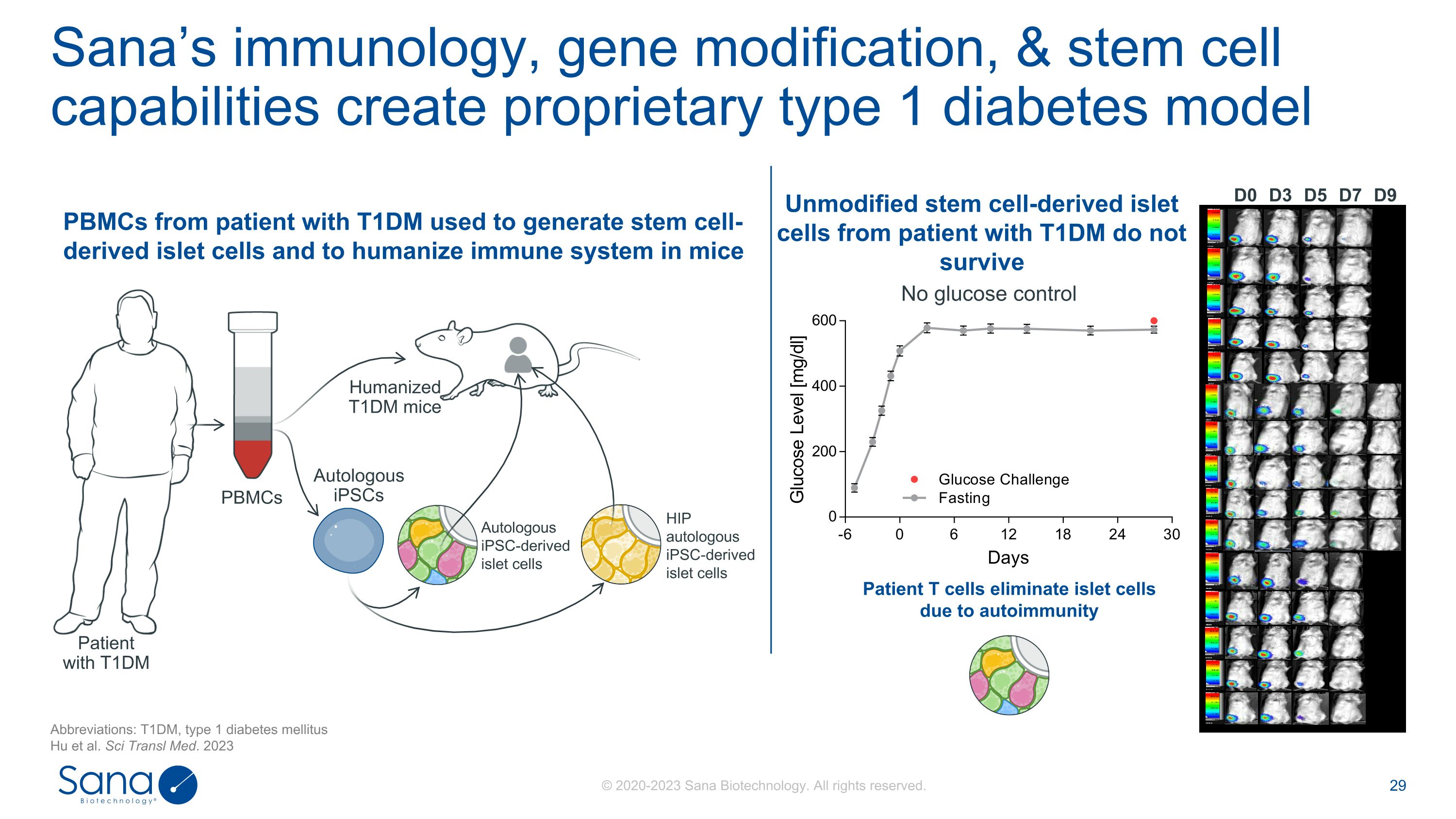
D0 D3 D7 D5 D9无葡萄糖控制患者T细胞因自身免疫而消除胰岛细胞Sana的免疫学、基因修饰和干细胞能力创造了专有的1型糖尿病模型缩写:T1DM,1型糖尿病Hu等人。Sci Transl Med. 2023 T1DM患者PBMCs自体iPSC-derived胰岛细胞人源化T1DM小鼠自体iPSCs HIP自体iPSC-derived胰岛细胞T1DM患者未修饰的干细胞衍生胰岛细胞不能存活T1DM患者的PBMCs用于产生干细胞衍生的胰岛细胞和人源化小鼠的免疫系统
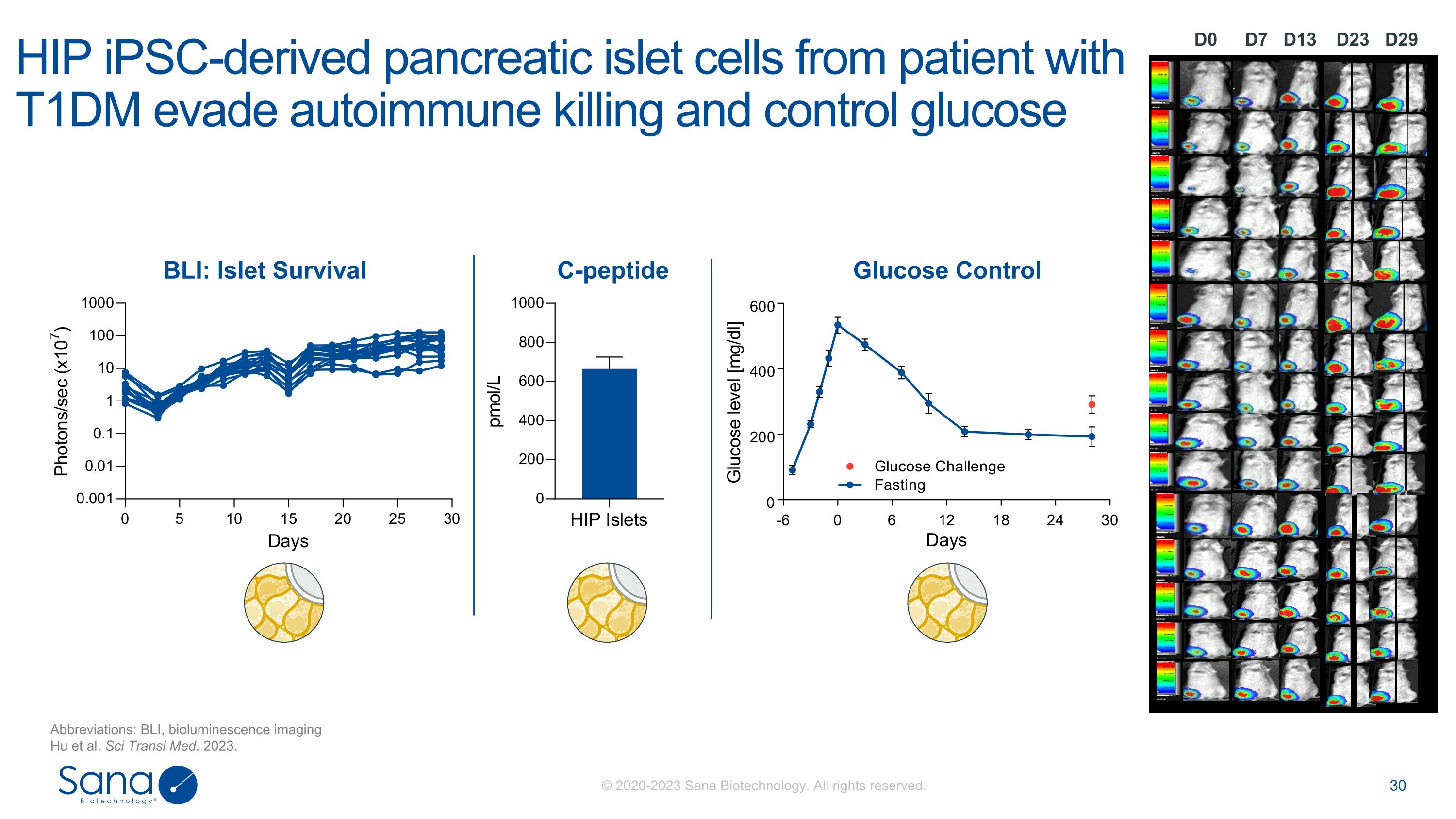
来自T1DM患者的D7 D0 D23 D29 D13 HIP iPSC衍生胰岛细胞逃避自身免疫杀伤和控制葡萄糖缩写:BLI,生物发光成像Hu et al. Sci Transl Med. 2023。BLI:胰岛存活C-肽葡萄糖控制
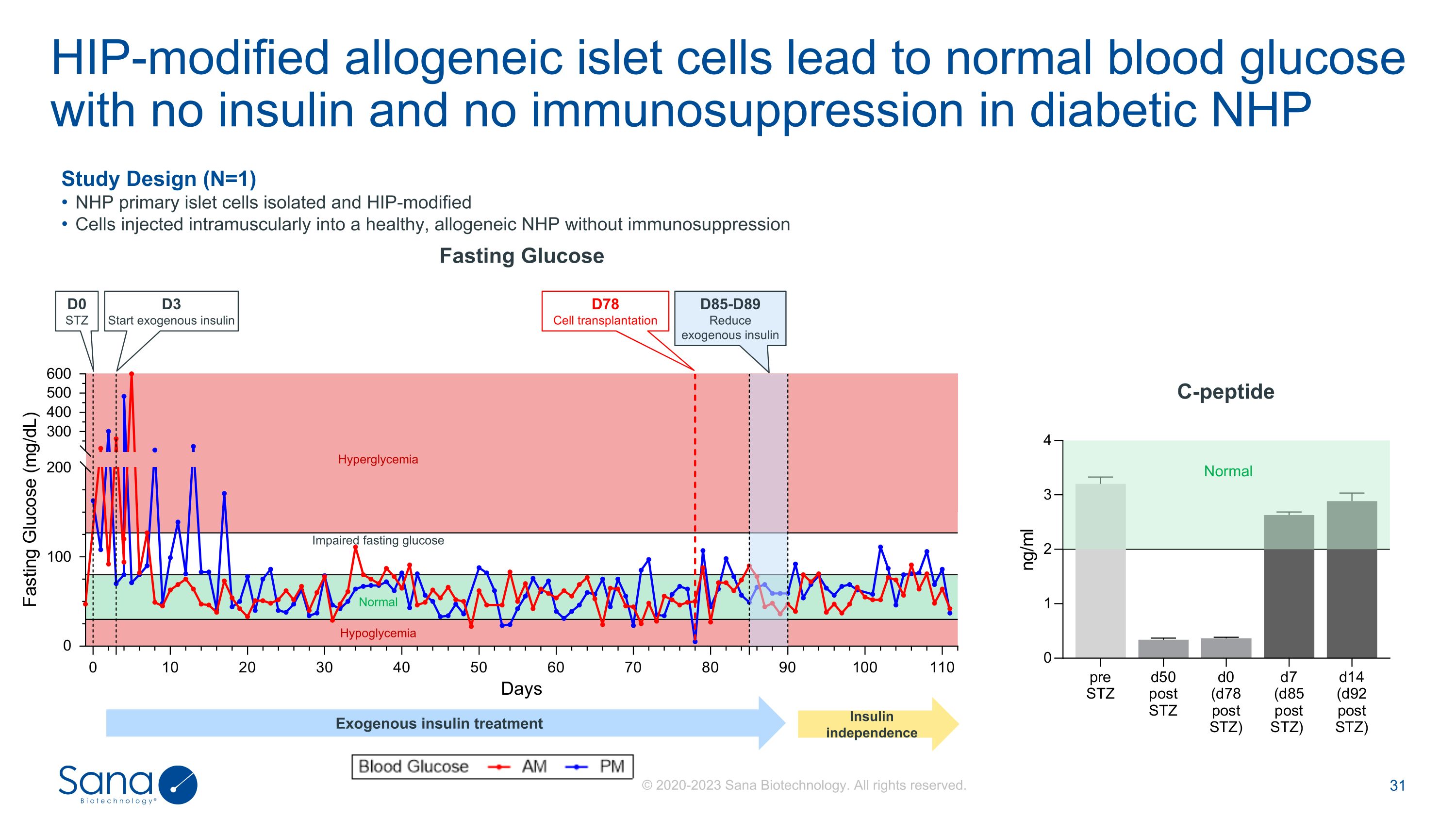
HIP修饰的同种异体胰岛细胞导致正常血糖无胰岛素和无免疫抑制的糖尿病NHP正常低血糖受损空腹葡萄糖高血糖D78细胞移植D85-D89减少外源性胰岛素D0 STZ D3启动外源性胰岛素研究设计(N = 1)NHP原代胰岛细胞分离和HIP修饰细胞肌肉注射到健康的同种异体NHP中,无免疫抑制C-肽空腹葡萄糖正常外源性胰岛素治疗胰岛素独立© 2020-2023 Sana Biotechnology。版权所有。
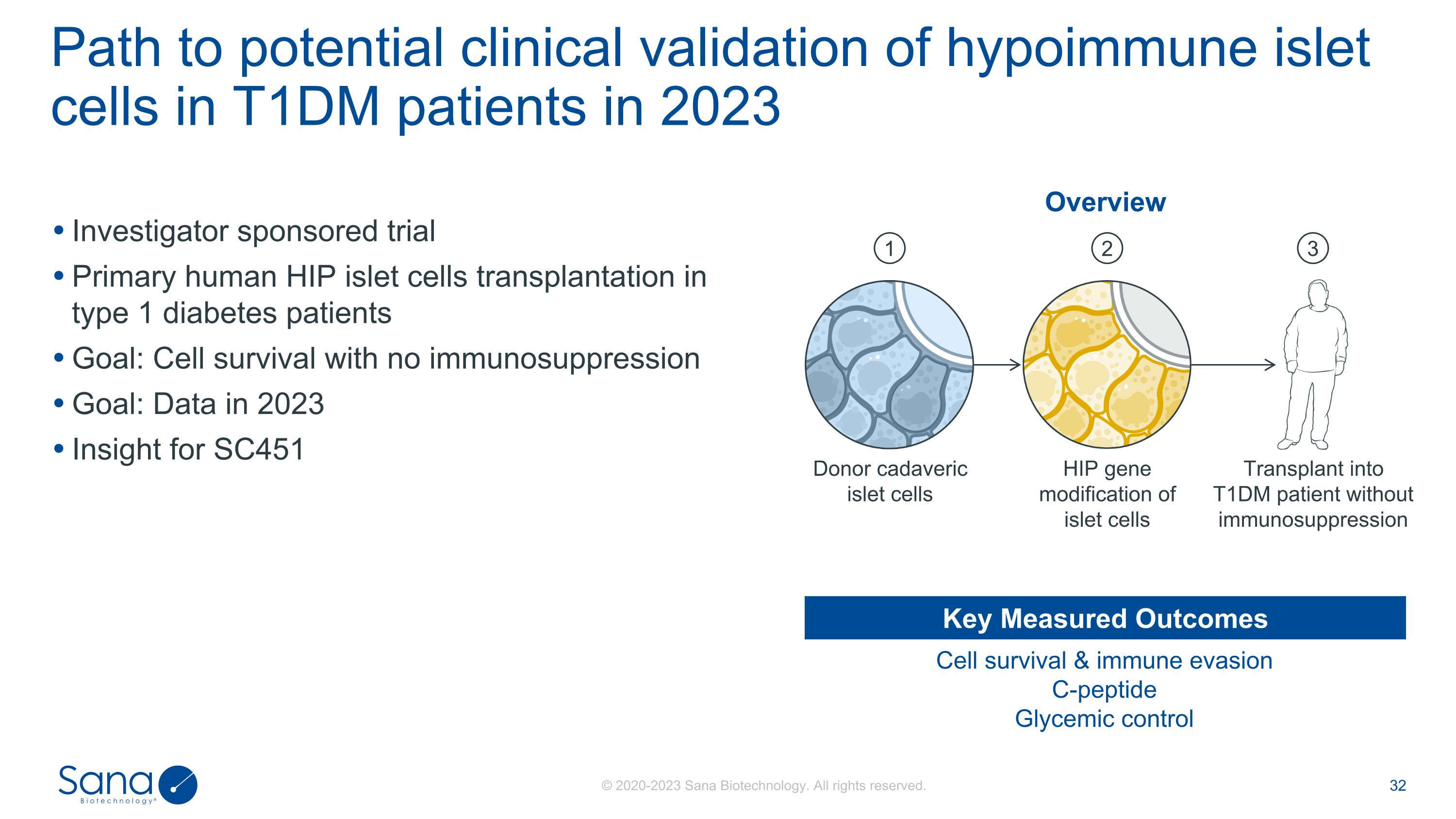
研究者赞助的试验1型糖尿病患者原发性人类HIP胰岛细胞移植目标:无免疫抑制的细胞存活目标:2023年数据透视SC451 2023年T1DM患者低免疫胰岛细胞的潜在临床验证途径细胞存活和免疫逃避C-肽血糖控制关键测量结果概述移植到T1DM患者体内无免疫抑制的胰岛细胞HIP基因修饰供体尸体胰岛细胞123
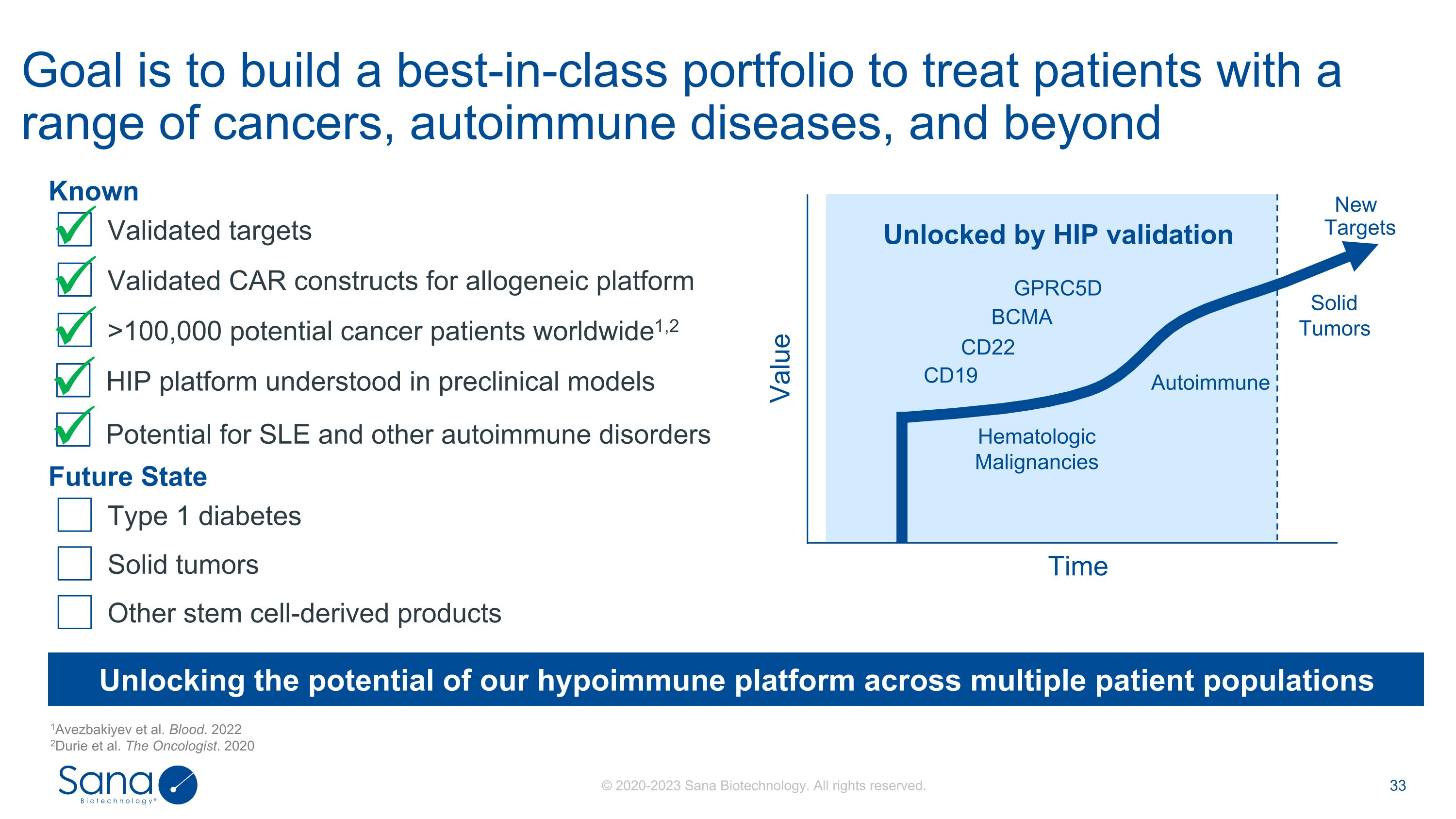
目标是建立一个一流的组合,治疗一系列癌症、自身免疫性疾病以及1Avezbakiyev等人血液以外的患者。2022 Durie et al. The Oncologist。2020 Unlocking the potential of our hyopimmune platform across multiple patient population Value Time CD19 CD22 BCMA Autoimmune Unlocked by HIP validation Solid tumors New targets血液系统恶性肿瘤GPRC5D Known > 100,000 potential cancer patients worldwide 1,2 Future State Validated CAR constructs for allogenic platform Validated targets 1型糖尿病Solid tumors HIP platform understands in preclinical models Other stem cell derived products SLE and other autoimmune dise
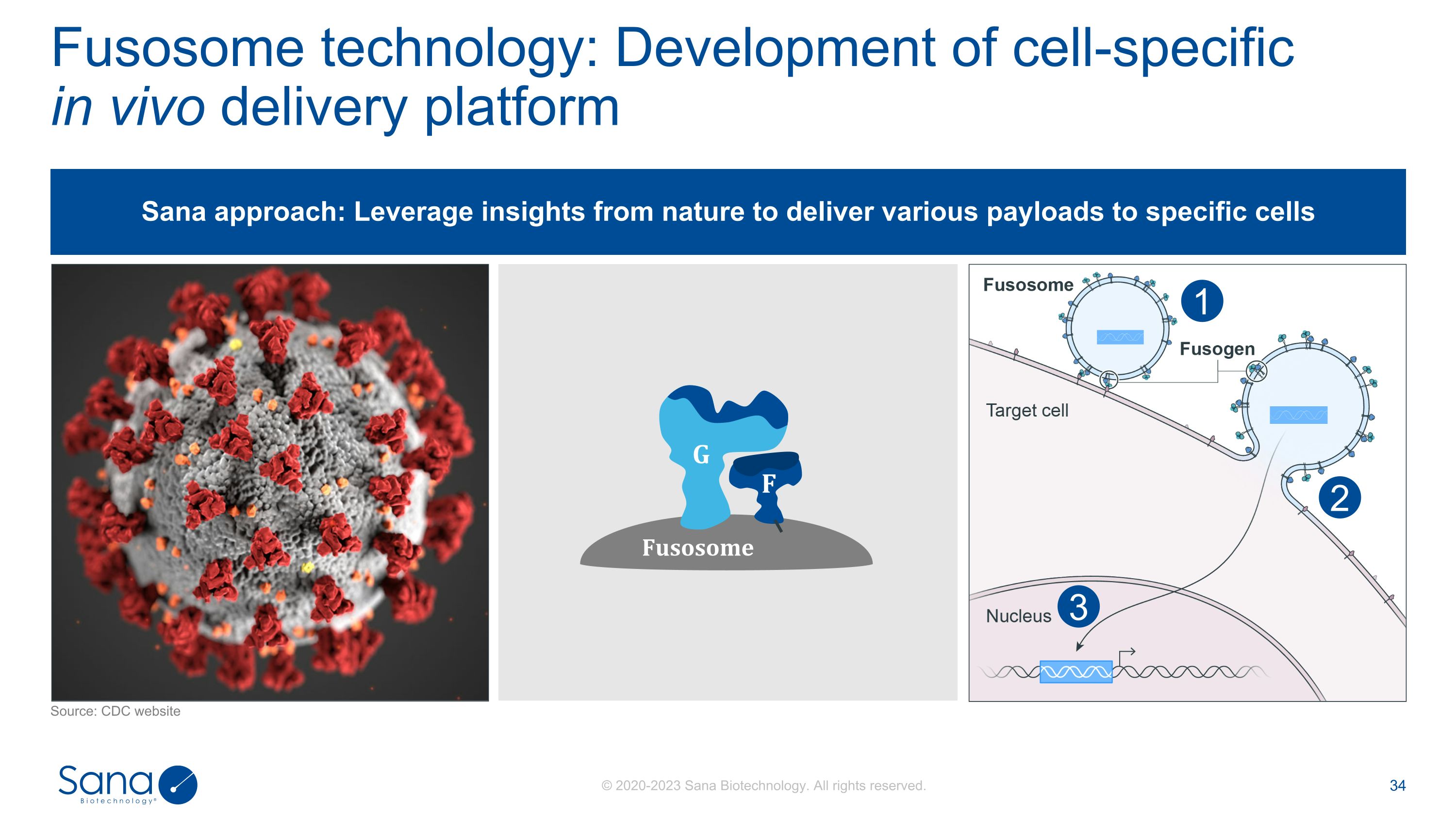
Fusosome技术:开发细胞特异性体内递送平台来源:CDC网站321Sana方法:利用来自大自然的洞见向特定细胞FG Fusosome递送各种有效载荷
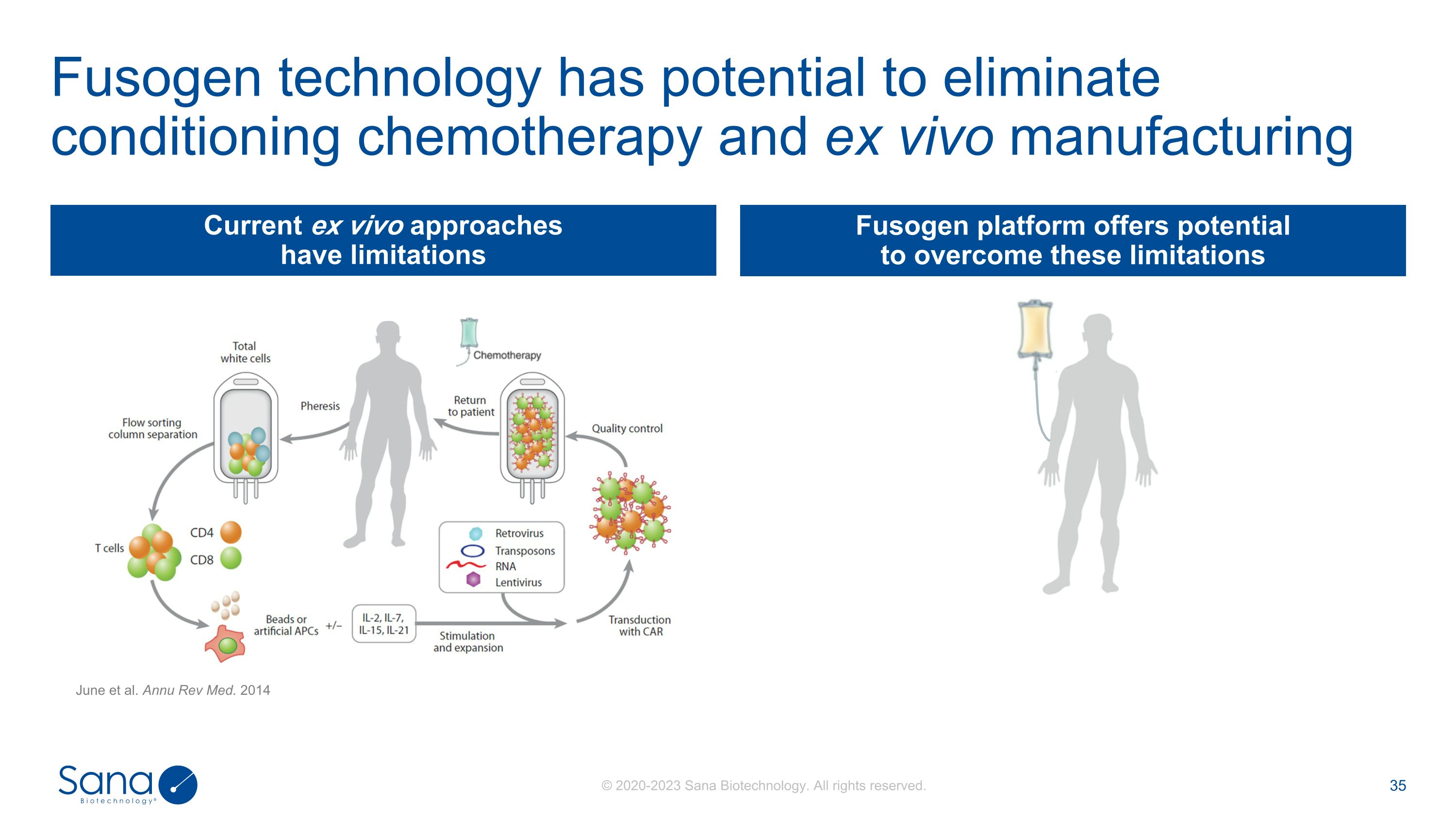
Fusogen技术有潜力消除条件反射化疗和离体制造目前的离体方法有局限性Fusogen平台提供了克服这些局限性的潜力June et al. Annu Rev Med. 2014
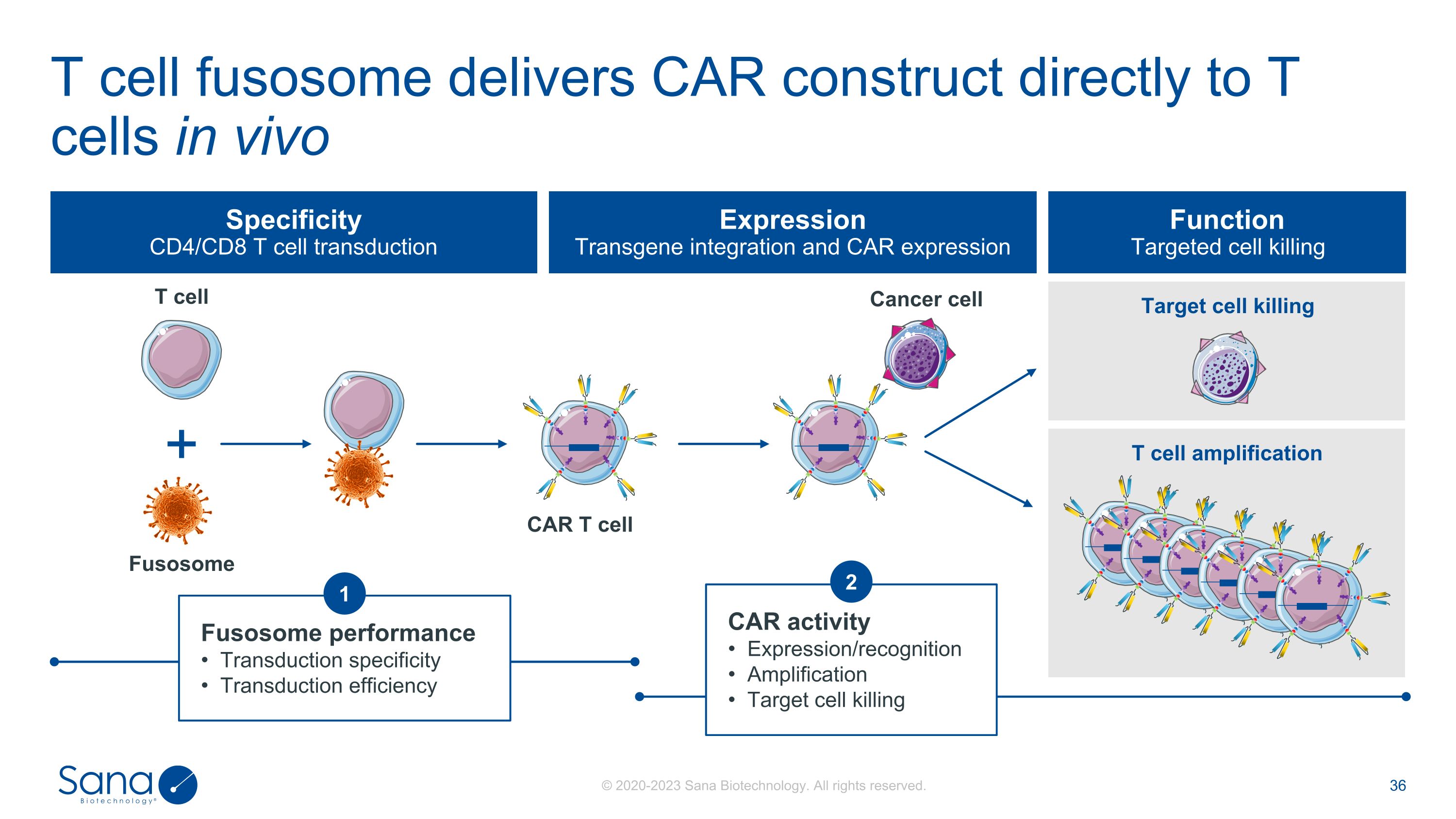
T细胞融合体向T细胞直接递送CAR构建体体内CAR活性表达/识别扩增靶细胞杀伤靶细胞杀伤T细胞扩增特异性CD4/CD8 T细胞转导表达转基因整合与CAR表达功能靶向细胞杀伤T细胞融合体癌细胞CAR T细胞2梭状体性能转导特异性转导效率1
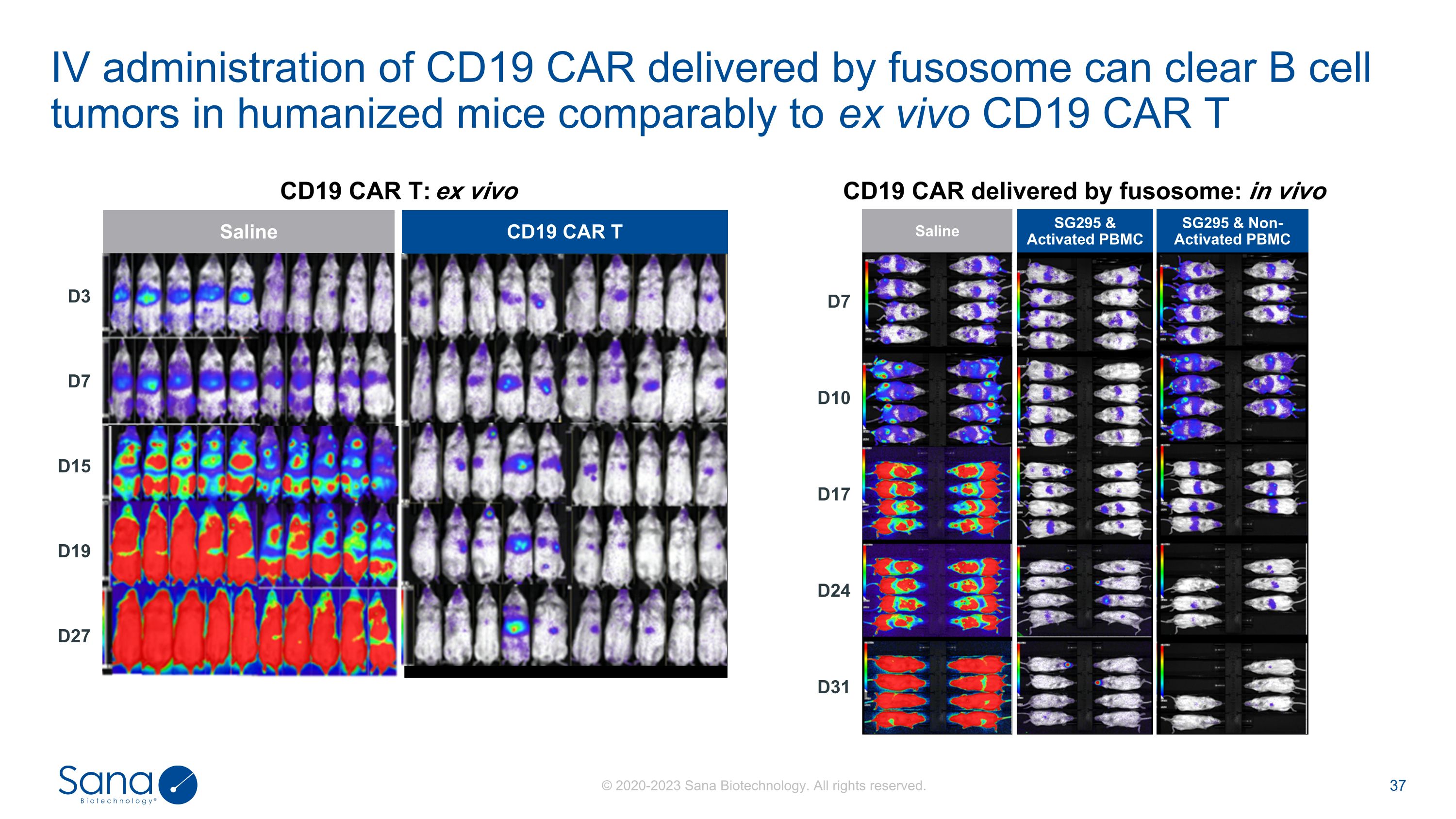
与体外CD19 CAR T盐水SG295 &活化PBMC SG295 &非活化PBMC CD19 CAR相比,体外CD19 CAR T:体外盐水CD19 CAR T D3 D7 D15 D19 D27 D7 D10 D17 D24 D31
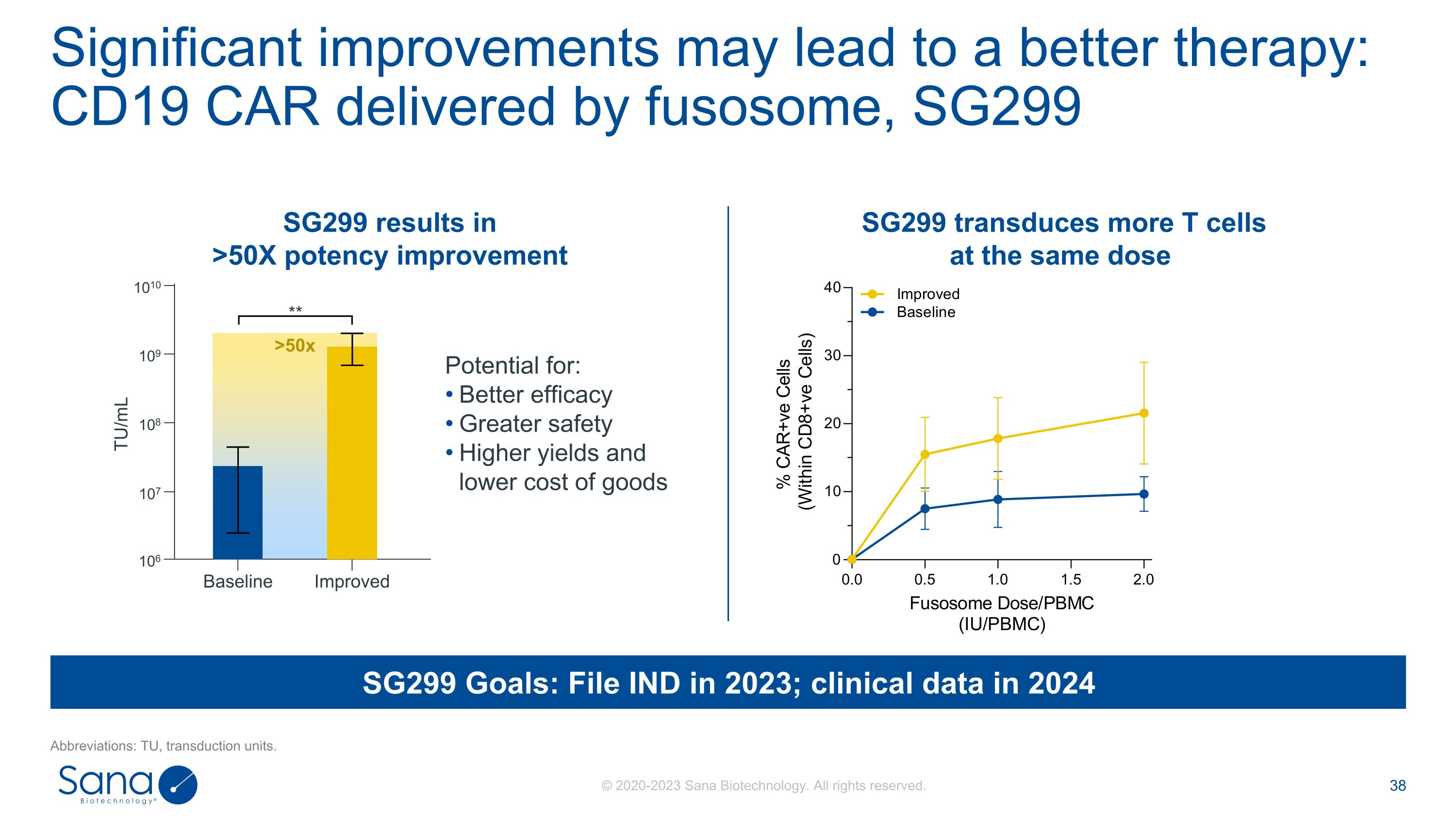
显著改善可能导致更好的治疗:CD19 CAR由fusosome递送,SG299缩写:TU,转导单元。潜力:更好的疗效更高的安全性更高的产量和更低的商品成本SG299导致> 50X的效力改进SG299在相同剂量下可转导更多的T细胞1010109108107106基线改进的TU/mL * * > 50x SG299目标:2023年提交IND;2024年临床数据
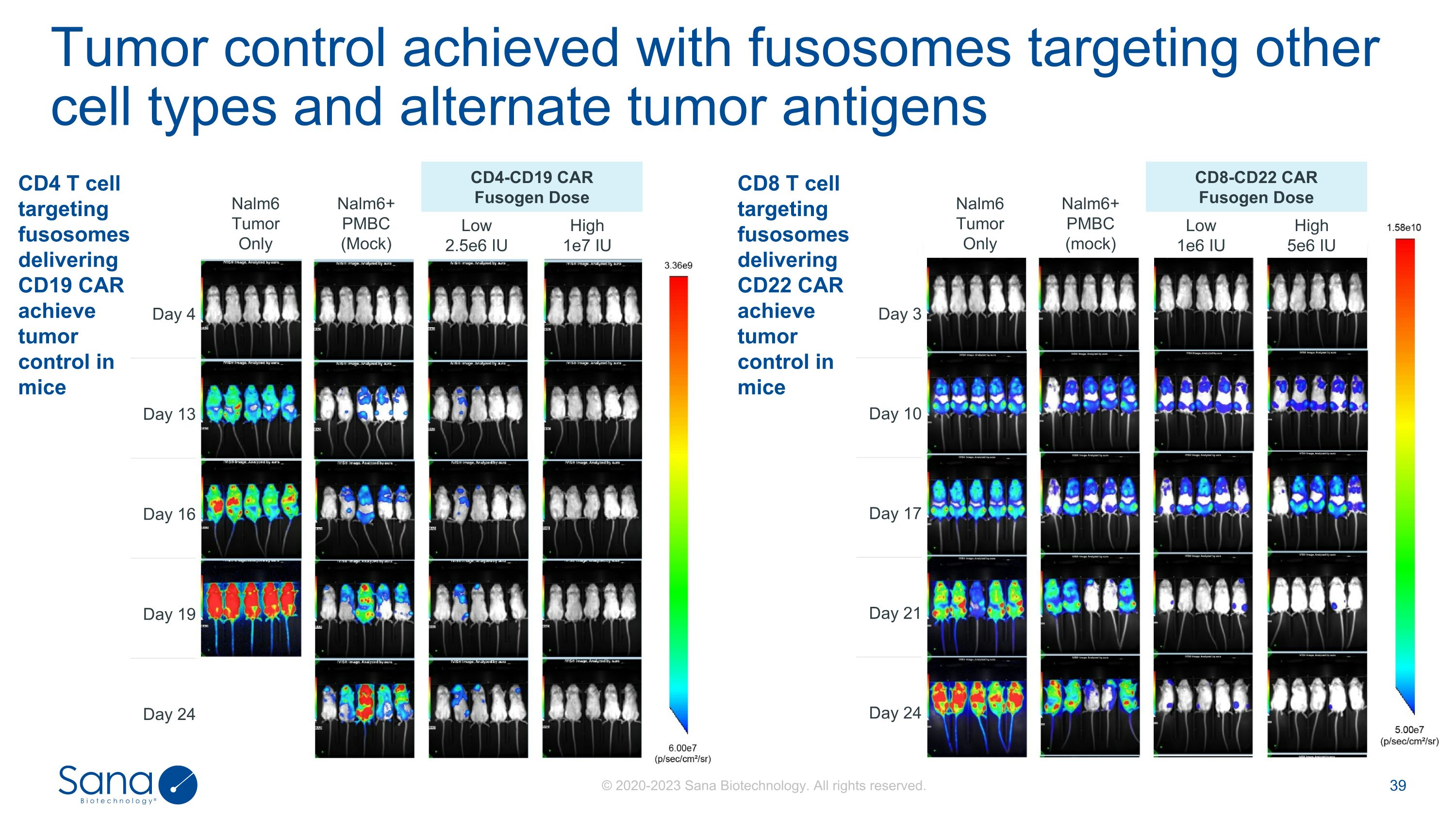
靶向其他细胞类型的融合体和替代肿瘤抗原CD4 T细胞靶向融合体递送CD19 CAR实现肿瘤控制小鼠CD8 T细胞靶向融合体递送CD22 CAR实现肿瘤控制小鼠Nalm6仅肿瘤Nalm6 + PMBC(模拟)CD4-CD19 CAR融合体剂量低2.5e6 IU高1e7 IU第4天第13天第16天第19天第24天Nalm6仅肿瘤Nalm6 + PMBC(模拟)CD8-CD22 CAR融合体剂量低1e6 IU高5e6 IU第3天第10天第17天第21天第24天
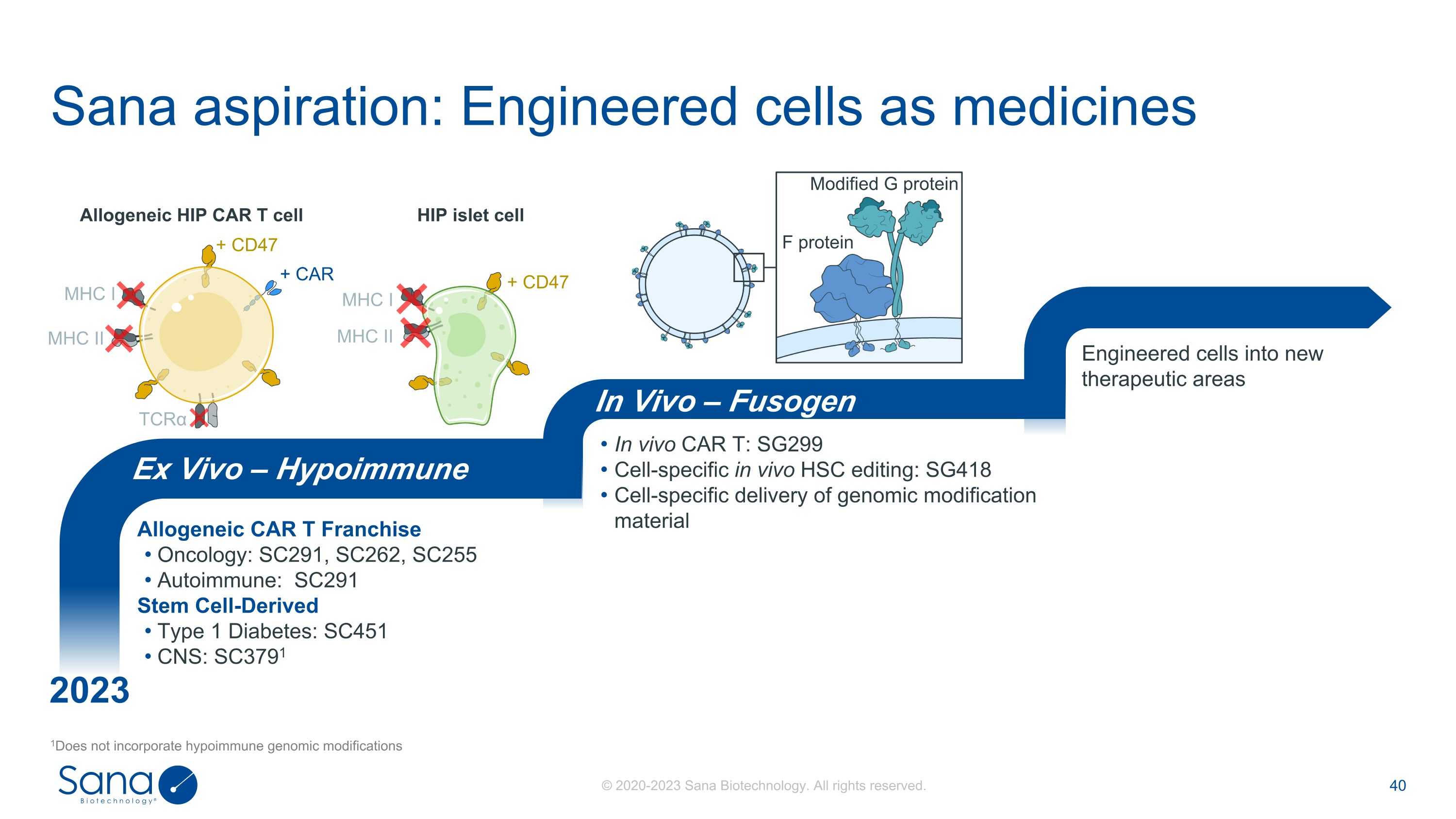
Sana aspiration:Engineered cells as medicine 1 Does not integrate lowimmune genomic modifications Allogenic CAR T Franchise Oncology:SC291,SC262,SC255 Autoimmune:SC291 Stem Cell-Derived 1型糖尿病:SC451 CNS:SC3791 In vivo CAR T:SG299 Cell-specific in vivo HSC编辑:SG418 Cell-specific delivery of genomic modification material Engineered cells into new therapeutical areas Ex Vivo – Hypoimmune In Vivo – Fusogen + CD47 MHC I MHC II Allogen


附录
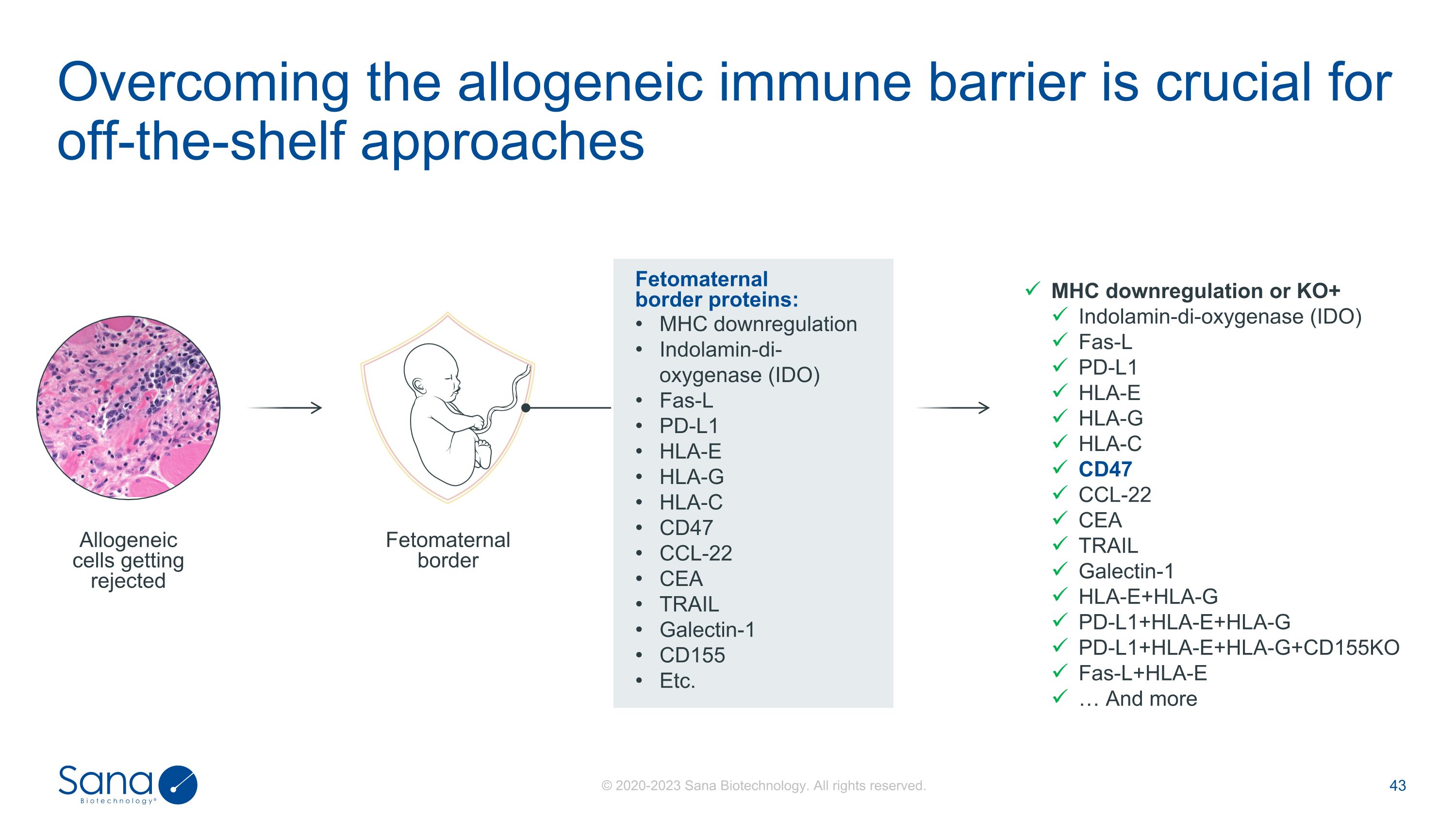
克服同种异体免疫屏障是关键的现成途径胎儿母体边界蛋白:MHC下调吲哚胺二加氧酶(IDO)Fas-L PD-L1 HLA-E HLA-G HLA-C CD47 CCL-22 CEA TRAIL Galectin-1 CD155等。MHC下调或KO +吲哚胺-二加氧酶(IDO)Fas-L PD-L1 HLA-E HLA-G HLA-C CD47 CCL-22 CEA TRAIL Galectin-1 HLA-E + HLA-G PD-L1 + HLA-E + HLA-G PD-L1 + HLA-E + HLA-G + CD155KO Fas-L + HLA-E…以及更多异体基因细胞被排斥胎儿母体边界
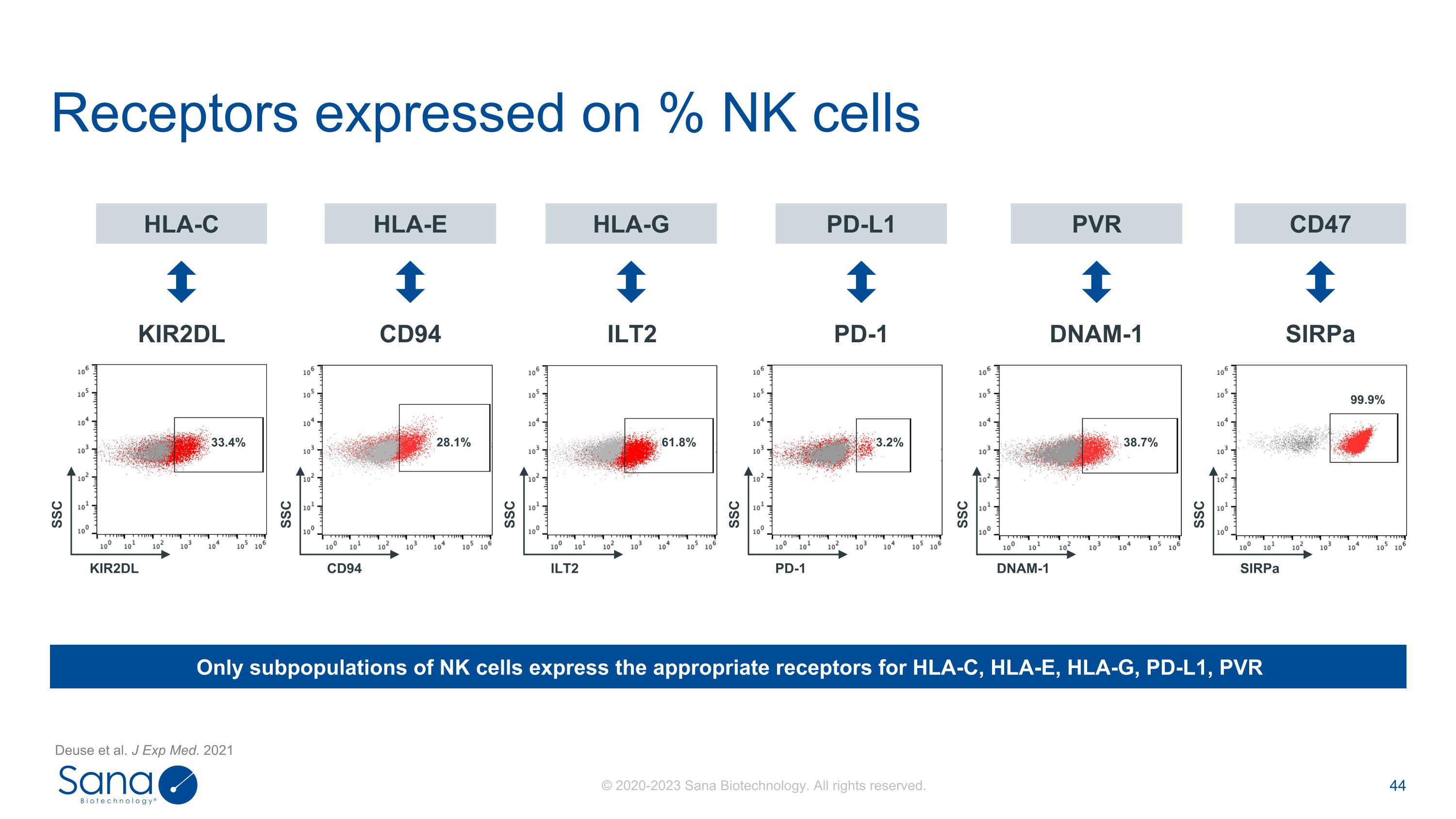
受体表达于% NK细胞PD-L1 HLA-E HLA-G HLA-C PVR CD94 CD47 SIRPa DNAM-1 PD-1 ILT2 KIR2DL 33.4% 28.1% 61.8% 3.2% 38.7%只有NK细胞亚群表达HLA-C、HLA-E、HLA-G、PD-L1、PVR 99.9% SSC KIR2DL SSC CD94 SSC ILT2 SSC PD-1 SSC SIRPa SSC DNAM-1 Deuse等人J Exp Med. 2021
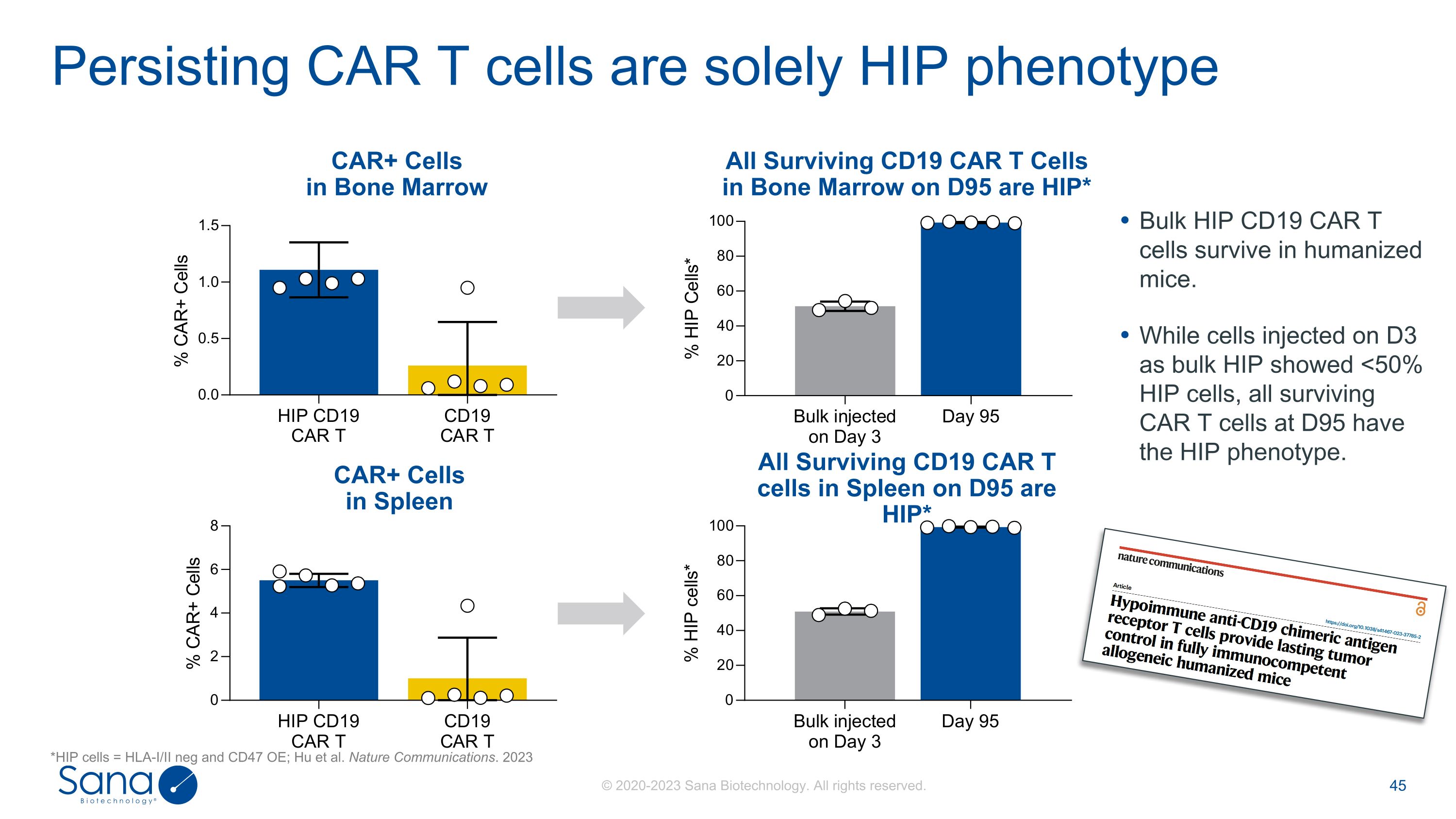
持久性CAR T细胞仅为HIP表型* HIP细胞= HLA-I/II neg和CD47 OE;Hu等人。Nature Communications。2023脾脏中的CAR +细胞D95上脾脏中所有存活的CD19 CAR T细胞都是HIP * CAR +细胞骨髓中所有存活的CD19 CAR T细胞都是HIP * Bulk HIP CD19 CAR T细胞在人源化小鼠中存活。而在D3上注射的细胞作为块状HIP显示出< 50%的HIP细胞,在D95上所有存活的CAR T细胞都具有HIP表型。
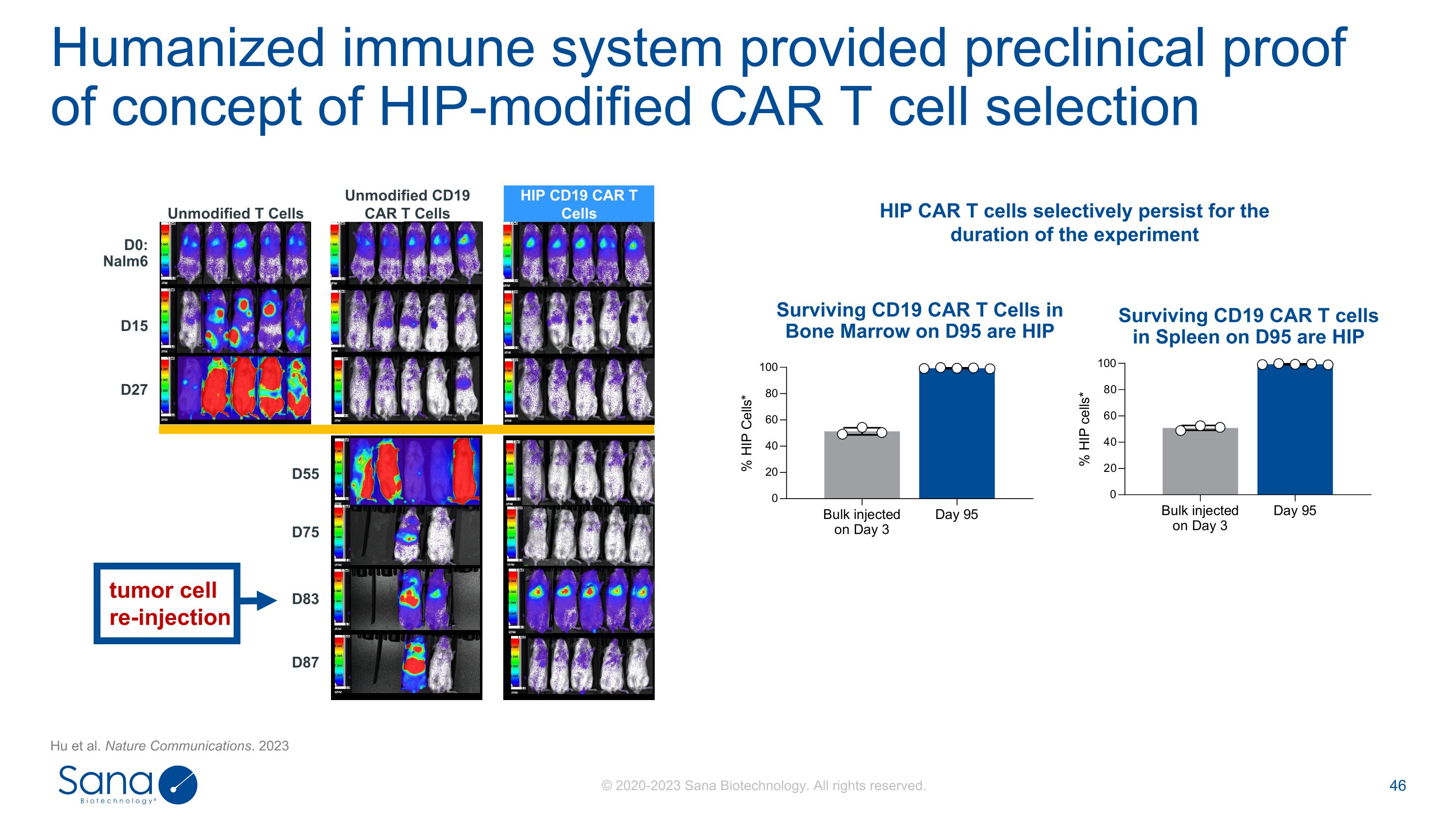
人源化免疫系统提供了HIP修饰CAR T细胞选择的临床前概念证明D55 D87 D75 D83 D0:Nalm6 D15 D27未修饰的CD19 CAR T细胞未修饰的T细胞HIP CD19 CAR T细胞肿瘤细胞再注射在D95的脾脏中存活的CD19 CAR T细胞是HIP存活的CD19 CAR T细胞在D95的骨髓中存活的CD19 CAR T细胞是HIP HIP CAR T细胞在实验期间选择性持续的Hu等人。Nature Communications。2023
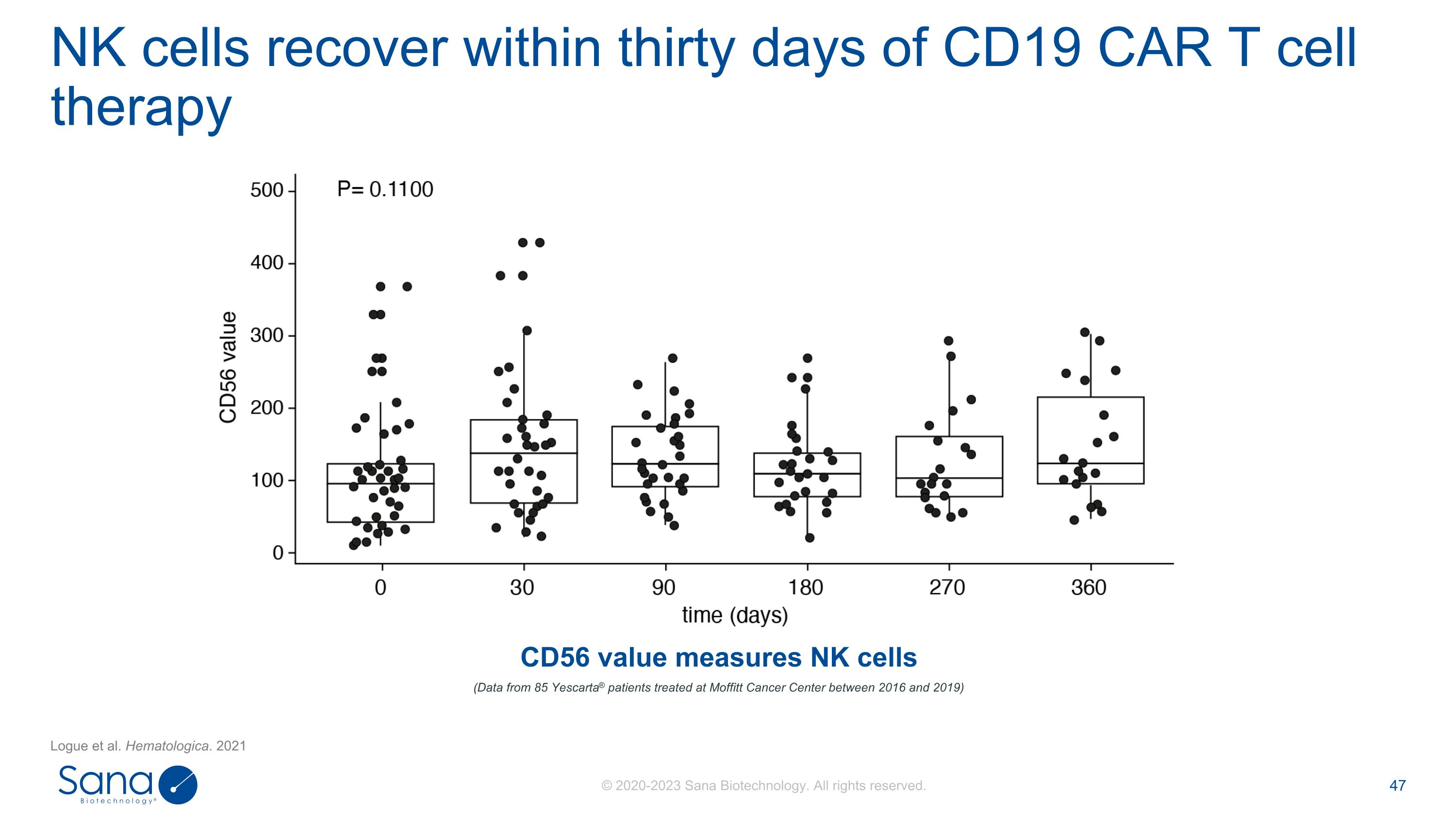
NK细胞在CD19 CAR T细胞治疗后30天内恢复。Logue等人。Hematologica。2021年(2016年至2019年在Moffitt癌症中心接受治疗的85名Yescarta ®患者的数据)CD56值衡量NK细胞