
打破边界。点燃变革。纳斯达克:IOBT杰富瑞医疗保健会议2025年11月附件 99.1

免责声明|本演示文稿中包含的某些信息包括经修订的1933年《证券法》第27A条和经修订的1934年《证券交易法》第21E条含义内的与我们的业务计划、临床试验和监管提交相关的“前瞻性声明”。在某些情况下,我们可能会使用“可能”、“应该”、“将”、“预期”、“计划”、“预期”、“可能”、“打算”、“目标”、“项目”、“考虑”、“相信”、“估计”、“预测”、“潜在”或“继续”等表达未来事件或结果不确定性的词语来识别这些前瞻性陈述。我们的前瞻性陈述是基于我们管理团队当前的信念和预期,其中涉及风险、环境的潜在变化、假设和不确定性。任何或所有前瞻性陈述都可能被证明是错误的,或者受到我们可能做出的不准确假设或已知或未知风险和不确定性的影响。这些前瞻性陈述受到风险和不确定性的影响,包括与我们的业务计划的执行、我们的临床试验或其他研究的成功和时间以及我们向美国证券交易委员会提交的文件中规定的其他风险相关的风险。由于所有这些原因,实际结果和发展可能与我们的前瞻性陈述中表达或暗示的结果和发展存在重大差异。请注意不要过分依赖这些前瞻性陈述,这些陈述仅在本演示文稿发布之日作出。除法律要求外,我们不承担公开更新此类前瞻性陈述以反映后续事件或情况的义务。

Cylembio是一款在研候选药物,未获美国FDA或其他监管机构批准上市。
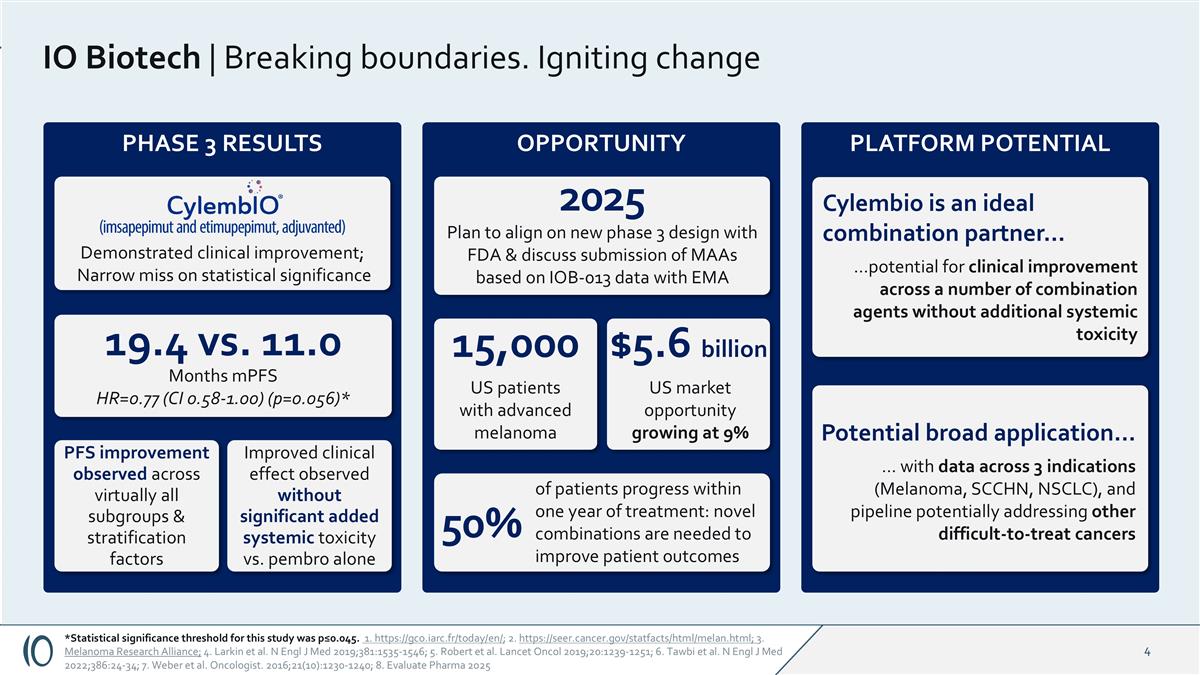
IO Biotech |打破边界。点燃变化第3阶段结果*本研究的统计显著性阈值为p ≤ 0.045。1. https://gco.iarc.fr/today/en/;2. https://seer.cancer.gov/statfacts/html/melan.html;3。黑色素瘤Research Alliance;4。Larkin et al. N Engl J Med 2019;381:1535-1546;5。Robert et al. Lancet Oncol 2019;20:1239-1251;6。Tawbi et al. N Engl J Med 2022;386:24-34;7。Weber等人,肿瘤学家。2016;21(10):1230-1240; 8.Evaluate Pharma 2025Cylembio是理想的组合合作伙伴……在没有额外全身毒性的情况下跨多个组合药物的临床改善潜力平台潜在机会与单独使用pembro 19.4 vs. 11.0个月mPFS HR = 0.77(CI 0.58-1.00)(p = 0.056)*在几乎所有亚组中观察到的PFS改善&分层因素显示临床改善;统计意义上的狭小遗漏潜在的广泛应用……有3个适应症(黑色素瘤、SCCHN、NSCLC)的数据,和可能解决患者其他难以治疗的癌症的管道在治疗一年内取得进展:需要新的组合来改善患者预后50% 1.5万名美国晚期黑色素瘤患者56亿美元美国市场机会以9%的速度增长计划与FDA调整新的3期设计&与EMA 2025讨论提交基于IOB-013数据的MAAs
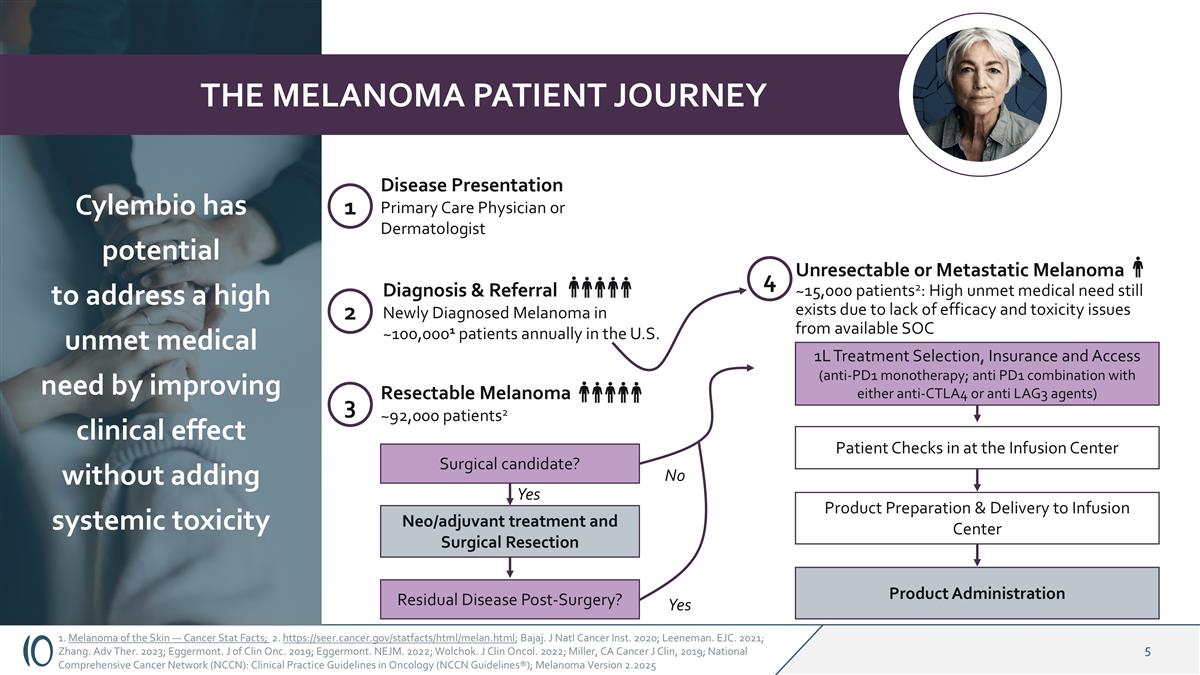
1.皮肤黑色素瘤—癌症统计事实;2. https://seer.cancer.gov/statfacts/html/melan.html;Bajaj。J Natl癌症研究所。2020年;利内曼。EJC。2021;张。adv ther。2023年;埃格蒙特。Clin Onc的J。2019年;埃格蒙特。NEJM。2022;沃尔乔克。J Clin Oncol。2022;Miller,加利福尼亚州 Cancer J Clin,2019;National Comprehensive Cancer Network(NCCN):Clinical Practice Guidelines in Oncology(NCCN Guidelines®);黑色素瘤2.2025版黑色素瘤患者旅程1疾病介绍初级保健医生或皮肤科医生2诊断&转诊美国每年约100,0001名患者新诊断的黑色素瘤3可切除的黑色素瘤~92,000名患者2手术候选者?手术后残留疾病?Neo/辅助治疗和手术切除4不可切除或转移性黑色素瘤~15,000名患者2:由于缺乏现有SOC 1L治疗选择、保险和准入(抗PD1单药治疗;抗PD1与抗CTLA4或抗LAG3药物联合使用)的疗效和毒性问题,仍然存在高度未满足的医疗需求患者在输液中心打卡产品制备和交付给输液中心产品管理局是否是Cylembio有潜力通过提高临床效果而不增加全身毒性来解决高度未满足的医疗需求

Cylembio在一线晚期黑色素瘤中的应用
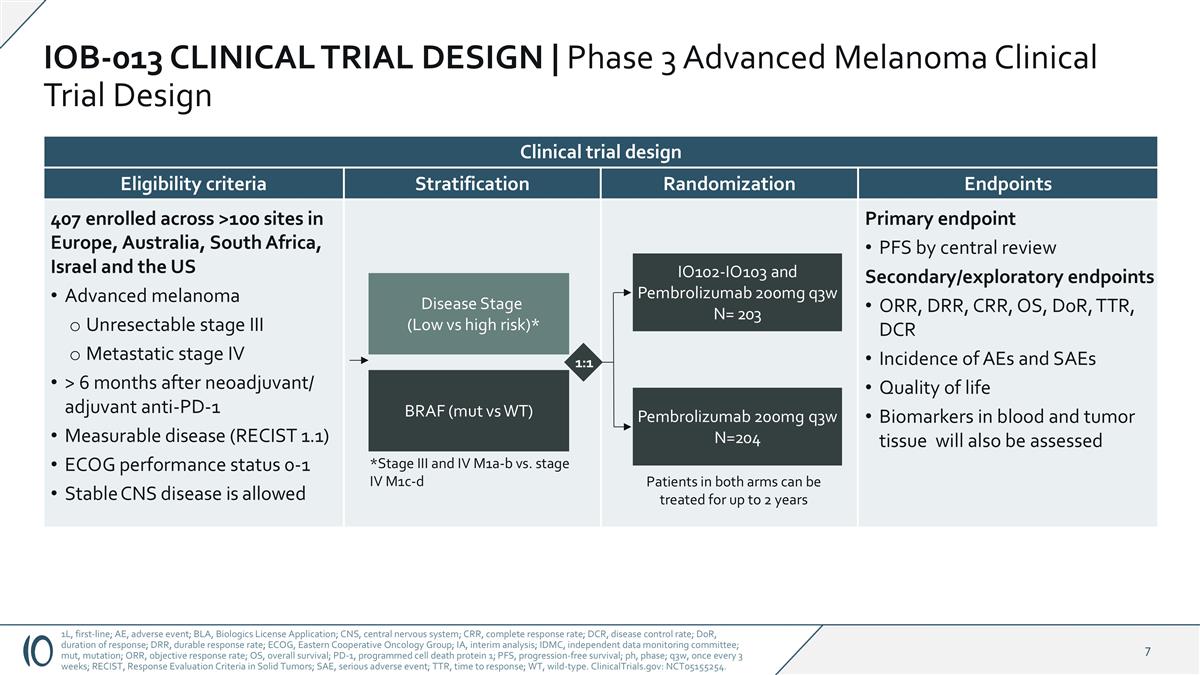
通过中心审评的主要终点PFS二级/探索性终点ORR、DRR、CRR、OS、DOR、TTRR、DCR的AEs发生率和血液和肿瘤组织中的SAEs生活质量生物标志物也将被评估分层终点随机407在欧洲、澳大利亚、南非、以色列和美国的> 100个地点入组晚期黑色素瘤不可切除的III期转移性IV期> 6个月后新辅助/辅助抗PD-1可测量疾病(RECIST 1.1)ECOG性能状态0-1稳定的CNS疾病允许符合标准1L,一线;AEE,不良事件;BLA,生物制品许可申请;CNS,中枢神经系统;CRR,完全缓解率;DCR,疾病控制率;DOR,应答持续时间;DRR,持久应答率;ECOG,东部肿瘤协作组;IA,中期分析;IDMC,独立数据监测委员会;mut,突变;ORR,客观应答率;OS,总生存期;PD-1,程序性细胞死亡蛋白1;PFS,无进展生存期;ph,期;q3w,每3周一次;RECIST,实体瘤中的应答评估标准;SAE,严重不良事件;TTR,应答时间;WT,野生型。ClinicalTrials.gov:NCT05155254。疾病阶段(低vs高风险)*BRAF(mut vs WT)*III期和IV期M1a-b与IV期M1c-d IO102-IO103和Pembrolizumab 200mg q3w N = 203 Pembrolizumab 200mg q3w N = 2041:1临床试验设计两臂患者可接受长达2年的治疗IOB-013临床试验设计| 3期晚期黑色素瘤临床试验设计

第3阶段试验| Cylembio在几乎所有预先指定的亚组和分层因子上证明了PFS的改善2025年8月发布的顶线结果*本研究的统计显著性阈值为p ≤ 0.045。**事后分析。资料来源:档案数据。总体生存趋势倾向于cylembio联合用臂,OS尚未成熟HR = 0.79(CI 0.57,1.10);与单独使用pembrolizumab相比具有良好耐受性且无明显额外全身毒性中位无进展生存期,ITT分析:cylembio加pembrolizumab 19.4个月vs.单独使用pembrolizumab治疗的患者11.0个月,HR = 0.77(CI 0.58-1.00)(p = 0.056)*在PD-L1阴性组,cylembio加pembrolizumab治疗患者的MPFS为16.6个月,而pembro单独治疗患者的MPFS为3.0个月,HR:0.54(CI 0.35-0.85)(标称p = 0.006)不包括既往抗PD1暴露患者**(n = 36):MPFS为24.8个月vs. 11.0个月HR:0.74(CI 0.56-0.98)(名义p = 0.037)(n = 371)
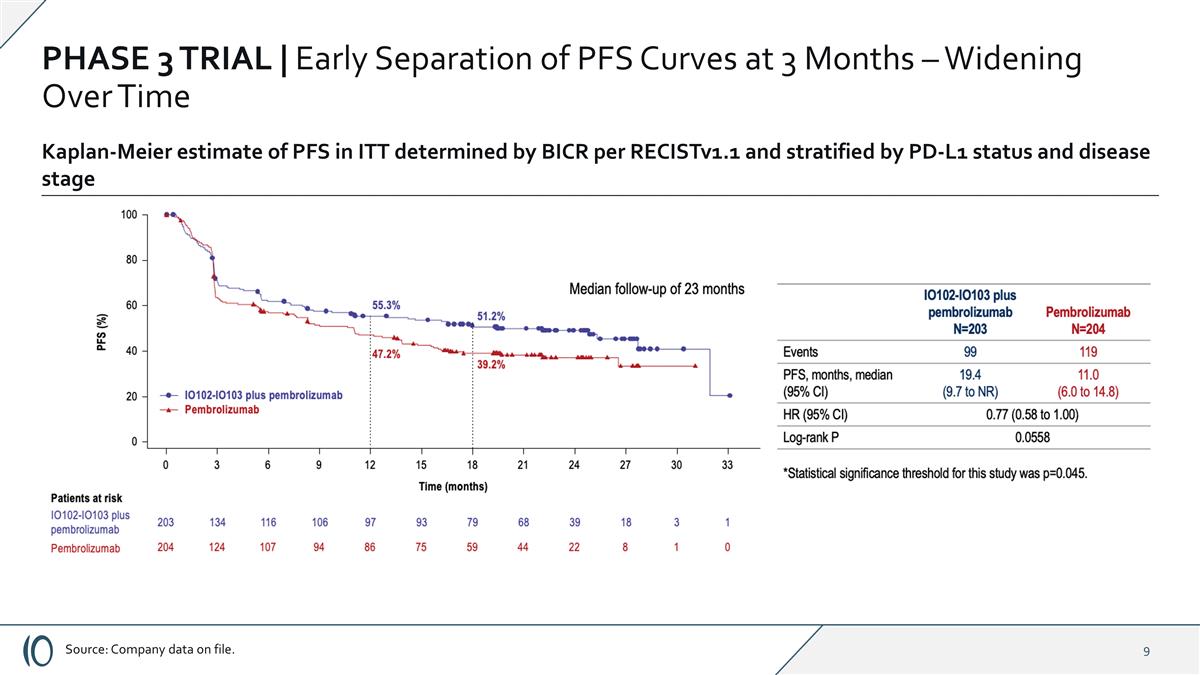
第3阶段试验| 3个月时及早分离PFS曲线–随时间扩大来源:公司存档数据。Kaplan-Meier估计BICR根据RECISTV1.1测定并按PD-L1状态和疾病阶段分层的ITT中PFS
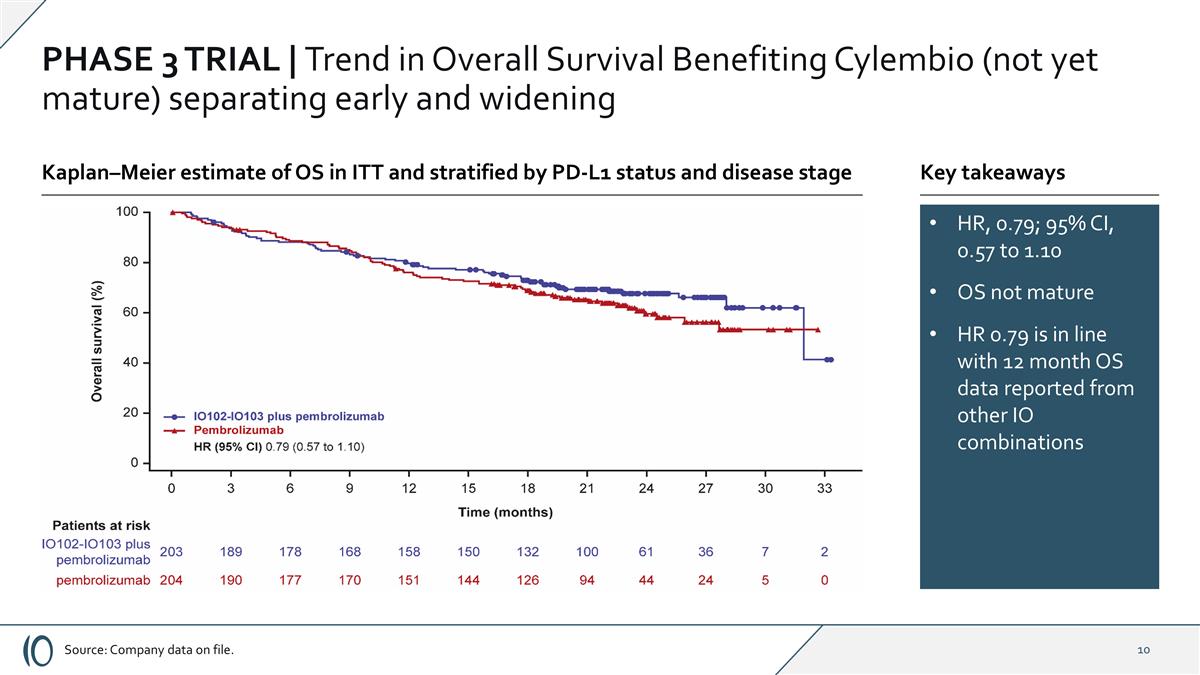
Phase 3 Trial | Trend in overall survival benefiting cylembio(not yet mature)separation early and widening HR,0.79;95% CI,0.57 to 1.10 OS not mature HR 0.79 is in line with 12 months OS data reported from other IO combinations Source:company data on file。Kaplan – Meier对ITT中OS的估计并按PD-L1状态和疾病阶段进行分层关键要点
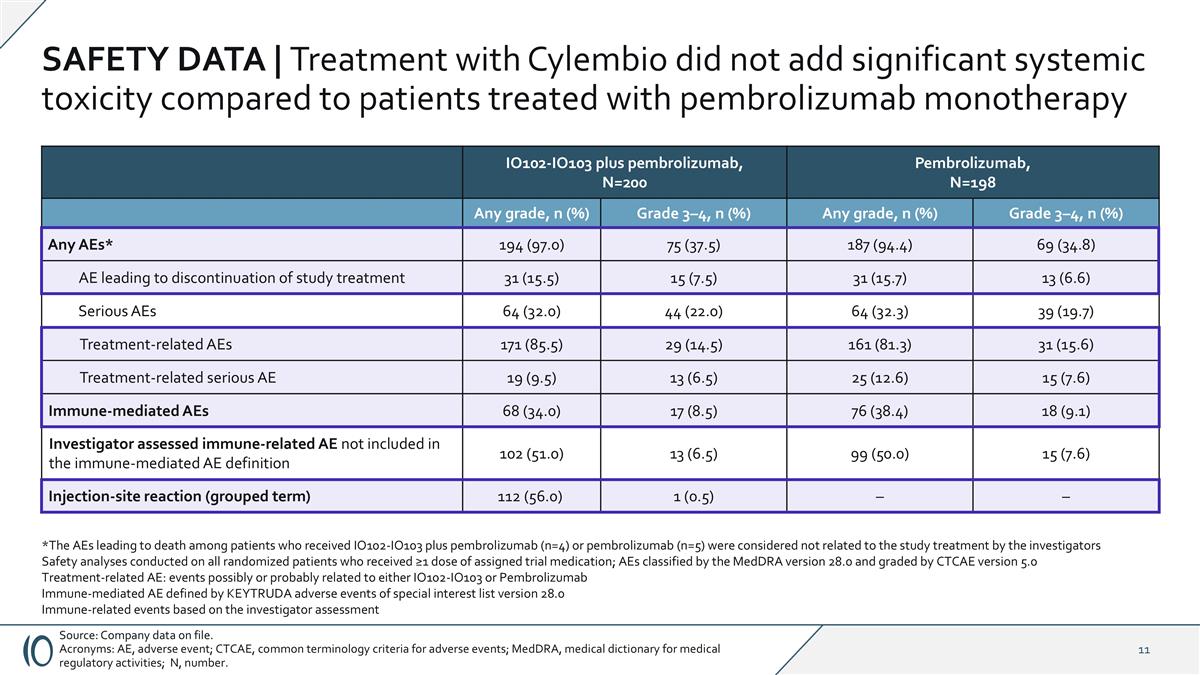
安全数据|与帕博利珠单抗单药治疗的患者相比,使用Cylembio治疗没有增加显着的全身毒性来源:公司存档数据。首字母缩写:AEE,不良事件;CTCAE,不良事件常用术语标准;MedDRA,医疗监管活动医学词典;N,数字。IO102-IO103加帕博利珠单抗,N = 200帕博利珠单抗,N = 198任意等级,n(%)3 – 4级,n(%)任意等级,n(%)3 – 4级,n(%)任意AEs*194(97.0)75(37.5)187(94.4)69(34.8)AE导致研究治疗中止31(15.5)15(7.5)31(15.7)13(6.6)严重AEs 64(32.0)44(22.0)64(32.3)39(19.7)治疗相关AEs 171(85.5)29(14.5)161(81.3)31(15.6)治疗相关严重AEs 19(9.5)13(6.5)25(12.6)15(7.6)免疫介导AEs 68(34.0)17(8.5)76(38.4)18(9.1)研究者评估的免疫介导AEs未包括在免疫介导AEs定义102(51.0)13(6.5)99(50.0)15(7.6)注射部位反应(分组术语)112(56.0)1(*AEs领先在接受IO102-IO103加pembrolizumab(n = 4)或pembrolizumab(n = 5)的患者中,研究人员认为与研究治疗无关的死亡;对所有接受≥ 1剂指定试验用药的随机患者进行的安全性分析;由MedDRA 28.0版分类的AEs和由CTCAE 5.0版治疗相关AEs分级:可能或可能与IO102-IO103或由KEYTRUDA定义的Pembrolizumab免疫介导AEs相关的事件特别关注清单28.0版不良事件基于研究者评估的免疫相关事件

先进梅兰诺马的市场机会| Cylembio®profile有潜力满足大量未满足的需求并推动市场领导地位1. https://gco.iarc.fr/today/en/;2. https://seer.cancer.gov/statfacts/html/melan.html.3。黑色素瘤Research Alliance;4。Larkin et al. N Engl J Med 2019;381:1535-1546;5。Robert et al. Lancet Oncol 2019;20:1239-1251;6。Tawbi et al. N Engl J Med 2022;386:24-34;7。Weber等人,肿瘤学家。2016;21(10):1230-1240; 8.Evaluate Pharma 2025黑色素瘤发病率呈上升趋势每年新诊断1-3~33.1万例患者(全球)每年~5.8万例患者死亡(全球)IV期患者30% 5年生存率Cylembio®Profile有潜力推动市场领先8203020241412108642 + 9% 13.29.4预测全球黑色素瘤药物销售额以十亿美元计美国CAGR患者和医生寻求更有效的治疗选择4-7~50%的患者在治疗一年内取得进展;需要新的组合来改善患者的预后
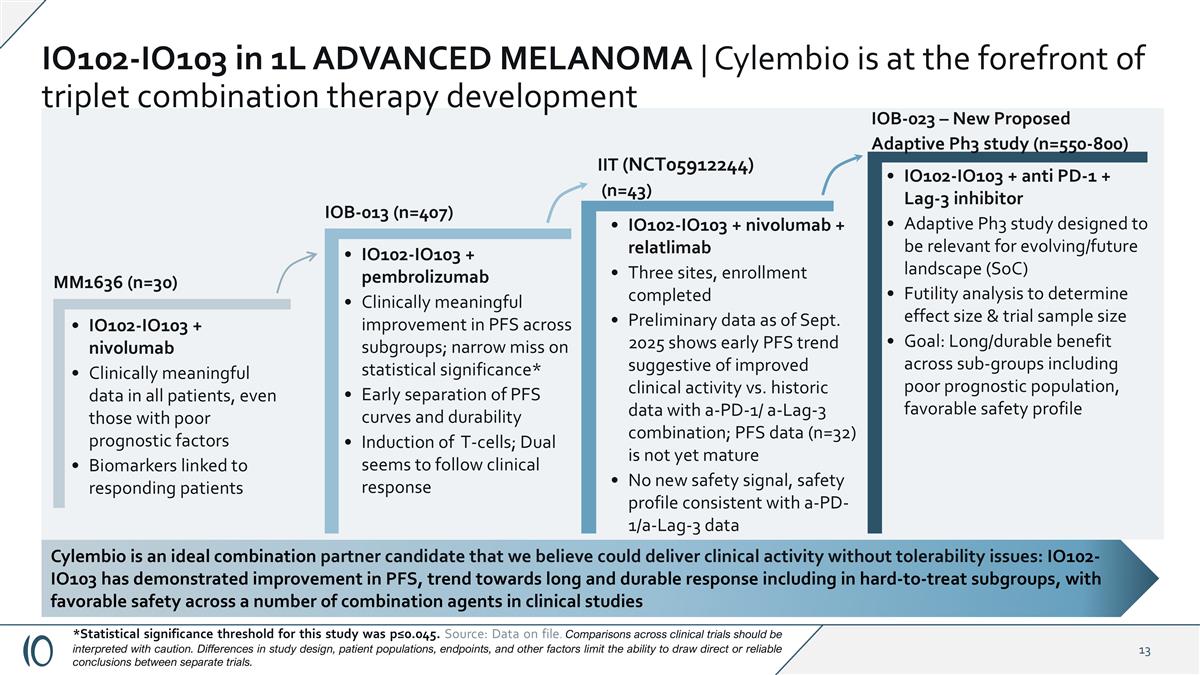
Cylembio是一个理想的组合合作伙伴候选者,我们认为它可以提供没有耐受性问题的临床活性:IO102-IO103已证明在PFS方面有所改善,具有长期和持久反应的趋势,包括在难以治疗的亚组中,在临床研究中具有跨多个组合药物的良好安全性IO102-IO103 + nivolumab在所有患者中的临床有意义的数据,即使是那些预后因素较差的生物标志物与应答患者IO102-IO103 +派姆单抗相关的患者,也对跨亚组的PFS有临床意义的改善;统计学意义上的狭窄遗漏*T细胞的PFS曲线和持久性诱导的早期分离;Dual似乎遵循临床反应IO102-IO103 + nivolumab + relatlimab三个位点,入组完成截至2025年9月的初步数据显示,与a-PD-1/a-Lag-3组合的历史数据相比,早期的PFS数据(n = 32)尚未成熟没有新的安全信号,安全性概况与a-PD-1/a-Lag-3数据一致IO102-IO103 +抗PD-1 + Lag-3抑制剂适应性Ph3研究旨在与进化/未来景观(SoC)效用分析相关,以确定效应大小和试验样本量目标:跨亚组的长期/持久获益,包括预后不良人群,有利的安全性概况MM1636(n = 30)IOB-023 –新提议的适应性Ph3研究(n = 550-800)IOB-013(n = 407)IIT(NCT05912244)(n = 43)IO102-IO103在1L先进的黑色素瘤中| Cylembio处于三联体联合疗法开发的前沿*本研究的统计显著性阈值为p ≤ 0.045。来源:档案数据。跨临床试验的比较应谨慎解读。研究设计、患者群体、终点和其他因素的差异限制了在不同试验之间得出直接或可靠结论的能力。
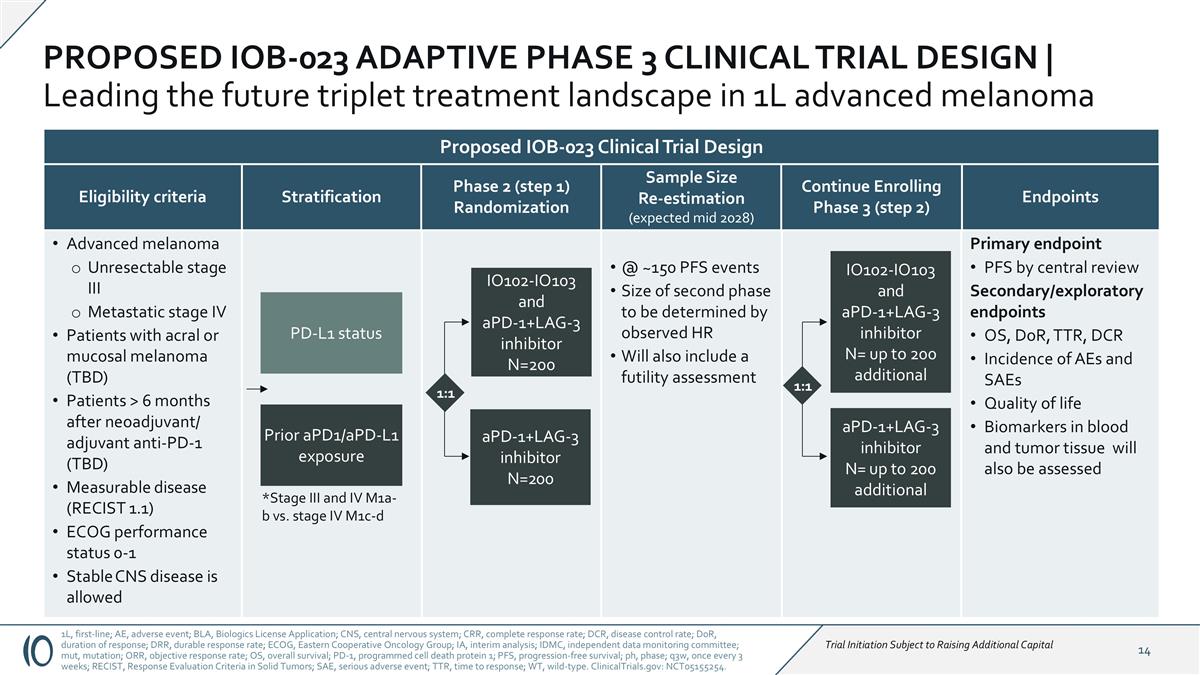
通过中心审评的主要终点PFS二级/探索性终点OS、DOR、TTR、DCR的AEs发生率和血液和肿瘤组织中的SAE生活质量生物标志物也将被评估分层终点2期(步骤1)随机分配晚期黑色素瘤不可切除的III期转移性IV期患者的肢端或粘膜黑色素瘤(TBD)患者在新辅助/辅助抗PD-1(TBD)可测量疾病(RECIST 1.1)后> 6个月ECOG性能状态0-1稳定的CNS疾病允许符合标准1L,一线;AEE,不良事件;BLA,生物制品许可申请;CNS,中枢神经系统;CRR,完全缓解率;DCR,疾病控制率;DOR,应答持续时间;DRR,持久缓解率;ECOG,东部肿瘤协作组;IA,中期分析;IDMC,独立数据监测委员会;mut,突变;ORR,客观缓解率;OS,总生存期;PD-1,程序性细胞死亡蛋白1;PFS,无进展生存期;ph,期;q3w,3周一次;RECIST,实体瘤中的应答评估标准;SAE,严重不良事件;TTR,应答时间;WT,野生型。ClinicalTrials.gov:NCT05155254。*III期和IV期M1a-b与IV期M1c-d IO102-IO103和aPD-1 + LAG-3抑制剂N = 200 aPD-1 + LAG-3抑制剂N = 200 PD-L1状态先前aPD1/aPD-L1暴露1:1建议的IOB-023适应阶段3临床试验设计|引领未来1L晚期黑色素瘤三联治疗格局@~150 PFS事件第二阶段的大小将由观察HR确定,还将包括无效评估样本量重新估计(预计2028年年中)继续入组第3阶段(第2步)IO102-IO103和APD-1 + LAG-3抑制剂N =最多200个额外的APD-1 + LAG-3抑制剂N =最多200个额外的1:1拟议的IOB-023临床试验设计试验启动受限于筹集额外资本

我们的管线:NSCLC、SCCHN、新辅助/辅助
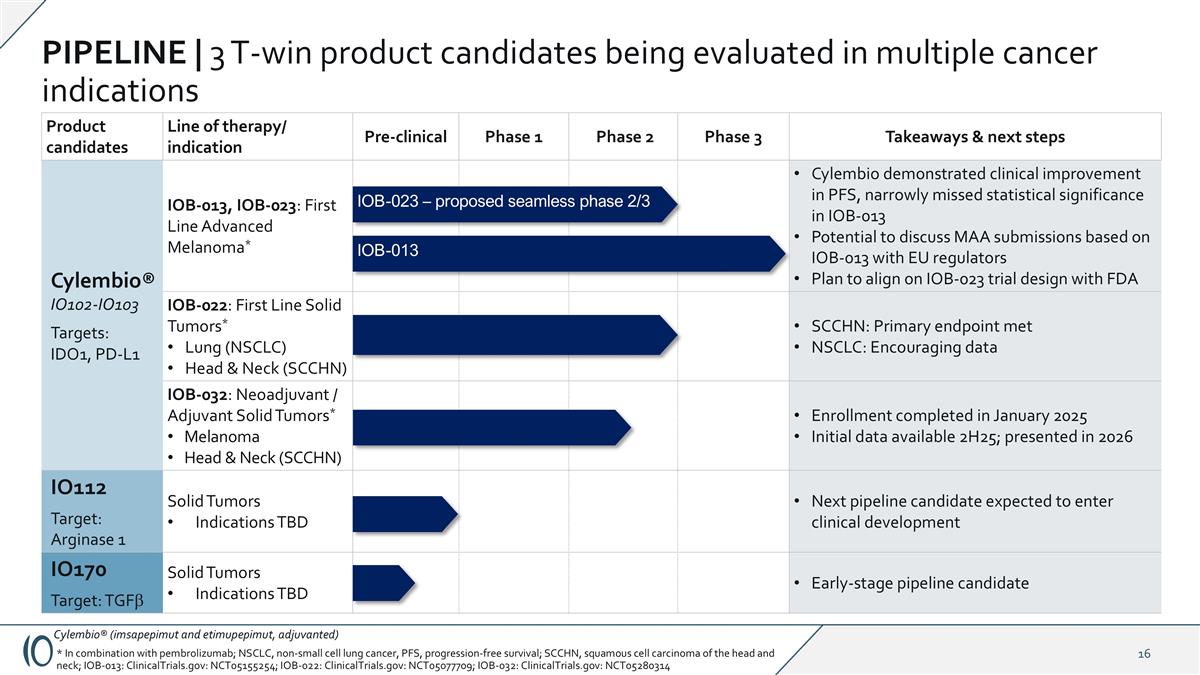
候选产品治疗线/适应症临床前1期2期3期要点&后续步骤Cylembio®IO102-IO103靶点:IDO1、PD-L1 IOB-013、IOB-023:一线晚期黑色素瘤*Cylembio在PFS方面显示出临床改善,在IOB-013中险些错过统计意义与欧盟监管机构讨论基于IOB-013的MAA提交的潜力计划在IOB-023试验设计上与FDA保持一致IO102 – IO103 IOB-022:一线实体瘤*肺(NSCLC)头颈(SCCHN)SCCHN:主要终点达到NSCLC:令人鼓舞的数据IOB-032:新辅助/辅助实体瘤*黑色素瘤头颈部(SCCHN)入组于2025年1月完成初步数据可用2H25;于2026年提出IO112目标:精氨酸酶1实体瘤适应症待定下一个有望进入临床开发的管线候选者IO170目标:TGFB实体瘤适应症待定早期管线候选者PIPELINE | 3个T-win产品候选者正在多个癌症适应症中进行评估Cylembio®(imsapepimut和etimupepimut,佐剂)*联合帕博利珠单抗;NSCLC、非小细胞肺癌、PFS、无进展生存期;SCCHN、头颈部鳞状细胞癌;IOB-013:ClinicalTrials.gov:NCT05155254;IOB-022:ClinicalTrials.gov:NCT05077709;IOB-032:ClinicalTrials.gov:NCT05280314 IOB-013 IOB-023 –建议的无缝2/3期

来自2期的第一线Metastic NSCLC结果(SITC 2024)ORR 55%未确认/48%已确认;mPFS 8.1个月基准**ORR39 %,mPFS 6.5个月状态鼓励ORR和PFS,且近一半患者的第一线复发/Metastatic SCCHN结果从2期(ESMO2024)无进展ORR44.4 %;mPFS 6.6个月,不考虑HPV状态基准**ORR 23%,mPFS 3.4个月状态主要终点ORR从3期(IOB-013)达到令人鼓舞的PFS一线高级黑色素瘤结果:19.4个月mPFS;HR = 0.77(CI 0.58-1.00)(p = 0.056)*;统计意义上的狭隘遗漏;在几乎所有亚组&分层因素中都观察到了临床改善;下一步:计划与FDA在新的3期设计上保持一致&讨论提交基于IOB-013数据的MAAs,临床数据的EMA总量令人难以置信|跨三个适应症证明的临床有意义的活动……扩展跨三个适应症的证据主体和设置*本研究统计显著性阈值为p ≤ 0.045;**KEYNOTE-048(pembro单独用于1L SCCHN PD-L1 CPS ≥ 20%):ORR 23%;KEYNOTE-042(pembro单独用于1L NSCLC PD-L1 TPS ≥ 50%):ORR 39%;1。Kjeldsen JW等NAT Med 2021;27:2212 – 23。Erratum in:NAT Med 2022;28:871;2。Lorentzen CL,et al. J Immunother Cancer 2023;11:e006755;3。ClinicalTrials.gov:NCT05155254;4。Riess JW等人出席ESMO 2024。海报1022P;5。Riess JW等人出席STIC 2024。海报756从晚期黑色素瘤开始…
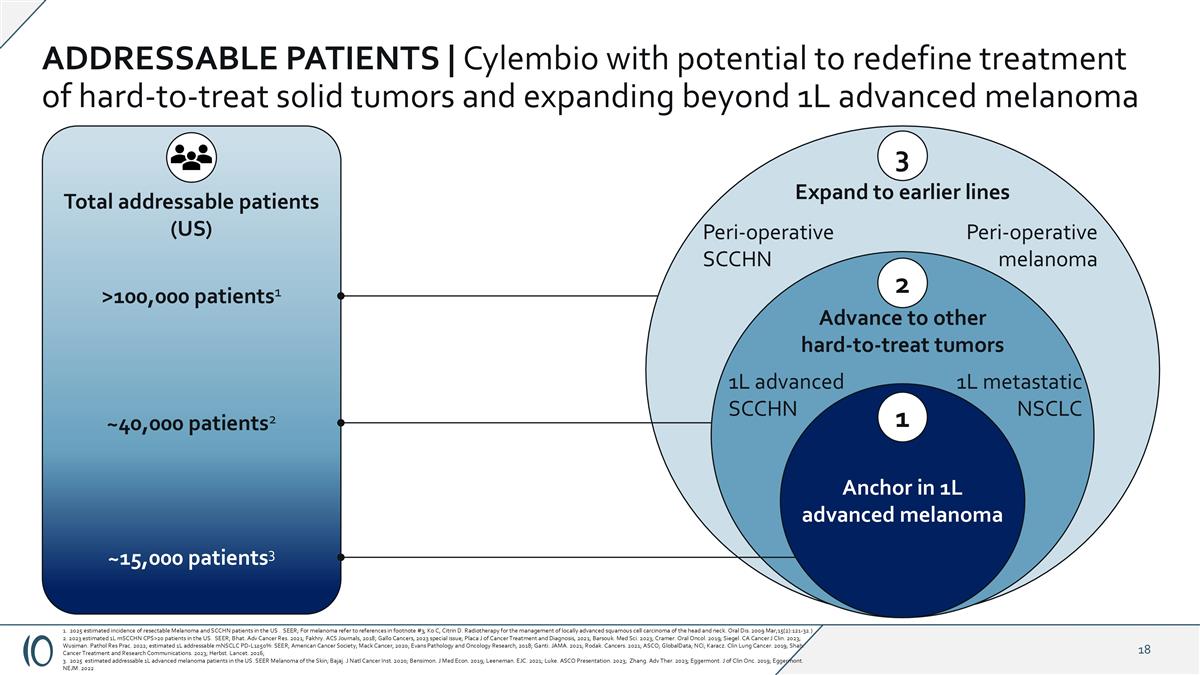
可寻址患者| Cylembio有可能重新定义难以治疗的实体瘤的治疗并扩展到1L晚期黑色素瘤之外总可寻址患者(美国)> 100,000名患者1~40,000名患者2~15,000名患者3扩展到更早的线3围手术期SCCHN围手术期黑色素瘤推进到其他难以治疗的肿瘤2 1L转移性NSCLC 1L晚期SCCHN锚定1L晚期黑色素瘤11。2025年美国可切除黑色素瘤和SCCHN患者的估计发病率。SEER;黑色素瘤参见脚注# 3中的参考资料;KO C,Citrin D.放疗治疗局部晚期头颈部鳞状细胞癌。口服DIS。2009年3月;15日(2):121-32。)2。2023年美国估计1L mSCCHN CPS > 20例患者。SEER;Bhat。ADV Cancer Res. 2021;Fakhry。ACS Journals,2018;Gallo Cancers,2023特刊;Placa J of Cancer Treatment and Diagnosis,2021;Barsouk。Med Sci. 2023;Cramer。口服Oncol。2019;西格尔。加利福尼亚州癌症J临床。2023年;乌西曼。Pathol Res Prac。2022;估计1L可寻址mNSCLC PD-L1 ≥ 50%:SEER;美国癌症协会;Mack Cancer,2020;Evans Pathology and Oncology Research,2018;Ganti。JAMA。2021;罗达克。癌症。2021;ASCO;GlobalData;NCI;Karacz。临床肺癌。2019;沙阿。癌症治疗和研究通讯。2023年;赫伯斯特。柳叶刀。2016; 3.2025年美国估计可寻址1L晚期黑色素瘤患者。SEER皮肤黑色素瘤;Bajaj。J Natl癌症研究所。2020年;本西蒙。J Med Econ。2019;里尼曼。EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. EJC. E2021;卢克。ASCO演示文稿。2023;张。adv ther。2023年;埃格蒙特。Clin Onc的J。2019年;埃格蒙特。NEJM。2022
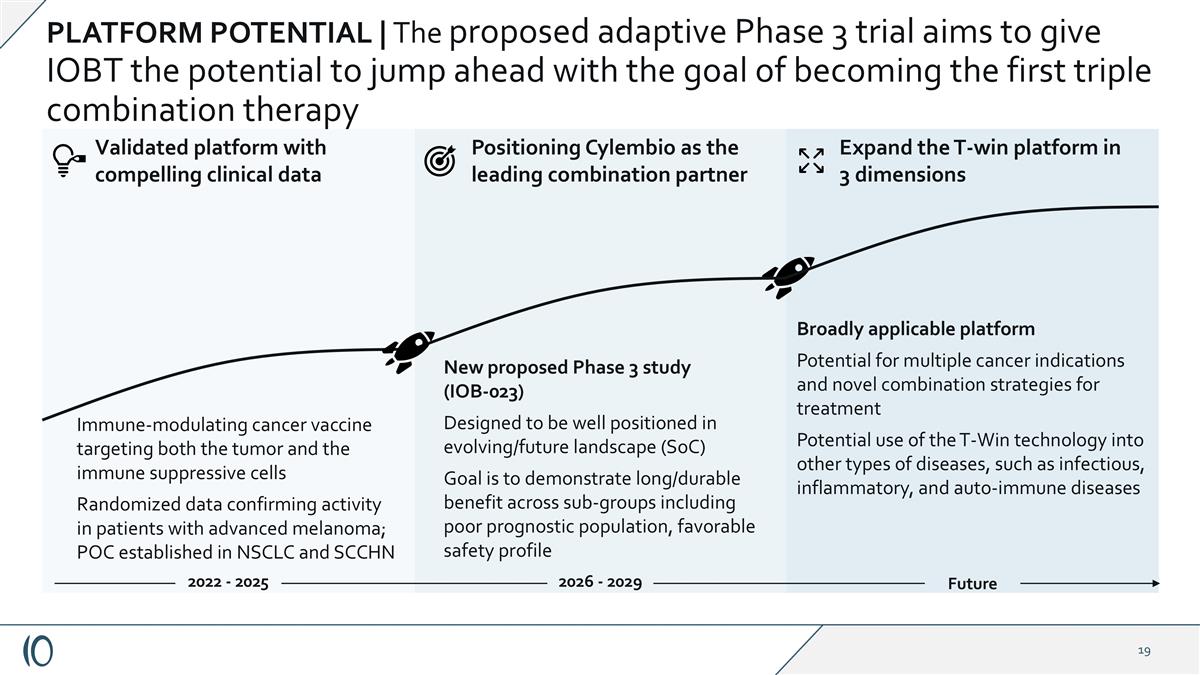
平台潜力|拟议的适应性3期试验旨在赋予IOBT跃升的潜力,目标是成为第一个三联疗法新提议的3期研究(IOB-023)旨在在进化/未来景观(SoC)中处于有利地位,目标是在包括预后不良人群在内的亚群中证明长期/持久的益处,良好的安全性概况未来2026-2029年广泛适用的平台多种癌症适应症的潜力以及用于治疗的新型联合策略T-Win技术在其他类型疾病中的潜在用途,例如传染性、炎症性、和自身免疫疾病拓展T-win平台3个维度免疫调节癌症疫苗同时靶向肿瘤和免疫抑制细胞随机数据证实在晚期黑色素瘤患者中的活性;POC在NSCLC和SCCHN 2022-2025建立的验证平台,具有令人信服的临床数据定位Cylembio作为领先的联合伙伴
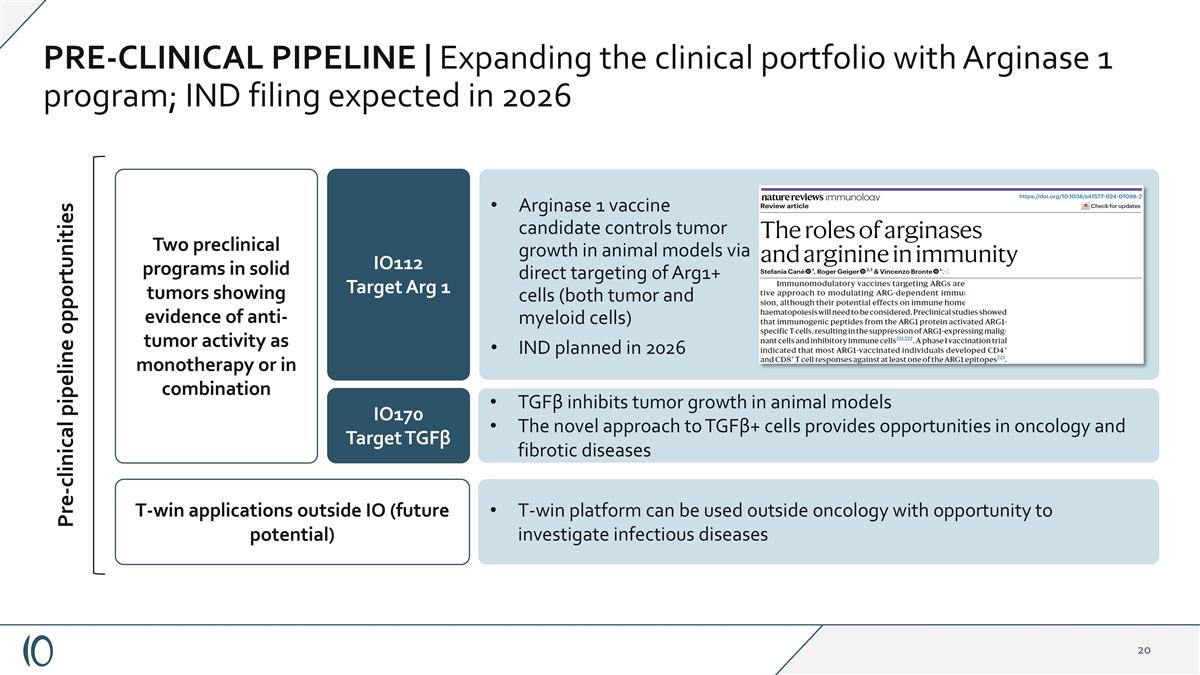
T-win平台可用于肿瘤外有机会调查传染病两个实体瘤临床前项目显示抗肿瘤活性证据作为单一疗法或联合临床前PIPELINE |扩大精氨酸酶1项目的临床组合;预计2026年提交IND申请临床前管道机会IO112靶点Arg 1 IO170靶点TGF β TGF β在动物模型中抑制肿瘤生长TGF β +细胞的新方法提供了肿瘤学机会和纤维化疾病的T-win应用在IO(未来潜力)精氨酸酶1候选疫苗之外,通过直接靶向Arg1 +细胞(包括肿瘤和骨髓细胞)IND在动物模型中控制肿瘤生长,计划于2026年

我们的T赢®平台
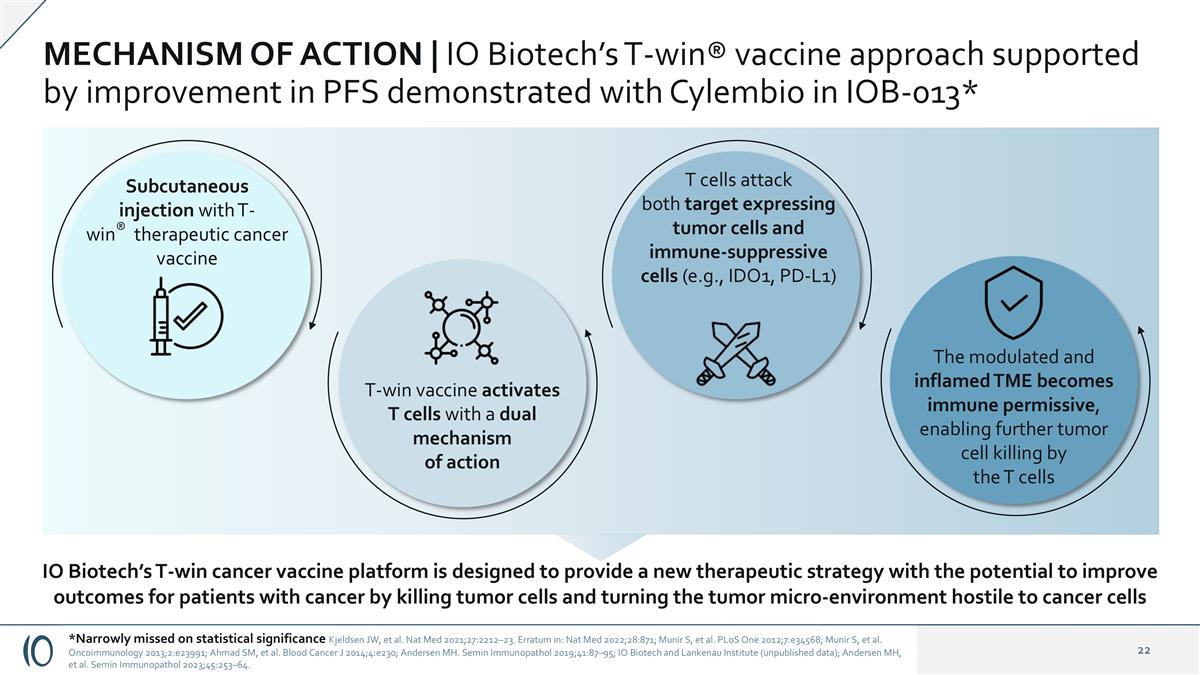
行动机制| IO Biotech的T赢®用Cylembio在IOB-013中证明的改善PFS支持的疫苗方法*皮下注射T-win®治疗性癌症疫苗T-win疫苗以双重作用机制激活T细胞T细胞同时攻击靶标表达肿瘤细胞和免疫抑制细胞(例如IDO1、PD-L1)被调节和发炎的TME变得免疫许可,使T细胞能够进一步杀伤肿瘤细胞IO Biotech的T-win癌症疫苗平台旨在提供一种新的治疗策略,通过杀伤肿瘤细胞并使肿瘤微环境对癌细胞不利,从而有可能改善癌症患者的预后*在统计意义上略有遗漏Kjeldsen JW等NAT Med 2021;27:2212 – 23。Erratum in:Nat Med 2022;28:871;Munir S,et al. PLOS One 2012;7:e34568;Munir S,et al. OncoImmunology 2013;2:e23991;Ahmad SM,et al. Blood Cancer J 2014;4:e230;Andersen MH。Semin Immunopathol 2019;41:87 – 95;IO Biotech和兰克瑙研究所(未公布数据);Andersen MH,et al. Semin Immunopathol 2023;45:253 – 64。
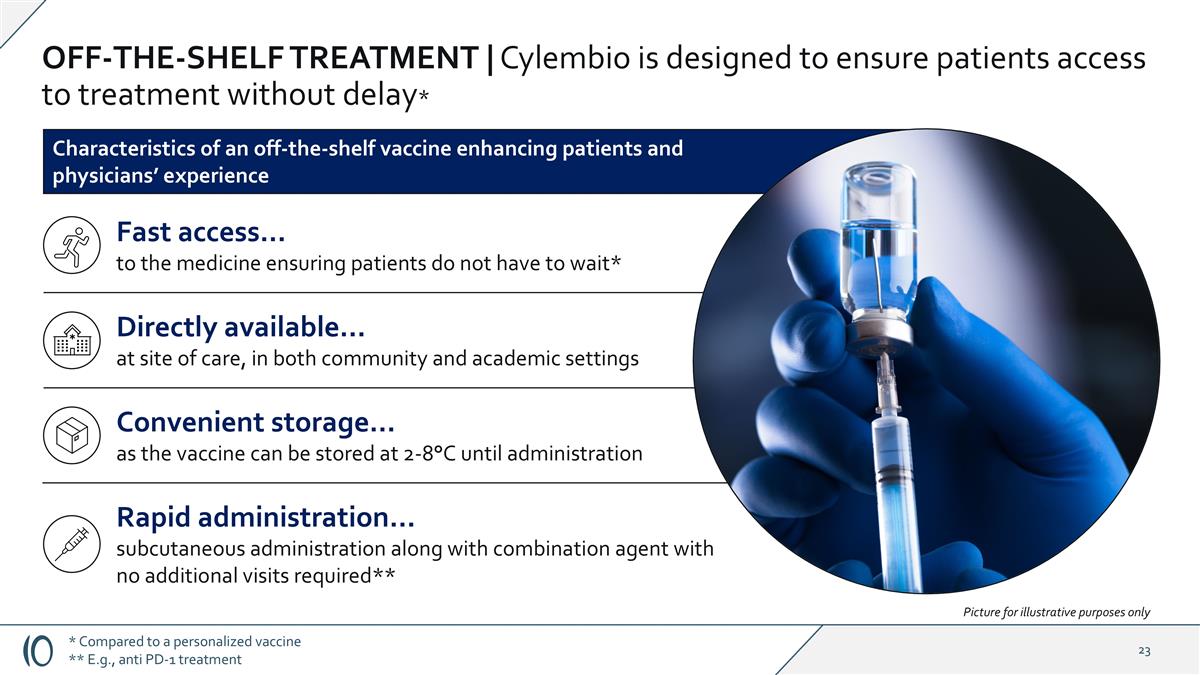
Off-SHELF Treatment | Cylembio旨在确保患者能够毫不延迟地获得治疗**与个性化疫苗相比**例如,抗PD-1治疗现成疫苗的特点增强了患者和医生的经验,可直接获得……在护理现场,在社区和学术环境中快速给药……皮下给药连同联合用药,无需额外就诊**快速获取…药物确保患者不必等待*方便储存…因为疫苗可以在2-8 ° C下储存直到给药图片仅用于说明目的

展望

里程碑|预计到2026年的几个重要里程碑Cylembio | 1L晚期黑色素瘤3期研究中主要终点的顶线读数,2015年第三季度,险些错过统计意义的入组于2025年1月完成新辅助/辅助PH2的初始数据可用2H25;于2026年提交的neoadj/adj PH2队列的完整入组入组于2025年1月完成的入组来自新辅助/辅助PH2的初始数据可用2H25;于2026年提交的neoadj/adj PH2队列IND使能研究的完整入组H1 2025 H2 2025继续准备提交IND cylembio |新辅助/辅助黑色素瘤cylembio | 1L肺(NSCLC)cylembio |头颈(SCCHN)IO112 |实体瘤(临床前)IO170 |实体瘤(临床前)Ph2 BLA的最终数据,双非小细胞肺癌;SCCHN,头颈部鳞状细胞癌可能启动新的3期研究基于IOB-013数据的潜在欧盟MAA提交2026年IND提交额外数据截至2026年第一季度的现金,第三季度现金余额约为3100万美元**2025年5月6日,公司提取了EIB A期贷款融资,获得了本金1000万欧元的资金。2025年7月4日,公司提取了EIB贷款融资的第二期,获得了1250万欧元,未支付某些费用和交易相关费用;在25年第三季度,该公司通过ATM设施出售了约660万美元,扣除费用和开支后

IO Biotech团队

团队|我们拥有一支强大的管理团队,拥有大型生物制药和生物技术经验Mai-Britt Zocca,博士总裁兼首席执行官Amy Sullivan,MBA 首席财务官 Dan Mannix,博士高级副总裁监管丨Devin Smith丨总法律顾问Qasim Ahmad,MD首席医疗官Fai ç al Miyara,博士首席商务官Eric Faulkner,MBA首席技术官Marjan Shamsaei,PharmD高级副总裁商业

团队|我们的管理团队得到董事会和科学顾问委员会Peter Hirth的支持,博士主席Kathleen Sereda Glaub,MBA成员David V. SmithTERM3,MBA成员– Lundbeckfonden Heidi Hunter成员TERM3,MBA成员Mai-Britt Zocca,博士创始人、总裁兼首席执行官Inge Marie Svane,医学博士,博士联合创始人、临床顾问Alexander Eggermont,医学博士,高级临床顾问TERM0 Kapil Dhingra Kapil Dhingra,医学博士战略研发顾问Mads Hald Andersen,DMSC.,博士联合创始人、科学顾问Helen Collins,医学博士董事会科学顾问