美国
证券交易委员会
华盛顿特区20549
表格6-K
根据1934年《证券交易法》第13a-16条或第15d-16条规则,外国私营发行人的报告
2024年10月10日

委员会文件编号:001-39363
IMATICS N.V。
Paul-Ehrlich-Stra ß e 15
72076图宾根,德意志联邦共和国
(主要行政办公室地址)
以复选标记指明注册人是否以表格20-F或表格40-F为掩护提交或将提交年度报告:
| 表格20-F | ☒ |
表格40-F | ☐ |
这份关于表格6-K的报告中包含的信息
2024年10月10日,Immatics N.V.(“公司”或“Immatics”)提供了ACTengine的更新的1b期临床数据®IMA203 TCR-T靶向PRAME在黑色素瘤患者中的应用,并提供了有关SUPRAME的最新信息,这是即将在转移性黑色素瘤患者中评估IMA203的3期试验。IMA203是Immatics最先进的基于TCR的自体细胞疗法,它针对一种源自黑色素瘤中优先表达的抗原(PRAME)的HLA-A * 02-呈现(人类白细胞抗原)肽,PRAME是一种在多种实体癌中经常表达的蛋白质。数据截止日期为2024年8月23日。
患者基线特征。截至数据截止,28名经过大量预处理的转移性黑色素瘤患者在临床试验的1b期剂量扩展部分接受了总TCR-T细胞10至100亿的推荐2期剂量(“RPTD”)的IMA203治疗。接受治疗的患者群体由既往全身治疗中位数为2线的患者组成,包括皮肤黑色素瘤患者(N = 13)、葡萄膜黑色素瘤患者(N = 12)、黏膜黑色素瘤患者(N = 2)和一名原发性不明的黑色素瘤患者(N = 1)。
安全数据。安全人群包括701在所有剂量水平和所有肿瘤类型的试验的1a期剂量递增和1b期剂量扩展部分中的患者。所有患者均观察到≥ 3级治疗中出现的不良事件(“TEAEs”)。如下表所示,最常见的不良事件是与淋巴耗竭相关的预期血细胞减少(1-4级),以及大多数是轻度至中度细胞因子释放综合征(“CRS”)。一些患者很少经历免疫效应细胞相关神经毒性综合征(“ICANS”)(1级:6%的患者,2级:4%的患者,3级:4%的患者)。在安全人群中未观察到5级治疗相关的不良事件,即使剂量高达~10x109TCR-T细胞。1b期黑色素瘤亚群中的耐受性特征与完整的IMA203单药治疗耐受性特征大体一致。
1所有开始淋巴耗竭的患者。包括1名开始淋巴耗竭但未接受IMA203 TCR-T细胞的患者和1名开始淋巴耗竭并在数据截止后安排T细胞输注的患者。
治疗-安全人群中出现的突发不良事件(N = 701)
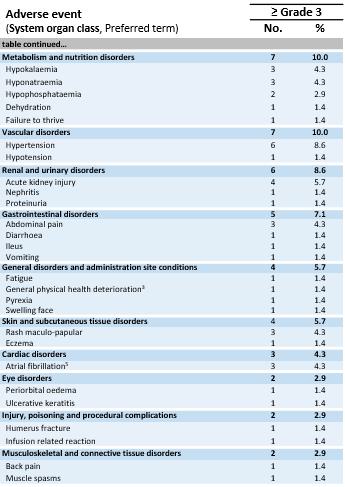
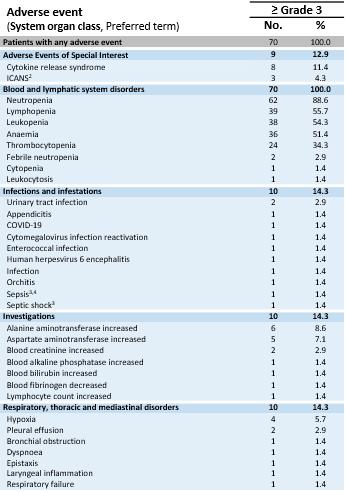
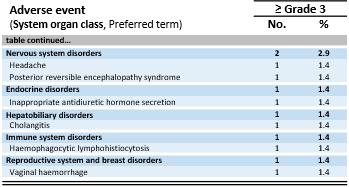
所有TEAEs ≥ 3级不分关联性研究治疗。不良事件使用医学词典进行编码以进行监管活动。等级根据美国国家癌症研究所不良事件通用术语标准5.0版确定。CRS和ICANS的等级是根据CARTOX标准确定的(Neelapu等人,2019年)。每个不良事件和严重程度分类仅统计一次患者。基于从开放临床数据库中提取的中期数据(2024年8月23日);
1首次IMA203输注后有疾病进展的2例患者接受探索性第二次IMA203输注。他们只有在二次输注后才出现这些≥ 3级TEAEs,这些被列入表中:第一例患者:腹痛、细胞因子释放综合征、腹泻、低钾血症、蛋白尿;第二例患者:肱骨骨折、肌肉痉挛、中性粒细胞减少、血小板减少;2例ICANS:免疫效应细胞相关神经毒性综合征;3例致命不良事件未被认为与任何研究药物相关;4例患者死于来源不明的脓毒症,未接受IMA203 TCR-T细胞;5例DLT:2021年3月17日报道的DL2时1a期的剂量限制性毒性。
抗肿瘤活性和耐久性。下表列出了在1b期临床试验的所有黑色素瘤患者和在1b期临床试验的皮肤黑色素瘤患者中观察到的IMA203的抗肿瘤活性和反应的持久性。在黑色素瘤患者群体中,截至目前,14例确诊的应答中有7例正在进行中
数据截止。对于该分析,中位响应持续时间的中位随访时间为9.3个月,而从2024年5月的最新数据更新算起,中位随访时间为3.5个月。
| 1b期所有黑色素瘤患者(N = 282,3) | 皮肤黑色素瘤患者1b期(N = 133) | |
| 确认的客观缓解率 | 54% (14/26) | 54% (7/13) |
| 客观缓解率 | 62% (16/26) | 62% (8/13) |
| 疾病控制率 | 92% (24/26) | 92% (12/13) |
| 肿瘤缩小 | 88% (23/26) | 85% (11/13) |
| 响应持续时间中位数 | 12.1个月 | 12.1个月 |
| 中位无进展生存期 | 6.0个月 | 6.1个月 |
| 总生存期中位数 | 未达到 | 15.9个月 |
IMA203在黑色素瘤中的随时间反应(N = 282, 3)

无进展生存期(“PFS”)和总生存期(“OS”)。在试验的第1b阶段部分之前实施了制造改进,以增强IMA203的关键功能。结果,所有处于剂量扩展阶段的患者都接受了更新版本的IMA203治疗,其中包括使用单核细胞耗竭(阴性选择)或CD8/CD4阳性选择的T细胞富集过程。更新后的数据表明,在1a期治疗的黑色素瘤患者和1b期治疗的患者之间,中位PFS和中位OS发生了显着的积极变化,如下表所示。
| 1b期剂量扩展黑色素瘤患者(N = 28) | 1a期剂量递增黑色素瘤患者(N = 11) | |
| 中位无进展生存期 | 6.0个月 | 2.6个月 |
| 总生存期中位数 | 未达到 | 6.3个月 |
此外,在1b期试验的所有患者中,大约有一半的患者有深度反应(> 50%的肿瘤减少)。观察到该亚组患者的中位PFS超过1年,而肿瘤< 50%的患者
2在数据截止时,另外两名黑色素瘤患者正在等待输注后的首次肿瘤评估。
3根据影响T细胞产品的不同制造版本,黑色素瘤疗效人群不包括在2024年5月更新中报告的试验1a期DL4治疗的5名患者。
与以次优剂量递增治疗的患者相比,仍观察到中位PFS延长2倍以上的情况有所减少(包括肿瘤大小增加的患者)。
转化数据。来自1a期和1b期患者的转化数据表明,IMA203 T细胞在单次给药后在所有患者中迅速移植,并显示出超过两年的持久性。观察到三个关联/相关性,证明在所有接受IMA203治疗且有样本(N = 65)的患者中,剂量暴露、生物学数据和临床结果具有高度一致性:首先,IMA203 T细胞剂量与确认的临床反应显着相关(p = 0.02)。二是IMA203 T细胞剂量与T细胞峰水平相关(c最大,r = 0.84,p = 1.6x10-18).第三,IMA203 T细胞峰值水平(c最大,p = 0.05)和T细胞暴露(AUC0-28d,p = 0.05)与确诊的临床反应相关。
IMA203单药治疗的发展路径与制造。2024年9月24日,Immatics完成了与美国食品药品监督管理局(“FDA”)的D型会议,以确认RPTD和化学、制造和控制(“CMC”)包,并讨论SUPRAME的试验设计,这是计划中的IMA203的注册启用3期随机对照临床试验。已收到FDA的书面会后会议记录。
SUPRAME将在360例HLA-A * 02:01阳性的二线或以后(2L +)不可切除或转移性黑色素瘤患者中评估IMA203靶向PRAME,这些患者之前接受过检查点抑制剂的治疗。患者将按1:1随机分配IMA203或研究者在2L +环境中选择选定的批准治疗。根据该公司与FDA的讨论,完全批准的主要终点将是中位数PFS。鉴于该患者群体中2-3个月的预期PFS,以及IMA203 1b期试验数据中观察到的6个月的PFS,该公司已确定,使用中位数PFS作为主要终点是寻求完全批准的最快途径,并且与客观缓解率(“ORR”)相比,呈现出更具吸引力的商业定位。该试验的次要终点将包括ORR、安全性、应答持续时间、无总生存期损害和患者报告的结果。计划在2026年初进行预先指定的中期分析。
SUPRAME 3期试验计划在全球范围内运行,地点在美国和欧洲,初步目标是在美国寻求生物制品许可申请(“BLA”)批准。2024年10月2日,Immatics也完成了与德国监管部门Paul Ehrlich Institute(PEI)的会面,确定了在德国开展临床试验的相同试验设计。
SUPRAME 3期试验有望于2024年12月开始,预计2026年完成患者入组。该公司的目标是在2027年初提交BLA以获得全面批准。
Immatics的后期临床细胞疗法开发得到其与时间轴、能力和设施相关的差异化制造的支持。IMA203细胞治疗产品在7天内制造完成,随后进行7天的QC释放测试,成功率> 95%达到目标剂量。该公司还完成了约100,000平方英尺的研发和良好生产规范(“GMP”)制造设施的建设,该设施采用模块化设计,可实现高效且具有成本效益的可扩展性,旨在服务于早期阶段和注册授权试验,以及商业供应。新址预计将于2025年初开始细胞治疗产品的GMP制造。与此同时,与UT Health合作运营的现有GMP设施将保持活跃状态,直到2025年底。
* * *
鉴于上述情况,公司发布了一份新闻稿,其副本作为附件 99.1附于本文件后,并提供了一份演示文稿,其副本作为附件 99.2附于本文件后,并提供了一份更新的公司演示文稿,其副本作为附件附件 99.3附于本文件后。
本报告中的某些陈述可能被视为前瞻性陈述。前瞻性陈述通常涉及未来事件或公司未来的财务或经营业绩。例如,有关产品候选者数据读出的时间、临床试验的时间、结果和设计、临床试验的性质(包括此类临床试验是否将使能注册)、临床前阶段产品候选者的IND或CTA备案的时间、临床阶段产品候选者的BLA备案的时间、产品候选者的估计市场机会、制造时间表、产能和成功的声明
费率、该公司专注于合作伙伴关系以推进其战略,其他指标均为前瞻性陈述。在某些情况下,您可以通过“可能”、“应该”、“预期”、“计划”、“目标”、“打算”、“将”、“估计”、“预期”、“相信”、“预测”、“潜在”或“继续”等术语来识别前瞻性陈述,或者这些术语的否定或它们的变体或类似术语。此类前瞻性陈述受到风险、不确定性和其他因素的影响,这些因素可能导致实际结果与此类前瞻性陈述明示或暗示的结果存在重大差异。这些前瞻性陈述基于估计和假设,尽管Immatics及其管理层认为这些估计和假设是合理的,但本质上是不确定的。新的风险和不确定因素可能会不时出现,不可能预测所有的风险和不确定因素。可能导致实际结果与当前预期存在重大差异的因素包括但不限于管理层无法控制的各种因素,包括一般经济状况以及公司在20-F表格年度报告和向美国证券交易委员会(SEC)提交的其他文件中列出的其他风险、不确定性和因素。本报告中的任何内容均不应被视为任何人表示将实现本文所述的前瞻性陈述或将实现此类前瞻性陈述的任何预期结果。你不应该过分依赖前瞻性陈述,这些陈述仅在作出之日起生效。公司不承担更新这些前瞻性陈述的义务。本报告中提供的所有科学和临床数据——根据定义,在完成临床试验和临床研究报告之前——本质上是初步的,并接受进一步的质量检查,包括惯常的来源数据验证。
参照成立
这份关于表格6-K的报告(本协议的附件99.1、99.2和99.3除外)应被视为以引用方式并入Immatics N.V.的表格F-3(注册号333-240260和333-274218)上的注册声明中,并自本报告提交之日起成为其中的一部分,但以不被随后提交或提供的文件或报告所取代为限。
展览指数
| 附件编号 | 说明 |
| 99.1 | 2024年10月10日新闻稿 |
| 99.2 | 2024年10月10日的介绍 |
| 99.3 | 2024年10月10日公司介绍 |
签名
根据1934年《证券交易法》的要求,注册人已正式安排由以下签署人代表其签署本报告,并因此获得正式授权。
| IMATICS N.V。 | ||
| 日期:2024年10月10日 | ||
| 签名: | /s/Harpreet Singh | |
| 姓名: | Harpreet Singh | |
| 职位: | 首席执行官 | |