
公司概况2024年08月附件 99.2

本演示文稿中包含的某些信息和在本演示文稿中口头作出的陈述涉及或基于从第三方来源获得的研究、出版物、调查和其他数据以及Verrica自己的内部估计和研究。虽然Verrica认为,截至本介绍之日,这些第三方来源是可靠的,但它没有独立核实,也不对从第三方来源获得的任何信息的充分性、公平性、准确性或完整性作出任何陈述。虽然Verrica认为其内部研究是可靠的,但此类研究尚未得到任何独立消息来源的验证。本演示文稿包含经修订的1933年《证券法》第27A条和经修订的1934年《证券交易法》第21E条或《交易法》含义内的前瞻性陈述,这些陈述涉及重大风险和不确定性。在某些情况下,您可以通过“可能”、“可能”、“将”、“可能”、“将”、“应该”、“预期”、“打算”、“计划”、“目标”、“预期”、“相信”、“估计”、“预测”、“项目”、“潜在”、“继续”和“进行中”等词语来识别前瞻性陈述,或这些术语的否定词,或旨在识别关于未来的陈述的其他类似术语。这些陈述涉及已知和未知的风险、不确定性和其他因素,这些因素可能导致我们的实际结果、活动水平、业绩或成就与这些前瞻性陈述所表达或暗示的信息存在重大差异。尽管我们认为,我们对本演示文稿中包含的每项前瞻性陈述都有合理的依据,但我们提醒您,这些陈述是基于我们目前所了解的事实和因素以及我们对未来的预期的组合,对此我们无法确定。前瞻性陈述包括以下方面的陈述:我们对用于治疗传染性软疣的YCANTH(以前称为VP-102)的商业化的预期以及我们开发和商业化我们的候选产品的计划;我们计划对我们的候选产品进行临床试验的时间安排;我们维持YCANTH(VP-102)用于治疗传染性软疣的监管批准或获得YCANTH(VP-102)用于治疗外生殖器疣和、普通疣和我们的其他候选产品的额外适应症的批准的能力;我们的候选产品的临床效用;我们的商业化,营销和制造能力及战略;我们对医疗保健专业人员使用YCANTH(VP-102)治疗传染性软疣、VP-315治疗基底细胞癌和我们的任何候选产品的意愿的预期;我们对第三方付款人报销或患者支付YCANTH(VP-102)治疗传染性软疣和我们的任何候选产品的预期;我们的知识产权地位;我们计划在许可、收购、为其他皮肤病条件开发和商业化额外的候选产品,以建立一个完全整合的皮肤病公司;我们的竞争地位以及与我们的竞争对手或我们的行业相关的开发和预测;我们对基底细胞癌市场规模的预期;我们识别、招聘和留住关键人员的能力;法律法规的影响;我们计划确定与我们的商业目标一致的具有重大商业潜力的额外候选产品;以及我们对未来收入、费用和额外融资需求的估计。您应该参考我们的10-K表格年度报告中的“风险因素”、我们截至2024年6月30日的季度10-Q表格季度报告以及我们向SEC提交的其他文件,以讨论可能导致我们的实际结果与我们的前瞻性陈述中明示或暗示的结果存在重大差异的重要因素。由于这些因素,我们无法向您保证,本演示文稿中的前瞻性陈述将被证明是准确的。此外,如果我们的前瞻性陈述被证明是不准确的,那么不准确可能是重大的。鉴于这些前瞻性陈述中的重大不确定性,您不应将这些陈述视为我们或任何其他人的陈述或保证,即我们将在任何指定的时间范围内实现我们的目标和计划,或者根本不会。本演示文稿中的前瞻性陈述代表我们截至本演示文稿发布之日的观点。我们预计,随后的事件和发展可能会导致我们的观点发生变化。然而,尽管我们可能会选择在未来某个时候更新这些前瞻性陈述,但我们不承担公开更新任何前瞻性陈述的义务,无论是由于新信息、未来事件或其他原因, 法律规定的除外。因此,您不应依赖这些前瞻性陈述来代表我们在本演示文稿日期之后的任何日期的观点。除非另有说明或上下文另有要求,否则本演示文稿中对“公司”、“我们”、“我们的”、“我们的”、“我们”或类似术语的所有提及均指本演示文稿中出现的Verrica Pharmaceuticals Inc.“Verrica”、Verrica徽标、YCANTH(VP-102)和Verrica制药 Inc.的其他商标或服务标记是Verrica Pharmaceuticals Inc.的财产。本演示文稿包含其他商号、商标和他人的服务标记,这些均为其各自所有者的财产。免责声明

重塑皮肤科疗法,重点关注临床医生给药的疗法和未满足的高需求的开发和商业化,重点关注具有报销潜力的产品,作为一种医疗福利,为皮肤病患者提供有意义的福利。版权所有© 2024 Verrica制药。版权所有。不用于推广用途Verrica是一家皮肤病治疗公司,为需要医疗干预的皮肤病开发药物
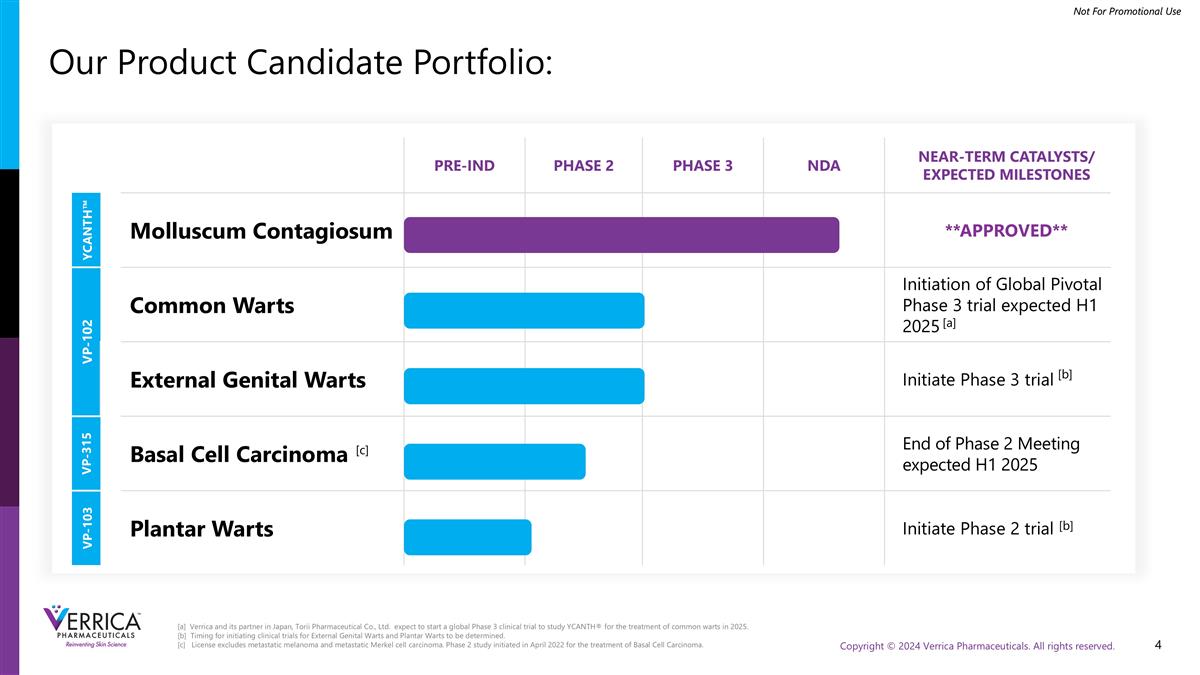
[ a ] Verrica及其在日本的合作伙伴Torii Pharmaceutical Co.,Ltd.预计将于2025年启动全球3期临床试验,研究YCANTH ®用于治疗普通疣。[ b ]外生殖器疣、足底疣启动临床试验时间待定。[ c ]许可不包括转移性黑色素瘤和转移性默克尔细胞癌。2期研究于2022年4月启动,用于治疗基底细胞癌。Pre-IND Phase 2 Phase 3 NDA NeAR-term CATALYSTS/Expected Milestones YCANTH ™ Molluscum Contagiosum * * Approved * * VP-102 Common Warts Initiation of Global Pivotal Phase 3 Trial expected H1 2025 External Genital Warts Initiate Phase 3 Trial VP-315 Basal Cell Cancinoma End of Phase 2 Meeting Expected H1 2025 VP-103 Plantar Warts Initiate Phase 2 Trial [ b ] [ c ] [ a ] [ b ]我们的候选产品组合:
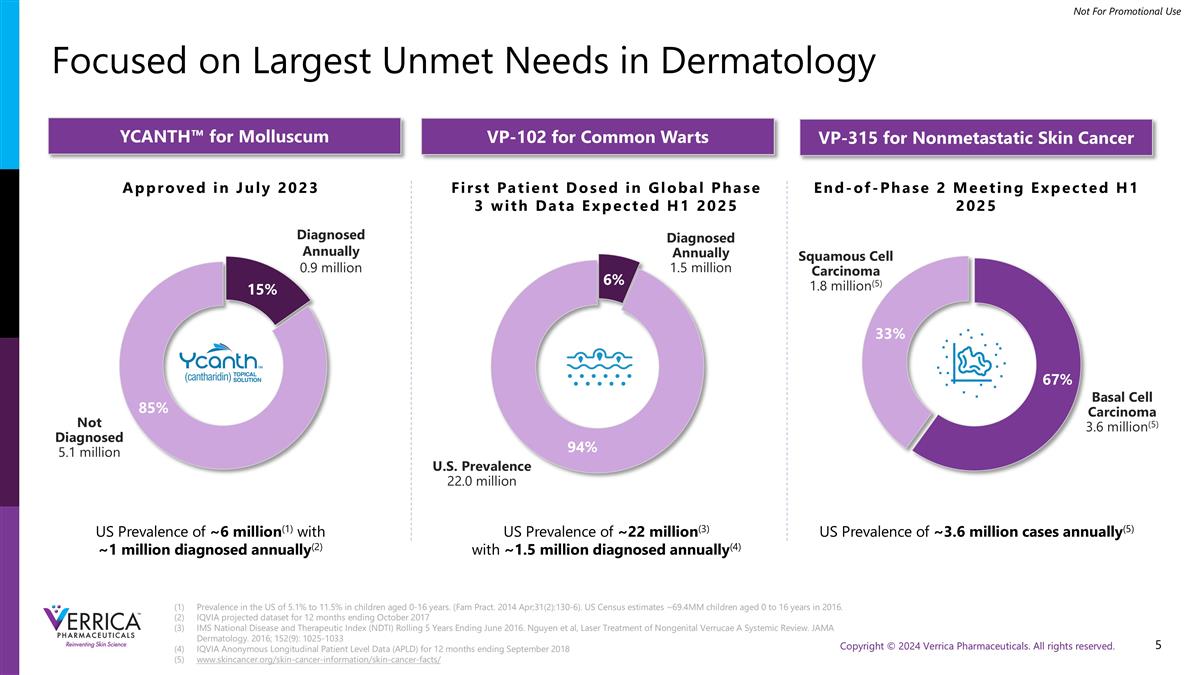
专注于美国0-16岁儿童皮肤科发病率5.1%至11.5%的最大未满足需求。(Fam Pract。2014年4月;31日(2):130-6)。美国人口普查估计,2016年0至16岁的儿童约为69.4mm。截至2017年10月的12个月的艾昆纬预测数据集IMS国家疾病和治疗指数(NDTI)滚动5年截至2016年6月。Nguyen et al,Laser Treatment of Nongenital Verrucae a System Review。JAMA皮肤科。2016;152(9):1025-1033截至2018年9月的12个月艾昆纬匿名纵向患者水平数据(APLD)www.skincancer.org/skin-cancer-information/skin-cancer-facts/2023年7月批准未诊断510万例每年诊断90万例YCANTH ™用于软疣VP-102用于普通疣VP-315用于非转移性皮肤癌全球3期首例患者给药数据预计2025年上半年2期结束会议预计2025年上半年基底细胞癌360万例(5)鳞状细胞癌180万例(5)85% 15% 94% 6%美国流行率2200万例年确诊150万例美国流行率~600万例(1)年确诊~100万例(2)美国流行率~2200万例(3)年确诊~150万例(4)美国流行率~360万例年(5)67% 33%

(1)FDA拥有监管复合剂的权力。如果重复犯罪和意图欺诈/误导,不适当的复利可能会导致罚款加上重罪定罪。(2)就天然来源的斑点素订立供应协议;根据规定的最低年度采购订单和预测,供应商同意不向北美任何其他有效的客户供应斑点素、任何甲虫或其他斑点素来源的原材料,这些客户包括:英国、比利时、丹麦、芬兰、法国、德国、意大利、荷兰、挪威、波兰、西班牙、瑞典,瑞士和土耳其授予斑点素作为原料药的5年NCE独占权;可能额外获得6个月的普通疣和足底疣适应症的儿科独占权Verrica已经并将强制执行其权利,寻求从市场上移除任何基本上是YCANTH副本的复方斑点素,除非它符合FDA法定豁免。此外,随着YCANTH ™的批准,Verrica已向FDA提出请求,要求将斑点素从503B第1类中移除,并已向FDA寻求进口警报,以在进口到美国之前扣留任何复合斑点素。(1)YCANTH ™有可能解决标准包装和容器/封闭系统监管排他性的稳定性问题;专利组合复合药房制造(2)仿制药进入ANDA批准的障碍可能会受到专利待决保护的阻碍以及YCANTH ™与潜在竞争对手之间的显着差异,限制了具有处理高强效设施的商业CMO和高度易燃液体产品YCANTH ™专利申请:特定配方申请方使用方法设计综合法规、知识产权和制造战略,以保持YCANTH ™排他性;VP-315 COM颁发的保护

VP-315 PCT/EP2009/006774;Composition-of-Matter(COM)专利,已授予到期2032年(美国)到期2029年(欧洲(1),日本,AU,BR,加利福尼亚州,CN,IN,JP,KR,NZ,RU,and SG)PCT/EP2017/052279;使用方法专利,正待到期2037年(预计在美国、欧洲、日本、CN、KR)到期2037年(澳大利亚已授予)PCT/EP2023/087127;制剂专利,正待到期2043(预期)PCT申请正待PCT/EP2023/087135;壳聚糖制剂专利,正待到期2043(预期)PCT申请正待PCT/US2024/024185;管理波兰、西班牙、瑞典、瑞士和土耳其

拥有广泛产品发布和皮肤科经验的管理团队Select product launch Terry Kohler 首席财务官首席医疗官Gary Goldenberg、MD Ted White总裁兼首席执行官Joe Bonaccorso首席商务官

基底细胞癌潜在解决方案:VP-315状态:第2阶段会议结束预计2025年上半年

概述基底细胞癌(BCC)疾病概述BCC的特点是缓慢的局部侵袭性生长,可对皮肤和周围组织造成破坏性缩写:ASIP:Agouti信号蛋白;MC1R:Melanocortin-1受体;TYR:酪氨酸酶;UV:紫外线;BCC:基底细胞癌1. www.skincancer.org/skin-cancer-information/skin-cancer-facts/2。中,徐。“基底细胞癌。”整形外科档案39.02(2012):166-170。3.Piva de Freitas,Paola,et al.“转移性基底细胞癌:一种常见疾病的罕见表现”医学界病例报告2017. 1(2017):8929745。4.Tyagi,Ruchita,et al.“躯干结节性囊性基底细胞癌:一个毫无戒心的年轻人的诊断困境。”伊朗病理学杂志12.4(2017):410。5.Lewis KG,Weinstock MA。1969年至2000年美国非黑色素瘤皮肤癌死亡率趋势。J投资Dermatol 2007;127:2323-7。基底细胞基底膜黑色素细胞基底细胞癌表皮真皮下层肌层伴有多种病因,BCC是一种上皮性肿瘤,主要被认为是由位于表皮基底层的多电位细胞引起的。概述BCC是最常见的癌症(美国每年诊断出3.6m(1)个病例),在世界范围内发病率不断上升(美国在1994年至2014年期间上升了77%)(1)每三个新发癌症中就有超过一个是皮肤癌,绝大多数是BCC(1)被诊断出的BCC患者有35%的几率在3年内发生另一次(非复发)病变,5年内或高达50%以上(2,5)尽管发病率很高,但BCC很少致命,转移率也非常低(< 1%)(3)长期暴露于紫外线辐射是最大的风险因素;额外的环境因素包括晒黑床和靠近赤道(即由于紫外线照射导致的较高风险)表型和遗传因素也有助于BCC的发展,例如浅色皮肤色素沉着、头发/眼睛颜色、年龄、男性性别,以及皮肤癌的遗传史BCCs通常出现在身体更多暴露于阳光的区域,有~80%的BCCs位于面部和头部(4);其他BCCs最常见于躯干和四肢BCCs以临床多样的方式存在;然而,结节型是最常见的形态亚型,约占病例的60-80 %(4)呈现危险因素
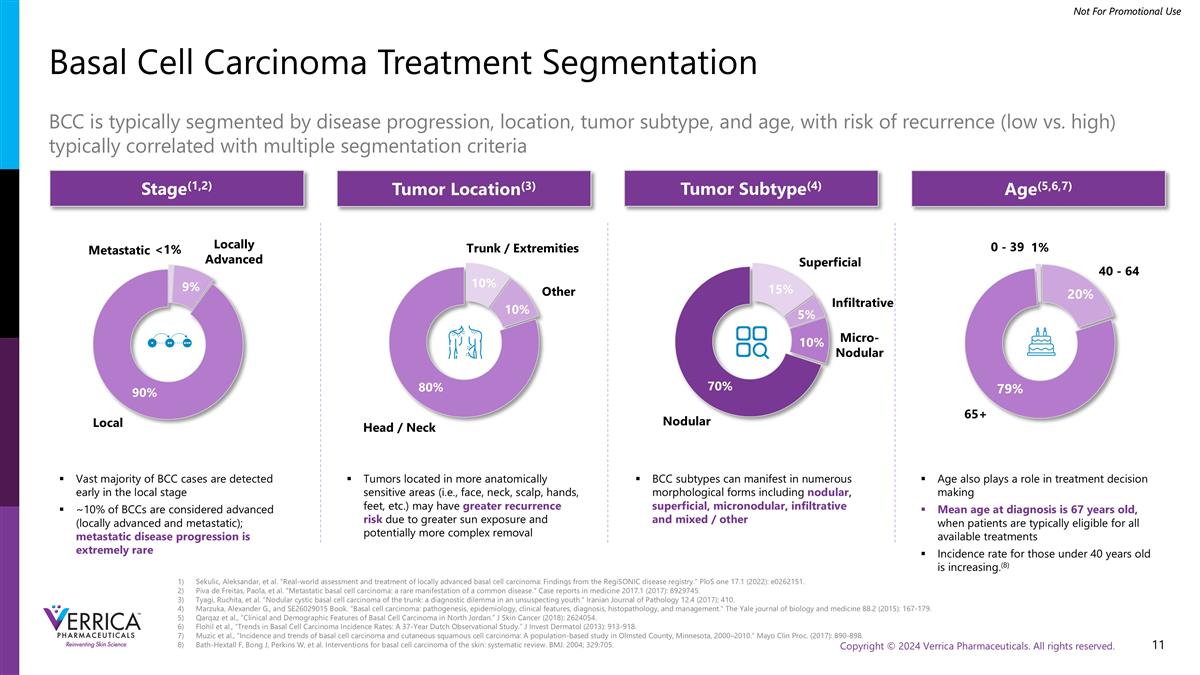
Sekulic,Aleksandar,et al.“局部晚期基底细胞癌的真实世界评估和治疗:RegionSONIC疾病登记处的发现。”PLOS One 17.1(2022):e0262151。Piva de Freitas,Paola,et al.“转移性基底细胞癌:一种常见疾病的罕见表现”医学界病例报告2017. 1(2017):8929745。Tyagi,Ruchita,et al.“躯干结节性囊性基底细胞癌:一个毫无戒心的年轻人的诊断困境”伊朗病理学杂志12.4(2017):410。Marzuka、Alexander G.和SE26029015 Book。“基底细胞癌:发病机制、流行病学、临床特征、诊断、组织病理学、管理。”The Yale Journal of Biology and Medicine 88.2(2015):167-179。Qarqaz等人,“约旦北部基底细胞癌的临床和人口统计学特征。”J皮肤癌(2018):2624054。Flohil等人,“基底细胞癌发病率趋势:一项为期37年的荷兰观察性研究。”J Invest Dermatol(2013):913-918。Muzic等人,“基底细胞癌和皮肤鳞状细胞癌的发病率和趋势:明尼苏达州奥姆斯特德县的一项基于人群的研究,2000 – 2010年。”Mayo Clin Proc。(2017): 890-898.Bath-Hextall F,Bong J,Perkins W,et al.皮肤基底细胞癌的干预措施:系统综述。BMJ。2004; 329:705.基底细胞癌治疗分割BCC通常按疾病进展、位置、肿瘤亚型和年龄进行分割,复发风险(低vs.高)通常与多个分割标准相关阶段(1,2)肿瘤位置(3)肿瘤亚型(4)年龄(5,6,7)绝大多数BCC病例在局部早期发现~10%的BCCs被认为是晚期(局部晚期和转移性);转移性疾病进展是极其罕见的肿瘤,位于更具解剖学敏感性的区域(即面部、颈部、头皮、手、脚,等)可能由于更多的阳光照射而具有更大的复发风险,并且潜在的更复杂的去除BCC亚型可以表现为多种形态形式,包括结节性、浅表性、微结节性、浸润性和混合性/其他年龄也在治疗决策中发挥作用诊断时的平均年龄为67岁,此时患者通常符合所有可用治疗的条件40岁以下人群的发病率正在增加。(8)<局部1微结节性局部晚期
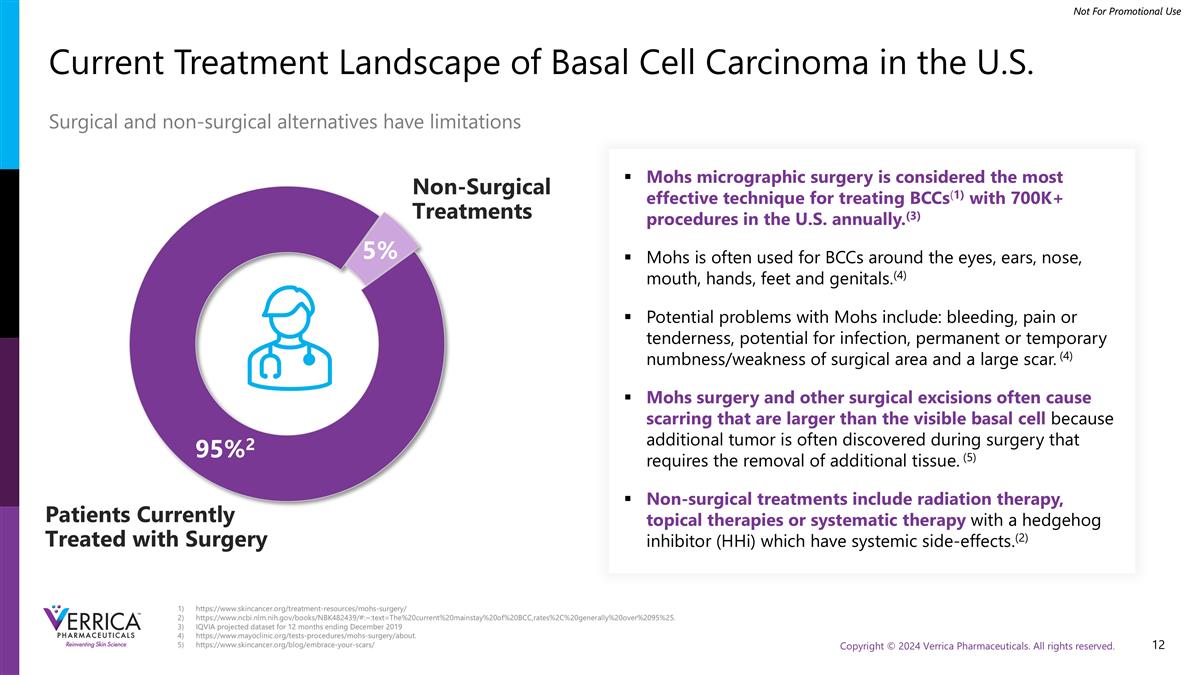
https://www.skincancer.org/treatment-resources/mohs-surgery/https://www.ncbi.nlm.nih.gov/books/NBK482439/#:~:text=the%20current%20main % 20of%20BCC,rates % 2c%20generally % 20over % 2095% 25。艾昆纬预测的截至2019年12月的12个月的数据集https://www.mayoclinic.org/tests-procedures/mohs-surgery/about. https://www.skincancer.org/blog/embrace-your-scars/美国基底细胞癌的当前治疗前景。手术和非手术替代方案存在局限性,目前接受手术治疗的患者95% 25%非手术治疗mohs显微手术被认为是治疗BCCs(1)的最有效技术,在美国每年有700K +的手术。(3)mohs通常用于眼、耳、鼻、口、手、脚和生殖器周围的BCCs。(4)mohs的潜在问题包括:出血、疼痛或压痛、潜在的感染、手术区域的永久性或暂时性麻木/无力和大(4)mohs手术和其他手术切除通常会导致比可见基底细胞更大的疤痕,因为在需要切除额外组织的手术中经常会发现额外的肿瘤。(5)非手术治疗包括放射治疗、局部治疗或使用具有全身副作用的刺猬抑制剂(HHI)进行系统治疗。(2)
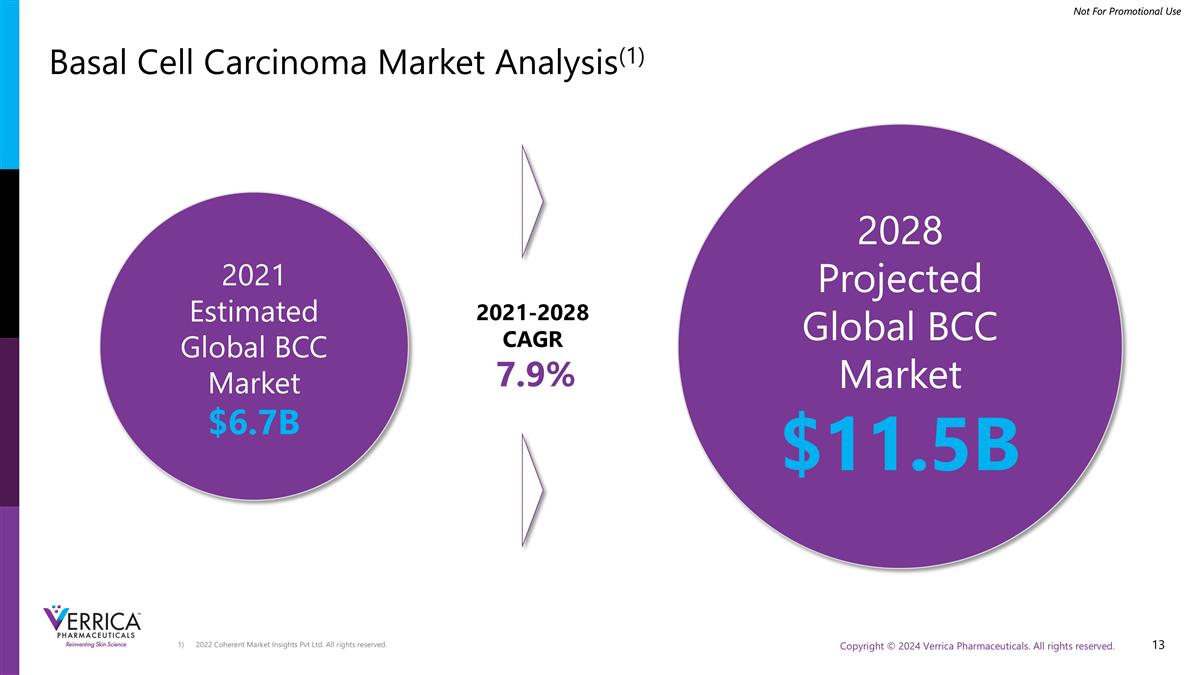
2022 Coherent Market Insights Pvt Ltd.版权所有。基底细胞癌市场分析(1)2021年预计全球BCC市场$ 6.7B 2021-2028 CAGR7.9 % 2028年预计全球BCC市场$ 11.5B

VP-315一种潜在的非手术替代品
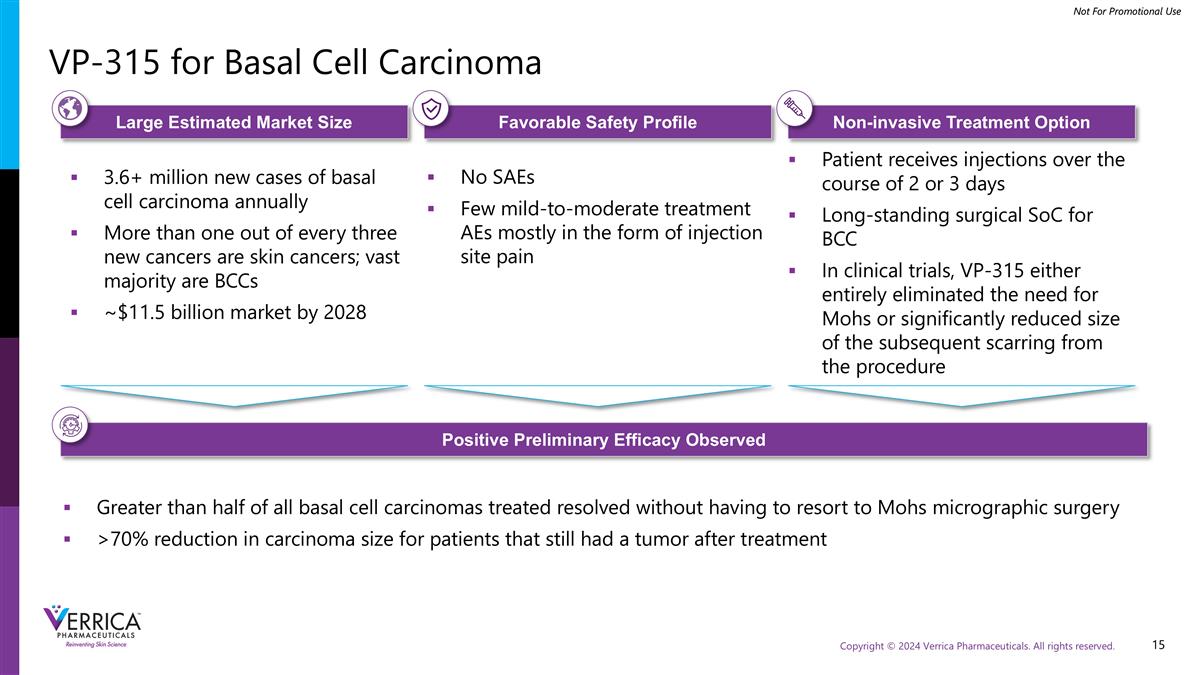
用于基底细胞癌的VP-315估计市场规模大、安全性好、无创治疗方案积极初步疗效观察到每年新增360万+例基底细胞癌每三种新发癌症中就有超过一种是皮肤癌;到2028年绝大多数是BCCs~115亿美元的市场没有SAE很少有轻中度治疗AEs主要以注射部位疼痛的形式出现患者在2或3天的过程中接受注射长期存在的用于BCC的手术SoC在临床试验中,VP-315要么完全消除了对mohs的需求,要么从手术中显着缩小了后续瘢痕的大小超过一半的基底细胞癌治疗解决了,而无需求助于mohs显微手术>对于治疗后仍有肿瘤的患者,癌大小减少了70%
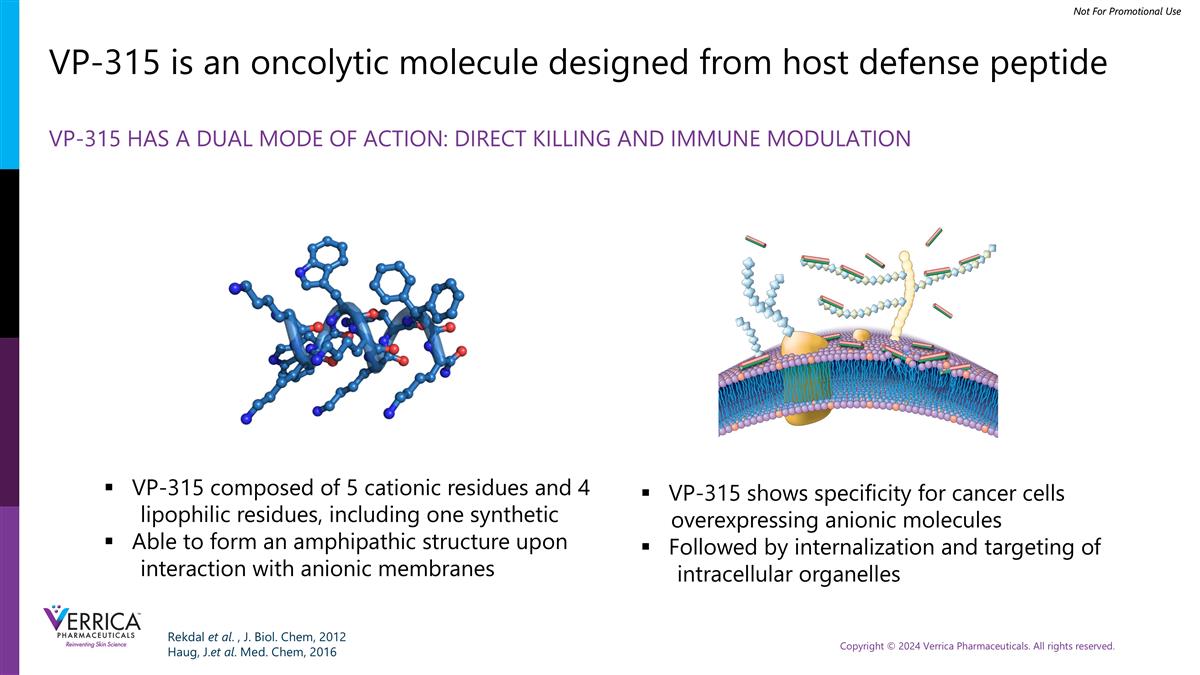
VP-315是一种由宿主防御肽VP-315设计的溶瘤分子,具有双重作用模式:直接杀伤和免疫调节VP-315由5个阳离子残基和4个亲脂性残基组成,包括一种合成的能够在与阴离子膜相互作用时形成两亲结构的VP-315,显示出对过表达阴离子分子的癌细胞的特异性,随后是内化和靶向细胞内细胞器Rekdal等人,J. Biol。Chem,2012 Haug,J.et al. Med. Chem,2016
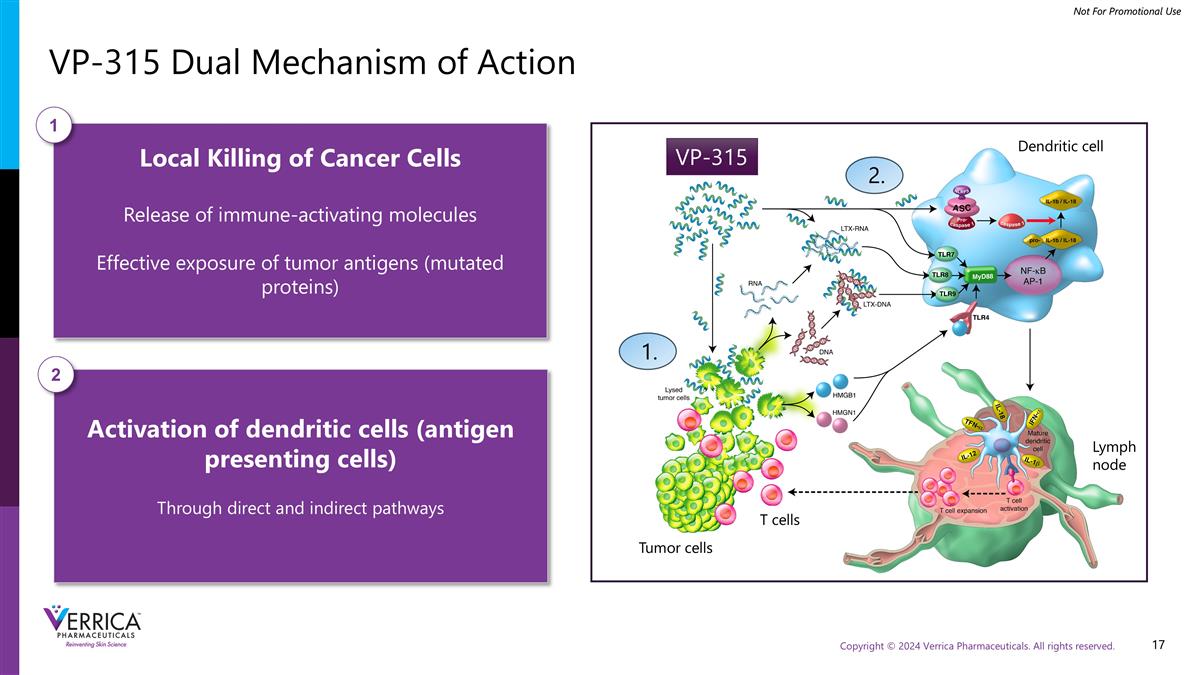
VP-315双重作用机制局部杀伤癌细胞释放免疫激活分子肿瘤抗原(突变蛋白)的有效暴露1通过直接和间接途径激活树突状细胞(抗原呈递细胞)2 VP-315 1。2.肿瘤细胞T细胞淋巴结树突状细胞

VP-315 2期临床研究设计开放标签概念验证研究以评估安全性和耐受性、剂量方案、疗效研究由两部分组成(第1部分和第2部分);第1部分的主要目标是评估第2部分的最大耐受剂量第1部分第2部分旨在探索以递增剂量给药个体受试者时的初始VP-315安全性概况,旨在快速评估最大耐受剂量(MTD)并确定VP-315诱导每个治疗病灶坏死的能力,同时寻求建立BCC的AE-profile。第1部分更新:VP-315 2期试验的第1部分招募了10名受试者,并展示了良好的安全性和耐受性,没有报告严重的不良事件。接受较高剂量范围的受试者经历了临床肿瘤坏死的一致反应。旨在根据安全性和耐受性确定给药8mg VP-315的最佳方案旨在确认从第1部分确定的探索性剂量(8mg VP-315)并确定第2部分的推荐方案,队列4(连续几天两次给药)和5(连续几天三次给药)在队列2中注意到疼痛的剂量限制性毒性,因此省略了队列3,并在队列4和5中使用了研究第1部分中使用的注射方案,因为它没有显示出任何耐受性问题。队列1 & 2队列4 & 5旨在获得有关VP-315的安全性、耐受性和给药方案的信息,以支持一项关键的P3研究,该研究旨在评估第2部分、队列1和2 Verrica中VP-315最佳给药方案的安全性和耐受性,以评估BCC肿瘤的完全清除和肿瘤大小缩小,以确定VP-315药代动力学的最佳给药方案,还评估患者报告的结果和医生的整体评估

VP-315 2期设计及初步结果

VP-315 2期BCC:初步疗效结果基底细胞癌完全清除率51%残余癌患者肿瘤大小缩小71%肿瘤大小总体缩小86%
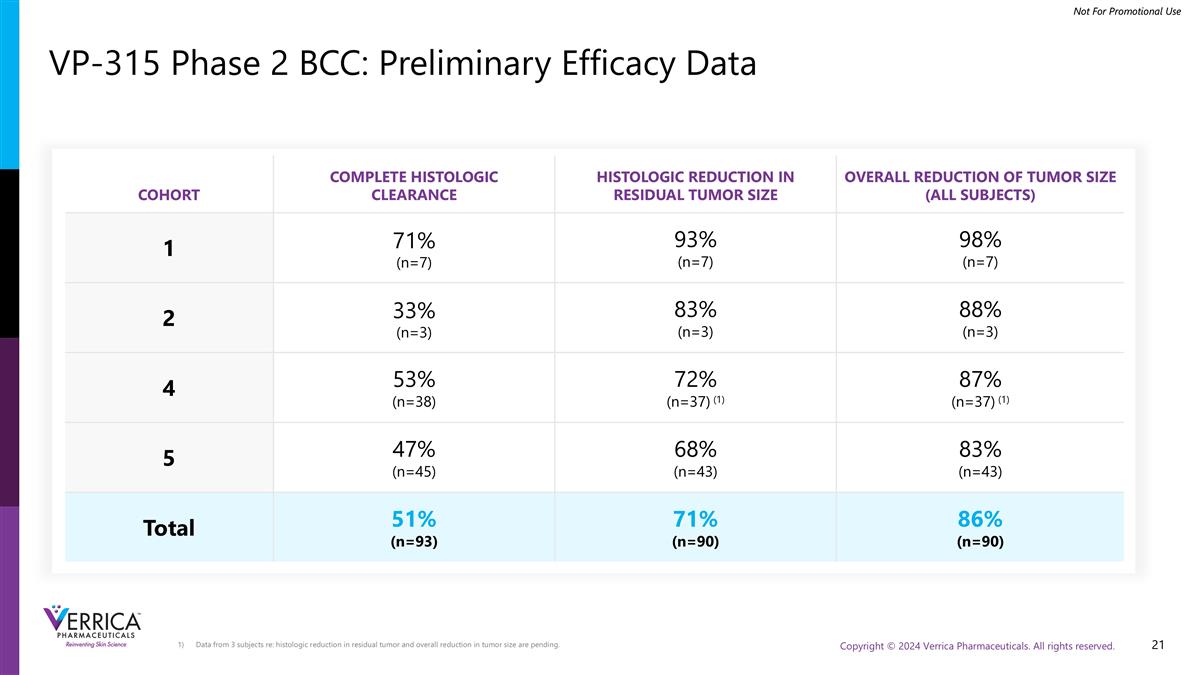
COHORT完全组织学明确组织学减少残余性肿瘤大小总体减少肿瘤大小(所有受试者)171%(n = 7)93%(n = 7)98%(n = 7)233%(n = 3)83%(n = 3)88%(n = 3)453%(n = 38)72%(n = 37)(1)87%(n = 37)(1)547%(n = 45)68%(n = 43)83%(n = 43)合计51%(n = 93)71%(n = 90)86%(n = 90)3个受试者的数据re:histHistHistHistHistHistHistHistHistHistHistHistHistHistHistHistHistHistHistHistHistHistHistHistHistHistHistHistHistHistHistHVP-315 2期BCC:初步疗效数据
VP-315 2期BCC:初步安全性和耐受性结果未报告与治疗相关的严重不良事件(SAE)大多数与治疗相关的不良事件(TRAE)为轻度至中度,并观察到预期的皮肤反应
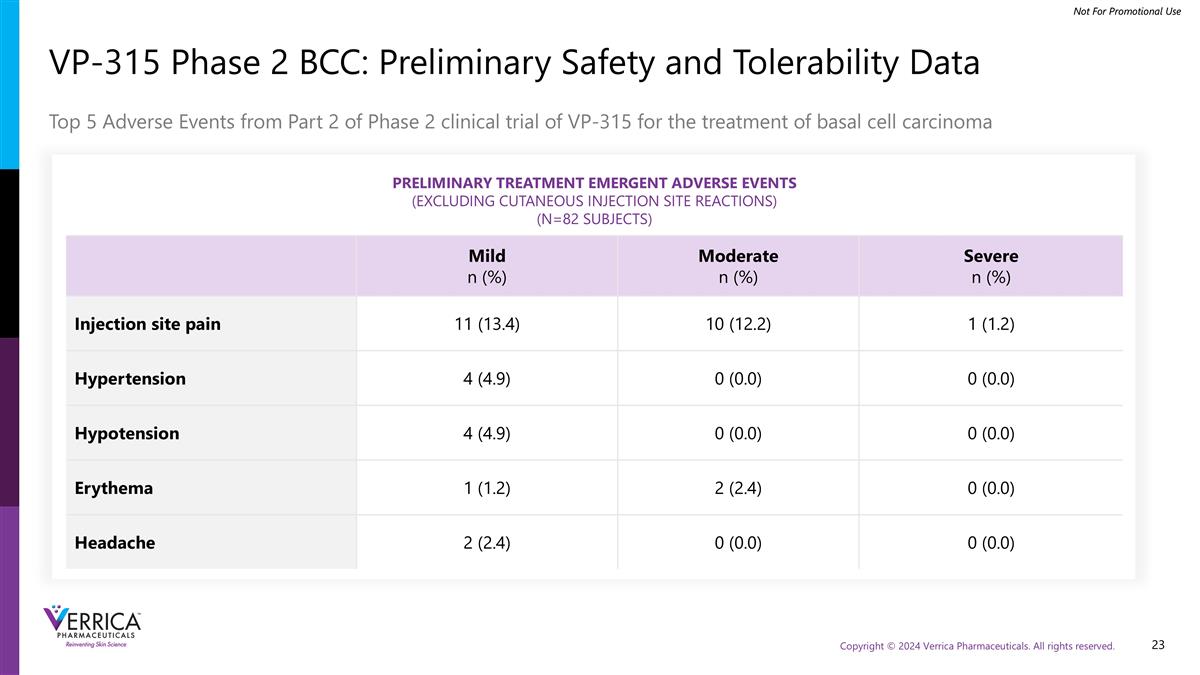
VP-315 2期BCC:初步安全性和耐受性数据TOP5不良事件来自VP-315治疗基底细胞癌初步治疗的2期临床试验第2部分的不良事件(不包括皮肤注射部位反应)(N = 82受试者)轻度n(%)中度n(%)重度n(%)注射部位疼痛11(13.4)10(12.2)1(1.2)高血压4(4.9)0(0.0)0(0.0)低血压4(4.9)0(0.0)0(0.0)红斑1(1.2)2(2.4)0(0.0)

资料来源:根据初步目标产品简介进行的LifeSci一级市场研究– 2024年3月完成(N = 20名HCP;n = 10名皮肤科医生,n = 9名皮肤科/莫氏外科医生;n = 1名皮肤肿瘤医生)。评论反映了医生从初级市场研究的观点;VP-315 2期临床试验期间没有研究晚期和不可切除的患者。初步数据和市场研究支持使用VP-315作为基底细胞癌的潜在1L治疗,这是基于利用目标产品概况进行的初级市场研究,接受调查的医生认为,VP-315有可能在初级或新辅助环境中被用作一线治疗初级治疗:医生确定的使用案例患者在初级环境中最能从VP-315中受益的是那些风险较高和/或:对手术结果VP-315感到疲劳的手术厌恶手术将使晚期和/或不可切除的患者受益1认为:由于年龄偏大,不是VP-315的手术候选者,与更持久和耐受的治疗反应相关“这种治疗对于不想接受手术的患者来说会很棒。我为我的患者提供了所有可用的治疗方案,我相信他们中的一些人会选择这种治疗方式。”–皮肤科医生新辅助治疗:医生认定的使用案例患者在新辅助环境中最能受益于VP-315的是那些:有大的肿瘤,将受益于体积缩小以使手术更容易有肿瘤在美容敏感区域有肿瘤在难以治疗区域(例如,shins)的医生指出,如果VP-315产生具有临床意义的真实世界证据,并且手术治疗BCC的经济动机降低,那么新辅助治疗的使用率可能会随着时间的推移而增加。医生表示,与相对于刺猬抑制剂而言,具有更可容忍的副作用特征相关的有效新辅助治疗满足了明显未满足的需求。“我总是要权衡为患者提供治疗的风险和益处。目前,我不确定让患者暴露于明显的副作用是否是一个好主意,但如果你有一种耐受性非常好的治疗方法,同时在6周内将肿瘤缩小一半,那将是一个合理的想法。”–莫氏外科医生

基底细胞癌的完全清除率残余癌患者的肿瘤大小减少基于利用目标产品概况进行的初级市场研究,接受调查的医生认为VP-315有潜力被用作一线疗法超过一半接受治疗且无后续需要mohs手术的患者没有疤痕,49%的残余癌患者具有良好的安全性,mohs手术病变面积减少71% mohs手术病变面积减少明显疤痕面积减少51% 71% 360万新例年VP-315:一线治疗潜在初步数据和市场研究支持VP-315作为基底细胞癌潜在1L治疗的用途(续)

VP-315数据库锁定的预期下一步2024年第三季度临床研究报告2024年第四季度基因组和T细胞(免疫应答)数据2025年第一季度FDA结束阶段2会议2025年第一季度

YCANTH ™(斑鹿素)外用溶液0.7%首个FDA批准的传染性软疣产品

YCANTH ™(cantharidin,0.7%)药物-装置组合产品通过专为可靠设计的一次性使用涂抹器盖尖端过滤安培管交付,并在一次性使用涂抹器中靶向给药局部溶液活性成分cantharidin(0.7%)在专有的局部配方一次性使用涂抹器中,以减少交叉污染并促进局部溶液的应用小开口允许靶向受影响的皮肤GMP控制、货架稳定、一致的局部制剂允许可靠的剂量/给药口服威慑,以帮助降低意外摄入的风险可视化试剂识别已治疗的病变

www.aad.org/public/diseases/a-z/molluscum-contagiosum-symptoms molluscum由痘病毒引起的背景概述主要感染儿童,发病率最高的是< 14岁的儿童,如果不治疗则具有高度传染性,病变平均持续13个月,尽管在某些人中可能需要长达五年的时间1,通常会导致患者和父母的焦虑和社会挑战,并对生活质量的病因学和临床表现传递皮肤到皮肤接触受污染物体的共享(例如,衣服、毛巾、泳池玩具)诊断&症状一般10~30个病灶100 +可观察到病灶可能是感染的唯一征兆,且往往无痛可诊断为皮肤活检与其他病灶并发症鉴别皮肤刺激、炎症、再感染的滤泡性或乳头状结膜炎如果眼睑上有病变蜂窝组织炎
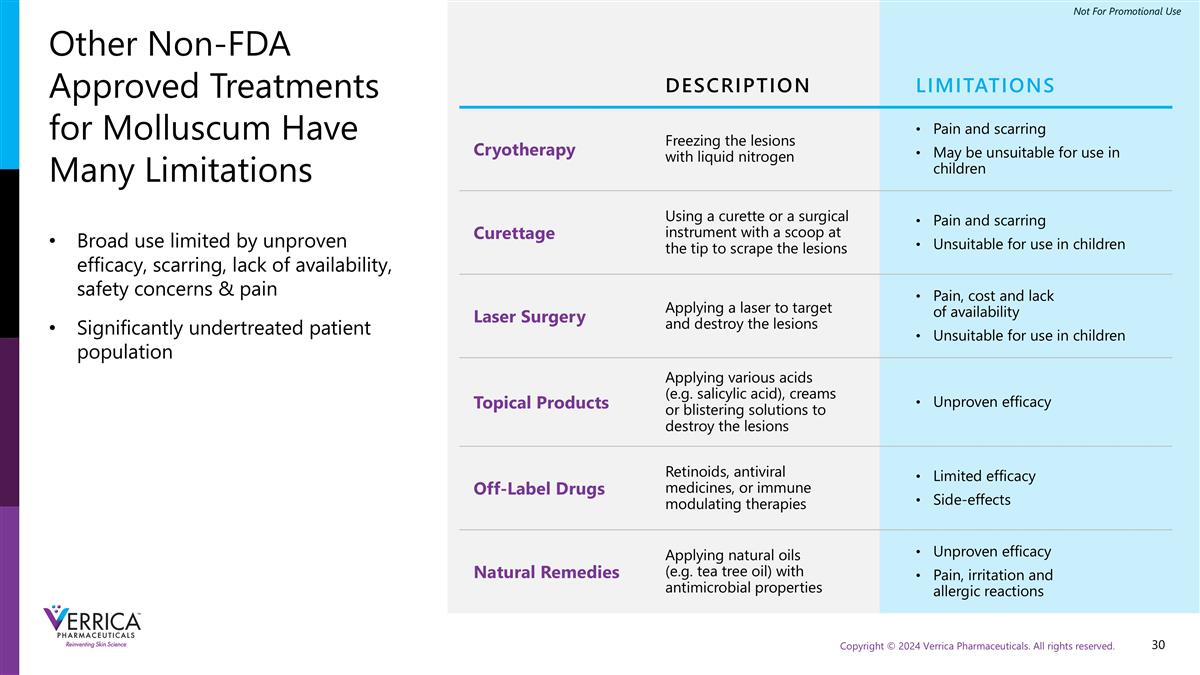
其他非FDA批准的软疣治疗方法有很多限制描述限制冷冻疗法用液氮疼痛和疤痕冻结病灶可能不适合用于儿童刮宫使用刮刀或尖端有勺子的手术器械刮除病灶疼痛和疤痕不适合用于儿童激光手术应用激光靶向和破坏病灶疼痛、成本和缺乏可得性不适合用于儿童的外用产品应用各种酸(例如水杨酸)、乳膏或起泡溶液来破坏病灶未经证实的功效非标签药物类视黄素、抗病毒药物,或免疫调节疗法有限的功效副作用自然疗法应用具有抗菌特性的天然油脂(例如茶树油)未经证实的功效疼痛、刺激和过敏反应广泛使用受限于未经证实的功效、疤痕、缺乏可用性、安全问题和疼痛治疗显着不足的患者群体

Eichenfield LF、Siegfried E、Kwong P等人汇总了两项评估VP-102的随机III期试验的结果,VP-102是一种药物-装置组合产品,含有0.7%斑僵素(w/v),用于治疗传染性软疣。Am J Clin Dermatol。2021;22(2):257-265 ClinicalTrials.gov(Trial 1 [ NCT03377790 ]和Trial 2 [ NCT03377803 ])方法在CAMP-1和CAMP-2两个3期试验中,在传染性软疣1,2 wo同设计、随机、双盲、多中心、车辆对照试验YCANTH在两个随机、双盲、安慰剂对照3期试验中进行研究,试验1和试验2(分别为n = 266和n = 262)在2岁及以上的传染性软疣受试者中进行。大多数患者每3周接受一次针对每个病灶的YCANTH或载体的24小时皮肤给药,最多4次治疗。第84天完全清除传染性软疣的参与者百分比次要终点安全性和耐受性第21、42和63天完全清除的参与者百分比如果发生严重的局部皮肤反应,YCANTH在治疗后24小时前被移除。
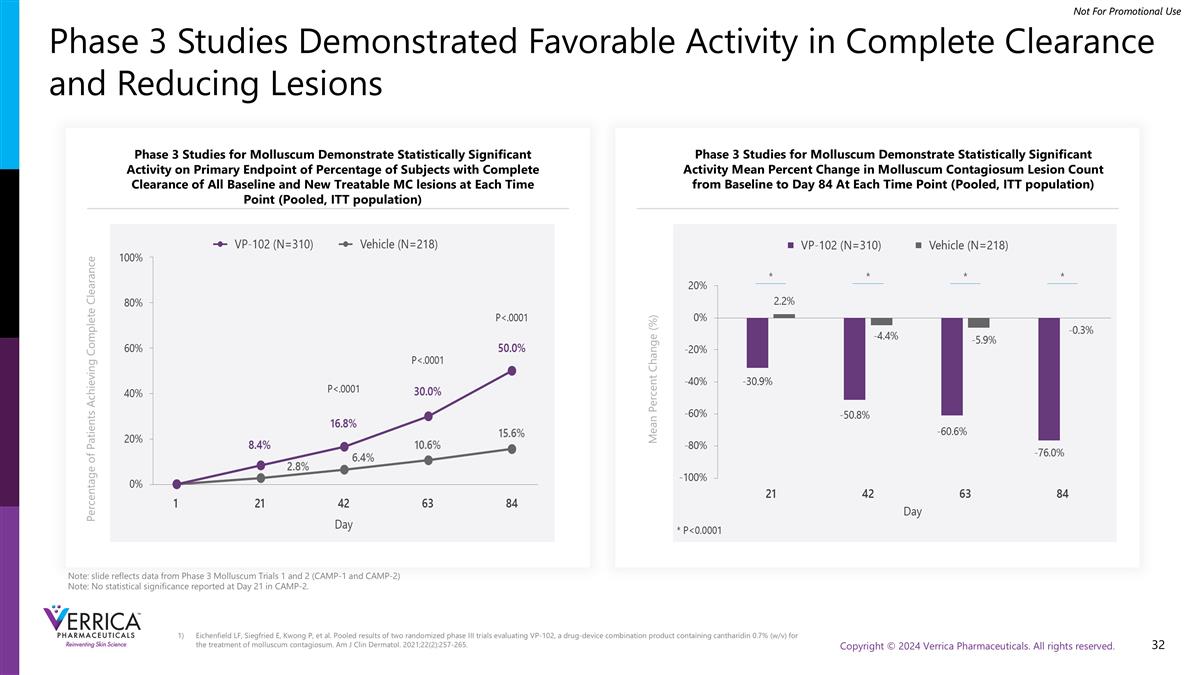
3期研究显示在完全清除和减少病变方面具有良好的活性软体动物的3期研究表明,在每个时间点(汇总,ITT人群),在所有基线和新的可治疗MC病变完全清除的受试者百分比的主要终点上具有统计学意义的活性软体动物的3期研究表明,在每个时间点,从基线到第84天,传染性软体动物病变计数的平均百分比变化具有统计学意义(汇总,ITT人群)平均百分比变化(%)注:幻灯片反映了3期软体动物试验1和2(CAMP-1和CAMP-2)的数据注:CAMP-2在第21天无统计意义报告。实现完全清除的患者百分比Eichenfield LF、Siegfried E、Kwong P等人。汇总了两项随机III期试验的结果,这些试验评估了VP-102,这是一种含有0.7%斑旅素(w/v)的药物-器械组合产品,用于治疗传染性软疣。Am J Clin Dermatol。2021;22(2):257-265.
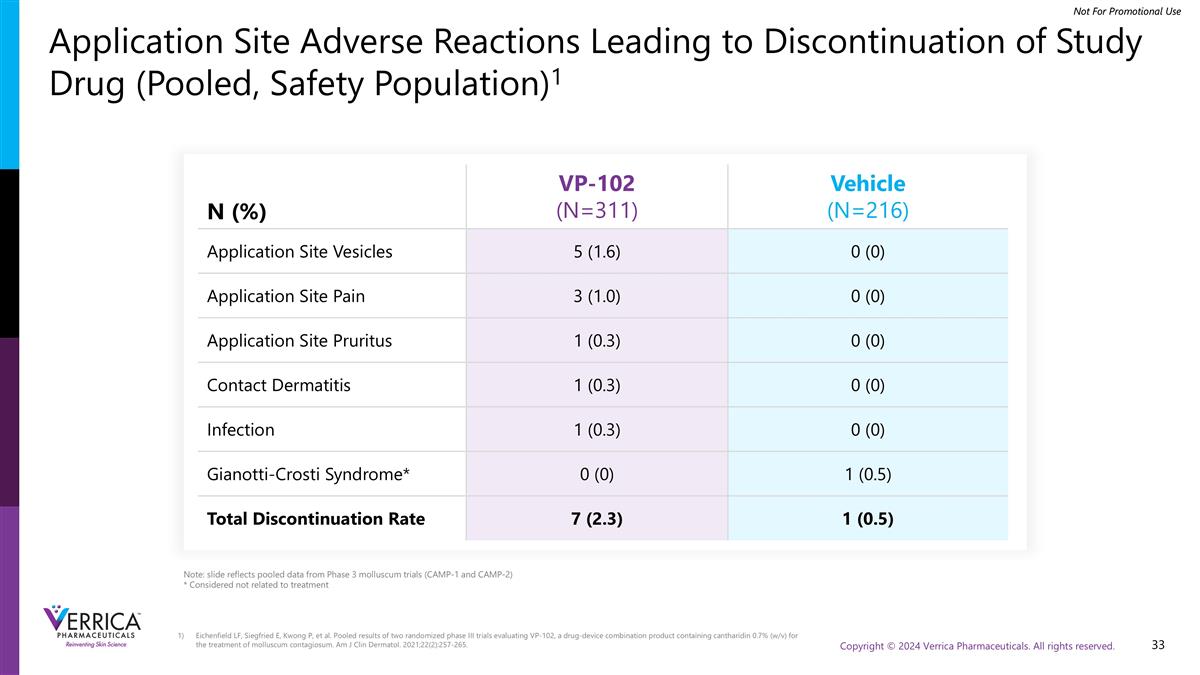
Eichenfield LF、Siegfried E、Kwong P等人汇总了两项评估VP-102的随机III期试验的结果,VP-102是一种药物-装置组合产品,含有0.7%斑僵素(w/v),用于治疗传染性软疣。Am J Clin Dermatol。2021;22(2):257-265.申请场所不良反应导致研究药物停用(汇总,安全人群)1注:幻灯片反映3期软体动物试验(CAMP-1和CAMP-2)的汇总数据*被认为与治疗无关N(%)VP-102(N = 311)载体(N = 216)申请场所囊泡5(1.6)0(0)申请场所疼痛3(1.0)0(0)申请场所瘙痒1(0.3)0(0)接触性皮炎1(0.3)0(0)感染1(0.3)0(0)Gianotti-Crosti综合征* 0(0)1(0.5)总停药率7(2.3)1(0.5)

YCANTH ™(斑点苷)外用溶液0.7%商业化及产品上市
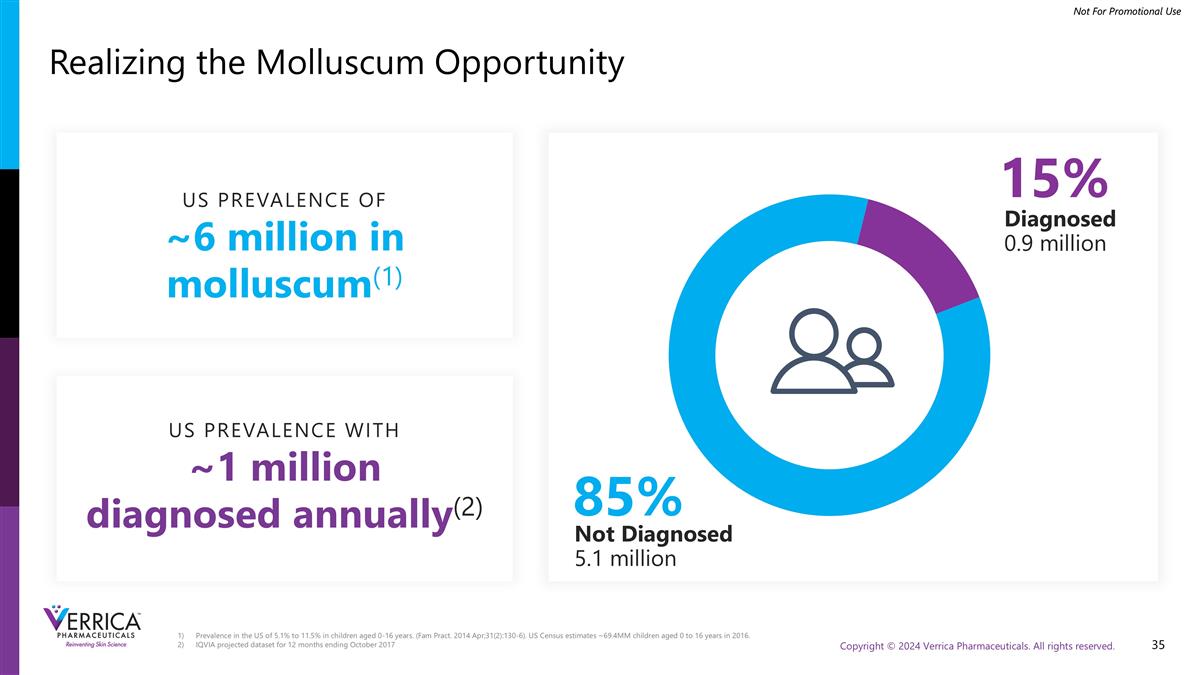
美国0-16岁儿童的患病率为5.1%至11.5%。(Fam Pract。2014年4月;31日(2):130-6)。美国人口普查估计,2016年0至16岁的儿童约为69.4mm。截至2017年10月的12个月的艾昆纬预测数据集实现软体动物机会未诊断510万美国流行率~600万在软体动物(1)85% 15%诊断90万美国流行率每年诊断约100万(2)
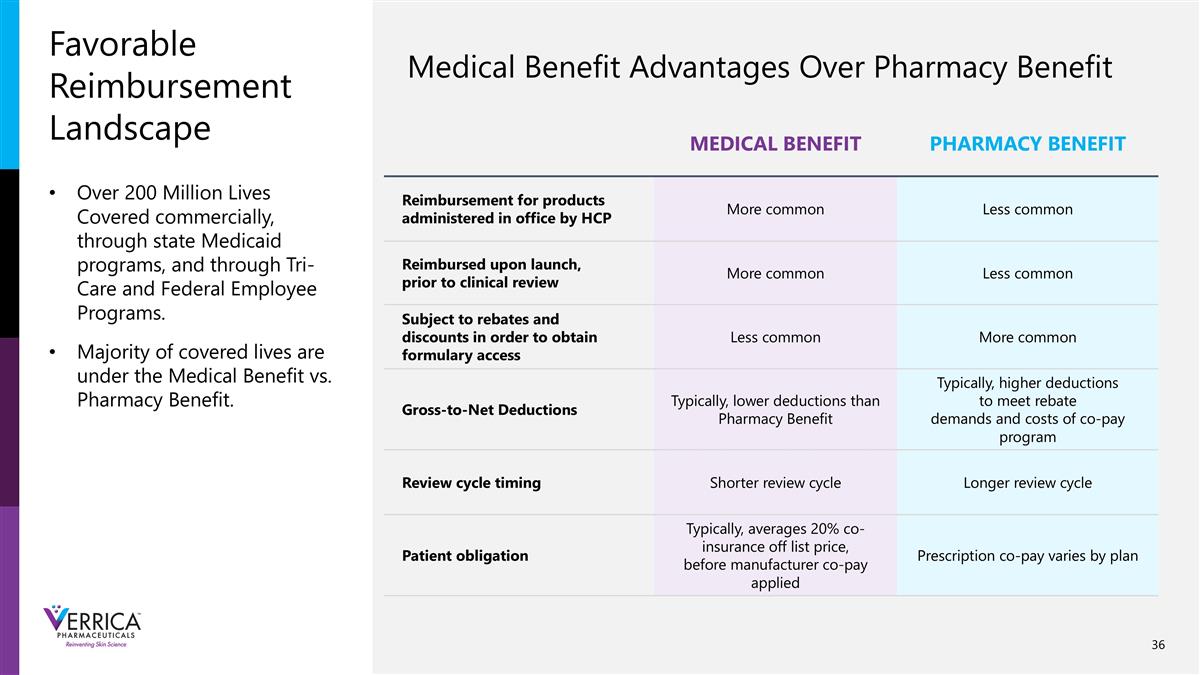
有利的报销格局医疗福利制药福利对由HCP在办公室给药的产品的报销更常见不太常见在上市时报销,在临床审查之前更常见不太常见受制于回扣和折扣以获得处方集访问更常见更常见的毛净额扣除通常,低于药房福利的扣除通常,更高的扣除以满足回扣需求和共同支付计划的成本审查周期时间更短的审查周期更长的审查周期患者义务通常,平均从目录价格中扣除20%的共同保险,在制造商共同支付应用处方共同支付之前,商业上覆盖的超过2亿人的生命因计划而异,通过州医疗补助计划,以及Tri-Care和联邦雇员计划。大多数受保生命处于医疗福利vs.药房福利之下。医疗福利相对于药房福利的优势
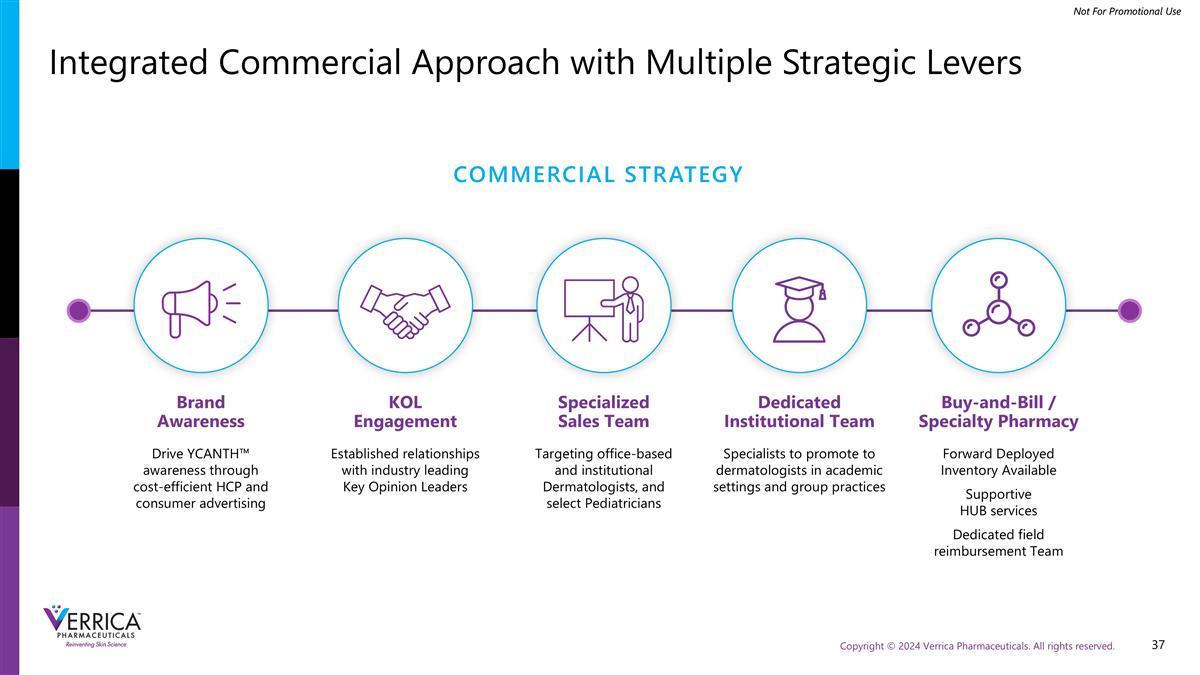
专门的机构团队专家在学术环境和团体实践中向皮肤科医生推广具有多个战略杠杆的一体化商业方法品牌知名度通过高性价比的HCP和消费者广告推动YCANTH ™意识针对办公室和机构皮肤科医生的专门销售团队,选择儿科医生买单/专业药房转发部署的库存可用的支持性HUB服务专门的现场报销团队KOL参与与行业领先的关键意见领袖建立了关系商业战略

共有78名YCANTH ™销售代表,目标是儿科皮肤科医生和皮肤科医生、卫生系统和儿科办公室48名以办公室为基础的代表,目标是皮肤科医生10名专注于卫生系统的专门机构代表5名为Buy and Bill Accounts提供计费和编码支持的领域关系经理20名专注于儿科购买群体成员的专门儿科代表
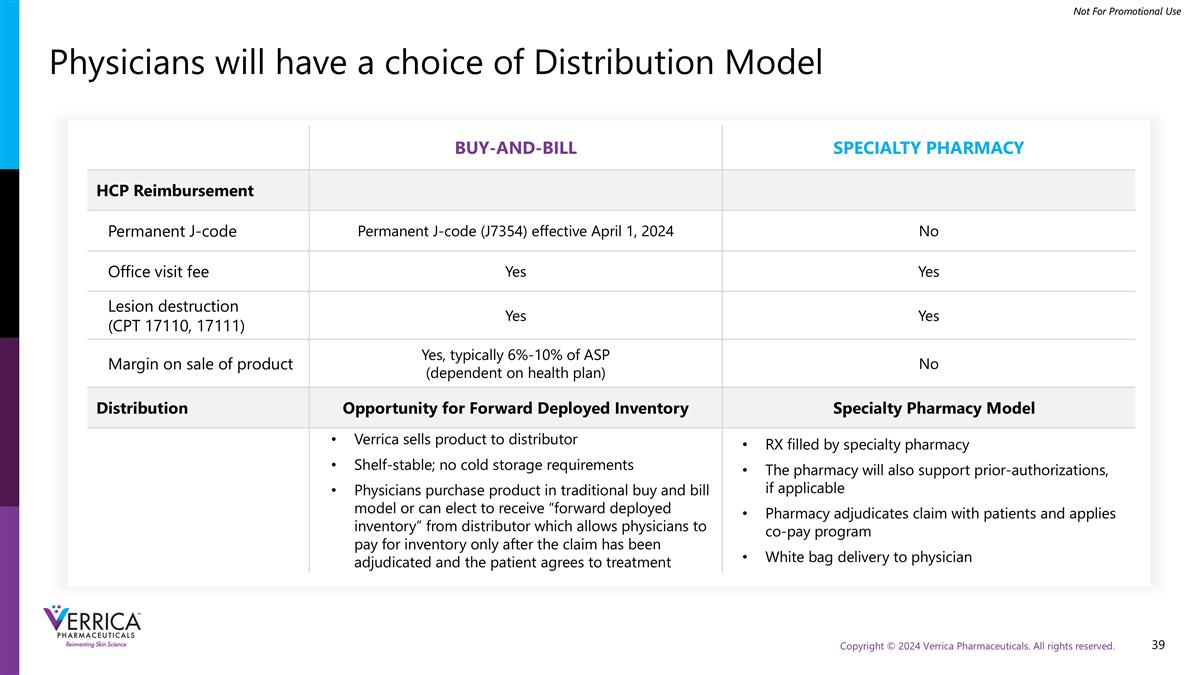
医师将有选择的分销模式买入即付专业药房HCP报销永久J码永久J码(J7354)2024年4月1日生效无办公室就诊费是是病变销毁(CPT17110,17111)是是产品销售保证金是,通常为ASP的6%-10 %(取决于健康计划)没有分销机会的远期部署库存专业药房模式Verrica将产品销售给分销商货架稳定;没有冷藏要求医生以传统的购买和账单模式购买产品或可以选择从分销商那里接收“远期部署库存”,这使得医生只能在索赔得到裁决并且患者同意由专业药房填写的治疗RX后才能为库存付款。药房也将支持事先授权,如果适用的药房与患者裁定索赔并对医生应用共付计划白袋交付

Common Warts the potential solution:status:启动全球3期试验,预计2025年上半年

IMS国家疾病和治疗指数(NDTI)滚动5年,截至2016年6月。Nguyen et al,Laser Treatment of Nongenital Verrucae a System Review。JAMA皮肤科。2016;152(9):1025-1033截至2018年9月的12个月艾昆纬匿名纵向患者水平数据(APLD)由人乳头瘤病毒(HPV)引起的疣状疱疹(普通疣)概述感染所有年龄段的患者持续感染,高度难治的典型2-5个病变未获FDA批准用于治疗普通疣的药物美国患病率为2200万1,年诊断有150万2病因和临床表现从皮肤到皮肤接触接触接触接触受污染物体的诊断&症状圆顶状肉色病变常见于手、指、膝盖或肘部病变可成群或呈线型发生病变可引起相当大的疼痛和不适,可随皮肤外伤而扩散,并可能是发痒的并发症可发生瘢痕形成患处色素沉着障碍病灶细菌重复感染刺激、疼痛、周围皮肤发红

我们已经成功完成了一项针对普通疣患者的2期研究(COVE-1)研究设计终点应用队列1:一个中心队列2:四个中心的疗效、安全性和耐受性开放标签研究,包含两个队列在第84天完全清除所有可治疗疣(基线和新的)的受试者的主要百分比在第2、3和4次访问时完全清除所有可治疗疣的受试者的次要百分比在第84天可治疗疣的数量(%)较基线的变化队列1:21名受试者2 +岁的普通疣,在过去14天内未接受过任何类型治疗的患者队列2:35名12岁以上患有普通疣的受试者,在过去14天内未接受过任何类型的治疗研究药物YCANTH(VP-102)对每个可治疗的疣局部给药,最多4次应用队列1治疗直至明确,队列2在首次访问许可时接受一次额外治疗被观察到最多4次总应用给药频率至少为14天(队列1)或21天(队列2)在队列2中允许Paring YCANTH(VP-102)将保持24小时后用肥皂和温水取出
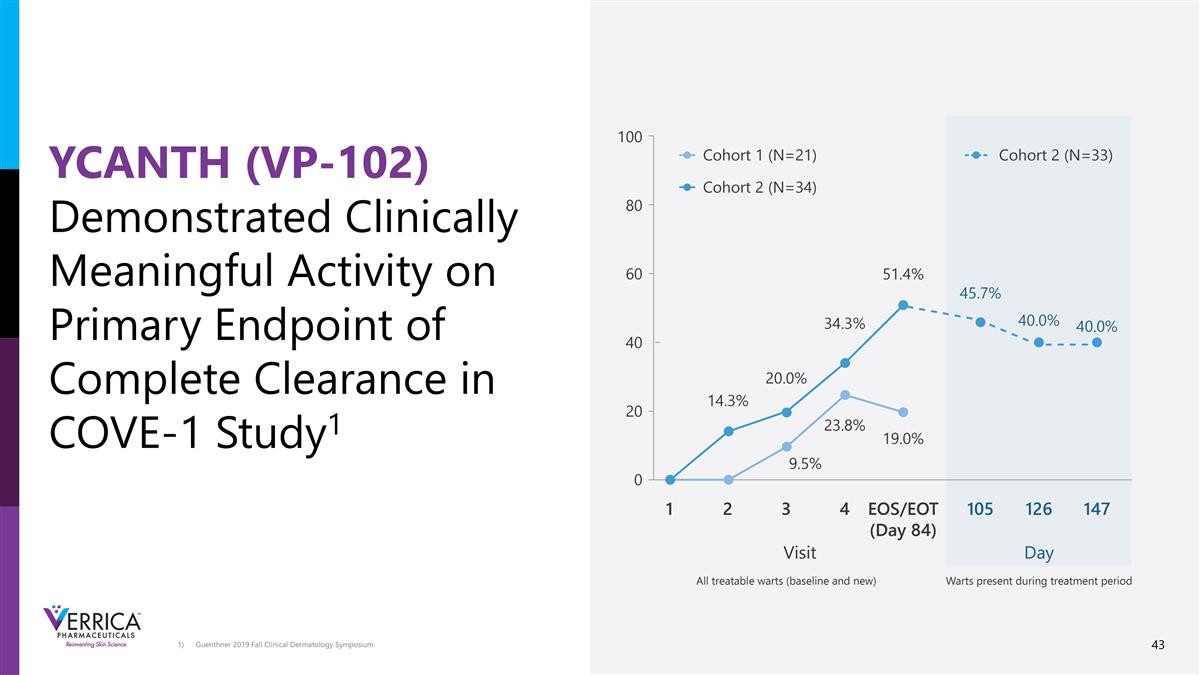
Guenthner 2019秋季临床皮肤病学研讨会YCANTH(VP-102)在COVE-1研究中展示了关于完全清除的主要终点的临床意义活动1
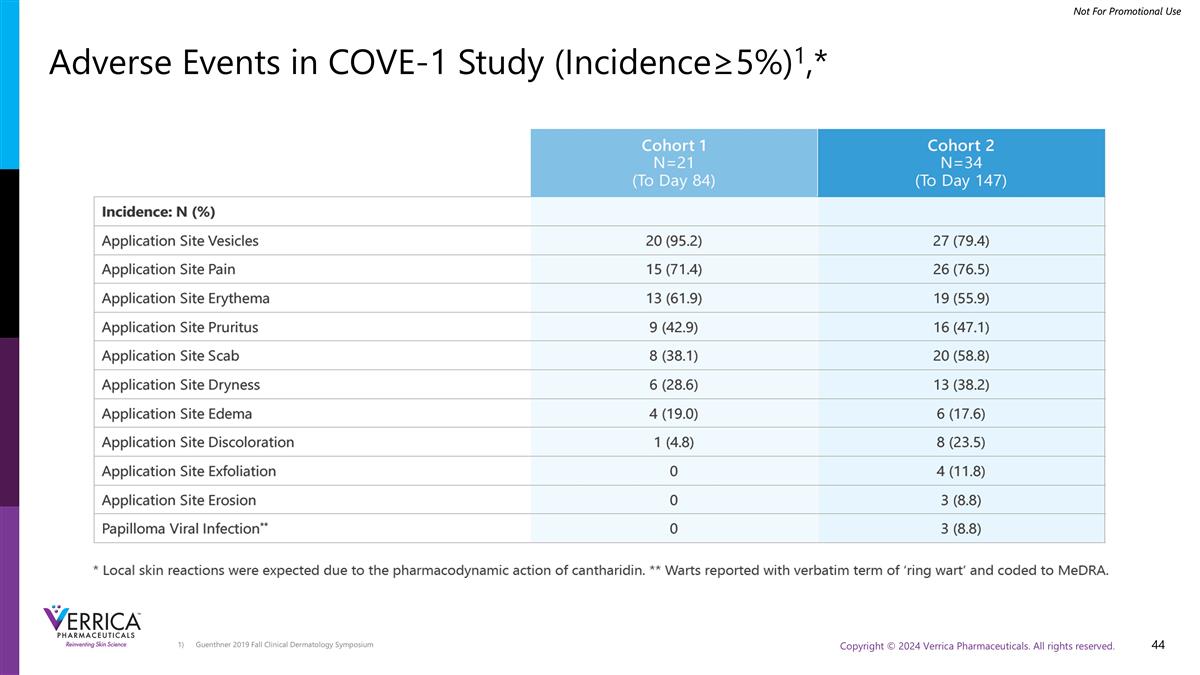
Guenthner 2019年秋季临床皮肤病学研讨会COVE-1研究中的不良事件(发生率≥ 5%)1,*

外生殖器疣潜在解决方案:状态:3期研究时间待定

Yanofsky,Valerie & Patel,Rita & Goldenberg,Gary。(2012).生殖器疣:全面复查。临床与美容皮肤病学杂志。5.25-36.尖锐湿疣(生殖器疣)概述由人乳头状瘤病毒(HPV)引起的生殖器和肛周区域皮肤表面病变传染性高、复发常见的治疗方案有局限性美国每年新诊断的EGW病例约为50万至100万例1病因和临床表现传递性接触诊断&症状传播的皮肤到皮肤接触可出现扁平、圆顶状、角化、有花梗和菜花状病变,可发生单一、成簇或为斑块状病变可发痒,并可引起疼痛和不适并发症刺激、疼痛、及患处周围皮肤发红色素沉着瘢痕形成可发生病灶细菌重复感染

外部生殖器疣(EGW)患者的2期研究(CARE-1)研究设计终点应用研究由两部分(A和B)组成A部分的主要目标是确定B部分多中心、双盲、载体控制剂量方案中用于评估的两种最佳给药方案、有效性、安全性和耐受性第84天所有可治疗疣完全清除的受试者的主要百分比在第21、42天所有可治疗疣完全清除的受试者的次要百分比,和63 A部分:18名18岁以上受试者有2-30个外生殖器和/或肛周疣,基线就诊时≥ 4周B部分:87名18岁以上受试者有2-30个外生殖器和/或肛周疣,基线就诊时≥ 4周研究药物YCANTH(VP-102)每21天对每个可治疗的疣局部给药,直至完全清除,最多4次治疗A部分:三个治疗组,2小时、6小时,和24小时持续时间的皮肤暴露后再用肥皂和温水取出B部分:6和24小时持续时间的治疗暴露(根据A部分选择)与随访期到第147天给药频率为每21天一次
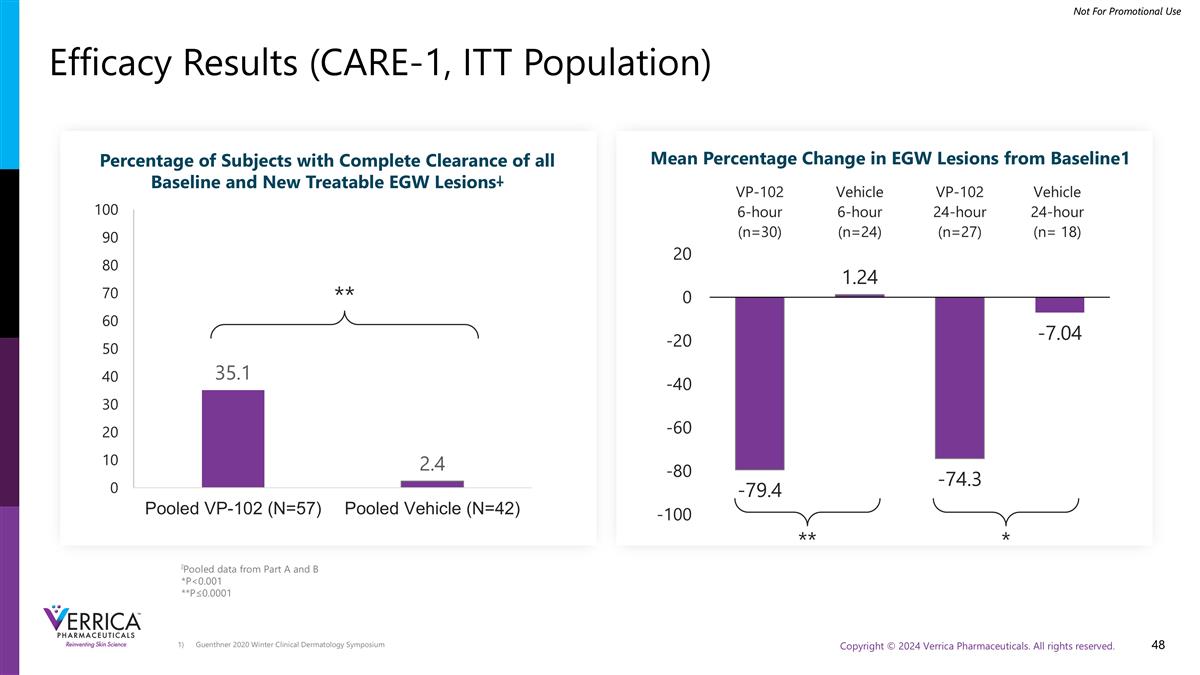
Guenthner 2020冬季临床皮肤病学研讨会疗效结果(CARE-1,ITT人群)汇集了来自A和B部分的数据* p < 0.001 * * p ≤ 0.0001 * * * * EGW病变相对于基线的平均百分比变化1完全清除所有基线和新的可治疗EGW病变的受试者百分比丨*
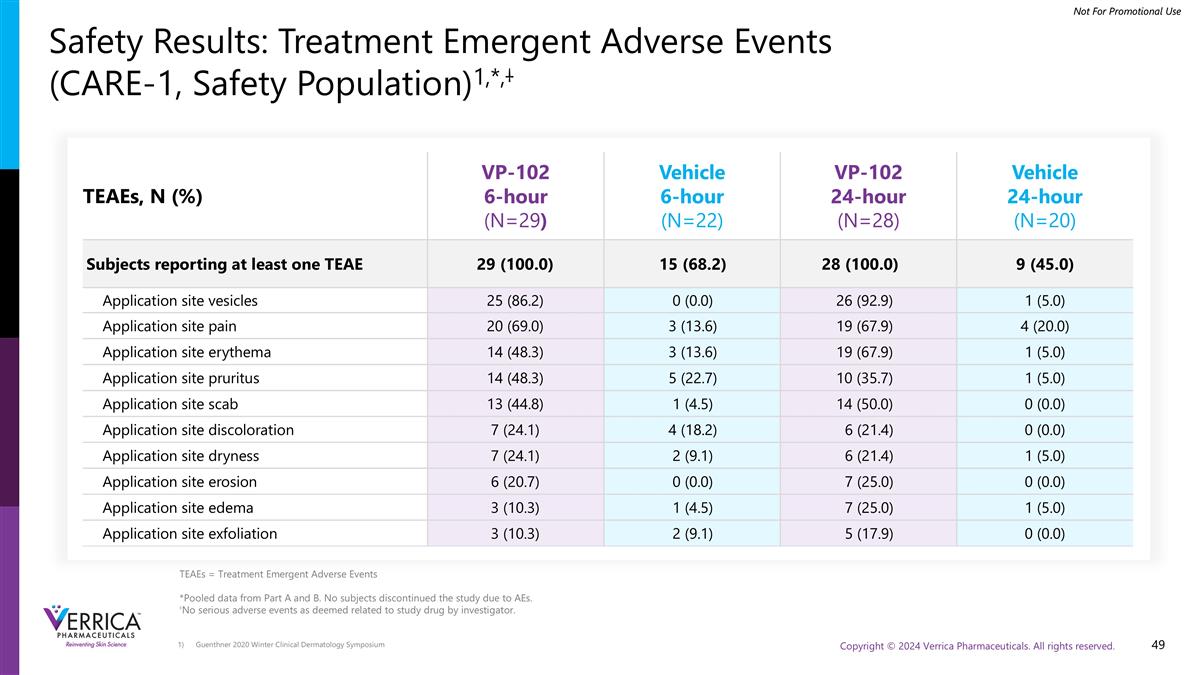
Guenthner 2020冬季临床皮肤病学研讨会安全性结果:治疗紧急不良事件(CARE-1,安全人群)1,*,丨TEAEs,N(%)VP-102 6小时(N = 29)车辆6小时(N = 22)VP-102 24小时(N = 28)车辆24小时(N = 20)受试者报告至少一个TEAE29(100.0)15(68.2)28(100.0)9(45.0)应用部位囊泡25(86.2)0(0.0)26(92.9)1(5.0)应用部位疼痛20(69.0)3(13.6)19(67.9)4(20.0)应用部位红斑14(48.3)3(13.6)19(67.9)1(5.0)应用部位瘙痒14(48.3)5(22.7)10(35.7)1(5.0)应用部位痂13(44.8)1(4.5)14(50.0)0(0.0)应用部位变色7(24.1(9.1)6(21.4)1(5.0)应用部位侵蚀6(20.7)0(0.0)7(25.0)0(0.0)应用部位水肿3(10.3)1(4.5)7(25.0)1(5.0)应用部位剥落3(10.3)2(9.1)5(17.9)0(0.0)TEAEs =治疗突发不良事件* A和B部分的汇总数据。没有受试者因AEs而中止研究。无研究者认为与研究药物相关的严重不良事件。
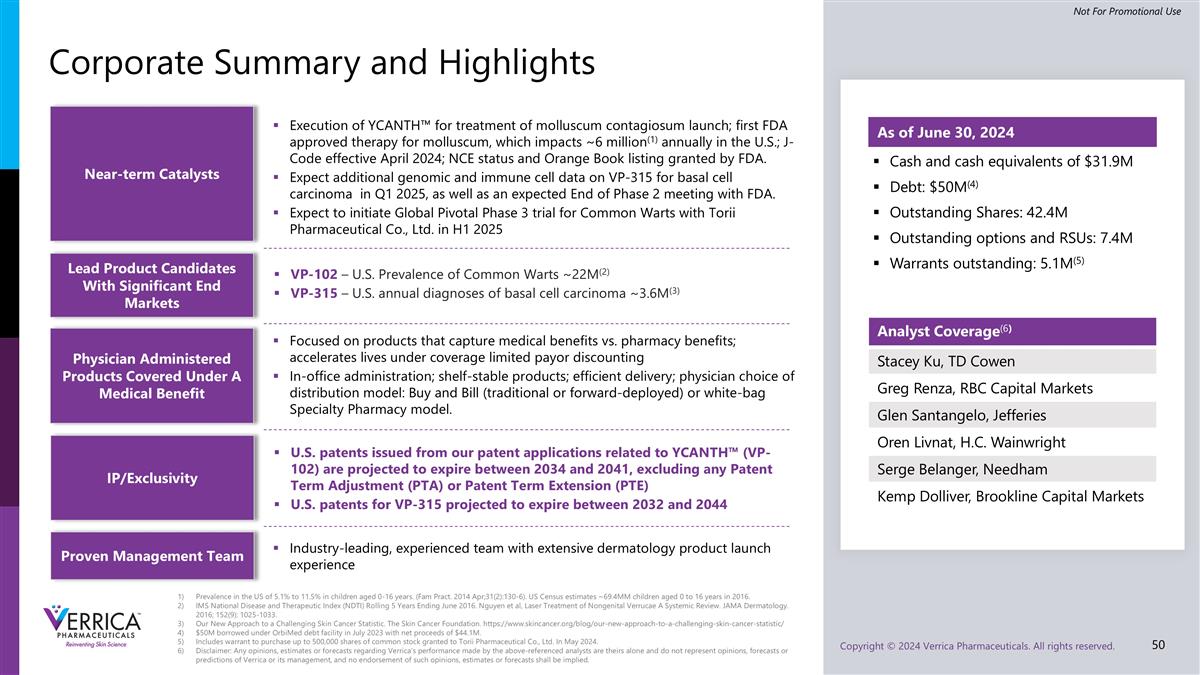
美国0-16岁儿童的患病率为5.1%至11.5%。(Fam Pract。2014年4月;31日(2):130-6)。美国人口普查估计,2016年0至16岁的儿童约为69.4mm。IMS国家疾病和治疗指数(NDTI)滚动5年,截至2016年6月。Nguyen et al,Laser Treatment of Nongenital Verrucae a System Review。JAMA皮肤科。2016; 152(9): 1025-1033.我们应对具有挑战性的皮肤癌统计数据的新方法。皮肤癌基金会。https://www.skincancer.org/blog/our-new-approach-to-a-challenging-skin-cancer-statistic/2023年7月在OrbiMed债务融资下借入5000万美元,净收益为4410万美元。其中包括购买2024年5月授予Torii Pharmaceutical Co.,Ltd.的最多50万股普通股的认股权证。免责声明:上述分析师就Verrica的业绩作出的任何意见、估计或预测仅为其个人意见,并不代表Verrica或其管理层的意见、预测或预测,亦不应暗示对该等意见、估计或预测的认可。公司摘要和要闻分析师报道(6)Stacey Ku、TD 高宏集团 Greg Renza、RBC Capital Markets Glen Santangelo、Jefferies Oren Livnat、H.C. Wainwright Serge Belanger、Needham Kemp Dolliver、Brookline Capital Markets现金和现金等价物3190万美元债务:5000万美元(4)流通股:4240万股未行使期权和RSU:740万股未行使认股权证:510万股(5)近期催化剂YCANTH ™用于治疗传染性软疣上市;首个FDA批准的软疣疗法,在美国每年影响约600万(1);2024年4月生效的J-Code;FDA授予的NCE地位和橙皮书上市。预计2025年第一季度将有更多关于VP-315治疗基底细胞癌的基因组和免疫细胞数据,以及预计与FDA的2期会议结束。预计将在2025年上半年与Torii Pharmaceutical Co.,Ltd.启动普通疣的Global Pivotal 3期试验主要候选产品,具有重要的终端市场VP-102 –美国普通疣流行率~22m(2)VP-315 –美国每年诊断的基底细胞癌~36m(3)医生给药的产品涵盖在一项医疗福利下,重点关注获得医疗福利与药房福利的产品;在覆盖范围内加速有限付款人折扣办公室管理下的生活;货架稳定的产品;高效交付;医生选择的分销模式:购买和开单(传统或向前部署)或白袋专业药房模式。根据我们与YCANTH ™(VP-102)相关的专利申请颁发的美国专利预计将于2034年至2041年之间到期,不包括VP-315的任何专利期限调整(PTA)或专利期限延长(PTE)美国专利预计将于2032年至2044年之间到期截至2024年6月30日,行业领先、经验丰富的团队拥有广泛的皮肤科产品发布经验IP/独占性验证管理团队

YCANTH ™(斑点苷)外用溶液0.7%美国处方信息

访问YCANTH.com获取重要安全信息和完整处方信息注:YCANTH(局部溶液0.7%)在美国仅被FDA批准用于治疗成人和两岁及以上儿童患者的传染性软疣。美国处方信息亮点YCANTH处方信息和相关重要安全信息如下表所示重点说明信息适应症和使用情况YCANTH适用于2岁及以上剂量和给药的成人和儿童患者传染性软疣的局部治疗所有医疗保健专业人员在制备和给药YCANTH仅供局部使用之前应接受指导和培训。不用于口服、黏膜、眼科使用根据需要每3周对每个病灶直接涂抹一次不要在单次治疗期间使用超过两个涂抹器治疗后24小时用肥皂和水取下。如出现严重起泡、疼痛或其他严重副作用,应立即洗去YCANTH并报告不良反应。剂型和强度外用溶液:0.7%斑鸠素禁忌症无警告和注意事项与不适当给药相关的毒性如果口服给药,可能会发生危及生命或致命的毒性局部皮肤反应可燃性不良反应YCANTH是一种起泡剂。在临床试验期间,97%接受YCANTH治疗的受试者观察到应用部位的局部皮肤反应。局部皮肤反应包括水泡、瘙痒、疼痛、变色、红斑等。风险评估和缓解策略无对每位患者的治疗次数没有限制

警告和注意事项与不适当给药相关的毒性:如果口服给药,可能会发生危及生命或致命的毒性。治疗后避免接触治疗区域,包括口腔接触。如果YCANTH与眼睛接触,可能会发生眼部毒性。如果YCANTH进入眼睛,用水冲洗眼睛至少15分钟。局部皮肤反应:应用部位的反应有水泡、瘙痒、疼痛变色、红斑等。避免涂抹在眼睛和黏膜组织附近,要对皮肤健康。如果YCANTH接触到任何无意的表面,或健康皮肤,立即去除。如果出现严重的局部皮肤反应,应在治疗后24小时前取出。易燃性:YCANTH是易燃的,即使干燥后也是如此。在治疗期间和应用后直至移除前,应避免在病灶(s)附近发生火灾、火焰或吸烟。

软体动物临床证据

J投资Dermatol。1962年7月;39:39-45。J免疫醇方法。2001年11月1日;257(1-2):213-20.2斑点素在皮肤表浅起泡中引发双重反应病变皮肤斑点素是一种起泡剂,引起皮肤起泡的药效学反应。斑点素一旦应用,会激活导致桥粒斑块退化和表皮内起水泡的中性丝氨酸蛋白酶。(1)引发炎症和免疫反应斑点素刺激白细胞浸润(例如,中性粒细胞、巨噬细胞、B和T细胞以及嗜酸性粒细胞)和包括TNF-a、IL-8和CXCL-5在内的趋化因子和细胞因子的释放。(2)桥粒切开和水泡形成淋巴细胞中性粒细胞嗜酸性粒细胞巨噬细胞12

YCANTH ™(VP-102)治疗软疣试验和状态制定/应用方法试验设计试验目标的重大临床进展第3阶段关键试验CAMP-1完全VP-102 N = 266在SPA随机、双盲、多中心、安慰剂对照下进行,评估VP-102相对于安慰剂的皮肤应用在第84天完全清除的疗效,以评估VP-102的安全性和耐受性关键试验CAMP-2完全VP-102 N = 262随机、双盲、多中心,安慰剂对照评估VP-102相对于安慰剂的皮肤应用在第84天完全清除的疗效以评估VP-102第2阶段的安全性和耐受性创新试验完整的VP-102开放标签,单中心N = 33确定VP-102单次24小时应用可能的全身暴露,以确认安全性和有效性与施用者试点试验完成我们在VP-102中使用的斑旅苷的专有配方,应用于棉签开放标签的木棍部分,单中心N = 30以评估安全性和有效性并确定最佳治疗持续时间
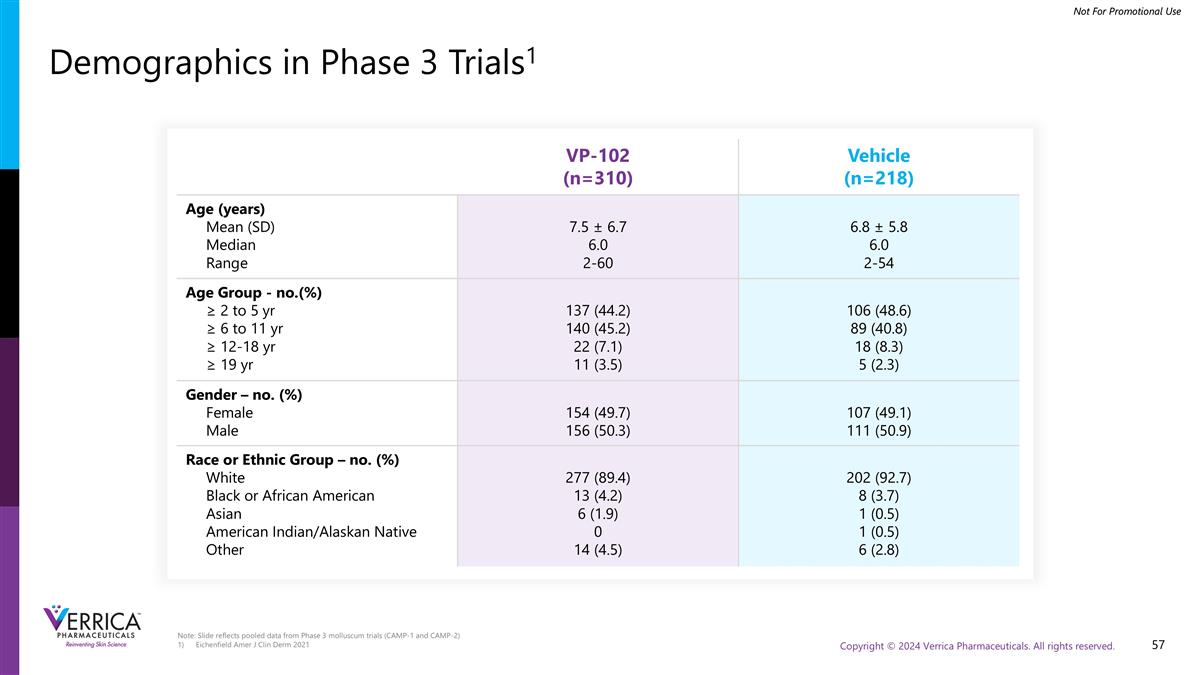
注:幻灯片反映了3期软体动物试验的汇总数据(CAMP-1和CAMP-2)Eichenfield Amer J Clin Derm 2021第3阶段试验中的人口统计数据1 VP-102(n = 310)车辆(n = 218)年龄(岁)平均(SD)中位范围7.5 ± 6.76.0 2-60 6.8 ± 5.86.0 2-54年龄组-第(%)≥ 2至5岁≥ 6至11岁≥ 12-18岁≥ 19岁137(44.2)140(45.2)22(7.1)11(3.5)106(48.6)89(40.8)18(8.3)5(2.3)性别–第(%)女性男性154(49.7)156(50.3)107(49.1)111(50.9)种族或族裔组–第(%)白黑或非裔美国人亚裔美国印第安人/阿拉斯加土著其他277(89.4)13(4.2)6(1.9)014(4.5)202(92.7)8(3.7)1(0.5)1(0.5)6(2.8)
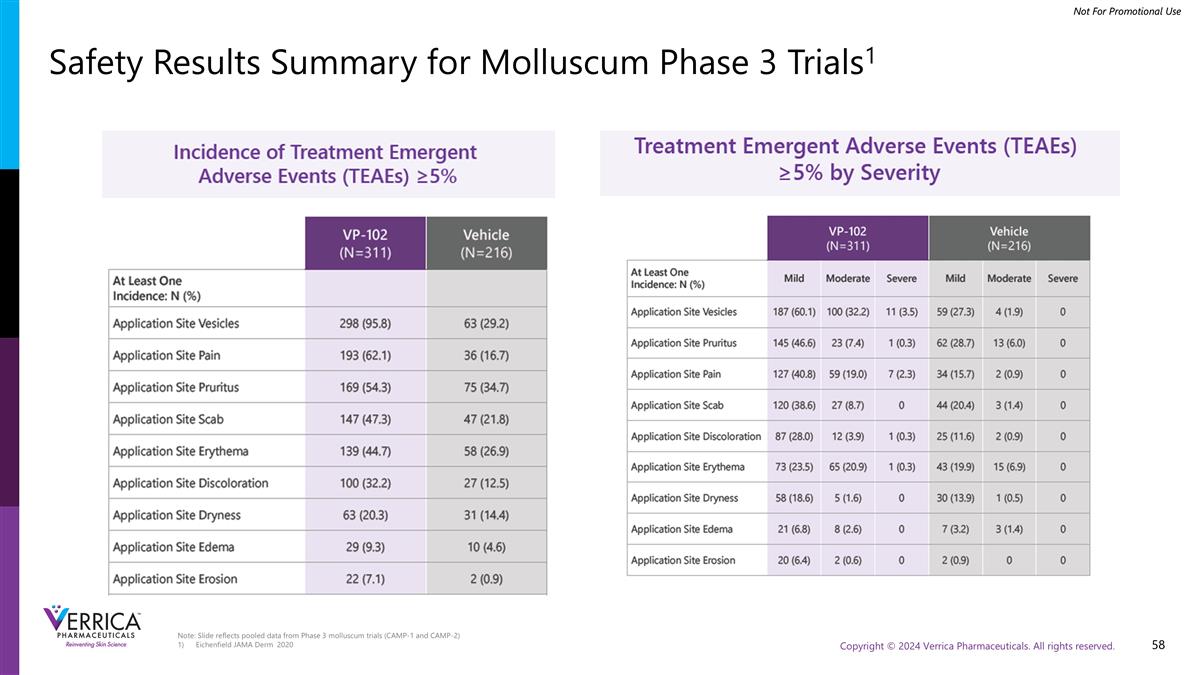
注:幻灯片反映了来自3期软体动物试验(CAMP-1和CAMP-2)的汇总数据Eichenfield JAMA Derm 2020年软体动物3期试验的安全性结果摘要1

YCANTH ™概述,VP-102/103知识产权组合关键索赔和专利申请授予美国专利和专利到期价值VerRICA新型斑点素制剂和我们的YCANTH ™(VP-102)特定配方(PCT/US2014/052184和PCT/US2018/036353)含有斑点素制剂的一次性施药器包括我们的YCANTH ™(VP-102)商业施药器(PCT/US2014/052184和PCT/US2018/037808)US 11,052,064(2035年5月28日到期)* US 11,147,790(8月22日到期,2038)*不包括任何潜在的专利期限延长(PTE)可能会阻止仿制药复制我们的无醚配方或制造类似配方可能会阻止仿制药使用一次性使用的斑鸠素涂抹器,该涂抹器既包含用于保持产品稳定性的玻璃安培,也包含放置在分配尖端之前的过滤器,这有助于提高给药精度并防止与我们的YCANTH ™(VP-102)(PCT/US2018/037808和US 29/607744)US D900312、US D1036656的商业涂抹器的皮肤设计直接接触(2035年10月27日和7月23日到期,2039)可能会阻止仿制药使用类似的施药方法使用斑点素治疗软体动物(PCT/US2018/037808、PCT/US2018/036353和PCT/US2014/052184)US 11,052,064(2035年5月28日到期)* US 11,147,790(2038年8月22日到期)*不包括任何潜在的专利期限延长(PTE)可能会阻止仿制药使用类似的治疗方案和标签方法来纯化斑点素并分析斑点素或斑点素溶液(PCT/US2016/14139)US 11,168,091(3月8日到期,2036)可能会迫使仿制药寻找替代方法来生产GMP斑点素或确定其原料药或药品是否符合GMP的斑点素合成方法(PCT/US2015/066487)(PCT/US2018/054373)US 10,745,413(2036年3月10日到期)合成版本将降低影响天然来源原料药的外部污染物和环境因素的风险。可能会阻止仿制药与合成版本的斑鸠素Ampule粉碎工具竞争,包括我们专有的YCANTH ™(VP-102)Ampule Crush Tool(PCT/US2021/054752和US 29/755448)US D983407(2038年4月11日到期)可能会阻止竞争对手复制我们的Ampule Crush Tool或制造类似设备我们与YCANTH ™(VP-102)相关的专利申请中颁发的任何美国专利预计将在2034年至2041年之间到期,不包括任何专利期限调整(PTA)或专利期限延长(PTE)123456