证券交易委员会
华盛顿特区20549
表格20-F
◻根据《1934年证券交易法》第12(b)或(g)条作出的登记声明
或
根据《1934年证券交易法》第13或15(d)条提交的年度报告
截至2024年12月31日止财政年度
或
◻根据1934年证券交易法第13或15(d)条提交的过渡报告
对于从到的过渡期
◻根据1934年《证券交易法》第13或15(d)条提交的贝壳公司报告
需要本壳公司报告的事项发生日期.....。
委托档案号001-35193
(在其章程中指明的注册人的确切名称) |
|
(成立法团的司法管辖权) |
Sant Cugat del Vall è s 08174 西班牙巴塞罗那 |
(主要行政办公室地址) |
总法律顾问 电话:+ 34935710221 电子邮件:david.bell@grifols.com
2410 Grifols Way 加利福尼亚州洛杉矶90032-3514 |
(公司联系人姓名、电话、电子邮件和/或传真号码及地址) |
根据该法第12(b)节注册或将注册的证券。
各类名称 |
|
交易代码 |
|
注册的各交易所名称 |
由美国存托国证明 收据,每个美国人 代表存托股份 一项B类无投票权 GRIFOLS, S.A.的股份 |
GRFS |
纳斯达克股票市场有限责任公司 |
根据该法第12(g)节注册或将注册的证券。
没有。 |
(班级名称) |
根据该法第15(d)节有报告义务的证券。
没有。 |
(班级名称) |
注明截至年度报告所涵盖期间结束时发行人的每一类资本或普通股的流通股数量。
426,129,798股A类股
261,425,110股B类股
如果注册人是《证券法》第405条所定义的知名且经验丰富的发行人,请用复选标记表示。
◻无
如果此报告是年度报告或过渡报告,请用复选标记表明注册人是否不需要根据1934年《证券交易法》第13或15(d)节提交报告。
◻有丨否
用复选标记表明注册人(1)在过去12个月内(或要求注册人提交此类报告的较短期限内)是否已提交1934年证券交易法第13或15(d)条要求提交的所有报告,以及(2)在过去90天内是否已遵守此类提交要求。
◻无
用复选标记表明注册人在过去12个月(或在注册人被要求提交此类文件的较短时间内)是否以电子文件方式提交了根据S-T条例第405条(本章第232.405条)要求提交的每一份互动数据文件。
◻无
通过复选标记指明注册人是大型加速申报人、加速申报人、非加速申报人还是新兴成长型公司。参见《交易法》第12b-2条中“大型加速申报人”、“加速申报人”、“新兴成长型公司”的定义。
大型加速过滤器 |
加速披露公司◻ |
非加速披露公司◻ |
新兴成长型公司◻ |
如果一家新兴成长型公司按照美国公认会计原则编制财务报表,请用复选标记表明注册人是否选择不使用延长的过渡期来遵守根据《交易法》第13(a)节规定的任何新的或修订的财务会计准则↓。◻
↓“新的或经修订的财务会计准则”是指财务会计准则委员会在2012年4月5日之后发布的对其会计准则编纂的任何更新。
用复选标记表明注册人是否已就编制或发布其审计报告的注册会计师事务所根据《萨班斯-奥克斯利法案》(15 U.S.C. 7262(b))第404(b)节对其财务报告内部控制有效性的评估提交报告和证明。
◻无
如果证券是根据该法第12(b)节登记的,请用复选标记表明备案中包括的登记人的财务报表是否反映了对先前发布的财务报表的错误更正。☒
用复选标记表明这些错误更正中是否有任何重述需要对注册人的任何执行官根据§ 240.10D-1(b)在相关恢复期间收到的基于激励的补偿进行恢复分析。☒
用复选标记表明注册人在编制本备案中包含的财务报表时使用了哪种会计基础:
美国公认会计原则◻ |
已发布的国际财务报告准则 |
其他◻ |
如果针对上一个问题已勾选“其他”,则用复选标记表示注册人选择遵循的财务报表项目。
◻项目17◻项目18
如果这是一份年度报告,请用复选标记表明注册人是否为空壳公司(定义见《交易法》第12b-2条)。
◻有丨否
i
165 |
||
165 |
||
165 |
||
165 |
||
165 |
||
165 |
||
176 |
||
177 |
||
178 |
||
187 |
||
187 |
||
187 |
||
187 |
||
187 |
||
188 |
||
189 |
||
189 |
||
189 |
||
189 |
||
189 |
||
191 |
||
197 |
||
197 |
||
197 |
||
197 |
||
197 |
||
198 |
||
199 |
||
199 |
||
200 |
||
200 |
||
200 |
||
200 |
||
201 |
||
201 |
||
201 |
||
201 |
||
204 |
||
204 |
||
204 |
||
205 |
||
208 |
||
208 |
||
208 |
||
208 |
||
212 |
||
二、
一般信息
如本年度报告表格20-F所用,除非文意另有所指或另有说明:
| ● | 所有提及“Grifols”、“公司”、“我们”、“我们”和“我们的”均指GRIFOLS, S.A.,一家公司(sociedad an ó nima)根据西班牙法律组建,以及我们的合并子公司; |
| ● | 凡提及“集团”或“Grifols集团”,均指GRIFOLS, S.A.及Grifols,S.A.拥有或控制的公司集团;及 |
| ● | 有关本表格20-F中引用的术语的进一步解释和/或定义,请参阅“术语汇总表”。 |
财务和其他信息的介绍
本文件中Grifols财务信息的列报基础符合国际会计准则理事会颁布的国际财务报告准则或国际财务报告准则,或IASB(合称“IFRS-IASB”)以及包含管理我们财务信息的适用立法的其他立法规定,除非另有说明。
本年度报告表格20-F中所有提及(i)“欧元”、“欧元”或“欧元”均指欧盟共同货币,(ii)“美元”、“美元”或“美元”均指美国货币。
Grifols的功能和表示货币是欧元。除股份和每股金额、百分比和另有说明外,所有表格披露均以千欧元为单位。本年度报告表格20-F中包含的某些金额和其他数字已进行四舍五入调整。因此,任何表格中所列总额与金额总和之间的任何差异都是由于四舍五入造成的。
会计准则变更及差错更正
由于会计处理的应用不正确,我们截至2024年12月31日止年度的合并财务报表中列报的比较数字已重列,原因如下:(i)我们已将我们参与一家合资企业确认为一项财务投资。但在2024年期间,经过与CNMV的讨论,我们得出结论,该协议应被确认为共同经营,要求确认共同控制实体的资产、负债和结果。为在各期间各自的损益表中准确列报这些损失,截至2024年12月31日止年度的合并财务报表中已重列了2023年和2022年损益表对应的比较数字,其影响分别表示业绩减少1700万欧元和2300万欧元;(ii)我们错误地应用了对一家联营公司的非控股权益的会计处理,导致对其中的权益法投资进行了更正。在此背景下,我们在截至2024年12月31日止年度的合并财务报表的比较信息中重述了截至2023年1月1日与“以权益入账的被投资方的投资”和“合并储备”相关的金额,减少了4.57亿欧元,与“以权益入账的被投资方的投资”、“持有待售的非流动资产”相关的金额,及截至2023年12月31日的‘综合储备’,分别减少1.13亿欧元、3.44亿欧元及4.57亿欧元;及(iii)由于截至2023年12月31日及2022年12月31日止年度的综合全面收益表的小标题“权益入账的被投资单位/换算差异”的措辞不准确,在截至2024年12月31日止年度的综合财务报表中,此标题的符号已被修改,对应项目为综合全面收益表的小标题“换算差异”。由于这一不精确,本子标题已分别修改为截至2023年12月31日和2022年12月31日的金额分别为1.24亿欧元和6100万欧元,对照小标题“参与以权益法核算的投资的其他综合收益-换算差异”。这一不精确的措辞并未对综合资产负债表中全球范围内考虑的总标题“翻译差异”产生任何影响。
见第一部分项目5,“经营和财务审查与前景—— A.经营成果——影响我们财务状况和经营成果的因素——会计准则变更和差错更正”,以及截至2024年12月31日止年度的合并财务报表附注2(d)和附注10。
三、
非国际财务报告准则财务措施
这份20-F表格年度报告的某些部分包含非国际财务报告准则财务指标,特别是固定货币。我们的管理层使用这一衡量标准来评估集团在为集团做出运营和战略决策方面的财务表现。因此,我们认为这项措施对投资者和利益相关者是有用的。
不变货币
以固定货币计算的净收入差异是通过将调整后的当期数字(使用上一期间的月平均汇率计算)与上一期间的净收入进行比较确定的。由此产生的固定货币百分比差异被认为是非IFRS-IASB财务计量。以固定货币计算的净营收差异计算的是不受外汇波动影响的净营收差异。我们认为,恒定的货币差异是衡量我们运营的一个重要指标,因为它抵消了外汇影响,并说明了一年到下一年的潜在变化。我们认为,由于完全由汇率波动引起的变化被消除,本演示文稿提供了一个有用的期间对比。我们定义和提出的以固定货币计算的净收入差异可能无法与其他公司报告的类似衡量标准进行比较。以固定货币计算的净收入差异具有局限性,特别是因为消除的货币影响构成了我们净收入的重要因素,并可能对我们的业绩产生重大影响。我们在评估我们的结果和业绩时,一方面不考虑固定货币的差异,另一方面也不考虑根据IFRS-IASB编制的变化。我们提醒您遵循类似的方法,仅在根据IFRS-IASB编制的其他财务业绩衡量标准之外考虑有关固定货币期间与期间收入差异的数据,而不是作为替代或优于这些数据。我们将源自IFRS-IASB净收入的波动与源自不变货币的波动并列。
报告的净收入与以固定货币计算的净收入的对账情况见下文:
截至12月31日止年度, |
截至12月31日止年度, |
|
|||||||||||
|
2024 |
|
2023 |
|
% var |
|
2023 |
|
2022 |
|
% var |
|
|
(百万欧元) |
(百万欧元) |
|
|||||||||||
净收入 |
|
7,212.3 |
|
6,592.0 |
|
9.4 |
% |
6,592.0 |
|
6,064.0 |
|
8.7 |
% |
汇率影响导致的变化 |
|
58.6 |
|
|
|
133.6 |
|
|
|||||
固定货币净营收 |
|
7,270.9 |
|
6,592.0 |
|
10.3 |
% |
6,725.6 |
|
6,064.0 |
|
10.9 |
% |
市场信息的介绍
市场信息(包括我们的经营活动以及我们的子公司或被我们收购的公司的经营活动的市场份额、市场地位和行业数据)或本年度报告中关于我们(或被我们收购的公司)相对于竞争对手的地位的20-F表格中提出的其他陈述在很大程度上反映了我们管理层的最佳估计。这些估计是基于从客户、贸易或商业组织和协会、我们经营所在行业内的其他联系人获得的信息,在某些情况下,基于已公布的统计数据或独立第三方的信息。除另有说明外,我们的市场份额数据,以及我们的管理层对我们的相对竞争地位的评估,是通过将我们在相关期间的销售数据与我们的管理层对竞争对手在该期间的销售数据的估计进行比较,以及根据已公布的统计数据、从提交给美国证券交易委员会或美国证券交易委员会的文件中获取的信息以及来自独立第三方的信息,特别是市场研究局或MRB等机构发布的报告和提供的信息得出的。您不应依赖此处提供的市场份额和其他市场信息作为市场份额或其他实际情况的精确度量。
关于前瞻性陈述的警示性陈述
这份年度报告包含的陈述构成了1995年《美国私人证券诉讼改革法案》含义内的“前瞻性陈述”。前瞻性陈述通常由“可能”、“预期”、“相信”、“估计”、“预测”、“预期”、“打算”、“预测”、“将”、“将”、“应该”或此类术语的否定或此类术语的其他变体或类似或类似的词语或表达等词语来识别。
四、
这些前瞻性陈述(如适用)反映了我们管理层当前的信念、假设和预期,并受制于许多可能导致实际结果出现重大差异的因素。这些因素包括但不限于:
| ● | 我们制造工艺的复杂性以及我们的生物中间体易受污染; |
| ● | 我们需要持续监测我们的产品是否存在可能的意外副作用; |
| ● | 我们遵守政府法规的能力,以便我们可以继续制造和分销我们的产品; |
| ● | 我们的血浆供应或我们的单采血浆中心运营中断的影响; |
| ● | 竞品和定价的影响以及竞争对手的行为; |
| ● | 卖空者或其他市场颠覆者为压低我们股票的市场价格、对我们的业务运营产生负面影响和/或产生非立功诉讼而采用的策略和技术的影响; |
| ● | 产品责任索赔对我们业务的影响; |
| ● | 我们对无传染性疾病的血浆供应的依赖; |
| ● | 我们与融资相关的计划,包括再融资计划、利率和可用性,以及融资机会的成本; |
| ● | 利率波动的影响; |
| ● | 我们的制造和储存设施意外关闭或延迟开放新的计划设施; |
| ● | 依赖第三方制造产品和提供服务; |
| ● | 我们在开发中将产品商业化的能力; |
| ● | 我们保护知识产权的能力。 |
| ● | 美国医疗保健立法、新立法、监管行动或法律程序影响(其中包括)美国医疗保健系统,以及药品定价和报销,包括医疗补助、医疗保险和340B计划; |
| ● | 美国以外市场影响产品定价、报销、准入或分销渠道的立法或法规; |
| ● | 与我们的运营改进计划(定义见下文)相关的成本节约、精简公司职能、优化血浆成本和运营、提高效率和协同效应、结构改进和其他措施的规模;和 |
| ● | 影响我们经营所在行业的法律要求的变化。 |
请在“项目3.D.风险因素”下查看本表20-F中列出的可能影响我们业务的这些风险和其他风险的更详细讨论。
v
前瞻性陈述不是对未来业绩的保证,涉及风险、假设和不确定性,包括上面所列的风险、假设和不确定性,实际结果可能与前瞻性陈述中明示或暗示的结果存在重大差异。
所有与本年度报告中涉及的事项有关并可归属于我们或代表我们行事的任何人的书面和口头前瞻性陈述,其全部内容均受到本年度报告中包含或提及的警示性陈述的明确限定。本年度报告中包含的前瞻性陈述仅在本年度报告发布之日发表。除法律要求外,我们不承诺更新任何前瞻性陈述以反映该日期之后的事件或情况,或反映意外事件的发生。
六
第一部分
项目1。 |
董事、高级管理层和顾问的身份 |
a. |
董事和高级管理人员 |
不适用。
b. |
顾问 |
不适用。
c. |
审计员 |
不适用。
项目2.提供统计数据和预期时间表
a. |
报价统计 |
不适用。
b. |
方法和预期时间表 |
不适用。
项目3.关键信息
a. |
[保留] |
b. |
资本化和负债 |
不适用。
c. |
要约的原因及所得款项用途 |
不适用。
d. |
风险因素 |
总结
我们的公司、我们的业务和我们的证券受到许多风险的影响,这些风险在D项的其他地方有更全面的描述。我们在下面概述了我们的关键风险因素。
与我们的Structure相关的风险:
| ● | 我们的大量负债水平可能会对我们的财务状况产生不利影响,限制我们对业务变化做出反应的能力,并阻止我们履行债务义务; |
| ● | 尽管我们负债累累,但我们仍可能产生更多的债务。这可能会加剧与我们的大幅杠杆相关的风险; |
1
| ● | 为了偿还我们的债务和其他义务,我们将需要大量现金。我们产生现金的能力取决于许多因素,其中一些因素可能超出我们的控制范围; |
| ● | 我们债务协议中的契约在许多方面限制了我们的业务; |
| ● | 我们履行财务义务的能力部分取决于我们从子公司获得股息和其他分配的能力; |
| ● | 我们与关联方进行交易,此类交易可能呈现可能对我们产生不利影响的可能利益冲突的表象; |
| ● | 根据美国证券交易委员会的规则和条例,我们是一家外国私人发行人,因此,根据1934年《证券交易法》,我们不受多项规则的约束,并且被允许向美国证券交易委员会提交的信息少于在美国注册成立的公司; |
| ● | 世界各地的军事冲突,以及全球对此的反应,可能会对我们的业务和运营结果产生不利影响;和 |
| ● | 根据美国证券法强制执行民事责任的能力可能受到限制。 |
| ● | 我们是一家跨国企业,在众多税务管辖区开展业务。 |
| ● | 包括美国、欧盟和/或中国在内的全球潜在贸易争端和互惠关税的意外结果可能会对我们的业务造成影响。 |
| ● | 对墨西哥国民越境进入美国捐献血浆的能力的限制可能会扰乱我们的血浆供应,并对我们的财务业绩产生重大不利影响。 |
| ● | 我们经营所在国家(包括加拿大和美国)的移民法变化可能会影响我们将具有特定制造和IT专业知识的员工派往外国地区以建设或升级某些基础设施的能力。 |
与本公司及本公司业务相关的风险:
| ● | 我们的制造过程很复杂,涉及可能容易受到污染和产量变化的生物中间体。等离子和等离子衍生产品脆弱,对等离子或等离子衍生产品的不当处理可能会对我们的运营产生不利影响; |
| ● | 一旦我们的产品获得批准并上市,我们必须持续监测它们是否有迹象表明它们的使用可能会导致严重和意想不到的副作用,这可能会危及我们的声誉和我们继续营销我们产品的能力。我们还可能被要求进行批准后临床试验,作为许可产品的条件。而且,我们可能无法将开发中的产品商业化; |
| ● | 我们继续制造和分销我们的产品的能力取决于我们在我们的设施中继续遵守cGMP法规; |
| ● | 我们的血浆供应出现重大中断,包括由于宏观经济条件、大流行病或移民政策和执法的变化,可能会对我们的业务和增长计划产生重大不利影响; |
| ● | 我们的单采血浆中心的运营中断将导致我们变得供应受限,我们的财务业绩将受到影响; |
2
| ● | 我们净收入的很大一部分历来来自于我们的免疫球蛋白(“IG”)产品的销售,我们预计它们将继续占我们销售额的很大一部分。与这些产品有关的任何不利市场事件都可能对我们产生重大不利影响; |
| ● | 我们面临重大竞争; |
| ● | 我们面临来自拥有更大财力资源的公司的竞争; |
| ● | 我们产品生产的技术变革可能需要对创新、数字化转型和新技术进行大量投资,这可能会使我们的生产过程变得不经济,并削弱我们在我们经营所在行业的竞争力; |
| ● | 新病原体的发现可能会减缓我们的增长并对利润率产生不利影响; |
| ● | 涉及我们生产或分销的产品的产品责任索赔或产品召回和/或自愿撤回可能对我们的业务产生重大不利影响; |
| ● | 我们持续生产安全有效的血浆衍生产品的能力,有赖于没有传染性疾病的血浆供应; |
| ● | 在当今数据驱动的世界中,无效的IT治理带来了重大风险,包括数据泄露、监管不合规、运营效率低下、财务损失和创新受阻; |
| ● | 我们未来的成功取决于我们留住高级管理层成员的能力,以及吸引、留住和激励合格人员的能力; |
| ● | 我们的业务需要大量的资本来运营和增长,并实现我们实现增加经营杠杆的战略,包括完成几个大型资本项目; |
| ● | 我们可能无法成功地发展我们的一些国际业务; |
| ● | 有关一般监管和法律环境的不确定性,特别是在中国,可能会对我们的业务产生不利影响; |
| ● | 我们容易受到利率变动的影响; |
| ● | 我们的经营业绩和财务状况可能会受到外币汇率不利变化的影响,尤其是欧元相对于美元的价值发生重大转变; |
| ● | 如果我们的主要设施遭遇严重事故,或者如果不可抗力事件严重影响了我们运营和生产可销售产品的能力,我们的大部分制造能力可能会被长期关闭; |
| ● | 如果我们遇到设备困难或如果我们的设备或一次性商品的供应商未能及时交付关键产品部件或供应,我们的制造能力将受到损害,我们的产品销售可能会受到影响; |
| ● | 如果我们的运输或分销渠道由于严重事故、流行病、恐怖主义行为、罢工、地震、重大火灾或风暴或任何其他不可抗力事件而变得无法进入,我们的供应、生产和分销过程可能会被打乱; |
| ● | 我们在很大程度上依赖第三方的服务来销售、分销和交付我们的产品; |
3
| ● | 我们依赖第三方的服务来制造某些产品; |
| ● | 我们可能无法将开发中的产品商业化; |
| ● | 有关隐私和数据安全的复杂和不断演变的美国和国际法律法规以及我们的信息技术系统面临的网络安全事件风险增加,可能导致运营成本增加,并对我们的业务造成重大干扰; |
| ● | 网络攻击或其他隐私和数据安全事件(例如涉及我们的血浆或献血者的个人信息)可能会扰乱我们的业务,并使我们面临重大损失、责任和声誉损害; |
| ● | 我们的成功在很大程度上取决于我们是否有能力在美国和其他国家获得并维持与我们的技术和产品相关或纳入其中的知识产权的保护; |
| ● | 除了专利技术,我们还依赖我们未获得专利的专有技术、商业秘密、工艺和专有技术; |
| ● | 我们可能侵犯或被指控侵犯第三方的知识产权; |
| ● | 我们已在许可中获得某些专利权,并与第三方共同拥有某些专利权; |
| ● | 我们可能无法从签订新的或经修订的合同、成本节约和业务改善举措中实现预期收益; |
| ● | 气候变化和重大自然灾害风险增加可能会对我们的业务产生不利影响;以及 |
| ● | 不同司法管辖区的生物特征信息隐私法的变更、颁布和/或执行,包括美国的联邦和州法律,可能会使我们面临潜在的责任。 |
医疗保健行业相关风险:
| ● | 美国医疗改革可能对我们的业务产生不利影响; |
| ● | 政府对报销的压力和限制可能会对我们的业务产生不利影响; |
| ● | 政府对产品开发和监管批准的法规的影响,以及政府对报销的压力和限制可能会对我们的业务产生不利影响; |
| ● | 未能遵守有关我们产品销售和营销的法律法规或诉讼中的不利决定可能会对我们造成不利后果; |
| ● | 如果其他政府或私人第三方付款人降低或以其他方式限制我们产品购买者的报销金额、价格、范围或其他资格要求,我们可能会受到不利影响; |
| ● | 我们受到广泛的政府监管合规和道德监督; |
| ● | 未能遵守不断变化的监管要求可能会对我们的业务产生重大不利影响;和 |
| ● | 我们受到广泛的环境、健康和安全法律法规的约束。 |
4
与我们的股票和美国存托股票相关的风险:
| ● | 如果我们发现我们对财务报告的内部控制存在重大弱点或重大缺陷,可能会对我们提供及时可靠的财务信息和履行美国联邦证券法规定的报告义务的能力产生不利影响,这也可能影响我们美国存托股票的市场价格或我们继续在纳斯达克上市的能力; |
| ● | Grifols家族可能对我们的业务开展施加重大影响; |
| ● | 我们在纳斯达克的B类ADS的市场价格,以及我们在场外市场交易的A类ADS的市场价格,可能会波动; |
| ● | 卖空者或其他市场破坏者使用的技术可能会压低我们股票的市场价格,对我们的业务运营产生负面影响和/或产生非立功诉讼; |
| ● | 美元和欧元汇率波动可能会增加持有我们ADS或股票的风险; |
| ● | 我们的股票或ADS的美国持有人可能无法获得认购(或优先)权利;和 |
| ● | ADS持有人可能会受到其ADS转让的限制。 |
与我们的Structure相关的风险
我们的大量负债水平可能会对我们的财务状况产生不利影响,限制我们对业务变化做出反应的能力,并阻止我们履行债务义务。
我们负债累累。截至2024年12月31日,我们的流动和非流动金融负债为101.667亿欧元,其中绝大部分(94.906亿欧元)为长期债务。
我们的高负债水平可能对我们的业务产生重大不利影响,例如:
| ● | 使我们更难就未偿债务履行我们的义务; |
| ● | 使我们更容易受到经济衰退和业务不利发展的影响; |
| ● | 削弱我们为营运资金、资本支出、收购或一般公司用途获得额外融资的能力; |
| ● | 由于我们的现金流的很大一部分用于支付债务利息,因此减少了我们可用于运营和其他目的的资金; |
| ● | 对我司购置款债务、设备融资和不动产抵押项下所有未偿债务的标的资产提出优先排序债权; |
| ● | 限制我们为控制权变更要约提供资金的能力; |
| ● | 与债务可能相应减少的竞争对手相比,我们处于竞争劣势; |
| ● | 限制我们在规划或应对我们的业务和我们经营所在行业的变化方面的灵活性;和 |
5
| ● | 限制我们进行战略性收购或开发其他商业机会。 |
我们预计将使用运营现金流来支付我们未偿债务项下的费用和到期金额。我们支付这些款项的能力取决于我们未来的表现,这将受到金融、商业、经济和其他因素的影响,其中许多因素可能超出我们的控制范围。我们的业务可能无法在未来从运营中产生足够的现金流,我们预期的收入和现金流增长可能无法实现,这两种情况中的任何一种或两者都可能导致我们无法偿还债务或为其他流动性需求提供资金。如果我们没有足够的流动性,我们可能会被要求对当时现有的全部或部分债务进行再融资,出售资产或产生更多债务。我们可能无法以我们可以接受的条件完成任何这些替代方案,或者根本无法完成。此外,现有或未来债务协议的条款可能会限制我们采用任何这些替代方案。未能产生足够的现金流或未能实现任何这些替代方案可能会对我们的业务、经营业绩和财务状况产生重大不利影响。
尽管我们负债累累,但我们仍可能产生更多的债务。这可能会加剧与我们的大幅杠杆相关的风险。
我们可能会在未来产生大量额外债务,包括额外的担保债务。我们的业务是资本密集型的,我们经常寻求额外的资本。尽管管辖2019年票据(定义见本文件)、2021年票据(定义见本文件)、2024年4月票据(定义见本文件)和2024年12月票据(定义见本文件)、第一留置权信贷便利(定义见本文件)和欧洲投资银行定期贷款(定义见本文件)的每一份契约都包含对产生额外债务的限制,但这些限制受到一些资格和例外情况的限制,在某些情况下,为遵守这些限制而产生的债务,包括有担保债务,可能是巨大的。将额外债务增加到目前的债务水平可能会加剧上述与杠杆相关的风险。有关我们负债的更多信息,请参看第一部分第5项,“经营和财务审查与前景—— B.流动性和资本资源——信贷来源。”
为了偿还我们的债务和其他义务,我们将需要大量现金。我们产生现金的能力取决于许多因素,其中一些因素可能超出我们的控制范围。
我们支付债务和为债务再融资以及为营运资金需求和计划资本支出提供资金的能力将取决于我们未来产生现金的能力。由于经济状况变化、竞争加剧或我们无法控制的其他事件导致我们的经营现金流大幅减少,可能会增加对额外或替代流动性来源的需求,并可能对我们的业务、财务状况、经营业绩、前景以及我们偿还债务和其他义务的能力产生重大不利影响。如果我们无法偿还债务,我们将被迫采取替代策略,其中可能包括减少资本支出、出售资产、重组或为我们的债务再融资或寻求额外的股权资本等行动。我们无法向您保证,这些替代策略中的任何一种都可以在令人满意的条件下实施,如果有的话,或者它们将产生足够的资金来支付我们的债务所需的款项。
此外,我们在第一留置权信贷便利下的借款采用浮动利率,使我们面临利率风险。如果利率提高,即使借款金额保持不变,我们对浮动利率债务的偿债义务也会增加,我们的净收入也会减少。
我们无法向您保证,我们的业务将从运营中产生足够的现金流,或者未来的借款将根据第一留置权信贷便利或以其他方式提供给我们,其金额足以使我们能够支付我们的债务或为我们的其他流动性需求提供资金。我们可能需要在此类债务到期时或之前对我们的全部或部分债务进行再融资。我们无法向您保证,我们将能够以商业上合理的条款或根本无法为我们的任何债务再融资,包括第一留置权信贷便利、2019年票据、2021年票据、2024年4月票据、2024年12月票据和欧洲投资银行定期贷款。有关我们负债的更多信息,请参看第一部分第5项,“经营和财务审查与前景—— B.流动性和资本资源——信贷来源。”
6
我们债务协议中的契约在许多方面限制了我们的业务。
管理我们的债务和适用于我们的其他财务义务的协议包含各种契约,但有惯常的警告,这些契约限制了我们的能力和/或我们受限制的子公司的能力,其中包括:
| ● | 对他人的义务产生或承担留置权或额外债务或提供担保; |
| ● | 发行可赎回股票和优先股; |
| ● | 向Grifols股东支付股息或进行分配或赎回或回购股本; |
| ● | 预付、赎回或回购债务; |
| ● | 进行贷款、投资和资本支出; |
| ● | 订立限制我们受限制附属公司分派的协议; |
| ● | 出售我司子公司资产和股本; |
| ● | 与关联公司进行某些交易;和 |
| ● | 与另一个人合并或合并,或将我们几乎所有的资产出售给另一个人。 |
违反这些契约中的任何一项都可能导致我们债务协议项下的违约。一旦发生违约事件,相关债权人可以选择宣布债务协议项下的所有未偿金额立即到期应付,就第一留置权信贷便利而言,2024年12月票据、2024年4月票据、2021年票据、2019年票据和欧洲投资银行定期贷款终止所有提供进一步信贷的承诺。如果我们无法偿还这些金额,相应的债权人可以对授予他们的抵押品进行担保,以确保该债务。我们已将很大一部分资产作为第一留置权信贷便利、欧洲投资银行定期贷款、2019年票据、2024年4月票据和2024年12月票据的抵押品。如果我们现有债务下的各自债权人加速偿还借款,我们可能没有足够的资产来偿还我们的债务。
我们履行财务义务的能力部分取决于我们从子公司获得股息和其他分配的能力。
我们的主要资产是我们在运营子公司中持有的股权。因此,我们依赖子公司的股息和其他分配来产生必要的资金来履行我们的财务义务,包括支付我们未偿债务的本金和利息。我们的子公司可能无法从运营中产生足够的现金,以使我们能够就我们的债务支付本金和利息,或者可能有优先股息,这些股息要求在向我们支付任何股息之前支付。例如,就我们在美国的单采血浆子公司Biomat USA,Inc.(“Biomat USA”)和Biomat Newco Corp(“Biomat Newco”)而言,如果股息由其各自的股东宣布,那么GIC投资者(定义见本第一部分第4项,“公司信息— A.公司的历史和发展——重要里程碑”)将有权获得优先股息。此类股息相当于Biomat USA(就其10股优先股)和Biomat Newco(就其9股优先股)每年各自支付的每股4,168,421.05美元,并附带额外权利以及包括赎回权和每股52,105,263.16美元的清算优先权。见第一部分第5项,“经营和财务审查与前景—— A.经营成果——影响我们财务状况和经营成果的因素——处置—— Biomat交易。”
7
此外,我们的子公司向我们支付的任何股息、分配、贷款或垫款可能会受到股息限制,或者就外国子公司而言,根据适用的当地法律和我们子公司经营所在司法管辖区的货币转移限制,可能会受到汇回收益的限制。此外,我们的子公司向我们支付的款项将取决于我们子公司的收益。根据我们的债务条款,我们的子公司被允许产生可能限制这些子公司向我们付款的额外债务。我们无法向您保证,关于我们子公司当前和未来债务的协议将允许这些子公司向我们提供足够的现金,以在到期时为我们的债务支付资金。
我们的子公司在法律上与我们不同,并且,除了为某些债务提供担保的现有和未来的子公司外,我们没有义务(或有义务或其他)支付我们的债务到期金额或向我们提供资金以进行此类支付。
我们与关联方进行交易,此类交易存在可能对我们产生不利影响的利益冲突。
我们向关联方采购商品和服务、向关联方销售产品以及以其他方式与关联方进行其他交易。这些关联方交易产生了与我们和我们的管理层有关的利益冲突的可能性,包括:
| ● | 我们的高级管理人员、执行官和与关联方负有责任的董事可能意识到某些适合向我们以及此类其他关联方介绍的商业机会,并可能向此类其他方介绍此类商业机会; |
| ● | 我们的高级管理人员、执行人员和与关联方负有责任的董事可能对其他实体负有重大责任,并花费大量时间服务于其他实体,在分配时间方面可能存在利益冲突; |
| ● | 此类冲突可能导致我们管理层中的个人寻求将其经济利益或某些相关方的经济利益推进到我们之上;和 |
| ● | 关联交易产生的利益冲突的出现,可能会损害我们投资者的信心。我们的审计委员会定期审查这些交易。尽管进行了这些审查,但利益冲突可能会对我们的业务、财务状况和经营业绩产生不利影响。 |
有关我们的关联交易的更多信息,请参阅本第一部分第7项,“主要股东和关联交易—— B.关联交易”以及本年度报告表格20-F中包含的我们经审计的综合财务报表附注31。
8
根据美国证券交易委员会的规则和条例,我们是一家外国私人发行人,因此,根据1934年《证券交易法》,我们不受多项规则的约束,并且被允许向美国证券交易委员会提交的信息少于在美国注册成立的公司。
作为经修订的1934年《证券交易法》或《交易法》规定的外国私人发行人,我们豁免遵守《交易法》规定的某些规则,包括《交易法》第14节规定的代理规则,这些规则对代理征集规定了某些披露和程序要求。此外,我们不需要像根据《交易法》注册证券的美国公司那样频繁或迅速地向美国证券交易委员会或SEC提交定期报告和财务报表;我们不需要提交根据美国公认会计原则编制的财务报表;我们也不需要遵守SEC法规FD,这对选择性披露重大非公开信息施加了某些限制。此外,我们的高级职员、董事和主要股东在买卖我们的A类股或B类股方面不受《交易法》第16条或《交易法》规则的报告或短期利润回收条款的约束。因此,您收到的关于我们的信息可能少于您收到的关于一家在美国注册成立的公司的信息,并且根据美国联邦证券法获得的保护可能少于您在一家在美国注册成立的公司获得的保护。如果我们在未来某个时候失去了作为外国私人发行人的地位,我们将不再受此类规则的豁免,除其他外,我们将被要求提交定期报告和财务报表,就好像我们是一家在美国注册成立的公司一样。满足这些额外监管要求所产生的成本可能是巨大的。
此外,根据NASDAQ Stock Market LLC(“NASDAQ”)上市规则(“NASDAQ上市规则”),作为外国私人发行人,我们可以选择遵循我们本国的惯例,以代替NASDAQ上市规则5600系列的公司治理要求,但根据NASDAQ上市规则5615(a)(3)的规定需要遵守的规则除外。在纳斯达克上市规则5615(a)(3)允许的范围内,我们选择遵循西班牙的做法,以代替纳斯达克上市规则5600系列的要求。见第二部分“公司治理”项目16.g。
世界各地的军事冲突,以及全球对此的反应,可能会对我们的业务和运营结果产生不利影响。
发生不可预见或灾难性事件,包括地缘政治和其他经济或政治状况或事件,例如2022年以来俄罗斯和乌克兰之间的军事冲突、2023年10月以色列发生恐怖袭击后加沙持续冲突以及随后发生的伊朗和以色列之间的冲突,目前,根据其规模,这些冲突可能对国家和区域经济造成不同程度的破坏,并可能导致我们的业务中断。例如,为应对俄乌军事冲突,美国、英国、欧盟等对俄罗斯和俄罗斯某些个人和实体实施了新的重大制裁和出口管制。这场冲突还导致了全球市场的大幅波动和混乱。
无法预测这些冲突的长期影响,其中可能包括但不限于进一步制裁、经济和政治稳定的不确定性、通货膨胀率上升和能源价格进一步上涨、供应链挑战以及对货币汇率和金融市场的不利影响。此外,针对这些或任何其他未来冲突的制裁已经导致或可能导致网络攻击的威胁增加,这可能对我们的IT系统、我们的网络和我们的服务产品的安全以及我们数据的保密性、可用性和完整性构成风险。截至目前,乌克兰、加沙以及伊朗和以色列之间的冲突并未直接影响我们的业务运营,但我们无法确定此类冲突不会影响现有和潜在客户,并对我们未来的运营产生不利影响。
根据美国证券法,送达诉讼程序和执行民事责任的能力可能受到限制。
我们是一家根据西班牙法律组建的公司,我们的许多子公司也在美国境外注册成立。我们的资产和子公司的资产的很大一部分位于美国境外。此外,我们几乎所有的董事和高级管理人员以及我们某些子公司的高级管理人员和董事都是美国以外国家的国民或居民,这些人的全部或大部分资产位于美国境外。因此,投资者可能难以在美国境内就根据1933年《证券法》(“证券法”)产生的事项向我们或我们的某些子公司或其董事或高级管理人员送达诉讼程序,或根据《证券法》规定的民事责任对他们执行美国法院的判决。也可能难以在美国就对这些人或对我们或我们的某些子公司作出的任何判决进行全面追偿。
9
此外,对于仅基于美国证券法的原始诉讼,或执行美国责任法院判决的诉讼在西班牙的可执行性存在疑问。如果在西班牙境外获得判决,并努力在西班牙境内执行判决,西班牙法院是否会同意承认并执行外国判决存在一定疑问。因此,即使您在美国法院获得了有利的判决,您也可能会被要求在西班牙重新提起索赔诉讼。
我们是一家跨国企业,在众多税务管辖区开展业务。
我们受制于我们经营所在司法管辖区不断演变和复杂的税法,并定期就税务相关事项获得建议。在确定我们的税务负债时需要作出重大判断,我们的纳税申报表定期由各税务机关审查。我们定期评估这些检查产生结果的可能性,以确定我们对税务或有事项的应计是否充足;然而,由于税务事项的复杂性,任何税务事项的最终解决可能会导致支付高于或低于应计金额。此外,我们可能会受到税法变化的影响,包括税率变化、新税法以及国内外司法管辖区以及司法管辖区之间修订的税法解释,包括欧盟的影响,这可能会对我们的税务费用和/或税收余额产生重大不利影响,税收政策的变化可能会对我们的业务产生重大不利影响。此外,我们全球业务的一体化性质可能会导致不同国家的税收当局对在个别国家征税的利润提出相互矛盾的主张,包括与我们的子公司就公司间交易相互收取的价格有关的潜在争议,即所谓的转让定价。此外,现有或未来的行政命令或有关关税的法律的其他变化,包括美国行政当局和国会、欧盟和/或中国可能会对我们的业务、财务状况和经营业绩产生不利影响。有关关税的法律的任何变化对我们业务的影响(如果有的话)将取决于对贸易施加的具体限制,包括此类关税的生效日期和持续时间、此类关税所涵盖的司法管辖区、此类关税的数量以及其他司法管辖区征收的潜在报复性关税。任何这些风险的发生都可能对我们的业务、财务状况和经营业绩产生重大不利影响。
特别是,经济合作与发展组织(“OECD”)引入了一个关于税基侵蚀和利润转移的新的包容性框架(BEPS 2.0),其中包含一个双支柱解决方案,以应对经济数字化带来的税收挑战。这些变化目前正由世界各地的税务机关逐步实施,代表着对国际税收框架的根本性改变。支柱一提供了一项新的关联标准/征税权,将一部分无形/剩余利润直接分配给市场辖区,但仅限于最大和最赚钱的公司。第二支柱规定了全球最低征税水平(15%),为司法管辖区之间的税收竞争确立了下限。自经合组织包容性框架出台以来,已有130多个国家认可该框架,欧盟成员国正式通过了欧盟的第二支柱指令。然而,美国可能会对适用全球最低税提出质疑,并可能对适用或将适用全球最低税的司法管辖区(包括欧盟)的公司征收报复性税或采取其他报复行动。
截至本年度报告发布之日,某些欧盟成员国已开始将该指令转化为法律,但执行日期各不相同。虽然我们预计第二支柱不会对我们的税收提供或有效税率产生实质性影响,但第二支柱可能会导致我们经营所在的某些司法管辖区的补税,我们将继续监测不断变化的税收立法。根据最终规则,我们可能会面临增加税务和会计披露的要求。更多信息,见本年度报告所载经审计综合财务报表附注4(q)和28。
包括美国、欧盟和/或中国在内的全球潜在贸易争端和互惠关税的意外结果可能会对我们的业务造成影响。
我们的业务使我们面临来自美国、欧盟中国或其他国家的贸易保护主义加剧对我们的业务产生不利影响的风险。面对外国进口,各国政府可能会转向贸易壁垒,以保护或重振本国产业。对进口的限制,包括以关税的形式,可能会对全球贸易产生重大影响,并间接影响对我们产品的需求。我们所服务的市场中的贸易保护主义可能会导致出口商品的成本、交付商品所需的时间长度以及与出口商品相关的风险增加,从而导致出口商品量和对进口产品的需求下降,包括我们的血浆衍生疗法。由于许多产品的全球供应链具有相互关联的性质,这些政策可能会影响未直接征收或被征收关税的国家的进出口。
10
美国与包括欧盟成员国和中国在内的其他国家在贸易和其他问题上的紧张关系仍然很高。美国总统特朗普领导的新一届政府对包括欧盟和中国在内的多种商品实施了广泛的关税,这导致并可能继续导致包括中国和欧盟在内的其他国家的报复性关税。新政府广泛使用关税作为政策工具,给美国与中国、欧盟、加拿大、墨西哥和其他出口国之间的未来关系带来了重大不确定性,包括在贸易政策、条约、政府法规和关税方面,并引发了对贸易战可能延长的担忧。保护主义事态发展,或对其可能发生的看法,可能对全球经济状况产生重大不利影响,并可能显着减少全球贸易,特别是美国与其他国家,包括中国和欧盟国家之间的贸易,这可能对我们的业务、经营业绩和财务状况产生不利影响。任何新的或增加的贸易壁垒或贸易限制,包括由于美国或其他国家征收的关税,都可能对我们的业务、经营业绩和财务状况产生不利影响。
对墨西哥国民越境进入美国捐献血浆的能力的限制可能会扰乱我们的血浆供应,并对我们的财务业绩产生重大不利影响。
我们严重依赖于保持持续和不间断地获得美国来源的血浆(通过血浆置换术获得),这是我们血浆衍生产品的主要原材料。我们的血浆采集过程取决于捐赠者到达我们遍布全国的血浆采集中心网络并同意捐赠血浆。
我们在美国收集的血浆中,有很大一部分来自跨越美墨边境的捐献者,他们在加州、德克萨斯州和亚利桑那州等边境州的血浆采集中心进行捐赠。任何限制或政策变化或任何其他限制或阻止持有有效美国签证的墨西哥国民为此目的进入美国的问题都可能对我们收集足够血浆以满足生产需求的能力产生重大影响。多年来,美国当局实施或提出了各种可能限制跨境旅行的措施,包括改变签证政策、旅行禁令或增加边境检查站的执法行动。如果实施或收紧任何新的或现有的限制,它们可能会显着减少可用的捐献者池,并扰乱我们的血浆采集业务。血浆供应减少可能导致更高的采集成本、对替代来源的依赖增加或潜在的供应短缺,所有这些都可能对我们的收入和盈利能力产生不利影响。例如,在新冠疫情期间,美国关闭了美墨边境,这阻止了个人越境进入美国并在我们的血浆采集中心捐献血浆,从而大大减少了血浆捐赠的数量。边境关闭和旅行禁令或限制可能会限制捐赠者到达我们的血浆采集中心的能力,并减少我们的血浆供应。
如果我们无法获得足够数量的来源等离子体,我们可能无法找到具有成本效益的替代等离子体来源,我们维持等离子体衍生产品当前制造水平的能力将受到限制。此外,供应的任何减少都可能影响我们满足患者需求和合同义务的能力,可能导致声誉损害或监管审查。因此,我们可能会遇到净收入或利润率大幅下降、客户流失、我们作为等离子衍生产品可靠供应商的声誉受到负面影响或我们的生产增长计划大幅延迟。任何对我们血浆供应链的重大中断都可能对我们的业务、财务状况和经营业绩产生重大不利影响。
我们经营所在国家(包括加拿大和美国)的移民法变化可能会影响我们将具有特定制造和IT专业知识的员工派往外国地区以建设或升级某些基础设施的能力。
我们在组织的关键部分高度依赖技术人才,我们在招聘、培训和留住合格人员方面投入巨资。我们业务的成功取决于我们吸引和留住有才华和经验丰富的专业人士的能力,以及在世界各地动员他们以满足我们增长需求的能力,包括在世界各地建造新设施和升级现有基础设施。
11
法律、法规和习俗,包括我们主要市场美国和加拿大的立法和惯例,可能会限制我们吸引、激励和留住所需水平的合格人员的能力。一些国家和非政府组织最近表达了对离岸外包与国内就业机会流失之间的关联的担忧。很难预测可能影响移民法的政治和经济事件,或者它们可能对我们的制造和技术专业人员获得或更新工作签证产生的限制性影响。我们经营所在国家的移民法律可能会发生立法变化,以及由于政治力量和经济状况而导致适用和执行标准的差异。改变移民法以限制国内公司在国际上外包服务、限制某些工作签证的可用性或在我们经营的关键市场增加签证费用可能会影响我们及时为项目配备人员的能力,并对我们的盈利能力产生负面影响。
除了呼吁修改有关接纳高技能临时和长期工人的美国移民法外,美国联邦和/或州一级可能会颁布限制外包的立法。由于我们的大部分业务中心都在美国各地,美国移民法的修改可能会使我们更难为我们的员工获得所需的非移民工作授权,从而使我们能够竞争并为我们在美国的客户提供及时且具有成本效益的服务,这反过来可能会对我们的收入和经营盈利能力产生不利影响。此外,如果移民或签证法律法规的立法或行政变更损害了我们的招聘流程或项目,涉及非其工作所在国公民的人员,我们的国际扩张和我们的总体业务可能会受到重大不利影响。如果我们不能有效地增加和留住员工,我们实现战略目标的能力将受到不利影响,我们的业务和增长前景将受到损害。
与公司和我们业务相关的风险
我们的制造过程很复杂,涉及可能容易受到污染和产量变化的生物中间体。等离子和等离子衍生产品很脆弱,对等离子或等离子衍生产品的不当处理可能会对我们的运营产生不利影响。
血浆是一种容易受到损害和污染的原材料,可能含有人类病原体,其中任何一种都会使血浆不适合进一步制造。例如,我们或第三方供应商对血浆的污染或不当储存可能要求我们销毁我们的一些原材料。如果不合适的等离子体在释放到我们的制造工艺之前未被识别和丢弃,则可能需要丢弃由该等离子体制成的中间产品或成品,或召回任何释放到市场的成品,从而导致计入已售商品的成本。
我们血浆制品的制造是一个极其复杂的分馏(将血浆分离成成分蛋白)、纯化、灌装和精加工的过程。由于我们的一项或多项产品测试、制造、过程控制和质量保证过程的失败,我们的产品可能会变得不可发布或无法满足我们的规格。我们可能会检测到以下情况:未按照我们的制造程序生产未释放的产品或我们生产过程中使用的血浆未按照美国食品药品监督管理局(“FDA”)和其他国家类似监管机构执行的现行良好营销规范(“cGMP”)法规或其他类似法规的合规方式收集或储存,这可能会导致我们确定受影响的产品不应被释放,因此应被销毁。
一旦我们制造了我们的等离子体衍生产品,他们必须小心处理并保持在适当的温度。我们未能,或供应、运输或分销我们产品的第三方未能妥善照顾我们的血浆衍生产品,可能要求销毁此类产品。
虽然由于血浆、我们的工艺和我们的产品的复杂性,我们预计会在正常业务过程中注销少量在制品库存,但意外事件可能会导致注销和其他成本大大超出我们的预期。此类冲销和其他成本可能会导致我们的盈利能力出现重大波动。此外,我们的产品受到污染可能会导致与我们开展业务的投资者、消费者或其他第三方对我们的制造程序的可靠性失去信心,这可能会对我们的销售和利润产生不利影响。此外,在不知情的情况下分销的有缺陷或受污染的产品可能会导致患者伤害,威胁我们产品的声誉,并使我们面临产品责任损害赔偿和索赔。
12
由于血浆的性质,我们收集或购买的用于分馏的血浆的生物学特性会发生变化,这可能会导致所需馏分的可获得产量出现波动,即使遵循了cGMP规定。由于产能限制,较低的产量可能会限制我们等离子体衍生产品的生产。如果此类产量较低的批次血浆影响生产时间延长,可能会减少我们可以营销的产品总量并增加我们的销售成本,从而降低我们的盈利能力。
我们制造中间免疫分析抗原和抗体来筛选人捐献的血液和血液制品也是一个复杂的生物过程,存在实质性的生产风险。这些过程通常涉及上游或发酵过程和下游或纯化过程。由于在上游过程中,我们处理活细胞,我们可能会面临不想要的细胞的污染,这最终会转化为低产量。一般来说,产量也会受到在这个发酵步骤中添加到反应器中的不同营养成分的很大影响。同样,在纯化步骤中,由于树脂成分差、设备故障或程序错误,我们可能会面临低产率。
一旦我们的产品获得批准并上市,我们必须持续监测它们是否有迹象表明它们的使用可能会导致严重和意想不到的副作用,这可能会危及我们的声誉和我们继续营销我们的产品的能力。我们还可能被要求进行批准后临床试验,作为许可产品的条件。
至于所有医药产品,使用我们的产品有时会产生不良副作用或不良反应或事件(统称为“不良事件”)。在大多数情况下,这些不良事件是已知的,预计会以某种频率发生,并在产品的标签中进行了描述。我们的一些产品的已知不良事件包括过敏或过敏反应,包括休克和感染因子的传播。此外,使用某些产品有时会产生额外的不良事件,详见下文。
| ● | 白蛋白的使用有时会产生以下不良事件:高血容量、循环超负荷、肺水肿、过多的水分和过敏表现,包括荨麻疹、寒战、发热和呼吸、脉搏和血压的变化。 |
| ● | 凝血因子IX的使用有时会产生以下不良事件:诱导中和抗体;血栓栓塞,包括心肌梗死;弥散性血管内凝血;静脉血栓形成和肺栓塞;以及,在免疫耐受诱导的治疗情况下,肾病综合征。 |
| ● | 使用抗血友病凝血因子VIII有时会产生以下不良事件:诱导中和抗体、血栓栓塞事件和溶血性贫血或溶血。 |
| ● | 使用免疫球蛋白有时会产生以下不良事件:恶心、呕吐、乏力、发热、僵硬、注射部位反应、过敏或过敏反应、无菌性脑膜炎、关节痛、背痛、头晕、头痛、皮疹、瘙痒、荨麻疹、溶血或溶血性贫血、高蛋白血症、血清粘度增高和低钠血症、心肌梗死、中风、肺栓塞和深静脉血栓形成等血栓栓塞反应、输血相关的急性肺损伤和肾功能不全和急性肾功能衰竭。 |
| ● | 使用抗乙肝免疫球蛋白有时会产生以下不良事件:心肌梗塞、中风、肺栓塞和深静脉血栓等血栓栓塞反应、无菌性脑膜炎、溶血性贫血或溶血和急性肾功能衰竭。 |
| ● | Koate的使用®-DVI,我们在美国独家授权给Kedrion S.P.A,一家根据意大利法律组建的公司,有时会产生以下不良事件:过敏反应、手臂、耳朵和面部刺痛、视力模糊、头痛、恶心、胃痛和紧张不安的感觉。 |
| ● | Prolastin的使用®,Prolastin®-C,alpha-1蛋白酶抑制剂,或A1PI,有时会产生以下不良事件:呼吸困难、心动过速、皮疹、胸痛、寒战、流感样症状、超敏反应、低血压和高血压。 |
13
此外,使用我们的产品可能与严重和意外的不良事件有关,或与比预期频率更高的不太严重的反应有关。当我们的产品用于重症患者人群时,这一点可能尤其正确。当这些突发事件被报告给我们时,我们必须进行彻底的调查,以确定产品安全的因果关系和影响。这些事件还必须具体向适用的监管机构报告。如果我们的评估得出结论,或者监管机构认为,存在与该产品相关的不合理风险,我们将有义务撤回该产品的受影响批次。此外,由新产品引起的意外不良事件可能只有在广泛使用该产品后才会被确认,这可能会使我们面临产品责任风险、监管机构的执法行动以及对我们声誉的损害。
一旦我们生产出产品,医生将负责按照我们的指示开具和管理产品以及标签上描述的适应症。然而,医生为未经批准、标签外、用途或以与我们的指示或标签不一致的方式开出我们的产品并不罕见。如果此类标签外使用和背离我们的管理指示变得普遍并产生诸如功效降低或其他不良影响等结果,我们的产品在市场上的声誉可能会受到影响。
我们继续制造和分销我们的产品的能力取决于我们在我们的设施中继续遵守cGMP法规。
我们产品的制造过程受详细的书面程序和政府法规的约束,其中规定了血液、血液制品和其他产品的cGMP要求。我们的质量运营部门监控这些程序和法规的遵守情况,以及材料、制造中间体和最终产品符合其规格的情况。不遵守既定程序或规定,或不符合规范,可能要求拒绝和销毁产品或材料。
我们对cGMP法规的遵守情况和我们质量体系的有效性通过FDA和其他国家类似监管机构对我们设施的检查进行定期评估。如果在检查中发现了缺陷,我们必须采取行动纠正这些缺陷,并向监管部门证明我们的纠正是有效的。如果注意到严重缺陷或如果我们无法防止再次发生,我们可能不得不召回产品或暂停运营,直到可以实施适当的措施。我们还被要求向FDA和其他国家的类似监管机构报告某些偏离程序的情况,即使我们确定这些偏离并不重大,这些监管机构也可能要求我们采取类似措施。由于cGMP反映了不断发展的标准,我们需要定期更新我们的制造工艺和程序以符合cGMP。这些变化可能导致我们在不提高我们的盈利能力或产品安全性的情况下产生成本。例如,可能需要更敏感的检测分析(如果可以获得),或者现有程序或过程可能需要重新验证,所有这些都可能是昂贵和耗时的,并且可能会延迟或阻止产品的制造或新产品的推出。
制造工艺的变更,包括产品制造地点的变更或第三方制造商的变更,可能需要FDA或其他监管机构根据cGMP法规对制造工艺和程序进行事先审查和批准或重新验证。
要在我们的升级设施完成后验证我们的制造流程和程序,我们必须证明升级设施的流程和程序与我们其他设施目前的流程和程序具有可比性。为了提供这样的比较分析,现有流程和我们期望在我们的升级设施中实施的流程都必须符合我们期望的升级完成时的现行监管标准。此外,包括cGMP法规在内的监管要求不断演变。未能调整我们的运营以符合适用监管机构制定和解释的新标准将产生合规风险,可能会损害我们维持正常运营的能力。
包括FDA和欧洲药品办公室(“EMA”)在内的监管机构定期检查我们的设施,以评估持续遵守cGMP的情况。如果FDA、EMA或其他监管机构发现我们的设施不合规,我们正在进行的运营或扩张计划将受到不利影响。
14
我们的血浆供应出现重大中断,包括由于宏观经济状况、大流行病或移民政策和执法的变化,可能会对我们的业务和增长计划产生重大不利影响。
我们的大部分收入依赖于我们获得美国来源的血浆(通过血浆置换术获得),这是我们血浆衍生产品的主要原材料。我们增加收入的能力在很大程度上取决于增加获得血浆的机会。如果我们无法获得足够数量的来源等离子体,我们可能无法找到具有成本效益的替代等离子体来源,我们维持等离子体衍生产品当前制造水平的能力将受到限制。因此,我们可能会经历净收入或利润率的大幅下降、客户流失、我们作为等离子衍生产品可靠供应商的声誉受到负面影响或我们的生产增长计划大幅延迟。
我们目前的业务计划设想增加血浆衍生产品的生产,这取决于我们维持和/或增加血浆收集或提高产品产量的能力。维持和/或增加血浆收集的能力可能会受到限制,我们的血浆供应可能会受到干扰,或者血浆成本可能会大幅增加,原因有很多,包括:
| ● | 捐款池减少。 |
| ● | 包括美国在内的大多数等离子衍生产品最大市场的监管机构限制在制造等离子衍生产品时使用从特定国家和地区收集的血浆。例如,上世纪90年代初爆发的变异克雅氏病,即疯牛病,导致美国暂停使用基于在英国旅行、居住或输血以及对血液制品安全性的担忧而从某些人那里收集的血浆,这导致国内外对血浆收集和检测的监管加强,并取消了特定人群在供体库中的资格,显着减少了潜在供体库。这一暂停在2022年才被解除。新病毒毒株的出现可能会进一步减少潜在的供体库。过去几年,由于行动受限等原因,新冠肺炎大流行也对我们的血浆采集量产生了不利影响。 |
| ● | 宏观经济状况的变化可能会影响捐助者的数量。例如,过去几年在美国,在新冠疫情期间向家庭发放的政府刺激计划的实施产生了双管齐下的效果,既减少了个人捐献血浆的经济激励,也阻碍了我们在血浆采集中心维持适当劳动力水平的能力。其他宏观经济因素,如未来美国通胀和利率均显著下降,可能导致个人获得更便宜债务的机会增加,从而降低他们捐赠血浆的经济动机; |
| ● | 某些移民政策和执法的变化可能会损害我们的部分血浆供应。见“—限制来自墨西哥的有效美国签证持有者越境进入美国捐献血浆的能力可能会扰乱我们的血浆供应,并对我们的财务业绩产生不利影响。” |
| ● | 监管要求。见“——我们的单采血浆中心的运营中断将导致我们变得供应受限,我们的财务业绩将受到影响。” |
| ● | 血浆供应来源。近年来,随着血浆衍生物制造商不断收购血浆采集中心,行业内出现了垂直整合。血浆供应的任何重大中断或血浆需求的增加都可能要求我们从替代来源获得血浆,而这些来源可能无法及时获得。 |
15
我们的单采血浆中心运营中断将导致我们受到供应限制,我们的财务业绩将受到影响。
为了使血浆用于我们产品的制造,收集血浆的个别中心必须获得我们销售我们产品的那些国家的监管机构的许可和批准,例如FDA和EMA。当新的单采血浆中心启用时,必须在FDA、EMA和其他适用监管机构批准后对其进行持续检查,以确保其符合cGMP和其他监管要求,这些监管要求可能会发生变化。虽然我们认为我们的中心及时遵守不断变化的要求,但不断变化的要求所必需的合规努力可能会增加我们的成本。不能令人满意的检查可能会阻止新的中心获得运营批准,或者可能会导致现有批准被暂停或撤销。
单采血浆中心要保持其政府批准运营,其运营必须继续符合cGMP和其他监管要求。如果我们确定某单采血浆中心在收集血浆方面不符合cGMP和其他监管要求,我们可能无法使用并可能最终销毁从该中心收集的血浆,这将被记录为货物成本费用。此外,如果在受影响的血浆与来自其他来源的合规血浆汇集后发现血浆采集过程中的违规行为,整个血浆池、在制品中间材料和最终产品都可能受到影响。因此,我们可能会经历重大的存货减值准备和核销。
我们计划继续通过在我们的血浆采集中心收集以及通过选择性收购或改造和搬迁现有中心来获得我们的血浆供应,以用于我们的制造过程。这一战略取决于我们是否有能力成功整合新的中心,是否有能力为任何尚未获得FDA或其他监管机构批准的中心获得FDA和其他必要的批准,是否有能力在所有中心维持符合cGMP的环境,以及是否有能力为我们的中心吸引捐助者。
我们提高和提高单采血浆中心生产效率的能力可能受到以下因素的影响:(i)我们经营单采血浆中心的选定地区的经济环境和人口变化;(ii)竞争性中心进入我们经营的地区;(iii)我们对个别地区的人口潜力判断错误,我们预计这些地区将增加产量并吸引新的捐助者;(iv)与设施相关的意外挑战;(v)选定单采血浆中心的意外管理挑战;或(vi)政府对限制捐赠人口的政策或施加法规的意外变化这使得血浆捐赠变得繁重且具有限制性。
我们净收入的很大一部分历来来自我们的免疫球蛋白产品的销售,我们预计它们将继续占我们销售额的很大一部分。与这些产品有关的任何不利市场事件都可能对我们产生重大不利影响。
我们历来有很大一部分净收入来自我们的免疫球蛋白产品,包括我们的免疫球蛋白产品。于2024年及2023年,我们的静脉注射免疫球蛋白(“IVIG”)产品分别占我们净收入的约50.8%及48.5%。如果这些IVIG产品中的任何一种失去了可观的销售额,或者在市场上被大幅或完全取代,我们将失去我们净收入的重要和实质性来源。同样,如果任一Flebogamma®,Gamunex®-C/Gamunex®,xembify®或Prolastin®如果成为诉讼对象或政府不利裁决要求我们停止销售它,我们的业务可能会受到不利影响。尽管我们目前预计这些产品的销售额不会有任何显着下降,但显着下降可能是由于血浆采购和制造问题导致可供销售的产品可用性降低和市场条件不断变化。
16
我们面临着巨大的竞争。
我们面临着巨大的竞争。武田、CSL Behring、Kedrion Biopharma、Octapharma Plasma and Bio Products Laboratory Ltd.现在各自在美国都有10%液体IVIG产品。Octapharma和Bio Products Laboratory也都有5%液体IVIG产品。GC Biopharma推出其10% IVIG产品AlygloTM,于2024年推向美国市场,Argenx于2024年获得FDA批准,用于VYVGART HYtrulo(皮下),这是一种IVIG产品,用于治疗慢性炎症性脱髓鞘多发性神经病(“CIDP”)患者。这类产品是我们一些主要产品Flebogamma的直接竞争对手®,Gamunex®-C/Gamunex®或Xembify®.随着竞争加剧,由于许多客户对价格越来越敏感,我们的一些竞争对手对免疫球蛋白产品的价格打了折扣。如果客户要求更低价格的产品,我们可能会失去销量或被迫降低价格。
在肺病学的治疗领域,特别是α-1-抗胰蛋白酶增强疗法(“AAT”),我们面临着来自其他公司的竞争,例如福泰制药、Kamada、Mereo Biopharma、TERM3、AATEC Medical和Korro Bio研究和开发新型吸入式和重组AAT疗法,以及专注于α-1的基因疗法的潜力。此外,我们预计竞争加剧将来自于赛诺菲,因为该公司最近宣布预计将从Inhibrx收购与INBRX-101(一种优化的重组AAT增强疗法)相关的所有资产和负债。在α 1-蛋白酶抑制剂缺乏症领域,CSL的Respreeza®产品正在与我们的Prolastin产品竞争。我们现在和未来的竞争对手可能会增加他们的销量、降低他们的价格、改变他们的分销模式或改进他们的产品,从而对我们的产品销售和市场份额造成损害。此外,如果我们的A1PI患者基础的流失率加速超过我们的预测,我们的患者将会减少,销量也会下降。
我们的竞争对手也可能开发其他新疗法,例如小分子、重组产品、吸入产品、基因疗法或其他新疗法,用于我们的产品目前用于的适应症。重组因子VIII和因子IX产品,目前可在美国和欧洲获得并广泛使用,在治疗A型和B型血友病方面与我们的血浆衍生产品竞争,并被许多人认为具有较低的疾病传播风险。额外的重组产品和新的小分子,有些具有延长的半衰期,与我们的产品竞争并减少了对我们产品的需求。Genetech的Hemlibra,一种用于控制A型血友病患者出血的非血浆产品,是血友病市场的另一个竞争者。使用Hemlibra是使用血浆衍生和重组因子VIII的重大竞争风险。此外,许多新的基因疗法已被批准,更多的正在开发用于治疗血友病,这可能会进一步与我们现有的血浆衍生疗法竞争。
此外,当我们正在研究使用白蛋白的其他适应症时,这些新的可能性被以下事实所抵消:在我们应用它的主要应用中,白蛋白的使用有竞争对手的替代品,作为血浆扩容器。
我们只是生产用于治疗遗传性肺气肿患者的α-1抗胰蛋白酶的众多公司之一,我们的竞争对手不断开发新产品,包括吸入式、基因疗法、重组或其他新的各种给药方法用于这种疗法。此外,其他公司正在开发新的治疗方法,例如基因疗法、吸入式和重组产品,尽管围绕这类新疗法的潜在安全性和有效性存在不确定性,但它们增加了我们的竞争水平。
推出获批用于替代给药途径的产品,包括皮下给药,也可能对我们产品的销售产生不利影响。例如,CSL Behring和Takeda推出了20%浓度的人免疫红蛋白制剂,用于治疗需要抗体替代的人群,而Takeda有一种免疫球蛋白,具有重组人透明质酸酶,适用于治疗成人原发性免疫缺陷(“PL”)。尽管我们获得了FDA对类似浓度和给药途径的批准,但随着其他参与者继续在这一不断扩大的治疗领域开展业务,竞争水平仍然显着并呈上升趋势。
其他公司正在开发不同的疗法,用于治疗目前使用我们的免疫球蛋白治疗的自身免疫性疾病和其他疾病。如果增加使用VIII因子、IX因子、白蛋白、α-1或免疫球蛋白的替代产品,使得生产我们的血浆衍生产品不经济,或者如果进一步的技术进步改善了这些产品或为我们的血浆衍生产品创造了其他有竞争力的替代品,我们的财务状况和经营业绩可能会受到重大不利影响。我们预计未来将面临来自生物仿制药产品的更大竞争,这可能会进一步对我们的财务业绩产生不利影响。
17
我们目前没有销售治疗性重组产品。我们的管道中有额外版本的A1PI,但我们不能确定这些产品中的任何一个将来会被批准或销售。此外,我们正在开发免疫球蛋白领域的其他潜在创新。然而,我们不能确定我们将成功开发这些产品用于许可的商业用途。因此,我们的产品供应可能仍然是血浆衍生的,即使我们的竞争对手提供竞争性重组产品。
我们面临着来自拥有更多金融资源的公司的竞争。
我们在竞争激烈的市场开展业务。我们的主要竞争对手包括武田、CSL Behring、Argenx和Octapharma。我们的一些竞争对手拥有比我们大得多的财政资源。因此,他们或许可以将更多的资金用于研发和新的生产技术,以及推广他们的产品和业务。这些竞争对手也可能能够在更长时间内维持故意大幅降低其产品或服务的价格。竞争对手开发同类或优势产品或增加定价竞争可能会导致我们的净收入减少或我们的利润率下降。
我们产品生产的技术变革可能需要对创新、数字化转型和新技术进行大量投资,这可能会使我们的生产过程变得不经济,并削弱我们在我们经营所在行业的竞争力。
我们的等离子衍生物、诊断和生物用品产品的生产具有技术快速变化、医疗进步、不断变化的消费者要求、较短的设备生命周期、不断变化的监管要求和不断发展的行业标准等因素的特点。近年来,技术进步加速了变革,未来的技术发展和医疗进步可能会使我们的生产过程变得不经济。我们的成功可能取决于我们增强当前技术的能力,包括通过使用人工智能工具,以及开发或获取新技术以跟上技术发展和不断发展的行业标准,同时响应客户需求的变化。这种创新努力可能需要我们投入大量资金来升级我们的设施,并以具有竞争力的价格开发我们的产品。
对新技术、流程和商业模式的额外投资使我们面临一定的风险和挑战,例如与公司战略不一致、人才资源和地域限制、财务资源限制以及适应我们无法控制的外部因素。这些风险和挑战有可能破坏实现数字化转型的全部收益,并削弱公司在我们经营所在行业内的竞争力。
我们利用人工智能,这可能会使我们承担责任或对我们的业务产生不利影响。
我们已经构建和整合,并可能在未来构建和整合与我们的业务、产品和服务相关的人工智能(“AI”)工具,包括旨在减少冷却工厂能源消耗和提高IVIG生产性能的AI。然而,利用人工智能存在重大风险,无法保证我们的使用将增强我们的产品或服务或产生预期结果。例如,人工智能算法可能存在缺陷、不足、质量差、反映不需要的偏见形式或包含其他错误或不足之处,其中任何一种都可能不容易被发现,这可能会损害对人工智能解决方案的接受,包括纳入我们产品和服务的解决方案。如果我们创建或使用的AI解决方案有缺陷、不准确或有争议,我们可能会招致运营效率低下、竞争损害、法律责任、品牌或声誉损害,或对我们的业务和财务业绩产生其他不利影响。此外,无法保证我们对人工智能的使用将成功地提高我们的运营效率或以其他方式产生我们预期的结果。
18
使用某些人工智能技术会产生知识产权风险,包括对专有知识产权的妥协和知识产权侵权。此外,我们预计将看到与人工智能使用和道德相关的政府和超国家监管不断增加,这也可能会显着增加该领域的研究、开发和合规负担和成本。例如,欧盟于2024年颁布的《人工智能法案》(“AI法案”)——世界上第一部综合性人工智能法律——对高风险人工智能系统的提供者和部署者规定了重大义务,并鼓励人工智能系统的提供者和部署者在开发和使用这些系统时考虑到道德原则。如果我们开发或使用受《AI法案》管辖的AI系统,则可能需要确保更高的数据质量、透明度和人工监督标准,以及遵守特定且可能造成负担且代价高昂的道德、问责制和行政要求。人工智能的快速发展将需要应用大量资源来设计、开发、测试和维护我们的产品和服务,以帮助确保人工智能按照适用的法律法规和以对社会负责的方式实施,并最大限度地减少任何真实或感知到的意外有害影响。我们的供应商可能会反过来将人工智能工具纳入他们自己的产品中,而这些人工智能工具的供应商可能无法满足现有或快速发展的监管或行业标准,包括隐私和数据安全方面的标准。此外,世界各地的不良行为者使用越来越复杂的方法,包括使用人工智能,从事涉及盗窃和滥用个人信息、机密信息和知识产权的非法活动。任何这些影响都可能损害我们的声誉,导致宝贵财产和信息的损失,导致我们违反适用的法律法规,并对我们的业务产生不利影响。
新病原体的发现可能会减缓我们的增长并对利润率产生不利影响。
新病原体的可能出现可能会引发对我们现有的灭活和生产方法的改变的需要,包括管理新的检测测试。这样的发展可能会导致生产延迟,直到新方法到位,以及增加的成本,可能不会轻易转嫁给我们的客户。
涉及我们的产品或我们分销的产品的产品责任索赔或产品召回和/或自愿撤回可能对我们的业务产生重大不利影响。
我们的业务使我们面临产品责任索赔的风险。我们面临与我们的候选产品在人体临床试验中的测试相关的产品责任风险的固有风险,以及当我们商业销售任何产品时的更大风险。如果我们不能成功地为我们的候选产品或产品造成伤害的索赔进行抗辩,我们可能会承担重大责任。无论案情或最终结果如何,赔偿责任索赔可能导致以下任何或所有情况:
| ● | 对我们的产品和我们可能开发的任何候选产品的需求减少; |
| ● | 损害我们的声誉; |
| ● | 临床试验参与者的退出; |
| ● | 为相关诉讼辩护的费用; |
| ● | 向试验参与者或患者提供大量金钱奖励; |
| ● | 收入损失;和 |
| ● | 无法将我们可能开发的任何产品商业化。 |
与许多等离子分馏器一样,我们一直并可能在未来涉及与我们的产品有关的产品责任或相关索赔,包括声称通过使用此类产品传播疾病的索赔。血浆是一种已知能够传播病毒和病原体的生物物质,无论已知或未知。因此,我们的血浆和血浆衍生产品,如果捐献者没有得到适当的筛查,或者如果血浆没有得到适当的收集、检测、灭活、加工、储存和运输,可能会导致严重的疾病,并可能导致患者死亡。任何通过使用我们的一种产品或我们销售的第三方产品传播的疾病都可能导致据称感染此类产品的人提出索赔。
19
我们的潜在产品责任也延伸到我们的诊断业务部门和医疗保健解决方案(如本文所定义)产品。此外,我们销售和分销第三方产品,我们销售或分销此类产品的司法管辖区的法律也可能使我们面临这些产品的产品责任索赔。此外,产品存在缺陷可能要求我们对此类产品进行召回。
产品责任索赔或产品召回和/或自愿撤回产品可能导致重大财务损失、负面声誉影响和无法留住客户。尽管我们有一个保单计划,旨在保护我们和我们的子公司免受产品责任索赔的影响,并且我们自行为部分风险投保,但针对我们的保单提出的索赔可能会超出我们的承保范围。随着销售额的增长,我们打算扩大我们的保险范围。然而,由于产品责任保险价格昂贵且可能难以获得,产品责任索赔可能会减少我们以可接受的条款获得产品责任保险的机会。反过来,我们可能无法以合理的成本维持保险范围,也可能无法获得足以满足可能产生的任何责任的保险范围。虽然我们没有经历过一次实质性责任索赔,但我们不能向您保证我们以后不会经历一次。
我们持续生产安全有效的血浆衍生产品的能力,有赖于没有传染性疾病的血浆供应。
尽管有重叠的保障措施,包括筛查供体和其他去除或灭活病毒和其他传染病致病因子的步骤,但无法完全消除通过血浆衍生产品传播疾病的风险。如果未来人类人口中出现新的传染病,监管机构和公共卫生当局可以采取预防措施,限制疾病的传播,这将削弱我们获得血浆、制造我们的产品或两者兼而有之的能力。在有确凿的医学或科学证据表明某种疾病对血浆衍生产品构成风险之前,可以采取此类预防措施。
近年来,开发了新的检测和病毒灭活方法,可以更有效地检测和灭活采集血浆中的传染性病毒。然而,无法保证此类新的检测和灭活方法将充分筛查并灭活我们产品生产中使用的血浆中的传染性因子。
等离子和等离子衍生产品易碎,对我们的等离子或等离子衍生产品的不当处理可能会对经营业绩产生不利影响。
等离子体是一种容易受到损害的原材料。几乎在从捐献者那里收集到血浆后,血浆就会在等于或低于-20 Celsius(-4华氏度)的温度下储存和运输。我们一旦制造出等离子衍生产品,一定要小心处理,保持在适当的温度下。我们未能,或供应、运输或分销我们的等离子和等离子衍生产品的第三方未能妥善照顾我们的等离子或等离子衍生产品可能要求我们销毁某些原材料或产品。如果此类故障损坏的等离子或等离子衍生产品的数量很大,则该等离子或那些等离子衍生产品的损失可能会对我们的财务状况和经营业绩产生重大不利影响。
在当今数据驱动的世界中,无效的IT治理带来了重大风险,包括数据泄露、监管不合规、运营效率低下、财务损失和创新受阻。
我们高度依赖IT流程,这可能会使无效治理成为实质性风险。无效的IT实践可能导致潜在的数据泄露,这可能通过违反合同要求、违反某些适用法律以及使我们面临财务和声誉损害的方式对我们产生影响。此外,无效的IT治理可能导致我们未能遵守该领域的某些监管要求,这可能导致法律处罚和利益相关者之间的信任丧失。最后,由于没有强大的IT治理实践,导致成本增加和生产力下降、业务流程中断以及需要补救措施,我们可能会面临某些运营效率低下的问题。有关更多详细信息,请参阅第II部分“网络安全”的第16K项。
20
我们未来的成功取决于我们留住高级管理层成员以及吸引、留住和激励合格人员的能力。
我们高度依赖执行团队和科学团队的主要成员。失去任何这些人的服务可能会阻碍我们的研究、开发、运营和商业化目标的实现。特别是,我们认为,失去我们高级管理团队的任何成员都可能对我们的业务产生重大负面影响。有关高级管理层成员的情况,详见本第一部分第6项,“董事、高级管理人员和员工—— A.董事和高级管理人员——高级管理人员。”我们没有为我们的任何高级管理层投保“关键人物”保险。
招聘和留住合格的运营、财务和会计、科学、临床以及销售和营销人员将是我们成功的关键。鉴于众多制药和生物技术公司之间对类似人员的竞争,我们可能无法以可接受的条件吸引和留住这些人员。我们还经历了来自大学和研究机构的科学和临床人员的聘用竞争。如果我们无法吸引、留住和激励合格和有经验的人员,我们可能会失去客户,盈利能力也会下降。即使我们成功地吸引和留住了这类人员,对这类员工的竞争可能会显着增加我们的薪酬成本,并对我们的财务状况和经营业绩产生不利影响。
cGMP条例还要求,我们雇用和负责产品制造的人员,包括,例如血液或血液成分的收集、加工、测试、储存或分配,在数量、教育背景、培训(包括必要的专业培训)和经验或两者的组合方面足够,并具有与其分配的职能相称的能力,透彻地了解其执行的程序或控制操作,必要的培训或经验,以及有关将相关cGMP要求应用于其个人职责的充分信息。我们未能吸引、留住和激励合格人员,可能会导致违反监管规定、影响产品质量、要求受影响产品召回或退出市场或导致暂停或终止我们的产品营销许可,或任何组合。
我们的业务需要大量的资本来运营和增长,并实现我们实现增加经营杠杆的战略,包括完成几个大型资本项目。
我们实施了几个大型资本项目,以扩大和改善我们设施的能力和结构,并改善我们在美国的单采血浆中心的结构。这些项目可能会超出预算或被推迟。我们无法确定这些项目是否会及时完成,或者我们是否会保持我们对cGMP法规的遵守,我们可能需要花费额外的金额来实现合规。此外,当这些多年项目完成时,市场状况可能与我们关于竞争对手数量、客户需求、替代疗法、报销和公共政策的假设存在显着差异,因此可能无法实现资本回报。
我们还计划继续在研发上投入大量资金,以获得FDA和其他监管部门的批准,为现有产品的新适应症,为现有产品开发新的产品交付机制,并开发创新的产品添加。我们在成功地将这些努力转化为盈利产品方面面临许多障碍,包括但不限于成功开发用于临床试验的实验产品、FDA和其他监管机构可接受的临床研究方案的设计、临床试验的成功结果、我们扩大制造工艺以生产商业数量或成功过渡技术的能力、FDA和其他监管机构对我们产品的批准以及我们成功上市批准产品或新适应症的能力。
例如,当一个新产品获得批准时,FDA或其他监管机构可能会要求进行批准后的临床试验,有时也称为IV期临床试验。如果此类试验结果不利,这可能会导致失去产品上市许可,从而导致销售损失。
我们不断进行资本支出,用于维护和加强我们的设施。未来资本支出的数量和时间取决于许多因素,包括市场条件、监管要求以及特定项目的范围和时间等。我们发展业务的能力取决于这些项目的及时完成和获得必要的监管批准。
21
我们可能无法成功地发展我们的一些国际业务。
我们目前在100多个国家进行销售。这种地域分散的资源要成功运作,需要相当大的管理和财政资源。特别是,我们必须将我们的商业文化与我们经营所在的每个国家的商业文化联系起来。此外,国际业务和在国外市场提供服务还面临额外风险,例如市场条件变化、货币汇率波动、贸易战和壁垒,包括美国或包括中国和/或欧盟国家在内的其他国家对进口商品征收关税、外汇管制、监管变化、税收制度变化(包括特朗普政府和美国国会提议修改美国税法)、外国投资限制、内乱、战争和新出现的流行病,以及全球移民政策的变化,这些变化可能会阻碍我们获得在各国工作的签证的能力。此外,如果我们有重要业务的地区或我们正在寻求扩展的地区遭遇经济衰退或货币贬值,我们在该地区的净收入和应收账款收款可能会大幅下降,或者我们可能无法在该地区成功扩展或运营。
有关一般监管和法律环境的不确定性,特别是在中国,可能会对我们的业务产生不利影响。
我们的国际业务受适用于外国投资和外资企业的当地法律法规管辖。我们的业务可能会受到这些法律法规的解释和执行以及变化的不利影响。这些法律法规往往缺乏透明度,可能难以解释,并且可能执行不一致。我们收入的很大一部分来自我们在中国的业务。中国还没有发展出涵盖我们活动各个方面的综合法律体系。中国的法律制度是以成文法规为基础的。先前的法院判决可能会被引用以供参考,但先例价值有限。自1979年以来,中国的立法法规显著增强了对各种形式的外商在华投资的保护。由于这些法律法规较新,且由于公布的裁定书数量有限且不具约束力,这些法律法规的解释和执行具有不确定性。此外,中国的法律体系部分基于可能具有追溯效力的政府政策和内部规则,在某些情况下,根本不公布。因此,我们可能不知道有任何涉嫌违反这些政策和规则的行为,直到被指控的违规行为发生之后。在中国的任何诉讼都可能旷日持久,并导致大量成本以及资源和管理层注意力的转移。
我们容易受到利率变动的影响。
我们将发行债务和银行借款作为资金来源。截至2024年12月31日,我们的高级有息债务分别为32亿美元和60亿欧元。在这些金额中,29.0%对我们的美元计价债务以浮动利率、与有担保隔夜融资利率(“SOFR”)的利差计息,对我们的欧元计价债务以与欧元银行同业拆借利率(“EURIBOR”)的利差计息。我们应付的利率的任何增加,可能受到(其中包括)我们无法满足某些财务比率的不利影响,将增加我们的利息支出并减少我们的现金流,这可能对我们的财务状况和经营业绩产生重大不利影响。见第一部分项目11,“关于市场风险的定量和定性披露——利率风险。”
我们的经营业绩和财务状况可能会受到外币汇率不利变化的影响,尤其是欧元相对于美元的价值发生重大转变。
我们很大一部分业务是以我们报告货币欧元以外的货币进行的。2024年,在我们72亿欧元的净收入中,有48亿欧元,即66.6%是以美元计价的。我们还面临其他货币的汇率波动风险,例如英镑、巴西雷亚尔、加元以及阿根廷、墨西哥和智利比索。欧元、美元和我们开展业务的其他货币之间的货币波动会导致外币折算收益或损失可能很大。
我们还面临基于美元计价债务支付的风险。截至2024年12月31日,我们有大约32亿美元的美元计价优先债务。见第一部分第5项“经营和财务回顾与展望—— B.流动性和资本资源”和第一部分第11项“关于市场风险的定量和定性披露——货币风险”。
22
如果我们的主要设施遭遇严重事故,或者不可抗力事件严重影响了我们运营和生产可销售产品的能力,我们的大部分制造能力可能会被长期关闭。
我们收入的很大一部分来自等离子体分馏或在我们的主要设施制造的产品,包括位于圣地亚哥、克莱顿、埃默里维尔、洛杉矶和帕雷茨的设施。此外,我们的等离子供应的很大一部分储存在加利福尼亚州工业城的设施中,以及我们的Clayton和Parets设施中。如果我们的任何主要设施,包括上述设施,受到事故或不可抗力事件的影响,例如地震、重大火灾、风暴或爆炸、重大设备故障或电力故障持续时间超过我们的备用发电机的能力,我们的收入将受到重大不利影响。在这种情况下,我们的制造能力可能会被长时间关闭,我们可能会经历原材料、在制品或成品库存的损失。此外,由于气候变化的影响,随着气温的上升,极端天气条件可能会变得更加严峻和频繁,而这种极端天气条件可能会加剧上述风险和不确定性。
其他不可抗力事件,例如恐怖行为、流感大流行或类似事件也可能阻碍我们经营业务的能力。此外,如果我们的Clayton、Los Angeles或Parets设施或我们的血浆储存设施进行重建,获得此类新设施的监管批准和原材料血浆的补充可能会耗费时间。在此期间,由于需要FDA和外国监管机构对此类设施和工艺进行检查和认证,我们将无法在其他工厂生产我们的所有产品。
我们的财产损失和业务中断保险可能不足以减轻任何此类事故或不可抗力事件造成的损失。我们也可能无法从失去的血浆或在制品库存中恢复价值,以及从我们无法生产的产品中获得销售机会。
如果我们遇到设备困难,或者如果我们的设备或一次性商品的供应商未能及时交付关键产品组件或供应,我们的制造能力将受到损害,我们的产品销售可能会受到影响。
我们依赖于供应和维护我们设备的数量有限的公司,并提供用于制造我们产品的色谱树脂、滤料、玻璃和塞子等供应。如果我们的设备出现故障,机器的维修或更换可能需要大量的时间和成本,这可能会扰乱我们的生产和其他运营。我们的血浆采集中心依赖第三方供应的一次性用品和第三方托管的信息技术系统。没有这些一次性用品的不间断供应和这些系统的运行,我们的单采血浆中心就无法运作。关键零部件或一次性用品的替代来源可能无法立即获得。虽然我们经历了这些系统的周期性中断,但材料中断会影响我们运营收集中心的能力。
任何新设备或供应材料的变化可能需要我们重新验证或FDA或包括EMA在内的其他监管机构的审查和批准,这可能会耗费时间并需要额外的资本和其他资源。我们可能无法在合理的时间内,或在商业上可接受的条件下,找到足够的替代供应商,如果有的话。因此,受影响产品的发货可能会受到限制或延迟。我们无法获得用于收集血浆和制造产品的关键来源供应,这可能要求我们推迟产品的发货,损害客户关系并迫使我们缩减运营。
如果我们的运输或分销渠道由于严重事故、流行病、恐怖主义行为、罢工、地震、重大火灾或风暴或任何其他不可抗力事件而变得无法进入,我们的供应、生产和分销过程可能会被打乱。
并非所有的运输或分销渠道都配备了运输血浆的设备。如果我们的任何运输或分销渠道因严重事故、大流行病、恐怖主义行为、罢工、地震、重大火灾或风暴或任何其他不可抗力事件而无法进入,我们可能会遇到血浆和其他原材料的持续供应中断、我们的生产过程延迟或我们直接向客户分销我们的产品的能力降低。
23
我们在很大程度上依赖第三方来销售、分销和交付我们的产品。
我们定期与团购组织(“GPO”)、家庭护理公司、备用输液场所、医院集团、分销商和其他机构签订分销、供应和履行合同。我们高度依赖这些协议来成功销售、分销和交付我们的产品。例如,在美国,我们主要依靠GPO和我们的分销商来销售我们的免疫球蛋白产品。如果这些方违反、终止或以其他方式未能履行这些合同,我们有效分销产品的能力可能会受到损害,我们的业务可能会受到重大不利影响。此外,由于我们无法控制的情况,例如经济普遍下滑、市场饱和或竞争加剧,我们可能无法成功地重新谈判我们的合同或获得对我们同样有利的条款。此外,我们在某些国家依赖分销商销售我们的产品。与我们的分销商支持我们的出口业务的分歧或困难可能会导致销售损失。
我们依赖第三方的服务来制造某些产品。
我们有几种不同产品的销售权和分销权,包括Tavleese®在欧洲市场。然而,对于其中许多产品,我们依赖第三方供应。如果此类第三方无法在欧洲适当和及时地制造和交付必要的产品和服务,我们的业务可能会受到重大影响。
我们可能无法将开发中的产品商业化。
在获得监管部门批准销售我们的候选产品或营销现有产品用于新的指定用途之前,我们必须自费进行广泛的临床前测试,以证明我们的候选产品在动物中的安全性,并进行临床试验,以证明我们的候选产品在人体中的安全性和有效性。临床前和临床测试费用昂贵,难以设计和实施,可能需要多年才能完成,并且不确定结果。我们的一项或多项临床试验失败可能发生在测试的任何阶段。我们可能会在临床前测试和临床试验过程中或由于这些过程而经历许多不可预见的事件,这些事件可能会延迟或阻止我们获得监管批准或将我们的候选产品商业化的能力,包括但不限于以下情况:
| ● | 监管机构或机构审查委员会(“IRB”)不得授权我们在一国境内或在预期试验地点开始临床试验或进行临床试验; |
| ● | 产品审批的监管要求可能并不明确,可能会随着时间的推移而演变,并可能因司法管辖区而有所不同; |
| ● | 我们的临床前试验或临床试验可能会产生阴性或不确定的结果,我们可能会决定,或者我们可能会被监管机构要求,进行额外的临床前试验或临床试验,或者放弃我们曾预期有希望的项目; |
| ● | 我们的临床试验所需的患者数量可能比我们预期的要多,我们的临床试验的注册可能比我们预期的要慢,或者参与者可能会以比我们预期更高的速度退出我们的临床试验,其中任何一项都将导致重大延误; |
| ● | 我们的第三方承包商可能无法遵守监管要求或及时履行其对我们的合同义务; |
| ● | 如果参与者面临不可接受的健康风险或任何参与者经历了意外的严重不良事件,我们可能会被迫暂停或终止我们的临床试验; |
| ● | 监管机构或IRB可能会出于各种原因要求我们暂停、暂停或终止临床研究,包括不遵守监管要求; |
24
| ● | 临床研究人员未被发现或隐瞒的欺诈活动,如果被发现,可能会阻止提交该研究人员编制的临床数据,导致监管部门暂停或实质性科学审查我们的一项或多项上市申请,并导致根据被确定为欺诈的数据分发的任何批准产品被召回; |
| ● | 我们的临床试验成本可能比我们预期的要高; |
| ● | 我们的候选产品或进行我们的临床试验所需的其他材料的供应或质量可能不足或不足,因为我们目前没有与第三方制造商就我们的任何候选产品的长期商业供应达成任何协议; |
| ● | FDA或其他监管机构对临床前或临床研究的审计可能会发现不遵守适用法规,这可能导致结果被取消资格并需要进行额外的研究; |
| ● | 我们的候选产品的效果可能无法达到预期的临床益处或可能导致不良副作用,或候选产品可能具有其他意想不到的特征;和 |
| ● | 我们的临床试验,或监管机构审查我们临床试验结果的能力,可能会因为未来的大流行而被推迟,其影响与新冠肺炎大流行类似。 |
如果我们被要求对我们的候选产品进行超出我们目前考虑的额外临床试验或其他测试,如果我们无法成功完成我们的临床试验或其他测试,如果这些试验或测试的结果不是阳性或仅是轻微阳性或存在安全问题,我们可能会延迟或无法为我们的候选产品获得上市批准或报销,或无法获得批准的适应症没有达到预期的宽泛或在获得上市批准后将产品从市场上移除。
如果我们在测试或批准方面遇到延误,我们的产品开发成本也会增加。我们不知道是否会有任何临床前试验或临床试验按计划开始,是否需要重组或是否会如期完成,如果有的话。重大的临床前或临床试验延迟也可能缩短专利保护期,在此期间,我们可能拥有将我们的候选产品商业化的独家权利,或者可能允许我们的竞争对手在我们这样做之前将产品推向市场,从而削弱我们将我们的产品或候选产品商业化的能力。
即使临床前试验获得成功,我们仍然可能无法将产品商业化,原因是难以获得对其工程工艺的监管批准,或者在将该工艺扩展到商业化生产方面存在问题。此外,如果生产,一种产品可能无法获得医生、患者、医疗保健支付者和医学界其他人的充分市场认可以实现盈利。我们的候选产品的市场接受程度,如果被批准用于商业销售,将取决于许多因素,其中一些因素超出我们的控制范围,包括以下因素:
| ● | 任何副作用的流行率和严重程度; |
| ● | 相对于替代疗法的疗效和潜在优势; |
| ● | 以有竞争力的价格向我们的候选产品提供销售的能力; |
| ● | 相对便利和便于管理; |
| ● | 医生开新疗法的意愿和目标患者群体尝试这类疗法的意愿; |
| ● | 营销和分销支持的力度;以及 |
| ● | 足够的第三方覆盖或报销。 |
25
因此,我们无法保证我们可能寻求开发的任何产品将永远成功商业化,并且在它们未能成功商业化的情况下,此类产品可能涉及大量费用而没有相应的收入。
有关隐私和数据安全的复杂和不断演变的美国和国际法律法规以及我们的信息技术系统面临的网络安全事件风险增加,可能会导致运营成本增加,并对我们的业务造成重大干扰。
我们的运营高度依赖于我们的信息技术系统,包括基于互联网的系统,这些系统可能容易受到故障、网络安全事件、错误入侵、数据泄露、恶意软件、勒索软件和恶意攻击的影响。此外,近年来信息安全风险普遍增加,增加了我们系统的潜在脆弱性,例如数据安全漏洞或网络攻击,无论是员工还是其他人,这可能会使敏感数据暴露给未经授权的人。此类数据安全漏洞可能导致商业秘密或其他知识产权的丢失,或可能导致我们的员工、客户、血浆捐献者和其他人的个人信息(包括敏感个人信息)被公开曝光。数据安全漏洞还可能对科学研究和临床试验的进行产生不利影响,包括提交研究结果以支持上市许可。
此外,我们的信息技术系统利用某些管理敏感数据的第三方服务机构,例如有关血浆捐献者的个人医疗信息,如果这些第三方服务机构受到数据安全漏洞的影响,我们的业务可能会受到不利影响。我们可能会继续产生大量费用,以遵守法律、法规、行业标准或合同义务规定的现有隐私和安全标准和协议。
联邦、州和外国政府继续采用新的、或修改涉及数据隐私以及数据收集、处理、存储、转移和使用的现有法律法规。这包括,例如,欧盟的法规、《通用数据保护条例》(“GDPR”)和新的《加州消费者保护法》(“CCPA”),将于2020年1月1日生效。在努力满足经修订的1996年《GDPR、CCPA、美国健康保险流通和责任法案》以及实施条例(“HIPAA”)和其他数据隐私法规的过程中,我们已经并将继续对我们的业务实践进行某些操作上的更改。美国各地和世界各地的其他政府当局正在考虑有关数据保护的类似类型的立法和监管提案。这些隐私、安全和数据保护法律法规可能会增加业务运营成本,要求改变我们的业务,要求将安全漏洞通知客户或员工,或者限制我们使用或存储个人信息。
例如,健康信息法律法规,例如HIPAA下的法规及其可能的修订,包括要求实施各种记录保存、操作、通知和其他旨在保护该信息的做法,将其使用限制在允许的目的,并在发生隐私和安全漏洞时通知受影响的个人,建立有关电子健康数据传输的标准,并为特定电子交易制定规则,例如涉及向第三方付款人提交索赔的交易。未能遵守HIPAA和类似的州法律可能会使我们面临违约索赔、巨额罚款、处罚和其他责任和费用、补救成本以及对我们声誉的损害。此外,2022年7月20日向美国众议院提出的一项美国联邦隐私法案(并由适用委员会于2022年12月30日报告),将对公司如何处理个人数据,包括识别或与个人合理关联的信息,例如我们的消费者,提出新的要求。如果这项法案成为法律,我们可能会被要求实施某些安全措施,以保护和保护个人数据免受未经授权的访问。如果任何适用的机构发布相关规定,我们可能会受到遵守这一要求的进一步要求。
例如,在美国,特别是在加利福尼亚州,CCPA通常要求公司,例如我们,就收集、使用和披露加利福尼亚州居民的某些个人信息制定额外的保护措施。加州总检察长于2020年8月14日宣布最终确定CCPA初始法规,此后提出了两套对CCPA法规的新修改,并已完成所需的公众意见征询程序,尽管它们仍有待加州总检察长的内部审查和最终确定,其时间尚不确定。除了规定由加州总检察长强制执行外,CCPA还规定了私人诉讼权。违反《中国人民代表大会》的主体可能要承担民事处罚。值得注意的是,2020年11月,加利福尼亚州颁布了《加利福尼亚州隐私权法案》(“CPRA”),自2023年1月1日起生效,该法案对CCPA进行了修订。CPRA除其他实质性措施外,还扩大了CCPA的私人诉讼权,增加了消费者对个人信息的控制,对企业施加了新的合规义务,并颁布了可能适用于我们企业的新例外情况。值得注意的是,CPRA成立了加州隐私保护机构委员会,负责执行CCPA和CPRA,并于2023年2月批准了CPRA的最终法规。美国其他州要么有,要么大概会通过类似的法律。
26
欧洲议会和欧盟理事会通过了GDPR,增加了欧洲个人的隐私权,扩大了数据控制者和数据处理者的责任范围,并对向位于欧洲的个人提供商品或服务或监测这些个人行为的公司(包括欧洲以外的公司)施加了更高的要求和潜在的惩罚。不遵守规定可能会导致高达2000万欧元(以较高者为准)的罚款,或占全球公司收入的4.0%。
我们努力实施符合GDPR、CCPA、HIPAA和其他数据保护要求的计划和控制措施可能会给我们带来额外成本,我们无法预测对要求的解释,或我们为响应新要求或对要求的解释而改变的做法,是否会对我们的业务产生重大不利影响。
网络攻击或其他隐私和数据安全事件(例如涉及我们的血浆或献血者的个人信息),并可能扰乱我们的业务,使我们面临重大损失、责任和声誉损害。
我们和我们的第三方服务提供商在我们的运营中经常处理、存储和传输大量数据,包括敏感的个人信息以及与我们的业务或第三方相关的专有或机密信息,包括我们的血浆或献血者。我们可能会受到我们与第三方服务提供商在内部和外部使用的信息技术安全系统的破坏。
网络攻击可能会渗透我们和我们的第三方服务提供商的安全控制,并导致敏感个人信息或专有或机密信息(例如关于我们的血浆或献血者的信息)被盗用或泄露,包括在我们或他们的某些产品所使用的系统上存储或传输的此类信息,从而造成系统中断,导致关闭(包括我们的生产工厂中断),或部署病毒、蠕虫病毒、勒索软件、拒绝服务攻击和其他攻击我们系统的恶意软件程序。我们和我们的第三方服务提供商处理我们的患者和受益人的个人信息,患者个人数据,遍布美国和世界其他地区。我们或我们的业务伙伴可能会遇到违反HIPAA、GDPR和或其他类似法律要求的数据泄露,例如:
| ● | 涉及不允许使用、访问或披露患者身份信息或不安全个人数据的数据泄露; |
| ● | 我们或我们的业务伙伴疏忽对其电子系统和设备实施所需的行政、技术和物理保护措施的数据泄露,或 |
| ● | 导致不允许使用、访问或披露我们的员工、受益人和/或血浆或献血者的个人身份信息的数据泄露。 |
在适当的时候,我们已经向有关当局提出了针对未知攻击者的投诉,我们联系了受到非法数据发布影响的患者以及其他相关监管部门和利益相关者。虽然这些数据泄露和攻击对我们的财务状况和经营业绩没有任何实质性影响,但未来针对我们IT系统的网络攻击可能会导致财务数据丢失或我们的运营中断,这可能对我们未来的业务、财务状况和经营业绩产生重大不利影响。乌克兰战争增加了对我们的系统和数据进行网络攻击的风险。
随着我们以数字方式存储和共享的敏感个人信息或财务数据数量增加,我们面临的这些隐私和数据泄露以及网络攻击风险也会增加(尤其是当医疗或药品记录是高价值目标时),包括未被发现的攻击、损坏、丢失或未经授权的披露或访问的风险,并且试图防范这些风险的成本也会增加。无法保证我们或我们的外部服务提供商为保护敏感个人信息和专有或机密信息以及将安全性融入我们产品的设计而实施的安全技术、流程和程序将是有效的。
27
任何未能保护我们的信息技术系统、财务数据以及我们的患者和客户的敏感信息免受攻击、损坏、丢失或未经授权的披露或访问,无论是由于我们的作为或不作为,还是由于我们的第三方业务伙伴或代表我们使用和存储此类个人信息的供应商的作为或不作为,都可能对我们的声誉和继续正常运营的能力产生重大不利影响,使我们面临强制性公开披露要求、诉讼和政府强制执行程序、重大罚款、处罚和/或补救成本,以及补偿性、特殊、惩罚性和法定损害赔偿、同意令和其他不利行动,其中任何一项都可能对我们的业务、财务状况和经营业绩产生重大不利影响。有关我们的网络安全风险管理和治理的信息,请参阅本年度报告第二部分第16K项,“网络安全”。
我们的成功在很大程度上取决于我们是否有能力在美国和其他国家获得和维持与我们的技术和产品相关或纳入其中的知识产权的保护。
我们的成功在很大程度上取决于我们是否有能力在美国和其他国家获得并维持对涵盖或纳入我们的技术和产品的知识产权的保护,特别是与我们的净化过程相关的知识产权。生物技术和制药领域的专利格局通常具有高度不确定性,涉及复杂的法律和科学问题。我们可能无法获得与我们的技术或产品相关的额外已发布专利。即使向我们或我们的许可人颁发专利,它们也可能受到质疑、缩小范围、作废、被认为无法执行或被规避,这可能会限制我们阻止竞争对手营销类似产品的能力或限制我们的产品获得专利保护的时间长度。此外,我们的大多数专利都与我们生产产品所使用的工艺有关,而不是与产品本身有关。在许多情况下,我们未来生产或开发的血浆衍生产品本身将无法获得专利。由于我们的专利与工艺有关,如果竞争对手能够设计和使用不依赖于我们受保护的知识产权的工艺,那么该竞争对手可以销售与我们开发或销售的类似的等离子体衍生产品或其他产品。
我们的专利也可能无法为我们提供针对拥有类似技术的竞争对手的保护。由于美国和许多其他司法管辖区的专利申请通常在提交后18个月才公布,如果有的话,并且由于科学文献中发现的公布往往落后于实际发现,我们和我们的许可人都不能确定我们或他们是第一个提出我们或他们已发布的专利或未决专利申请中声称的发明的人,或者我们或他们是第一个提出保护此类专利申请中所载发明的人。如果第三方也提交了涵盖我们的候选产品或类似发明的美国专利申请,我们可能会被要求参与由美国专利商标局宣布的对抗程序,称为“干扰程序”,以确定在美国的发明优先权。这些诉讼的成本可能是巨大的,我们在这些诉讼中的努力可能不会成功,从而导致我们预期的美国专利地位的损失。
我们的专利在不同的日期到期。我们的未决和未来专利申请可能不会作为专利发布,或者,如果发布,可能不会以将为我们提供任何竞争优势的形式发布。即使发布,我们也不能保证:我们现在或将来的任何专利或专利权利要求或其他知识产权不会失效或被作废、规避,质疑或放弃;我们的知识产权将提供竞争优势;我们向潜在竞争对手主张我们的知识产权或解决当前或未来争议的能力将不受我们与第三方的协议的限制;我们的任何未决或未来专利申请将被发布或具有最初寻求的覆盖范围;我们的知识产权将在竞争可能激烈或法律保护可能薄弱的司法管辖区强制执行;或者我们不会失去针对我们主张我们的知识产权的能力,或将我们的技术许可给,其他并收取特许权使用费或其他付款。此外,我们的竞争对手或其他人可能会围绕我们受保护的专利或技术进行设计。
对我国知识产权的有效保护,在一些国家可能是不可得、有限或未申请的。美国和其他国家专利法或其解释的变化也可能降低我们的知识产权价值或缩小我们的专利保护范围。此外,某些国家的法律制度不赞成激进地强制执行专利,外国的法律可能无法像美国的法律那样保护我们的权利。因此,我们的专利组合可能无法为我们提供足够的权利,以排除其他人将与我们相似或相同的产品商业化。为了维护和执行我们的专利和其他知识产权,我们可能需要向第三方提出索赔或提起诉讼。这类诉讼可能会给我们带来巨大的成本,并转移我们管理层对开发和商业化我们产品的注意力。
28
我们和制药行业的其他公司一样,可能会意识到我们的产品的假冒版本在国内外变得可用。假冒产品可能使用不同且可能受到污染的血浆和其他原材料来源,制造假冒产品所涉及的净化过程可能会引发额外的安全问题,对此我们无法控制。任何报告的涉及声称是我们产品的假冒产品的不良事件都可能损害我们的声誉,尤其是我们产品的销售,以及消费者普遍使用血浆衍生疗法的意愿。
未经授权使用我们的知识产权可能已经发生或将来可能发生。尽管我们已采取措施将这种风险降至最低,但任何未能识别未经授权的使用和以其他方式充分保护我们的知识产权的行为都会对我们的业务产生不利影响。例如,任何未经授权使用我们的商标都可能损害我们的声誉或商业利益。此外,如果我们被要求启动与未经授权使用相关的诉讼,无论是作为原告还是被告,这类诉讼将非常耗时,迫使我们承担大量成本,并转移我们的注意力以及我们的管理层和其他员工的努力,这反过来可能导致收入减少和费用增加。
除了专利技术,我们还依赖我们未获得专利的专有技术、商业秘密、工艺和专有技术。
我们通常寻求通过与我们的员工、顾问、科学顾问和第三方签订保密协议来保护专有信息。这些协议可能无法有效防止泄露机密信息,可能会对其期限进行限制,并且在未经授权泄露机密信息的情况下可能无法提供适当的补救措施。此外,否则我们的商业秘密可能会被我们的竞争对手或其他第三方知晓或独立开发。如果我们的雇员、顾问或承包商在为我们工作时使用他人拥有的知识产权,可能会就相关或由此产生的专有技术和发明的权利产生争议。为确定和执行我们的所有权范围,可能需要昂贵和耗时的诉讼,而未能获得或维持商业秘密保护可能会对我们的竞争业务地位产生不利影响。我们还依赖与客户、供应商、分销商、员工和顾问的合同保护,并实施旨在保护我们商业秘密的安全措施。我们无法向您保证,这些合同保护和安全措施不会被违反,我们将对任何此类违反行为有足够的补救措施,或者我们的供应商、雇员或顾问不会主张此类合同所产生的知识产权权利。
由于我们依赖商业秘密和保密协议,除了专利之外,还保护我们的一些知识产权,因此存在第三方可能获取和不正当利用我们的专有信息以使我们处于竞争劣势的风险。我们可能无法发现未经授权使用此类信息、阻止此类使用或采取适当和及时的措施来强制执行我们的知识产权。
我们可能会侵犯或被指控侵犯第三方的知识产权。
我们的产品或候选产品可能侵犯或被指控侵犯已发布专利的一项或多项权利要求,或可能属于随后可能发布且我们不持有许可或其他权利的已发布专利申请中的一项或多项权利要求的范围。第三方可能在美国和/或国外拥有或控制这些专利或专利申请。这些第三方可能会向我们或我们的合作者提出索赔,这将导致我们产生大量费用,如果对我们胜诉,可能会导致我们支付大量损害赔偿。此外,如果对我们或我们的合作者提起专利侵权诉讼,我们或他们可能会被迫停止或延迟作为诉讼标的的产品或候选产品的研究、开发、制造或销售。
如果我们被发现侵犯了第三方的专利权,或为了避免潜在的索赔,我们或我们的合作者可能会选择或被要求向第三方寻求许可,并被要求支付许可费或特许权使用费,或两者兼而有之。这些许可证可能无法以可接受的条件获得,或者根本无法获得。即使我们或我们的合作者能够获得许可,这些权利也可能是非排他性的,这可能导致我们的竞争对手获得相同的知识产权。最终,如果由于实际或威胁的专利侵权索赔,我们或我们的合作者无法以可接受的条款获得许可,我们可能会被阻止将产品商业化,或被迫停止我们业务运营的某些方面。
29
制药和生物技术行业存在涉及专利和其他知识产权的实质性诉讼和其他诉讼。除了针对我们的侵权索赔,我们可能会成为其他专利诉讼和其他诉讼的一方,包括美国专利商标局宣布的干扰诉讼和欧洲专利局的异议诉讼,涉及与我们产品有关的知识产权。任何专利诉讼或其他程序给我们带来的成本,即使以有利于我们的方式解决,也可能是巨大的。我们的一些竞争对手可能能够比我们更有效地承受这类诉讼或诉讼的成本,因为他们的财务资源要大得多。专利诉讼或其他程序的发起和继续产生的不确定性可能对我们在市场上的竞争能力产生重大不利影响。专利诉讼和其他诉讼程序也可能会消耗大量的管理时间。
我们的许多员工以前受雇于大学或其他生物技术或制药公司,包括我们的竞争对手或潜在竞争对手。我们采取措施确保我们的员工不会在他们的工作中为我们使用他人的专有信息或专有技术。然而,我们可能会受到声称,我们或这些雇员无意或以其他方式使用或披露了任何此类雇员的前雇主的知识产权、商业秘密或其他专有信息。诉讼可能是针对这些索赔进行辩护所必需的,即使我们成功地为自己辩护,也可能会给我们带来巨大的成本或分散我们的管理注意力。如果我们未能为任何此类索赔进行辩护,除了支付金钱损失外,我们可能会失去宝贵的知识产权或人员。
我们已在许可中获得某些专利权,并与第三方共同拥有某些专利权。
我们对我们已获得许可或与第三方共同拥有的某些知识产权的权利及其价值可能取决于我们的第三方许可人或共同所有人(如适用)根据我们与他们的知识产权协议的履行情况。如果这些第三方中的一方不能或不能强制执行其在此类知识产权方面的权利或根据我们与他们的协议履行,则可能会影响我们在市场上有效竞争和经营我们的业务的能力。
我们关于某些专利权的许可内协议可能会对我们作为被许可人施加付款和/或其他重大义务。尽管我们目前遵守了我们在这些许可下的所有重大义务,但如果我们违反任何此类义务,我们的交易对手许可人可能有权终止许可。此类终止可能会限制、延迟或消除我们开发和商业化我们的产品的能力,这可能会对我们的业务产生不利影响。我们不能保证我们许可的第三方专利和技术不会被许可给我们的竞争对手。未来,我们可能需要获得额外的许可,更新现有的许可协议或以其他方式替换现有技术。我们无法预测这些许可协议是否能够获得或续签,或者技术是否能够以可接受的条款被替换,或者根本无法预测。
我们可能无法从签订新合同或修订合同、成本节约和业务改进举措中实现预期收益。
近期我们通过收购Haema Plasma KFT,从ImmunoTek GH,LLC(2024年和2025年)收购了血浆采集中心。(2024年)、加拿大Plasma Resources Corporation(2023年)、Biotest AG(2022年)、BPL Plasma Inc.和Kedplasma,LLC(2021年)、韩国公司GC Pharma(Group)(“GC Pharma”)(2020年)和州际血库集团(2019年)。无法保证我们将通过这种血浆收购策略获得成功,或者我们将实现我们期望从这些新中心获得的所有好处。此外,我们还实施了一项成本节约计划,以减少员工人数,在血浆采购过程中提高效率,并关闭某些表现不佳的血浆中心,以及其他战略。见第一部分“A.经营成果——影响我们财务状况和经营成果的因素——经营改善计划”项目5。我们的成本节约和业务改进举措可能会导致意外的费用和开支,从而对我们的财务业绩产生负面影响,我们可能无法实现预期的效率和估计的成本节约。此外,如果我们无法有效实施这些举措,或者它们未能按预期运作,我们的财务业绩可能会受到不利影响。此外,这些类型的举措可能会产生意想不到的后果,例如分散管理层和员工的注意力、业务中断、无法吸引或留住关键人员,这可能会对我们的业务或财务状况以及经营业绩产生负面影响。如果我们不能有效地制定、实施和管理我们的成本节约或业务改进举措(包括我们的收购),我们可能会遇到运营困难和成本增加,这可能会对我们的经营业绩产生不利影响。
30
气候变化和重大自然灾害风险增加可能会对我们的业务产生不利影响。
气候变化已经在一些地区造成极端高温和糟糕的空气质量,这有可能加剧呼吸系统疾病等先前存在的健康状况。此外,温度和湿度的增加可能会导致携带病媒传播疾病的昆虫激增,包括登革热和疟疾。最终,在抗菌素耐药性也在上升之际,气候变化可能会破坏数十年来在改善人类健康方面取得的进展。
我们面临着气候风险,例如物理风险(例如,高温、缺水、海平面上升、恶劣天气事件造成的洪水)和过渡风险(例如,监管框架、碳定价、资本成本和获得资本的机会),这些风险的程度和影响可能因国家而异。例如,我们的一些生产设施依赖于大量水供应的可用性,这些设施位于水日益稀缺的地区。其他设施位于一些地方,因为天气事件越来越剧烈,海平面上升,或两者兼而有之,越来越有可能发生严重的洪水。在存在这种风险的地区,它不仅影响我们自己的运营,也影响我们的分销供应链。这类事件可能会导致成本增加、业务中断、设施被毁、生命损失,以及患者用来获取我们药物的医疗保健系统中断。
气候变化引发了全球各地采用新的监管要求。例如,加州最近的立法扩大了对公司报告温室气体排放的要求,这可能间接导致对技术投资的要求增加,以减少能源使用、用水和温室气体排放,超出我们对现有计划的预期投资。本第一部分第4项,“关于公司的信息—— B.业务概览——气候变化。”此外,立法可能包括碳定价、气候风险披露授权,以及改变分区或建筑规范以提高气候适应能力。这些转型风险的综合影响可能会增加我们的直接运营成本,并在我们的整个供应链中产生同样的影响。
不同司法管辖区的生物特征信息隐私法的变更、颁布和/或执行,包括美国的联邦和州法律,可能会使我们面临潜在的责任。
世界各地的监管当局和政府已经实施并正在考虑有关生物特征信息隐私的进一步立法和监管提案。对生物特征信息隐私和数据保护提出更严格要求的新法律法规可能会在包括美国、欧盟和英国在内的多个司法管辖区出台。遵守越来越多司法管辖区的法律法规可能需要大量资源和成本,包括与改造我们的设施、产品或流程相关的资源和成本。
在美国,有关生物特征数据隐私和数据保护的法律法规多种多样,美国的某些州法律在个人信息方面可能比联邦、国际或其他州法律更严格或范围更广,或提供更大的个人权利,这类法律可能彼此不同,所有这些都可能使合规工作复杂化。包括美国联邦贸易委员会(“FTC”)在内的美国联邦和州监管机构已开展了以生物识别信息为重点的执法行动。例如,伊利诺伊州的《生物特征信息隐私法》(“BIPA”)、德克萨斯州的《生物特征识别符捕获或使用法案》(“CUBI”)以及华盛顿州的《我的健康我的数据法案》(“MHMD”)限制了生物特征识别符和生物特征信息的收集和使用。根据BIPA的私人诉讼权提起了几起集体诉讼,BIPA通常得到法院的广泛解读。我们被点名参与了一项集体诉讼,并已达成和解,该诉讼声称我们在收集血浆捐献者的指纹数据时未能遵守BIPA的要求。见第一部分第8项,“A.合并报表和其他财务信息——法律诉讼——伊利诺伊州生物识别信息隐私法索赔。”
根据适用的隐私和数据保护法律,我们可能受到的任何未来类似法律诉讼和任何政府执法行动,除了法律费用外,可能会给我们造成重大损失,这可能会对我们的业务、经营业绩和财务状况产生不利影响。此外,我们未能遵守上述和其他监管要求或与生物特征信息隐私和数据保护相关的法律、规则和条例,或被认为未能遵守,可能会导致政府实体、消费者或其他方对我们的声誉损害或诉讼或行动。此类诉讼或行动可能会使我们受到重大处罚和负面宣传,要求我们改变我们的数据和其他业务做法,增加我们的成本并严重扰乱我们的业务或阻碍我们的全球扩张。
31
与医疗保健行业相关的风险
美国医疗改革可能会对我们的业务产生不利影响。
美国分别于2010年3月颁布并经修订的《患者保护和平价医疗法案》以及《伴随的医疗保健和教育和解法案》(统称为“ACA”)加强了联邦对私人医疗保险计划的监督,并纳入了一些条款,旨在降低医疗保险支出和总体医疗保健成本,减少欺诈和滥用行为,并提供获得更多医疗保险的机会。虽然ACA大幅扩大了美国拥有健康保险的个人数量,但它仍面临持续的法律挑战,包括寻求使部分或全部法律或其被解释的方式无效的联邦诉讼,并可能对美国医疗保健行业产生重大影响。
由于联邦立法和行政努力废除、实质性更改、替换或使部分或全部ACA无效,这些努力也存在不确定性。未来任何实质性改变医疗保健行业的立法、指导、规则或条例和/或行政命令都可能对我们的运营产生重大影响。ACA的不确定状态影响了我们的计划能力,如果不进行充分更换,将其废除可能会对我们的美国业务产生重大不利影响。
政府对报销的压力和限制可能会对我们的业务产生不利影响。
我们在世界各地的多个司法管辖区从事与医药产品有关的各种制造、加工、营销和销售活动。这些活动使我们受到几项政府法规的约束,这些法规要求对我们经营所在的各个国家的定价和一般业务进行多种类型的控制。许多国家的整体医疗保健费用占国内生产总值的百分比增长,意味着政府和支付方承受着更严格控制支出的巨大压力。
在美国,这是我们的主要市场,近年来医疗保健行业的趋势已经引起了重大变化,包括转向管理式或基于价值的护理、集体购买协议、合并以办公室为基础的医疗保健提供者,以及其他节省成本、减少收入和减少支付的措施,例如,涵盖我们产品的几个政府医疗保健计划,包括医疗补助、医疗保险B和D部分以及340B计划。这些趋势可能会对我们的财务业绩产生重大不利影响。全球对医疗保健成本控制的重视对我们产品的定价以及我们获得和维持报销率以覆盖我们产品的能力产生了重大压力,这可能会对我们的业务产生不利影响。
此外,联邦资金用于支付我们在Medicaid和Medicare下的产品的可用性要求我们根据340B计划延长折扣,对该计划的更改可能会对我们的财务业绩产生不利影响。340B计划将折扣扩大到各种符合条件的实体,包括社区卫生诊所和接受某些政府医疗补助的某些其他实体,以及为某些低收入个人提供不成比例份额服务的医院,以及某些癌症中心、儿童医院、重症接诊医院和农村转诊中心。340B计划价格,或上限价格,不能超过平均制造商价格(“AMP”)(根据Medicaid药品回扣计划向美国医疗保险和医疗补助服务中心(“CMS”)报告)减去Medicaid单位回扣金额。我们已与政府订立药品定价协议(“PPA”),我们已同意通过向符合条件的实体收取不超过拟用于门诊的药品的最高价格的费用,参与340B计划。有关该计划的不断变化的要求继续由负责监督340B计划的联邦机构美国卫生与公众服务部(“HHS”)的卫生资源和服务管理局(“HRSA”)发布,这造成了不确定性,并且340B计划的某些方面,例如与制造商对在合同药房地点开具的处方的340B定价限制有关的问题,继续在联邦法院受到质疑,这增加了这种不确定性。我们认为,我们符合340B计划的要求,并正在继续审查和监测影响340B计划的这些和其他发展。
某些监管和立法机构以及美国国会的持续努力集中在定价和报销上,我们预计医疗保健行业将在2025年及以后继续受到越来越大的定价和成本控制压力。这些定价和成本控制压力可能会影响我们产品的报销率,并对我们的业务产生不利影响。详见第一部分第4项,“E.监管事项——药品定价与报销。”
32
政府法规对产品开发和监管批准的影响可能会对我们的业务产生不利影响。
我们在世界各地的多个司法管辖区开发和制造医药产品。这些活动使我们受到若干政府法规的约束,这些法规要求我们在我们经营所在的各个国家开发我们的产品所必需的特定政府批准。我们的产品获得市场批准是一个漫长、昂贵和复杂的监管过程,需要密集的临床前和临床数据,批准过程可能因每个司法管辖区的监管机构而有很大差异。相关卫生当局可能会在提交上市许可申请时,或更晚在其审查期间,施加可能随时间演变的要求,包括要求额外的临床试验,这些当局可能会延迟或拒绝批准。此外,相关卫生当局的政府监管监督对我们业务的核心作用使我们面临行政和执法变更或延误的风险,包括可能来自卫生当局的人员配置水平或资源。例如,新产品的开发和监管批准可能会因近期FDA预算和人员配置的削减而延迟,这可能会导致响应时间变慢和审查周期变长。
即使我们已在一个或多个主要市场获得产品的上市批准,我们可能需要投入大量时间和资源在其他市场申请批准,并且无法保证我们将能够获得此类批准。近年来,卫生当局越来越关注产品安全和医药产品的风险/收益情况,这可能导致更繁重和成本更高的审批过程,并对我们获得在研产品监管批准的能力产生负面影响。例如,FDA和EMA一直在实施严格的批准要求,特别是在证明产品功效和安全性所需的数据量方面。
在我们的主要市场美国,对于被发现与先前根据生物制品许可申请(“BLA”)获得许可的生物“参考产品”具有“生物仿制药”或“可互换”的生物制品,有一种简化的监管批准途径。这种简化的批准途径旨在通过在某种程度上依赖参考产品赞助商产生的数据,以及FDA先前对参考产品的审查和批准,允许生物类似药产品更快、更便宜地上市。
该法律规定,在参比产品首次获得FDA许可之日起四年后,不得接受任何生物类似药申请进行FDA审查,并且FDA不得在参比产品首次获得许可后12年内对申请的批准生效。该法律还包括创新者生物和生物类似药制造商就专利侵权、有效性和可执行性提起诉讼的广泛过程,这可能会增加保护我们的参考产品的成本。一旦获得批准,生物仿制药可能会与之前批准的参比产品竞争,在某些情况下,根据适用法律可能会被视为“可以与之互换”。生物类似药产品一旦获得批准,将在多大程度上以类似于传统仿制药替代非生物产品的方式替代我们的任何产品,目前尚不清楚,并将取决于仍在发展的一些市场和监管因素。结合FDA确保开发安全有效的生物仿制药的权力,2022年9月,FDA 2022年生物仿制药用户费用修正案签署成为法律。2022年FDA生物仿制药用户费用修正案重新授权将2012年《生物仿制药用户费用法案》延长五年(至2027年),该法案允许FDA评估和收取生物仿制药费用。虽然向生物仿制药项目赞助商收取的费率旨在加快生物仿制药申请的审查进程,但未知这些费用未来将如何转嫁,这也可能影响我们的财务业绩。我们预计未来将面临来自生物仿制药产品的更大竞争,包括专利挑战可能增加,所有这些都可能对我们的财务业绩产生不利影响。
关于获得我们产品的机会,ACA为一个以患者为中心的结果研究所建立并提供了大量资金,以协调和资助比较有效性研究,因为这些术语在ACA中有定义。虽然比较有效性研究的既定意图是开发信息以指导提供者获得最有效的疗法,但比较有效性研究的结果可能会影响被确定为成本效益低于其他疗法的疗法的报销或覆盖范围。如果我们的任何产品被确定为低于替代疗法的成本效益,这些产品的报销水平,或根本不愿报销的意愿,可能会受到影响,这可能会对我们的财务业绩产生重大影响。关于FDA确保开发安全有效的生物仿制药的权力,2022年9月,FDA 2022年《用户费用重新授权法案》签署成为法律,该法案允许FDA评估和收取生物仿制药的费用,为期五年,直至2027年。虽然向生物仿制药项目赞助商收取的费率旨在加快生物仿制药申请的审查过程,但此类费用可能会转嫁给制造商,因此也可能影响我们的财务业绩。
33
未能遵守有关我们产品销售和营销的法律法规或诉讼中的不利决定可能会对我们造成不利后果。
我们在世界各地的多个司法管辖区从事与医药产品有关的各种营销、促销和教育活动,并销售医药产品。医药产品和医疗器械的推广、营销和销售受到高度监管,我们等市场参与者的销售和营销行为受到世界各地政府当局越来越多的监管,我们相信这一趋势将持续下去。
例如,美国规范我们行为的法律可以通过刑事、民事和行政处罚来执行。违反《联邦食品、药品和化妆品法》(“FDCA”)、《联邦虚假申报法》(“FCA”)、《公共卫生服务法》(“PHS法”)等法律或被称为“反回扣法规”和“民事货币处罚法”的美国社会保障法条款或根据其授权颁布的任何法规,可能会导致监禁判决、罚款或被排除在联邦和州计划之外,这可能由医疗保险、医疗补助计划、国防部、其他监管机构和法院裁定。无法保证我们的活动不会受到监管机构和其他政府当局的审查,也无法保证我们的做法不会被发现违反适用的法律、规则和条例,或根据联邦或州虚假索赔法由私人公民“关系人”迅速提起诉讼。有关欺诈和滥用法律的描述,请参看第一部分第4项,“关于公司的信息—— E.监管事项——政府监管——美国政府监管——反欺诈和滥用监管。”
不遵守欺诈和滥用法律法规还可能导致其他重大民事和刑事处罚和成本,包括失去执照以及无法参与联邦和州医疗保健计划,并可能对我们的业务产生重大不利影响。此外,检察、监管或司法当局可能会以可能要求我们改变运营或产生大量辩护和和解费用的方式解释或适用这些措施。欺诈和滥用法律法规在过去几年中受到了更高的执法活动。自从ACA大幅加强了FCA的条款、Medicare和Medicaid的反回扣条款以及其他医疗保健反欺诈条款的规定以来,也出现了更多由“相关”举报人提起的qui tam诉讼,他们可能会获得高达政府赔偿总额的30%。即使是监管机构或私人关系者提出的不成功的挑战,也可能导致声誉受损并产生巨额成本。此外,这些法律中有许多是模糊的或无限期的,没有得到法院的解释,并受到检察和监管部门的频繁修改和不同的解释,增加了不遵守的风险。大多数州都采用了类似的州虚假索赔法,这些州法律都有自己的处罚措施,可能是在对FCA处罚之外,还有其他欺诈和滥用法律。虽然我们认为我们基本上遵守了适用的欺诈和滥用法律法规,并制定了充分的合规计划和控制措施以确保实质性合规,但我们无法预测适用法律或法律解释的变化,或我们的服务或营销实践因应适用法律或法律解释的变化而发生的变化,是否会对我们的业务产生重大不利影响。
未能满足FDCA规定的要求也可能导致处罚,以及要求订立同意法令或命令,规定允许的公司行为。在这方面,我们的洛杉矶设施以前是根据1998年2月根据FDA和美国司法部(“DOJ”)的行动签订的同意法令进行管理的,该法令涉及该设施的前所有者Alpha Therapeutic Corporation(“Alpha”)犯下的违反FDCA的行为。同意令规定由FDA对植物进行年度检查。2012年3月15日,美国加州中区地方法院下达命令,撤销对洛杉矶设施的同意令。
未能遵守《小灵通法案》下的340B计划的要求也可能导致不良后果,该法案将折扣扩大到根据《小灵通法案》获得健康服务赠款的各种社区健康诊所和其他实体(“340B计划”)。2016年初,HRSA敲定了一项关于340B计划定价方法的法规,规定。HRSA法规规定了何时可能对340B计划覆盖实体的“知情和故意”制造商多收费进行民事罚款,并规定多收费的制造商可能会受到重大的罚款。此类调查结果还可能导致负面宣传,可能会损害制造商的声誉,或导致业务中断、处罚或CMP。根据HRSA规定,对于每一次向涵盖实体多收费用的情况,CMP可能会被处以最高5000美元的罚款。如果我们最终被要求改变我们在340B计划下药品分销方面的销售或定价做法,或者如果我们被要求根据适用法规支付罚款,将对我们的收入和盈利能力产生不利影响。
34
此外,美国、加拿大和欧盟的企业一般被限制推广未经主管监管部门专门批准的其他适应症的获批产品,企业也不得推广未经批准的产品。不当推广未经批准的药物或器械或药物或器械的未经批准的适应症可能会使我们受到监管机构的警告或执法行动,损害对我们产品的需求,并使我们受到民事和刑事制裁。此外,还根据FCA对被指控推广药品标签外使用的公司实施了制裁,因为这种推广会诱导医疗保险和其他联邦计划下的使用和随后的报销要求。行业数据表明,IVIG量的很大一部分可能被用于填补未经FDA或类似监管机构批准的适应症的医生处方。违反或指控违反上述限制可能会对我们的业务产生重大不利影响。
我们被要求向CMS报告详细的定价信息,扣除包含的折扣、回扣和其他优惠,以计算国家报销水平、某些联邦价格以及某些联邦和州的回扣义务。我们建立了收集和向CMS准确报告这些数据的系统,并制定了合规计划,旨在确保收集的信息在所有方面都是完整的。如果我们向联邦政府报告的定价信息不准确,我们可能会受到可能对我们的业务产生不利影响的罚款和其他制裁(包括潜在的FCA责任)。
要在美国境外营销和销售我们的产品,我们必须获得并保持监管批准,并遵守这些司法管辖区的监管要求。各国的批准程序在复杂性和时间上各不相同。我们可能无法及时获得美国以外监管机构的批准(如果有的话),这将阻止我们在这些市场上将产品商业化。此外,一些国家,特别是欧盟国家,对处方药定价进行了规范。在这些国家,在收到产品的上市批准后,与政府当局进行定价讨论可能需要相当长的时间。为了在一些国家获得报销或定价批准,我们可能需要进行一项临床试验,将我们的候选产品的成本效益与其他可用疗法进行比较。这样的试验可能会耗费时间和费用,并且可能不会显示我们的产品在功效方面的优势。如果我们的产品无法获得报销或范围或金额受到限制,或者如果定价定在不令人满意的水平,在美国或欧盟,我们可能会受到不利影响。
在美国,根据联邦医师支付阳光法案或开放支付计划(“PPS法案”),我们被要求报告和披露支付给某些医疗保健提供者的款项或其他价值转移,包括医生、某些高级实践提供者,如医师助理和执业护士,以及教学医院。CMS在一个公开的网站上发布来自这些报告的信息,包括转移的金额和医疗保健提供者的身份。根据PPS法案,我们被要求收集和报告有关我们与涵盖的医疗保健提供者的某些财务关系的详细信息。PPS法案优先于类似的州报告法律,尽管我们或我们的子公司也可能被要求根据某些州透明度法律进行报告,这些法律涉及PPS法案未涵盖的情况,其中一些州法律也是模棱两可的。我们还受到外国法规的约束,这些法规要求供应商与其客户之间的某些互动具有透明度。虽然我们相信我们有基本合规的计划和控制措施来遵守这些报告要求,但我们无法向您保证,法规不会要求我们采取额外的合规步骤。我们遵守这些规则给我们带来了额外的成本。
我们还受制于与我们在美国境外开展海外业务有关的某些法律法规,包括美国《反海外腐败法》(“FCPA”)和其他反贿赂法律及相关法律,以及与我们内部账簿和记录的准确性有关的法律,这些都是近年来不断增加的执法活动的重点。根据《反海外腐败法》,美国越来越注重监管美国企业在美国境外发生的行为,一般禁止为获得或保留业务而向外国官员支付报酬。此外,在一些国家,我们可能依赖第三方来营销和分销我们的产品,而这些方可能缺乏足够的内部合规资源,并可能在涉及实质性腐败的外国市场开展业务。如果我们监测这些方的努力未能发现潜在的不当行为,我们可能会对这些第三方不遵守适用法律法规的行为负责,这可能会对我们的业务产生重大不利影响。
35
如果其他政府或私人第三方付款人降低或以其他方式限制我们产品购买者的报销金额、价格、范围或其他资格要求,我们可能会受到不利影响。
我们的某些产品受到各种成本控制措施的约束,例如政府强制实施的全行业降价、强制性定价制度、参考定价制度、支付方根据成本效益分析限制获得治疗、从成本较低国家向成本较高国家进口药品的增加、通过提高共付额将支付负担转移给患者、限制医生在竞争药品中进行选择的能力、强制用仿制药替代专利等效药,以及医生减少专利处方药处方的压力越来越大。这些压力可能对我们的业务、财务状况或经营业绩以及我们的声誉产生重大不利影响。
例如,某些医药产品,例如血浆衍生产品,在我们的几个主要市场受到价格管制,包括西班牙和欧盟国家。在美国,我们产品的定价水平是由政府付款人确定并与私人第三方付款人协商确定的,如果产品的可报销金额减少,可能会导致配药该产品的团体或个人停止给药该产品、给予较低剂量、替代成本较低的产品或寻求额外的价格相关优惠。这些行动可能会对我们的财务业绩产生负面影响,特别是在我们的产品在市场上获得溢价或报销变化导致治疗地点发生变化的情况下。对我们产品的直接和间接价格控制和压力的存在已经影响并可能继续对我们维持或提高毛利率的能力产生重大不利影响。此外,在我们开展业务的某些国家,整体医疗保健成本的增长和某些疲软的经济和金融环境,以及对药品定价做法的更多审查,例如在美国,都增强了这些定价压力。
在美国,对定价的担忧导致了更严格的审查,以及政府正在努力提高医疗保健和药品成本的透明度。例如,2020年11月12日,CMS发布了对医院和团体健康计划施加价格透明度要求的最终规则,该规则从2022年到2024年分三个阶段生效。截至1月1日,2024年付款人必须披露网络内供应商协商费率(包括与设备供应商和制造商的费率)、所有涵盖项目和服务的历史网络外允许金额,包括所有处方药。各国也在颁布各种透明度措施。公布我们的协商费率可能会影响我们独立谈判销售合同和费率协议的能力。此外,围绕正在进行的价格透明度提案的不确定性影响了我们的规划能力,因为这些提案如果全部或部分获得通过,可能会对我们的业务产生不利影响。
美国越来越多的州也提出或通过立法,寻求直接或间接监管药品定价,例如要求药品制造商提供某些价格上涨的提前通知,或对州机构购买的药品设置最高价格上限。规范药品定价的州法律可能会导致我们对受影响的产品承受额外的定价压力,并可能对我们的业务产生不利影响。
此外,医生对药品的预期用途可能会影响定价。医生经常为产品标签中未描述的、与临床研究中测试的不同的用途以及获得FDA或其他国家类似监管机构批准的用途开出合法可用的疗法。这些标签外用途在医学专业中很常见,医生可能认为,这种标签外用途构成了许多患者在不同情况下的首选治疗或最后手段的治疗。在美国,许多药品的标签外用途可能由医疗保险和其他第三方付款人报销,通常基于付款人确定预期用途是用于医学上接受的适应症,例如,基于发表在同行评审医学期刊上的研究或药物汇编中包含的信息,例如美国药典-国家处方集。然而,如果医疗保险或其他第三方支付方(包括美国或欧盟的支付方)减少或取消对包括IVG在内的产品标签外用途的报销,我们可能会受到不利影响。
拟议中的联邦和州立法针对药品定价,包括与制造商就价格、报销和折扣进行直接谈判。血浆蛋白疗法已被排除在几项立法的某些方面之外;然而,我们的产品可能会受到新的定价限制的持续风险。
36
我们受到广泛的政府监管合规和道德监督。
我们的业务受到政府的广泛监管,并受到我们经营所在的许多国家的监督。我们制定了反腐败、隐私、医疗保健和企业合规政策和程序,这些政策和程序管理我们以及我们的分销商和供应商的业务实践。这些政策和程序是通过对我们的员工、分销商和供应商的教育、培训和监测来实施的。此外,为了加强对适用的医疗保健法的遵守并减轻发生不遵守情况时的潜在责任,监管机构,如美国HHS的监察长办公室(“OIG”),已建议采用和实施一项全面的医疗保健合规计划,该计划通常包含美国量刑委员会指南手册第8B2.1节中描述的有效合规和道德操守计划的要素。越来越多的美国制药公司有这样的项目,我们采用了美国的医疗保健合规和道德项目,这些项目通常包含OIG的建议。然而,我们采取和执行这些不同的政策和程序并不能确保我们将避免调查或适用的政府机构施加处罚。
未能遵守不断变化的监管要求可能会对我们的业务产生重大不利影响。
我们在世界各地的多个司法管辖区从事与医药产品有关的各种制造、加工、营销和销售活动。这些活动使我们受到管理我们全球业务的几项政府法规的约束。管理我们业务和运营的许多司法管辖区的法律和法规受到影响我们遵守能力的不同和不断变化的解释,以及未来的变化、增加和执行方法,包括考虑到政治变化。有关适用法律和法规的变更可能要求我们更新或修改我们的运营、服务、营销实践以及合规计划和控制,并可能给我们带来额外和不可预见的成本,对我们构成新的或以前不重要的风险,或可能对我们的业务产生重大不利影响。无法保证当前和未来的政府法规不会对我们的业务产生不利影响,我们也无法预测新的监管优先事项、监管行动的形式、内容或时间,以及它们对医疗保健行业以及我们的业务和运营的影响。
我们受到广泛的环境、健康和安全法律法规的约束。
我们的业务涉及危险物质、废物及各种生物化合物和化学品的受控使用和产生、处理、管理、储存、处理和处置。这些材料造成污染或伤害的风险无法消除。如果发生任何受管制化学品、物质或废物的事故、泄漏或释放,我们可能会对由此造成的损害承担责任,包括对污染的调查、补救和监测,包括自然资源损害,其成本可能是巨大的。作为不动产的所有者和经营者,我们也可能对由于先前的场地使用或活动而导致的有害物质的存在承担责任,而不考虑导致或促成此类有害物质在我们的财产上、在我们的财产上、在我们的财产下或从我们的财产上存在或释放的原始行为的过错或合法性。我们还受众多环境、健康和工作场所安全法律法规的约束,包括有关实验室程序、接触血液传播病原体以及处理生物危险材料、化学品和废物的法律法规。
虽然我们维持工人赔偿保险,以涵盖因使用和处理这些材料、化学品和废物而导致我们的员工受伤而可能产生的成本和费用,但该保险可能无法提供足够的潜在责任保障。
未来可能会采用影响我们运营的额外或更严格的联邦、州、地方或外国法律法规。我们可能会产生大量资本成本和运营费用,以遵守任何这些法律或法规以及根据这些法律和法规所要求的任何许可的条款和条件,包括在我们各自的设施中安装新的或更新的污染控制设备、修改我们的运营或执行其他纠正措施的成本。此外,对不遵守环境和健康安全法律法规或不具备或不遵守所需环境许可条款和条件的,可处以罚款和处罚。
37
与我们的股票和美国存托股票相关的风险
如果我们发现我们对财务报告的内部控制存在重大缺陷或重大缺陷,可能会对我们提供及时可靠的财务信息和履行美国联邦证券法规定的报告义务的能力产生不利影响,这也可能影响我们美国存托股票的市场价格或我们继续在纳斯达克上市的能力。
有效的内部和披露控制对于我们提供可靠的财务报告和有效防止欺诈以及作为一家上市公司成功运营是必要的。如果我们不能提供可靠的财务报告或防止欺诈,我们的声誉和经营业绩将受到损害。“重大缺陷”是财务报告内部控制方面的缺陷或缺陷组合,其严重程度低于实质性缺陷,但其重要性足以值得负责监督我们财务报告的人员关注。此外,“重大缺陷”是财务报告内部控制的缺陷,或缺陷的组合,从而存在无法及时预防或发现公司年度或中期财务报表重大错报的合理可能性。
如果我们对财务报告的内部控制存在任何重大缺陷或重大缺陷,则此类重大缺陷或重大缺陷可能会对我们提供开展业务和履行美国联邦证券法规定的报告义务所需的及时可靠的财务信息的能力产生不利影响,这可能会影响我们继续在纳斯达克上市的能力。内部和披露控制不力可能导致投资者对我们报告的财务信息失去信心,这可能对我们的美国存托股票或ADS的交易价格或我们的债务评级产生负面影响。
见第2部分“控制和程序”项目15,涉及由于与编制合并财务报表时需要作出重大判断的复杂交易的会计核算相关的资源补充不足导致的重大弱点。
Grifols家族可能对我们的业务进行施加重大影响。
公司创始人及其亲属(“Grifols家族”)和Scranton Enterprises B.V.直接和间接拥有我们约36%的A类股份。A类股行使我公司100%的表决权控制权。因此,Grifols Family和Scranton Enterprises B.V.可能对需要股东批准的事项施加重大影响,其中包括选举我们的董事会,或董事会、股息政策和某些基本公司行动,例如发行债券、合并或解散。主要股东的利益与其他股东的利益可能发生冲突,主要股东可以选择与其他股东利益不一致的方式解决冲突。见本第一部分第7项,“主要股东与关联交易——关联交易”。
38
我们在纳斯达克的B类ADS的市场价格,以及我们在场外市场交易的A类ADS的市场价格,可能会波动。
我们的B类ADS和A类ADS的市场价格可能会受到各种因素的影响而波动,其中许多因素是我们无法控制的。这些因素包括但不限于以下方面:
| ● | 市场对我们财务表现的预期; |
| ● | 我们的经营业绩和财务状况的实际或预期波动; |
| ● | 证券分析师对我司经营业绩预估的变动; |
| ● | 卖空者或其他市场破坏者用来压低我们股票市场价格的技巧; |
| ● | 传播与我们的业务运营、财务或公司披露有关的虚假或恶意歪曲信息; |
| ● | 任何股东在市场上潜在或实际出售我们的B类ADS区块或卖空我们的B类ADS。任何此类交易都可能在任何时间或不时发生,无论是否通知我们(见“——卖空者采用的技术可能会压低我们股票的市场价格,对我们的业务运营产生负面影响和/或产生非立功诉讼”); |
| ● | 新竞争者或新产品在我们经营所在市场的进入; |
| ● | 市场整体波动;以及 |
| ● | 本节提到的风险因素。 |
无论运营和财务状况如何,我们的B类ADS的市场价格都可能受到上述任何因素或其他因素的不利影响。自2022年12月31日以来,我们的B类ADS在2024年10月1日的交易价格最高为11.56美元/ADS,在2024年3月13日的交易价格最低为5.47美元/ADS。2025年4月10日收盘时,我们的B类ADS交易价格为6.52美元。
卖空者或其他市场颠覆者采用的技术可能会压低我们股票的市场价格,对我们的业务运营产生负面影响和/或产生非立功诉讼。
卖空是卖出卖方并不拥有但已向第三方借入的证券,意图在晚些时候买回相同的证券以归还出借人的做法。卖空者寻求从出售所借证券和购买替换证券之间的证券价值下降中获利,因为卖空者希望在购买中支付的金额低于他们在出售中获得的金额。由于证券价格下跌符合卖空者的利益,某些卖空者发布或安排发布关于相关发行人及其业务前景的负面研究报告和指控,以便在卖空证券后制造负面的市场势头并为自己创造利润。这些空头攻击在过去曾对相关证券的价格造成下行压力。
39
我们一直是卖空者负面宣传的对象。有关更多信息,请参见“第5项。经营和财务回顾与前景—— A.经营业绩——影响我们财务状况和经营业绩的因素——卖空者报告。”目前尚不清楚这种负面宣传会对我们产生什么长期影响和/或我们未来是否会继续不时受到卖空者的攻击。如果我们成为任何额外不利指控的对象,即使此类指控不真实,我们可能不得不花费大量资源调查此类指控和/或为自己辩护。例如,针对这种负面宣传,我们投入了大量资源和时间,包括同时进行内部和外部审查。虽然我们更愿意对任何此类卖空者的攻击进行强有力的防御,但由于适用的州或联邦法律,或商业机密问题,我们可能会在回应任何指控的方式上受到限制。此外,此类指控已导致,并可能进一步导致SEC或CNMV进行的更严格的审查和调查。未来对卖空者负面宣传的任何回应或对监管机构信息请求的回应都可能代价高昂且耗时,并可能转移管理层对我们日常运营的注意力。
即使是针对我们的毫无根据或彻头彻尾的虚假指控,也可能严重影响我们的A类股、B类股、ADS的市场价格以及我们的业务运营。由于我们收集血浆以及制造和销售血浆衍生疗法的业务性质,我们在很大程度上依赖于我们的品牌和客户对我们服务的信心。因此,这些指控可能会损害我们的声誉、对我们服务的信心以及与现有客户和潜在新客户的关系,从而影响我们的收入。
如果由于卖空者的负面宣传而对我们提起任何诉讼,我们无法预测此类行动的时间、结果或后果,我们也无法向您保证我们的抗辩将会成功,或者我们是否会受到任何损害,或者受到多少损害。无论我们是否胜诉,如果对我们提起任何此类诉讼,我们都可能会产生重大的辩护费用,这可能会对我们的财务状况和经营业绩产生重大不利影响。
美元和欧元汇率波动可能会增加持有我们ADS或股票的风险。
西班牙股票证券市场由位于马德里、巴塞罗那、毕尔巴鄂和巴伦西亚的四家证券交易所(统称“西班牙证券交易所”)组成。在西班牙证券交易所进行的大部分交易是通过西班牙自动报价系统(Sistema de Inteconexi ó n Burs á til Espa ñ ol,简称SIBE)完成的。
我们的A类股票和B类股票在西班牙证券交易所上市,并在SIBE以欧元报价。此外,我们的B类股票在美国纳斯达克全球精选市场以ADS的形式进行交易,以美国存托凭证(ADR)为凭证,以美元计价。此外,我们的一些A类股票以ADS的形式在场外交易。美元和欧元之间的汇率波动可能会导致我们的ADS价值与我们的股票价值之间出现暂时性差异,这可能会导致寻求利用这种差异的投资者进行大量交易。这可能会增加我们股票或ADS价格的波动性,并对其产生不利影响。
此外,由于美元和欧元之间的汇率波动,我们的ADS持有人在西班牙出售从ADR存管人撤回的任何股票时将获得的收益的美元等值以及以ADS所代表的我们的股票以欧元支付的任何现金股息的美元等值也可能下降。
我们的股票或ADS的美国持有人可能无法获得认购(或优先)权利。
在未来增加我们的注册股本的情况下,现有股东一般将有权根据西班牙法律享有认购(或优先认购)权利,除非股东的决议放弃,或者,如果此类权力已根据股东的决议、董事会的决议授予董事会,并且在某些情况下,例如为实物出资进行的增资,其中认购(或优先认购)权利不适用于法律,则除外。B类股持有人一般不会对任何有关增资或放弃认购(或优先认购权)的决议拥有投票权,除非该决议不会以与A类股相同的方式对待B类股,但经修订的《GRIFOLS, S.A.公司章程》(“公司章程”)中规定的有限情况除外。
40
代表A类股份的美国存托凭证持有人,或者,即使被授予优先购买权,我们代表B类股份的美国存托凭证持有人,或美国居民股东可能无法行使投票权或认购(或优先购买权)权利(视情况而定),在这种情况下,我们的美国存托凭证持有人可能会被大幅稀释,除非根据经修订的《证券法》或《证券法》的登记声明对此类权利有效,并且他们授予此类权利的股份或《证券法》的登记要求豁免可用。
我们打算在提供任何权利时评估与任何此类注册要求相关的成本和潜在责任,以及允许行使股份认购(或优先)权利的好处。在这样做时,我们还将评估我们当时可能认为适当的任何其他因素。
无法保证我们将决定遵守此类注册要求。如果不满足此类注册要求,存托人将在存款时出售与ADS相关的认购(或优先购买权)权利,并将此类出售的收益(如果有的话)分配给ADS的持有人。如果存托人无法出售未被行使或未被分配的权利,或者如果出售不合法或合理可行,则将允许这些权利失效,在这种情况下,这些权利将不会有任何价值。
ADS持有人可能会受到其ADS转让的限制。
ADS可在存托人的账簿上转让。然而,存托人一般可以在存托人账簿关闭时拒绝交付、转让或登记转让ADS,或者如果由于法律或任何政府或政府机构或委员会的任何要求或根据存款协议的任何条款,存托人或我们认为此类行动是必要或可取的。此外,在支付费用、税款和类似费用的情况下,或如果我们随时指示存托人在我们规定的与股东大会、支付股息或为遵守任何适用法律或政府法规而合理必要的期间内停止新的发行和撤回我们的股票,我们可能会暂停交出ADS和撤回我们的股票。
项目4.关于公司的信息
a. |
公司历史与发展 |
简介
我们于1940年在西班牙巴塞罗那成立,由输血和临床分析领域的专家和先驱、我们现任董事会名誉主席(非成员)的祖父Antonio Grifols i Roig博士创立。我们生产和销售等离子衍生产品已有70多年的历史。在过去的25年里,我们通过有机扩张和在欧洲、美国、拉丁美洲、非洲和亚洲的收购,从一家主要在西班牙国内的公司发展成为一家全球性公司。
我们于1987年6月22日在西班牙注册成立为一家有限责任公司,名称为Grupo GRIFOLS, S.A.,并于2005年更名为GRIFOLS, S.A.。我们以“Grifols”这一商业名称开展业务。我们的注册和主要行政办公室位于Avinguda de la Generalitat,152 Parque Empresarial Can Sant Joan,08174 Sant Cugat del Vall è s,Barcelona,Spain,我们的电话号码是+ 34935710500。有关该公司的更多信息,请访问我们的网站www.grifols.com。
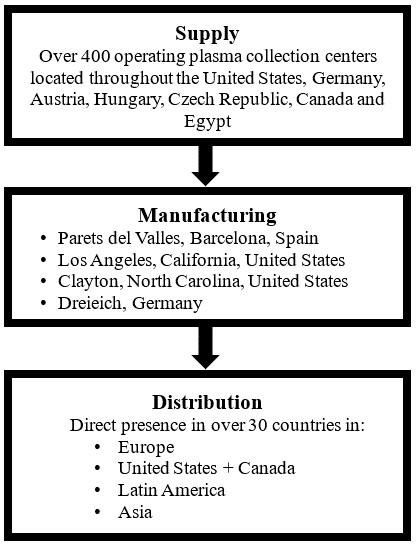
我们是一家垂直整合的全球等离子衍生物生产商,我们相信,就全球总销售额而言,我们跻身该行业三大生产商之列。我们的活动包括采购原材料、制造各种血浆衍生产品以及向医疗保健提供者销售和分销最终产品。我们通过有机增长和收购相结合的方式扩大了我们的血浆采集网络和我们的制造能力。截至2024年12月31日,我们在美国、德国、奥地利、匈牙利、加拿大和埃及(通过我们与埃及国家服务项目组织(NSPO)的合资企业)拥有400多个运营中的单采血浆中心。
41
我们还研究、开发、制造和销售体外诊断产品,包括用于临床和血库实验室以及医院产品的分析仪器、试剂、软件和相关产品。
自我们于2006年5月17日完成首次公开募股以来,我们的A类股票已在西班牙证券交易所上市,并在SIBE上市,股票代码为“GRF”。自2008年1月以来,我们一直是IBEX-35指数的一部分,该指数由流动性和市值排名前35位的西班牙上市公司组成。我们的A类股票也以ADS的形式在美国的场外市场交易,ADR就是明证。场外交易的每份ADS代表我们的两股A类股票。我们发行的B类股票是作为收购Talecris Plasma Resources,Inc.(“Talecris”)对价的一部分,该公司已并入我们的子公司Biomat USA,并在西班牙证券交易所上市并在SIBE报价,股票代码为“GRF.P。”我们的B类股票在美国纳斯达克全球精选市场也以ADS的形式进行交易,以ADR为凭证,代码为“GRFS”。”在纳斯达克交易的每份ADS代表我们的一股B类股票。我们的ADS目前以美元交易。2011年11月,我们的ADS被纳入纳斯达克生物技术指数。
SEC在http://www.sec.gov维护一个互联网站点,其中包含有关以电子方式向SEC提交文件的发行人的报告、信息声明和其他信息。
重要里程碑
以下是我们最重要的一些历史里程碑:
| ● | 2025年2月3日,我们完成了从ImmunoTek GH,LLC(“ImmunoTek”)收购美国28个单采血浆中心的交易。此次收购是在2021年7月29日发起的,当时我们与ImmunoTek签订了一份协议,该协议于2023年和2024年进行了修订,以安排28个中心的建设、许可和调试。根据该协议,我们成立了一家名为Biotek America LLC(“ITK JV”)的联合运营公司,通过该公司,我们最初持有28家单采血浆中心各75%的权益,而ImmunoTek持有剩余的25%。2024年,我们以2.65亿美元的总金额收购了14个血浆采集中心,自2025年2月3日起,我们完成了对剩余14个中心的收购,总金额约为2.813亿美元。请参阅本部分第一部分“经营和财务回顾与前景—— A.经营成果——后续事件”第5项“— B.业务概览——原材料”和“经营和财务回顾与前景—— A.经营成果——影响我们的财务状况和经营成果的因素——最近的收购。” |
| ● | 2024年6月18日,我们完成了向海尔集团(“海尔”)出售中国公司上海RAAS血液制品有限公司(“上海RAAS”)20%股权的交易,以换取约18亿美元,同时保留上海RAAS的6.58%股权。我们已于2020年3月30日收购了上海RAAS 26.2%的投票权和经济权利,以换取我们的美国子公司Grifols Diagnostic Solutions Inc.(“GDS”)45%的经济权利和40%的投票权。我们保持并扩大了在中国的业务,并利用出售所得大幅减少了债务。见本部分第一部分第5项,“经营和财务回顾与前景—— A.经营成果——影响我们的财务状况和经营成果的因素——近期处置情况——上海RAAS;” |
42
| ● | 2022年4月25日,我们收购了Grifols Biotest Holdings GmbH(前身为Tiancheng(Germany)Pharmaceutical Holdings AG(“Biotest Holdings”))的全部现有股权,后者进而拥有德国上市公司Biotest AG(一家供应血浆蛋白产品和生物治疗药物的全球公司)89.88%的普通股和1.08%的优先股,总对价为1,090,518,254欧元。此外,(1)我们完成了对Biotest AG所有剩余股东的自愿要约收购,以收购他们的普通股和优先股,我们在其中收购了1,250,298股普通股(每股43.00欧元)和8,340,577股优先股(每股37.00欧元);(2)在Biotest AG前股东行使适用的德国公司法规定的合法认沽权后,我们于2022年5月收购了185,359股普通股。这使我们在Biotest AG的权益达到97.13%的投票权和70.18%的股本。由于这些交易,我们又收购了28家血浆采集中心。2025年3月31日,我们的董事会批准了向Biotest AG的少数股东提出的公开摘牌要约。见第一部分第5项,见第一部分第5项,“经营和财务审查与前景—— A.经营业绩——后续事件—— Biotest AG公开退市收购要约最近的收购—— Biotest AG收购”和“经营和财务审查与前景—— A.经营业绩——影响我们的财务状况和经营业绩的因素——最近的收购—— Biotest AG收购;” |
| ● | 2021年12月1日,我们出售了Biomat Newco 12.9%的优先股和Biomat USA 12.5%的优先股,这是我们在美国的血浆采集子公司,属于Biomat集团,也由Biomat USA的子公司Grifols Bio Supplies,Inc.(前身为Interstate Blood Bank,Inc.)、Talecris和Biomat USA South,Inc.组成,后两者已分别并入Biomat USA并解散给Parette Investment Pte. Ltd.(统称“Biomat Group”),后者为Parette Investment Pte. Ltd.(“GIC投资者”),Parette Investment Pte. Ltd.是一家由新加坡政府设立的主权财富基金。收到的收购价格为9.9亿美元。我们将所得款项净额用于(i)根据第一留置权信贷便利预付6亿美元的循环贷款本金,(ii)预付142,360,501.31美元的美元B档定期贷款本金,(iii)预付88,003,617.48美元的欧元B档定期贷款,以及(iv)根据资产出售要约回购97,535,000.00欧元的2019年票据。见第一部分项目5,“经营和财务审查与前景—— A.经营成果——影响我们的财务状况和经营成果的因素——处置—— Biomat交易”和“经营和财务审查与前景—— B.流动性和资本资源——信贷来源;” |
| ● | 2020年10月15日,我们收购了加州生物制药公司Alkahest,Inc.(“Alkahest”)100%的股权,总对价为1.46亿美元。2015年,我们此前收购了Alkahest的大量少数股权,通过此次交易,我们获得了对该公司的完全控制权; |
| ● | 2020年10月1日,我们从韩国公司GC Pharma收购了位于加拿大蒙特利尔的一个血浆分馏设施和两个净化设施,以及位于美国的11个血浆采集中心,总对价为4.57亿美元。一旦我们完成翻修并获得蒙特利尔设施所有必要的许可证和监管批准,我们将成为加拿大唯一一家大规模的等离子产品商业制造商。我们预计将于2025年开始在加拿大工厂生产白蛋白以供应加拿大市场,并于2027年开始血浆分馏和丙种球蛋白制造; |
| ● | 2018年6月,我们完成了对德国制药公司Haema GmbH(原名Haema AG)的收购,收购价格为2.2亿欧元; |
| ● | 2018年8月,我们完成了对美国制药公司BPC Plasma Inc(前身为Biotest US Corporation)的收购,收购价格为2.86亿美元; |
| ● | 2016年12月,我们与Hologic Inc.(“Hologic”)订立资产购买协议,收购Hologic的核酸检测(“NAT”)供体筛查部门。该交易于2017年1月完成,收购价格为19亿美元; |
43
| ● | 2014年1月,我们收购了诺华公司(“诺华”)的诊断业务,收购价格为17亿美元; |
| ● | 2011年6月,我们收购了美国生物治疗公司Talecris Biotherapeutics,收购价格为37亿美元;以及 |
| ● | 2003年7月,我们收购了Alpha Therapeutics Corporation的资产,包括其位于加利福尼亚州洛杉矶的血浆分离工厂,收购价格为1.04亿美元。 |
有关我们的营运、产品及服务的重大变动的进一步详情,请参阅本第一部分第5项“营运及财务回顾及前景—— A.经营成果——影响我们的财务状况及经营成果的因素”及本第一部分第6项“董事及高级管理人员”。有关我们主要资本支出和资产剥离的更多详细信息,请参阅本第一部分第5项,“运营和财务审查与前景—— B.流动性和资本资源——资本支出、其他无形资产和使用权。”
接受Brookfield和Grifols家族股东的私下竞标
2024年7月7日,我们的董事会收到某些Grifols家族成员(“家族股东”)和Brookfield Capital Partners(UK)Limited(“Brookfield”)的请求,允许访问公司的某些信息,以便就收购Grifols的股份进行尽职调查。该交易的意图,如果实现,将是公司退市。2024年11月19日,根据为分析交易而成立的独立交易委员会的建议,我们的董事会宣布,不会建议我们的股东接受Brookfield对公司全部已发行股本(包括A类和B类股)估值为64.5亿欧元的潜在要约。Brookfield的这一指示性、非约束性估值意味着每股A类股10.50欧元和每股B类股7.62欧元的价格,我们的董事会认为这大大低估了该公司的基本面前景和长期潜力。2024年11月27日,我们公开确认终止与Brookfield就此类交易进行的讨论。
b. |
业务概况 |
一般
我们是全球领先的专业血浆疗法公司之一,开发、制造和分销广泛的基于血浆衍生蛋白的生物药物。血浆衍生物是在人体血浆中发现的蛋白质,一旦分离纯化,就具有治疗价值。这些基于蛋白质的疗法可延长和提高患有慢性和急性、通常危及生命的疾病的个体的生命,这些疾病包括原发性和继发性免疫缺陷、慢性炎症性脱髓鞘性多发性神经病(“CIDP”)、A1PI缺乏症和相关的肺气肿、免疫介导的ITP、格林巴利综合征、川崎病、同种异体骨髓移植、A型和B型血友病、血管性血友病、创伤性或失血性休克以及严重烧伤。此外,我们构建了专注于研究、开发、制造和营销用于临床和血库实验室的体外诊断产品的诊断业务。我们还专门提供输液解决方案、营养产品和医疗器械,供医院和诊所使用。
44
我们的产品和服务被100多个国家的医疗保健提供者用于诊断和治疗患有血友病、免疫缺陷、传染病和一系列其他疾病的患者。我们通过运营商业子公司,在30多个国家直接开展业务。
就全球总销售额而言,我们是业内领先的生产商。我们相信我们在血浆衍生品行业的各个细分领域,包括A1PI、IG和白蛋白,以及在血浆采集中心和分馏能力方面,都拥有前三的市场地位。我们的长期目标是通过开发新的和差异化的血浆衍生疗法,以及通过收购和新建项目扩大我们的全球血浆采集足迹,进一步加强我们的领导地位。
我们将业务组织为五个业务单元:血浆采购、生物制药、诊断、生物用品和其他。
血浆采购。血浆采购业务部门包括与血浆采集有关的所有活动,包括对献浆者的评估和筛查以及我们的血浆采集中心的运营。我们没有报告血浆采购业务部门的收入,因为在我们的设施中收集的所有血浆都出售给生物制药业务部门中的Grifols公司,并且这些集团内部销售的收入在合并时抵消了与此类销售相关的集团内部费用,从而确保我们的财务信息中仅反映外部收入。由于其业务面向内部的性质,我们在这份表格20-F的年度报告中描述了我们在生物制药部门下的血浆采购业务。
BioPharma(前身为BioScience)。生物制药业务部门包括与制造用于治疗用途的血浆衍生物有关的活动,包括血浆的接收、分析、检疫、分类、分馏和纯化以及终端产品的销售和分销。我们生产的主要血浆产品有IG、VIII因子、Alpha 1(A1PI)和白蛋白。我们还生产肌内(超免疫)免疫球蛋白、ATIII、IX因子和血浆促凝血酶原激素组分(“PTC”)。生物制药业务部门占我们2024年总净营收的61.425亿欧元,或85.2%。
诊断。诊断业务部门专注于研究、开发、制造和营销体外诊断产品,包括用于临床和血库实验室的分析仪器、试剂、软件和相关产品,覆盖从捐赠到输血的整个价值链。我们将诊断业务集中在输血医学(免疫学、免疫血液学)和止血等专科诊断领域。诊断事业部的主要客户为献血中心、临床分析实验室和医院免疫血液学服务。核酸检测(NAT,Donor Screening Unit)从事基于NAT技术的检测和仪器的研究、开发、制造和商业化,用于输血和移植筛查。NAT技术使检测血液和血浆捐赠中是否存在感染因子成为可能,有助于提高输血安全性。诊断业务部门占我们2024年总净营收的6.449亿欧元,占比8.9%。
生物用品。Bio Supplies的净收入主要包括与非治疗用途的生物制品相关的收入以及向第三方的血浆销售。生物用品业务部门占我们2024年总净营收的2.157亿欧元,即3.0%。
其他活动和运营。除了我们的四个业务部门,我们还有其他较小的业务、活动和业务线(“其他”),这些收入主要来自向第三方提供制造服务、第三方血浆销售和研究活动。其他还包括我们的医疗保健解决方案(以前是我们的医院部门)。该业务单位还包括由集团制造并拟用于医院药房的医药产品,以及与我们自身产品互补的产品的营销。其他公司占我们2024年总净营收的2.092亿欧元,即2.9%。
地理市场
我们相信,我们是全球领先的等离子体衍生物生产商,与武田和CSL集团一起,按总销售额计位列行业三大生产商之列。我们是全球最大的A1PI生产商,用于治疗A1PI缺乏相关的肺气肿。
我们目前通过30多个国家的分销商和子公司在100多个国家开展业务。美国是全球等离子衍生物部门销售规模最大的地区。截至2024年12月31日止年度,美国和加拿大占我们总净营收的56.7%,欧盟占我们总净营收的21.4%(其中27.4%产生于西班牙),世界其他地区占我们总净营收的22.0%。
45
某些销售区域,特别是新兴市场,在社会经济条件增强的推动下经历了持续增长,包括普遍增加对患者的免疫缺陷、自身免疫性疾病和低水平α 1蛋白的检测,我们的产品可以治疗所有疾病,更知情的患者需要更优质的医疗护理,以及增加政府在血浆衍生产品上的医疗保健支出。预计这些新兴市场将出现显著增长。我们在拉丁美洲的存在和经验,在墨西哥、哥伦比亚、阿根廷、智利和巴西等国家,我们在那里营销和销售产品已有20多年,这使我们能够从我们的生物制药和诊断业务部门的这一额外增长中受益。在亚太地区,我们通过在马来西亚、中国、泰国、新加坡、澳大利亚、日本、印度、香港、台湾和印度尼西亚的子公司和代表处建立了业务。我们还在迪拜和沙特阿拉伯开设了中东代表处。
我们保持对国际扩张和收购的持续关注,并将继续有选择地考虑产生运营协同效应的收购。有关我们为进一步增强运营而进行的收购的具体例子,请参见上文“— A.公司的历史与发展——重要里程碑”。
以下图表反映了过去三年我们每个地理区域的净收入摘要:
|
年终 |
|
|
年终 |
|
|
年终 |
|
|
||||
12月31日, |
占总量% |
12月31日, |
占总量% |
12月31日, |
占总量% |
|
|||||||
各地区净收入汇总 |
2024 |
净收入 |
2023 |
净收入 |
2022 |
净收入 |
|
||||||
(单位:千欧元,百分比除外) |
|
||||||||||||
欧洲联盟(1) |
|
1,541,338 |
21.4 |
% |
1,255,927 |
19.1 |
% |
1,032,210 |
|
17.0 |
% |
||
美国和加拿大 |
|
4,087,030 |
56.7 |
% |
3,898,961 |
59.1 |
% |
3,855,607 |
|
63.6 |
% |
||
世界其他地区 |
|
1,584,014 |
22.0 |
% |
1,437,089 |
21.8 |
% |
1,176,150 |
|
19.4 |
% |
||
合计 |
|
7,212,382 |
100.0 |
% |
6,591,977 |
100.0 |
% |
6,063,967 |
|
100.0 |
% |
||
| (1) | 在欧盟获得的净收入包括在西班牙获得的净收入。 |
主要活动
我们将业务组织为五个业务单元:血浆采购、生物制药、诊断、生物用品和其他。血浆采购业务部门不产生收入,因为收集的所有血浆都出售给生物制药业务部门的Grifols公司。因此,我们对综合财务信息的列报不包括作为经营分部的等离子采购。下图展示了过去三年我们每个其他业务部门的总净收入:
|
年终 |
|
|
年终 |
|
|
年终 |
|
|
||||
12月31日, |
占总量% |
12月31日, |
占总量% |
12月31日, |
占总量% |
|
|||||||
按业务部门划分的净收入汇总 |
2024 |
净收入 |
2023 |
净收入 |
2022 |
净收入 |
|
||||||
(单位:千欧元,百分比除外) |
|
||||||||||||
生物制药 |
|
6,142,588 |
85.2 |
% |
5,558,301 |
84.3 |
% |
5,005,382 |
82.5 |
% |
|||
诊断 |
|
644,898 |
|
8.9 |
% |
670,269 |
|
10.2 |
% |
671,292 |
|
11.1 |
% |
生物用品 |
|
215,664 |
|
3.0 |
% |
159,957 |
|
2.4 |
% |
146,076 |
|
2.4 |
% |
其他 |
|
209,232 |
|
2.9 |
% |
203,450 |
|
3.1 |
% |
250,165 |
|
4.0 |
% |
各部门间 |
|
— |
|
— |
— |
|
— |
(8,948) |
|
(0.1) |
% |
||
合计 |
|
7,212,382 |
|
100.0 |
% |
6,591,977 |
|
100.0 |
% |
6,063,967 |
|
100.0 |
% |
生物制药业务部门
生物制药事业部负责血浆衍生产品的研发、生产和营销。2024年,生物制药业务部门占我们总净营收的85.2%。
46
运营Structure
以下图表说明了其运营结构:
从血浆捐赠到治疗应用,行业价值链过程有四个主要步骤:(i)血浆收集,(ii)运输和物流,(iii)制造(分馏和纯化)和(iv)营销和分销。我们存在于价值链的各个层面,从收集中心到最终产品的分销。这种垂直整合使我们能够利用我们在每个阶段的地位来控制整个过程,从较低的价格中受益,并向我们的客户推出互补产品,例如通过诊断业务部门提供的产品。
血浆采购
等离子体是等离子体衍生产品生产中使用的关键原材料。我们通过开设新的血浆采集中心和收购,通过有机增长相结合的方式扩大了我们的血浆采集网络。我们主要从美国和欧洲(德国、奥地利、捷克共和国和匈牙利)通过400多个运营中的血浆采集中心以及在较小程度上通过与第三方的协议获得我们的血浆。在过去几年中,根据我们业务战略的实施,我们在美国、加拿大和欧洲收购了血浆采集中心。
47
2024年,我们的血浆采集与2023年持平,2024年采集血浆的平均每升成本与2023年的平均每升成本相比下降了4.4%。我们还在2024年增加了我们的血浆采集中心优化,独特的捐献者人数上升到93万人,捐献者频率增加,并新安装了更高效的血浆置换设备。我们还通过在60%的美国血浆中心实施列线图技术以及引入新的血浆单采设备来提高我们的血浆采集效率,以增加血浆体积采集,同时保持供体安全。
我们认为,到2025年,我们的大部分血浆需求将通过在我们的血浆采集中心收集的血浆以及在较小程度上根据各种血浆采购协议从第三方供应商购买的血浆来满足。由于我们的大部分等离子是内部采购的,因此我们有能力确保满足我们制造需求的等离子的可用性,并确保整个制造过程中等离子的质量。
我们已实施机制,以确保血浆捐献者符合适用法规规定的指导方针,其中包括健康、年龄和捐赠频率。一旦完成血浆捐赠,根据适用的美国和欧洲法规的要求,我们对每一次捐赠都进行病原体检测,如HIV、甲型肝炎、乙型和丙型肝炎、细小病毒B19和梅毒。如果我们发现一个单位的血浆不能用于分馏过程,我们会通知捐献者,并从我们的库存中删除该捐献者以前捐赠的所有血浆。
我们在这份20-F表格的年度报告中描述了我们在Biopharma部门下的血浆采购业务,因为血浆收集是我们垂直整合价值链的基本部分。我们没有将血浆采购描述为一项独立的业务,而是将其整合到生物制药业务部门的描述中,以反映其在确保我们的血浆衍生疗法的原材料方面的主要作用。这种方法符合将上游供应链活动与产生最终产品用于商业化的核心生物制药运营联系起来的行业实践。我们认为,通过合并Biopharma内部对血浆采购的描述,我们可以更清楚地了解血浆采购如何直接支持创收、成本效率和战略决策,同时还能确保分部报告和财务披露的一致性。
运输和物流
一旦采集到血浆,就在采集中心冷冻,送到分馏中心。这一过程的一个重要方面是实施安全程序,以保证捐赠血浆的质量和安全。为确保血浆中发现的蛋白质的保存,血浆必须保持在或低于-20 Celsius(-4华氏度)的温度。按照欧洲和美国的要求,我们将等离子体储存在-30度Celsius(-22华氏度)的温度下。运输过程中,等离子体保持在-20 ℃或以下Celsius的温度。我们的冷冻血浆由两家运输公司中的一家运输,这两家公司在整个行业都使用相同的方法。
截至2024年12月31日止年度,我们实施了与运营改进计划相关的举措,以优化我们的供应链和分销物流。这些举措包括最大限度地利用运输集装箱的可用空间,将每个集装箱的血浆运输量提高6.8%,从而减少运输总量。其他正在进行的措施包括优化欧洲工作场所的血浆采集路线频率,促进血浆采集点、仓库和巴塞罗那制造综合体之间的满载货物,以及使用更大的美国托盘来优化储存和运输。
分馏提纯
一旦获得血浆,就可能被用于血浆输血。它也可以被冷冻(作为新鲜的冷冻血浆),并通过分馏过程制造成血浆衍生物。分馏过程包括通过温度和pH值变化分离特定蛋白质,以及使用过滤和离心技术。这一过程还包括引入各种病毒灭活程序的阶段。在接近冰点的温度下,罐体中会发生分馏,以保持蛋白质的完整性。所有已知的等离子体衍生产品都可以从同一批等离子体中分馏出来。因此,开发一种新的或更高产量的等离子衍生产品可能会产生增量销售,而不会增加对额外等离子的要求。
48
我们目前在美国(北卡罗来纳州克莱顿和加利福尼亚州洛杉矶)运营两个Biopharma制造工厂,一个在西班牙(Parets del Vall è s),一个在爱尔兰(都柏林),一个在加拿大(蒙特利尔)和一个在德国(Dreieich)。我们的等离子衍生产品在我们的Clayton、Los Angeles和Parets工厂生产。我们的克莱顿工厂是世界上最大的综合蛋白质生产基地之一,包括血浆衍生蛋白质的分馏、纯化和无菌灌装和精加工。
目前,Clayton、Los Angeles和Parets工厂配备并获得许可,可为美国、欧洲和其他市场生产某些等离子衍生产品。例如,我们生产我们的Flebogamma®DIF和Gamunex®在Clayton、Los Angeles和Parets工厂为我们所有市场提供IVIG产品。
我们与加拿大血浆资源公司(“CPR”)签订了一项协议,据此我们有权获得在CPR拥有的采集中心捐赠的血浆。这份协议还授予我们最早在2026年从CPR收购血浆采集中心的权利。我们打算使用我们从心肺复苏术获得的血浆,以及我们从我们在加拿大的中心收集的血浆,来履行我们根据与加拿大血液服务公司(“CBS”)的长期协议所做的承诺,如下文段所述。
2022年7月29日,我们与加拿大非营利组织CBS签署了一项为期15年的可再生能源合作协议,该组织在加拿大医疗保健系统内开展全国性业务。CBS代表加拿大除魁北克省以外的所有省和地区政府为患者提供服务,保障加拿大的国家系统提供与血液、血浆、干细胞、器官和组织相关的救生疗法。通过该协议,我们承诺向CBS供应相当于加拿大患者消费需求的25%(240万克)的IG数量(不包括魁北克)。除了上述从CPR获得的血浆外,我们还打算通过从我们拥有和管理的加拿大血浆采集中心网络收集的血浆来履行这一协议,该网络在我们位于魁北克省蒙特利尔的工厂生产我们的产品。
作为与CBS安排的一部分,我们正在加拿大开发六个全资拥有的单采血浆中心(五个在安大略省,一个在埃德蒙顿)。我们已与第三方顾问订立顾问服务协议,以发展该等中心。第三方顾问将就所提供的服务收取某些费用,这些费用已在我们经审计的综合财务报表中披露,并包含在我们于2024年3月1日向市场提交的资本支出计划中。对于我们用于供应IG的每升加拿大血浆,我们还将向CBS供应所有剩余的制造浆料,用于加工其他血浆衍生产品。
此外,于2020年10月1日,我们向GC Pharma购买了位于加拿大蒙特利尔的血浆分馏设施和两个净化设施(以及位于美国的11个血浆采集中心)。一旦我们完成翻修并获得蒙特利尔设施所有必要的许可证和监管批准,我们将成为加拿大唯一一家大型血浆产品商业制造商。我们预计将于2025年开始在加拿大工厂生产白蛋白以供应加拿大市场,并于2027年开始血浆分馏和丙种球蛋白制造。
我们还通过获得FDA和EMA许可证,并完成进一步的要求,不断优化我们的分馏能力的利用,这使我们能够在我们的任何其他设施中净化在我们的一个设施中生产的中间产品。我们获得了以下FDA许可,其中包括:
| ● | 在我们的Clayton工厂使用在我们的洛杉矶和Parets工厂制造的Fraction II + III制造Gamunex®; |
| ● | 在我们的洛杉矶工厂使用在我们的洛杉矶和克莱顿工厂制造的Fraction II + III制造Gamunex®; |
| ● | 使用在我们洛杉矶工厂获得的Fraction V在我们的Parets工厂生产白蛋白; |
| ● | 使用在我们的Clayton和Parets工厂获得的Fraction V生产白蛋白®在我们洛杉矶的工厂里; |
| ● | 使用在我们洛杉矶工厂获得的Fraction IV-1生产Prolastina®,我们在西班牙销售的A1PI,在我们的克莱顿工厂; |
49
| ● | 使用在我们洛杉矶工厂获得的Fraction IV-1生产Prolastin®-C在我们Clayton工厂冻干; |
| ● | 使用我们Clayton工厂获得的Fraction IV-1生产Prolastin®-C液体在我们的Parets工厂; |
| ● | 使用我们Parets工厂目前采用的相同方法生产阿方酸®在我们洛杉矶的工厂里; |
| ● | 使用Clayton分馏设施的浆料生产Gamunex®和Prolastin®; |
| ● | 生产纳米过滤的Gamunex®和40克的小瓶展示;和 |
| ● | 使用在我们Clayton工厂获得的低温沉淀来生产Alphanate®在我们的克莱顿工厂,随后被送到我们的洛杉矶工厂进行填充。 |
我们正在继续努力获得更多这种性质的FDA许可。通过此类许可证提供的灵活性使我们能够提高生产效率,并更好地应对美国、欧盟和其他世界市场之间的需求变化。
有关我们制造设施的更多信息,请参阅下面的“— D.物业、厂房和设备”。
安全
我们从未经历过因安全风险而强制召回我们任何批次的生物制品成品。根据我们对安全和质量的承诺,由于我们发现分离到一小部分血浆供体的过敏/超敏类型反应率较高,作为预防措施,我们过去曾自愿撤回一些不包括成品生物制品的产品批次。这些撤回是在适用法域的政府当局知情的情况下进行的。我们的理念是,血浆捐献者和患者的健康是最重要的考虑因素。没有一款撤回的产品涉及对患者有任何重大影响的报告。我们坚信,我们的安全理念与创造利润的商业目标是一致的。我们还相信,我们在市场上拥有强大的安全声誉,从而使我们的产品对客户特别有吸引力。我们进一步相信,我们的垂直整合业务模式使我们能够通过实施我们的安全标准,帮助确保我们的等离子衍生产品的安全和质量。
血浆采集、分馏和纯化过程漫长、复杂、规制程度高。我们采用并保持了严格的安全标准,我们认为这些标准超过了欧洲和美国卫生当局的要求。Grifols集团定期接受良好生产规范(“GMP”)主管卫生当局的检查和认证,例如欧洲当局、FDA和我们产品上市的其他国家的其他相关政府当局。2024年,我们执行了超过390次质量控制供应商审核,以确保符合GMP。
我们维持我们认为与其他行业参与者在血浆安全方面一致的标准,这些标准定期获得血浆蛋白治疗协会(“PPTA”)的认证,根据国际质量血浆计划(“IQPP”),用于血浆捐献中心,以及根据卓越、保证和领导计划(“QSEAL”)的质量标准,用于分馏厂。例如,来源血浆库存在捐赠后保持不少于60天,以允许在此期间(血清转换后或由于高风险行为或国际旅行)捐赠者被取消资格的情况下检索和销毁血浆单位。我们还推出了等离子瓶采样等创新方法™系统,在捐献血浆时自动准备、编码和标记测试样本,而Pedigri™On Line系统,旨在为整个血浆供应链提供人体血浆原料的全程可追溯性。见下文“—分配过程”。我们在每次捐献前都会进行常规健康筛查和医学评估,确保血浆捐献者的健康仍然是优先事项。
50
我们的制造工厂的设计符合现行的GMP标准和清洁区域的适用法规,旨在最大限度地减少清洁区域以及人为干预,目的是降低污染风险。这些设施须遵守清洁和消毒计划以及纠正和预防性维护计划。我们定期自愿关闭我们所有的制造设施,以进行维护工作、扩建项目和其他资本投资。我们的制造设施在我们运营期间从未因为监管违规而被强制关闭。我们认为,我们的自愿关闭程序降低了任何强制关闭的风险。
我们有适当的流程,确保我们所有的血浆衍生产品严格按照经过验证和批准的程序生产,并按照相应的上市许可。此外,每个制造过程都包括至少一个经过验证的特定病毒灭活或去除步骤,作为预防措施,以避免不太可能的病毒污染。
由于我们的产品是无法最终灭菌的蛋白质,因此它们在被无菌填充到最终容器中之前先通过过滤进行灭菌。我们为Grifols无菌灌装(“GSF”)系统申请了专利,该系统可最大限度地降低无菌灌装过程中微生物或微粒污染的风险。在此过程中,灭菌容器在A级层流气流下充满产品。部分密闭的容器(带塞子和保护器的小瓶)在灌装前进行消毒。容器关闭单元保持部分关闭直到填充时刻,之后立即密封,从而通过减少产品和容器暴露在受控环境中来降低污染风险。灌装过程被记录下来,这使我们能够识别任何相关问题的原因,并更容易地进行整改。这些记录根据我们的数据保留政策进行维护。
一旦无菌灌装,每一单位产品都被激光标记,目的是对每个容器进行单独识别,防止和检测假冒产品。这使我们能够保护我们制造过程的完整性。
等离子体衍生物制造出来后,每个批次的每个单元都要进行目视检查,以便检测容器封口系统中是否存在外来颗粒或其他缺陷。每批还根据许可规格、上市许可和相应的药典专著,在生产过程中和生产过程结束时进行检测。所有流程均由Grifols现有的质量体系监督,目标是确保产品以适当的质量、纯度、效力和安全性推向市场。
最后,一旦产品上市,我们的药物警戒系统使我们能够控制因给药我们的产品而产生的所有潜在不良反应。我们的监测系统跟踪由于使用医疗设备和体外诊断引起的不良事件,从而确保我们的产品在世界各地的安全。
我们不断投资于改善我们的制造设施和等离子体分馏工艺,以及其他相关系统,以确保我们产品的质量和安全。
51
分配过程
对于每一批等离子体衍生物,我们向客户提供有关我们在制备该批次时使用的每一单位等离子体的来源、特性和控制的电子信息。这个功能,叫做Pedigri™On Line系统,让我们产品的医疗保健用户和监管部门能够即时、便捷地获取这些信息,切实证明我们产品的全程可追溯性。我们自1996年以来就有这个系统,我们相信我们是唯一一家向客户提供这一功能的分馏器。
我们拥有自己的销售和分销网络,几乎覆盖了我们所有的市场,配备了训练有素的人员。我们在2024年的大部分销售是通过我们自己的分销网络进行的,这对于我们产品的正确处理是有经验的。我们认为,这一网络提供了更大的安全性,因为它使我们能够跟踪我们的产品,并在潜在的产品召回情况下迅速做出反应。在我们没有自己的分销网络的国家,我们使用精心挑选的分销商,他们被要求遵守我们所有的安全标准。
欲了解更多信息,请参阅下文“—营销和分销”。
生物制药产品和服务
收集到的血浆,无论是来源还是回收的,都被分离成不同的成分蛋白。我们分离和纯化范围广泛的血浆衍生产品,以改善患者护理。我们的生物制药业务部门还销售一种非血浆衍生医药产品Tavlesse®(fostamatinib),在欧洲。
52
下面的图表按品牌名称和各自的治疗适应症展示了我们的主要产品:
产品说明 |
|
主要治疗适应症 |
Gamunex®/Gamunex®-C.免疫球蛋白注射液(人用),10%辛酸酯/chomatography纯化。Flebogamma®5%和10% DIF。免疫球蛋白静脉注射(人)。 |
IVIG用于治疗:原发性和继发性免疫学缺陷以及包括免疫介导的ITP在内的自身免疫性疾病;禁用或不建议使用主动免疫接种的患者的麻疹暴露前/暴露后预防;格林巴利综合征;川崎病;慢性炎症性脱髓鞘性多发性神经病(“CIDP”);和多灶性运动神经病(“MMN”)。严重急性肌无力加重是Gamunex的批准适应症®-C在欧洲。 |
|
|
|
|
Xembify®.免疫球蛋白皮下(人)-KLHW 20%溶液。 |
用于治疗原发性体液免疫缺陷(“PI”)。在欧洲和澳大利亚,Xembify®还适用于治疗预防性抗生素无效或禁忌的慢性淋巴细胞白血病(“CLL”)患者的低丙种球蛋白血症和复发性细菌感染,多发性骨髓瘤(“MM”)患者的低丙种球蛋白血症和复发性细菌感染,以及同种异体造血干细胞移植(“HSCT”)患者的低丙种球蛋白血症。 |
|
|
|
|
HyperRAB®狂犬病免疫球蛋白(人)。 |
用于暴露后预防的抗狂犬病免疫球蛋白,连同狂犬病疫苗,适用于所有先前未接种过狂犬病疫苗且已确认有足够狂犬病抗体滴度的疑似接触狂犬病的人员。 |
|
|
|
|
Prolastin®/Prolastin®-C/Prolastin®-C液/Prolasplan®/前列腺炎®/pulmolast®/Lynspad®.Alpha 1-蛋白酶抑制剂(人用)。 |
用于治疗因严重遗传性α-1抗胰蛋白酶缺乏症(“A1PI缺乏症”)而出现肺气肿临床证据的成人。 |
|
|
|
|
范赫迪™和Alphanate®.抗血友病因子/血管性血友病因子复合体(人)。 |
用于VIII因子缺乏症(A型血友病)出血的预防、管理和控制及血管性血友病的适应症。 |
|
|
|
|
科阿特®-DVI。抗血友病因子(人)。 |
用于VIII因子缺乏症(A型血友病)出血的防治。 |
|
|
|
|
白蛋白®/白蛋白®FlexBag®/人血白蛋白Grifols®/纤溶酶®.白蛋白(人)5%、20%和25%。 |
用于重建和维持血液循环容量,用于治疗低血容量(即创伤性或失血性休克、感染性休克和严重烧伤)和治疗与肝硬化相关的并发症。 |
|
心梗™/VeraSeal®.人纤维蛋白原/人凝血酶。 |
在标准手术技术不足以改善止血的成人中作为补充治疗,并在血管手术中作为缝合支撑。 |
|
塔夫莱斯®.福司他马替尼六水二钠薄膜包衣片。 |
用于治疗其他治疗难治性成人患者的慢性免疫性血小板减少症(“ITP”)。 |
53
静脉注射免疫球蛋白(IVIG)
Gamunex-C®IVIG,即用型液体IVIG产品,是IVIG细分领域的拳头产品之一。我们认为Gamunex-C®IVIG由于一套全面的差异化产品特性,是自推出以来同类产品中的精品之一。根据PPTA的数据,我们是免疫球蛋白生产和营销的市场领导者之一,截至2024年11月30日止十二个月期间,我们在美国的市场份额为24.3%。
皮下免疫球蛋白(“SCIG”)
Xembify®,我们的20% SCIG,于2019年首次在美国上市,适应症为治疗原发性免疫缺陷。2024年,FDA批准了一项标签扩展,允许未接受过IG治疗的患者开始使用Xembify进行SCIG治疗®无需先进行IVIG治疗,让Xembify®美国首个有此适应症的20% SCIG产品。FDA的这一批准还包括新的双周给药(而不是之前的每周给药),以提高患者的灵活性和便利性。Xembify®还被批准用于加拿大和欧盟几个国家的原发性和继发性免疫缺陷。我们推出了Xembify®在2023年和2024年的十个国家中(2023年为西班牙和澳大利亚,随后是2024年的挪威、瑞典、法国、捷克共和国、斯洛伐克、冰岛、芬兰和英国)。
人狂犬病免疫球蛋白(“HRIG”)
我们认为HyperRAB®是世界领先的HRIG,与狂犬病疫苗一起用于暴露后预防,适用于所有疑似接触狂犬病且之前未接种过狂犬病疫苗的人。HyperRAB®,一种在美国有售的300iU/ml制剂,是唯一一种作为更高效力制剂提供的HRIG,在每一剂量的给药中可能需要更少的注射。截至2024年12月,我们在美国抗狂犬病免疫球蛋白的销售额中估计有87%的市场份额。
Alpha-1-抗胰蛋白酶增强疗法(AAT)
我们相信,在AAT产品的销售方面,我们是全球市场的领导者。2024年12月31日,我们的AAT产品在全球27个国家拥有58个许可证,其中19个位于北美和欧洲。根据我们的估计,截至2024年12月,我们在AAT的全球销售市场份额超过70%。我司AAT产品的主要品牌是Prolastin®,一种慢性增强和维持疗法,用于治疗与严重遗传性A1PI缺乏症相关的肺气肿。我们销售Prolastin的冻干粉剂型®主要在北美和南美以及欧洲。2024年,我们针对这一Prolastin配方推出了新的4克和5克小瓶尺寸®在欧洲多个国家,包括德国、丹麦、法国、奥地利、西班牙、葡萄牙和意大利。此外,我们即用型液体制剂中的AAT(Prolastin®-C Liquid)获得FDA批准并在美国销售,我们目前正在进行一项全球范围的临床试验,以满足批准后的监管承诺并获得Prolastin的监管批准®-C液体在欧洲。2023年,我们赞助了超过150,000项与这项正在进行的临床试验相关的基因检测。
A型血友病
Koate之间®-DVI、FANHDI和Alphanate,所有控制A型血友病患者出血的产品,我们在2023年PDFVIII型血友病A市场(不包括Von WilleBrand疾病使用)中根据全球销量估计有14.3%的市场份额。
白蛋白
我们有几个以白蛋白为基础的产品,主要是在我们的白蛋白®品牌。我们在全球销售基于白蛋白的产品,预计2023年销量的市场份额为17.4%。我们的白蛋白产品符合美国、欧洲和中国的要求,使其对生物技术公司和基因实验室以及医院和医生具有吸引力。2021年和2022年,我们在美国推出并开始销售白蛋白25%和5% FlexBag®,一种灵活的容器,旨在增加便利性、易用性、耐用性。2024年白蛋白25%和5% FlexBag销量®在美国占白蛋白总量的39.0%®品牌销售额(与2023年的18.7%相比)。我们预计推出白蛋白FlexBag®在中国和选定的欧洲国家。
54
慢性免疫性血小板减少症(ITP)
塔夫莱斯®,由Grifols Biopharma商业化的第一个口服疗法,是一种新型SYK抑制剂,已从里格尔制药获得许可,可在欧洲以及中东和北非的其他市场进行商业化。塔夫莱斯®适用于治疗其他治疗无效的成年患者的慢性免疫性血小板减少症。2024年,我们推出了Tavlesse®在斯洛伐克和阿拉伯联合酋长国销售,并在捷克共和国、挪威、丹麦、荷兰、德国、西班牙、意大利、法国和英国销售该产品。我们计划扩大我们的Tavlesse®销往沙特阿拉伯。
其他产品
我们生产抗凝血酶产品(例如,AT、ATIII、pdAT)如Anbinex®和血小板®III,用于预防和治疗抗凝血酶缺乏症患者的血栓栓塞并发症;以及AlphaNine®,profilnine®和因子IX Grifols®,用于B型血友病患者出血防控。
我们商业化肌肉(超免疫)免疫球蛋白,用于预防和治疗破伤风,预防和治疗乙肝,以及出生时RH因子并发症。纽利瓦®和Igantibe®用于肝移植后预防乙肝再感染移植物。
我们还制造Vistaseal™/Veraseal®,一种由纤维蛋白原和人凝血酶组成的生物纤维蛋白密封剂,用于外科手术加速愈合过程。该产品在美国和加拿大、部分欧洲国家(即德国、英国、瑞士、爱沙尼亚、拉脱维亚、立陶宛、奥地利、爱尔兰、荷兰、法国和意大利)以及韩国、台湾地区、新加坡、波多黎各、以色列和澳大利亚由强生 MedTech(强生旗下公司)实现商业化。2024年,VistaSeal™在美国、加拿大和澳大利亚获得批准,可使用其纤维蛋白密封剂溶液治疗儿科患者的手术出血。
销售医药产品,首先要向拟上市销售产品的辖区有关部门进行产品登记。为了遵守特定司法管辖区的监管要求,我们在西班牙和美国有一个核心团队,负责与分配到该司法管辖区的子公司的技术人员一起准备、归档和协调注册流程。截至2024年12月31日,我们在欧洲、美国、拉丁美洲、亚洲和世界其他地区的90个国家注册了1,101个生物制药产品许可证。截至2024年12月31日,我们为生物制药产品颁发的最重要的政府许可是:
| ● | Gamunex®/Gamunex®-C/Flebogamma®DIF。我们有223个许可证,用于营销和销售一种或多种IVIG产品; |
| ● | Xembify®.我们有35个这个产品的营销和销售许可证; |
| ● | Prolastin®/Prolastin®-C/Prolastin®-C液/Prolasplan®/前列腺炎®/pulmolast®/Lynspand®.Alpha 1-蛋白酶抑制剂(人用)。我们有64个许可证,用于营销和销售这些A1PI产品中的一个或多个; |
| ● | 范赫迪™/Alphanate®/Koate®-DVI因子VIII。我们有220个许可证,用于营销和销售这些因子VIII产品中的一个或多个; |
| ● | 白蛋白®/人血白蛋白Grifols®/纤溶酶®.我们有283个许可证,用于营销和销售一种或多种不同浓度的这些白蛋白产品; |
| ● | VistaSealTM/VeraSeal®.我们有29张这种产品的营销和销售许可证;和 |
| ● | 塔夫莱斯®.我们有Tavlesse的EMA授权®在欧盟和英国的国家授权。塔夫莱斯®目前在捷克、挪威、丹麦、荷兰、德国、西班牙、意大利、法国、英国、阿拉伯联合酋长国和斯洛伐克销售。 |
55
除了销售上述产品外,我们还与许多西班牙输血组织达成一系列安排,从这些组织分馏回收的血浆(从献血获得的血液中分离出的血浆),并以我们自己的品牌名称制造血浆衍生物,供医院使用。我们向输血中心收取分馏和制造服务费用。我们还向西班牙的医院和诊所提供输血血浆的病毒光灭活。血浆在我们的制造设施中被灭活,然后被送回收集它的诊所或医院,在那里被用于输血。
诊断业务部门
诊断业务部门的收入为6.449亿欧元,占2024年总净营收的8.9%,专注于研究、开发、制造和营销体外诊断产品,包括用于诊断临床和血库实验室的分析仪器、试剂、软件和相关产品。
于2024年12月31日,我们超过90.0%的体外诊断产品,包括但不限于凝胶卡、试剂红细胞和Ultrio Elite,已获得体外诊断监管(“IVDR”)认证。IVDR是在欧洲市场投放市场、提供体外诊断医疗设备并投入服务的监管基础。我们目前正在执行所有剩余的要求,以便为我们所有的体外诊断产品及时获得IVDR认证。
该事业部的主要专业化领域为输血医学和临床及专科诊断。
在输血医学方面,我们认为我们在NAT血液筛查解决方案方面拥有显著的市场份额。此外,我们增加了对几个主要全球市场的医院输血服务和血液中心的自动化免疫血液系统和试剂的销售。我们还继续扩大我们在特定领域的临床和诊断产品组合,包括自身免疫,并有协议扩大我们制造的用于临床和血库诊断测试的抗原数量。我们的主要诊断产品有:
56
产品说明 |
|
主要应用 |
|---|---|---|
|
||
输血医学: |
||
Procleix®黑豹®系统/Procleix®黑豹®与自动化就绪技术(ART)。自动化NAT血液筛查系统、化验和软件。 |
用于检测捐献血液和血浆中的传染性病毒和寄生虫包括:HIV(1型和2型);甲型肝炎、乙型肝炎、丙型肝炎和戊型肝炎;细小病毒B19;疟原虫、巴贝虫和虫媒病毒样、基孔肯雅热、西尼罗河病毒、登革热、寨卡病毒。 |
|
瓦迪亚纳®/Erytra®/Erytra Eflexis®分析仪。利用凝胶凝集技术实现DG凝胶自动处理的自动化免疫血液分析仪®系统,包括DG Gel®卡、试剂红细胞、抗血清及相关软件。手动和半自动化设备也是DG Gel系统的一部分。 |
用于常规输血前配伍测试,包括血型、意外抗体筛查和鉴定、扩展表型和交叉匹配测试等。 |
|
|
||
BLOODChip ID/IDCoreXT/IDHPAXT/IDRHDXT/IDCORE控盘/BIDSXT.基于Luminex技术的多重血型基因分型系列产品,包括红细胞主要等位基因变异株试剂盒、人血小板抗原、ID CORE阳性对照XT,以及一个随附的软件。 |
用于帮助确定由于近期输血、自身抗体或其他限制可能无法使用传统血型方法进行分型的个体的血型。 |
|
抗原。某些传染病检测的关键组成部分。 |
用于制造临床诊断和献血者筛查免疫分析。 |
|
临床和专科诊断: |
||
Promonitor®.高特异性免疫测定法,用于测定各种生物药的血清药物水平和抗药物抗体。 |
用于测量多种生物药物的药物和抗体数量,常用于各种炎症性疾病的治疗。 |
|
AlphaIDTM.α-1缺乏症患者的基因检测。 |
这是一种免费的面颊拭子,用于筛查慢性阻塞性肺疾病(“COPD”)最常见的遗传形式alpha-1。 |
我们在西班牙的Parets工厂生产大部分凝胶卡和红细胞,并组装我们的免疫血液分析仪。我们还在澳大利亚生产凝胶卡,在瑞士生产红血球。我们在美国埃默里维尔工厂生产抗原,而用于血液和血浆传染病筛查的转录介导扩增NAT试剂盒的oligos和其他关键成分则在美国圣地亚哥工厂生产。我们还预计将于2025年开始在我们的圣地亚哥工厂生产凝胶卡,并在2025年底或2026年初开始生产红血球,这取决于监管部门的批准。
在几个国家,我们分销BLOODChip®由我们的子公司Progenika BioPharma,S.A.(“Progenika”)制造的血型基因分型测试。该产品线包括测定37种红血球基团抗原的ID CORE XT、检测最相关的RHD变异的分子诊断试剂盒ID RHD XT、测定12种人血小板抗原(“HPA”)系统的HPA-1和ID HPAXT试剂盒。BIDSXT是允许分析、解释和数据库管理将结果传输到实验室信息系统(“LIS”)的软件工具。
我们的许多诊断业务部门产品的生产、营销和销售须事先向适用司法管辖区的有关当局进行此类产品的登记。截至2024年12月31日,我们在欧洲、美国、加拿大、拉丁美洲、亚太、中东和非洲的50多个国家注册了3643个诊断产品许可证。除了上述产品外,我们还为客户提供与第三方合作开发或由第三方制造的解决方案,我们认为这些解决方案补充了我们的产品线。
我们的诊断业务部门包括一整套产品和系统,以进行献血者筛查分子检测,旨在检测输血相关传染病的病原体,如HIV(1型和2型)、甲型肝炎、乙型肝炎、丙型肝炎、戊型肝炎、细小病毒B19、疟原虫、巴贝西亚和虫媒病毒,如基孔肯雅热、西尼罗河病毒、登革热和寨卡病毒。
57
输血医学最近的努力
作为我们地域扩张战略的一部分,我们继续考虑在各国发展卫生系统时将血液和血浆捐赠纳入NAT筛查的请求。从2020年到2024年,我们进入了几个新的国家,如危地马拉、巴拉圭和捷克共和国。近年来,我们专注于获得FDA和其他监管机构的批准,以扩大我们的产品组合。下表总结了最近的这些努力:
产品说明及主要应用 |
|
许可更新 |
|
Procleix质量控制,旨在用作外部化验质量控制材料,以监测在Procleix上进行的多项化验的性能®黑豹®系统。 |
2022年FDA 510(k)批准。 |
||
Procleix®Plasmodium Assay,用于Procleix Panther系统,巴西。 |
2023年在巴西获得批准。 |
通过我们在美国的子公司Biomat USA和Interstate Blood Bank Inc.,我们与美国的非营利性献血者检测实验室组织Creative Testing Solutions(“CTS”)签订了一项协议。根据这项协议,自2022年4月1日起,CTS开始运营为期十年(最多可再生十年)的我们位于田纳西州孟菲斯和德克萨斯州圣马科斯和奥斯汀的三个检测实验室,以进行血液和血浆采集的供者筛查。Grifols实验室解决方案将继续提供专业测试,包括过程中和最终产品测试,以及与分子和血清学免疫血液学相关的临床问题的诊断解决方案。这家位于德克萨斯州奥斯汀的设施提供检测、咨询和综合解决方案,以优化血液学、肿瘤学、围产学、产科、药剂学、移植和输血医学领域专家的患者护理。
58
我们经营一条高质量抗原产品线,这些产品是通过与Quidel Ortho的联合业务生产的,在全球范围内销售的临床诊断和血液筛查免疫分析测试的关键组成部分。作为这项联合业务的一部分,我们与雅培签订了一份合同,供应用于制造免疫分析诊断的高质量抗原。这份总价值约为7.00亿美元的合同将抗原供应延长至2026年,确保了这一领域更高水平的经常性收入。我们还与OraSure Technologies有一项长期协议,该协议自2005年起生效(目前有效期至2026年),据此我们向OraSure Technologies的抗体测试系列提供抗原。下表总结了我们最近为获得更多许可和增加我们的免疫血液学产品市场所做的努力:
免疫血液学产品说明及主要应用 |
|
许可更新 |
血型管理器,旨在协助免疫血液学仪器、血液建立计算机软件和实验室信息系统之间的数据接口和管理,作为DG Gel的一部分®系统。 |
2022年CE标志;2022年FDA 510(k)批准;2023年巴西批准。 |
|
Grifols SCD38,旨在对抗达雷妥姆介导的泛反应性,而不会显着稀释患者的血浆,并能够随后筛查和鉴定DG凝胶中的不规则抗体®系统和管技术,以及DG凝胶中的交叉匹配®系统。达雷妥单抗是一种CD38靶向单抗,用于治疗多发性骨髓瘤。然而,在治疗期间,该药物与红细胞上的CD38蛋白结合,可以改变关键输血前测试的结果。这会耽误这些患者的救命输血。 |
2022年CE标志。 |
|
DG凝胶®8 Direct Coombs卡,用于评估两种不同人体血液样本的直接抗球蛋白检测。本品设计用于分化IgG型免疫球蛋白或补体C3d组分在体内致敏的红细胞。该卡打算与DG Gel一起使用®系统。 |
2022年BLA批准。 |
|
DG凝胶®DC Scan Plus,拟用于直接抗球蛋白试验评价的凝胶技术。该试验允许在人体血液样本中通过IGG、IGA和IGM型免疫球蛋白和/或与补体C3b、C3d和C4b组分进行体内致敏的红细胞分化。DG凝胶®DC Scan Plus卡意在调查已确定或疑似存在溶血的临床情况,以区分免疫性和非免疫性溶血性贫血。该卡可以手动使用,也可以与DG Gel的自动化仪器一起使用®系统。 |
2022年CE标志;2023年巴西批准;2023年澳大利亚批准。 |
|
血清-细胞池DIA 0.8%,设计用于常规检测,用于在供体中筛查不规则抗体,包括抗原DIA。 这种试剂补充了现有的试剂红细胞,使我们能够加强我们在市场上的存在,例如巴西,当地法规要求对抗原DIA进行鉴定。 |
2022年CE标志;2023年巴西批准。 |
|
DG Reader NET,一个使用与我们的全自动系统相同的耗材和试剂操作的单卡处理平台。这款产品设计用于我们的DG凝胶上®系统。 |
2016年CE标志;2018年FDA 510(k)批准;2023年中国批准。 |
59
以下是我们诊断业务部门产品方面的主要最新发展:
| ● | 我们在中国市场获得了DG Reader Net的注册,这是我们的半自动化血库系统,用于处理DG凝胶卡和Erytra Eflexis,这是我们的旗舰全自动血型平台; |
| ● | 我们获得了用于虫媒病毒筛查的Procleix ArboPlex Assay 4-in-1 NAT的CE标志。这项检测是一项体外核酸检测,检测通过蚊子载体传播的四种虫媒病毒:基孔肯雅热、登革热、西尼罗河病毒和寨卡病毒。虫媒病毒是一个日益严重的威胁,随着气候变化和全球连通性的增加,地理传播更加普遍。这是专为筛选虫媒病毒而设计的酸性核酸检测在IVDR下的首个CE标志; |
| ● | 我们在2022年获得了CE标志,目前正致力于在美国获得批准,为Procleix®Plasmodium Assay,一种检测导致疟疾疾病的全血标本中来自疟原虫物种(P. falciparum、P. knowlesi、P. malariae、P. ovale和P. vax)的核糖核酸(“RNA”)的检测方法。该检测旨在用于Procleix上血库的常规筛查®黑豹®system,我们估计我们目前是市场领导者,并继续努力为血库提供创新解决方案。 |
临床和专科诊断
我们保留了第一个FDA批准的生物分子测试,该测试使用患者的DNA进行诊断。这种检测α-1抗胰蛋白酶缺乏症的基因检测(“A1AT基因分型检测”)可以对从血液中提取的DNA以及在纸上采集的一滴血(“干血斑”)或作为口腔拭子采集的人类唾液样本进行。这项测试是由Progenika开发的。2022年,A1AT基因分型检测也获得CE标志。尽管非常复杂,但该测试的设计使任何分子生物学实验室都可以在最少的人工干预下进行处理。
AlphaID™,我们的面颊拭子大大简化了样本采集过程,允许医生和医疗保健提供者获得足够的口服样本用于alpha-1筛查,而无需订购实验室结果。该测试自2019年起在美国推出。我们的子公司Progenika开发了一项名为“AlphaID™在家遗传健康风险服务”,直接向家庭提供针对潜在的α-1抗胰蛋白酶缺乏症患者的诊断解决方案。自2022年获得FDA批准以来,这个复杂的多学科项目汇集了以Progenika为首的六家国际公司。
通过子公司Progenika,我们使用下一代测序技术(“NGS”)制造家族性高胆固醇血症(“FH”)的基因诊断测试。诊断业务部门继续努力拓宽Promonitor®line,用于监测生物药物,因为在智利的销售仍在继续,选择欧盟国家、澳大利亚和美国Promonitor®产品线包括同样由Progenika开发的ELISA(酶联免疫吸收剂测定)装置线,用于监测正在接受类风湿性关节炎和其他慢性炎症性疾病生物药物治疗的患者。我们在Promonitor中维持两个额外测试的CE标记®能用生物制品戈利木单抗进行治疗的家族,以及允许使用单一稀释剂来测量药物和抗体数量的几种生物药,通常用于治疗各种炎症性疾病,如类风湿性关节炎和溃疡性结肠炎。Progenika还与DIESSE Diagnostica Senese共同开发了Chorus Promonitor,这是对Promonitor的改编®DIESSE的合唱分析仪的ELISA试剂盒。这种对单调测试和即用即用设备的适配旨在满足客户和市场对改进自动化的需求。Chorus Promonitor有助于改进测试工作流程,从而为临床医生带来更早的反馈。
根据与AESKU Diagnostics GmbH & Co.(“AESKU”)的独家协议,我们在智利、葡萄牙、西班牙和墨西哥分销自身免疫诊断产品。
生物用品业务部门
生物用品业务部门为生物技术行业提供人类生物材料,旨在用于研究、临床试验以及制造药物和诊断产品。大多数材料和产品来自我们的垂直一体化制造流程(内部生产)的收集中心。生物用品业务部门占2.157亿欧元,占我们2024年总净营收的3.0%。
60
我们的生物用品业务部门的产品涵盖了对基于人的生物材料的需求无法被其他类型的产品所取代的广泛应用,例如:
| ● | 细胞疗法:提供基于人的细胞培养补充剂、血浆蛋白、白细胞单采(通过单采获得并用于开发新的细胞疗法的白细胞浓缩物)。 |
| ● | 医药制造业:用作辅料的人基血浆蛋白(即作为药物载体或介质的非活性物质或制造治疗药物中的其他活性物质)。用于制造血浆衍生药物的人血浆和中间体。 |
| ● | 诊断制造:用于制造用于体外诊断测试的质量控制和校准器的人体血细胞、蛋白质、血浆和血清。 |
| ● | 生命科学研究:用于生命科学基础研究或由体外诊断公司开发和验证其分析测定的人类血液衍生产品和生物标本。 |
我们的生物用品业务部门也向第三方进行血浆销售。
其他活动和业务(“其他”)
“其他”代表运营和活动,包括向第三方提供制造服务和第三方血浆销售,以及由Grifols集团制造的用于医院药房的医药产品。
随着2022年7月出售Goetech,LLC的几乎所有资产,该公司以Medkeeper(“Medkeeper”)的名义开展业务,我们以前的“医院部门”的活动显着减少,这导致我们将这些活动和相关产品重新分配到一个更小的业务线,名为医疗保健解决方案(“医疗保健解决方案”),该业务线也被记为其他。其他公司占我们2024年总净营收的2.092亿欧元,即2.9%。见第一部分第5项,“运营和财务审查与前景——影响我们的财务状况和运营结果的因素——近期处置—— MedKeeper。”
医疗保健解决方案业务线提供服务并制造医院、血库、血浆采集中心和其他医疗保健系统使用的产品。这些产品包括肠外解决方案、机器人和软件,以及我们营销的第三方产品,以补充我们制造的产品。
研究与开发
研发是我们业务的一个重要方面。我们的主要研发目标是(i)发现和开发新产品,(ii)研究现有产品的新应用,以及(iii)改进我们的制造工艺以提高产量、安全性和效率。2022年研发支出为3.611亿欧元,2023年为3.953亿欧元,2024年为3.82亿欧元。
2024年12月31日,我们有大约17亿欧元的金额作为正在进行的开发成本(而2023年12月31日为14亿欧元)。这包括(1)从Alkahest获得的用于神经退行性疾病、神经肌肉疾病和眼科疾病的产品的正在进行的研发项目中的金额为3.024亿欧元;(2)从Biotest获得的血浆疗法(纤维蛋白原和三调素)的正在进行的研发项目中的金额为8.788亿欧元。见本年度报告所载我们经审计的综合财务报表附注7。
61
此外,截至2024年12月31日,我们拥有1260名致力于研发的科学家和支持人员。
我们有几十年的成功创新历史。例如,我们开发了一种独特的分馏设计,可降低污染风险和维护成本,并提高每升血浆提取的产品量。我们还开发了第一台用于自动化清洗血细胞的离心机组。此外,我们是首批对VIII因子进行双重病毒灭活过程的血浆分馏器之一,并且设计并实施了一种用于小瓶无菌灌装的新过程,与其他现有过程相比,该过程减少了潜在污染物的暴露。此外,我们还为我们的IG、α-1 PI和ATIII产品开发了一种病毒灭活的纳滤方法。
我们的重点治疗研究领域集中在免疫学、肝病学和重症监护、肺病学、血液学、神经病学和传染病。我们在这些治疗领域的下一个创新将超越血浆衍生蛋白,因为我们为提高研发能力而进行的重大投资使我们能够开发一类新的重组抗体和小分子候选药物。
生物制药倡议
我们的生物制药业务部门有多个研发项目正在进行中,其中15个处于临床开发阶段。下表反映了截至最近三年末我们生物制药业务部门按开发阶段划分的研发项目总数。
截至12月31日, |
||||||
开发阶段 |
|
2024 |
|
2023 |
|
2022 |
发现 |
|
19 |
|
24 |
|
19 |
临床前 |
|
32 |
|
23 |
|
28 |
临床 |
|
15 |
|
22 |
|
23 |
后商业化研究 |
|
6 |
|
14 |
|
39 |
其余项目 |
|
10 |
|
16 |
|
14 |
Total Biopharma研发项目 |
|
82 |
|
99 |
|
123 |
62
下表列出了我们最重要的研发项目:
产品候选者 |
|
治疗性 |
|
产品 |
|
潜在用途 |
|
开发阶段 |
Xembify® |
|
免疫学 |
|
血浆衍生 |
|
慢性淋巴性白血病、多发性骨髓瘤和非霍奇金淋巴瘤的继发性免疫缺陷 |
|
三期(目前正在开展的临床试验方案) |
Alpha-1蛋白酶抑制剂 |
肺科 |
血浆衍生 |
先天不足所致肺气肿 |
I/II期(目前正在开展的皮下给药临床试验方案)。 IV期美国/III期欧盟(目前正在进行的静脉给药临床试验方案) |
||||
纤维蛋白密封胶 |
|
手术出血 |
|
血浆衍生 |
|
血管、器官和软组织手术 |
|
2019年在美国推出,2020年在欧盟推出。上市后儿科临床试验完成。欧盟已批准,英国和美国已批准。 |
免疫球蛋白 |
眼科 |
血浆衍生 |
干眼症 |
临床前开发 |
||||
纤维蛋白原 |
血液学 |
血浆衍生 |
先天不足&严重低纤蛋白原/后天缺乏 |
III期(目前正在监管审查中的临床试验方案) |
||||
三调素 |
传染病 |
血浆衍生 |
重症社区获得性肺炎(“SCAP”) |
三期(目前正在开展的临床试验方案) |
63
Xembify®– CLL的继发性免疫缺陷。本次临床试验(NCT05645107)的主要目的是获得Xembify的适应症®慢性淋巴细胞白血病(“CLL”)、多发性骨髓瘤(MM)和非霍金淋巴瘤(“NHL”)导致的继发性免疫缺陷。CLL是西方国家老年人中最常见的白血病,确诊时的平均年龄为72岁。该病的特点是在外周血、骨髓、次生淋巴器官中积累单克隆、成熟、CD5 + B细胞。CLL患者感染风险增加,反复或严重感染是CLL患者发病和死亡的主要原因,在这一人群中造成30%至50%的死亡。MM是第二大最常见的血液恶性肿瘤,在美国和欧洲,估计每年发病率分别为7.1和4.5至6.0例/10万人。一般来说,MM在65岁至74岁的患者中经常被诊断。MM是一种克隆性疾病,其特征是恶性成熟浆细胞在骨髓中积累(有时还伴有髓外受累)并产生一种异常的单克隆副蛋白,名为M蛋白。NHL代表了一组不同生物学和预后的异质恶性肿瘤。NHL包括许多亚型,每个亚型都有不同的流行病学;病因;形态学、免疫表型、遗传和临床特征;以及对治疗的反应。这些肿瘤起源于淋巴组织,主要是淋巴结。目前的证据表明,CLL、MM和NHL等B细胞淋巴组织增生性疾病的二次抗体缺乏导致的低丙种球蛋白血症易导致患者因患者的基础疾病或其癌症而发生严重感染。该3期临床试验目前正在美国和欧洲国家招募患者,以支持FDA在美国提交。
Alpha-1蛋白酶抑制剂–先天不足导致的肺气肿。SPARTA(Prolastin的研究®-C随机治疗与Alpha-1增强;NCT01983241),我们的4期(美国)/3期(欧盟)临床试验,旨在确定α-1-抗胰蛋白酶缺乏症(AATD)(α-1)肺气肿患者在每周接受两种不同剂量方案静脉注射(IV)Grifols Prolastin治疗时,肺组织损失的进展是否较慢®-C Alpha-1,是一种未得到充分诊断的遗传性疾病,可导致慢性阻塞性肺疾病(COPD),这是一组呼吸道疾病,其中包括肺气肿,当患者的AAT水平较低时可能会发生这种疾病,TERM0是一种保护肺部的保护性蛋白。目前批准的剂量为每周静脉输液60mg/kg。SPARTA是迄今为止规模最大的AAT增强疗法随机、双盲、安慰剂对照研究,旨在评估Prolastin的潜力®-C与安慰剂相比,通过每周给予两种有效剂量水平来提高AAT蛋白水平,从而显着降低alpha-1患者的肺气肿进展。该临床试验正在16个国家和50多个地点进行。它将评估两种不同剂量的Prolastin方案的疗效和安全性®-C(60和120mg/kg/周)对比安慰剂156周(即三年),通过全肺计算机断层扫描(CT)密度测定测量肺-组织损失率作为临床疗效的首要衡量标准。
我们还在进行一项I/II期研究(NCT04722887),评估Alpha1-蛋白酶抑制剂皮下(人)15%(Alpha-1 15%),这是一种皮下(SC)AAT治疗,正在与液体Alpha1-蛋白酶抑制剂(人)IV进行比较。这种治疗α 1-抗胰蛋白酶缺乏症的首个人体SC方法,如果在临床试验中被证明是成功的,可以为患者提供在家给药的便利和灵活性。在这项为期八周的多中心、单剂量和重复剂量研究中,Grifols 1/2期研究GC2008的队列1已完成,并证明Alpha-1 15%没有任何安全问题会阻止该研究进入队列2。目前还没有用于增强AAT的SC选项,在这项针对Alpha-1患者的首次人体研究中评估SC给药选项,在管理他们的AAT缺陷方面可能会提供更多自由,允许患者在家中舒适地给药。到2025年2月,完成队列2入组。该组参与者正在接受更高剂量的180mg/kg SC Alpha-1 15%。该队列的最后一次患者就诊预计将在2025年夏末进行。
纤维蛋白密封胶。我们于2008年开始对使用纤维蛋白密封胶作为支持治疗改善血管、器官和软组织手术止血的安全性和有效性进行临床试验。2014年,我们在欧盟完成了将纤维蛋白密封胶用于血管外科的临床试验。另外进行了三项临床试验:(i)在美国进行的关于在实体器官手术中使用纤维蛋白密封剂的III期临床试验;(ii)在美国进行的关于在软组织手术中使用纤维蛋白密封剂的III期临床试验;以及(iii)在美国进行的关于在血管手术中使用纤维蛋白密封剂的III期临床试验。美国所有的纤维蛋白密封剂临床试验都在2015年完成。于2017年11月收到FDA和EMA的上市许可批件。与第三方达成分销协议,需要额外的监管补充。心梗®于2019年在美国推出,Veraseal®于2020年在欧盟推出。此外,一项评估纤维蛋白密封剂作为儿科受试者手术期间止血辅助手段的安全性和有效性的IV期研究已于2022年完成,以支持FDA和EMA监管许可。截至2024年12月31日,我们已获得欧盟、英国和美国的批准。
64
免疫球蛋白。2023年,我们与眼科疾病治疗的先驱开发商Selagine签订了全球合作和许可协议,以探索免疫球蛋白滴眼液治疗干眼病(DED)的潜力,这是一种在2023年影响全球超过1亿人的病理。在一项试点I/II期临床试验中,受试者使用基于Grifols Flebogamma DIF的滴眼液治疗®每日两次,持续八周,确保DED的体征和症状明显减少,耐受性或不良事件无差异。几种不同的炎症来源,包括蛋白质(细胞因子或趋化因子)、细胞(中性粒细胞、T细胞和树突状细胞)和病原性抗体,在DED中存在于眼表面,并有助于其体征和症状,这可能受益于应用免疫球蛋白。我们在2023年9月完成了关于这种免疫球蛋白的FDA pre-IND会议。我们目前正在使用Flebogamma DIF进行临床前开发®5%用于治疗DED,预计2025年转入II期临床试验。
纤维蛋白原。AdFIRST研究是一项前瞻性、主动对照、多中心III期研究,旨在调查纤维蛋白原浓缩物BT524在获得性纤维蛋白原缺乏症(“AFD”)患者中的疗效和安全性,这种情况通常发生在手术过程中,当纤维蛋白原不足以止血时。计划脊柱和腹部手术期间失血量高的患者按1:1随机分配接受BT524或FFP/冷沉淀治疗。为了评估疗效,将两种治疗方案之间的进一步失血进行比较。这项研究是与五个欧洲国家的十个研究地点合作进行的,于2023年9月结束。AdFirst研究在2024年2月达到了主要终点,证明纤维蛋白原浓缩物BT524在治疗AFD方面与目前针对这种情况的护理标准一样有效。该浓缩液可减少接受计划的主要脊柱或腹部手术的AFD患者的术中失血。
2024年,我们在欧洲和美国启动了BT524精矿的监管授权程序。我们在纤维蛋白原生产工艺方面拥有重要专利。
三调素。研究996:这项多国III期临床试验计划招募约590名需要有创机械通气的重症sCAP(社区获得性肺炎)成人住院患者。ESCAPE试验将在全球范围内进行,患者将接受曲莫杜林或安慰剂治疗,作为标准护理的附加疗法。
这项前瞻性、双盲、安慰剂对照的III期试验的临床概念是基于之前的II期临床试验(“CIGMA”)的有希望的结果而制定的,该试验涉及160名需要有创机械通气的SCAP患者。在CIGMA试验中,有严重炎症迹象的患者亚组在使用三调素治疗时,通过炎症的快速正常化显示出令人鼓舞的死亡率降低。该试验目前正在包括美国在内的多达20个国家进行,并正在招募患者。
过去三年开展的其他生物制药研发项目包括:
2024:
| ● | Gamunex和Xembify的新容器封闭系统; |
| ● | 提高整个制造设施的IGG产量的工艺优化; |
| ● | 新制造设施的投产和正在进行的制造优化; |
| ● | 开发一种改进工艺,为制造Rho-D提供更高的产品安全性和良率;和 |
| ● | 用于制造Plasmanate的改良工艺的开发。 |
2023:
| ● | 提高整个制造设施的IGG产量的工艺优化; |
| ● | 开发改进工艺,为制造Rho-D提供更高的产品安全性和良率; |
| ● | 制造Plasmanate的改良工艺的开发;和 |
65
| ● | 向我们的子公司Grifols Canada Plasma,Inc.(原名Prometic Plasma Resources,Inc.)转让白蛋白工艺; |
2022:
| ● | 用于白蛋白的新型容器封闭系统®和XMIBify预充式注射器; |
| ● | 评估Flebogamma新适应症的临床方案®DIF5 %; |
| ● | A1PI。新的小瓶尺寸的Prolastin®正在开发中,提供制造效率的重要进步以及改善患者便利性;和 |
| ● | 评价人血白蛋白长期给药对晚期肝硬化腹水患者心血管、肝肾功能影响的临床研究。 |
所有临床试验都涉及风险和不确定性。临床前和临床测试费用昂贵,难以设计和实施,可能需要多年才能完成,并且不确定结果。我们的一项或多项临床试验失败可能发生在测试的任何阶段。我们可能会在临床前测试和临床试验过程期间或由于这些过程而经历许多不可预见的事件,这些事件可能会延迟或阻止我们获得监管批准或将我们的候选产品商业化的能力。关于这些不可预见事件的讨论,见第一部分第3项,“关键信息—— D.风险因素——与公司和我们的业务相关的风险——我们可能无法将正在开发中的产品商业化。”在每个发展阶段完成后,我们评估与追求的目标相比所取得的成果。以上列出的每一个关键项目在不同发展阶段的结果方面都达到了我们的期望,我们期望每一个项目的发展进程都能向前推进。
我们相信,我们目前的流动资金足以通过完成上述关键项目以及我们的其他研发计划为我们的持续成本提供资金。
诊断倡议
诊断事业部研发支持各业务领域,包括输血医学、临床诊断、重组蛋白业务等。诊断业务部门专注于开发用于供体筛查的体外诊断试剂/分析、仪器和软件,其中包括确保安全性的病原体检测和确定供体/受体血液相容性的血型检测。在这里,研发重点关注为新出现的病原体开发新的分析方法、增加多重测试能力(在单个反应中同时检测几种分析物)以及改进的自动化解决方案的机会,以便为客户提高效率和通量。诊断业务部门还开发用于临床诊断的产品,包括神经病学和肿瘤学领域的下一代免疫分析平台,以及涵盖传染病的下一代分子检测平台。
研发团队采用了多样化的技术组合,包括转录介导的扩增(“TMA”)、聚合酶链式反应(“PCR”)、用于分子测定的下一代测序(“NGS”)、使用红细胞(“RBC”)的基于免疫学的方法以及凝集。我们还利用超灵敏单分子计数检测技术开发新的免疫分析,以及快速PCR技术开发下一代分子分析。我们继续研发新的重组蛋白、抗体和酶作为关键原材料,以支持传染病、神经退行性疾病和免疫血液学等各个领域的内外部诊断客户。我们的诊断研发团队继续评估新技术和研究工具,包括人工智能(AI),以评估它们在提高我们的竞争优势和融入我们的开发组合方面的潜力。
66
2022年,诊断事业部根据IVD新规2017/746在试剂、化验和软件方面的17项免疫血液学产品获得CE标志,此外还实现了用于解决daratumumab干扰血型的新试剂盒的IVD CE标志。在欧洲,我们的诊断业务部门还获得了IVDD下Procleix Plasmodium的CE标志和IVDR下新的改进试剂平衡系统的CE标志。在美国,我们通过510(k)流程(这意味着FDA与制造商同意医疗设备类似于先前批准的产品)获得FDA许可,用于新的Procleix质量控制,同时发布了新版本的Pooler软件。诊断业务部门还为现有的几个A类产品实现了更新的CE标志,以将这些从IVDD法规过渡到IVDR法规。
2023年,诊断业务部门继续为我们的免疫血液学产品线发布创新产品,包括整个平台产品组合的新软件版本,以提高我们客户的效率和生产力。我们在美国推出了我们的BTM中间件,同时我们的旗舰血型平台EFlexis也在中国获得了监管批准,以扩大我们的地理足迹。我们还推出了DC Scan Plus,这是一种在IVDR监管下的新DG凝胶测试,它将特异性扩展到常规分析物之外,并通过提高灵敏度和特异性来改善患者护理,从而改善供体筛查领域的临床患者管理和结果。我们还发布了我们的Pooler软件的新版本,以及促进测试实验室提高自动化和易用性的软件。此外,我们在美国推出了首个免费直接面向消费者的计划(包括创新和复杂的基因分型测试和服务),用于筛查α 1-抗胰蛋白酶缺乏症(Alpha-1)的遗传风险。
2024年,诊断业务部门继续开发并向市场推出新的高多重供体筛查解决方案,以推动效率提高并应对输血传播疾病的发展趋势。该团队获得了Procleix ArboPlex检测的CE标志批准,该检测四种虫媒病毒:基孔肯雅病毒RNA、登革热病毒RNA、西尼罗河病毒RNA和寨卡病毒RNA。该团队还完成了Ultrioplex W检测的美国临床试验,该检测可检测HIV-1、HIV-2、丙型肝炎病毒(“HCV”)、乙型肝炎病毒(“HBV”)和西尼罗河病毒(“WNV”)。此外,我们完成了Procleix Plasmodium检测的美国临床试验,并开发了一种仅供研究使用(“RUO”)的检测方法,用于筛查伴有血小板减少综合征病毒(“SFTSV”)的严重发热,以努力解决即将出现的新病原体。我们还在开发新的软件,以支持Procleix供体筛查平台上的新检测产品,并为我们的供体筛查客户提高中间件解决方案的效率和生产力。在血型领域,Diagnostics业务部门推进了下一代血型平台的开发,为美国启动了具有扩展表型分析的自动化抗血清程序的开发,并在整个仪器组合中推出了多个创新软件版本,包括Eflexis上的自动化滴定方法——所有这些目标都是为我们的客户提高效率和生产力。此外,我们为抗CD38抗体治疗患者提供的创新血型干扰解决方案2024年在欧洲的商业成功推动了该解决方案未来扩展到美国市场的追求。
2024年,诊断业务部门申请了超过16项新专利,涵盖物质组成、方法和设备,进一步扩大了我们在分子检测、传染病、血型分析、临床诊断领域的知识产权组合和竞争地位。
其他倡议
通过我们的子公司Araclon Biotech,S.L.(“Araclon”),我们致力于寻找解决方案,促进阿尔茨海默病的新诊断和治疗方法,以应用于疾病的早期阶段。Araclon正致力于验证早期诊断测试和开发疫苗(ABvac40),以对抗无症状阶段的阿尔茨海默病。疫苗已通过动物实验阶段,完成1、2期临床试验。
ABVAC40的2期试验于2018年启动,于2023年结束,显示出积极的结果。ABvac40具有良好的安全性,刺激了针对A β 40肽的强大免疫反应,并在早期AD患者中展示了潜在的认知益处,达到了主要终点。尽管该试验并非旨在评估神经心理量表的疗效,但我们在ABVAC40治疗组和安慰剂组之间的次要终点上观察到了有希望的结果。2024年的事后分析表明,淀粉样蛋白沉积患者获益更大,微型精神状态检查(“MMSE”)量表显着下降的病例更少,尤其是在顶级反应者中。我们注意到与安慰剂相比,ABVAC40治疗患者的新发脑微出血发生率更低。我们正在准备2025年发表的关键成果。
67
通过我们的子公司Alkahest,我们专注于识别随着年龄以及随着具有生物学影响的疾病的发生而变化的蛋白质。迄今为止,Alkahest已经在细胞水平上使用先进的分子分析技术鉴定了超过10,000种不同的蛋白质,其中一些我们进入了我们的发现和开发管道,作为治疗衰老疾病的新靶点。2024年,Alkahest转向早期发现工作,推进Chronos PD,这是一个目标蛋白质组平台,可以在疾病表现出表型之前对其进行检测。Chronos PD从帕金森病开始,计划转移到其他疾病领域。
我们的子公司GigaGen Inc.(“GigaGen”)正在开发一类新型疗法,即重组多克隆抗体,以解决传染病方面未满足的需求。2024年,GigaGen在一项1期临床试验中为首位患者给药,以评估GIGA-2339的安全性和耐受性,GIGA-2339是该公司首个用于治疗乙型肝炎病毒(HBV)感染的重组多克隆抗体候选者,在其作为研究性新药(IND)获得FDA批准后。GIGA-2339包括1000多个靶向HBV的重组人抗体,以模拟人体的自然免疫反应,具有消除病毒和激活免疫系统的潜力。HBV目前尚无治愈方法,全球范围内有超过2.96亿人受到影响,每年导致超过80万人死亡。此外,2024年5月,GigaGen宣布与美国国家癌症研究所合作,在评估其抗CTLA-4单克隆抗体GIGA-564用于治疗转移性或局部晚期实体瘤的安全性和耐受性的1期临床试验中进行首例患者给药。
2024年,我们与隶属于美国卫生与公众服务部的生物医学高级研究与发展局(“BARDA”)启动了战略合作伙伴关系,以评估眼表免疫球蛋白(“OSIG”)滴眼液治疗硫芥引起的眼部损伤的非临床疗效。这项概念验证研究旨在评估OSIG的抗炎和免疫调节潜力,以中和暴露于硫芥菜的长期影响——硫芥菜是一种已知会导致使人衰弱的角膜损伤的化学战剂。正在研究的OSIG疗法正在从针对干眼病(“DED”)的正在进行的开发计划中重新调整用途,计划于2025年开始进行2期临床试验。这一举措代表着将我们的IG平台应用扩展到眼科和生物防御领域的重要一步。
在2024年期间,由于适用协议的终止以及在研发资源向更高优先项目进行战略调整后,我们停止了我们与安道尔政府合资持有的Grifols Pyrenees研究中心,SL,以及AlbaJuna Therapeutics S.L倡议和Trimodulin研究1,001。停产没有,预计也不会对我们的财务状况或长期增长战略产生实质性影响。
季节性
我们的业务没有受到季节性趋势的明显影响。
原材料
血浆是我们用来制造产品和疗法的关键原材料。我们的血浆主要来自我们位于美国和欧洲(德国、奥地利、捷克共和国和匈牙利)的血浆采集中心网络,在较小程度上来自第三方供应商。见“—主要活动—生物制药事业部—血浆采购。”我们依赖健康的个人捐赠人类血浆来开发和制造我们的产品。因此,我们获得血浆的成本可能会有所不同,这取决于捐赠者访问我们的血浆采集中心的能力以及我们为血浆捐赠支付的补偿。例如,在冠状病毒大流行期间,封锁和限制行动,特别是美国与墨西哥的边境关闭,直接影响了我们获得血浆捐赠的能力。见第一部分第3项,“D.风险因素——与公司和我们业务相关的风险——我们的血浆供应出现重大中断,包括由于宏观经济条件、流行病或移民政策和执法的变化,可能对我们的业务和我们的增长计划产生重大不利影响。”
68
与2023年收集的数量相比,我们的血浆供应在2024年保持稳定,验证了2023年期间实施的战略措施的有效性,以提高血浆收集和制造效率,加强财务管理,并执行我们的运营改进计划(定义见第一部分第5项,“A.运营结果——影响我们的财务状况和运营结果的因素——运营改进计划”)。
同样,与2023年的平均每升成本相比,我们在2024年采集的每升血浆的平均成本下降了4.4%。这一减少主要是由于捐助者补偿减少、捐助者中心业务有所改善以及每笔捐款的收益最大化。
我们密切监测、持续审查和修订我们产品的供应采购策略,以及时识别我们供应链中的任何风险,包括由于我们依赖与第三方供应商的外包制造关系而产生的风险。如有必要,我们会战略性地管理关键材料或成品的库存水平,以应对与运营和质量问题、产能和单一采购等相关的潜在风险。我们还继续监测我们的血浆采集平台的效率,并将我们所有的血浆检测集中到位于德克萨斯州奥斯汀和圣马科斯、田纳西州孟菲斯、佛罗里达州博卡拉顿、德国莱比锡和西班牙帕雷茨的六个实验室。
我们的长期目标是通过开发新的和差异化的血浆衍生疗法,以及通过收购和新建项目扩大我们的全球血浆采集足迹,进一步加强我们的领导地位,如下所述;
| ● | 2025年2月完成从ImmunoTek收购美国28家单采血浆中心。此次收购是在2021年7月29日发起的,当时我们与ImmunoTek签订了一份协议,该协议于2023年和2024年进行了修订,以安排28个中心的建设、许可和调试。根据该协议,我们成立了ITK JV,这是一家联合运营公司,通过该公司,我们最初持有28个单采血浆中心各75%的权益,而ImmunoTek持有剩余的25%。2024年,我们以2.65亿美元的总金额收购了14个血浆采集中心,自2025年2月3日起,我们完成了对剩余14个中心的收购,总金额约为2.813亿美元。见第一部分“经营和财务审查与前景—— A.经营成果——后续事件”和“经营和财务审查与前景—— A.经营成果——影响我们的财务状况和经营成果的因素——最近的收购”项目5。 |
| ● | 于2022年4月25日,我们向Tiancheng International Investment Limited(“TIIL”)收购Biotest Holdings的所有现有股权,并接受TIIL授予Biotest Holdings的若干股东贷款的转让。Biotest Holdings进而拥有Biotest AG 89.88%的普通股和1.08%的优先股,Biotest AG是一家供应血浆蛋白产品和生物治疗药物的全球公司,这使我们能够进入另外28个血浆采集中心。见第一部分第5项,“经营和财务审查与前景—— A.经营成果——影响我们财务状况和经营成果的因素——收购—— Biotest AG收购。” |
| ● | 2021年3月31日,我们从Kedplasma,LLC收购了七家美国的血浆捐赠中心,收购总价为5520万美元。 |
| ● | 2021年2月28日,我们通过资产出售协议以3.85亿美元的价格从BPL Plasma Inc收购了25家美国的血浆中心。见第一部分第5项,“经营和财务回顾与前景—— A.经营成果——影响我们财务状况和经营成果的因素——收购。” |
| ● | 2020年10月,我们从GC Pharma购买了位于美国的11个采集中心,以及位于加拿大蒙特利尔的一个血浆分馏设施和两个净化设施,总对价为4.57亿美元,无债务基础上。 |
| ● | 2019年4月,我们在美国收购了26家血浆采集中心和10家献血中心,作为我们收购州际血库集团(Interstate Blood Bank,Inc.,Bio-Blood Components,Inc.和Plasma Biological Services,LLC)100%股权的一部分,该集团已并入我们的子公司Grifols Bio Supplies,Inc.。 |
69
| ● | 于2018年12月28日,我们的附属公司GWWO,即BPC Plasma Inc的附属公司Biotest Pharmaceuticals Corporation(“BPCorp”)、Haema GmbH(前称Haema AG)及GRIFOLS, S.A.订立血浆供应协议(“血浆供应协议”),据此,GWWO同意收购从BPCorp及Haema GmbH拥有的约60个血浆采集中心收集的所有血浆。GRIFOLS, S.A.为血浆供应协议项下的所有GWWO义务提供担保,该协议于2019年1月1日延长了30年。见本第一部分第7项,“主要股东与关联交易—— B.关联交易——涉及Haema GmbH、BPC Plasma Inc(前身为Biotest US Corporation)和Scranton Enterprises B.V.及其各自子公司的交易—— Plasma供应协议和GWWO向Scranton Plasma B.V.的预付款” |
我们的静脉治疗产品的主要原材料是塑料瓶和玻璃瓶,我们从多家欧洲供应商处采购。
营销和分销
我们目前向100多个国家的医院和诊所、GPO、政府和其他分销商销售生物制药、诊断和医疗保健解决方案产品。
在美国,销售模式复杂,中间商众多,要求我们对产品的分销执行多方面的安排。成品销售通过经销商、批发商、专科药店、居家保健公司、诊所、医院、政府实体等多种渠道直接配送至医师办公室。付款人和购买者还控制对产品的访问,需要与付款人和GPO分别进行谈判。GPO是为其成员充当采购中介的实体,这些成员主要是医院。GPO就其成员使用的用品、设备和医药产品(包括血浆衍生物)的价格和数量进行谈判。
我们通过集中的销售演示向医疗保健提供者和其他决策者(例如医院的决策者)推销我们的产品。虽然价格和数量是通过与中间商的合同协议进行谈判,但对我们产品的需求是通过Grifols的销售代表的促销努力产生的。在GPO的情况下,按合同价格向每个GPO的授权分销商(s)进行实际销售,然后分销商将产品销售给该GPO的成员。我们直接向GPO的成员推广我们的产品。出于安全和售后服务的原因,要求分销商向我们提供最终交付给客户的细节。
在欧洲,销售、营销和分销过程有所不同,欧洲的大部分销售一般直接销往医院。我们与大部分欧洲市场的主要医院建立了长期合作关系,我们相信医院是忠实的客户,他们认可我们产品的高质量和安全性、我们作为供应商的可靠性以及我们的销售代表提供的强大的产品专业知识和服务。由于我们的客户群的性质和行业中普遍存在的重复销售,我们通过集中的销售演示而不是通过广告活动来营销我们的产品。
对东欧、中东和一些亚洲国家的销售主要由我们销售网络之外的第三方进行。我们在拉丁美洲的销售主要靠我们的销售网络。
销售代表
我们要求我们的销售代表能够突出我们的产品与竞争对手的产品之间的技术差异。这项技能需要高度的培训,因为销售人员必须能够与医生、药剂师和其他医务人员进行互动并讨论产品差异。销售代表拜访了以办公室为基础的医疗保健提供者和以医院为基础的医疗保健提供者、部门负责人、采购代理、高级医院主任、实验室主任和药房经理。我们通过固定工资和基于销售额的奖金部分的方式对我们的销售代表进行补偿。我们按照主要产品类别划分我们的销售努力。我们的销售人员主要分布在欧洲和美国,但我们在拉丁美洲和亚太地区也有销售人员。
在我们的生物制药业务部门,我们使用由营销和销售人员组成的混合销售部门。在一些国家,我们有针对免疫学和神经病学、肺部、重症监护和凝血因子的产品线特定销售单位。
70
广告
我们参加医学会议、大会和博览会,偶尔在医学期刊和行业杂志上发布广告。这一促销活动也得到了线上活动的支持。
分配
我们认为,拥有我们自己的分销网络,配备训练有素的人员,是成功的销售和营销工作的关键要素。通过这个网络,我们能够提供高质量的售前和售后服务,我们认为这能提高品牌认知度和客户忠诚度。我们的分销网络在正确处理我们的产品方面经验丰富,并使我们能够知道我们的产品位于何处,使我们能够在出现疑似问题或产品召回时迅速采取行动。
我们的分销网络人员分布在欧洲、拉丁美洲、美国和亚太地区,负责分销我们的生物药、诊断和其他医疗产品以及与我们自己的产品互补的其他主要医疗保健公司制造的商品。
在2024年期间,我们通过自己的分销网络分销大部分产品。在某些情况下,特别是在诊断领域,我们通过营销合作伙伴和第三方分销商分销产品。我们在30多个国家有直接的存在,我们在没有直接存在的国家仔细选择分销商。我们有一个反应灵敏、有效的物流组织,能够准时满足世界各地医院中心和其他客户的需求。
截至2024年12月31日,我们的销售、营销和分销网络包括1,542名员工,其中包括1,375名销售和分销人员以及167名营销员工。
我们的每个商业子公司都对各自当地市场的要求负责。我们的目标是让每个商业子公司通过其服务质量、道德标准和对客户需求的了解而被认可为我们的公司之一。强大的本地知识使我们能够与客户建立并保持长期关系,以赢得他们的信任和信心。
专利、商标和许可
专利和商标
通过我们的专利所有权、共同所有权和许可,我们寻求获得并维护我们的初级产品的知识产权保护。
截至2024年12月31日,我们在世界各国拥有2759项专利和专利申请,其中688项正在最终申请过程中。在一些国家,这些专利授予20年的保护期。这些专利中约有1216项将在未来十年内到期。就近期到期情况而言,Grifols无菌灌装系统专利已于2024年1月到期,纤维蛋白原溶液中去除病毒的工艺专利已于2024年3月到期。
截至2024年12月31日,我们还拥有3601项商标和商标在世界各国的申请,其中130项正在最终申请过程中。此外,我们与第三方共同拥有某些专利和专利申请,包括在诺华收购后与诺华共同拥有的专利权。
我们在西班牙和德国设有人员部门,负责处理专利和商标的批准和维护过程,并监测可能的侵权行为。
71
等离子体衍生产品专利
截至2024年12月31日,我们拥有2175项与等离子体衍生物相关的专利和专利申请,其中欧洲986项,美国和加拿大311项,世界其他地区878项。这些专利中最重要的涉及:
| ● | 一种浓缩的皮下α-1抗胰蛋白酶; |
| ● | 小容量血浆置换在阿尔茨海默病治疗中的应用; |
| ● | 用于神经退行性应用的转铁蛋白; |
| ● | 转铁蛋白治疗缺氧诱导因子相关病症; |
| ● | 纤溶酶在伤口愈合中的应用; |
| ● | 纤溶酶在器官移植中的应用; |
| ● | a浓缩皮下免疫球蛋白G注射液; |
| ● | 用于治疗细菌感染的浓缩免疫球蛋白M制剂; |
| ● | 超免疫免疫球蛋白治疗新冠; |
| ● | 抗凝血酶治疗钝性创伤; |
| ● | 抗凝血酶治疗脑卒中; |
| ● | MIP1a作为白蛋白治疗阿尔茨海默病有效性的标志物; |
| ● | 使用血浆交换去除引起神经退行性疾病的外泌体;和 |
| ● | 利用血浆交换去除引起癌症的外泌体。 |
诊断产品和医疗保健解决方案专利
截至2024年12月31日,我们拥有552项与诊断产品和医疗保健解决方案业务线相关的专利和专利申请,其中欧洲319项,美国和加拿大93项,世界其他地区140项。这些专利中最重要的涉及:
| ● | BlisPack®,一种吸塑处理机; |
| ● | ERYTRA EXLEXIS®,一种使用DG Gel进行输血前兼容性测试的中型仪器®技术; |
| ● | 用于人体血浆蛋白的创新容器; |
| ● | 新型HIV抗原用于血液筛查; |
| ● | CD38受体的可溶性重组形式; |
| ● | CD47受体的可溶性重组形式; |
| ● | 用于检测新冠肺炎的重组抗原;以及 |
72
| ● | 分子检测的多路复用技术。 |
第三方的许可
我们从第三方获得某些知识产权许可,包括Singulex和Hologic。Singulex授予我们在某些知识产权下的全球独家许可,用于使用和销售用于献血者和血浆筛查的某些产品和服务。根据与Hologic的知识产权许可,我们获得了Hologic某些知识产权的全额支付许可,用于NAT供体筛查单元。
政府当局的许可证
美国政府当局在联邦、州和地方一级,以及在整个欧盟、拉丁美洲、亚洲和其他地方的其他国家,通过许可、批准、审查、检查和其他要求,广泛规范我们收集、制造、销售或正在开发的医疗保健产品的研究、开发、测试、批准、制造、标签、批准后监测和报告、包装、促销、储存、广告、分销、营销和进出口。
例如,为了销售我们的等离子衍生产品,我们必须持有适用政府当局的适当产品许可证。我们在90个国家注册了1,101个Biopharma产品许可,其中包括我们从FDA获得的在美国销售IG、A1PI、白蛋白、VIII因子、IX因子、ATIII和PTC的许可。我们的许多诊断业务部门产品的生产、营销和销售须事先向适用司法管辖区的有关当局进行此类产品的登记。我们在欧洲、美国、加拿大、拉丁美洲、大洋洲和亚洲共81个国家注册了3643个诊断产品许可证。
政府的监督延伸到我们行动中涉及的各种设施。例如,我们的Parets和Murcia设施受欧洲卫生当局适用的法规和标准的约束。关于FDA的监督,我们Parets工厂的Instituto Grifols Biopharma工厂自1995年以来一直在FDA注册,我们的其他制造工厂保持FDA注册,并且都遵守FDA的标准。我们租用了大部分血浆采集中心以及位于德克萨斯州奥斯汀的主要实验室设施,并为所有这些地点与包括FDA在内的适当监管机构保持许可。
有关政府许可和监管的更多信息,请参见上文“—主要活动”和下文“— e.监管事项”。
监管
有关适用于我们业务的法规的详细信息,请参阅下文“— E.监管事项”。
保险范围
一般及产品责任
Grifols有一个保单计划,旨在保护我们和我们的子公司(包括美国子公司)免受产品责任索赔的影响。自2024年5月1日起,我们为诊断和生物用品业务部门的所有设施制造的产品以及第三方产品销售提供每次索赔和年度总计高达2.30亿美元的产品责任保险。该限额为每项索赔3.85亿美元,按生物制药业务部门的年度总额计算。这项政策将于2025年4月30日到期,我们预计将在这样的到期日期之前再续一年。
Grifols的责任计划还保护在Grifols的子公司开展业务的国家产生的某些环境责任。这一风险的承保范围最高可达每次索赔和年度总额2.30亿美元。
73
Biomat USA,Inc.、Grifols Bio Supplies,Inc.、BPC Plasma Inc.、Prometic Plasma Resources,Inc.、Plasmavita Healthcare GmbH、Plasmavita Healthcare II GmbH、Haema GmbH和Haema Plasma KFT维持单独的责任保险单。该政策涵盖了他们从事血浆置换术经营活动的职业责任,将于2025年4月30日到期。该保单下责任索赔的最高承保金额为每次索赔和年度总额1500万美元。此外,我们的普通责任险提供超额保障。
财产损失和业务中断
我们的财产损失和业务中断保险计划涵盖我们和我们的子公司(包括美国子公司)。这项保险计划将于2025年4月30日到期,涵盖厂房和建筑物、设备和机械所遭受的损害。根据现行条款,保险公司将承保火灾、烟雾、闪电和爆炸等对我们设施造成的损害,每次事故损失最高可达15亿美元。它还涵盖洪水造成的财产损失,每次索赔最高可达1.1亿美元,年度总额。这份保单还对利润损失给予最高一定金额的保障。
我们还有一项过境和库存保险计划,该计划涵盖原材料、供应品、半成品和成品的损害,每次过境索赔最高可达2500万美元,每年总计为库存索赔高达8亿美元。这项保险计划将于2025年4月30日到期,我们预计将在到期前再续保一年。
赛博
我们的网络保险涵盖数据泄露和勒索软件攻击导致的高达6000万美元的财务损失。这项保险计划将于2025年4月30日到期,我们预计将在到期前再续保一年。
自保
我们通过我们的全资子公司之一Squadron ReInsurance DAC购买部分相关保单,自行为上述部分风险投保。我们还为一般责任、财产和业务中断、捐赠中心专业责任、过境、库存和网络等主要保险全球项目的一部分进行自我保险。
我们为我们的全球责任计划每年的每项索赔自保5000万美元(该金额为每项索赔8500万美元,生物制药业务部门的年度总额除外),财产损失和利润损失的前十天的每项损失的前500,000美元,过境损失的每项索赔的前30,000美元,库存损失的每项索赔的前200,000美元,以及任何超过200万美元的过境或库存损失,额外保留损失价值的10%,每次损失最高为500,000美元,年度总额为300万美元,以及第一笔500万美元的每笔损失与网络安全风险有关。这些金额超过了构成我们保险计划的每份保单的免赔额。
气候变化
根据联合国实现2030年议程中确定的可持续发展目标的计划,我们做出了帮助保护环境的承诺。自2020年以来,我们的企业环境计划包括为我们的业务减少排放和脱碳里程碑。到2030年,我们致力于将单位生产的温室气体排放量比2018年的水平减少55.0%,将单位生产的能源效率提高15.0%,并确保我们设施中消耗的电力100%来自可再生能源。
2024年,基于科学的目标倡议——一个使公司和金融机构能够根据最新的气候科学(“SBTI”)设定减排目标的全球性机构,正式批准了我们的短期减排目标。SBTI的批准证实了我们与全球气候行动的一致,并支持《巴黎协定》将本世纪全球变暖限制在1.5 ° C的目标。这些目标基本上涵盖了直接和间接运营产生的所有Grifols温室气体(“GHG”)排放。其中包括:
| ● | 范围1和2 GHG排放:我们承诺到2030年,以2022年为基年,将绝对范围1和2的GHG排放量减少42%(目标边界包括与生物源土地相关的排放和生物能源原料的清除量)。 |
74
| ● | 范围3 GHG排放:我们承诺在同一时间范围内将购买的商品和服务、资本货物、燃料和能源相关活动以及上游运输和分销产生的绝对范围3 GHG排放量减少25%。 |
我们实现此类SBT的行动计划包括:(i)通过更多地使用视频通话等技术,最大限度地减少我们不同工业和运营地点之间的空中旅行;(ii)通过提供灵活工作时间的政策,提高我们员工的远程工作水平;(iii)优化我们等离子运输网络中的物流,包括通过船舶将中间产品从我们在美国的设施运送到爱尔兰,而不是空运;(iv)通过向我们设施内的员工提供补贴共享运输服务等措施,最大限度地减少员工旅行和通勤的影响;(v)通过通过PPA购买可再生能源产生的能源,越来越依赖可再生能源。
2024年,我们通过购电协议(“PPA”)、使用两座光伏电站(位于巴塞罗那和穆尔西亚)以及全球升温潜能值等于零的制冷剂气体的制冷工厂等行动,消耗了1.917亿千瓦时的可再生电力,占总消费量的44.6%。为了取代污染最严重的技术,我们定期分析市场上可用的技术选项,特别关注提高我们设施气候适应力的技术。
我们的GHG排放清单涵盖所有范围(1、2和3)和类别,遵循《GHG议定书》并涵盖公司的所有活动:
| ● | 范围一是我们经营活动本身产生的直接排放,包括燃烧源产生的排放。2024年,我们的范围1排放量稳定在106,289 tCO2e与106,459 TCO相比2e在2023年。2023年,我们的范围1排放量比2022年增加了12.0%,达到95,242个tCO2e由于我们的热电联产厂运营天数增加; |
| ● | 范围2为外购能源产生的间接排放,主要是我们业务消耗的电力。2024年,我们的范围2排放量比2023年(按市场法)下降25.0%,达到73,876 tCO2e由于增加使用可再生能源。应用基于位置的方法,不包括可再生能源的努力,2024年的排放量也比2023年减少了38%,达到84,343 tCO2e、用电量减少所致。2023年,我们的范围2排放量较2022年下降8.0%(按市场法),达到98,106吨CO2e,由于可再生能源的使用增加;和 |
| ● | 范围3是我们业务上下游价值链中发生的所有其他间接排放。范围3包括供应商在我们产品或服务的整个生命周期、商务旅行、员工旅行和通勤等方面的排放。2024年,我们的范围3排放量比2023年增加了11.0%,达到1,051,606 tCO2e.2023年,我们的范围3排放量比2022年下降了33.0%,总计947,463吨CO2e.商品和服务仍占我们范围3排放量的50.0%以上,其次是我们的合同运输。 |
75
自2019年以来,我们定期更新我们的气候风险地图,作为我们管理气候相关风险和机遇的综合方法的一部分。该框架有助于公司确定潜在影响是否构成重大风险或机会。2024年,在公司复原力评估的框架内,我们根据国际科学界的建议和CSRD等关键报告框架建立的一般标准,进行了气候风险和机会分析。分析包括政府间气候变化专门委员会提出的用于评估物理气候风险的强调悲观情景(SSP5-8.5);国际能源署提出的用于评估过渡风险的强调乐观情景(“NZS”);以及基于2 ° C全球变暖情景(SSP2-RCP-4.5)的符合气候相关财务披露工作组建议的战略分析。
我们还估算了气候变化方面每一项重大风险和机遇的潜在财务影响。对于这一过程,我们评估了公司整个价值链中的27个潜在气候相关风险和机会,包括供应商(上游)、我们自己的运营和基础设施,以及我们产品的分销和使用(下游)。根据这一分析,我们确定了12个重大风险和机会:2个物理风险、6个过渡风险和4个机会。有关我们的环境战略和气候变化风险管理的更多信息,请参阅我们的2024年年度可持续发展报告,可在我们的网站上查阅。
c. |
组织Structure |
GRIFOLS, S.A.是Grifols集团的母公司,该集团于2024年12月31日由93家公司、联营公司和其他子公司组成。与GRIFOLS, S.A.控制的公司一样,GRIFOLS, S.A.直接或间接拥有大部分股权或投票权的子公司已完全合并。此外,还有4家公司采用权益法核算,原因是GRIFOLS, S.A.拥有其股本的20%-50 %之间,对其财务或经营政策没有支配权。
有关我们的合并和非合并公司的详细信息,请参阅本年度报告表格20-F中包含的经审计的合并财务报表附注1和2(b)。
d. |
物业、厂房及设备 |
我们的总部在西班牙的巴塞罗那。截至2024年12月31日,我们在八个国家拥有或租赁设施,我们的主要工厂地点设在西班牙、德国和美国。我们目前在12个不同地点的13个地点拥有或租赁制造设施,其中五个拥有等离子体分馏能力。下表显示了截至2024年12月31日我们主要物业的地理位置和业务用途。
76
位置 |
|
设施 |
|
自有/租赁(2) |
|
经营宗旨 |
|
|---|---|---|---|---|---|---|---|
Parets del vall è s,西班牙 |
工业设施One Parets |
拥有66%;34%的物业向第三方出租 |
等离子体分馏制造等离子体衍生物&业务单元支持活动 |
||||
工业设施两个Paret |
80%拥有;物业的20%向第三方租赁 |
制造诊断和保健解决方案产品 |
|||||
工业设施三部分 |
拥有70%;物业的30%向第三方出租 |
血浆储存&其他经营活动 |
|||||
美国加利福尼亚州洛杉矶–谷 |
工业设施,美国 |
持股92%;物业8%向第三方租赁 |
等离子体分馏等离子体纯化制造等离子体衍生物 |
||||
美国加州洛杉矶–工业之城 |
美国工业城 |
100%出租 |
血浆储存 |
||||
美国北卡罗来纳州克莱顿 |
克莱顿设施 |
100%拥有 |
等离子体分馏等离子体纯化制造等离子体衍生物 |
||||
美国北卡罗来纳州达勒姆 |
研究三角园 |
拥有22%权益,78%物业向第三方租赁 |
研发实验室和办公室 |
||||
美国加利福尼亚州埃默里维尔 |
埃默里维尔设施 |
100%拥有 |
制造诊断产品 |
||||
美国加利福尼亚州圣卡洛斯 |
阿尔卡赫斯特遗址 |
100%出租 |
研发实验室和办公室 |
||||
美国加利福尼亚州南旧金山 |
GigaGen网站 |
100%出租 |
研发实验室和办公室 |
||||
西班牙穆尔西亚 |
工业设施穆尔西亚 |
100%拥有 |
制造医疗保健解决方案产品 |
||||
瑞士弗里堡 |
工业设施瑞士 |
100%出租 |
制造诊断产品 |
||||
澳大利亚墨尔本 |
工业设施澳大利亚 |
100%拥有 |
制造诊断产品 |
||||
美国加利福尼亚州维斯塔 |
Grifols Bio Supplies,INC |
100%出租 |
生物制品制造 |
||||
美国得克萨斯州圣马科斯 |
等离子体检测实验室 |
100%拥有 |
血浆检测 |
||||
美国加利福尼亚州圣迭戈 |
圣地亚哥设施 |
拥有75%权益;另有25%物业向第三方租赁 |
制造TMA放大NAT试剂盒的组件 |
||||
爱尔兰都柏林 |
全球运营中心 |
(1) |
与生物制药业务部门相关的经营活动 |
||||
Sant Cugat del Vall è s,西班牙巴塞罗那 |
总部 |
100%出租 |
总部 |
||||
Derio,Bizkaia,西班牙 |
Progenika Biopharma |
90%拥有,10%出租 |
制造诊断产品&研发 |
||||
西班牙萨拉戈萨 |
阿拉克伦生物科技 |
100%出租 |
研发实验室和办公室 |
||||
美国佛罗里达州博卡拉顿 |
Grifols Bio Supplies,Inc |
100%出租 |
专业测试 |
||||
Arrasate,Guipuzcoa,西班牙 |
Kiro Grifols |
100%出租 |
制造医院设备和办公室 |
||||
美国田纳西州孟菲斯 |
Grifols Bio Supplies,Inc |
拥有57%,租赁43% |
等离子体实验室 |
||||
德国莱比锡 |
Haema |
100%拥有 |
总部、实验室和仓库 |
||||
加拿大蒙特利尔 |
工业设施蒙特利尔 |
100%拥有 |
等离子体分馏等离子体纯化 |
||||
德国Dreieich |
工业设施Dreieich |
拥有86%,租赁14% |
等离子体分馏 |
||||
埃及开罗 |
工业设施开罗 |
与NSPO合资(Grifols持股49%,NSPO持股51%) |
等离子体检测实验室等离子体存储 |
(1) |
我们持有该物业999年的租赁权益。 |
(2) |
基于物业规模的租赁百分比。 |
77
等离子体分馏装置
我们的等离子衍生产品在我们的Parets、Los Angeles、Clayton和Dreieich工厂生产。我们所有的分馏设施都有FDA和EMA认证。截至2024年12月31日,我们的设施的聚合分馏能力足以满足我们目前的生产需求。
Parets设施具有独特的设计,将维护区域与分馏和净化程序所需的清洁区域分开。我们在内部开发的这种设计,最大限度地减少了污染的风险,并降低了维护成本。除了获得欧盟和其他所需特定当局的许可,用于生产各种血浆衍生产品,Parets工厂还获得了FDA的许可。除了血浆分馏设施外,Parets场地还有用于生物制药业务部门的蛋白质纯化、填充和完成、包装、储存、研发和能源联产设施,以及用于诊断业务部门和医疗保健解决方案业务线的制造设施。Parets工厂持有生物制药、诊断和医疗保健解决方案工厂的GMP、ISO 13485和ISO 14001以及其诊断制造设施的ISO 9001认证。
洛杉矶的这座设施包含凝血因子、IG和白蛋白的纯化和无菌填充区。该工厂获得了FDA的许可,Grifols正在努力通过ISO 14001认证对洛杉矶工厂进行认证,这与我们其他制造工厂类似。
我们在2024年增加了北卡罗来纳州克莱顿工厂的产能。该设施是世界上最大的血浆衍生疗法完全集成设施之一,包括血浆接收、分馏、纯化、灌装/冷冻干燥和包装能力,以及冷冻储存、测试实验室和用于临床供应制造的cGMP试点工厂。该设施拥有ISO 14001认证,该认证认可环境绩效的卓越和持续改进。认证范围包括人血浆衍生的医药专业的研究、开发、生产和质量控制。
2020年10月,我们从GC Pharma手中收购了位于蒙特利尔的血浆分离设施(连同两个净化设施)。一旦我们完成翻修并获得蒙特利尔设施所有必要的许可证和监管批准,我们将成为加拿大唯一一家大规模的等离子产品商业制造商。我们预计将于2025年开始在加拿大工厂生产白蛋白以供应加拿大市场,并于2027年开始血浆分馏和丙种球蛋白制造。
我们在爱尔兰都柏林有一个白蛋白纯化、加药和无菌灌装工厂。这个工厂使我们在软包装中填充白蛋白的能力显着增加。与我们应对气候变化影响的措施保持一致,都柏林工厂拥有最新的生态效率技术,可以节省能源和水。
2022年4月,作为Biotest AG收购的结果,我们收购了Dreieich工厂。该设施具有血浆分馏能力,以及白蛋白、新型纤维蛋白原和IGM浓缩物产品线和下一代多价免疫球蛋白的批量生产工厂。
我们与NSPO的合资企业Grifols Egypt目前正在开罗建设一个新的生产基地,该基地将设有分馏和净化工厂、物流设施和一个完全自动化的等离子体分析实验室。
全球运营中心
我们在爱尔兰都柏林的工厂是我们生物制药业务部门的全球运营中心。该设施占地22846平方米,作为Grifols集团的全球供应链管理中心运营。我们的全球运营中心容纳了我们生物制药公司的全球物流和分销活动;血浆、中间糊剂和成品的仓储、产品的标签和二次包装;以及与血浆和血浆衍生物供应有关的监管和质量保证活动。最后,我们的都柏林设施还集中了我们的财政职能,并充当我们进入资本市场的入口。
78
e. |
监管事项 |
政府监管
美国和其他国家的政府当局广泛监管(其中包括)医疗保健产品的研究、开发、测试、批准、制造、标签、批准后监测和报告、包装、促销、储存、广告、分销、营销以及出口和进口,例如我们收集、制造、销售或正在开发的产品。获得监管批准和遵守所有适用法律法规的过程需要花费大量的时间和财力资源。以下是对我们业务的整体监管格局的总结。
美国政府条例
在美国,FDA根据FDCA和(如适用)《小灵通法案》及其实施条例对药品、生物制剂、血浆采集和医疗器械进行监管。在产品开发过程、审批过程中或审批后的任何时候不遵守适用的FDA要求,可能会受到行政或司法制裁。这些制裁可能包括(如适用)FDA对药物、设备或生物制剂的试验实施临床暂停、拒绝批准未决申请、撤回批准、警告信、产品召回、产品扣押、全部或部分暂停生产或分销、禁令、罚款、民事处罚或刑事起诉或这些制裁的任何组合。任何机构或司法执法行动都可能对我们产生重大不利影响。
The BLA(Biologics License Application)审批流程
也是生物制品的药物,例如我们的血浆衍生产品IG、A1PI、VIII因子和白蛋白,以及与检测血液和血液成分相关的某些体外诊断产品,也必须满足PHS法案(公共卫生服务法)及其实施条例的要求。为了让一种生物药产品,或者为了这些体外诊断测试,在美国合法上市,该产品必须有FDA批准的BLA(生物制品许可申请)。获得FDA的BLA批准是一个稳健的过程,其中包括完成临床前实验室测试、受控人体临床试验、提交制造和化学数据,以及FDA的多个统计和物理审查过程。在临床开发的所有阶段,监管部门要求对所有临床活动、临床数据和临床试验研究者进行广泛的监测和审计,包括有关不良事件和安全问题的报告。
鉴于流程稳健,我们的某些临床试验可能无法在任何特定时期内成功完成,如果有的话。此外,我们或FDA可能随时以各种理由暂停或终止临床试验,例如,受试者或患者可能面临不可接受的健康风险,经历过严重和意外的不良事件,或者在研究环境中继续使用可能是不道德的。同样,如果研究没有按照IRB的要求进行,或者研究与对患者的意外严重伤害相关,IRB可能会暂停或终止对研究的批准。
总体而言,测试和批准过程需要大量的时间和精力,因此无法保证FDA将接受BLA的备案,并且即使提交了备案,也不能保证任何批准都将及时获得,如果有的话。在大多数情况下,BLA必须附带一笔可观的用户费用。
79
在我们的主要市场美国,对于被发现与先前根据BLA获得许可的生物“参考产品”具有“生物仿制药”或“可互换”的生物制品,有一种简化的监管批准途径。这种简化的批准途径旨在通过在某种程度上依赖参考产品的赞助商产生的数据,以及FDA之前对参考产品的审查和批准,允许生物类似药产品更快、更便宜地上市。该法律规定,在参比产品首次获得FDA许可之日起四年后,不得接受任何生物类似药申请进行FDA审查,并且FDA不得在参比产品首次获得许可后12年内使批准申请生效。该法律还包括创新者生物和生物类似药制造商对专利侵权、有效性和可执行性进行诉讼的广泛过程,这可能会增加保护我们的参考产品的成本。一旦获得批准,生物仿制药可能会与之前批准的参比产品竞争,在某些情况下,根据适用法律,可能会被视为“可以与之互换”。生物类似药产品一旦获得批准,将在多大程度上以类似于传统仿制药替代非生物产品的方式替代我们的任何产品,目前尚不清楚,并将取决于仍在发展的一些市场和监管因素。结合FDA确保开发安全有效的生物仿制药的权力,2022年9月,FDA 2022年生物仿制药用户费用修正案签署成为法律。2022年FDA生物仿制药用户费用修正案重新授权将2012年《生物仿制药用户费用法案》延长五年(至2027年),该法案允许FDA评估和收取生物仿制药费用。
获得BLA的测试和批准过程需要大量的时间、精力和财政资源,每个过程可能需要几年时间才能完成。从临床活动中获得的数据并不总是确凿的,可能会受到不同解释的影响,这可能会延迟、限制或阻止监管机构的批准。FDA可能不会及时批准,或者根本不批准。我们在努力获得必要的政府批准时可能会遇到困难或意外的成本,这可能会延迟或阻止我们营销我们的产品。FDA可能会限制使用适应症或对任何可能限制产品商业应用的批准设置其他条件。
批后要求
在产品获得监管批准后,我们被要求遵守多项批准后要求。例如,作为批准BLA的条件,FDA可能会要求上市后的测试和监督,以监测产品的安全性或有效性。此外,获得批准的BLA的持有者必须保留广泛的记录,向FDA报告某些不良反应和生产问题,提供最新的安全性和有效性信息,并遵守有关其产品的广告和促销标签的要求。此外,质量控制和制造程序必须继续符合cGMP法规和惯例,以及BLA中规定的批准制造条件。FDA定期检查生产设施,以评估符合cGMP的情况,这对程序、实质性和记录保存提出了一定的要求。相应地,生产企业必须继续在生产和质量控制领域花费时间、金钱和精力,以保持符合cGMP和其他方面的监管合规。
未来的FDA检查可能会在我们的设施或我们的第三方供应商的设施中发现合规问题,这些问题可能会扰乱生产或分销,或者需要大量资源来纠正和防止任何缺陷的再次发生,并可能导致监管机构的罚款或处罚。此外,发现产品存在问题或未能遵守适用要求可能会导致对产品、制造商或经批准的BLA持有者的限制,包括从市场上撤回或召回该产品或其他可能延迟或禁止进一步营销的自愿、FDA发起的或司法行动。新发现或开发的安全性或有效性数据可能需要更改产品的批准标签,包括增加新的警告和禁忌症。
ACA为以患者为中心的结果研究所建立并提供了大量资金,以协调和资助比较有效性研究。虽然比较有效性研究的既定意图是开发信息以指导提供者获得最有效的疗法,但比较有效性研究的结果可能会影响被确定为成本效益低于其他疗法的疗法的报销或覆盖范围。
80
孤儿药指定
FDA可能授予孤儿药资格,用于治疗在美国影响少于20万人的“罕见疾病或病症”的药物,或在美国影响超过20万人的药物,且没有合理预期在美国开发和提供针对此类疾病或病症的药物的成本将从该药物在美国的销售中收回。提交上市审批申请前,必须先申请孤儿药定点。孤儿药认定不会在监管审评审批过程中传递任何优势,也不会缩短持续时间。孤儿药指定可以为临床试验成本、税收优势和FDA用户费用豁免提供赠款资助机会。此外,如果具有孤儿药认定的产品随后获得FDA对其具有此种认定的适应症的首次批准,则该产品有权获得孤儿药独占权,这意味着FDA不得在七年内批准任何其他针对同一适应症的相同药物上市申请,除非在有限的情况下,例如表现出对具有孤儿药独占性的产品的临床优越性或明显不同的给药模式。竞争对手可能会因孤儿产品具有排他性的适应症而获得不同药物或生物制剂的批准。然而,如果一家拥有孤儿药独占权的公司无法供应市场,FDA可以允许另一家拥有相同药物的公司获得上述适应症的上市许可。FDA授予Gamunex®IVIG孤儿药地位,该地位为CIDP适应症在美国提供了市场独占权,直至2015年9月。Gamunex®IVIG是美国首个获批CIDP的IVIG产品。
快速通道指定
FDA的快速通道项目,其中之一是快速通道指定,旨在促进旨在治疗严重或危及生命的疾病的新药的开发和审查,这些新药展示了解决这些疾病未满足的医疗需求的潜力。快速通道指定适用于产品和正在研究的特定适应症的组合。因此,获得快速通道指定的是针对特定适应症的特定药物的开发程序。
被指定为处于快速通道药物开发计划的产品的赞助商可以与FDA进行密切的早期沟通,包括通过及时的会议和对临床试验的反馈。处于快速通道药物开发项目中的产品也可能获得FDA优先审评或加速批准;换言之,审评周期有六个月的审评时钟,而不是十个月或12个月的审评时钟。赞助商也可以在整个申请完成之前提交申请的完成部分;但是,直到整个完成的BLA提交给FDA并由FDA提交文件后,审查时钟才会正式开始。如果新出现的数据不再支持快速通道指定,不再追求指定的药物开发计划,或满足同一适应症未满足的医疗需求的另一产品被优先批准,FDA可能会通知赞助商,其项目不再被归类为快速通道开发计划。
血浆采集
FDA要求每个血浆采集中心在开业前都有许可和认证流程,并对设施和流程进行定期检查。许多州还对血浆采集进行监管,规定了类似的义务以及额外的检查和审计。征收中心受到监管部门的定期检查,如果据称不遵守规定,可能会导致罚款、引证、中心临时关闭、丢失或暂停许可证或召回成品。
诊断设备
我们的某些产品作为医疗器械受到监管,在美国通常需要获得商业化许可,通常被称为FDA的“510(k)许可”,这是基于向FDA发出的上市前通知,通过证明与合法上市的器械(predicate device)具有实质性的等效性,证明将要上市的器械是安全和有效的。医疗器械制造商必须在FDA注册其机构,器械的生产必须符合适用的现行良好生产规范和质量体系规定。一些州还对某些医疗器械的制造或分销进行监管,规定了额外的许可、检查和审计要求。关于制造和销售免疫分析抗原和抗体以筛查人类捐献血液和血液制品,这些产品是根据FDA颁发的BLA制造和销售的,并受到与生物制品相关的加强监管监督。
81
药品供应链安全法
2013年《联邦药品质量和安全法》对药品供应链要求进行了规范,并对某些州法律进行了先发制人的规定。该法案的标题II,称为《药品供应链安全法案》(“DSCSA”),建立了一个国家电子、可互操作的系统,以识别和追踪在美国分销的某些处方药,包括我们的某些产品。DSCSA的跟踪和追踪要求(适用于处方药的制造商、批发商、重新包装商和分发商(例如药店))取代了与DSCSA要求不一致、比DSCSA要求更严格或除此之外的原FDA药物谱系要求和先发制人的州要求。DSCSA还对处方药批发商和第三方物流供应商(“3PLs”)的许可和运营制定了某些要求,并包括在各州未在FDA法规中许可此类实体成立但尚未最终确定的情况下创建国家批发商和3PL许可。DSCSA一般要求批发商和3PL在处方药的记录保存、储存和处理方面按照一定的标准配送药品。根据DSCSA,各州可优先实施与美国联邦标准不一致、不那么严格、直接相关或涵盖的任何许可要求,但FDA已澄清,在FDA国家许可法规最终确定并生效之前,当前的州许可要求可能仍然有效。
反欺诈及滥用规管
由于我们提供的产品和服务由美国联邦医疗保健计划(如医疗保险和医疗补助)报销,我们的活动也受到CMS(美国医疗保险和医疗补助服务中心)的监管和OIG(美国监察长办公室)的强制执行。联邦反回扣法规禁止提供者和其他人直接或间接索取、接受、提供或支付任何报酬,目的是为政府医疗保健计划所涵盖的服务或项目产生转介或订单。许多州都有类似的法律。法院对这项法律的解释非常广泛,包括认为即使薪酬的一个目的是产生转介,即使有其他合法目的,也发生了违规行为。有法定和监管例外或安全港,概述了被视为合法的安排。然而,一项安排不属于安全港的事实并不一定使该行为根据《反回扣法规》成为非法行为。总之,即使是公司与转介来源之间的合法业务安排,也可能导致政府执法机构的审查,并需要大量公司资源来应对政府调查。此外,某些商业行为,例如向医疗保健提供者支付咨询费、赞助教育或研究赠款、慈善捐赠、与为未经FDA批准的用途开具产品处方的医疗保健提供者的互动以及对继续医学教育计划的财政支持,必须在狭隘的规定和受控范围内进行,以避免因错误影响医疗保健提供者开具或购买特定产品或作为对过去开具处方的奖励而承担的潜在责任。
任何实体如果故意提出或导致提出向美国联邦政府付款的虚假索赔,或者故意为此类虚假索赔制作或导致被制作虚假记录材料,或者故意隐瞒或逃避向政府付款的义务,包括故意保留多付款项,均违反了FCA(Federal False Claims Act)。违反反回扣法规的付款也可以构成FCA责任的基础。
由于举报人(称为“举报人”)以美国(如适用,特定州)的名义提出投诉,以及可能获得高达政府赔偿总额30%的举报人,FCA的执法活动有所加强。违反FCA的人可能要承担三倍的损害赔偿、强制性处罚、失去许可以及被排除在联邦和州医疗保健计划之外的责任。此类处罚可能会对我们的业务产生重大不利影响。此外,检察、监管或司法当局可能会以可能要求我们改变运营或产生大量辩护和和解费用的方式解释或适用这些措施。即使是监管机构或相关方提出的不成功的挑战,也可能导致声誉受损并产生巨额成本。大多数州都采用了类似的州虚假索赔法,这可能会导致重大的额外处罚。
我们还受制于与我们的海外业务开展有关的某些美国和外国法律法规,包括美国《反海外腐败法》、英国《反贿赂法》、德国反腐败法律和其他反贿赂法律以及与我们内部账簿和记录的准确性有关的法律,这些都是近年来全球范围内不断增加的执法活动的重点。
82
“PPS法案”(Physician Payments Sunshine Act)就向医生、医师助理、执业护士、临床护士专家、认证注册护士麻醉师、认证护士-助产士、教学医院、制造商和GPO(团购组织)支付或进行的其他价值转移,就从业者和教学医院在报告实体中的所有权权益,对生物、药物和设备制造商提出了报告和披露要求。CMS将这些报告中的信息发布在一个公开的网站上,包括转移的金额以及从业者和教学医院的身份。PPS法案优先于类似的州报告法,尽管我们或我们的子公司也可能被要求根据某些州透明度法律进行报告,这些法律涉及PPS法案未涵盖的情况,其中一些州法律以及联邦法律可能是模棱两可的。我们还受到外国法规的约束,这些法规要求供应商与其客户之间的某些互动具有透明度。
其他卫生保健条例
在美国,对定价的担忧导致了更严格的审查以及政府正在努力提高医疗保健和药品成本的透明度。例如,2020年11月12日,CMS发布了对医院和团体健康计划施加价格透明度要求的最终规则,该规则从2022年到2024年分三个阶段生效。截至2024年1月1日,医院和团体健康计划必须披露网络内提供者协商费率(包括与设备供应商和制造商的费率)、所有涵盖项目和服务的历史网络外允许金额,包括所有处方药和药品定价信息。各国还颁布了各种透明度规则和条例。公布我们的协商费率可能会影响我们独立谈判销售合同和费率协议的能力。
另一项值得注意的医疗保险医疗改革举措,即2015年《医疗保险准入和CHIP重新授权法案》(“MCRA”),建立了一项新的质量支付计划,该计划修改了某些医疗保险B部分支付给“合格临床医生”,包括医生、牙医和其他从业者。根据MCRA,某些符合条件的临床医生被要求通过基于绩效的激励支付系统(“MIPS”)或高级替代支付模式(“APMS”)参与Medicare,通过这些模式,Medicare B部分报销根据与质量、促进互操作性、成本和改进活动相关的报告数据进行上调或下调。符合MIPS资格的临床医生必须在次年3月31日之前报告年度绩效数据。根据提交的数据进行的付款调整适用于数据提交后的绩效年度内的Medicare B部分索赔。MCRA为医生参与风险合同提供了大量的经济激励,同时增加了医生信息技术和报告义务。MCRA不断发展,其影响取决于未来的监管活动和市场上的医生活动。新的支付和交付系统改革计划,包括仿照此类联邦计划的计划,也越来越多地通过医疗补助管理人员以及私营部门在州一级推出,这可能会进一步改变市场并影响我们的业务。
近期,美国多个州也提出或通过立法,寻求直接或间接监管药品定价,例如要求药品生产商公开报告定价信息或对国家机构采购的药品设置最高价格上限。例如,2024年6月,纽约实施了一项处方药价格透明度法,要求处方药制造商对某些药品价格上涨超过特定阈值提供提前通知和解释。加利福尼亚州、俄勒冈州、华盛顿州和新泽西州也颁布了类似的法律,据报道,其他一些州也在考虑类似的立法。这类法律可能会导致我们对受影响的产品承受额外的定价压力。有关这些压力的更多详情,请见下文“—药品定价与报销”。
反垄断和消费者保护
美国联邦政府、美国大多数州和许多外国都有反垄断法,禁止某些类型的被视为反竞争的行为,以及寻求保护消费者免受不当商业行为侵害的消费者保护法。在美国联邦一级,联邦贸易委员会负责监督这类法律的执行,各州也有类似的政府机构。违反反垄断法或消费者保护法可能导致各种制裁,包括刑事和民事处罚。私人原告也可能因涉嫌违反反垄断法而在美国对我们提起民事诉讼,包括索赔三倍的损害赔偿。
83
欧洲共同体政府条例
除了美国的法规外,我们还受制于其他管辖我们产品的临床试验和商业销售和分销的司法管辖区的各种法规。无论我们是否获得FDA对某一产品的批准,我们必须获得美国以外国家的可比监管机构对某一产品的批准,然后才能开始在这些国家营销该产品。各国的审批流程各不相同,时间可能比FDA批准所需的时间更长或更短。各国对开展临床试验、产品许可、定价和报销的要求差异很大。此外,除了最终产品的批准外,用于制造成产品在欧盟分销的血浆采集中心还必须得到欧洲卫生主管部门的批准。
药品可以通过使用集中授权程序或国家授权程序在欧盟获得授权。EMA负责集中授权程序。
集中授权程序
EMA负责人类药物的集中程序,或社区授权程序。这一程序导致社区营销授权,这是在整个欧盟范围内有效的单一营销授权,以及在欧洲经济区/欧洲自由贸易联盟国家冰岛、列支敦士登和挪威。
社区授权程序是强制性的:
| ● | 来自生物技术过程的药物,如基因工程; |
| ● | 先进疗法药物,如基因疗法、体细胞疗法或组织工程药物; |
| ● | 对首次实施社区授权程序时未获得社区上市许可的含有新活性物质的人用医药产品,其治疗适应症为治疗人类免疫缺陷病毒(“HIV”)或后天免疫缺陷综合征(“AIDS”)、癌症、神经退行性疾病、糖尿病、自身免疫性疾病等免疫功能障碍或病毒性疾病的;以及 |
| ● | 官方指定的孤儿药(罕见病用药)。 |
社区授权程序对产品是可选的:
| ● | 含有用于上述以外适应症的新活性物质; |
| ● | 代表重要的治疗、科学或技术创新;或 |
| ● | 为此,授予社区营销授权将符合欧盟公共卫生的利益。 |
我们的血液衍生产品不受强制社区授权,但它是我们新产品的一个选项。Flebogamma®DIF50 mg/ml和100 mg/ml,用于密封剂和Tavlesse(fostamatinib)的VeraSeal溶液通过社区授权程序获得批准。
通过社区授权程序的申请直接提交给EMA。EMA相关科学委员会的评估需要长达210天的时间,在评估结束时,委员会会就药物是否应该上市通过一项意见。这一意见随后被转交给欧盟委员会,该委员会拥有在欧盟授予营销授权的最终权力。
一旦获得社区营销授权,该授权的持有者可以开始向所有欧盟国家的患者和医疗保健专业人员提供该药物。
84
国家授权程序
每个欧盟成员国都有自己的程序,在自己的领土内,对不属于共同体授权程序范围的药品进行授权。这类药品在几个国家的授权,企业可以同时选择两种可能的途径。
| ● | 分散程序.使用分散程序,公司可以在多个欧盟国家申请同时授权尚未在任何欧盟国家获得授权且不属于集中程序强制范围的药品。 |
| ● | 互认程序.在互认程序中,一种药品首先在一个欧盟成员国获得授权,按照该国的国家程序。在此类授权之后,可以通过相关国家同意承认原始的全国性营销授权的有效性的程序,向其他欧盟成员国寻求进一步的营销授权。 |
我司产品Niuliva 250I.U./ml、XMIBify 200mg/ml通过分散程序获批。我们的产品Prolastina®1000毫克/毫升,和Gamunex®10%和部分人血白蛋白Grifols/白蛋白许可通过互认程序获批。我们所有其他产品均根据个别国家程序获得批准。如果我们想在未来将我们的产品许可扩展到其他欧洲国家,我们期望使用互认程序。
在某些情况下,这些程序中出现的争议可以作为“转介程序”的一部分提交给EMA进行仲裁。
孤儿药指定
指定孤儿药品的申请由EMA通过孤儿药品委员会进行审查。孤儿认定的标准是:
| ● | 该药品拟用于诊断、预防或治疗在提交指定申请时在欧盟影响不超过10,000人中的5人的危及生命或慢性衰弱状况(流行标准); |
| ● | 该医药产品意在诊断、预防或治疗危及生命、严重衰弱或严重慢性疾病,在没有激励的情况下,该医药产品上市后的收入不太可能覆盖其开发投资;和 |
| ● | 要么没有授权有关病症的令人满意的诊断、预防或治疗方法,要么,如果存在这种方法,该药品将对受病症影响的人有重大益处。 |
某一医药产品被指定为孤儿的公司受益于以下激励措施:
| ● | 协议援助(产品开发阶段孤儿药科学建议); |
| ● | 直接获得集中上市许可和10年营销独占权; |
| ● | 财政奖励(费用减免);和 |
| ● | 欧盟委员会提供的一份清单中详细列出了国家激励措施。 |
85
孤儿药产品可享受以下费用减免等级:
| ● | 中小企业(SME)礼宾援助和后续行动全额(100%)减免,儿科相关援助非中小企业赞助者全额减免,非儿科援助非中小企业赞助者减免75%; |
| ● | 为确定哪些公司有资格获得中小企业奖励,EMA适用欧洲共同体委员会第2003/361/EC号建议中提供的微型、小型和中型企业的定义。要获得援助资格,企业必须在欧洲经济区成立,雇员少于250人且年营业额不超过5000万欧元或年资产负债表总额不超过4300万欧元; |
| ● | 对所有保荐机构预授权检查全减,对中小企业预授权检查减90%; |
| ● | 中小企业新申请社区营销授权全额减免,非中小企业保荐机构减免10%;和 |
| ● | 授予上市许可后第一年仅向中小企业开展含年费的授权后活动全额减免。 |
我们有以下产品的EMA孤儿药指定:
| ● | alpha-1蛋白酶抑制剂(吸入用),用于治疗囊性纤维化;及 |
| ● | α-1蛋白酶抑制剂(吸入用),用于治疗先天性α-1抗胰蛋白酶缺乏症。 |
因为这些产品中的每一个都已经在欧盟获得了非孤儿适应症的授权,为了获得上述任何孤儿适应症的上市许可,我们将被要求通过社区授权程序为此类适应症申请单独的上市许可,使用不同的专有名称。无法将现有的上市许可延长至涵盖新的孤儿适应症。孤儿和“非孤儿”适应症不能在同一上市许可范围内。
86
英国监管流程
英国(“英国”)于2020年1月31日退出欧盟,不再是欧盟成员国。过渡期,在此期间欧盟制药法继续适用于英国,于2020年12月31日结束。
截至2021年1月1日,该协议在爱尔兰/北爱尔兰适用,并对英国针对北爱尔兰的医药产品的上市许可产生影响。然而,欧盟和英国之间有一项名为“温莎框架”的新协议,该协议修订了《北爱尔兰议定书》,并规定了向北爱尔兰供应药品的长期安排。温莎框架将确保药品能够在英国范围内获得药品和保健产品监管机构(“MHRA”)的批准和许可,并规定不适用欧盟伪造药品指令(“FMD”)对在北爱尔兰上市和供应的药品的要求。这些新安排自2025年1月1日起生效。
英国有几条航线获得上市许可。可用的选项由预期市场和应用类型决定。要获得上市许可,您需要使用以下程序之一:
国家航线:
| ● | 国家程序(a 150天程序).这一国家150天加速程序可用于高质量申请在英国上市一种药物; |
| ● | 滚动审查.允许在模块(s)中提交您的申请,以获得在英国的营销授权。这是一条上市许可申请的新途径,英国一种新活性物质的申请人逐步提交eCTD档案的模块,供MHRA预先评估,而不是作为合并的完整档案提交的一部分。 |
这一滚动审查旨在通过提供定期增强的监管互动和建议来简化新药开发,以降低最后阶段失败的风险,并可能与目标开发概况(“TDP”)相结合,为创新药物的开发提供更清晰的途径。
任何基于“完整卷宗”的新活性物质的上市许可申请,包括生物制品,均可获得滚动审评资格;
| ● | 国际承认程序(60天至110天程序).截至2024年1月1日,欧共体决定依赖程序和相互承认/分散依赖程序已被新的国际承认程序(“IRP”)所取代。这条路线适用于新的上市许可申请、变体、线路延长和续订,并对已经从MHRA指定的参考监管机构(“RRS”)之一获得同一产品授权的申请人开放。人用医药产品委员会的积极意见或相互承认/分散的积极程序结果是IRP目的的RR授权。除了EMA和欧盟成员国主管当局,还有其他可能的RR(如澳大利亚、加拿大和美国)。IRP将允许MHRA为英国患者的利益考虑到值得信赖的监管伙伴的专业知识和决策。MHRA将对IRP申请进行有针对性的评估,但如果所提供的证据被认为不够可靠,则保留拒绝申请的权力。 |
| ● | 来自北爱尔兰的不受限制的访问(UAP)(为期70天的程序).申请人可以在某些符合条件的情况下,寻求在英国承认在北爱尔兰批准的营销授权。在实施温莎框架后,如果获得批准,通过UAP进行的营销授权(MA)将导致英国范围内的MA和北爱尔兰MA将被撤销。 |
87
该路线可用于通过欧洲程序(仅限MR或DC程序)在北爱尔兰批准的营销授权。
申请应包括获准在北爱尔兰上市的档案,并附有相关RMS评估报告的所有迭代。
国际航线(协作程序):
| ● | Access财团.Access联盟是一个由监管机构组成的中型联盟,它们共同努力促进更大的监管协作,并为打算在英国、澳大利亚、加拿大、新加坡和/或瑞士销售一种药物的公司调整监管要求。MHRA于2020年加入该联盟,并于2021年1月开始工作共享应用程序;以及 |
| ● | 奥比斯计划.Project Orbis是一个由FDA协调的项目,涉及澳大利亚(TGA)、加拿大(加拿大卫生部)、英国(MHRA)、新加坡(HSA)、巴西(ANVISA)、以色列(IMOH)和瑞士(Swissmedic)的监管机构,以审查和批准有前景的癌症治疗方法。 |
更多信息可以在英国的许可证申请网站(www.gov.uk)上找到。
加拿大监管程序
授权上市。2024年,加拿大卫生部实施了多项监管现代化举措,以简化产品审批并增强对公共卫生需求的响应能力。值得注意的是,2024年11月,加拿大卫生部引入了敏捷许可框架,修订了《食品和药品条例》(“FDR”)和《医疗器械条例》(“MDR”)。这些修正案扩大了加拿大卫生部对市场授权施加条款和条件的权力,并正式使用滚动审查,以促进更早获得有前景的疗法。治疗产品在接受评估其安全性、有效性和质量的审查后,可以在加拿大上市。新药提交必须提交给加拿大卫生部进行审查,申办者必须在产品在加拿大上市之前收到合规通知(“NOC”)和/或药物识别号(“DIN”)。药品产品的审查责任由加拿大卫生部治疗产品局(“TPD”)负责,而生物制品的审查责任则由生物制品、放射性药物和基因治疗局(“BGTD”)负责。在加拿大上市的任何产品都需要有活性DIN。我们的IG、A1PI、白蛋白和超免疫产品均须遵守这些审查和授权程序。
市场授权的变更。加拿大现有市场授权有四类变化。1级变化被认为“明显不同”,有可能影响产品的安全性、功效、质量或有效性。这些都需要提交补充新药提交,并且在实施变更之前必须由加拿大卫生部签发NOC。2级变更不被视为“重大”,但“应通报的变更”提交必须提交给加拿大卫生部进行审查,并通过向赞助商发出“无异议”信函提供批准。3级变更影响安全性、质量或有效性的可能性极小,无需加拿大卫生部事先批准即可进行;这些变更的摘要将与申办者的年度药物通知一起报告给加拿大卫生部。基于对风险的预期,在没有任何通知加拿大卫生部的情况下实施了4级更改。
短缺管理。2024年12月,加拿大卫生部提出了对FDR和MDR的修正案,以加强其管理药品和医疗设备短缺的权威。如果获得通过,这些修正案将要求市场授权持有者报告短缺、停产和需求意外激增,从而使加拿大卫生部能够更主动地应对供应风险。
临床试验。临床试验申请(“CTA”),在进行任何建议使用新产品或使用现有产品的研究方案之前,必须向加拿大卫生部提交,其中适应症、目标人群、给药途径或剂量与当前市场授权不同。CTA应包括所进行的临床前和临床研究的摘要以及(如适用)化学、制造和控制数据,并提交给TPD(针对药品)或BGTD(针对生物制品)进行审查。TPD或BGTD负责评估参与者的保护和安全以及产品质量;对于被认为可以接受的研究,他们将向赞助商发出“无异议”信函。在进行研究之前,还需要每个试验的研究伦理委员会批准。
88
机构许可。加拿大境内所有涉及药品产品的制造、包装/标签、测试、进口、分销或仓储的机构都必须具有当前的机构许可证(一旦颁发机构许可证,必须在每年的4月1日之前提交年度报告,以保持该许可证的有效性)。作为进口商/分销商,部分许可要求包括证明根据许可进口/分销的产品的制造、包装/标签或测试所涉及的任何外国(非加拿大)设施符合cGMP。
批后要求。2024年12月,加拿大卫生部修订了有关产品召回的监管框架,引入了强制性报告义务,以加强监督和应对能力。健康产品和食品分局检查局继续检查持牌机构的cGMP合规情况。药品不良反应必须按照加拿大卫生部的药物警戒要求向已上市健康产品管理局报告。
监管协调。截至2024年5月1日,CADTH过渡到加拿大药物管理局(“CDA”)。CDA现在在协调国家药物政策、提供基于证据的健康技术和疗法评估以及就资助决定向公共支付者提供建议方面发挥着更广泛的作用。
美国、欧洲、英国和加拿大以外市场的监管程序
美国、加拿大和欧洲以外国家的大多数监管机构要求,产品在获得本国市场授权之前,必须先获得FDA或欧洲当局的批准。有数量有限的国家(巴哈马、百慕大、关岛、阿曼和卡塔尔)不需要对产品进行进一步的当地产品注册,它们可能会根据现有的FDA批准进行分销。
除了要求提交包含支持产品安全性、功效和质量的文件的许可申请外,许多国家还要求提交我们产品的FDA出口证书,以保证此类产品可以在美国合法销售。医药产品研究所证书(“CPP”)和/或外国政府证书(“CFG”)由FDA应在美国以外国家寻求许可的制造商的请求颁发。CPP符合世界卫生组织(“WHO”)制定的格式,旨在供进口国在考虑是否许可相关产品在该国销售时使用。CFG提供的文件表明,该产品可以在美国合法销售,制造商符合GMP。美国、加拿大和欧洲以外国家有限数量的监管机构进行现场检查,以验证GMP合规性。未能维护和记录GMP合规性可能会导致撤销上市许可。此外,产品的制造或测试程序的变更需要在提交变更之前在美国批准变更以在国际市场注册。这些变化可能需要在每个市场获得批准,以维持产品分销。此外,支持我们出口业务的分销商的任何变化都可能导致销售损失。
药品定价与报销
在美国和其他国家,我们产品的销售在物质方面取决于第三方付款人是否可以报销。第三方支付方包括政府健康项目、管理式医疗服务提供者、私人健康保险公司和其他组织。这些第三方支付方越来越多地挑战价格,并审视医疗产品和服务的成本效益。此外,监管部门新批准的保健品报销情况存在较大不确定性。例如,如果第三方付款人不认为产品与现有替代产品相比具有成本效益,他们可能会拒绝报销。可能无法获得足够的第三方补偿,以使我们能够维持足够的价格水平,以实现我们在产品开发方面的投资的适当回报。
美国药品定价和报销
在美国,我们的产品根据几个政府计划报销或购买,包括医疗补助、医疗保险(B和D部分)和340B计划。Medicaid是一项州和联邦政府的联合健康计划,为低收入个人提供有保障的门诊处方药。Medicare是一项由联邦政府运营的计划,为65岁及以上的人以及任何年龄的具有特定残疾的人提供医疗保健。340B计划是美国联邦政府根据《小灵通法案》制定的药品定价计划。联邦资金用于支付我们在Medicaid和Medicare Part B计划下的产品的可用性要求我们在340B计划下延长折扣。
89
医疗补助、340B计划和退伍军人事务部。
医疗补助包括各州不同的各种报销计划,并规定了适用于按服务收费和管理式医疗安排的报销要求。这些要求适用于我们的某些产品。根据Medicaid,药品制造商根据各州提供的使用数据和制造商提供的定价信息向各州支付回扣,例如AMP(制造商平均价格)和制造商在回扣期间向美国任何实体在计算AMP的同一季度的任何定价结构中提供的最低价格(“最佳价格”)。各州与美国联邦政府分享回扣。大多数品牌药的回扣金额为每单位AMP的23.1%或经美国所有城市消费者消费价格指数(“CPI-U”)调整的每单位AMP和最优惠价格之间的差额,但有某些例外情况。例如,对VIII因子、IX因子等特定凝血因子的返利金额为每单位AMP的17.1%或经CPI-U调整的AMP与每单位最优价格之间的差额中的较大者,对非创新多来源(仿制药)药物的返利金额最低等于AMP的13.0%。
联邦资金用于支付我们在Medicaid下的产品的可用性要求我们根据340B计划延长折扣。340B计划将处方药折扣扩大到某些实体,包括各种社区卫生诊所和接受政府医疗保健赠款的某些其他实体,以及为低收入个人提供不成比例份额服务的医院、某些癌症中心、儿童医院、重症接诊医院和农村转诊中心。340B计划规定了一种基于小灵通法案上限价格的定价方法,该价格通常不能大于AMP减去根据Medicaid药品回扣计划建立的单位回扣金额。我们与政府签订了一项PPA,据此我们参与了340B计划,向符合条件的实体收取的费用不超过拟用于门诊的药物的小灵通法案上限价格。监督340B计划的联邦机构HHS的HRSA(健康资源与服务管理局)不断发布有关340B计划的不断变化的要求,这造成了不确定性。
同样,作为医疗补助报销的条件,我们根据联邦供应计划(“FSS”)的授权政府用户与退伍军人事务部的FSS合同,提供我们的产品供其购买。这些交易涉及与退伍军人事务部协商确定FSS价格。公司还被要求向四个联邦机构——退伍军人事务部、国防部、海岸警卫队和小灵通(包括印度医疗服务)——提供折扣药品定价,以便联邦资金用于报销医疗补助计划下的产品。对这四个联邦机构的销售必须采用上限价格方法,该方法通常要求药品价格等于或低于上一财年非联邦AMP的24.0%。
90
医疗保险和340B计划。
可能影响Grifols集团报销的主要医疗保险计划是涵盖医生服务和门诊护理的医疗保险B部分,以及提供自愿门诊处方药福利的医疗保险D部分。
Medicare Part B报销提供者在门诊环境中提供的某些涵盖药物和生物制剂,例如医生办公室和医院门诊环境。报销率历史上一般为销售均价(“ASP”)+ 6%。从2018年1月1日开始,CMS的一项规则将Medicare B部分报销降低到ASP-22.5 %的比率。美国最高法院于2022年6月15日裁定此类削减为非法,导致康哲药业将一般ASP + 6%的税率追溯至2018年1月1日。根据这一裁决,康哲药业于2023年11月8日发布了一项新规则,确定受影响的医院将获得一笔一次性总付金额,相当于如果2018-2022年340B计划支付政策从未存在,他们将获得的大致付款。340B计划仍然受到涉及诉讼的法律挑战,这些诉讼可能会导致计划变更,从而产生不确定性。我们认为,我们符合340B计划的要求,并正在继续审查和监测影响340B计划的这些和其他发展。此外,根据2013年《两党预算法案》和随后的措施,联邦医疗保险在2013年至2032年的联邦财政年度将削减2%的联邦支出,即“封存”,包括根据联邦医疗保险报销的药物。由于进一步的国会行动可能会减少、消除或以其他方式改变这种支付减少,因此这种对医疗保险报销的隔离的全部影响仍不确定。
Medicare Part D承保范围通过与CMS签约的私营保险公司进行管理。为了根据该计划获得付款,该计划涵盖我们的某些产品,我们需要与根据联邦计划指导运营的私营保险公司协商价格,这些价格可能低于我们可能获得的价格。此外,医疗保险D部分计划还包括一项覆盖缺口功能,即一旦受益人为医疗保险D部分下应付的药物支出了一定的金额,医疗保险D部分的福利将在一段时间内减少,直到这些受益人产生一定水平的自付费用。根据这一覆盖缺口,药品生产企业被要求为某些属于受益人覆盖缺口的药品提供70%的折扣(“覆盖缺口折扣”)。然而,截至2025年1月1日,根据2022年联邦通胀削减法案,CMS取消了覆盖缺口设计和覆盖缺口折扣,并实施了“制造商折扣计划”,根据该计划,在受益人满足其医疗保险D部分免赔额后,药品制造商通常必须在初始覆盖阶段为适用药物提供10%的折扣,在灾难性覆盖阶段提供20%的折扣。由于这一新设计有望降低医疗保险受益人的自付费用,制造商在这些费用中的份额可能会增加。因此,从2025年开始,我们的净收入可能会受到不利影响。
91
此外,2022年的《通胀削减法案》首次为Medicare提供了直接与药品制造商谈判药品价格的能力,以确定Medicare将为Medicare D部分(2026年生效)和Medicare B部分(2028年生效)涵盖的某些药品支付的价格。某些药物被排除在谈判过程之外,例如将孤儿药指定为其唯一FDA批准的适应症的药物和某些血浆衍生药物。如果我们的药物属于上述任何排除类别,Medicare将没有能力就这些药物谈判我们的价格。未能遵守程序要求的制造商可能会受到民事罚款和消费税。
同样根据2022年的《通胀削减法案》,如果制造商普遍提高Medicare B部分涵盖的品牌处方药和生物制品或Medicare D部分涵盖的某些药物和生物制品的价格,在每种情况下的价格都高于此类产品的适用通胀率,那么该制造商将被要求向Medicare支付回扣。如果我们的产品被Medicare受益人使用,我们将被要求向Medicare支付回扣,否则可能面临代表实际价格与虚高价格之间差异的罚款。并且,从2025年开始,这项法律将制造商与医疗保险支出相关的责任修改为高于受益人的自付费用上限。在2023年12月13日的指导文件中,CMS大致概述了其计算方法和过程,包括某些调整(例如在药物短缺的情况下,例如为血浆衍生产品提供了某些更大的减少)。CMS于2024年11月1日发布了联邦医疗保险处方药通胀回扣计划的最终规则制定,包括将这些计划编纂成文。从2025年开始,CMS被要求开始为这些回扣向药品制造商开具发票,包括2022、2023和2024年的发票。生产企业未及时支付到期返利金额,可能会被处以民事罚款。我们将继续审查和监测医疗保险下的这些新的通胀削减法案计划,这些计划造成了不确定性,并可能对我们的业务产生不利影响。
其他相关规定。
如果品牌处方药和生物制剂的某些制造商和进口商向特定的美国政府健康计划(例如退伍军人事务部)或根据此类特定的政府健康计划(例如医疗保险B部分、医疗保险D部分和医疗补助)的覆盖范围,该实体已将超过500万美元的品牌处方药和生物制剂销售额汇总,则一般而言,ACA会向该实体征收年费。向每个涵盖实体收取的费用一般计算为归属于所有涵盖实体的品牌销售总额的分配部分,该总额可能会发生变化。从2019年至今,总额为28亿美元。此外,《处方药用户费用法案》(“PDUFA”)规定了制药和生物公司就某些药物和生物制品的批准申请、某些生物制品的许可以及每年为符合条件的产品评估的某些处方药计划费用向FDA支付的用户费用。PDUFA下的费用涵盖了FDA运营预算的很大一部分,该措施还涉及监管审批流程的各个方面,例如时间安排和程序。PDUFA每五年接受一次国会的重新授权,2022年9月,FDA 2022年用户费用重新授权法案签署成为法律,重新授权2023至2027财年的PDUFA。
美国联邦、州和地方政府已经颁布并继续考虑额外立法,以限制医疗保健成本的增长,包括处方药的成本。美国越来越多的州也提出或通过立法,寻求直接或间接监管药品定价,例如要求药品制造商公开报告定价信息或对州机构购买的药品设置最高价格上限。例如,2024年6月,纽约实施了一项处方药价格透明度法,要求处方药制造商对某些超过规定阈值的药品价格上涨提供提前通知和解释。这类法律可能导致我们在受影响的产品上遇到额外的定价压力,并可能对我们的业务产生不利影响。
此外,如果政府和第三方支付方未能提供足够的覆盖范围和报销,我们获得商业销售监管批准的任何产品的适销性都可能受到影响。现有和未来的立法可能会限制对我们现有产品或我们正在开发的候选药物的支付,包括可能允许联邦政府直接与制造商谈判价格。美国这种对管理式医疗日益重视的情况有所增加,并将继续加大药品定价压力。有关与报销和定价相关的某些风险的讨论,见第一部分第3项,“关键信息—— D.风险因素——与医疗保健行业相关的风险——美国医疗改革可能会对我们的业务产生不利影响。”
92
欧盟药品定价和报销
我们在欧盟的运营受到影响我们产品定价和市场准入的法规的约束。欧盟成员国政府能够通过适用于国家医疗保健系统的成本控制措施来监管医药产品的价格。因此,在过去几十年中,欧盟成员国政府一直在引入严格的卫生经济学和结果研究(“HEOR”)标准,这是一个研究医疗干预措施的经济、临床和社会影响的多学科领域,以限制成本增加,特别是在创新处方药方面。
这些HEOR标准正由健康技术评估(HTA)组织以国别为基础应用,该过程评估健康技术和干预措施的效果和影响,为医疗保健领域的政策和决策提供信息,包括成本效益分析、预算影响模型和与现有已上市(或在研)药物相比增加的临床益处,这些药物被用作比较基准,以评估价值主张并确定价格和报销水平。欧盟成员国还寻求通过立法和卫生政策来限制医疗保健支出,对医药产品实施强制性回扣,并对制药行业进行财政追回。我们预计,欧盟成员国将在未来几年继续采取行动减少医疗保健支出。
其他国家的定价和偿还
全球许多国家一直在采取措施控制医疗保健成本,尤其是与处方药相关的成本。例如,在亚洲,各国的药品定价和报销规定差异很大,反映出不同的医疗基础设施和经济状况。在中国,政府实施了多项改革,以控制药品价格和改善准入。National医疗安全管理局(“NHSA”)对药品集中采购进行监督,这导致许多药物大幅降价。在印度,国家药品定价管理局(“NPPA”)对药品价格进行监管,以确保药品保持可承受的价格。国家药品监督管理局执行“药品价格管制令”,根据生产成本、市场竞争等因素,对基本药物设置最高限价。此外,印度推广仿制药一直是其让医疗保健更容易获得和更具成本效益的战略的基石。
澳大利亚医疗服务咨询委员会(“MSAC”)也使用HTA框架来评估公共资助申请,包括:(i)PICO(人口、干预、比较者、结果),用于描述卫生服务或技术的人口、干预、比较者和结果;(ii)评估报告(由申请人或HTA小组制定),用于审查临床证据并对服务或技术进行经济和财务评估;(iii)对申请人制定的评估报告进行独立评论(评论);以及(iv)利益相关者的咨询意见。
日本的医疗保健费用以按服务收费(“FFS”)为基础进行管理,其中提供者根据每个项目分配的点数计算报销,然后根据点数对服务或产品进行报销。日本的支付系统(诊断程序组合,或“DPC”)类似于在美国发现的诊断相关团体(“DRG”)预期支付系统(“PPS”),尽管DPC并没有因为其独特的PPS与FFS的组合而导致成本降低,但人们强烈反对进一步整合PPS。
在拉丁美洲,各国采用多种策略来规范药品定价和报销,通常将直接价格控制与参考定价系统相结合。在巴西,1999年颁布的仿制药立法通过促进使用仿制药以提高可负担性,对药品定价产生了重大影响。National Health监测机构(“ANVISA”)负责监督这些仿制药的监管和批准,药品市场监管商会(“CMED”)则在考虑生产成本和经济评估等因素的情况下为药物设定最高价格。在阿根廷,政府还实施直接价格管制,与制药公司谈判价格以保持可负担性。这两个国家都采用参考定价系统,将药品价格与其他国家的价格进行基准比较,以确保竞争力并防止过度定价。
93
在加拿大,药品定价和报销由联邦监督和省/地区合作共同管理。专利药品价格审查委员会(“PMPRB”)是负责确保专利药品价格不过度的联邦机构。它通过审查类似药品在加拿大和国际上的价格等因素,确定最高允许价格。泛加拿大药品联盟(“PCPA”)代表跨省和地区的公共药品计划谈判药品价格,旨在实现一致和更低的药品成本。此外,加拿大健康药物和技术机构(“CADTH”)开展健康技术评估,包括临床和经济评估,为大多数公共药物计划的报销决定提供信息。
项目4.A.未解决的工作人员意见
没有。
项目5.经营和财务审查及前景
以下是我们截至2024年12月31日和2023年12月31日以及截至2024年12月31日止三年的财务状况和经营业绩的回顾,以及已经影响或预计可能影响我们持续和未来经营的关键因素。您应该结合我们的经审计的综合财务报表以及本年度报告中表格20-F其他地方包含的随附附注阅读以下讨论和分析。
本次讨论中包含的一些信息,包括有关我们的业务计划和战略以及我们预期的融资来源的信息,包含涉及风险和不确定性的前瞻性陈述。您应该阅读第一部分中的“关于前瞻性陈述的警示性陈述”,以讨论与这些陈述相关的风险。您还应该阅读第一部分的第3项,“关键信息—— D.风险因素”,以讨论可能影响我们的业务、财务状况和经营业绩的某些因素。
我们根据国际会计准则理事会发布的国际财务报告准则编制了截至2024年12月31日和2023年12月31日以及截至2024年12月31日止三年的经审计合并财务报表。除另有说明外,本项目所包含的财务信息及相关讨论和分析均以欧元表示。除非另有说明,本20-F表年度报告中的财务信息分析基于我们截至2024年12月31日和2023年12月31日以及截至2024年12月31日止三年的实际经审计综合财务报表。
有关我们列报财务信息的更多信息,请参阅本第一部分中的“财务和其他信息的列报”。
a. |
经营业绩 |
后续事件
Biotest AG公开摘牌购买要约
2025年3月31日,我们的董事会批准通过我们的子公司Grifols Biotest Holdings GmbH提交公开摘牌购买要约,以收购我们的子公司Biotest AG的所有无面值不记名普通股和所有无投票权不记名优先股。董事会打算向Biotest AG股东提供每股普通股43.00欧元和每股优先股30.00欧元的收购价格。要约的条款和条件将在一份要约文件中传达,该文件将在未来几周内准备好并提交给德国联邦金融监管机构Bundesanstalt f ü r Finanzdienstleistungsaufsicht(BaFin)的批准。不迟于股东接受要约的最后期限届满前十个工作日,我们打算申请将Biotest AG股票摘牌,并将这些股票从法兰克福证券交易所的交易中移除。
94
董事会变动
2025年2月25日,我们的董事会非执行主席Thomas Glanzmann先生宣布,他将于2025年我们的股东大会后从董事会退休,预计将于6月举行。Glanzmann先生将由独立董事会成员Anne-Catherine Berner女士担任非执行主席。随着独立主席的任命,根据西班牙法律,独立首席董事的职位将不再是强制性的。我们的董事会将不会提议更换此类空缺,并将在2025年股东大会后提议将董事会成员总数减少至12名。
从ImmunoTek收购单采血浆中心
2024年4月1日,通过我们的子公司Grifols Bio North America,LLC(“GNBA”),我们以1.349亿美元的价格从ImmunoTek收购了位于美国的七个血浆采集中心。2024年7月1日,GNBA以1.301亿美元从ImmunoTek收购了另外7家美国血浆采集中心。这些交易是根据2021年与ImmunoTek签订的合作协议进行的,该协议于2023年和2024年进行了修订,以安排在美国建设、许可和启用28个单采血浆中心。根据该协议,我们成立了ITK JV,这是一家联合运营公司,我们通过该公司最初持有28个单采血浆中心中每一个75%的权益,而ImmunoTek持有剩余的25%。见本部分第一部分项目4,“关于公司的信息—— B.业务概览——原材料”以及本年度报告中包含的我们经审计的合并财务报表附注3、10和34。
按照合作协议的预定,自2025年1月2日起生效,我们购买了八个血浆采集中心,总金额为1.589亿美元。虽然收购最后六个单采血浆中心的时间定于2026年1月,但我们修改了与ImmunoTek的合作协议,截至2025年2月3日购买这些中心,总购买价格为1.224亿美元,其中6000万美元我们提前支付,其余6220万美元将于2026年1月2日到期应付(如原协议规定)。此类延期付款记录在我们的子公司Biomat Holdings LLC为ImmunoTek签发的金额为6930万美元的本票(“本票”)中,其中包括应付给ImmunoTek的大约700万美元的管理费,没有应计利息。六家单采血浆中心作为本票的抵押品,本票由GRIFOLS, S.A.提供担保
由于在2024年收购了14个中心,并在2025年收购了剩余的14个中心,我们现在完全拥有和管理(除了2025年2月收购的最后六个中心,我们将于2025年5月1日开始管理),通过我们的子公司Biomat Holdings LLC(拥有GNBA),ImmunoTek根据2021年7月签订的合作协议开发的所有28个血浆采集中心。与ImmunoTek的合作现已终止(尽管根据过渡服务协议,ImmunoTek将继续管理最后六个中心,直到2025年4月30日),并且GBNA不再是ITK合资企业的成员。2025年2月3日,ImmunoTek发布了GBNA于2023年6月授予ImmunoTek的五项担保中的三项,用于与不受ITK合资公司项下合作影响的某些ImmunoTek血浆采集中心相关的租赁合同。其余两项担保总额约为2000万美元,只要租赁协议仍然有效,这些担保将继续有效。担保金额将随着标的租赁期限的缩短而减少。请参阅本部分第一部分“关于公司的信息—— B.业务概览——原材料”第4项“——影响我们的财务状况和经营业绩的因素——最近的收购”以及本年度报告中包含的我们经审计的综合财务报表附注3、10和34。
影响我们财务状况和经营成果的因素
会计准则变更及差错更正
ITK合资公司
2021年,我们与ImmunoTek就血浆捐赠中心的开设和管理达成合作协议(见本第一部分“公司信息— A.公司历史和发展—重要里程碑”和上文“—后续事件”第4项),从而创建了一家名为ITK JV的合资企业。直到2022财年,我们都承认我们参与ITK合资企业是一项财务投资。然而,在2024年,经过与CNMV的讨论(见下文“—卖空者报告”),我们得出结论,这份协议应被确认为共同经营,要求确认共同控制实体的资产、负债和结果。
95
因此,截至2024年12月31日止年度,ITK合资企业的资产和负债被纳入我们的合并经审计财务报表,金额分别为1.51亿欧元和1.91亿欧元,确认了4000万欧元的准备金负调整,扣除折算差额。此次整合于2023年1月1日起前瞻性开展。这一对准备金的负向调整主要与ITK合资公司在2021、2022和2023年的亏损有关。为在各期间的损益表中准确列报这些损失,2023年和2022年损益表对应的比较数字已在截至2024年12月31日止年度的合并财务报表中重列,其影响分别意味着业绩减少1700万欧元和2300万欧元。
上海RAAS
我们对一家联营公司的非控股权益的会计处理应用有误,导致对上海RAAS的权益法投资进行了更正。根据2019年与上海RAAS订立的协议,于2020年3月30日,我们收到上海RAAS相当于其26.2%股本的股份,以换取代表我们附属公司GDS 45%经济权利的股份。因此,我们持有一家联营公司的股份,而该联营公司反过来又持有GDS的股份。
由于国际财务报告准则没有具体涉及对联营公司的投资入股集团公司时非控制性权益的会计处理,我们选择会计政策是(i)将通过持有上海RAAS的股权获得的间接权益Grifols在GDS中归属于Grifols的所有权百分比增加11.79%(占45%的26.2%),从而将非控制性权益减少该百分比,以及(ii)将上海RAAS就其在GDS的股权确认的任何金额从对上海莱士的权益法投资中排除,因为Grifols合并了GDS净资产的100%。因此,由于2020年3月采用的会计政策,Grifols拥有GDS 66.79%(55% + 11.79%)的应占股权,同时非控股权益减少至33.21%。归属于非控股权益的净权益减少额被综合储备抵销,因为这是与少数股东的交易,没有失去控制权。
由于在2024年出售了上海RAAS 20%的股权(见下文“—最近的处置—上海RAAS”),我们发现,对上海RAAS的投资的初始确认本应不包括根据我们在交易日的会计政策,上海RAAS在GDS中持有的金额,金额为4.57亿欧元。因此,归属于非控股权益的权益减少应减少了2020年3月确认的对上海RAAS以权益核算的被投资单位的投资,而不是影响综合储备。因此,在我们2020、2021、2022和2023财年的财务报表中,上海RAAS的股份和合并储备都被高估了4.57亿欧元。
在此背景下,我们在截至2024年12月31日止年度的合并财务报表的比较信息中重述了截至2023年1月1日与“以权益入账的被投资方的投资”和“合并储备”相关的金额,减少了4.57亿欧元,与截至2023年12月31日的“以权益入账的被投资方的投资”、“持有待售的非流动资产”和“合并储备”相关的金额,分别减少了1.13亿欧元、3.44亿欧元和4.57亿欧元。
96
尽管这一更正导致股本减少4.57亿欧元,但更正对我们的损益表没有影响,代表了不正确的会计处理,但不影响每个受影响财政年度的正确结果。因此,在我们截至2020年12月31日、2021年、2022年及2023年12月31日止年度的经审核综合财务报表中,在上海RAAS的权益法投资中确认的业绩以及归属于GRIFOLS, S.A.和GDS非控股权益的业绩均正确入账。此次更正降低了对上海RAAS投资的账面价值,此次出售上海RAAS 20%股权所录得的净收益在2024年财务报表中得到了准确核算。
综合全面收益表
由于截至2023年12月31日及2022年12月31日止年度的综合全面收益表子标题“权益入账被投资方/折算差额”的符号措辞不准确,在截至2024年12月31日止年度的综合财务报表中,该标题的符号已被修改,对应项目为综合全面收益表子标题“折算差额”。由于这一不精确之处,本子标题已分别修改为截至2023年12月31日和2022年12月31日的1.24亿欧元和6100万欧元的金额,对应子标题“参与以权益法核算的投资的其他综合收益-换算差异”。这一不精确的措辞并未对综合资产负债表中全球范围内考虑的总标题“翻译差异”产生任何影响。
有关上述会计准则变更和错误更正以及这些变更如何影响我们的业绩的更多详细信息,请参阅本年度报告表格20-F中包含的截至2024年12月31日止年度的合并财务报表附注2(d)和10。
卖空者报告
2024年1月9日、2月20日和3月6日,一家做空公司发布报告,质疑我们的会计做法、公司披露和对透明度的承诺,显然是试图压低我们股票的市场价格。这些报告包含大量虚假和误导性陈述。尽管如此,我们的A类和B类股票的价格明显下跌,并继续以比报告发布前显着更低的价格交易。自报告发表以来,我们股票的市场一直高度波动。2024年1月8日,我们的A类和B类股票价格分别收于14.24欧元和10.11欧元。2024年3月7日,即卖空者发布第三份报告的次日,我们的A类和B类股票价格分别收于6.93欧元和4.93欧元。
此外,在报告公布后,西班牙国家证券市场委员会(Comisi ó n Nacional del Mercado de Valores,简称“CNMV”)就做空公司的指控展开了调查,并向我们提出了多项询问,我们已对这些询问进行了及时回复。2024年3月21日,CNMV发布了关于其调查的结论,其中确认我们的财务报表和我们的债务不需要重述。见“— CNMV调查结论。”我们还自愿向SEC提供信息并回应SEC提出的问题,以提供澄清。
我们一直致力于通过采取多项行动来恢复市场、股东和其他利益相关者的信心,其中包括:
| ● | 对西班牙国家证券市场委员会CNMV发起的调查和SEC的信息请求提供充分合作与协作; |
| ● | 及时与我们所有的利益相关者进行沟通,在我们的网站、CNMV门户网站和EDGAR上通过现场电话会议和多次官方沟通的方式分享我们对已发布报告的明确回应。所有新闻稿均可在Grifols网站(https://www.grifols.com/en/other-relevant-information)上公开查阅;以及 |
| ● | 我们成立了一个工作组,成员包括我们的审计委员会成员、来自法律、通信、财务、投资者关系和管理团队的高级管理人员,以及在通信方面具有专长的外部顾问。 |
97
此外,在2024年1月26日,我们向美国纽约南区地方法院提交了一份诉状,控告对已发布报告中的虚假和误导性陈述负责的各方,以追回因此类陈述而对我们和我们的利益相关者造成的财务和声誉损失。被告动议驳回控诉,我们曾极力反对。截至本20-F表格年度报告日期,该动议在法院待决。
CNMV的调查结论和行政制裁程序
由于一家做空机构发布了某些报告,其中包含大量虚假和误导性陈述,在上文“——卖空者报告”中有更全面的描述,CNMV就做空机构提出的指控展开了调查,并向我们提出了多项询问,我们对此及时做出了回应。
2024年3月21日,CNMV发布了关于其调查的结论。最重要的是,CNMV得出的结论是,它认为没有任何必要让Grifols重述其财务报表,所有分析过的关联方交易都是在公平基础上进行的。CNMV还得出结论,它没有发现任何证据表明其财务报表中反映的Grifols的财务债务与事实不符。这些结论构成了对卖空公司就这些要点提出的主张的驳回。
具体而言,CNMV认为合理且符合IFRS,Grifols的会计处理如下:
| ● | 在Grifols的财务报表中合并Haema GmbH(前称Haema AG)和BPC Plasma Inc.; |
| ● | 2021年收购BPL Plasma,Inc.的25家血浆采集中心,Grifols将其作为业务收购入账; |
| ● | 因与上海RAAS订立2019年协议而将GDS并表为受控公司;及 |
| ● | 自2022年起将Haema Plasma KFT并表为受控公司。 |
CNMV确实认为,与ImmunoTek的交易(见本第一部分第4项,“关于公司的信息—— B.业务概览——原材料”和本年度报告中包含的经审计综合财务报表附注10)本应根据IFRS 11作为一项合营安排而不是一项财务投资入账。这一结论导致我们截至2024年12月31日止年度的合并财务报表中以往各期比较数字的错误更正。见上文“—会计准则变更及差错更正”。
此外,CNMV在我们的定期披露中确定了以下需要改进的领域:(i)我们财务报表中某些解释性说明的详细程度,(ii)关联方交易的细分和详细程度,以及(iii)非会计财务业绩指标的列报方式。应CNMV的要求,我们于2024年4月4日向市场发布了一份说明,提供了有关这些改进领域和其他财务披露的额外信息和解释。这份说明是作为表格6-K的当前报告提交给SEC的。
2024年9月25日,中国证监会执行委员会对我司启动行政处罚程序。这一程序是基于上述结论和需要改进的领域。Grifols于2024年11月7日正式提交了我们对制裁的抗辩。CNMV提议的财务制裁不超过100万欧元。截至本年度报告日,行政处罚程序仍在进行中。请参阅本年度报告表格20-F中包含的截至2024年12月31日止年度的合并财务报表附注29。
2024年9月25日,CNMV还对发布上述报告的卖空公司发起了制裁程序。CNMV在其官方公告中表示,通过在其2024年1月9日的报告中包含有偏见、虚假或误导性的内容,以及违反与客观提出投资建议有关的义务,它已在卖空者的行动中发现了有充分根据的信息操纵迹象。此外,CNMV在其公开公告中提到,它将有关卖空公司可能操纵行为的所有信息转发给西班牙检察官办公室,后者找到了刑事诉讼的理由,并在西班牙高级国家法院对Gotham提起了刑事诉讼。
98
价格控制
某些医疗保健产品,包括血浆衍生产品,在其销售的许多市场受到价格管制,包括西班牙和欧盟其他国家。对这些产品的价格管制的存在在过去对我们维持或提高我们的价格和毛利率的能力产生了不利影响,并可能继续产生不利影响。
血浆供应限制
等离子体是等离子体衍生产品生产中使用的关键原材料。我们继续增加收入的能力在很大程度上取决于增加获得血浆的机会。我们目前主要从美国和欧洲(德国、奥地利和匈牙利)获得血浆,主要是通过我们的血浆采集中心,在较小程度上是通过与第三方的协议。
等离子产品需求持续增长可能导致行业供应受限。作为回应,我们和我们的某些竞争对手和独立供应商可以开设一些新的单采血浆中心。
截至2024年12月31日,我们在美国、欧洲、德国、奥地利和匈牙利;加拿大和埃及(通过我们与NSPO的合资企业)运营了400多个血浆采集中心。我们通过有机增长、开设新的血浆采集中心和收购相结合的方式扩大了我们的血浆采集网络。2025年完成从ImmunoTek收购美国28家单采血浆中心。2022年,我们收购了Biotest AG和它,新增了28家血浆采集中心。2021年,我们从BPL Plasma Inc收购了25家血浆采集中心,从Kedplasma,LLC收购了7家美国血浆捐赠中心和1家加拿大血浆中心。在2020年和2019年,我们收购了37家血浆采集中心和10家献血中心,作为涉及Grifols Bio Supplies Inc(接替州际血库集团)和GC Pharma的交易的一部分。
此外,我们专注于通过关闭或合并表现不佳的中心来优化我们的单采血浆中心网络,在2022年关闭了18个表现不佳的中心,并在2023年关闭或合并了7个中心。
最近的收购
从ImmunoTek收购血浆采集中心
自2025年2月3日起,我们完成了从ImmunoTek收购美国28家血浆采集中心的交易。本次收购是根据2021年7月29日与ImmunoTek签订的合作协议完成的,该协议于2023年和2024年进行了修订,以安排28个中心的建设、许可和调试。根据该合作协议,我们成立了ITK JV,这是一家联合运营公司,通过该公司,我们最初持有28个单采血浆中心各75%的权益,而ImmunoTek持有剩余的25%。2024年,我们收购了14个收集中心,总金额为2.65亿美元,2025年,我们收购了剩余的14个中心,总金额约为2.813亿美元。见第一部分第5项“经营及财务回顾及前景—— A.经营成果——后续事项”,第一部分第4项“关于公司的信息—— B.业务概览——原材料”,以及本年度报告中包含的我们经审计的综合财务报表附注3、10和34。
Haema Plasma KFT。
2024年10月31日,通过我们的子公司GWWO,我们从Scranton Plasma,B.V.收购了Haema Plasma KFT. 100%的资本,金额为3500万欧元。见本年度报告所载截至2024年12月31日止年度的合并财务报表附注3(e)和31。另见第一部分第7项“主要股东与关联交易—— B.关联交易——海马等离子KFT。”
萨斯卡通等离子体中心
2023年7月7日,通过我们的全资子公司Grifols Canada Plasma,Inc.(前身为Prometic Plasma Resources,Inc.),我们以约800万欧元的价格从加拿大Plasma Resources Corporation手中收购了位于萨斯卡通(加拿大)的血浆捐赠中心。见本年度报告所载截至2024年12月31日止年度的合并财务报表附注3(a)。
99
Access Biologicals,Inc。
2022年6月15日,通过我们的子公司Chiquito Acquisition Corp.,我们以1.42亿美元收购了总部位于加利福尼亚州圣地亚哥的公司Access Biologicals LLC 51%的有表决权股份。我们曾在2017年1月以5100万美元的价格收购了这家公司49%的有表决权股份。Access Biologicals LLC的核心业务是收集和制造广泛的生物产品组合。结合封闭式材料采购流程,为体外诊断、生物制药、细胞培养和诊断研发等不同市场提供支持服务。自2023年4月1日起,Chiquito Acquisition Corp.和Access Biologicals LLC及其子公司Access Plasma,LLC和Access Cell Culture,LLC与我们的子公司Grifols Bio Supplies Inc合并,后者是合并的存续实体。
Biotest AG收购
2022年4月25日,我们向TIIL收购了德国私人持股公司Biotest Holdings的100%股权,并接受了TIIL授予Biotest Holdings的某些股东贷款的转让。Biotest Holdings进而拥有法兰克福证券交易所上市的德国股份公司Biotest AG 89.88%的普通股和1.08%的优先股。收购Biotest Holdings的收购价为1090518254欧元,其中包括Biotest Holdings授予Biotest AG的3.18亿欧元应收贷款。此外,(1)我们完成了对Biotest AG所有剩余股东的自愿要约收购,以收购他们的普通股和优先股,其中我们收购了1,250,298股普通股(每股43.00欧元)和8,340,577股优先股(每股37.00欧元);(2)在Biotest AG前股东行使适用的德国公司法规定的合法认沽权后,我们于2022年5月收购了185,359股普通股。收购Biotest Holdings、自愿要约收购以及根据认沽权收购股份,使我们在Biotest AG的权益达到97.13%的投票权和70.18%的股本。
为了为此次收购提供资金,2021年10月5日,我们的全资子公司Grifols Escrow Issuer,S.A.U.(“Escrow Issuer”)发行了将于2028年10月15日到期、年利率为3.875%的14.00亿欧元优先票据和将于2028年10月15日到期、年利率为4.750%的7.050亿美元优先票据。在成功达成所有适用的先决条件后,于2023年6月27日,但出于会计目的,自2023年1月1日起生效,托管发行人与公司合并并入公司,公司作为存续实体并承担托管发行人在票据项下的所有义务。见“—— B.流动性和资本资源——信贷来源—— 2021年票据。”
Biotest AG是一家专注于创新血液学和临床免疫学解决方案的全球性公司。总部位于Dreieich(德国),开发、生产和销售应用于血液学、临床免疫学和重症监护的生物医药产品。Biotest AG目前的产品组合包括12种不同的产品,在全球90多个国家拥有商业足迹,在全球拥有约2600名员工。
2025年3月31日,我们的董事会批准了向Biotest AG的少数股东提出的公开摘牌要约。见第一部分第5项,见第一部分第5项,“经营和财务回顾与前景—— A.经营业绩——后续事件—— Biotest AG公开退市收购要约近期收购—— Biotest AG收购。”
近期处置
上海RAAS
2024年6月18日,我们完成了向海尔集团(“海尔”)出售中国公司上海RAAS 20%股权的交易,以换取约18亿美元,同时保留上海RAAS 6.58%的股份。
100
作为与海尔协议的一部分,(1)我们在上海RAAS的董事会中保留一名董事;(2)我们和海尔在交易完成后的三年内不得转让我们各自在上海RAAS的任何股份;以及(3)我们承诺(a)使我们的子公司GDS(其中上海RAAS拥有45%的经济权利和40%的投票权)在2024年至2028年期间实现利息、税项、折旧和摊销前的总收益为8.5亿美元,前提是该等业绩的任何赤字将迫使我们向上海RAAS进行赔偿,金额相当于上述赤字的百分比,该百分比的比例为上海RAAS在该日期持有的股本百分比,(b)促使GDS在2024年至2028年期间向其股东分配其可分配利润的50%,以及(c)将与我们剩余的6.58%上海RAAS股份有关的表决权转让给海尔,期限为自海尔支付购买价款之日起十年。根据GDS的历史业绩表现,我们认为GDS将达到经营业绩要求,不会形成到期赔付。
作为战略联盟和股份购买协议的一部分,我们已将与上海RAAS的现有独家白蛋白分销协议的期限延长至2034年,并有可能再延长十年,并保证在2028年之前根据该协议提供的最低供应量。我们保持并扩大了在中国的业务,我们的目标是进一步发展中国等离子行业,并在诊断领域探索新的机会和协同效应,同时利用出售所得收益显着减少债务。见本年度报告所载经审核综合财务报表附注10、12及29。
根据Biomat USA和Biomat Newco章程中的某些少数股东补救措施,我们将继续监督Biomat集团管理和运营的各个方面。Biomat集团收集的所有血浆将继续通过长期血浆供应协议提供给我们,用于生产血浆衍生药物。
MedKeeper
2022年7月,我们的子公司Grifols Shared Services North America Inc.将作为MedKeeper(“MedKeeper”)开展业务的美国技术公司Geotech,LLC的几乎所有资产出售给美国公司碧迪医疗和公司的关联公司,调整后的购买总价为9160万美元。由于此次撤资,我们在损益表中确认了2310万欧元的收入。我们曾于2018年1月以9800万美元收购MedKeeper的51%股权,并于2020年11月以6020万美元收购剩余的49%股权。
运营改进计划
2023年,我们实施了一项运营改进计划,旨在加强我们的竞争力,并建立一个更精简、更高效、更具成本效益的全球组织(“运营改进计划”)。该计划侧重于三大领域:优化等离子成本和运营、精简企业职能以及提高整个组织的其他效率。
该计划的第一部分,优化血浆成本和运营,改善了我们的血浆采购运营,使我们能够通过以下一套措施保持所需的血浆体积,同时降低每升血浆的成本:
| ● | 2022年关闭或合并18家表现不佳的单采血浆中心,2023年关闭或合并7家; |
| ● | 减少支付给血浆捐献者的补偿; |
| ● | 提高了我们员工的生产力,以每名全职员工的血浆采集量来衡量;和 |
| ● | 安装新的、更高效的血浆置换设备,提高产量。 |
该计划的第二部分,即精简公司职能,通过以下举措导致2023年员工减少约8.0%,主要是在美国的血浆业务(或约2,000名员工):
| ● | 集中和自动化功能; |
101
| ● | 跨业务部门更充分地共享服务; |
| ● | 整合供应商; |
| ● | 精简报告结构; |
| ● | 西班牙的一项劳动力削减计划(ERE),影响了51名员工;以及 |
| ● | 消除重复职能和岗位。 |
该计划的第三部分,提高整个组织的其他效率,使我们能够降低与全球采购、物流和设施等相关的运营成本。这种运营成本的降低需要采取以下举措:
| ● | 房地产合理化影响某些办公室,但不影响工业设施;和 |
| ● | 围绕商业、工业和供应链职能建立全球性组织。 |
运营改善计划增加了我们的运营现金流并改善了我们的财务业绩,从而在我们的运营中节省了成本。2024年,我们的经营现金流为9.02亿欧元,高于2023年的2.19亿欧元,部分原因是根据该计划实施的措施产生了持续影响。2023年,运营改进计划下的措施导致每位全职员工的血浆采集量增加了32.0%,这表明劳动生产率有所提高,与2022年相比,2023年我们产品的制造成本降低了5.0%。
根据国际财务报告准则会计规则,上述影响属于非经常性,因为它们涉及一次性、非常措施。2022年,我们产生了3610万欧元的成本,主要与关闭18个血浆采集中心有关,目的是优化我们的血浆中心网络。在2024年和2023年,我们分别记录了与运营改进计划相关的3600万欧元和1.593亿欧元的重组影响。2024年,这笔费用主要涉及遣散费、咨询费和其他重组活动。
其他因素
我们的财务和经营前景还可能受到许多其他内部和外部因素的重大影响,例如政府监管或解释的不利变化、竞争加剧、无法雇用或留住维持计划增长所必需的合格人员、关键高级管理人员的流失、在发展部分国际业务方面出现问题以及缺乏足够的资本等。
经营业绩
概述
随后的讨论和分析提供了我们的管理层认为与评估和理解我们的综合经营业绩相关的信息。我们鼓励您阅读以下关于我们的财务状况和经营业绩的讨论和分析,以及我们的经审计的综合财务报表和本年度报告中表格20-F其他地方包含的相关说明。
102
截至2024年12月31日止年度,与截至2023年12月31日止年度相比:
|
截至12月31日止年度, |
|
改变 |
|
|||||
合并损益表数据 |
2024 |
|
2023(1) |
|
€ |
|
% |
|
|
|
(单位:千欧元,百分比除外) |
||||||||
持续经营 |
|
|
|
|
|
|
|
|
|
净收入 |
|
7,212,382 |
|
6,591,977 |
|
620,405 |
|
9.4 |
% |
销售成本 |
|
(4,417,844) |
|
(4,108,495) |
|
(309,349) |
|
7.5 |
% |
毛利率 |
|
2,794,538 |
|
2,483,482 |
|
311,056 |
|
12.5 |
% |
研究与开发 |
|
(384,036) |
|
(395,282) |
|
11,246 |
|
(2.8) |
% |
销售、一般和管理费用 |
|
(1,255,291) |
|
(1,372,665) |
|
117,374 |
|
(8.6) |
% |
营业费用 |
|
(1,639,327) |
|
(1,767,947) |
|
128,620 |
|
(7.3) |
% |
其他收益 |
|
— |
|
3,042 |
|
(3,042) |
|
— |
|
与本集团有类似活动的权益入账被投资单位的利润/(亏损) |
|
36,804 |
|
63,740 |
|
(26,936) |
|
(42.3) |
% |
经营成果 |
|
1,192,015 |
|
782,317 |
|
409,698 |
|
52.4 |
% |
财务收入 |
|
44,423 |
|
62,430 |
|
(18,007) |
|
(28.8) |
% |
财务费用 |
|
(714,765) |
|
(596,884) |
|
(117,881) |
|
19.7 |
% |
股息 |
2,060 |
— |
2,060 |
— |
|||||
出售贸易应收款项的财务成本 |
(30,782) |
(24,993) |
(5,789) |
23.2 |
% |
||||
金融工具公允价值变动 |
|
19,882 |
|
1,459 |
|
18,423 |
|
1,262.7 |
% |
金融资产减值 |
|
(9,081) |
|
— |
|
(9,081) |
|
— |
|
汇兑差额 |
|
(59,756) |
|
(16,386) |
|
(43,370) |
|
264.7 |
% |
财务结果 |
|
(748,019) |
|
(574,374) |
|
(173,645) |
|
30.2 |
% |
权益入账被投资单位的利润/(亏损) |
|
— |
|
(922) |
|
922 |
|
— |
|
所得税前利润 |
|
443,996 |
|
207,021 |
|
236,975 |
|
114.5 |
% |
所得税费用 |
|
(231,190) |
|
(43,349) |
|
(187,841) |
|
433.3 |
% |
合并净利润 |
|
212,806 |
|
163,672 |
|
49,134 |
|
30.0 |
% |
(1) |
截至2023年12月31日止年度的财务资料已重列,以适用准则变更及更正错误。请参阅上文“影响我们的财务状况和经营业绩的因素——会计准则的变更和错误更正”,并参阅我们截至2024年12月31日止年度的合并财务报表附注2(d)和10,该报表包含在本年度报告的表格20-F中。 |
净收入
净收入的计算方法是从我们的毛收入中减去某些退款、现金折扣、批量回扣、医疗保险和医疗补助折扣以及其他折扣,这主要是由商品销售产生的。请参阅本年度报告表格20-F中包含的我们经审计的综合财务报表的附注5和24。
我们的业务部门在2024年的综合净收入总额方面报告了创纪录的业绩。我们的净收入在2024年增长了9.4%(按固定汇率计算为10.3%),即6.204亿欧元,与2023年的66亿欧元相比达到了72亿欧元。这些结果主要归因于每升血浆采集成本的降低、对我们关键蛋白质的强劲需求、积极的销量增长和全球市场的产品组合,净收入总额的增长主要是由于我们的生物制药业务部门的表现,如下所述。
103
下表反映了与2023年相比,我们每个业务部门在2024年的净收入汇总:
|
年终 |
|
|
年终 |
|
|
|
|
|||||
|
12月31日, |
|
占总量% |
|
12月31日, |
|
占总量% |
|
|
|
|||
按业务部门划分的净收入汇总 |
|
2024 |
|
净收入 |
|
2023 |
|
净收入 |
|
% var |
|
% var CC(1) |
|
(单位:千欧元,百分比除外) |
|
||||||||||||
生物制药 |
6,142,588 |
85.2 |
% |
5,558,301 |
84.3 |
% |
10.5 |
% |
11.3 |
% |
|||
诊断 |
|
644,898 |
|
8.9 |
% |
670,269 |
|
10.2 |
% |
(3.8) |
% |
2.1 |
% |
生物用品 |
|
215,664 |
|
3.0 |
% |
159,957 |
|
2.4 |
% |
34.8 |
% |
35.3 |
% |
其他 |
|
209,232 |
|
2.9 |
% |
203,450 |
|
3.1 |
% |
2.8 |
% |
3.5 |
% |
各部门间 |
|
— |
|
— |
|
— |
|
— |
— |
— |
|||
合计 |
|
7,212,382 |
|
100.0 |
% |
6,591,977 |
|
100.0 |
% |
9.4 |
% |
10.3 |
% |
| (1) | 以固定货币计算的净收入差异是通过将调整后的当期净收入(使用上一期间的月平均汇率计算)与上一期间的净收入进行比较确定的。见“金融和其他信息的呈现——不变货币。” |
生物制药。生物制药业务部门的净收入增长10.5%(按固定汇率计算为11.3%),从2023年的56亿欧元增至2024年的61亿欧元。这一增长主要是由于全球潜在需求强劲、每升血浆采集成本降低、美国和加拿大以外地区销售的强劲业绩以及有利的销量和产品组合推动了关键蛋白质的稳健表现。2024年,免疫球蛋白(我们的主要蛋白质之一,约占生物制药业务部门收入的60%)的销售额有所增长,在静脉注射免疫球蛋白(IVIG)和皮下免疫球蛋白(SCIG)XAMBify强劲需求的推动下,其净收入增长了14.5%(按固定汇率计算为15.3%)®,SCIG报告增长15.3%(按固定汇率计算为55.5%)。
2024年,与2023年相比,我们的白蛋白销售净收入增长了7.1%(按固定汇率计算为8.0%),继续看到整个中国和美国的需求增加。与2023年相比,2024年销售Alpha-1和特殊蛋白质的净收入增长了4.1%(按固定汇率计算为4.9%)。随着2024年初专业医药分销商的过渡,美国Alpha-1特许经营权继续恢复势头,而狂犬病免疫球蛋白的需求继续稳固。
诊断。诊断业务部门从2023年的6.702亿欧元下降3.8%(按固定汇率计算下降2.1%)至2024年的6.449亿欧元。该业务部门的业绩主要是由我们在血型解决方案(BTS)和分子供体筛查(MDS)业务中确立的强大市场地位推动的。这一增长得到了所有相关市场广泛的地域需求以及血液和血浆捐赠增加的支持。
我们的防弹少年团销售净收入增长11.5%(按固定汇率计算增长14.2%),而MDS业务净收入下降5.3%(按固定汇率计算下降3.9%)。这些结果是由我们在所有相关市场的广泛地理需求以及增加的血液和血浆捐赠推动的。
生物用品。Bio Supplies的净收入增长34.8%(按固定汇率计算为35.3%),从2023年的1.60亿欧元增至2024年的2.157亿欧元,这主要是由于向第三方生物制药公司销售强劲的生物供应商业产品以及整合准入生物制剂、扩大市场范围和客户群。
其他。来自其他的净收入增长2.8%(按固定汇率计算为3.5%),从2023年的2.035亿欧元增至2024年的2.092亿欧元。这一增长是由于我们的医疗保健解决方案业务线的扩张,受肠外营养和复合药房服务的医院解决方案需求的推动。
104
下表反映了与2023年相比,我们每个地理区域在2024年的净收入汇总:
|
年终 |
|
|
年终 |
|
|
|
|
|||||
12月31日, |
占总量% |
12月31日, |
占总量% |
||||||||||
各地区净收入汇总 |
2024 |
净收入 |
2023 |
净收入 |
% var |
% var CC(1) |
|||||||
(单位:千欧元,百分比除外) |
|
||||||||||||
欧洲联盟(2) |
1,541,338 |
21.4 |
% |
1,255,927 |
19.1 |
% |
22.7 |
% |
22.7 |
% |
|||
美国和加拿大 |
|
4,087,030 |
|
56.7 |
% |
3,898,961 |
|
59.1 |
% |
4.8 |
% |
5.6 |
% |
世界其他地区 |
|
1,584,014 |
|
22.0 |
% |
1,437,089 |
|
21.8 |
% |
12.2 |
% |
10.2 |
% |
合计 |
|
7,212,382 |
|
100.0 |
% |
6,591,977 |
|
100.0 |
% |
9.4 |
% |
10.3 |
% |
| (1) | 以固定货币计算的净收入差异是通过将调整后的当期净收入(使用上一期间的月平均汇率计算)与上一期间的净收入进行比较确定的。见“金融和其他信息的呈现——不变货币。” |
| (2) | 在欧盟获得的净收入包括在西班牙获得的净收入。 |
美国和加拿大的净收入增长4.8%(按固定汇率计算为5.6%),从2023年的39亿欧元增至2024年的41亿欧元。这4.8%的增长主要是由于美国市场的潜在需求持续。同时,欧盟地区的净收入从2023年的13亿欧元增长22.7(按固定汇率计算增长22.7%)至2024年的15亿欧元,这主要是由于在几个欧洲核心国家推出了新的IG特许经营产品的相关推出。世界其他地区的净收入增长12.2%(按固定汇率计算为10.2%),从2023年的14亿欧元增至2024年的16亿欧元,这主要是由于全球销量增长和地域多元化。
销售成本
销售成本从2023年的41亿欧元增长7.5%至2024年的44亿欧元。销售成本占净收入的百分比从2023年的62.3%下降到2024年的61.3%。这主要是由于每升血浆采集成本的持续下降(与2023年相比,2024年下降了4.4%)、产量的提高以及整个血浆中心网络的采集效率。参见第一部分“——影响我们财务状况和经营成果的因素——经营改善计划”和第四项,“公司信息——业务概况——原材料。”
毛利率
毛利率从2023年净收入的37.7%增加到2024年的38.7%,这主要是由于收入增长强劲,以及由于产量和血浆中心运营的持续改善,每升血浆的成本降低。见第一部分“—经营改善计划”和第四项“公司信息—经营概况—原材料。”
研究与开发
研发支出下降2.8%,从2023年的3.953亿欧元降至2024年的3.84亿欧元。支出略有减少是由于对我们的研发项目和管道采取了更有效和更有纪律的方法,这标志着向更少、更高优先级和战略性项目的转变。详见本部分第一部分第4项,“公司信息— B.业务概况—研发”。
销售、一般和管理费用
销售、一般和管理费用从2023年的14亿欧元下降8.6%至2024年的13亿欧元。这一减少是由于主要由与我们的运营改进计划相关的遣散费和咨询费组成的非经常性重组成本减少了77.4%,从2023年的1.593亿欧元减少到2024年的36.0百万欧元。
105
财务结果
2024年财务业绩显示,2024年亏损7.48亿欧元,而2023年亏损5.744亿欧元。这一增长主要是由于与2024年赎回的债券(2017年票据为3.2%,2019年系列票据为1.625%)相比,2024年发行的新的优先担保债券(2024年4月票据为7.5%,2024年12月票据为7.125%)的利息支出增加。此外,来自其他金融负债的财务成本包括与Biomat交易相关的费用,据此,GIC投资者赎回了另一份Biomat Newco的B类份额,资本化利率增加至6.88% – 7.38%的范围,而上一年为6.03% – 6.79%。
所得税费用
2024年,我们的所得税前利润为4.44亿欧元,所得税费用为2.312亿欧元,税率为52.1%。我们的有效税率从2023年的19.3%增加到2024年的52.1%,这主要是由于与金额为3200万欧元的上海RAAS交易相关的特别税款以及西班牙税务当局对转让定价的不同解释进行评估导致西班牙不确定的税收拨备从2023年的7660万欧元增加到2024年的1.367亿欧元。
截至2023年12月31日止年度,与截至2022年12月31日止年度相比:
截至12月31日止年度, |
改变 |
|
|||||||
合并损益表数据 |
|
2023(1) |
2022(1) |
|
€ |
|
% |
|
|
(单位:千欧元,百分比除外) |
|
||||||||
持续经营 |
|
|
|
|
|
|
|
|
|
净收入 |
|
6,591,977 |
|
6,063,967 |
|
528,010 |
|
8.7 |
% |
销售成本 |
|
(4,108,495) |
|
(3,850,257) |
|
(258,238) |
|
6.7 |
% |
毛利率 |
|
2,483,482 |
|
2,213,710 |
|
269,772 |
|
12.2 |
% |
研究与开发 |
|
(395,282) |
|
(361,140) |
|
(34,142) |
|
9.5 |
% |
销售、一般和管理费用 |
|
(1,372,665) |
|
(1,195,847) |
|
(176,818) |
|
14.8 |
% |
营业费用 |
|
(1,767,947) |
|
(1,556,987) |
|
(210,960) |
|
13.5 |
% |
其他收益 |
|
3,042 |
|
22,235 |
|
(3,042) |
|
(86.3) |
% |
与本集团有类似活动的权益入账被投资单位的利润/(亏损) |
|
63,740 |
|
103,478 |
|
(39,738) |
|
(38.4) |
% |
经营成果 |
|
782,317 |
|
782,436 |
|
(119) |
|
0.0 |
% |
财务收入 |
|
62,430 |
|
33,859 |
|
28,571 |
|
84.4 |
% |
财务费用 |
|
(596,884) |
|
(478,323) |
(118,561) |
24.8 |
% |
||
股息 |
— |
— |
— |
— |
|||||
出售贸易应收款项的财务成本 |
(24,993) |
(18,201) |
(6,792) |
37.3 |
% |
||||
金融工具公允价值变动 |
|
1,459 |
|
11,999 |
|
19,660 |
|
(87.8) |
% |
金融资产减值 |
— |
— |
— |
— |
|||||
汇兑差额 |
|
(16,386) |
|
7,725 |
|
(28,385) |
|
(312.1) |
% |
财务结果 |
|
(574,374) |
|
(442,941) |
|
(131,433) |
|
29.7 |
% |
权益入账被投资单位的利润/(亏损) |
|
(922) |
|
(1,482) |
|
560 |
|
(37.8) |
% |
所得税前利润 |
|
207,021 |
|
338,013 |
|
(130,992) |
|
(38.8) |
% |
所得税费用 |
|
(43,349) |
|
(90,111) |
|
46,762 |
|
(51.9) |
% |
合并净利润 |
|
163,672 |
|
247,902 |
|
(84,230) |
|
(34.0) |
% |
(1) |
截至2023年12月31日及2022年12月31日止年度的财务资料已重列,以适用准则变动及更正错误。请参阅上文“影响我们的财务状况和经营业绩的因素——会计准则的变更和错误更正”,以及我们截至2024年12月31日止年度的合并财务报表附注2(d)和附注10,包含在本年度报告的20-F表格中。 |
106
净收入
净收入的计算方法是从我们的毛收入中减去某些退款、现金折扣、批量回扣、医疗保险和医疗补助折扣以及其他折扣,这主要是由商品销售产生的。请参阅本年度报告表格20-F中包含的我们经审计的综合财务报表附注24。
我们的业务部门在2023年的综合净收入总额方面报告了创纪录的业绩。我们的净收入在2023年增长了8.7%(按固定汇率计算为10.9%),即5.28亿欧元,达到66亿欧元,而2022年为61亿欧元。积极的市场动态,包括对我们关键蛋白质的强劲需求,以及我们血浆采集量的恢复,对这些结果至关重要,总净收入的增长主要是由于我们的生物制药业务部门的表现,如下所述。
下表反映了与2022年相比,我们每个业务部门2023年的净收入汇总:
|
年终 |
|
|
年终 |
|
|
|
|
|||||
12月31日, |
占总量% |
12月31日, |
占总量% |
|
|||||||||
按业务部门划分的净收入汇总 |
2023 |
净收入 |
2022 |
净收入 |
% var |
% var CC(1) |
|
||||||
(单位:千欧元,百分比除外) |
|
||||||||||||
生物制药 |
5,558,301 |
84.3 |
% |
5,005,382 |
82.5 |
% |
11.1 |
% |
13.3 |
% |
|||
诊断 |
|
670,269 |
|
10.2 |
% |
671,292 |
|
11.1 |
% |
(0.2) |
% |
2.3 |
% |
生物用品 |
|
159,957 |
|
2.4 |
% |
146,076 |
|
2.4 |
% |
9.5 |
% |
11.3 |
% |
其他 |
|
203,450 |
|
3.1 |
% |
250,165 |
|
4.0 |
% |
(18.7) |
% |
(17.8) |
% |
各部门间 |
|
— |
|
— |
(8,948) |
|
(0.1) |
% |
(100.0) |
% |
(100.0) |
% |
|
合计 |
|
6,591,977 |
|
100.0 |
% |
6,063,967 |
|
100.0 |
% |
8.7 |
% |
10.9 |
% |
(1) |
以固定货币计算的净收入差异是通过将调整后的当期净收入(使用上一期间的月平均汇率计算)与上一期间的净收入进行比较确定的。见“金融和其他信息的呈现——不变货币。” |
生物制药。生物制药业务部门的净收入增长11.1%(按固定汇率计算为13.3%),从2022年的50亿欧元增至2023年的56亿欧元。这一增长主要是由于更高的血浆供应、强劲的基本需求、美国和加拿大以外地区销售的强劲业绩以及有利的定价环境和产品组合推动了关键蛋白质的稳健表现。2023年,免疫球蛋白(我们的主要蛋白质之一,约占生物制药业务部门收入的55%)的销售额有所增长,其净收入增长14.9%(按固定汇率计算为17.2%),这是由于静脉注射免疫球蛋白(IVIG)的强劲需求、皮下免疫球蛋白(SCIG)XIMBify的推出®在几个欧洲国家和澳大利亚,以及其在美国等关键市场的增长,使这类产品的销售额增长了40.0%。
2023年,我们的全球白蛋白销售净收入较2022年增长17.6%,这主要是由于中国在需求增加和价格上涨的推动下实现了40.0%的增长。与2022年相比,2023年Alpha-1的销售净收入下降了2.1%。然而,欧洲国家的alpha-1销售逐步恢复,导致2023年第四季度与2022年同期的同比分析增长2.4%。考虑到我们生物制药业务部门结果的其他商业里程碑包括Tavlesse和Vistaseal的商业扩张。
诊断。诊断业务部门的净收入保持稳定,从2022年的6.713亿欧元下降0.1%(按固定汇率计算增长2.3%)至2023年的6.702亿欧元。该业务部门的业绩主要是由于在我们销售的主要国家(包括美国、阿根廷、巴西、西班牙和沙特阿拉伯)销售血液分型解决方案的净收入显着增长6.3%(按固定汇率计算为8.9%)。
107
销售NAT血液和血浆筛查解决方案的净收入下降2.6%(按固定汇率计算增长0.4%)。销售我们的NAT技术的结果受到了与关键客户延长重要合同背景下的定价优惠的负面影响。这一负面影响被销往亚太国家的强劲收入以及美国组织和器官检测市场的进展部分抵消。与澳大利亚红十字会合作在关键地区成功赢得招标也有助于抵消上述负面影响。
重组蛋白收入增长1.2%(按固定汇率计算为2.3%),受我们销售到的主要地区(尤其是美国)的需求以及与关键合作伙伴的十年供应协议的推动。推动该业务部门在2023年增长的其他重要成就有(1)美国推出AlphaID™At Home,an innovative solution to detect alpha-1 deficiency,a genetic disease whose symptomology is similar to COPD and(2)the launch of our CD38 solution,the first solible recombinant protein to facilitate pre-invasion compatibility testing in patients with multiple myeloma。
生物用品。来自Bio Supplies的净收入增长9.5%(按固定汇率计算为11.3%),从2022年的1.461亿欧元增至2023年的1.60亿欧元,这主要是由于我们的子公司Access Biologicals(于2022年收购)的持续整合扩大了该业务部门的产品组合,以及通过向第三方销售超免疫血浆。
其他。来自其他方面的净收入从2022年的250.2欧元下降18.7%至2023年的2.035亿欧元(尽管按固定汇率计算,这意味着增长了4.0%)。这一减少是由于出售了以前属于我们医院部门的某些公司和资产,这是我们在2022年关闭的一个业务部门。
下表反映了我们每个地理区域2023年与2022年相比的净收入汇总:
年终 |
年终 |
|
|||||||||||
12月31日, |
占总净额% |
12月31日, |
占总量% |
|
|||||||||
各地区净收入汇总 |
|
2023 |
|
收入 |
|
2022 |
|
净收入 |
|
% var |
|
% var CC(1) |
|
(单位:千欧元,百分比除外) |
|
||||||||||||
欧洲联盟(2) |
|
1,255,927 |
|
19.1 |
% |
1,032,210 |
|
17.0 |
% |
21.7 |
% |
21.7 |
% |
美国和加拿大 |
|
3,898,961 |
|
59.1 |
% |
3,855,607 |
|
63.6 |
% |
1.1 |
% |
3.4 |
% |
世界其他地区 |
|
1,437,089 |
|
21.8 |
% |
1,176,150 |
|
19.4 |
% |
22.2 |
% |
25.9 |
% |
合计 |
|
6,591,977 |
|
100.0 |
% |
6,063,967 |
|
100.0 |
% |
8.7 |
% |
10.9 |
% |
(1) |
以固定货币计算的净收入差异是通过将调整后的当期净收入(使用上一期间的月平均汇率计算)与上一期间的净收入进行比较确定的。见“金融和其他信息的呈现——不变货币。” |
(2) |
在欧盟获得的净收入包括在西班牙获得的净收入。 |
美国和加拿大的净收入从2022年的38.5亿欧元小幅增长1.1%(按固定汇率计算为3.4%)至2023年的39亿欧元。这1.1%的增长表明,我们的产品在该地区的整体市场增长率低于整体市场增长率,主要是由于我们专注于增加在其他市场的存在,再加上2022年由于新冠疫情造成的暂时竞争压力和血浆供应限制导致美国某些账户的损失。随着我们血浆供应的改善和每升血浆采集成本的下降,我们相信我们将在2024年收回这样的美国账户。与此同时,欧盟地区的净收入从2022年的10亿欧元增长21.7%至2023年的13亿欧元,这主要是由于Xembify销售额的显着增长和新的商业批准,这使得该地区不同产品组合的销售额有所增加。世界其他地区的净收入增长22.2%(按固定汇率计算为25.9%),从2022年的12亿欧元增至2023年的14亿欧元,这主要是由于全球有利的价格上涨。
销售成本
销售成本从2022年的38亿欧元增长6.7%至2023年的41亿欧元。销售成本占净收入的百分比从2022年的63.5%下降到2023年的62.3%。这主要是由于每升血浆采集成本的降低,以及运营改进计划促成的我们整体成本基础的降低。见“—影响我们财务状况和经营成果的因素—经营改善计划”及本部分第一部分第4项“公司信息—业务概况—原材料”。
108
毛利率
毛利率从2022年净收入的36.5%增加到2023年的37.7%,主要是由于强劲的收入增长和每升血浆的成本降低,原因是(1)缓解了新冠疫情的限制,这使得从2022年9月开始在美墨边境恢复血浆捐赠,进而导致捐赠者增加,2023年我们的血浆供应量增加10.0%,以及(2)运营改进计划下的成本节约举措。见第一部分“—经营改善计划”和第四项“公司信息—经营概况—原材料。”考虑到等离子行业的库存核算滞后约9个月,我们的2023年损益表已开始反映继2022年7月创下历史新高后每升成本下降带来的好处。每升成本下降导致2023年下半年毛利率上升。
研究与开发
研发支出增长9.5%,从2022年的3.611亿欧元增至2023年的3.953亿欧元。这些结果强调了Biotest AG的项目被整合到我们的投资组合中,以及我们正在努力整合和开发前沿项目,例如Alkahest和GigaGen的项目。详见本部分第一部分第4项“公司信息— B.业务概况—研发”。
销售、一般和管理费用
销售、一般和管理费用增长14.8%,从2022年的12亿欧元增至2023年的14亿欧元。此类增长的很大一部分是由重组成本推动的,这些成本主要包括遣散费以及支付给与我们的运营改进计划相关的顾问和顾问的费用。此外,由于完成对Biotest AG的整合以及普遍的通胀压力,我们还有一些剩余的成本增加。
财务结果
2023年财务业绩显示,2023年亏损5.744亿欧元,而2022年亏损4.429亿欧元。该增长主要是由于市场对我们在第一留置权信贷便利下的欧元和美元B档定期贷款下的浮动利率债务的利率上升的影响。
所得税费用
2023年,我们的所得税前利润为2.24亿欧元,所得税费用为4330万欧元,税率为20.4%。我们的有效税率从2022年的26.7%下降,主要是由于我们的应税收入的国家组合发生了变化。
监管
有关适用于我们业务的法规的详细信息,请参阅本第一部分第4项,“关于公司的信息—— E.监管事项。”
通货膨胀和外币波动
从历史上看,我们并没有受到核心地区通胀的实质性影响。然而,由于当前的宏观经济背景,我们在劳动力成本和销售、一般&行政成本方面存在一些通胀压力。更多详情见“—经营成果—概述”。
有关外汇波动如何影响我们业务的详细信息,请参阅“— B.流动性和资本资源。”另见第一部分项目3,“关键信息——与公司和我们业务相关的风险——我们的经营业绩和财务状况可能会受到外币汇率不利变化的影响,尤其是欧元相对于美元的价值发生重大转变”和第一部分项目11,“关于市场风险的定量和定性披露——货币风险。”
109
b. |
流动性和资本资源 |
我们的主要流动性和资本需求包括与以下相关的成本和费用:
| ● | 我们业务的运营(有关与我们运营相关的成本和费用的描述和量化,请参阅“—经营成果”、“—流动性和资本资源—经营活动产生的净现金”和“—营运资本”); |
| ● | 现有业务和新业务的资本支出(参见“—资本支出”,了解我们在截至2024年12月31日、2024年、2023年和2022年各年度发生的资本支出,包括其他无形资产和使用权增加的资本支出的描述和量化; |
| ● | 收购的购买价格(有关我们最近收购的描述,请参阅“—最近的发展”和“—影响我们的财务状况和经营成果的因素—收购”);和 |
| ● | 与我们现有和未来债务相关的偿债要求(有关我们的主要债务的描述和量化,请参阅“—信贷来源”)。 |
从历史上看,我们一直通过内部产生的现金流和债务融资来满足我们的流动性和资本需求。截至2024年12月31日,我们的现金和现金等价物总额为9.798亿欧元。此外,截至2024年12月31日,我们的流动性头寸为22.590亿欧元,其中包括根据我们的债务协议提供的未使用信贷额度12.793亿欧元,其中包括根据我们的第一留置权信贷额度作为循环贷款提供的12.793亿欧元。
我们预计,我们的运营现金流加上我们的现金余额和第一留置权信贷融资的循环贷款下的可用性,将提供充足的流动性,为我们目前的债务(主要是如上所述的偿债和收购付款)、预计营运资金需求和至少未来十二个月的资本支出提供资金。目前,我们没有在任何可能对资金汇回有限制的国家产生大量现金,我们估计位于爱尔兰、西班牙和美国的现有现金,连同运营产生的现金,将足以满足关键国家未来的现金需求。
我们致力于中期去杠杆化,并通过(i)内部产生的现金流,以及(ii)中期大幅减少股息支付,保持较高和充足的流动性水平。为进一步履行这一承诺,我们出售了上海RAAS 20%的股权以换取约18亿美元,并将出售所得用于全额赎回2017年票据。请参阅“— A.经营业绩—影响我们的财务状况和经营业绩的因素—近期处置情况—上海RAAS。”
我们的资本支出主要包括扩大和加强我们的生产设施、更换完全折旧的物品以及提高我们的运营效率。此外,我们分配累计产业资本投资以扩大生物制药业务部门的制造能力,以及对诊断和生物用品业务部门的投资,目标是改善我们在美国的血浆采集中心的结构并扩大我们的制造设施。我们还在扩建和搬迁血浆捐赠中心,并改善有关原料分类、制备和储存设施、物流中心和分析实验室的基础设施。
截至2024年12月31日,我们的主要现有合同义务包括金融债务义务,短期和长期债务的本金和利息摊销,其中包括资本化的租赁义务和按市场利率计息的双边信贷便利。此外,于2022年6月28日和2021年10月5日,我们订立了四笔7.05亿美元的交叉货币利率掉期,以对冲2021年票据的部分等值欧元(见上文“—信贷来源”和本年度报告中关于表格20-F的经审计综合财务报表附注30,以进一步讨论我们在2024年12月31日尚未履行的债务义务和相关利率协议)。我们有合同义务,涉及未来支付的许可和特许权使用费,一般基于销售量。
110
历史现金流
下表列出了我们截至2024年12月31日、2023年和2022年12月31日各年度的经营、投资和融资活动产生的现金净额。
截至12月31日止年度, |
||||||
|
2024 |
|
2023(1) |
|
2022(1) |
|
(单位:千欧元) |
||||||
来自(用于)经营活动的现金净额 |
|
902,168 |
|
218,690 |
|
(1,427) |
(用于)投资活动的现金净额 |
|
886,667 |
|
(394,719) |
|
(1,996,123) |
来自/(用于)筹资活动的净现金 |
|
(1,358,714) |
|
171,493 |
|
(164,901) |
(1) |
截至2023年12月31日及2022年12月31日止年度的财务资料已重列,以适用准则变动及更正错误。请参阅上文“影响我们的财务状况和经营业绩的因素——会计准则的变更和错误更正”,以及我们截至2024年12月31日止年度的合并财务报表附注2(d)和附注10,包含在本年度报告的20-F表格中。 |
经营活动产生的现金净额
截至2024年12月31日止年度,我们来自经营活动的净现金为9.021亿欧元,这主要是由于更强劲的营业收入、改善营运资金管理,特别是在库存和贸易应收账款方面,以及对运营费用采取严格的方法。见“— A.经营成果——影响我们财务状况和经营成果的因素——经营改善计划”和本部分第一部分第4项“B.业务概况——原材料。”营运资金损失1420万欧元。对营运资金的主要影响如下:
| ● | 贸易和其他应收款增加4190万欧元,主要是由于第四季度免疫球蛋白销售额大幅增长17.9%(全年增长15.3%),推动了今年第四季度11.7%的高收入增长率。平均收款期限稳定在36天(2023年为36天); |
| ● | 库存水平减少2580万欧元,这主要是由于有效的库存管理、血浆采集的改善以及在美国60%的血浆采集中心实施个性化列线图技术的积极结果,从而能够更精确地控制所收集的数量,并导致减少原材料浪费和血浆分馏过程中的精制,从而导致从每一升采集的血浆中提取更多的产品。2024年12月31日存货周转为294天,2023年12月31日报告为309天;和 |
| ● | 贸易和其他应付款项增加2870万欧元。平均付款期限从2023年12月31日的59天增加到2024年12月31日的61天。 |
截至2023年12月31日止年度,我们来自经营活动的净现金为2.187亿欧元,这主要是由于运营业绩改善、每升血浆采集成本降低以及在我们的运营改进计划的推动下,整个业务的成本基础降低。见“— A.经营成果——影响我们财务状况和经营成果的因素——经营改善计划”和本部分第一部分第4项“B.业务概况——原材料。”营运资金亏损4.059亿欧元。对营运资金的主要影响如下:
| ● | 贸易和其他应收款增加6830万欧元。平均收款期限稳定在36天(2022年为36天); |
| ● | 库存水平增加4.114亿欧元,主要是由于血浆供应增加,部分被每升血浆成本下降所抵消。2023年12月31日存货周转为308天,2022年12月31日报告为296天;和 |
| ● | 贸易和其他应付款项增加1.044亿欧元。平均缴费期由2022年12月31日的53天增至2023年12月31日的59天。 |
111
截至2022年12月31日止年度,我们来自经营活动的净现金亏损1090万欧元,主要是由于每升血浆收集成本增加和血浆捐赠激增导致库存水平增加。这一背景也对我们的营运资金产生了不利影响,造成了6.092亿欧元的损失。对营运资金的主要影响如下:
| ● | 贸易和其他应收款增加7750万欧元。平均收款期限增至36天(2021年为32天); |
| ● | 库存水平增加6.311亿欧元,主要是由于每升血浆收集成本增加和捐赠数量增加。存货周转于2022年12月31日为296天,而2021年12月31日报告为278天;及 |
| ● | 贸易和其他应付款项增加1.265亿欧元。平均付款期限由2021年12月31日的64天降至2022年12月31日的53天。 |
来自/(使用)投资活动的净现金
2024年来自投资活动的净现金流入8.867亿欧元,而2023年的净现金流出为3.947亿欧元,2022年为19.961亿欧元。
2024年的这一变化主要是由于出售了上海RAAS 20%的股权,这大大超过了资本支出和其他投资流出,以及收购和投资方面的支出总体减少(参见“—影响我们的财务状况和经营业绩的因素—近期处置—上海RAAS”)。2024年的投资主要集中在从ImmunoTek收购14个血浆采集中心,总金额为2.65亿美元,以及收购Haema Plasma KFT.的100%股份,金额为3500万欧元。请参阅“——影响我们财务状况和经营业绩的因素——最近的收购。”
2023年的投资主要集中于资本支出,特别是生物制药业务部门的新生产设施,包括在蒙特利尔(加拿大)的血浆分馏、免疫球蛋白纯化和白蛋白工厂、在都柏林的新的无菌白蛋白纯化加药和灌装工厂以及各种IT和数字化相关项目的投资。见“——资本支出。”
2022年进行的投资包括总额为14亿欧元的Biotest AG收购,以及执行以总额为1.42亿美元收购Access Biologicals剩余51%股本的看涨期权,以及分配给物业、厂房和设备以及无形资产的3.755亿欧元。资本支出主要集中于新的Biopharma制造设施,包括都柏林的新白蛋白工厂、蒙特利尔血浆分馏的升级、免疫球蛋白纯化和白蛋白工厂,以及几个IT和数字化相关项目。见“— A.经营成果——影响我们财务状况和经营成果的因素——最近的收购;”和“——资本支出、其他无形资产和使用权。”
来自/(用于)融资活动的净现金
2024年用于融资活动的现金净额为13.587亿欧元,主要是由于与赎回2017年票据发行的10亿欧元优先票据和本应于2025年2月到期的2019年票据系列相关的债务偿还净额。
2023年融资活动产生的现金净额为1.860亿欧元,主要是由于从我们的循环信贷融资中提取了3.602亿欧元(见本年度报告表格20-F中包含的经审计综合财务报表附注21(b)),主要被1.059亿欧元的租赁付款(见本年度报告表格20-F中包含的经审计综合财务报表附注8(b))、GIC投资者以4790万欧元赎回Biomat Newco的一股优先股以及偿还3190万欧元的EIB定期贷款所部分抵消。
2022年用于融资活动的现金净额为1.649亿欧元,主要是偿还债务净额的结果。
112
营运资金
我们的营运资金主要由我们的贸易应收账款周转率和库存账龄驱动,根据活动的不同,不同时期的营运资金可能会有很大差异。我们的资本需求将取决于许多因素,包括我们的销售增长率、对我们产品的接受度、持续获得足够的制造能力、维持符合cGMP标准的设施、研发活动的时间和程度,以及运营费用的变化,包括生产和采购血浆的成本,所有这些都具有不确定性。
2024年,我们通过加强库存管理、对应付账款和应收账款进行有纪律的监督以及积极优化经营性现金流,实现了营运资本效率的显着改善,导致净营运资本消耗相对于往年有所减少。然而,我们预计我们的现金需求将是巨大的,我们可能需要根据当前或未来的债务协议增加借款,以便为我们的运营和战略举措提供资金。我们预计,我们的营运资金将在绝对值上增加,以发展我们的业务。
库存老化
从2023年到2024年,库存老化平均值有所下降,这主要是由于更有效的库存管理、血浆采集的改善以及在美国约60%的血浆采集中心实施个体化列线图技术的积极结果,从而能够更精确地控制所收集的数量,并导致减少原材料浪费和血浆分馏过程中的精制,从而导致从每一升采集的血浆中提取更多的产品。库存账龄从2023年12月31日的308天降至2024年12月31日的294天。从2022年到2023年,库存老化平均值有所增加,这主要是由于在供应增加的情况下,每升血浆成本的改善产生了渐进的影响。库存账龄从2022年12月31日的296天增至2023年12月31日的308天。库存老化从2021年到2022年有所增加,主要是由于每升血浆收集成本更高和血浆捐赠数量更高。库存账龄从2021年12月31日的278天增至2022年12月31日的296天。
详见第一部分第4项,“关于公司的信息—— B.业务概况——原材料”。
应收账款
我们通常会在有或没有追索权的不同合同安排中向金融机构(因子)出售到期日不短于30天的应收账款(“合格应收账款”)。在无追索权的合格应收款销售中,转让应收款所有权所固有的所有重大风险和利益,包括单方面将转让应收款转让给非关联第三方的权利,均转移至保理商。这些销售被视为无追索权的保理业务,因此,就此类转让的应收账款按保理业务向我们支付的对价在我们的资产负债表中不作为债务入账。
在截至2024年12月31日、2023年和2022年12月31日的财政年度,我们分别向第三方出售了36.007亿欧元、28.581亿欧元和31.743亿欧元的无追索权应收账款。我们估计,我们在没有追索权的情况下向金融机构出售的发票数量为3.344亿欧元(2023年12月31日和2022年12月31日分别为3.919亿欧元和4.452亿欧元),根据到期日期,这些发票在2024年12月31日是无法收回的。
我们还向金融机构出售符合条件的应收账款,同时保留其所有权所固有的风险和收益。这些销售被视为具有追索权的保理业务,此类转让的应收款项的金额仍保留在我们的资产负债表上,而由这些因素垫付给我们的金额在我们的资产负债表上确认为短期债务。截至2024年12月31日,我们的资产负债表中没有记录为与有追索权的保理交易相关的短期债务的金额,而2023年12月31日和2022年12月31日的金额分别为1700万欧元和1650万欧元。
截至2024年12月31日的财政年度,我们在损益表中记录的已售应收款项的财务成本总计3080万欧元(截至2023年12月31日和2022年12月31日的财政年度分别为2500万欧元和1820万欧元)。我们的应收账款在2024年12月31日、2023年和2022年12月31日的平均账龄为36天。见本年度报告所载我们的综合经审计财务报表附注15和27。
113
资本支出、其他无形资产和使用权
在2024年,我们继续推进我们的资本投资计划,以扩大和改善我们业务部门的生产设施。考虑到近年来已经进行的投资,我们认为我们已经显着优化了我们的资本支出资源分配。2024年,我们的资本支出总额为2.613亿欧元(2023年为2.815亿欧元)。下表按业务部门列出截至2024年12月31日、2023年和2022年12月31日止年度我们的资本支出、其他无形资产和使用权增加。
截至12月31日止年度, |
||||||
|
2024 |
|
2023(1) |
|
2022(1) |
|
(单位:千欧元) |
||||||
生物制药 |
|
373,380 |
|
359,442 |
|
507,457 |
诊断 |
|
54,575 |
|
29,107 |
|
49,890 |
生物用品 |
|
2,128 |
|
9,066 |
|
98 |
其他 |
|
7,619 |
|
3,884 |
|
30,192 |
未分配 |
|
40,488 |
|
48,618 |
|
59,866 |
合计 |
|
478,190 |
|
450,117 |
|
647,503 |
(1) |
截至2023年12月31日及2022年12月31日止年度的财务资料已重列,以适用准则变动及更正错误。请参阅上文“影响我们的财务状况和经营业绩的因素——会计准则的变更和错误更正”,以及我们截至2024年12月31日止年度的合并财务报表附注2(d)和附注10,包含在本年度报告的20-F表格中。 |
2022年1月至2024年12月
设施。在2024年、2023年和2022年期间,与扩大和改善我们的制造设施有关的最重要的资本项目是:
Parets网站(西班牙巴塞罗那):
| ● | 投资提高纤维蛋白密封胶和主题凝血酶的纯化能力€2024年为0.2百万,€2023年为0.1百万和€2022年370万; |
| ● | 投资增加静脉溶液袋的生产€2024年130万,€2023年为50万人和€2022年140万; |
| ● | 投资€2022年50万,用于建造现有Grifols国际大楼的延伸和2-8 º C2000个托盘的舱室;和 |
| ● | 投资€2023年270万新建一条代加工产品制造流水线。 |
克莱顿遗址(美国北卡罗来纳州):
| ● | 用于建设新的免疫球蛋白纯化和灌装工厂的投资分别为2024年的70万欧元、2023年的1140万欧元和2022年的2070万欧元; |
| ● | 2023年100万欧元和2022年32,176欧元的新分馏厂建设投资(2024年没有投资); |
| ● | 扩建Grifols目前在Clayton的废水预处理厂,以满足Town of Clayton许可限制,2023年投资430万欧元,2022年投资1240万欧元; |
| ● | 用于增强冷却能力的建筑的投资将在2023年达到50万欧元,在2022年达到680万欧元;和 |
| ● | 2024年投资550万欧元扩大纤维蛋白原产能。 |
114
洛杉矶(美国加利福尼亚州):
| ● | 2023年对新的质量和风险管理系统的投资为80万欧元,2022年为300万欧元; |
| ● | 2024年为Gamunex孵化器建造新仓库的投资为10万欧元,2023年为290万欧元,2022年为80万欧元, |
| ● | 2023年投资70万欧元,2024年投资200万欧元,用于增加Gamunex、纯化和WFI产量;以及 |
| ● | 投资以提高我们的白蛋白纯化能力,并在2022年包括一个50万欧元的即用型柔性袋新展示。 |
都柏林(爱尔兰):
| ● | 投资建设新总部,全球运营和物流中心将作为生物制药业务部门新的全球运营中心的一部分,2024年为70万欧元,2023年为80万欧元,2022年为200万欧元; |
| ● | 投资2024年2020万欧元、2023年2050万欧元和2022年1760万欧元的袋装新白蛋白纯化和灌装工厂的安装;和 |
| ● | 2024年对新的E2E供应链系统流量的投资为300万欧元,2023年为280万欧元,2022年为60万欧元。 |
魁北克(加拿大):
| ● | 2024年投资7500万欧元,2023年投资4480万欧元,2022年投资5690万欧元,用于改造加拿大分馏增产、白蛋白制造和Gamunex添加设施。 |
圣地亚哥(美国加利福尼亚州):
| ● | 2024年投资20万欧元,2023年投资20万欧元,2022年投资30万欧元,用于扩大NAT诊断业务的制造能力,包括质量控制、研发实验室和研发中试工厂;和 |
| ● | 2024年投资520万欧元,2023年投资470万欧元,2022年投资680万欧元,在10895号楼建造新的免疫血液学制造设施。 |
埃默里维尔(美国加利福尼亚州):
| ● | 2023年投资10万欧元,2022年投资30万欧元,用于新的蛋白质制造工艺,并扩大基于哺乳动物细胞培养的实验室。 |
其他投资。与2024年、2023年和2022年期间扩大和改善我们的制造设施有关的其他相关资本项目有:
| ● | 为加强制造和包装识别而进行的序列化投资2024年为10万欧元,2023年为50万欧元,2022年为130万欧元; |
| ● | 美国2024年对新捐赠中心和捐赠中心扩建的投资为500万欧元,2023年为460万欧元,2022年为2380万欧元; |
115
| ● | 2024年投资10万欧元,2023年投资40万欧元,2022年投资380万欧元,以扩大我们的整体实验室测试能力; |
| ● | 在洛杉矶投资新建数据中心大楼,以支持所有IT服务,并利用现有数据中心解决当前风险,2024年投资10万欧元,2023年投资20万欧元,2022年投资90万欧元; |
| ● | 2022年投资380万欧元,用于收购毗邻我们巴塞罗那制造设施的79,180平方米的新物业,以扩大我们的工业和研究能力,使我们目前在该地区的员工人数增加了3,500多人; |
| ● | 用于更新制造设施以符合与制造无菌医药产品相关的EMA法规的投资,2024年为160万欧元,2023年为230万欧元,2022年为510万欧元; |
| ● | 投资以增加2024年220万欧元、2023年100万欧元和2022年80万欧元的IVIG净化能力;和 |
| ● | 2024年投资400万欧元,2023年投资450万欧元,2022年投资970万欧元,与血浆采集中心IT项目有关。 |
2025年1月至2026年12月
2024年,我们完成了2018年启动的19亿欧元投资计划,除其他投资外,该计划涉及扩大生物制药业务部门制造能力的累计产业资本投资,以及对诊断业务部门的投资。我们目前正将资本支出的重点放在维护我们的设施上,同时我们制定了2025年和2026年的大规模战略。
我们的大部分资本投资有利于我们的生物制药业务部门,系统地加强我们的制造设施。我们的目标是通过获得FDA和EMA许可证并完成其他要求以在我们的任何工厂纯化我们的任何中间产品来优化我们的分馏能力的利用。我们还在搬迁和改造血浆捐献中心,并改善有关原料分类、制备和储存设施、物流中心和分析实验室的基础设施。
与改善我们的制造设施有关的最重要的计划资本项目是:
| ● | 蒙特利尔:继续升级等离子体分馏和纯化设施; |
| ● | Clayton:继续投资升级垃圾处理厂、投资初期二期净化和充装设施以及扩大IV纤维蛋白原产能; |
| ● | 圣地亚哥:重建实验室、办公室和仓库,并继续扩大血液检测和免疫血液学系统; |
| ● | Dreieich:对Biotest AG将进行的几个部门的投资,以及对血浆采集中心的投资; |
此外,我们与NSPO的合资企业Grifols Egypt正在建设一个新的制造工厂(一期等离子物流中心),包括一个新的等离子实验室以及一个成品和原材料仓库。
116
信贷来源
欧洲投资银行定期贷款
2015年10月28日,GWWO与欧洲投资银行就欧洲战略投资基金下的1亿欧元定期贷款(“2015年欧洲投资银行定期贷款”)订立贷款协议,该协议于2017年12月5日、2019年4月15日和2019年11月15日进行了修订。贷款协议的财务条款包括自2015年10月28日起为期10年的固定利率为2.40%,以及在第三年至第十年分期偿还的还款时间表。这笔贷款的收益将用于支持我们的研发,主要专注于寻找血浆蛋白的新适应症,包括治疗阿尔茨海默病、血管疾病、心血管手术和动脉血栓形成等。
2017年12月5日,Grifols在欧洲投资银行获得了一笔总额为8500万欧元的新的长期贷款(“2017年欧洲投资银行定期贷款”),该贷款于2019年4月15日和2019年11月15日进行了修订。该贷款的财务条款包括为期十年的固定利率2.019%,以及任何本金到期应付前的两年宽限期。这笔贷款的收益被用于研发计划,特别是新产品(血浆蛋白)的发现和开发,现有血浆蛋白的新治疗适应症的发现以及制造工艺的改进,以提高产量、安全性和效率。
2018年9月7日,Grifols在欧洲投资银行获得一笔总额为8500万欧元的新的长期贷款(“2018年欧洲投资银行定期贷款”,连同2015年欧洲投资银行定期贷款和2017年欧洲投资银行定期贷款,“欧洲投资银行定期贷款”),并于2019年4月15日和2019年11月15日进行了修订。贷款协议的财务条款包括2.145%的固定利率,期限为10年,以及任何本金到期应付前的两年宽限期。这笔贷款的收益被用于研发计划,特别是发现血浆衍生蛋白疗法的新治疗适应症。
欧洲投资银行定期贷款由为下文所述的第一留置权信贷便利提供担保的同一实体提供担保,并由为第一留置权信贷便利、2019年票据、2024年4月票据和2024年12月票据提供担保的同一抵押品上的完善的第一优先担保权益(受允许的留置权的限制,如管理欧洲投资银行定期贷款的文件中所定义)担保,每一项如下所述(注意到位于西班牙的GWWO的血浆库存不被用于担保2019年票据、2024年4月票据和2024年12月票据),根据Grifols、GWWO、Grifols一方的某些子公司、欧洲投资银行、美国银行(Bank of America,N.A.)作为第一留置权信贷便利项下的抵押代理人以及纽约梅隆银行伦敦分行作为2019年票据、2024年4月票据和2024年12月票据项下的抵押代理人订立的惯常的同等债权人间协议,GWWO、该协议的缔约方、欧洲投资银行、美国银行(Bank of New York Mellon)和伦敦分行(Bank of New York Mellon)作为2019年票据、2024年4月票据和2024年12月票据项下的抵押代理人。
我们于2021年8月6日对EIB定期贷款进行了修订,以允许(i)完成Biomat交易;以及(ii)在Biomat交易完成后,Biomat USA和Talecris解除其各自根据EIB定期贷款的相应担保协议提供的担保,并解除对Biomat USA和Talecris资产授予的留置权。Biomat交易已于2021年12月1日完成。
于2022年9月28日,我们就EIB定期贷款订立经修订及重述的加入协议,以根据该协议将Biotest Holdings添加为担保人。
截至2024年12月31日,我们有8500万欧元的EIB定期贷款未偿本金总额。
117
第一留置权信贷便利
于2019年11月15日,我们与由Bank of America Europe指定活动公司(前称Bank of America Merrill Lynch International Limited指定活动公司)牵头的银团、Bank of America,N.A.、BNP Paribas S.A.、Sucursal en Espa ñ a、HSBC France、Banco Bilbao Vizcaya Argentaria S.A.和JP Morgan Securities PLC作为安排人(“安排行”)订立信贷及担保协议(“第一留置权信贷便利”),该协议由“定期贷款”和“循环贷款”组成。初始定期贷款(包括美元B档定期贷款和欧元B档定期贷款)已于2019年11月15日全部提取。美元B档定期贷款(原本金额等于2,500,000,000美元)和欧元B档定期贷款(原本金额等于1,360,000,000欧元)自2019年11月15日起八年到期,并有还款时间表,从截至2020年3月31日的财政季度的最后一个工作日开始按季度摊销,相当于2019年11月15日未偿还的初始美元B档定期贷款(或欧元B档定期贷款,视情况而定)本金总额的0.25%,剩余部分到期应付。
循环贷款最初提供了500,000,000美元的承付款,可在2019年11月15日开始至2019年11月15日六周年结束的期间内使用。2020年5月7日,我们扩大了循环贷款,将现有和新的循环贷款人的贷款人承诺从500,000,000美元增加到1,000,000,000美元。扩大融资的条款及条件与2019年11月15日订立的条款及条件相似。作为扩大规模的一部分,循环贷款的适用保证金在基本利率贷款的情况下从0.50%提高到1.50%,在欧洲货币利率贷款的情况下从1.50%提高到2.50%。此外,就未使用的循环承诺应付的承诺费由0.50%增加至0.875%。
2024年12月11日,我们对循环贷款执行了新的升级,据此,我们(i)将5.853亿美元的循环承诺延长18个月,直至2027年5月(剩余的4.147亿美元仍将在2025年11月到期)(“RCF延长至2027年”);以及(ii)与现有和新的循环贷款人将循环承诺额外增加2.782亿美元(将第一留置权信贷便利下的循环承诺总额增加到12.782亿美元)。作为扩大规模的一部分,截至2024年12月20日,已同意将RCF延期至2027年的贷款人所发放的循环贷款的适用保证金在基准利率贷款的情况下从每年1.50%增加到2.00%,在欧洲货币利率贷款的情况下从每年2.50%增加到3.00%,在定期SOFR贷款的情况下从每年2.50%增加到3.00%。
2025年2月21日,我们对循环贷款执行了新的升级,现有和新的循环贷款人同意将其在循环承诺下的承诺进一步增加7450万美元,从而产生总额为13.526亿美元的循环承诺融资(其中9.38亿美元将于2027年5月到期,剩余的4.146亿美元将于2025年11月到期)。
每次上调的目的都是为了加强我们的流动性头寸。
循环贷款的借款人是GWWO,这是一家爱尔兰实体,也是我们的全资直接子公司。欧元计价的B档贷款的借款人是Grifols。美元计价的B档贷款的借款人是Grifols Worldwide Operations USA,Inc.(“Grifols Worldwide Operations USA”),这是一家特拉华州公司,是GWWO的直接全资子公司。第一留置权信贷便利受纽约州法律管辖;但是,某些抵押文件受其他司法管辖区的当地法律管辖。
循环贷款的利率为(a)基准利率(即(i)最优惠利率、(ii)联邦基金利率加0.50%和(iii)定期有担保隔夜融资利率(“定期SOFR”)中的最高者,利率期限为一个月,加1.00%)加1.50%或(b)定期SOFR(如果以美元计价)或EURIBOR(如果以欧元计价)加2.50%。美元B档定期贷款的利率为(a)基本利率加1.00%或(b)定期SOFR加2.00%。欧元B档定期贷款利率为EURIBOR加2.25%。
118
第一留置权信贷便利下的借款须在发生某些事件时强制提前还款,包括发生某些债务以及出售或以其他方式处置某些资产。此外,如其中所定义,如果我们有超额现金流,第一留置权信贷便利下的部分借款将被强制提前偿还。定期贷款和循环贷款均由Grifols(仅就Grifols Worldwide Operations USA和GWWO的义务)和Grifols的某些子公司提供担保,这些子公司连同Grifols代表,截至2022年12月31日,总计至少60%的Grifols及其子公司的利息、税项、折旧和摊销前利润(按照第一留置权信贷便利中规定的公式计算,“担保人覆盖率测试”),并由完善的第一优先担保权益(受允许的留置权限制,如第一留置权信贷便利中所述)在美国信贷各方的所有有形和无形资产以及GWWO的等离子库存和Grifols某些子公司的股权质押(受某些排除和限制)中。截至20-F表格的本年度报告日期,第一留置权信贷融资由我们的子公司Grifols Biologicals LLC、Grifols Shared Services North America,Inc.、Grifols Therapeutics LLC、Instituto GRIFOLS, S.A.、Grifols International S.A.、Grifols USA,LLC和Grifols Biotest Holdings GmbH以及共同借款人(和担保人)GWWO和Grifols Worldwide Operations USA提供担保。
第一留置权信贷便利包括惯常的肯定和否定契约以及违约事件。除其他限制外,负面契约包括对额外债务、留置权、资产出售和关联交易的限制。违约事件包括(其中包括)违反契约、重大违反陈述、对其他重大债务的交叉违约、破产和无力偿债以及重大判决。
第一留置权信贷便利的条款包含对我们支付普通股息能力的限制。我们可能会在与我们的股息政策一致的正常业务过程中(a)支付股息,金额不超过任何财政年度的Grifols及其子公司在该财政年度的综合净收入的40%,可分期支付,第一个,不早于该财政年度的12月,最后一个,不迟于下一个财政年度或(b)无论是否在正常业务过程中,只要在其生效后,杠杆比率不超过3.75x。我们可能会在管辖优先再融资票据文件的契约条款(定义见第一留置权信贷便利)(视情况而定)要求的范围内,就优先再融资票据(定义见第一留置权信贷便利)定期支付利息。
第一留置权信贷便利和相关担保文件已于2021年8月13日修订为(i)允许完成Biomat交易,(ii)将担保人覆盖率测试降低至60%,以及(iii)在完成Biomat交易后,解除Biomat USA和Talecris各自根据第一留置权信贷便利提供的担保,并解除对Biomat USA和Talecris资产授予的留置权。Biomat交易已于2021年12月1日完成,我们将部分所得款项净额用于(i)根据第一留置权信贷便利预付6亿美元的循环贷款本金,(ii)预付142,360,501.31美元的美元B档定期贷款,以及(iii)预付等值88,003,617.48美元的欧元B档定期贷款。
于2022年4月21日及2022年4月25日,我们就第一留置权信贷融资订立对应协议,以分别增加托管发行人(其后已与公司合并及并入公司)及Biotest Holdings作为其项下的担保人。2022年9月28日,我们修订和重述了Biotest Holdings于2022年4月25日签订的对应协议,以修订和重述有关德国担保人将Biotest Holdings从股份公司(Aktiengesellschaft)转换为有限责任公司(Gesellschaft mit beschr ä nkter Haftung)的担保限制的条款。
第一留置权信贷便利于2023年5月3日进行了修订,规定以SOFR取代LIBOR作为参考利率。
2024年7月10日,我们使用出售上海RAAS 20%股权的部分收益,预付了金额为391,878,66 2.41欧元的欧元B期定期贷款和673,027,895.20美元的美元B期定期贷款。
截至2024年12月31日,我们有8.647亿欧元和15.340亿美元的定期贷款未偿本金总额,我们的循环贷款下没有未偿金额。
119
2019年票据
2019年11月15日,Grifols发行了9.05亿欧元、将于2025年2月15日到期、年利率为1.625%的优先有担保票据(“1.625%票据”)和7.70亿欧元、将于2027年11月15日到期、年利率为2.250%的优先有担保票据(“2.250%票据”,连同1.625%票据,“2019年票据”)。
2019年票据目前由Grifols的全资子公司在优先担保基础上提供担保,这些子公司是第一留置权信贷便利下的担保人和共同借款人。在允许留置权的情况下,2019年票据下的所有义务以及这些义务的担保由国内担保人的有形和无形资产、GWWO的血浆库存(位于西班牙的血浆库存除外)和Grifols某些子公司的股权质押(受某些除外情况和限制)以第一优先权为担保。为2019年票据提供担保的抵押品还为第一留置权信贷便利和欧洲投资银行定期贷款提供担保,但须遵守债权人间协议。
我们无须就2019年票据作出强制赎回或偿债基金付款。
如果我们遇到控制权变更,我们必须让2019年票据的持有人有机会以本金的101%向我们出售其2019年票据,外加应计和未付利息。
Grifols和2019年票据的担保人可能会产生额外债务,前提是Grifols和受限制子公司(定义见管理2019年票据的契约)在紧接此类额外债务发生日期之前最近结束的四个完整财政季度的合并基础上的固定费用覆盖率(定义见管理2019年票据的契约)将至少为2.00至1.00,按形式确定。此外,如果Grifols和受限制子公司(定义见管理2019年票据的契约)在紧接此类额外债务发生日期之前最近结束的四个完整财政季度的合并基础上的担保杠杆比率(定义见管理2019年票据的契约)不超过4.50至1.00,则Grifols和2019年票据的担保人可能会产生额外的有担保债务,该比率是根据备考基础确定的。
管辖2019年票据的契约包含某些契约,除例外情况外,限制Grifols及其受限制子公司的能力:(i)支付股息或进行某些其他受限制的付款或投资;(ii)产生额外债务或为债务提供担保并发行不合格股票;(iii)对资产设置留置权;(iv)合并、合并或出售我们和我们受限制子公司的全部或几乎全部资产;(v)与关联公司进行某些交易;(vi)对我们受限制子公司的股息或其他付款设置限制;以及(vii)对受限制子公司的债务设置担保。契约还包含某些惯常的违约事件。
2019年11月15日,2019年票据在爱尔兰证券交易所全球交易所市场上市。
2021年8月6日,我们签订了一份契约补充协议,修订了管辖2019年票据的契约,以(i)允许完成Biomat交易,以及(ii)在完成Biomat交易后,解除Biomat USA和Talecris根据管辖2019年票据的契约提供的担保和抵押品。Biomat交易已于2021年12月1日完成,我们于2022年1月11日根据向债券持有人的资产出售要约回购了本金总额为97,535,000欧元(1.625%票据的67,144,000欧元和2.250%票据的30,391,000欧元)的2019年票据。
于2022年4月21日及4月25日,我们订立契约补充,修订规管2019年票据的契约,以分别增加托管发行人(其后已与公司合并及并入公司)及Biotest Holdings作为2019年票据的担保人。2023年7月21日,我们签订了一份契约补充协议,修订了管辖2019年票据的契约,以确认托管发行人已与公司合并并并入公司,从而解除了托管发行人授予的担保。
120
于2024年8月8日,我们使用出售上海RAAS 20%股权的部分收益赎回1.625%票据的金额为495,036,000欧元。2024年12月27日,我们使用2024年12月票据的收益,连同手头现金,全额赎回了剩余未偿还的1.625%票据。
2.250%票据
2.250%票据于5月15日和11月15日每半年付息一次,自2020年5月15日开始。Grifols可按以下所列的赎回价格(以本金百分比表示)加上已赎回的2.250%票据的应计及未付利息(如有)全部或部分赎回2.250%票据,直至适用的赎回日期(受限于有关记录日期的2.250%票据持有人有权收取有关付息日到期的利息),如在以下所示年份的11月15日开始的十二个月期间内赎回:
年份 |
|
百分比 |
|
2023年及其后 |
|
100.5625 |
% |
2024年及之后 |
|
100.000 |
% |
2021年票据
2021年10月5日,托管发行人—— Grifols新成立的全资子公司,并未持有或以其他方式拥有任何重大资产的任何权益,发行了将于2028年10月15日到期、年利率为3.875%的1,400,000,000欧元优先票据(“欧元票据”)和将于2028年10月15日到期、年利率为4.750%的705,000,000美元优先票据(“美元票据”,连同欧元票据,“2021年票据”)。发行2021年票据的目的是为收购Biotest Holdings(以及间接收购Biotest AG)和自愿要约收购Biotest Holdings不拥有的Biotest AG股份提供资金。见“— A.影响我们财务状况和经营业绩的因素——收购—— Biotest AG收购。”
在2021年票据发行之日,为2021年票据持有人的利益,此次发行的总收益存入独立的托管账户,将在Biotest AG收购的先决条件满足后予以解除。该等条件已于2022年4月21日达成,并于成功达成所有先决条件后将资金释放予托管发行人。自2023年6月27日起,托管发行人与公司合并并入公司,合并的结果是公司是存续实体,承担(根据法律运作)托管发行人的所有资产和义务,托管发行人不复存在(“托管发行人合并”)。
在托管发行人合并之前,2021年票据仍然是托管发行人的一般无抵押债务,由公司和我们作为第一留置权信贷便利下的担保人和共同借款人的各全资子公司在优先无抵押基础上无条件担保。自托管发行人合并后,2021年票据成为公司的一般无抵押债务,并由我们的全资子公司在优先留置权信贷融资下的担保人和共同借款人在优先无抵押基础上提供无条件担保。
我们无须就2021年票据作出强制赎回或偿债基金付款。
如果我们遇到控制权变更,我们必须让2021年票据的持有人有机会以本金的101%向我们出售其2021年票据,外加应计和未付利息。
Grifols和2021年票据的担保人可能会产生额外债务,如果Grifols和受限制子公司(定义见管理2021年票据的契约)在紧接发生此类额外债务之日前最近结束的四个完整财政季度的合并基础上的固定费用覆盖率(定义见管理2021年票据的契约)将至少为2.00至1.00,按形式确定。
121
管辖2021年票据的契约包含某些契约,除例外情况外,限制Grifols及其受限制子公司的能力:(i)支付股息或进行某些其他受限制的付款或投资;(ii)产生额外债务或为债务提供担保并发行不合格股票;(iii)对资产设置留置权;(iv)合并、合并或出售我们和我们受限制子公司的全部或几乎全部资产;(v)与关联公司进行某些交易;(vi)对我们受限制子公司的股息或其他付款设置限制;以及(vii)对受限制子公司的债务设置担保。契约还包含某些惯常的违约事件。
2021年10月11日,2021年票据在爱尔兰证券交易所全球交易所市场上市。
2022年9月28日,我们签订了一份契约补充协议,修订了管辖2021年票据的契约,将Biotest Holdings添加为2021年票据的担保人。2023年7月21日,我们签订了一份契约补充协议,修订了管辖2021年票据的契约,以确认托管发行人已与公司合并并并入公司,并且公司成为2021年票据的发行人,承担了之前由托管发行人承担的所有义务。
A.美元纸币
美元票据按年利率4.750%计息,于2022年4月15日及10月15日每半年支付一次利息,由2022年4月15日开始。我们可于2024年10月15日及之后的任何时间,按下述赎回价格(以本金百分比表示)加上已赎回的美元票据的应计及未付利息(如有)至适用的赎回日期(受限于有关记录日期的美元票据持有人收取有关付息日到期利息的权利)全部或部分赎回美元票据,如在以下所示年份的10月15日开始的十二个月期间内赎回:
会计年度 |
|
百分比 |
|
2024 |
|
102.375 |
% |
2025 |
|
101.188 |
% |
2026年及以后 |
|
100.000 |
% |
在2024年10月15日之前,我们最多可赎回美元票据本金总额的40%,赎回价格相当于其本金的104.750%,金额等于或低于我们在一次或多次股票发行中筹集的净现金收益,加上此类票据的应计和未付利息(如有)至但不包括赎回日期。
B.欧元纸币。
欧元票据按年利率3.875%计息,于2022年4月15日及10月15日每半年付息一次,自2022年4月15日起。我们可于2024年10月15日及之后的任何时间按以下所列赎回价格(以本金百分比表示)加上已赎回欧元票据的应计及未付利息(如有)至适用的赎回日期全部或部分赎回欧元票据(以有关记录日期的欧元票据持有人收取有关利息支付日到期利息的权利为准),如在以下所示年份的10月15日开始的十二个月期间内赎回:
会计年度 |
|
百分比 |
|
2024 |
|
101.938 |
% |
2025 |
|
100.969 |
% |
2026年及以后 |
|
100.000 |
% |
122
在2024年10月15日之前,我们最多可以赎回欧元票据本金总额的40%,赎回价格相当于其本金的103.875%,金额等于或低于我们在一次或多次股票发行中筹集的净现金收益,加上此类票据的应计和未付利息(如有)至但不包括赎回日期。
2024年4月票据
2024年4月30日,Grifols发行了10.00亿欧元的优先有担保票据,将于2030年5月1日到期,年利率为7.500%。2024年6月4日,Grifols根据与2024年4月30日发行的票据(统称“2024年4月票据”)相同的契约和相同系列,额外发行了3亿欧元的优先担保票据。
2024年4月票据目前由Grifols的全资子公司在优先担保基础上提供担保,这些子公司是第一留置权信贷便利下的担保人和共同借款人。根据允许的留置权,2024年4月票据下的所有义务以及这些义务的担保,由国内担保人的有形和无形资产、GWWO的血浆库存(位于西班牙的血浆库存除外)和Grifols某些子公司的股权质押(受某些除外情况和限制)以第一优先权为担保。担保2024年4月票据的抵押品还担保2019年票据、2024年12月票据、第一留置权信贷便利和欧洲投资银行定期贷款,但须遵守债权人间协议。
我们无须就2024年4月票据作出强制赎回或偿债基金付款。
如果我们遇到控制权变更,我们必须让2024年4月票据的持有人有机会以下述赎回价格向我们出售其2024年4月票据,外加应计和未付利息。
Grifols和2024年4月票据的担保人可能会产生额外债务,如果Grifols和受限制子公司(定义见管辖2024年4月票据的契约)在紧接此类额外债务发生日期之前最近结束的四个完整财政季度的合并基础上的固定费用覆盖率(定义见管辖2024年4月票据的契约)将至少为2.00至1.00,按形式确定。此外,Grifols和2024年4月票据的担保人可能会产生额外的有担保债务,前提是Grifols和受限制子公司(定义见管辖2024年4月票据的契约)在紧接发生此类额外债务之日前最近结束的四个完整财政季度的合并基础上的担保杠杆比率(定义见管辖2024年4月票据的契约)不会超过4.50至1.00,这是在备考基础上确定的。
管辖2024年4月票据的契约包含某些契约,除例外情况外,限制Grifols及其受限制子公司的能力:(i)支付股息或进行某些其他受限制的付款或投资;(ii)产生额外债务或为债务提供担保并发行不合格股票;(iii)对资产设置留置权;(iv)合并、合并或出售我们和我们受限制子公司的全部或几乎全部资产;(v)与关联公司进行某些交易;(vi)对我们受限制子公司的股息或其他付款设置限制;以及(vii)对受限制子公司的债务设置担保。契约还包含某些惯常的违约事件。
2024年4月期票据按年利率7.500%计息,于2024年11月1日开始,于5月1日和11月1日每半年支付一次利息。我们可于2026年5月1日及之后的任何时间按下述赎回价格(以本金百分比表示)加上已赎回票据的应计及未付利息(如有)至适用的赎回日期全部或部分赎回2024年4月票据(以有关记录日期的票据持有人收取有关付息日到期利息的权利为准),如在以下所示年份的5月1日开始的十二个月期间内赎回:
会计年度 |
|
百分比 |
|
2026 |
|
104.000 |
% |
2027 |
|
102.000 |
% |
2028年及以后 |
|
100.000 |
% |
如果我们遇到控制权变更,我们必须给2024年4月票据的持有人机会,以上段所述的赎回价格,加上应计和未付利息,向我们出售他们的2024年4月票据。
123
如果我们在2026年5月1日之前赎回2024年4月票据,则赎回价格应等于所赎回的2024年4月票据本金的100%加上截至但不包括赎回日期的适用溢价以及应计和未付利息(如有)。“适用溢价”应由发行人确定为(i)该等已赎回的2024年4月票据本金金额的4.0%中的较大者;及(ii)(a)于该等赎回日期的现值(如有的话)(x)该等2024年4月票据(如适用)于2026年5月1日的赎回价格(如上表所示)的超出部分,加上(y)该等2024年4月票据截至2026年5月1日到期的所有必要利息支付(不包括截至赎回日期的应计但未支付的利息),使用按外滩利率贴现率计算(或,如果高于该外滩利率,则为零),在每种情况下截至该赎回日加上五十(50)个基点,超过(b)该2024年4月票据的本金金额。
我们将2024年4月票据的所得款项用于(i)于2024年5月27日全额赎回2017年发行的优先票据的未偿本金总额,否则这些票据将于2025年5月1日到期,以及(ii)偿还我们在第一留置权信贷额度下的循环信贷额度下的未偿金额。
2024年7月11日,2024年4月期票据在爱尔兰证券交易所全球交易所市场上市。
2024年12月的说明
12月19日,2024年Grifols发行了13.00亿欧元的优先有担保票据,将于2030年5月1日到期,年利率为7.125%(“2024年12月票据”)。
2024年12月票据目前由Grifols的全资子公司在优先担保基础上提供担保,这些子公司是第一留置权信贷便利下的担保人和共同借款人。根据允许的留置权,2024年12月票据下的所有义务以及这些义务的担保,由国内担保人的有形和无形资产、GWWO的血浆库存(位于西班牙的血浆库存除外)和Grifols某些子公司的股权质押(受某些排除和限制)以第一优先权为基础进行担保。担保2024年12月票据的抵押品还担保2019年票据、2024年4月票据、第一留置权信贷便利和欧洲投资银行定期贷款,但须遵守债权人间协议。
我们无须就2024年12月票据作出强制赎回或偿债基金付款。
Grifols和2024年12月票据的担保人可能会产生额外债务,前提是Grifols和受限制子公司(定义见管辖2024年12月票据的契约)在紧接此类额外债务发生日期之前最近结束的四个完整财政季度的合并基础上的固定费用覆盖率(定义见管辖2024年12月票据的契约)将至少为2.00至1.00,按形式确定。此外,Grifols和2024年12月票据的担保人可能会产生额外的有担保债务,前提是Grifols和受限制子公司(定义见管辖2024年12月票据的契约)在紧接发生此类额外债务之日前最近结束的四个完整财政季度的合并基础上的担保杠杆比率(定义见管辖2024年12月票据的契约)不超过4.50至1.00,按形式确定。
管辖2024年12月票据的契约包含某些契约,除例外情况外,限制Grifols及其受限制子公司的能力:(i)支付股息或进行某些其他受限制的付款或投资;(ii)产生额外债务或为债务提供担保并发行不合格股票;(iii)对资产设置留置权;(iv)合并、合并或出售我们和我们受限制子公司的全部或几乎全部资产;(v)与关联公司进行某些交易;(vi)对我们受限制子公司的股息或其他付款设置限制;以及(vii)对受限制子公司的债务设置担保。契约还包含某些惯常的违约事件。
124
2024年12月期票据按年利率7.125%计息,于2025年5月1日和11月1日每半年付息一次,自2025年5月1日起。我们可于2026年5月1日及之后的任何时间按下述赎回价格(以本金百分比表示)加上已赎回票据的应计及未付利息(如有)至适用的赎回日期全部或部分赎回2024年12月票据(以有关记录日期的票据持有人收取有关付息日到期利息的权利为准),如在以下所示年份的5月1日开始的十二个月期间内赎回:
会计年度 |
|
百分比 |
|
2026 |
|
104.000 |
% |
2027 |
|
102.000 |
% |
2028年及以后 |
|
100.000 |
% |
如果我们经历控制权变更,我们必须让2024年12月票据的持有人有机会以上段所述的赎回价格,加上应计和未付利息,向我们出售其2024年12月票据。此外,2024年12月期票据具有特殊的赎回功能,允许在满足特定条件的情况下,在非赎回期内以优惠的赎回价格相对于补足成本。
如果我们在2026年5月1日之前赎回2024年12月票据,则赎回价格应等于所赎回的2024年12月票据本金的100%加上截至但不包括赎回日期的适用溢价以及应计和未付利息(如有)。“适用溢价”应由发行人确定为(i)该等已赎回的2024年12月票据本金的4.0%中的较大者;及(ii)(a)于该赎回日期的现值(如有)的超出部分(如有)(x)该等2024年12月票据于2026年5月1日的赎回价格(如上表所述),加上(y)该等2024年12月票据截至2026年5月1日到期的所有必要利息支付(不包括截至赎回日期的应计但未支付的利息),使用按外滩利率(或,如果高于该外滩利率,则为零),在每种情况下截至该赎回日加上五十(50)个基点,超过(b)该2024年12月票据的本金金额。
我们将2024年12月票据的所得款项用于(i)连同手头现金,于2024年12月27日全数赎回本应于2025年2月15日到期的1.625%票据的未偿本金总额,以及(ii)根据第一留置权信贷融资全数偿还未偿还的循环贷款。
Biomat交易
2021年12月1日,我们向GIC投资者出售了代表Biomat Newco 12.9%的优先股和Biomat USA 12.5%的优先股,这是我们在美国的血浆采集子公司,属于Biomat Group的一部分。具体而言,GIC投资者获得了优先股。收到的收购价格为9.9亿美元。
作为交易的结果,这家GIC投资者获得了十股Biomat USA的B类普通股和九股Biomat Newco的B类普通股。虽然被命名为普通股,但这类股票没有投票权,每年对Biomat USA和Biomat Newco的优先股息为每股4,168,421.05美元。这些优先股还授予GIC投资者从2023年开始每年最多一股的赎回权,每股价格为52,105,263.16美元。这笔投资最初被记录为股权,但后来在我们根据IFRS-EU编制并向西班牙CNMV提交的截至2021年12月31日止年度的合并财务报表中被重述为债务。GIC投资者的投资在我们的财务报表中记录为债务,重新分类不影响遵守我们债务工具下的契约。
这家GIC投资者已行使其权利,在截至2023年12月31日和2024年12月31日的每一年赎回一股Biomat Newco的B类普通股,赎回价格为52,105,263.16美元。见本年度报告表格20-F所载截至2024年12月31日止年度的合并财务报表附注21(d)。
125
其他债务
在从ImmunoTek收购血浆采集中心的背景下,2025年2月3日,我们的子公司Biomat Holdings LLC发行了一张金额为6930万美元的有利于ImmunoTek的期票(这是Biomat Holdings LLC收购的六个血浆采集中心的购买价格的未偿余额,金额为6220万美元,加上约700万美元的管理费),没有应计利息。本票将于2026年1月3日到期。从ImmunoTek收购的上述六家单采血浆中心作为期票的抵押品,期票也由GRIFOLS, S.A.提供担保,根据我们与ImmunoTek的原始协议,否则这六家单采血浆中心将在2026年1月3日被收购。见“— A.经营业绩—后续事件——从ImmunoTek收购单采血浆中心。”
2024年6月,我们的子公司Grifols Canada Therapeutics Inc.(“Grifols Canada”)从Investissement Qu é bec(一家在魁北克煽动投资的政府金融机构)获得了一笔金额高达36,000,000加元的贷款融资。Grifols Canada正在使用这笔贷款的收益,为与其蒙特利尔治疗药物生产工厂的产能升级相关的升级和开始运营提供资金。根据这笔贷款,Grifols Canada应实现与蒙特利尔工厂相关的以下目标(“目标”):(1)在2027年5月31日之前创造并在整个贷款期限内保持至少184个长期工作岗位,产生(2)平均年薪毛额78,700加元,以及(3)产生与贷款人商定的某些合格支出(目标完成之日或2027年5月31日中较早者,“项目完成日期”)。
贷款将分60个月分期偿还,金额为450,000加元,从(i)项目完成日期;或(ii)第一次提款五周年中较早的日期开始。如果Grifols Canada至少完成75%的目标,贷款本金将减少9,000,000加元和项目中支付的合格支出的25%,两者中以较低者为准。如果Grifols Canada完成至少50%的目标,贷款将不会产生利息。如果Grifols Canada未能完成50%的目标,贷款将按Investissement Qu é bec的最优惠利率加上3.0%的年利率计息,从贷款的第一次支付起追溯计算。这笔贷款以Grifols加拿大蒙特利尔工厂的房地产抵押贷款以及Grifols S.A.的一封安慰信作为担保。截至2024年12月31日,没有提取这笔贷款的金额。
某些其他信贷安排和租赁义务已与不同的贷方建立,包括美国和Grifols子公司的长期和短期债务。截至2024年12月31日,我们在这些贷款下的短期信贷总额为590万欧元。短期信贷便利的到期日发生在未来12个月。见本年度报告所载我们的综合经审计财务报表附注21。
c. |
研发、专利和许可 |
有关我们的研发计划的详细信息,请参阅本第一部分第4项,“关于公司的信息—— B.业务概览——研发。”
d. |
趋势信息 |
血浆来源的蛋白质疗法对于延长和改善患有慢性、急性和危及生命的疾病包括传染性疾病,如肝炎、免疫性疾病,如多发性硬化症、血友病、血管性血友病、肝透析和急性疾病,如烧伤和严重失血的个体的生命至关重要。为此,不能在不危及患者生命的情况下中断或推迟这些产品的给药。这确保了对这类产品的稳定需求。此外,由于所治疗疾病的性质,美国血浆衍生产品的报销比例很高。此类利率的任何变化都可能在美国引发强烈的游说反应。
基于MRB报告,2021年,全球血浆蛋白市场(不含重组产品)达到292亿美元,较2018年增长23.5%,或在这三年期间每年增长7.3%。我们认为,许多等离子衍生产品未得到充分利用,将继续受益于强劲的需求。此外,一些血浆衍生疗法正在探索新的适应症,例如阿尔茨海默病的治疗。我们认为,等离子衍生产品的全球销量将继续增长,主要受促成其历史增长的相同因素的推动,包括:
| ● | 人口增长; |
126
| ● | 基于血浆的产品的新应用和适应症的发现和批准; |
| ● | 确诊患者和确诊但先前未治疗的患者数量增加; |
| ● | 地域扩张;和 |
| ● | 医生对病情和治疗的更大认识。 |
2024年,我们21.4%的销售额产生于欧盟,而2023年为19.1%,2022年为17.0%。我们预计,2025年我们在欧盟产生的销售百分比将不会显着增加。
进入等离子衍生产品行业存在重大壁垒,因为该行业受到高度监管,需要大量专业知识和资本投资。我们预计这些障碍不会在短期内减少。
监管环境。为了在血浆衍生物行业开展业务,制造商和分销商必须遵守FDA、EMA和全球类似机构的广泛监管。因此,需要进行大量投资,以开发、装备和维护必要的储存、分馏和净化设施,并发展适当的销售、营销和分销基础设施。此外,只有从FDA批准的中心收集的血浆中提取的蛋白质才能在美国上市,因此在美国开展业务需要确保充足的美国来源血浆供应。我们预计这些监管限制将持续下去。
产品管线。
由于我们最近的收购,我们拥有扩大的关键产品组合,并将继续投资于现有产品的新产品和新适应症的研发。一些正在进行的关键研发项目包括使用白蛋白、诊断和疫苗疗法治疗阿尔茨海默病、白蛋白治疗晚期肝硬化和腹水以及心脏手术中抗凝血酶的临床研究。
我们的产品管线在不同阶段提供了风险和价值之间的战略平衡。2024年,我们有82个生物制药计划正在开发中,超过80个诊断项目正在我们的管道中。2023年,我们的子公司Biotest AG在其纤维蛋白原浓缩物的3期临床试验中取得了积极的结果,标志着在治疗获得性纤维蛋白原缺乏症方面迈出了重要的一步。其他创新巩固了我们在血浆来源药物方面的地位,例如IG Yimmugo®,一种新开发的用于治疗免疫缺陷和自身免疫性疾病的免疫球蛋白,以及一种临床开发中从人血浆中纯化的抗体组合物Trimodulin,用于治疗重症社区获得性肺炎(SCAP)和重症新冠肺炎。
e. |
关键会计估计 |
根据国际财务报告准则编制合并财务报表要求我们在某些情况下做出估计和判断,这些情况会影响资产、负债、收入、费用的报告金额以及或有资产和负债的相关披露。有关我们重大会计估计的详细说明,载于本年度报告表格20-F其他地方所载的经审计综合财务报表附注。
我们的某些重要会计政策需要主观和复杂的判断,通常需要对本质上不确定的事项的影响进行估计。我们每年都一致地应用估算方法。除因发布新的会计指引而需要进行的变更外,我们在所述期间内对关键会计估计的应用并无重大变化。我们定期与董事会审计委员会一起审查我们的关键会计估计和估计。
这些会计政策包括折旧、后续确认、减值、商誉和摊销等。有关我们的关键会计估计和商誉的更多信息,请分别参阅本年度报告表格20-F中包含的经审计综合财务报表附注2、4和6。
127
有关最近发布的会计准则的更多信息,请见本年度报告表格20-F中包含的我们经审计的综合财务报表附注2。
项目6.董事、高级管理人员和员工
a. |
董事和高级管理人员 |
董事
自2024年1月至本年度报告日期,我们的董事会作出以下变动:
| ● | 2024年2月,根据增选程序,任命José Ignacio(Nacho)Abia Buenache先生为我们的董事会成员,以填补在“其他外部人员”类别下,自2024年4月1日起,当其类别变更为“执行人员”时,Steven F. Mayer先生辞职时产生的空缺,董事会指定他为首席执行官(“CEO”)。由于Abia先生最初由董事会通过增选程序任命为董事,我们于2024年6月举行的股东大会批准了他的任命。 |
| ● | 2024年6月,我武生物股东大会任命Claire Giraut女士和安妮-凯瑟琳·伯纳女士为独立董事。另外,James Costos先生辞去独立董事职务。 |
| ● | 2024年7月,Claire Giraut女士、Carina Szpilka女士辞去独立董事职务。 |
| ● | 2024年12月,董事会一致任命Pascal Ravery先生为独立董事,任命Paul S. Herendeen先生为自营董事,以填补两个空缺,均采用增选程序,填补了Claire Giraut女士和Carina Szpilka女士辞职时产生的空缺。因此,他们的任命有待于我们将于2025年6月举行的下一次股东大会批准。Paul Herendeen先生的任命是为了遵守某些少数股东(FF Hybrid LP、Flat Footed Series LLC-Fund3、GP Recovery Fund LLC、Mason Capital Master Fund和Sachem Head LP)的要求,这些股东将他们的股份进行分组以行使其比例代表权,并通过任命Herendeen先生为自营董事来实现这一点。 |
| ● | 2025年2月,Thomas Glanzmann先生宣布将于任期结束时辞去董事会职务。独立董事Anne-Catherine Berner女士将接替他担任我们董事会的非执行主席,董事会已决定不再增加一名成员。相反,董事会将提议将其组成减少至12名成员,从下一次股东大会开始。随着我们董事会独立主席的任命,首席独立董事的角色将被取消。 |
128
下文列出联委会成员的姓名和现任职务:
姓名 |
|
年龄 |
|
标题 |
|
类型 |
|
董事 |
|
任期 |
|
José Ignacio(Nacho)Abia Buenache |
56 |
董事兼首席执行官 |
行政人员 |
2024年2月 |
2028年6月 |
||||||
Thomas H. Glanzmann |
66 |
非执行主席 |
其他外部 |
2006年4月 |
下一个GSM(2) |
||||||
Raimon Grifols Roura |
61 |
董事、副主席 |
专有 |
2015年5月 |
2027年6月 |
||||||
V í ctor Grifols Deu |
48 |
董事 |
专有 |
2016年5月 |
下一个GSM(2) |
||||||
Tomás Dagá Gelabert |
69 |
董事 |
其他外部 |
2000年4月 |
2027年6月 |
||||||
Enriqueta Felip Font |
61 |
董事 |
独立 |
2019年5月 |
2027年6月 |
||||||
蒙特塞拉特Mu ñ oz Abellana |
57 |
董事兼首席独立董事(1) |
独立 |
2022年6月 |
2026年6月 |
||||||
Susana Gonz á lez Rodr í guez |
49 |
董事 |
独立 |
2022年6月 |
2026年6月 |
||||||
安妮·凯瑟琳·伯纳 |
61 |
董事 |
独立 |
2024年6月 |
2027年6月 |
||||||
帕斯卡尔·拉弗里 |
68 |
董事 |
独立 |
2024年12月 |
下一个GSM(2) |
||||||
I ñ igo S á nchez-Asia í n Mardones |
61 |
董事 |
独立 |
2015年5月 |
2027年6月 |
||||||
阿尔伯特·格里福尔斯昏迷-克罗斯 |
47 |
董事 |
专有 |
2023年12月 |
2028年6月 |
||||||
Paul S. Herendeen |
69 |
董事 |
专有 |
2024年12月 |
下一个GSM(2) |
||||||
Nuria Martín Barnés |
66 |
秘书,非成员 |
不适用 |
2015年5月 |
不适用 |
||||||
Laura de la Cruz Gal á n |
36 |
副书记、非委员 |
不适用 |
2023年12月 |
不适用 |
| (1) | 首席独立董事是2014年12月3日通过的第31/2014号法律引入的人物,该法律在公司治理问题上修订了西班牙公司法,或第31/2014号法律。董事会主席职务和首席执行官职务由同一人担任时,强制任命一名首席独立董事。首席独立董事除其他职责外,必须(i)是独立董事,并有权要求召开董事会会议或在已召开的董事会会议议程上列入新的要点,(ii)协调和召集非执行董事,(iii)在适用时直接由董事会对主席进行定期评估,(iv)与投资者和股东保持联系,以找出他们的观点,以便就他们所关注的问题形成意见,特别是,与公司的企业管治有关;及(v)协调主席继任计划。董事会在2024年7月16日举行的会议上任命Montserrat Mu ñ oz Abellana为公司首席独立董事。当Berner女士在Thomas Glanzmann先生辞职后接任董事会非执行主席职务时,由于董事会有一名主席为独立董事,首席独立董事的角色将终止。 |
| (2) | 任期将在我们的下一次股东大会上到期,预计将在2025年6月30日之前按照法律要求进行。根据西班牙公司法,通过共同选择程序被任命为董事会成员。 |
导演传记
José Ignacio(Nacho)Abia Buenache
Jose Ignacio(Nacho)Abia Buenache先生自2024年2月起担任GRIFOLS, S.A.的董事会成员,自2024年4月1日起担任公司首席执行官一职。此前,他曾在位于宾夕法尼亚州的奥林巴斯美洲公司担任总裁兼首席执行官超过10年。他还曾在东京证券交易所上市公司奥林巴斯公司担任执行官兼COO和CSO。Abia先生在医疗技术和生命科学行业拥有超过二十年的经验,其中一半时间在美国,另一半时间在欧洲,同时还在亚太地区花费大量时间发展业务。在加入奥林巴斯之前,他曾在信息技术和消费电子行业担任多个职位,为多家科技公司工作,包括索尼和TechData。
129
在学术领域,Nacho拥有加泰罗尼亚政治大学(UPC)的电信和电子工程学士学位、巴塞罗那商学院(EAEE)的工商管理硕士(MBA)学位,并在IESE(纳瓦拉大学)完成了高级管理人员课程(PADE)。Abia先生还担任美国-西班牙商会的董事会成员,同时也是Lehigh Valley Health Network的董事会成员,该网络是一个由宾夕法尼亚州13家医院和多个护理中心组成的医院系统。过去,他是生命科学和工业解决方案领域的公司Evident Corporation的董事会成员。
Thomas H. Glanzmann
Thomas H. Glanzmann先生自2006年4月起担任Grifols董事,现任公司非执行主席。他在2023年2月至2024年9月期间担任Grifols的执行主席,并在2023年5月至2024年4月期间担任首席执行官。他在爱尔康公司担任董事会董事和多个委员会(其中包括可持续发展委员会、薪酬委员会和创新委员会)的成员。他还是加州Medical Technology Venture Partners的创始人和普通合伙人。从2006年到2011年,他是Gambro AB的首席执行官。在此之前,Glanzmann先生是HemoCue AB的首席执行官兼董事总经理。Glanzmann先生曾于2004年至2005年担任世界经济论坛的董事总经理。1988年至2004年期间,他在Baxter Healthcare Corporation担任过多个职位:Baxter Healthcare Corporation高级副总裁兼高级公司官;Baxter Bioscience总裁;Immuno International首席执行官;以及European Biotech集团总裁等。1984年至1988年期间,他在菲利普莫里斯工作,担任挪威、丹麦和冰岛的国家经理。Glanzmann先生拥有瑞士洛桑IMD的MBA学位、美国达特茅斯学院的政治学学士学位以及美国加州大学洛杉矶分校安德森管理学院的董事会认证。
Raimon Grifols Roura
Raimon Grifols Roura先生自2015年起担任Grifols董事,自2023年2月起担任董事会副主席。在2017年至2023年期间,他与V í ctor Grifols Deu先生一起担任Grifols的联合和多位首席执行官。他接替了他的兄弟,Víctor Grifols Roura先生的职位。同样,他在2023年2月至2024年5月期间担任首席企业官一职。2001-2015年担任Grifols董事会秘书,非成员,2015年开始担任董事、董事会副秘书。2016年5月,董事会接受其辞去副秘书职务。在2016年7月被任命为执行董事之前,Grifols Roura先生一直是西班牙奥斯本·克拉克律师事务所的合伙人。Grifols Roura先生在巴塞罗那大学(Universidad de Barcelona)获得法律学位。
Raimon Grifols Roura先生是Deria S.A.(根据西班牙证券市场法,为非控股股东)的股东。他还是Scranton Enterprises,B.V.(非控股股东,根据西班牙证券市场法)的股东。
V í ctor Grifols Deu
V í ctor Grifols Deu先生自2016年起担任Grifols的董事。2017年至2023年,他与Raimon Grifols Roura先生一起担任Grifols的联席和多位首席执行官。他接替了父亲Víctor Grifols Roura先生的职位。他于2023年2月至2024年5月担任首席运营官一职。2001年加入公司,任公司计划与控制部分析师。2008年,他成为计划和控制部主任,还被任命为执行委员会成员。他一直是分析团队的一员,负责收购Alpha Therapeutics、Talecris Biotherapeutics和诺华输血诊断部门后的运营整合。他毕业于拉蒙·卢尔大学—— Sarri à化学学院的工商管理和管理,并拥有都柏林迈克尔·斯穆尔菲特商学院的工商管理和管理研究生学位。
V í ctor Grifols Deu先生是Ralledor Holding Spain S.L.(非控股股东,根据《西班牙证券市场法》)的股东。
130
Tomás Dagá Gelabert
Tomás Dagá Gelabert先生自2000年4月起担任Grifols董事,并于2016年5月至2023年12月担任我行董事会副秘书。他是西班牙奥斯本·克拉克律师事务所的创始人,在2024年12月之前,他一直是该律师事务所的合伙人。在2017年6月30日之前,他一直是西班牙奥斯本·克拉克律师事务所的执行合伙人。在加盟奥斯本·克拉克之前,他曾在巴塞罗那的Peat Marwick Mitchell & Co.的公司和税务部门工作。他的职业生涯为他提供了广泛的会计、财务和审计技能。Dag á先生在巴塞罗那大学(Universidad de Barcelona)获得法律学位。
Tomás Dagá Gelabert先生是Scranton Enterprises,B.V.(根据西班牙证券市场法,为非控股股东)的股东。
安妮-凯瑟琳·伯纳
安妮-凯瑟琳·伯纳夫人自2024年以来一直担任Grifols的董事。伯纳夫人带来了金融、医疗保健和工业领域的高管和非高管经验。她的职业生涯包括在多个行业的各种宣传上市和私营国际公司和组织中担任领导职务,重点是金融。在加入我们的董事会之前,Berner女士从1989年到2012年担任Vallila Interior AB的首席执行官和董事会主席,这是一家家族拥有的室内设计公司。伯纳夫人还曾担任芬兰议会议员,并在2015年至2019年期间担任芬兰政府交通和通信部长。伯纳夫人还拥有在林业和造纸、保险和建筑材料等多个行业担任董事会成员和主席的专业知识。她目前担任全球运输和物流公司K ü hne + Nagel AG和北欧公共金融服务集团SEB AB的董事会成员。自2022年以来,她一直担任德国著名能源服务提供商Getec Energie Holding GmbH的顾问委员会主席。此外,她于2022年加入Medicover AB董事会,专注于中欧和东欧的医疗保健和诊断服务。伯纳夫人还是赫尔辛基儿童创伤医院和机构Nadija sr基金会董事会的主席。Berner女士拥有芬兰赫尔辛基汉肯经济学院工商管理和经济学理学硕士学位。
Enriqueta Felip Font
Enriqueta Felip Font博士自2019年5月起担任Grifols的董事。她在巴塞罗那自治大学(UAB)获得了医学和外科学位,并在那里完成了医学肿瘤学博士学位的学习。2010年至2019年5月,她担任阿联酋联合银行副教授。她一直是英国维多利亚大学(UVIC-UCC)的医学教授,自2024年3月起,她担任UAB的教授。Felip Font博士在肿瘤领域拥有广泛的职业生涯和认可的经验,以及科学和研究领域的知识。她目前是Vall d‘Hebron大学医院肿瘤内科服务科长,也是Vall d’Hebron肿瘤研究所胸部肿瘤癌症组的首席研究员。Enriqueta Felip Font博士对癌症研究做出了重大贡献,尤其是在胸部肿瘤领域,并合作开发了肺癌方法,这些方法定义了该疾病的当前护理标准。Enriqueta Felip Font博士参与了与科学组织的多项倡议,其中作为国际肺癌研究协会(IASLC,2017-2021)的董事会成员。她目前是Institut d'Investigaci ó i Innovaci ó Parc Taul í科学委员会的成员。在整个职业生涯中,她在肿瘤领域的工作获得了多项认可。2015年,她获得了欧洲医学肿瘤学会(ESMO)颁发的首个女性肿瘤学奖。2022年5月,她被授予“La Vanguardia de la Ciencia奖”。2024年3月,她被授予“Heine H. Hansen”表彰,表彰在国际范围内为肺癌研究和教育做出重大贡献的肺癌研究人员,并由ESMO和IASLC联合授予。
最近,她在科睿唯安分析公司的2018、2019、2020、2021、2022、2023和2024年年度全球高被引用研究人员名单中担任主角。Enriqueta Felip Font博士已撰写了350多篇同行评审文章。她的专业背景为她提供了科技创新事务方面的专业知识和知识。
131
蒙特塞拉特Mu ñ oz Abellana
Mu ñ oz Abellana女士获得了巴塞罗那Qu í mic de Sari à研究所(Universitat Ramon Lull)的化学工程学位,并在IESE、INSEAD和伦敦商学院获得了多个高管发展课程。
她在宝洁的消费品部门开始了她的职业生涯,在那里她在欧洲各地的运营部门担任过不同的职务。在过去17年中,直到2022年底,她一直担任达能高级主管,曾担任全球医学营养运营副总裁、Iberia医学营养总经理和价值链数字化转型副总裁。
Mu ñ oz Abellana女士还是Uriach的独立董事和审计与合规委员会主席、Comexi的独立董事和任命与薪酬委员会主席、Coplus 130的独立董事和Eole Holdings的监事会主席。她的专业背景为她提供了运营、战略和数字化转型事务方面的专业知识和知识,以及会计、财务和审计技能。
Susana Gonz á lez Rodr í guez
Gonz á lez Rodr í guez女士获得阿斯图里亚斯商学院工商管理学位和旧金山州立大学MBA学位。她的职业生涯始于泰科电子和罗克韦尔自动化的电子行业部门,在那里她担任过不同的职务。她目前担任ABB的高级主管,自2025年2月起,担任机器自动化部门的全球首席销售官。同样,她是世界大企业联合会全球商业女性领袖理事会成员,也是西班牙理事会理事(Instituto de Consejeros-Administradores)成员。她的专业背景为她提供了战略、销售和数字化转型事务方面的专业知识和知识。
I ñ igo S á nchez-Asia í n Mardones
I ñ igo S á nchez-Asia í n Mardones先生自2015年5月起至2022年担任董事会首席独立董事,并自2015年5月起担任GRIFOLS, S.A.的董事。他获得了马德里Pontificia de Comillas大学(ICADE)的工商管理学位和哈佛商学院的MBA学位。2010年,他创立了Portobello Capital,在那里他仍然是执行委员会和投资委员会的合伙人和成员,领导了对Angulas Aguinaga等公司的投资,他是该公司的副主席和执行委员会成员,以及Hotels & Resorts Blue Sea,S.L.,他是该公司的董事会成员和主席。他还是西班牙哈佛俱乐部执行委员会的成员,此前他曾担任该俱乐部的主席。在此之前,1993年至2005年,他担任桑坦德银行的副总经理,2005年至2010年,他是Ibersuizas Gesti ó n SGECR,S.A.的合伙人和董事会成员,通过该合伙人和学术培训,他在财务和非财务方面的会计、审计和风险管理等事务方面获得了经验和知识。
阿尔伯特·格里福尔斯昏迷-克罗斯
Albert Grifols Coma-Cros先生于2004年加入Grifols集团,担任规划和控制部门的分析师。2007年跳槽至财务部,任财务分析师。2013年,Grifols Coma-Cros先生担任公司财务总监一职,并前往爱尔兰发展和实施集团的全球财务结构。2018年至2020年,他被任命为爱尔兰Grifols Worldwide Operations Limited的董事总经理,确保了爱尔兰文化与Grifols自身价值观在我们在该国的子公司逐步发展过程中的正确串通。从2021年到2023年,Grifols Coma-Cros先生担任首席科学创新官,负责整合Grifols集团以前分散在单一科学组织下的所有科学知识。他拥有巴塞罗那自治大学工商管理学位,并在ESADE、乔治城大学或Institut Estudis Financers(IEF)完成了多个管理发展课程。
Grifols Coma-Cros先生还自2015年起担任房地产公司Fisa 14,S.A.的董事会董事,并于2018年至2024年担任养老基金Bansabadell 18,FP的总裁。
132
帕斯卡尔·拉弗里
Pascal Ravery先生自2024年12月起担任Grifols的董事。具有广泛的企业融资和投资银行专业背景,具有跨多个行业和地区的并购重组、战略咨询等专长。他曾在上市公司和私营公司担任C-Suite和董事会顾问,并曾担任私营公司的非执行董事会成员。Ravery先生的金融职业生涯始于英国跨国私募股权和发展资本公司3i Group,他曾于1981年至1983年在该公司工作。随后,他加入了高盛萨克斯,专门研究美国和英国的并购和公司融资,在1985年至1992年期间在公司和国有企业的私有化、重大合并以及IPO中发挥关键作用。
1992年,Ravery先生加入摩根大通,担任董事总经理兼欧洲工业主管,最终于2008年成为投资银行部门的副主席。2012年,他被任命为瑞士摩根大通证券公司首席执行官兼管理委员会主席。2015年,拉弗里先生创立了Lakeside Capital Advisers,这是一家位于瑞士巴尔的企业融资咨询公司,目前担任该公司的首席执行官。Ravery先生毕业于欧洲工商管理学院MBA项目和欧洲工商管理学院独立董事项目。
Paul S. Herendeen
Paul S. Herendeen先生自2024年12月起担任Grifols的董事。他目前担任Endo,Inc.的董事长以及Elanco Animal Health公司的董事会成员。Herendeen先生曾担任Bausch Health Companies Inc.公司董事长顾问兼首席执行官,还曾担任该公司执行副总裁兼首席财务官。在此之前,他是硕腾公司的执行副总裁兼首席财务官。他还曾在专业制药公司Warner Chilcott担任首席财务官一职,此前他在MedPointe担任执行副总裁兼首席财务官四年后重新加入该公司。
在其职业生涯的早期,赫伦丁曾在Dominion Income Management和Cornerstone Partners担任主要投资者。他还在银行和公共会计领域担任过多个职位,包括在Oppenheimer & Company的投资银行集团、大陆银行公司的资本市场集团担任职务,并在Arthur Andersen & Company担任高级审计师。他拥有波士顿学院的学士学位和弗吉尼亚大学达顿商学院的MBA学位。
董事会秘书及副秘书、非成员简历
Nuria Martín Barnés
Nuria Martín Barnés女士于2001-2015年担任董事会副秘书、非成员,2015年至今担任董事会秘书、非成员。Martín女士自2017年7月1日起至2022年12月31日担任奥斯本克拉克西班牙公司的管理合伙人。在加入奥斯本·克拉克之前,她曾于1982年至1986年在毕马威Peat Marwick的公司和税务部门工作。Martín女士是Probitas Fundaci ó n Privada基金会的受托人和主席。她是Compa ñ í a General de Inversiones,SICAV,S.A.和Gesiuris CAT Patrimonis的董事会秘书和成员,以及Gesiuris Asset Management,S.G.I.I.C.,S.A.的董事会秘书,非成员。Martín女士在巴塞罗那大学获得法律学位。
Laura de la Cruz Gal á n
Laura de la Cruz Gal á n女士自2023年12月起担任董事会副秘书,自2024年4月起担任审计委员会非成员秘书。她是西班牙奥斯本·克拉克律师事务所的合伙人,自2012年以来,她一直在那里工作。De la Cruz女士专门研究与上市公司有关的公司治理,以及国际并购交易。她拥有巴塞罗那ESADE法学院的法律学位,并于2011年毕业。2023年,她被选入8第欧洲女性领导力网络组织的“女性人才库领导力计划”版。此外,她还是Fundaci ó V í ctor Grifols i Lucas的受托人和董事会秘书。
133
高级管理人员
我们继续对高级管理层进行变革,这与我们精简公司职能、将所有权与高级管理层分离以及提高整个组织的其他效率的战略计划相一致。见第一部分“经营和财务回顾与展望—— A.经营成果——影响我们财务状况和经营成果的因素——经营改善计划”项目5。
截至2024年1月1日,Albert Grifols Coma-Cros先生辞去首席科学创新官的行政职务,同时作为专有董事继续担任董事会成员,代表我们的主要股东之一Ponder Trade,S.L。
2024年2月,董事会任命José Ignacio(Nacho)Abia Buenache先生为Grifols的新任首席执行官,该职位由Abia先生于2024年4月1日担任。在与我们的前任首席运营官和首席公司官一起工作的过渡期后,Abia先生承担此前由这些职位担任的职责,而V í ctor Grifols Deu先生和Raimon Grifols Roura先生辞去其行政职务,继续担任自营董事,分别代表我们的主要股东Ralledor Holding Spain,S.L.和Deria,S.A.。
2024年5月,长期在Grifols任职的首席财务官 Alfredo Arroyo先生宣布退休,但在过渡阶段仍留在公司工作至2024年12月。
2024年9月,Rahul Srinivasan先生被任命为Grifols新的首席财务官,带来超过25年的金融服务经验,包括在毕马威、瑞士信贷和美国银行担任领导职务。
最终,在2024年9月,Thomas Glanzmann先生从执行主席过渡到非执行职务。
我们高级管理层的其他显着变化是:
| ● | Roland Wandeler先生被任命为我们生物制药业务部门的新总裁,接替Maria Pia D’Urbano女士; |
| ● | Camille Alpi先生被任命为我们的首席人力资源和人才官,接替Montserrat Gaja Llamas女士;和 |
| ● | Jaime Gonz á lez先生被任命为我们的首席数字信息官,接替Miguel Louzan先生。 |
| ● | Montse Ribas女士被任命为我们的首席传播和声誉官,接替Maria Teresa Rion é Llano女士。 |
134
我们的高级管理层目前由以下人员组成:
姓名 |
|
年龄 |
|
标题 |
|
自 |
|
José Ignacio(Nacho)Abia Buenache |
56 |
首席执行官 |
2024 |
||||
拉胡尔·斯里尼瓦桑 |
48 |
首席财务官 |
2024 |
||||
卡米尔·阿尔皮 |
43 |
首席人力资源和人才官 |
2024 |
||||
David Ian Bell |
70 |
首席公司事务和法律干事 |
2023 |
||||
Daniel Fleta Coit |
54 |
首席工业服务官 |
2022 |
||||
蒙特斯·里巴斯 |
57 |
首席传播和声誉官 |
2025 |
||||
J ö rg Sch ü ttrumpf |
50 |
首席科学创新官 |
2024 |
||||
Antonio Martinez Martinez |
58 |
总裁,诊断 |
2022 |
||||
卢伊斯·庞斯·戈麦斯 |
42 |
战略高级副总裁 |
2022 |
||||
Ignacio Ramal Subira |
57 |
首席内审&企业风险管理 |
2022 |
||||
Jaime Gonz á lez Peralta |
52 |
首席数字信息官 |
2024 |
||||
乔迪·巴尔塞尔·瓦尔斯 |
52 |
等离子采购总裁 |
2022 |
||||
罗兰·万德勒 |
52 |
生物制药公司总裁 |
2024 |
||||
恩里克·德拉托雷 |
53 |
首席合规官 |
2019 |
高级管理人员简历
以下是我们的高级管理人员也不是董事的履历:
拉胡尔·斯里尼瓦桑
Rahul Srinivasan自2024年9月起担任Grifols的首席财务官,负责监督公司的整体财务职能,包括规划、财务、税务、财务报告、投资者关系和可持续发展。
Srinivasan先生在毕马威、瑞士信贷和美国银行担任过多个高级领导职务,拥有超过25年的金融服务专业知识。他广泛的金融服务背景涵盖审计和鉴证服务、交易服务、公司融资、并购和资本市场。最近,他担任美国银行EMEA杠杆金融和资本市场主管。
他是英格兰和威尔士特许会计师协会(ICAEW)的杰出研究员,拥有伦敦政治经济学院商业数学和统计学士学位。此外,他还获得了法国巴黎ENPC国际管理学院全额赞助的高管MBA学位。
卡米尔·阿尔皮
Camille Alpi于2024年2月加入Grifols,担任首席人力资源和人才官,带来了横跨欧洲、美国、南美和亚洲的二十年国际人力资源领导经验。
在加入Grifols之前,他曾担任公司医疗保健部门达能Specialized Nutrition的人力资源副总裁。作为人力资源领导者的不同角色,他领导了地方、区域和全球层面的人力资源战略,重点关注人才和组织发展、员工体验和敬业度,以及转型和变革管理。
Alpi先生拥有瑞典乌普萨拉大学商业和经济学硕士学位。
David Ian Bell
David Bell是Grifols的首席公司事务和法务官,领导公司治理、法律和合规职能。自2003年加入Grifols担任总法律顾问以来,Bell先生一直是公司执行委员会和管理委员会的成员。
135
2016年至2020年,他担任首席创新官,2021年,他被任命为首席企业发展官,专注于战略合作伙伴关系和业务扩张。在Grifols任职之前,Bell先生是Alpha Therapeutic Corporation的副总裁兼总法律顾问、公司秘书以及Knapp,Petersen & Clarke的合伙人。
贝尔先生在西南大学获得法律学位,并拥有加州大学欧文分校的心理生物学科学学士学位。他还完成了哈佛法学院的律师指导课程。十多年来,他参加了PPTA(血浆蛋白治疗协会)的全球董事会,并于2016年至2019年担任该协会的主席。
Daniel Fleta Coit
Daniel Fleta自2019年1月起担任Grifols的首席工业官。他在Grifols的职业生涯跨越了二十多年,在Grifols Engineering担任过几个关键领导职位,包括总经理。
他拥有巴塞罗那拉蒙·鲁尔大学工业工程专业化学学位,并在IESE商学院完成了高管课程。他在工业运营和工程方面的广泛背景为Grifols在医疗保健领域的增长和创新做出了重大贡献。
蒙特斯·里巴斯
Ribas女士于2025年3月加入Grifols,担任首席传播和口碑官。在加入Grifols之前,Ribas女士在时尚和香水公司Puig工作了30年,在那里她领导了企业传播、公共战略和高级机构关系,担任企业传播和协议总监。Ribas女士拥有ESADE(商业管理和企业传播)的工商管理学位和两个硕士学位。她的丰富经验包括媒体关系、危机沟通、企业转型、管理重大事件等。
J ö rg Sch ü ttrumpf
J ö rg Sch ü ttrumpf博士于2024年9月加入Grifols,担任首席科学创新官(CSIO)。作为整个Grifols集团的创新负责人,Sch ü ttrumpf博士专注于加快关键治疗领域的差异化血浆和非血浆药物的开发。自2022年初以来,Sch ü ttrumpf博士一直担任我们子公司Biotest AG的首席科学官,自2012年起担任该公司的全球研究主管,自2015年起担任研发主管。Sch ü ttrumpf博士是一名内科科学家,专门研究输血医学和止血酶学,拥有法兰克福歌德大学、弗赖堡阿尔伯特-路德维希大学和IMD商学院的学位。在他的职业生涯中,他曾在德国和美国的领先研究机构工作。
Antonio Martinez Martinez
Antonio Mart í nez博士是我们诊断业务部门的总裁,他自2022年6月以来一直担任该职务。此前,他在同一单位担任科学和研发总裁。Martinez博士在Progenika BioPharma,S.A.创立并担任首席执行官近20年,之后该公司成为Grifols集团的一部分。在他职业生涯的早期,他曾在制药公司PharmaMar工作,并在纳瓦拉大学担任化学教授。
Mart í nez博士拥有纳瓦拉大学分子遗传学博士学位和IE商学院运营管理硕士学位。他还获得了穆尔西亚大学的化学学士学位。
卢伊斯·庞斯·戈麦斯
庞斯先生于2017年加入Grifols。他目前担任战略部高级副总裁。此前,庞斯先生曾在贝恩公司担任管理顾问。Pons先生拥有香港UST和伦敦商学院的MBA学位,并于2000年获得加泰罗尼亚理工大学工业工程学位。
136
Ignacio Ramal Subira
拉马尔先生于2008年加入Grifols。现任首席内审&企业风险经理。此前,拉马尔先生在安永会计师事务所担任外部审计师。Ramal先生获得经济学学位,是西班牙的注册会计师。
乔迪·巴尔塞尔·瓦尔斯
Jordi Balsells于2022年10月加入Grifols,担任等离子采购业务部门总裁。他在全球市场的多元化职业生涯中带来了丰富的战略领导和业务发展经验。在加入该公司之前,Balsells先生是巴塞罗那足球俱乐部的营销和授权董事总经理。
在巴塞罗那足球俱乐部任职之前,他在领先的时尚品牌Desigual工作了十多年,在那里他担任过多个高级领导职务,并且是推动该公司在亚洲业务扩张并显着增强其数字客户体验的高管团队的一员。在此期间,他在伦敦和香港生活和工作。
Balsells先生拥有Pompeu Fabra大学(巴塞罗那)的经济学和工商管理学位,ESADE的行政MBA,并在IESE商学院完成了管理发展课程(PDG)。他还在欧洲工商管理学院和哈佛商学院完成了高管教育课程。
罗兰·万德勒
Roland Wandeler博士于2024年1月加入Grifols,担任生物制药业务部门总裁,为公司带来了在执行角色和战略管理咨询方面二十多年的全球生物制药经验。
Wandeler博士在横跨欧洲和美国的整个职业生涯中,通过商业、运营和组织方面的卓越表现,在建立和领导团队、制定战略以及推动增长方面有着良好的记录。在此之前,他担任过MorphoSys的首席商务官,并在其在安进 14年的职业生涯中担任过多个高管职务,包括公司副总裁兼美国骨骼健康和心脏病学总经理、德国副总裁兼总经理以及Iberia总经理。
Wandeler博士毕业于苏黎世的瑞士联邦理工学院(ETH),拥有技术科学博士学位和化学工程理学硕士学位。
Jaime Gonzalez Peralta
Gonz á lez先生于2024年加入Grifols,担任首席数字信息官。他在为欧洲和美国的大型复杂跨国组织设计增值IT解决方案方面拥有超过25年的经验。最近,他在比利时丽笙酒店集团担任全球首席信息官。
Gonz á lez先生拥有美国计算机科学和电信等专业的硕士学位。
恩里克·德拉托雷
De la Torre先生于2014年加入Grifols,担任全球合规总监。他自2019年起担任首席合规官。在此之前,De la Torre先生曾在不同行业的客户担任质量、风险和合规审计师,之后于2001年加入勃林格殷格翰,曾在环境保护、安全、计算机系统验证和数据保护领域担任管理职务。自2010年起,他担任西班牙附属公司的合规官。De la Torre先生于1996年获得Institut Qu í mic de Sari à化学工程学位。他还拥有拉蒙·鲁尔大学的风险管理硕士学位,以及Esade商学院的高级管理人员MBA学位。
137
家庭关系
我行自营董事Raimon Grifols Roura先生与前任董事、董事会名誉主席(非成员)Víctor Grifols Roura先生为兄弟关系。
Raimon Grifols Roura先生是V í ctor Grifols Deu先生的叔叔,他既是我们的专有董事,也是前联席首席执行官。
我们的董事兼前任联席首席执行官V í ctor Grifols Deu先生是前任董事兼董事会名誉主席(非成员)Víctor Grifols Roura先生的儿子。
Mrs. Víctor Grifols Roura和Raimon Grifols Roura是José先生的孙子孙女,也就是我们的创始人Antonio Grifols i Roig。
我们的董事兼前任联席首席执行官Raimon Grifols Roura先生和前任董事兼董事会名誉主席(非成员)Victor Grifols Roura先生是我们专有董事Albert Grifols Coma-Cros先生的叔叔。
Victor Grifols Deu先生和Albert Grifols Coma-Cros先生是堂兄弟。
选定若干董事或高级管理人员所依据的安排
我们没有安排。
b. |
Compensation |
我们董事的薪酬是根据我们的董事薪酬政策确定的。根据《GRIFOLS, S.A.董事会内部职能规定》(Reglamento de funcionamiento interno del consejo de administraci ó n,或“董事会规定”)第15条,董事会的任命和薪酬委员会(Comisi ó n de nombramientos y retributiones,或“任命和薪酬委员会”)必须作为核心责任,向董事会提出(供批准并进一步向股东提出)适用于我们董事的薪酬政策。此外,任命和薪酬委员会还向董事会提出,供董事会批准,我们的高级管理人员和在董事会直接监督下履行顶层管理职责的员工的薪酬。
在确定薪酬政策时,任命和薪酬委员会考虑比较市场数据,为此对公司所有员工的薪酬待遇进行外部竞争性分析,其中包括管理团队。进行此项分析是为了分析补偿水平的充分性,并确保这些与行业内其他公司同等责任水平的市场标准一致。独立顾问开展的薪资调查通常被用作这一分析的信息来源。
作为这一核心责任的一部分,在2023年,任命和薪酬委员会对我们之前的董事薪酬政策进行了彻底的审查,获得了股东、投资者和其他利益相关者的意见,并获得了独立顾问Mercer LLC的建议。作为这一过程的结果,我们的股东在2023年6月16日举行的股东大会上批准了我们目前的董事薪酬政策,该董事薪酬政策由2024年6月14日举行的股东大会提交修订,以使其适应自政策批准以来发生的主要情况和事件(“董事薪酬政策”)。新政策的目的是加强我们的薪酬体系与我们的长期战略计划、股东利益和可持续性的一致性,所有这些都带有审慎的风险管理和避免利益冲突。
138
2024年6月14日举行的股东大会批准了对薪酬政策的主要修订如下:(i)鉴于Victor Grifols Roura先生已于2023年12月辞去董事会成员的职务,因此完全取消为董事会名誉主席设定的薪酬,(ii)消除对执行董事的薪酬的任何提及,因为他们已于2024年5月31日辞去执行职务,(iii)包括Nacho Abia先生作为首席执行官的薪酬方案和(iv)包括回拨政策(董事会于2023年10月批准)作为公司薪酬政策的一部分。
董事薪酬政策于2023年和2024年期间生效并适用,并将于2025年财政年度结束时到期。根据适用法律,新的薪酬政策必须在其申请的最后一个财政年度(即2025年)结束前提交我们的股东大会批准,该政策可能自其批准的时刻起适用。
董事会成员的薪酬
我们的《公司章程》一般规定了支付给董事会成员的补偿的确定流程。《公司章程》第二十条之二规定,董事薪酬由股东大会批准,适用期限最长为三个会计年度。新董事的薪酬政策必须在前一政策适用的最后一年之前获得股东大会批准,如经股东大会如此确定,任何获批准的新政策可自批准之日起至其后三年适用。
根据《董事会条例》第26条,董事薪酬政策(i)必须确定支付给所有董事的年度薪酬总额的最高金额,以及考虑到赋予他们每个人的职责和责任的分配标准,以及(ii)就履行执行职责的董事而言,必须包括年度固定薪酬的金额、设定可变部分的不同参数以及其合同的主要条款和条件,尤其包括期限,终止雇佣关系、排他性、合同后竞业禁止、保留或忠诚协议的遣散费或补偿。董事会随后根据公司章程、董事薪酬政策及相关协议(如适用)的框架,考虑到我们的委任及薪酬委员会的先前报告,确定将向每位董事分配多少股东批准的总薪酬金额作为薪酬。
根据我们的公司章程和董事薪酬政策,我们的董事有权因在我们的董事会担任董事而获得固定金额的报酬。执行行政职务的董事薪酬可能包括(i)固定金额,(ii)基于财务和非财务指标的可变金额,(iii)如适用,在某些终止或解雇情况下的薪酬,以及(iv)可能包括交付股份,或股份期权或参考股份价值的金额,但须遵守立法不时规定的要求,在每种情况下均根据《公司章程》和董事薪酬政策,以及根据《西班牙公司法》条款批准的协议。
截至2024年12月31日止年度,董事应计薪酬总额为1510万欧元。这一数额包括执行董事和非执行董事的薪酬。
非执行董事
我们的独立董事、专有董事和归类为“其他外部董事”的非执行董事(consejeros no ejecutivos)。我们的薪酬理念,如《董事会条例》第27条所述,规定非执行董事的薪酬应激励我们的董事敬业和参与,同时不对其独立性造成障碍。为此,第27条进一步规定,董事会应根据任命和薪酬委员会的建议,采取必要措施,确保非执行董事的薪酬遵守以下准则:(a)其薪酬应与其奉献精神、资格和责任相关;(b)他们被排除在任何计划(x)中,包括交付股权奖励或期权或与我们的股票价值挂钩的其他工具,(y)与我们的业绩挂钩,或(z)包括退休福利。然而,非执行董事可能会获得我们的股份报酬,前提是他们同意在董事会成员任期内持有此类股份。
139
根据董事薪酬政策,我们的股东将年度最高总金额设定为每位非执行董事应付的100,000欧元,向我们提供有偿专业服务的非执行董事除外。担任其中一个董事会委员会(审计委员会、任命和薪酬委员会以及可持续发展委员会)成员的任何董事,可额外获得25,000欧元的年度薪酬毛额(因此,他们的年度薪酬总额将达到125,000欧元)。同样,每名委员会主席可额外获得25,000欧元(因此,他们的年度薪酬总额将达到150,000欧元)。首席独立董事获得的额外薪酬为50,000欧元(因此,首席独立董事的年度薪酬总额将达到150,000欧元)。在任何情况下,非执行董事的薪酬不得超过每年150,000欧元。
我们的执行董事和向Grifols集团提供有偿专业服务的董事不会仅因其董事身份而获得任何报酬。归类为“其他外部董事”的董事在2024年没有获得任何薪酬。我们的董事都没有收到董事会或董事会各委员会会议的出席费。最后,根据《公司章程》第20条之二,我们的董事因担任董事而产生的一切费用均获补偿。
截至本年度报告发布之日,根据《交易法》的要求和纳斯达克上市规则,Anne-Catherine Berner女士、Enriqueta Felip Font博士、Susana Gonz á lez Rodr í guez女士、Montserrat Mu ñ oz Abellana女士、I ñ igo S á nchez-Asia í n Mardones先生和Pascal Ravery先生为我们的独立董事。Dag á先生和Glanzmann先生担任其他外部董事(且非独立),Raimon Grifols Roura先生、Victor Grifols Deu先生、Albert Grifols Coma-Cros先生和Paul S. Herendeen先生担任专有董事(且非独立),符合西班牙公司治理规则。
下表详细列出各非执行董事于2024年的个人薪酬:
|
固定补偿 |
|
委员会津贴 |
|
合计 |
|
(单位:欧元) |
||||||
Raimon Grifols Roura(2) |
|
58,333 |
|
— |
|
58,333 |
Victor Grifols Deu(2) |
|
58,333 |
|
— |
|
58,333 |
阿尔伯特·格里福尔斯昏迷-克罗斯 |
|
100,000 |
|
— |
|
100,000 |
Tomás Dagá Gelabert |
|
— |
|
— |
|
— |
蒙特塞拉特Mu ñ oz Abellana |
|
100,000 |
|
50,000 |
|
150,000 |
I ñ igo S á nchez-Asia í n Mardones |
|
100,000 |
|
50,000 |
|
150,000 |
Enriqueta Felip Font |
|
100,000 |
|
25,000 |
|
125,000 |
Susana Gonz á lez Rodr í guez |
|
100,000 |
|
25,000 |
|
125,000 |
安妮-凯瑟琳·伯纳 |
|
50,000 |
|
25,000 |
|
75,000 |
Paul S. Herendeen |
|
6,301 |
|
— |
|
6,301 |
帕斯卡尔·拉弗里 |
|
6,301 |
|
— |
|
6,301 |
合计 |
|
679,268 |
|
175,000 |
|
854.268(1) |
(1) |
该表仅反映现任非执行董事的薪酬。除上述金额外,我们还向2024年期间担任非执行董事且不再是我们董事会成员的人员支付了以下金额:(i)向James Costos支付75,000欧元;(ii)向Carina Szpilka L á zaro支付79,932欧元;以及(iii)向Claire Giraut支付8,562欧元。 |
(2) |
作为董事会专有非执行成员的Raimon Grifols Roura先生和Victor Grifols Deu先生的薪酬按其担任这些职务的2024年的月份(2024年6月至2024年12月)的比例支付。 |
执行董事
目前只有我们的首席执行官为公司履行执行职能。然而,在截至2024年12月31日止年度的部分时间内,其他董事履行了执行主席、首席公司官和首席运营官的执行职能。
140
我们的任命和薪酬委员会通过考虑类似公司中的类似角色来确定CEO的薪酬。这一决定依赖于外部顾问对全球行业同行的建议,例如Abeona、Baxter、Bio-Life Solutions、渤健、CSL、Rovi、默沙东、TERM2、全细胞医护科技、辉瑞、TERM4、赛诺菲、武田和奥林巴斯。委员会的工作包括对来自上述多个国家,如美国、澳大利亚、西班牙、德国、法国和日本的选定公开上市行业同行的2018年至2022年CEO薪酬进行比较分析,并结合可比公司的市场实践设计薪酬的各个要素。
执行董事与其执行职能相关的薪酬可能包括(i)固定金额,(ii)基于财务和非财务指标的可变金额,其中包括环境、社会和治理(“ESG”)目标,(iii)如适用,在某些终止或解雇情况下的补偿,以及(iv)交付股份,或参考股份价值的购股权或金额,但须遵守立法不时规定的要求。
执行董事的短期可变薪酬百分比是根据某些目标的实现情况确定的,这些目标是按年度确定的,并由董事会根据任命和薪酬委员会以及可持续发展委员会(如适用)的提议批准。这些目标与不同的财务和非财务指标和参数挂钩,所有这些都符合适用的薪酬政策。
截至2024年12月31日止年度,在董事薪酬政策中确立了以下财务和非财务指标。关于每一项目标,董事会批准了以下目标:
| ● | 与Grifols集团综合业绩相关的经济指标(总权重为40%): |
| o | 目标(权重15%):实现以固定货币计算的经营业绩达到一定水平; |
| o | 目标(权重25%):达到一定还本付息前并表现金流水平。 |
| ● | 债务削减指标(权重为25%):在2024年下半年实现总债务水平的降低。 |
| ● | 基于关键绩效指标(“KPI”)的ESG指标(权重为10%,其中2.5%用于环境KPI,4.0%用于社会KPI,3.5%用于治理KPI):目标是实现100%的ESG目标,这与我们的可持续发展战略一致,已由可持续发展委员会监督,并已由我们的独立审计师审查。 |
| ● | 创新指标(权重为10%):实现与创新项目相关的7个里程碑。 |
| ● | 其他运营指标(总权重为15%): |
| o | 目标(权重5%):宣布并在2024年4月至12月期间完成组织结构向新CEO的过渡;以及 |
| o | 目标(权重为10%):实现综合销售额较2023年增长7.3%,以固定货币计算。 |
首席执行官
我们的首席执行官在2024年累积了420万欧元(其中包括一笔非经常性签约奖金)的现金薪酬(290万欧元的固定薪酬和130万欧元的可变薪酬,已支付)。这一可变补偿金额是根据上述具体绩效目标的实现情况计算得出的。首席执行官的可变薪酬是通过对上述每个目标应用加权支付系数确定的,在应用83.86%的总绩效百分比后达到最终可变薪酬金额。
141
执行主席(至2024年9月)
截至2024年12月31日止年度,我们的董事会非执行主席、担任执行主席至2024年9月的Thomas Glanzmann先生应计120万欧元固定薪酬和110万欧元可变薪酬,均以现金支付。他的可变薪酬是根据上述具体业绩目标的实现情况计算的。他的可变薪酬是通过对上述每个目标应用加权支付系数确定的,在应用90.85%的总绩效百分比后达到最终可变薪酬金额。
首席运营官兼首席企业官(至2024年5月)
Raimon Grifols Roura先生和Victor Grifols Deu先生于2024年5月31日卸任前已领取执行职务薪酬。Raimon Grifols Roura先生的应计薪酬总额为390万欧元,其中包括455,370.78欧元的固定工资和330万欧元的额外薪酬,因为在我们的执行管理层发生变动并任命José Ignacio Abia Buenache先生为首席执行官后,他们有权根据各自的雇佣协议获得合同遣散费。同样,Victor Grifols Deu先生也累积了390万欧元,其中包括455,56 0.08欧元的固定工资和330万欧元的额外薪酬。此外,Raimon Grifols Roura先生作为我们子公司Biotest AG的监事会成员累计获得报酬的权利为18,333.33欧元。
Raimon Grifols Roura先生和V í ctor Grifols先生还各自获得了2022财年分配的21,274个限制性股票单位(RSU),归属期为两年零一天。因此,在2024年,每人获得了115,305.08欧元的B类股票。这些受限制股份单位是根据当时适用的薪酬政策根据执行董事担任该职务时适用的条款授予的。
高级管理层其他成员
2024年,我们的高级管理层成员(不包括同时担任董事会成员的成员)累积薪酬总额为1370万欧元。这一数字包括与2024年服务相关的或有或递延薪酬的应计项目。2023年,我们的高级管理层成员(不包括同时担任董事会成员的成员)累积薪酬总额为2370万欧元。这一数字包括与2023年服务相关的或有或递延薪酬的应计项目。2022年,我们的高级管理层成员(不包括同时担任董事会成员的成员)获得的薪酬总额为1390万欧元。这一数字包括与2022年服务相关的或有或递延薪酬的应计项目。
截至2024年12月31日、2023年和2022年12月31日止年度,为履行职责而向我们的高级管理人员(不包括同时担任董事会成员的人员)支付的总金额的细目载于下表。
当年支付金额 |
||||||
截至12月31日, |
||||||
成分 |
|
2024 |
|
2023 |
|
2022 |
(单位:欧元) |
||||||
工资 |
|
7,930,417 |
|
14,567,449 |
|
8,489,991 |
可变补偿 |
|
5,745,949 |
|
9,131,372 |
|
5,400,772 |
股票期权或其他证券 |
|
— |
|
— |
|
— |
其他——例如,人寿和健康保险 |
|
28,586 |
|
34,864 |
|
68,301 |
其他——例如,养老金/储蓄 |
|
31,778 |
|
30,776 |
|
124,677 |
142
高管薪酬回拨政策
2022年10月26日,SEC根据《交易法》第10D条修订了规则10D-1和其他规则,以实施《多德-弗兰克华尔街改革和消费者保护法》(Dodd-Frank Wall Street Reform and Consumer Protection Act,简称“回拨规则”)中基于激励的赔偿追偿条款,简称“回拨规则”。回拨规则要求国家证券交易所(如纳斯达克)采用上市标准,根据该标准,发行人必须实施和执行要求回拨任何现任或前任执行官在紧接所要求的发行人提交的财务报表重述日期之前的三个财政年度内因发行人严重不遵守证券法规定的任何财务报告要求而获得的基于激励的薪酬的政策。
2023年6月,SEC批准了纳斯达克发布的拟议回拨上市标准。2023年10月19日,我们的董事会批准了我们的“高级管理人员追回错误奖励薪酬的追回政策”,以遵守追回规则。该政策作为附件 97.1附于本年度报告后。
雇佣及遣散安排
我们与高级管理层的四名成员订立了雇佣合同,在我们发生控制权变更的情况下,他们有权单方面解除雇佣合同并获得两到五年工资的解雇福利。除此之外,我们高级管理层的六名成员根据合同有权在控制权变更以外的特定情况下获得一到两年工资的解雇福利。
有关雇员收到的付款的进一步详情,请参阅本年度报告所载我们经审计的综合财务报表附注29(c)和31(a)。
股权和其他激励计划
有关符合条件的员工(包括我们的高级管理层成员)可获得的基于股权的薪酬计划的描述,请参阅“— E.股份所有权”。
养老金和退休补偿方案
我们的董事和受雇于我们美国子公司的高级管理人员按照与我们其他员工相同的条款参与符合税务要求的401(k)计划。2024年期间,雇主对我们董事和高级管理层的401(k)计划的缴款总额为3180万欧元。在2024年,我们和我们的子公司均未预留或累积任何其他金额,以向我们的董事或高级管理人员提供养老金、退休金或类似福利。
c. |
董事会惯例 |
董事会
根据《公司章程》,我们由一个董事会(“董事会”)管理,该董事会可由不少于三名且不超过15名董事组成。我们目前的董事会有13名董事。董事必须是个人。根据西班牙法律,董事会负责管理、行政和代表有关业务的所有事项,但须遵守《公司章程》的规定和股东大会授予的权力。
任免
根据西班牙法律和我们的公司章程,董事由我们的股东选举产生,任期四年,可以连任,任期不限,但独立董事除外,根据西班牙法律和最初在2006年4月5日举行的董事会会议上批准并不时修订的董事会条例(“董事会条例”),独立董事的任期不得超过12年。我们没有为这些董事或其他方面规定以交错间隔或累积投票的方式重新选举董事。
143
董事必须是个人。董事任期届满前不再任职的,董事会可以聘任新的董事接替离任董事的方式填补空缺。任何如此委任的董事将任职至下一次股东大会时,我们的股东可能会确认或撤销该委任。如果该任命发生在召开一般股东大会的时间到召开该会议的时间之间,那么如此任命的董事将任职至下一次股东大会,届时此项任命将被确认或撤销。任何此类任命将仅限于离任董事的剩余任期,但不影响该董事的最终选举。董事可以随时由我会股东大会决议提出辞职或者被免职。身兼股东的董事,可就我们股东有关董事任免(包括任免该董事)的任何决议自由投票。
此外,根据《董事会条例》,董事必须向董事会提出辞呈,董事会可在以下情况下酌情接受该辞呈:(i)当该董事不再担任与该董事被任命为董事会相关的行政职务时;(ii)当出现可能损害公司名称或声誉的情况时,与其在公司内的行为有关或无关;(iii)当董事因不合格或不相容的法律原因而无法担任该职务时;(iv)当监管机构对其提出任何刑事指控或对其展开正式调查时;(v)当该董事因违反其作为董事的职责而受到我们审计委员会的严厉告诫时;(vi)当该董事参与董事会可能危及我们的利益或当其任命的理由不复存在时;(vii)在自营董事的情况下,当相关股东停止持有其在我们的股份,或将其股份减至低于合理地证明任命该董事的合理水平时。董事离任时,无论是在任期届满前以辞职或股东大会决议方式离任,均应在必须通过董事长或秘书送达董事会成员的函件中,足够详细地说明本决定背后的原因,或就非执行董事而言,说明其对股东大会决议理由的意见。
此外,根据西班牙公司法,有表决权股份的持有人(或一组共同行动的有表决权股份的股东)可根据董事会席位的空缺情况,任命与该股东(或一组股东)在我们的有表决权资本中的利益成比例的若干名董事。如果该股东(或股东集团)所持股份所代表的有表决权的股本等于或大于我们有表决权的总股本除以董事人数的结果,该股东(或股东集团)有权按比例指定董事人数。例如,在一家拥有五名董事的公司中,持有100股有表决权股份中的20股的股东将有权任命一名董事。如果行使这一权力,如此汇集的股份不得参与董事会其他成员的投票。然而,他们可能会就罢免现有董事行使投票权。由于此类权利仅适用于有表决权的股份或收回投票权的B类股份,我们的B类股份和在美国代表它们的B类ADS不计入比例代表权。
理事会必须从其成员中任命一名理事会主席。Thomas Glanzmann先生是现任非执行主席,并将担任该职务至2025年6月召开我们的股东大会为止。自股东大会召开以来,安妮-凯瑟琳·伯纳女士将接替格兰兹曼先生担任我们董事会的非执行主席。理事会还可指定一名或多名副主席,由其连续编号,在无法作为或缺席时由其接替主席。Raimon Grifols Roura先生为现任副主席。董事会可委任一名不须为董事会成员的名誉主席。名誉主席负有名誉代表的职责,并将向董事会主席和董事会副主席提供咨询意见。目前,Victor Grifols Roura先生为名誉主席,为董事会非成员。
董事会还必须任命一名秘书,也可以指定一名或多名副秘书。秘书或副秘书均无须为董事会成员;但秘书或副秘书除非是董事会成员,否则无权就摆在董事会面前的事项进行表决。Nuria Martín Barnés女士现任董事会秘书非成员,而Laura de la Cruz Gal á n女士现任董事会副秘书非成员。
144
董事会会议
根据《公司章程》,主席可在其认为必要或适当时召开董事会会议。还要求主席应三分之一董事的要求召集会议。董事会会议至少在会议日期前十天使用任何通知方式召开,除非紧急情况需要更短的期限。此类董事会会议通知必须说明地点、日期和时间以及要讨论的问题。西班牙法律要求董事会至少每三个月召开一次会议。我们的公司章程规定,董事会过半数董事(半数加一名出席会议的董事)(由董事会另一名董事亲自或委托代理人代表;非执行董事只能委任另一名非执行董事代表他们)构成法定人数。除法律另有规定或《公司章程》另有规定外,董事会决议必须由出席会议或派代表出席会议的董事以绝对多数通过,如出现平局,主席有权投决定性一票。
根据《公司章程》,董事会可以通过视频会议、电话会议或任何其他远程通信系统召开会议,只要所述通信是实时进行的,因此,在一个单独的行为中,并且参与或投票的个人的身份和电子通信的安全都得到适当的保障。
权力下放
根据西班牙法律和我们的公司章程,董事会可将其权力授予一个执行委员会(Comisi ó n Ejecutiva)或一名或多名首席执行官。西班牙公司法规定,任命执行委员会、任何首席执行官或授权永久授予此类董事会全部或部分权力的决议,需要获得此类董事会成员的三分之二多数,并在西班牙商业登记处(Registro Mercantil)登记此类决议。委员会亦可随时撤销该等权力。此外,当董事会成员被任命为首席执行官或被授予执行职能时,他/她将需要与公司达成协议,该协议应获得董事会三分之二多数的批准。相关董事将不得不避免参与此类协议的审议和表决过程。
根据西班牙公司法,董事会还可以向任何人授予一般授权书或特定授权书,无论该人是否为董事或股东。一般授权书必须在商业登记处登记。然而,西班牙法律规定,除其他外,以下权力不得由董事会授予:(i)制定年度财务报表并在股东大会上提交以供批准;(ii)股东大会授予董事会的权力(除非相关股东决议另有规定)。
José Ignacio(Nacho)Abia Buenache先生为公司现任首席执行官,全权委托董事会依法授予的所有权力。
现行条款届满
我们的董事和高级管理人员在其办公室任职的期间,以及每位董事任期届满的日期,见上文“— A.董事和高级管理人员”下的表格。
董事会各委员会
董事会下设审计委员会、任命和薪酬委员会以及可持续发展委员会。以下是这类委员会的简要介绍。
审计委员会
董事会根据《公司章程》第二十四条之二、第二十四条之三及《董事会章程》第十四条的规定设立审计委员会。
145
适用于审核委员会的条例载于上述条文,以及审核委员会章程,于2008年12月9日获董事会及审核委员会批准,最近于2024年4月作出修订,以使其内容适应《上市公司良好管治守则》的现行建议。就收购Talecris Biotherapeutics而言,在2011年5月24日举行的董事会会议上,修订了《公司章程》和《董事会条例》,以符合纳斯达克上市规则,并促进我们的B类ADS在纳斯达克上市。此外,审计委员会的章程在2015年3月31日举行的委员会会议上进行了修改,以使其适应第31/2014号法律规定的要求。2017年,修订了《公司章程》关于审计委员会组成和职能的第24条之三和《董事会条例》第14条,以使其内容与现行有效的《西班牙审计法》引入的《西班牙公司法》最新修正案相适应。2024年5月3日,董事会决议修订《董事会条例》第14条,规定审计师的最长聘用期(包括任何延期),确保该期限短于任何特定时间设定的最长法定期限,以保障审计师的独立性。
根据我们的西班牙公司治理要求以及我们的公司章程和董事会条例,审计委员会由最少三名董事和最多五名董事组成,他们由董事会根据这些董事在会计、审计和风险管理事项(财务和非财务)方面的知识、能力和经验任命。审计委员会的所有成员必须是非执行董事,且大多数必须是独立董事。作为一个群体,委员会成员必须具备与公司活动部门相关的相关技术知识。此外,审计委员会的所有成员,包括主席,都必须符合《交易法》和《纳斯达克上市规则》规定的独立性、经验和其他要求。
审计委员会的职责包括:
| ● | 就审计委员会负责的事项向股东大会报告; |
| ● | 向董事会建议外部审计师的甄选、任命、重选、聘用和更换,无论股东大会和董事会在根据西班牙法律批准此类决议方面拥有何种职权; |
| ● | 对我们内部审计部门的监督,包括选择、任命和解雇其经理,监督其预算,定期接收有关部门活动的信息并确保管理层考虑到部门报告的结论和建议; |
| ● | 建立和监督有关会计、内部控制或审计事项的投诉的接收、保留和处理程序,以及雇员和与Grifols有关的其他人对可疑会计或审计事项的关注的保密和匿名提交; |
| ● | 对财务和非财务信息的收集过程及相关内部控制制度进行监督;审查应提交证券监管部门的财务报表和定期财务报表并确保遵循适当的会计准则;就会计准则的任何变更以及表内和表外风险向董事会报告; |
| ● | 监督和评估我们的内部控制、内部审计和风险控制和管理系统、财务和非财务,包括任何运营、技术、网络安全、法律、社会、环境、政治、声誉或腐败相关风险的效率; |
| ● | 接受审计师提供的包括有关审计师独立性和进行财务报表审计的信息,并每年就审计师的独立性发表书面意见; |
| ● | 确保外部审计师与全体董事会召开年度会议,报告所开展的工作以及我们的会计和风险形势的演变; |
146
| ● | 确保支付给外聘审计员的工作报酬不损害其质量和独立性; |
| ● | 对拟由股东大会或董事会审批的关联交易事项进行报告,并对审批转授权的事项进行内部程序监督; |
| ● | 监督《董事会条例》中规定的与重要股东进行的任何交易;和 |
| ● | (i)确保在与股票市场有关的事项上遵守Grifols的内部行为准则,或股票市场行为准则、Grifols员工行为准则、董事会条例(每份均可在我们的网站www.grifols.com上查阅),以及一般而言,任何其他公司条例,以及(ii)提出任何必要的建议以改进此类条例。 |
审计委员会目前由I ñ igo S á nchez-Asia í n Mardones先生、Montserrat Mu ñ oz Abellana女士和Anne-Catherine Berner女士组成。根据《交易法》要求和纳斯达克上市规则,以及西班牙《公司法》,所有这些都是独立的。Laura de la Cruz Gal á n女士担任审计委员会秘书,非成员,已于2024年4月17日接替Tom á s Dag á先生担任这一职务。
委任及薪酬委员会
董事会根据《公司章程》第二十四条之二、第二十四条之四和《董事会章程》第十五条的规定,设立聘任与薪酬委员会。
适用于委任及薪酬委员会的规例载于上述条文,以及于2024年5月3日获董事会批准的委任及薪酬委员会规例。根据西班牙公司治理要求、《董事会条例》第15条和本委员会条例,任命和薪酬委员会需由三至五名成员组成,所有成员必须为非执行董事,其中至少包括两名独立董事。董事会在2024年5月3日举行的会议上决议批准修订《董事会条例》第15条,目的是将创建能力矩阵和领导董事会及其委员会的年度评估过程纳入委员会的职责范围。此外,它还包括上述评估中要解决的特定要点。
委任及薪酬委员会的职责包括:
| ● | 协助提名董事,包括根据在董事会任职所需的知识、能力和经验水平评估潜在的被提名人; |
| ● | 为董事会中代表性最少的性别制定代表性目标,并制定实现上述目标的指导方针; |
| ● | 就董事会各委员会成员的任命以及应担任董事会秘书和副秘书职务的人员向董事会提出报告和建议; |
| ● | 审查和组织董事会主席和首席执行官有序、有计划的继任工作; |
| ● | 报告首席执行官提出的任何高级管理层成员的任免提案; |
| ● | 对董事会及高级管理人员薪酬方案提出建议; |
| ● | 定期审查高级管理人员的薪酬计划,包括考虑其适当性和绩效; |
147
| ● | 报告董事可能存在利益冲突的交易,并确保潜在的利益冲突不会损害向委员会提供的任何外部建议的独立性;和 |
| ● | 定期审查适用于董事和高级管理人员的薪酬政策,并确保其个人薪酬与支付给其他董事和高级管理人员的薪酬相称。 |
根据外国私营发行人纳斯达克上市规则,我们的任命和薪酬委员会目前由Anne-Catherine Berner女士、Enriqueta Felip Font女士和Susana Gonz á lez Rodr í guez女士担任董事。都是独立的,符合《交易法》要求和纳斯达克上市规则。Nuria Martín Barnés女士担任任命和薪酬委员会秘书,非成员。
可持续发展委员会
董事会在2020年12月11日召开的会议上,决议修订《董事会条例》的若干条款,以使其内容适应CNMV于2020年6月发布的《上市公司良好治理守则》改革的某些建议,并设立了可持续发展委员会。
适用于可持续发展委员会的条例载于《董事会条例》第15条之二,以及董事会于2021年2月19日批准并于2023年2月修订的《可持续发展委员会条例》。根据《董事会条例》第15条之二和《可持续发展委员会条例》,可持续发展委员会须由三至五名成员组成,所有成员必须为非执行董事,其中大多数为独立董事。
可持续发展委员会的职责包括:
| ● | 监测遵守公司内部行为准则和公司治理规则的情况,确保企业文化与其宗旨和价值观保持一致; |
| ● | 监测有关披露经济-金融、非财务和公司信息的一般政策的执行情况,以及与股东和投资者、代理顾问和其他利益相关者的沟通。同样,公司与中小股东的沟通和关联方式也应受到监控; |
| ● | 定期评估公司的公司治理体系以及环境、气候变化和社会政策的有效性,以确认其正在履行其促进公司利益的使命,并酌情迎合剩余利益相关者的合法利益; |
| ● | 确保公司的环境、气候变化和社会实践符合既定战略和政策;和 |
| ● | 监测和评估公司与其利益相关者群体的互动。 |
可持续发展委员会目前由Anne-Catherine Berner女士、Montserrat Mu ñ oz Abellana女士和Enriqueta Felip Font女士组成。都是独立的,符合《交易法》要求和纳斯达克上市规则。Nuria Martín Barnés女士担任可持续发展委员会秘书,非成员。
可持续发展指导委员会是一个多学科、国际化的团队,于2021年创建,由投资者关系和可持续发展部门协调,该部门向可持续发展委员会报告。在其职能中,该委员会促进正在进行的对话,以确定、建立、实施和确认遵守Grifols总计划的目标,并生成和协调非财务和公司可持续发展信息的报告。
148
d. |
员工 |
下表列出截至2024年12月31日、2023年12月31日及2022年12月31日按部门划分的雇员人数:
截至12月31日, |
||||||
部门 |
2024 |
2023 |
2022 |
|||
制造业 |
|
18,774 |
|
18,979 |
|
21,235 |
研发—技术领域 |
|
1,514 |
|
1,255 |
|
1,271 |
行政和其他 |
|
1,673 |
|
1,686 |
|
1,870 |
一般管理 |
|
281 |
|
267 |
|
302 |
市场营销 |
|
184 |
|
155 |
|
167 |
销售和分销 |
|
1,396 |
|
1,395 |
|
1,469 |
合计 |
|
23,822 |
|
23,737 |
|
26,314 |
下表显示截至2024年12月31日、2023年12月31日和2022年12月31日按地理区域分列的雇员人数:
截至12月31日, |
||||||
地理区域 |
|
2024 |
|
2023 |
|
2022 |
西班牙 |
|
4,408 |
|
4,181 |
|
4,224 |
北美洲 |
|
13,771 |
|
14,076 |
|
16,862 |
世界其他地区 |
|
5,643 |
|
5,480 |
|
5,228 |
合计 |
|
23,822 |
|
23,737 |
|
26,314 |
我们积极培训员工。Grifols学院于2011年第二季度在西班牙开业。它是血浆衍生药物制备和生产相关所有工艺进阶培训的交汇点。Grifols学院充当Grifols集团人员的技术、科学和管理培训中心,促进专家和外部机构之间的持续交流,例如专业医疗保健协会、医院、学校和大学。通过Grifols学院,我们向员工提供技术培训和专业发展机会,包括教育费用报销计划、多项长期领导力发展计划以及使用虚拟现实技术进行的入职流程。在过去三年中,我们平均每年有超过12,300名员工参加了Grifols学院的专业发展和血浆增多症培训项目。
2024年,我们向前迈出了重要一步,推出了“Copilot”工具,这是一种可供所有员工使用的生成式AI解决方案。我们举办了关于其功能的交互式网络研讨会,以帮助员工释放其全部潜力。我们还提供灵活、按需学习的选择,使员工能够个性化学习并获得最符合其明确发展目标的资源。
我们促进建立在结社自由和集体谈判权基础上的社会对话,同时考虑到其行动国独特的文化、历史、经济和政治框架。除了培养开放的沟通渠道,我们还根据每个国家的具体情况调整我们的社会对话。这些努力加强了我们的企业文化,并确保员工的需求得到满足。
与工人法律代表的有效沟通对于解决需要在公司各个工作场所进行集体谈判的横向问题至关重要。西班牙劳资关系制度定义了两种类型的公司代表:工会代表和单一或选任代表。我们与这些代表定期举行与工作人员有关的特别会议,这些代表组成工会部门、工作理事会和员工代表团的一部分。我们的西班牙雇员主要由三个工会代表,工人委员会(Commisiones Obreras-CCOO),工人总工会(Uni ó n General de Trabajadores-UGT)和总劳工联合会(Confederaci ó n General del Trabajo-CGT)。
149
在法国、德国等国,我们定期会见工人的法律代表。在意大利,我们与工会组织讨论可能影响集体工作条件的决定。我们完全支持符合《世界人权宣言》的结社和集体谈判的基本权利。在西班牙、德国、意大利、法国、阿根廷和巴西,我们100%的员工根据集体协议工作。他们加在一起占总劳动力的27.9%。由于美国不存在特定行业的协议,因此在公司层面进行集体谈判。
我们投保了一份保单,承保员工因工伤事故导致的死亡或永久伤残。我们所有的员工都在这项政策的保障范围内。我们从2002年1月1日开始为我们所有的西班牙实体实施了一项固定缴款养老金计划,该计划不包括最高管理层,这要求我们向这些员工支付匹配的款项。截至2024年12月31日止年度,我们对该养老金计划的缴款为130万欧元,而截至2023年12月31日和2022年12月31日止年度,我们的缴款分别为110万欧元和100万欧元。我们还赞助了一项有利于美国雇员的储蓄计划,该计划符合经修订的1986年《国内税收法》第401(a)条规定的固定缴款计划。我们为该节约计划提供了完全归属的配套捐款,截至2024年12月31日止年度的总额为3360万美元,而截至2023年12月31日和2022年12月31日止年度的总额分别为3340万美元和3410万美元。对于德国的某些雇员,我们有一个固定福利养老金计划,这是成文法要求的。与该计划相关的养老金成本并不重要。
e. |
股份所有权 |
有关截至2024年12月31日我们现任董事和执行官就我们的A类股份直接、间接和代表持股的信息,请参阅本第一部分第7项,“主要股东和关联交易—— A.主要股东。”
2022年3月,我们制定了一项限制性股票计划(“RSU”),根据该计划,符合条件的员工有权在B类股票或B类ADS中获得高达50%的年度奖金,我们为此在RSU中额外贡献50%。根据本计划交付的B类股份或ADS在员工奖金授予日进行估值。受限制股份单位的归属期为两年零一天,之后可将受限制股份单位交换为B类股份或ADS。如果符合条件的员工在归属期之前离开公司或被解雇,他/她将无权获得额外的RSU。截至2024年12月31日,我们结算了金额为1760万欧元的2022年RSU计划(截至2023年12月31日为330万欧元,对应2020年RSU计划)。该承诺被视为以股权结算,截至2024年12月31日没有确认累计金额(截至2023年12月31日为830万欧元)。
2023年,我们的董事会对我们的薪酬政策进行了修改,包括终止在RSU中部分支付可变薪酬。相反,我们的董事会创建了两个新的可变薪酬计划,如下所述。有关我们的薪酬政策的更多详细信息,请参阅“— B.补偿。”有关我们可变薪酬计划的更多信息,请参阅本年度报告中包含的我们经审计的综合财务报表附注29(c)。
2024年,我们的董事会对我们的薪酬政策进行了修改,以便使这种政策适应董事会目前的情况。有关我们的薪酬政策的更多详细信息,请参阅“— B.补偿。”有关我们的可变薪酬计划的更多信息,请参阅本年度报告中包含的我们经审计的综合财务报表附注29(c)。
150
以权益结算的股份支付方案
2023年,我们批准了一项针对某些执行董事、GRIFOLS, S.A.的高级管理人员以及我们的子公司的为期四年的长期激励计划。根据该计划,这些个人有权获得一定数量的期权,代表有权以每股8.96欧元的行权价收购某些A类股票。在授出的期权中,40%将于计划两周年归属,其余60%将于计划四周年归属,在每种情况下均须遵守若干归属条件。根据以权益结算的股份支付计划,将授出最多400万份股票期权,代表收购400万股A类股份的权利。截至2024年12月31日,已确认的权益金额等于560万欧元(截至2023年12月31日为260万欧元)。
以现金结算的股份支付方案
2023年5月,我们的董事会批准了一项针对我们管理团队某些成员的四年长期激励计划。该计划基于限制性股票单位(RSU)的授予,其中50%将在计划两周年时归属,其余50%将在计划第四年末归属。根据本计划授出的受限制股份单位将以现金结算,金额相当于结算日前五个营业日A类股份的平均价格。截至2024年12月31日,累计总额为290万欧元。其中,210万欧元在标题“贸易债权人和其他应付账款”中为短期(截至2023年12月31日为170万欧元),80万欧元在标题“准备金”中为长期(截至2023年12月31日未计入金额)。截至2024年12月31日在综合损益表中确认的金额为120万欧元(2023年为170万欧元)。
针对管理层的保真计划
2024年,我们与某些高管签订了协议,确立了长期的股权激励或现金激励,作为我们薪酬体系的一部分。在股份转让的情况下,我们将在周年日或相关期间结束时以同等条件授予这些激励,前提是每个此类受益人必须一直受雇于Grifols直到结算日期。截至2024年12月31日,我们确认了110万欧元的权益金额。
前执行主席股份支付计划
2023年6月,我们的股东批准了我们的前执行主席Thomas Glanzmann先生的长期可变薪酬。根据该计划,他获得了70万份股票期权,代表有权以股东在该股东大会上确定的行权价收购70万股A类股票。股票期权将在授予日的第二个周年日归属,前提是Thomas Glanzmann先生通过由董事会以及任命和薪酬委员会进行的绩效评估。
该计划旨在奖励执行我们的运营改进计划所需的努力。它授予了2023年作出的70万股A类股的一次性基准奖励。
f. |
披露注册人为追回错误授予的赔偿而采取的行动。 |
2024年没有向我们的执行官支付错误的赔偿金。任命和薪酬委员会根据2024年财务报表的重述审查了薪酬追回政策的适用性。委员会最终认定,追回条款不适用于这些重述,因为它们不是任何执行董事的欺诈、故意不当行为或重大疏忽的结果。重述源于技术性会计调整和对适用会计准则的修订解释,而不是重大错报或财务操纵。
此外,董事会根据任命和薪酬委员会的建议,确认没有根据需要更正的不准确财务数据授予基于激励的薪酬。虽然我们针对高级管理人员追回错误奖励薪酬的追回政策在未来情况下仍然完全可以执行,但任命和薪酬委员会得出结论认为,将其应用于2024年财务重述将是不合适的,也没有法律上的合理性。
151
项目七、主要股东及关联方交易
a. |
主要股东 |
下表列出了某些信息,包括截至本年度报告日期我们A类(有投票权)股份的实益所有权的信息,适用于(i)我们的主要股东,包括根据适用的西班牙法规,我们已知的每个人或实体是我们A类股份3%以上的实益拥有人或我们A类股份1%的实益拥有人,如果一个人或实体的住所在避税天堂,(ii)我们的每个董事和(iii)我们的高级管理层的每个成员。
由于我们的A类股份是通过账簿分录表示的,因此无法知道其确切的所有权结构,除非通过股东自愿或遵守适用法规提供的信息,以及股份结算和清算所在的Sociedad de Gesti ó n de los Sistemas de Registro、Compensaci ó n y Liquidaci ó n de Valores,S.A.或Iberclear及其参与实体(entidades participantes)提供的信息。
受益所有权根据适用的西班牙法规确定。
|
数量 |
|
百分比 |
|
|
投票 |
投票 |
|
|||
实益拥有人名称 |
股份 |
权利 |
|
||
主要股东 |
|
|
|
|
|
Deria S.A。(1) |
39,183,692 |
|
9.195 |
% |
|
Scranton Enterprises B.V。(2) |
35,812,622 |
|
8.404 |
% |
|
Ponder Trade,S.L。 |
30,209,093 |
|
7.089 |
% |
|
Ralledor Holding Spain S.L。 |
26,224,374 |
6.154 |
% |
||
贝莱德集团公司(3) |
17,631,315 |
|
4.137 |
% |
|
Rokos Global Macro Master Fund LP(4) |
4,843,786 |
|
1.137 |
% |
|
平足有限责任公司(5) |
13,335,000 |
|
3.129 |
% |
|
Mason Capital Master Fund L.P。(6) |
13,525,737 |
3.174 |
% |
||
停战资本大师基金有限公司 |
4,534,850 |
1.064 |
% |
||
Melqart Opportunities Master Fund LTD(7) |
4,549,091 |
1.068 |
% |
||
摩根大通公司。(8) |
13,059,573 |
3.065 |
% |
||
董事 |
|
|
|
|
|
Thomas H. Glanzmann(9) |
230,500 |
* |
|||
José Ignacio(Nacho)Abia Buenache |
107,807 |
|
* |
||
Tomás Dagá Gelabert(10) |
303,661 |
|
* |
||
V í ctor Grifols Deu(11) |
107,834 |
|
* |
||
Raimon Grifols Roura |
49,118 |
|
* |
||
阿尔伯特·格里福尔斯昏迷-克罗斯 |
66,000 |
|
* |
||
高级管理人员 |
|
|
|
|
|
David Ian Bell |
20,000 |
|
* |
||
José Ignacio(Nacho)Abia Buenache |
107,807 |
|
* |
||
乔迪·巴尔塞尔·瓦尔斯 |
806 |
|
* |
||
拉胡尔·斯里尼瓦桑 |
10,250 |
* |
* |
不到1%。 |
(1) |
Grifols Roura家族成员通过Deria S.A.间接持有各自的股份。 |
(2) |
我们的某些董事拥有股份的Scranton Enterprises B.V.。Grifols家族的一些董事或执行官成员通过Scranton Enterprises B.V.间接持有其部分股份,见“— B.关联交易。” |
(3) |
在17,631,315个投票权总数中,14,340,268个投票权由BlackRock Inc.通过对A类股份的权利间接持有;3,291,047个通过金融工具(出借证券)持有。 |
(4) |
4,843,786个表决权通过股权置换持有。 |
(5) |
这13,335,000个投票权由Marc Andersen通过Marc P Andersen 2016 Irr Trust控制,后者控制着Flat Footed LLC。 |
(6) |
这13,525,737个投票权由Mason Capital Management LLC间接持有。 |
(7) |
在4,549,091个投票权总数中,通过差价合约(CFD)持有4,170,656个投票权,通过看跌期权持有378,435个。 |
152
(8) |
在13,059,573个表决权总数中,间接持有1.465.990个表决权,通过第三方存托凭证(持有的使用权)持有12.676个表决权,通过股权置换持有11,580,907个表决权。 |
(9) |
24,000股A类股通过Glanzmann Enterprises AG间接持有。 |
(10) |
在归属于Tomás Dagá Gelabert先生的303,661股有表决权的股份总数中,35,000股通过Prismiberica,S.A.间接持有。 |
(11) |
在归属于Victor Grifols Deu先生的107,834股有表决权的股份总数中,93,214股通过New Fiction 2012,S.L.间接持有。 |
据我们所知,我们不受任何其他公司、政府或任何其他自然人或法人的直接或间接控制。我们不知道有任何安排会导致我们的控制权发生变化。
截至20-F表格的本年度报告日期,根据我们的上市代理提供给我们的公开信息,我们估计32.5%的股份由美国的记录持有人持有。由于股份可能由被提名人持有,登记在册的股东人数可能无法代表实益拥有人的人数。
所有权发生重大变化
除下述情况外,自2022年1月1日起至本备案之日,未发生重大变化,因为此类股份转让已向CNMV报告:2
| ● | 2022年2月,Capital Research and Management Company达成5.659%的持股,并于2024年3月将持股比例降至5%以下。截至本年度报告日期,据我们所知Capital Research and Management Company持有我们的有表决权股份比例低于3%。 |
| ● | JP Morgan Chase & Co于2024年3月达成5.185%的持股协议,并于2024年7月将持股比例降至5%以下。截至本年度报告之日,据我们所知,摩根大通公司持有我们的有表决权股份不到3%。 |
| ● | 2024年,高盛公司对我们的A类股票进行了几次交易,在2024年5月达到了最高6.442%的持股比例。这一仓位在2024年6月降至0.170%。截至本年度报告之日,据我们所知,高盛公司持有的有表决权股份低于3%。 |
投票权
我们的每一股A类股份都有权投一票,但我们或我们的任何直接子公司以库存方式持有的A类股份的投票权被暂停。我们的主要股东、董事或高级管理人员持有的A类股份不赋予这些股东不同的投票权。
我们B类股的持有人通常没有投票权,但某些特殊事项需要获得我们已发行B类股的多数批准的情况除外。然而,我们的每一股B类股票都使其持有人有权在每一财政年度结束时从已发行股票的可分配利润中获得至少相当于每股B类股票0.01欧元的年度优先股股息。在任何给定的财政年度,我们将向我们的B类股票持有人支付优先股息,然后再从该财政年度的可分配利润中向我们的A类股票持有人支付任何股息。
有关我们的A类股和B类股的进一步详情,请参阅本第一部分第10项,“附加资料— B.组织章程大纲和细则—股东权利— B类股——在股东大会上就特别事项进行单独表决”和“附加资料— B.组织章程大纲和细则—股东权利”。
b. |
关联交易 |
我们不时与关联方进行公平交易,包括与涉及我们董事会某些成员或高级管理层的实体进行交易。我们制定了政策,以确保这些交易以透明的方式进行,并符合适用的法规和良好的公司治理实践。
关联交易政策与利益冲突政策
2024年5月3日,我们采用了新的关联交易政策(“RPT政策”),并于2024年10月22日采用了新的利益冲突政策。
153
我们的RPT政策为分析、批准和公布与关联方的交易建立了严格的流程,所有这些流程均按照适用法律进行。我们的利益冲突政策是对RPT政策的补充,它要求人员及时向内部审计部门或监察员披露任何真实的、潜在的或感知到的冲突,并为持续合规规定了年度申报。这些政策的全部内容,我们的网站都有提供。此外,有关我们的关联方交易的更多详细信息,请参阅本年度报告中包含的我们经审计的综合财务报表附注31。以下是我们自2022年1月1日以来订立的重大关联方交易的说明。
Haema GmbH(前称Haema AG)、BPC Plasma Inc(前称Biotest US Corporation)和Scranton Enterprises B.V.及其各自子公司的交易
出售实体予Scranton Plasma B.V.、卖方贷款予Scranton Plasma B.V.及认购期权协议
2018年12月28日,我们将Haema GmbH和BPC Plasma Inc各自的100%股权出售给Scranton Plasma B.V.,后者是我们的主要股东之一、关联方Scranton Enterprises B.V.的子公司,总价为5.38亿美元。Scranton Plasma B.V.通过本金3.6亿美元的贷款(“收购融资”)为此次收购提供资金。该交易的贷方要求GWWO向Scranton Plasma B.V.提供供应商贷款,最高金额为1.5亿美元。初始本金金额相当于9500万美元,到期日为2025年12月28日,利率为欧元同业拆借利率加200个基点。2023年,GWWO根据供应商贷款的相同条款和条件,向Scranton Plasma B.V.额外贷款1500万欧元。截至20-F表格年度报告之日,供应商贷款未偿还的欧元等值为1.319亿美元,这也是自2022年1月1日以来未偿还的最大金额。见本年度报告所载经审计综合财务报表附注11(b)。
同样在2018年12月28日,我们与Scranton Plasma B.V.签订了看涨期权协议,据此我们可以随时回购Haema GmbH和BPC Plasma Inc的股份。协议中规定的期权的行使价格将等于以下两者中的较大者:(i)向Scranton Plasma B.V.出售股份的相同价格,加上与交易相关的费用和从出售(2018年12月28日)到行使期权期间净营运资本的增加,以及(ii)偿还收购融资所需的金额,即4.25亿美元加上应计利息和注销此类债务所需的任何其他金额。
尽管我们目前没有持有Haema GmbH或BPC Plasma Inc的任何股权,但我们保留对这些实体的控制权,原因包括:(其中包括)(1)重新收购其股份的看涨期权协议以及行使该看涨期权的财务能力,(2)从看涨期权中获得的潜在投票权,(3)我们根据下文所述的血浆供应协议收购Haema GmbH和BPC Plasma Inc拥有的血浆采集中心收集的所有血浆,以及(4)根据管理协议管理这些实体的能力。由于这些因素,根据IFRS 10,我们在财务报表中全面合并了Grifols子公司等实体。有关更多详情,请参阅附注19以及本年度报告所载的经审核综合财务报表。
2024年7月,Scranton与Oaktree控制或管理的基金订立贷款协议(“贷款协议”),为收购融资再融资。这笔新融资得益于以下担保和担保权益:(i)BPC Plasma Inc和Haema GmbH的担保,(ii)对Haema GmbH和BPC Plasma Inc的股份的质押,以及(iii)对BPC Plasma Inc和Haema GmbH的资产的质押。
如果斯克兰顿在这笔新债务下发生违约,我们将有权在收到违约通知后的90天内对两家公司行使回购选择权。如果我们未能在该时间范围内行使这一选择权,我们将失去回购Haema GmbH和BPC Plasma Inc.股票的权利。截至2024年12月31日,新贷款项下没有违约报告。
154
GWWO向Scranton Plasma B.V.的等离子供应协议和预付款
于2018年12月28日,我们的附属公司GWWO、Biotest Pharmaceuticals Corporation(“BPCorp”)(其为BPC Plasma Inc、Haema GmbH及GRIFOLS, S.A.的附属公司)订立血浆供应协议,据此,GWWO同意收购从BPCorp及Haema GmbH拥有的约60个血浆采集中心收集的所有血浆。GRIFOLS, S.A.为血浆供应协议项下的所有GWWO义务提供担保,该协议于2019年1月1日延长了30年。
GWWO为根据血浆供应协议获得的血浆支付的价格是根据生产的全部成本确定的,加上固定的保证金,存在销售的排他性。根据某些条件和程序,该协议还授予BPCorp和Haema GmbH就未来交付的血浆提前收到GWWO付款的权利。截至本年度报告之日,GWWO根据《血浆供应协议》为未来交付血浆的预付款余额为1100万欧元。2024年期间,预付款的最高余额达4600万欧元。
BPC Plasma Inc、Haema GmbH和Scranton Plasma B.V.之间的现金池融资协议
2019年2月,Haema GmbH和BPC Plasma Inc与Scranton Plasma B.V.签订现金池融资协议,到期日为2027年。根据该协议,Haema GmbH和BPC Plasma Inc不时向其母公司Scranton Plasma B.V.转移资金,其中预付款可由Scranton Plasma B.V.抵销Haema GmbH和BPC Plasma Inc.不时分配的上游股息。截至2024年12月31日和2023年12月31日,本现金池协议项下的预付款余额分别为8230万欧元和1.012亿欧元。2024年和2023年,BPC Plasma Inc.向Scranton Plasma B.V.分配了没有现金流出的股息,金额分别为3950万欧元和2.664亿欧元,对应于BPC Plasma Inc前四个财年的业绩。2024年期间,这一现金池协议下的最高余额达1.36亿欧元。
收购Haema Plasma KFT。
2024年10月31日,通过我们的子公司GWWO,我们从Scranton Plasma,B.V.(我们的主要股东之一)收购了Haema Plasma KFT. 100%的资本,金额为3500万欧元。这一收购得到了独立专家出具的公平意见的支持。
2021年,我们与Scranton Plasma B.V.签订了看涨期权协议,据此我们有权收购Haema Plasma KFT的股份。同样在2021年,我们的子公司GWWO与Haema Plasma KFT签订了现金池融资协议。根据该协议,GWWO不时将资源垫付给一个集中的财务机制,以便为Haema Plasma KFT提供现金可用性。自2022年以来,关于Haema Plasma KFT的财务信息一直是我们合并财务报表的一部分,该交易已在我们的合并资产负债表下报告。鉴于我们在收购之前已经对Haema Plasma KFT行使了控制权,该交易对我们2024年的合并损益表没有影响。
见本年度报告所载截至2024年12月31日止年度的合并财务报表附注3(e)和31。
我们的子公司Instituto Grifols S.A.发行的本票。
Instituto Grifols S.A.自1987年以来一直每年发行不记名本票,为Grifols集团提供额外的营运资金和流动性。承兑票据为不可转让证券,在票据赎回日期之前不得转让给第三方(除由Instituto GRIFOLS, S.A.本身进行后续赎回外)。根据西班牙法律,发行期票不被视为公开发行用于认购证券,也不需要CNMV进行验证。截至2024年、2023年和2022年12月31日,我们关联方拥有的本票未偿余额分别为910万欧元、1770万欧元和1500万欧元。这些金额也是整个2024年、2023年和2022年的最高未偿余额(如适用)。
155
这些不记名本票期限为一年,每张面值为3000欧元。Instituto GRIFOLS, S.A.在每年5月4日到期时赎回所有未偿还的承兑票据,无论此类票据的购买日期如何。期票的利率是根据Grifols集团债务的加权平均成本确定的。将于2025年5月4日到期的票据的年利率为5.0%。见本年度报告所载我们的综合经审计财务报表附注21。
与Centuri ó n Real Estate S.A.U.的交易
我们与Centuri ó n Real Estate S.A.U.签订了多项租赁协议,据此我们支付了位于西班牙巴塞罗那Sant Cugat del Vall è s的某些房地产的使用权,我们将其用作办公楼,包括我们的西班牙总部。Centuri ó n Real Estate S.A.U.的唯一股东是Scranton Enterprises B.V.,我们的主要股东之一。这些租赁协议是按公平原则订立的。在截至2024年、2023年和2022年12月31日的年度,我们分别向Centuri ó n Real Estate S.A.U.支付了710万欧元、720万欧元和630万欧元的金额。这些租赁协议将于2045年3月1日到期。
与Marca Grifols,S.L.的许可协议
我们于1993年1月26日与Marca Grifols,S.L.签订了许可协议,授予我们使用“Grifols”商标99年的独家权利。许可协议规定,我们必须为许可支付年度特许权使用费,这是基于通货膨胀和我们的净销售额。该协议的最新更新将佣金定为Grifols综合销售额的0.1%。这项许可的费用在2024年、2023年和2022年分别为770万欧元、750万欧元和660万欧元。2024年12月23日,在由GRIFOLS, S.A.先生代表出席我局董事会的TERM1的重要股东Ralledor Holding Spain,S.L.收购Marca Grifols,S.L. 33%的股权后,Marca Grifols成为了GRIFOLS, S.A.的关联方。
与Club Joventut Badalona,S.A.D.的广告协议
2021年5月25日,我们与Club Joventut Badalona,S.A.D.订立广告协议,该实体是Scranton Enterprises B.V.(我们的主要股东之一)的重要股东。根据这份协议,我们向俱乐部支付年费,以换取我们品牌的曝光。我们在截至2024年12月31日、2023年和2022年12月31日的每一年就本协议支付了30万欧元。
慈善捐款
2024年,我们向由我们组建的V í ctor Grifols i Lucas基金会、J.A. Grifols基金会和Probitas私人基金会这三个慈善基金会捐款,我们的某些现任管理人员和董事担任Probitas私人基金会的赞助人。
V í ctor Grifols i Lucas基金会为进一步研究生物伦理学提供资助。它创建于1998年,其使命是通过一系列领域的专家之间的对话来促进生物伦理。V í ctor Grifols i Lucas基金会寻求在活跃于人类健康领域的组织、公司和个人中培养道德态度,提供了一个讨论平台,为不同观点的交流提供了一个论坛。V í ctor Grifols i Lucas先生是我们的前任首席执行官,是执行董事Raimon Grifols Roura先生和我们的董事会名誉主席(非成员)Victor Grifols Roura先生的父亲。截至2024年12月31日、2023年和2022年12月31日,我们分别向V í ctor Grifols i Lucas基金会捐款50万欧元、40万欧元和50万欧元。
J.A. Grifols基金会为旨在满足我们血浆采集中心所在社区需求的公民、社会、环境或教育项目提供支持,以此作为加强社区联系的一种手段。它成立于2008年,其使命是为血浆捐献者及其居住社区的健康和福祉做出贡献。在截至2024年、2023年和2022年12月31日的年度,我们分别向J.A. Grifols基金会捐款50万欧元、40万欧元和40万欧元。
156
Probitas私人基金会向缺乏医疗和卫生资源或因灾难而对这类服务有迫切和必要需求的国际社会提供医疗和卫生援助。Probitas私人基金会由我们于2008年创立。我们的董事之一Tomás Dagá Gelabert先生在2021年5月27日之前是Probitas私人基金会的赞助人。截至2024年、2023年和2022年,我们分别向Probitas私人基金会捐款340万欧元、130万欧元和340万欧元。
贷款
除本节上文另有说明外,我们没有向董事会成员或关键管理人员提供任何垫款或贷款,也没有代表他们承担任何担保承诺。我们也没有代表董事会前任或现任成员或关键管理人员承担任何养老金或人寿保险义务。
c. |
专家和法律顾问的利益 |
不适用。
项目8.财务信息
a. |
合并报表和其他财务信息 |
财务报表
请参阅本年度报告第F-1页开始的表格20-F中我们的经审计综合财务报表和相关附注。
法律程序
我们在日常业务过程中涉及各种法律诉讼。如果这些诉讼出现不利结果,我们认为由此产生的负债要么由保险承保,要么不会对我们的财务状况或经营业绩产生重大不利影响。
OFAC要求提供解释性指导
我们的子公司Biotest AG与五个不同的伊朗实体签订了产品供应协议,据此,伊朗实体将在伊朗收集的血浆送至Biotest AG进行处理。Biotest AG随后使用血浆为伊朗实体制造医药产品,包括IG产品、白蛋白、VIII因子和IX因子。这些产品供应协议是Biotest AG在我们于2022年收购该公司之前签订的。见第一部分第5项,“经营和财务审查与前景—— A.经营成果——影响我们财务状况和经营成果的因素——收购—— Biotest AG收购。”
2023年2月21日,Grifols根据《伊朗交易和制裁条例》(“ITSR”)向美国外国资产管制办公室(“OFAC”)许可证司提出了解释性指导或许可授权请求,该条例限制了与伊朗及其政府实体的商业互动,并规定了在不遵守的情况下进行制裁。Grifols在提交的文件中声称,ITSR不应适用于本案,但如果OFAC另有决定,OFAC应授权颁发许可证,允许Biotest AG目前基于人道主义理由开展涉及伊朗的活动。截至20-F表格的本年度报告日期,我们尚未收到OFAC许可部门的回复。
我们无法向您保证,OFAC将同意我们的断言,即ITSR不应申请或将颁发所要求的许可证。在这种情况下,我们将不得不终止Biotest AG在伊朗的活动,并可能受到处罚。终止Biotest AG在伊朗的活动不会对我们的运营或财务状况产生重大不利影响。
157
未支付的特许权使用费纠纷
GDS、GWWO、雅培或Abbott,以及Novartis Vaccines and Diagnostics,Inc.就Abbot根据日期为2019年8月16日的HIV许可和选择权协议(“HIV许可”)向GDS和Ortho支付的未付特许权使用费存在争议。2019年9月12日,GDS与Ortho向美国伊利诺伊州北区地方法院提交了仲裁通知。2019年10月3日,雅培终止HIV许可并申请宣告性救济,寻求使许可专利无效。GDS提出了驳回和强制仲裁的动议,但法院继续所有未决动议,并将各方提交给地方法官召开强制和解会议。2020年2月5日,双方出席了由地区法官下令举行的强制性和解会议,由地方法官主持。没有达成令人满意的解决方案。2020年3月16日,GDS与Ortho就诉讼事项进行了答辩和反诉,同时就Abbot所欠的终止前款项进行仲裁。仲裁聆讯时间为2020年6月15日-16日,仲裁员判给GDS/Ortho 400万美元。法庭诉讼仍在继续。阿博特的解雇动议于2020年12月1日被否决。事实发现于2021年10月25日结束。Expert Discovery于2022年10月14日得出结论,双方提出了处置性动议,包括Abbott提出的即决判决动议和GDS提出的异议。法院相关部分驳回了雅培的即决判决动议。GDS和Ortho争辩说该专利是有效的,他们认为雅培的声明性救济行动将是不成功的。2024年1月31日召开调解会,未果。2025年3月,双方同意以条款解决争端。这些条款包括,除其他条款外,与Grifols的财务和解、在有损于Abbott的无效主张的情况下解雇以及Grifols的侵权反诉。
有关我们所涉及的法律诉讼的更多信息,请参阅本年度报告中包含的我们的年度综合财务报表附注29(f)。
Biotest Pharmaceuticals Corporation收购的反垄断批准
2018年8月,FTC发布同意令,允许收购24个捐赠中心,并要求将三个中心剥离给Kedrion。同意令要求向FTC提交年度报告,期限为10年。自我们完成收购以来,我们已经提交了每一份年度合规报告,FTC没有采取进一步行动。
CFIUS对某些交易的批准
2019年9月,由于我们与上海RAAS签订了股份交换协议,Grifols和美国外国投资委员会(“CFIUS”)签订了国家安全协议,以确保保护按要求从在美国收集并保存在捐赠者管理系统(“DMS”)中的人类来源血浆的捐赠者处获得的某些数据,并且根据该协议,我们有义务向CFIUS提交两年一次的合规报告。最近一次报告于2025年2月4日提交并被受理,下一次报告将于2025年8月提交。
CNMV执行委员会。
2024年9月25日,CNMV执行委员会就CNMV于2024年3月21日达成的结论启动了行政处罚程序,该结论与CNMV在2024年发布的卖空报告后进行的调查有关。就结论和补充信息中提到的事件对Grifols的拟议制裁不超过100万欧元。由于涉及金额,我们不认为这一程序材料,因为它不会对我们的财务和经营业绩产生任何影响。2024年11月7日,我们提交了针对行政处罚程序的辩护指控。见第一部分第5项,“经营和财务回顾与前景—— A.经营成果——影响我们财务状况的因素和卖空者报告。”
158
股息政策
A类股
我们的股息政策是派发约40%的综合净利润。然而,第一留置权信贷便利和管理我们的财务债务的一些其他文件包含对我们在日常业务过程中根据我们的股息政策支付现金股息的能力的限制,具体取决于我们的债务水平和某些限制性支付篮子的可用性。有关第一留置权信贷便利的条款和我们的其他融资安排的进一步讨论,请参阅本第一部分的项目5,“运营和财务审查与前景—— B.流动性和资本资源——信贷来源”,无论如何,由于我们承诺降低债务水平,我们预计在债务杠杆低于4.00:1.00之前不会追求任何现金股息的分配。
董事会每年根据对我们的资产负债表和现金流、流动资产与流动负债的比率、我们的预期资本和流动性要求、我们的管理文件的规定以及我们的融资安排中关于现金股息的规定的审查,对股息的宣布和支付进行审查。未来股息的支付将由董事会根据上述因素以及在考虑宣布股息时其认为相关的其他因素决定。无法保证未来是否或以何种金额支付任何股息。
此外,可用于分配的储备的可用性受到西班牙法律的限制。我们和我们的西班牙子公司的可分配储备受到强制性储备金额的限制,其中包括,对我们和我们的每个西班牙子公司而言,法定储备和有待由我们和我们的每个西班牙子公司摊销的资本化研究和开发金额。截至2024年12月31日,由于资本化的研究和开发支出,对可分配储备的这一限制在综合基础上达到了2390万欧元。
2024年期间,不派发股息。如上文所述,董事会并未建议在即将举行的股东周年大会上就截至2024年12月31日止年度向股东派发股息。
B类股
如果优先股股息总额不超过该年度的可分配利润,且股息的分配已获得我们的股东批准,则每份B类股有权从该股已发行的每个财政年度结束时的可分配利润中获得至少相当于每B类股0.01欧元的年度优先股股息。在任何特定财政年度,我们将向B类股持有人支付优先股息,然后再从该财政年度的可分配利润中向A类股持有人支付任何股息。所有已发行B类股的优先股息将由我们在该财政年度结束后的九个月内支付,金额不超过该财政年度获得的可分配利润。2024年,不派发股息。
b. |
重大变化 |
见第一部分第5项,“经营和财务回顾与展望—— A.经营成果——后续事件。”
159
项目9.要约及上市
a. |
要约及上市详情 |
自我们于2006年5月17日完成首次公开募股以来,我们的A类股票已在西班牙证券交易所上市,并在西班牙自动报价系统中以股票代码“GRF”进行报价。
我们的B类股票自2011年6月2日起在西班牙证券交易所上市,并在西班牙自动报价系统报价,股票代码为“GRF.P”。
我们的A类ADS没有在全国交易所上市,自2009年7月以来一直在场外交易公告板上交易,这是一种由纳斯达克提供的电子股票上市服务。
我司B类ADS自2011年6月2日起在纳斯达克全球精选市场上市交易,代码为“GRFS”。每份B类ADS代表一份B类份额。
b. |
分配计划 |
不适用
c. |
市场 |
我们的A类股票自2006年5月17日起在西班牙证券交易所上市,并在西班牙自动报价系统报价,股票代码为“GRF”。我们的B类股票作为收购Talecris的部分对价发行,于2011年6月2日在西班牙证券交易所上市,并在西班牙自动报价系统报价,股票代码为“GRF.P”。
我们的B类ADS自2011年6月2日起在纳斯达克全球精选市场上市交易,代码为“GFRS”。
西班牙证券市场
西班牙证券交易所由位于马德里、巴塞罗那、毕尔巴鄂和巴伦西亚的四家证券交易所组成。在它们上进行的大部分交易都是通过西班牙自动报价系统完成的。2024年期间,西班牙自动报价系统占西班牙证券交易所股票证券总交易量的大部分。
西班牙自动报价系统
西班牙自动报价系统于1989年推出,连接西班牙证券交易所,为在其上上市的证券提供统一的连续市场,消除了西班牙证券交易所之间的大部分差异。
该系统的主要特点是在输入订单时对买卖订单进行计算机化匹配。每笔订单在输入匹配订单后立即执行,但可以修改或取消,直到执行。投资者和经纪商可以持续监测市场的活跃程度。西班牙自动报价系统由Sociedad de Bolsas运营和监管,该公司由管理西班牙证券交易所的公司所有。西班牙自动报价系统上的所有交易必须通过银行、经纪公司、官方股票经纪人或当地交易所的交易商公司成员直接进行。
每个交易日的CET时间为上午8:30至9:00(UTC + 1),有一场开盘前竞价活动,在此期间下单。电脑化交易时间(开放时段)为上午9:00至下午5:30 CET(UTC + 1),进行连续交易。每节课以5分钟的竞价结束,时间为下午5:30至5:35。CET(UTC + 1),随机结束时间为30秒。每次拍卖产生的价格为该时段的收盘价。
160
2021年3月29日,有关西班牙自动报价系统功能的新规则开始生效,该系统除其他外,对股票价格的最大价格波动进行了监管。在新的规则下,连续市场中的每只股票都被赋予了一个静态和动态的范围,在这个范围内价格可以波动。股票的价格可能会以高于或低于其开盘价(即上一交易日的收盘价)的静态区间(这是公开的,根据股票的平均历史价格波动率计算)上涨或下跌。当股票交易超出该区间时,股票暂停交易五分钟,在此期间进行竞价交易。本次拍卖后,股票价格可再次以高于或低于其上次拍卖价格(在触发再次拍卖前将被视为新的静态价格)的静态幅度上涨或下跌。此外,股票的价格不能上涨或下跌超过其动态价格范围(这是公开的,根据股票的日内平均波动率计算),从它交易的最后一个价格开始。如果价格变化超过股票的动态范围,则触发五分钟竞价。
此外,还有一个大宗市场(el mercado de bloques),允许买卖双方在交易时段的上午9:00至下午5:30之间进行大宗交易。CET(UTC + 1)。在一定条件下,这个市场允许以不同于现行市场价格的价格进行交易的交叉交易。大宗市场的交易在价格偏离和成交量方面受到一定的限制。
在下午5:40至8:00 p.m. CET(UTC + 1)期间,某些交易可能会发生,从而受益于交易前透明度要求的豁免。
清零结算系统
直到2003年4月1日,在西班牙证券交易所和连续市场上进行的交易通过Servicio de Compensaci ó n y Liquidaci ó n de Valores,S.A.(其商业名称为Iberclear)进行清算和结算。自2003年4月1日以来,西班牙证券交易所、公共债务市场(Mercado de Deuda P ú blica)、AIAF固定收益市场(Mercado AIAF de Renta Fija)和拉丁美洲股票市场(Mercado de Valores Latinoamericanos en Euros)的所有交易以及为此目的指定Iberclear的其他官方监管市场和多边交易系统上的任何证券交易的结算和清算都是通过由Servicio de Compensaci ó n y Liquidaci ó n de Valores合并而成的Iberclear进行的,S.A and Central de Anotaciones del Mercado de Deuda P ú blica,由西班牙银行管理。
记账式系统
在任何西班牙证券交易所上市的股票的所有权必须由Iberclear维护的登记册中的条目来表示,所有权的转移或变更通过此类登记册中的条目来实现。证券登记制度分为两个层次:由Iberclear管理的中央登记处,负责保管参与者的证券余额,以及由参与者管理的按持有人名称列出证券的详细登记处。
证券市场立法
西班牙证券市场法(今天称为Ley 6/2023,de 17 de marzo,de los Mercados de Valores y de los Servicios de Inversi ó n),或证券市场法,于1989年首次生效,除其他外:
| ● | 成立了独立的监管机构CNMV,对证券市场进行监管; |
| ● | 建立交易行为、要约收购和内幕交易监管框架; |
| ● | 要求证券交易所成员为公司实体; |
| ● | 要求在西班牙证券交易所上市的公司提交年度经审计财务报表,并公开半年度财务信息; |
| ● | 建立了通过计算机整合西班牙证券交易所报价的框架; |
161
| ● | 免征证券销售转让和增值税; |
| ● | 自1992年起解除监管的经纪佣金;以及 |
| ● | 规定以记账式或交付所有权证明方式转让股份。除其他外,《证券市场法》经第37/1998号法律修订,该法律实施了两项欧盟指令,对《证券市场法》进行了创新。首先是承认西班牙和其他被授权提供投资服务的欧盟成员国公司都可以完全进入官方二级证券市场,拥有完全的运营能力,从而能够直接接纳银行实体进入证券交易所区域。第二个创新是扩大了《证券市场法》的范围,将金融工具清单包括在内,例如金融交换合同,或分期付款金融合同,这扩大了所包括的证券类别。 |
关于金融体系改革措施的第44/2002号法律(2002年11月22日)进一步修订了《证券市场法》,其中对管辖金融市场和公司的法律进行了某些修改,包括:
| ● | 要求上市公司设立审计委员会的规定,重新界定了相关事件的报告要求,建立了有关保密和内幕信息及关联交易处理的规则,防止在市场价格方面的操纵和欺诈行为以及其他有关市场透明度的规定; |
| ● | Iberclear的成立;和 |
| ● | 经济和财政部(Ministerio de Economic í a y Hacienda)监管金融服务电子合同的授权。 |
2003年7月17日,为加强上市公司的透明度,第26/2003号法律对《证券市场法》进行了修订。它介绍了:
| ● | 信息和透明度义务,包括对上市公司公司网站内容的详细要求以及向CNMV提交年度公司治理报告的义务;和 |
| ● | 执行一系列公司治理规则的义务,其中包括有关董事会和股东大会的规定。 |
2005年3月11日,第5/2005号皇家法令法律获得批准,修改了《证券市场法》,以便在证券向公众发售或获准交易时对招股说明书实施欧洲议会和欧盟理事会或理事会的指令2003/71/EC。该指令(i)统一了对批准招股说明书过程的要求,这使得招股说明书能够在整个欧盟有效,并且(ii)纳入了后来在西班牙皇家法令或皇家法令1362/2007中规定的原产国原则的应用。
2007年4月12日第6/2007号法律修订了《证券市场法》,修改了收购要约规则和发行人透明度规则。这项法律于2007年8月13日生效,并部分纳入欧洲议会和理事会2004年4月21日关于收购出价的西班牙法律制度指令2004/25/EC和欧洲议会和理事会2004年12月15日关于统一其证券获准在受监管市场交易的发行人信息的透明度要求和修订指令2001/34/EC的指令2004/109/EC。2007年7月27日关于证券收购要约适用规则的第1066/2007号皇家法令;2007年10月19日关于上市证券发行人透明度要求的第1362/2007号皇家法令;以及2012年12月21日关于实施2010年12月24日欧洲议会和理事会第2010/73/EC号指令(修订指令2003/71/CE和指令2004/109/EC)的第1698/2012号皇家法令进一步发展了这项法律。
162
第6/2007号法律(i)对上市证券发行人发布的定期财务信息(年度、半年度和季度)进行了几项修改,以及(ii)对确立提供企业重大股份通知义务的制度进行了新的发展。这些职责包括通知要求,例如:
| ● | 任何有权取得、转让或行使股份授予的表决权的人,不论股份的实际所有权如何,以及拥有、取得或转让其他有权取得有表决权股份的证券或金融工具的人,必须按照规定提供持有重大股权的通知; |
| ● | 上市公司的董事,除了提供有关与这些股份挂钩的发行人的股份或其他证券或金融工具的任何交易的通知外,还必须在任命或辞职时告知CNMV其所持股份;和 |
| ● | 上市公司在某些情况下必须提供有关其库存股的交易通知,这将在发展中的法规中确立。 |
2010年7月2日第1/2010号皇家立法法令批准了《西班牙公司法》,以巩固和明确适用于公共有限公司、有限股份合伙企业和有限责任公司的法律。
2011年3月4日关于可持续经济的第2/2011号法律(Ley de Economic í a Sostenible)修订了《证券市场法》中有关公司治理和管理报告的年度报告要求的规定。该法还在西班牙《上市公司统一良好治理准则》(C ó digo Unificado de Buen Gobierno de las Sociedades Cotizadas,“CNMV治理准则”)中就董事会及其委员会的组成以及董事作为执行、专有或独立的资格提出了某些公司治理和股东披露建议。CNMV上市公司治理准则于2015年获批,并于2020年6月进一步修订。它统一了适用于西班牙上市公司的建议和原则;删除了CNMV治理准则中写入西班牙立法的一些原则和建议,并引入了一些关于上市公司企业社会责任的建议。
2011年8月1日第25/2011号法律修订了《证券市场法》,以实施欧洲议会和理事会关于上市公司股东行使某些权利的指令2007/36/CE,以简化和促进信息权和股东投票权。
2012年6月22日第1/2012号法律修订了《西班牙公司法》,规定上市公司必须使用公司网站,并引入了有关公司网站的创建、修改、转让和删除的其他新要求,以及与此类网站内容相关的董事义务。
关于市场滥用的第596/2014号条例(EU)于2016年生效,该条例直接适用于所有欧盟成员国,旨在确保欧盟的条例与市场发展保持同步,以打击金融市场以及跨商品和相关衍生品市场的市场滥用行为。
2014年12月3日第31/2014号法律修订了《西班牙公司法》,以改善公司治理实践,提高管理效率并提高在西班牙证券交易所上市公司的透明度。
2017年6月14日直接适用于所有欧盟成员国的(EU)第2017/1129号条例于2019年全面生效,以规范向公众发售证券或获准在受监管市场交易时发布的招股说明书,并废除指令2003/71/EC。
2018年11月23日关于支付服务和其他紧急金融措施的第19/2018号皇家立法法令,除其他外,修订了《证券市场法》,以融入西班牙法律体系,以及关于市场滥用的(EU)第596/2014号条例。《证券市场法》引入的主要新奇之处在于:(i)区分内幕信息和相关信息的概念;(ii)取消了制定证券市场内部行为准则的义务;(iii)降低了负有管理责任的人员的通知门槛。
163
2018年12月28日,西班牙《商法典》、《公司法》和《审计法》经第11/2018号法律修订,以加强对上市公司非财务和多样性信息等的披露。它引入了信息和多样性义务,包括(i)有义务就环境事项、社会和员工相关事项、尊重人权、反腐败和贿赂事项以及社会事项编写非财务信息说明,以及(ii)有义务确保公司董事的甄选程序促进与年龄、残疾和培训以及性别、经验和知识相关的多样性。
2020年6月26日,CNMV批准了对CNMV治理准则的部分审查。审查更新并调整了这类守则的各项建议,以适应自公布以来批准的各种干预法律修正案,并澄清了引起某些疑问的其他法律修正案的范围。改革的四个关键要素是:(i)促进妇女在董事会中的存在;(ii)非财务信息和可持续性更加重要;(iii)更多地关注声誉风险,以及一般情况下的非财务风险;(iv)澄清与董事会成员薪酬相关的方面。
由于上述CNMV管治守则的修订,2020年10月6日的第1/2020号通告修订了(i)2020年6月12日的第5/2013号通告,为上市公众公司、储蓄银行和其他发行获准在正式证券市场交易的证券的实体设立了年度公司治理报告的新模板,以及(ii)2020年6月12日的第4/2013号通告,通过建立上市公众公司董事、储蓄银行发行获准在正式证券市场交易的证券的董事会和控制委员会成员薪酬年度报告新模板。
2021年4月12日第5/2021号法律,除其他法规外,修订了《西班牙公司法》,以及《西班牙证券市场法》。这项法律的目的是将欧洲议会和理事会2017年5月17日修订指令2007/36/EC的西班牙法律指令(EU)2017/828转用于鼓励股东长期参与上市公司。
由于上述《西班牙公司法》和《西班牙证券市场法》的修订,2021年9月28日的第3/2021号文修订了(i)2020年6月12日的第4/2013号文,为上市公众公司的董事以及发行获准在正式证券市场交易的储蓄银行的董事会和控制委员会成员的薪酬年度报告建立了新的模板,以及(ii)2020年6月12日的第5/2013号文,为上市公众公司的年度公司治理报告建立了新的模板,储蓄银行和发行获准在正式证券市场交易的证券的其他实体。
2022年5月26日,CNMV 2/2022号文获得通过。该通告确立了用于报告其证券获准在受监管市场交易的实体的重大持股情况以及报告发行人以其库存股进行的任何交易的新表格,并包括适用于做市商的某些新规定。
2023年3月17日第6/2023号法律批准了《证券市场法》,从2015年起废除了以前的《证券市场法》。新的证券市场包含与2015年立法相关的某些调整,意在改善其组织并消除一些不一致之处。为制定《证券市场法》,批准了以下条例:(i)第813/2023号皇家法令,关于投资服务公司和其他提供投资服务的实体的法律制度(2023年11月29日生效);(ii)第814/2023号皇家法令,关于金融工具、交易准入、可转让证券和市场基础设施的登记(2023年11月29日生效,但第111条所载规定除外,该条款于2023年11月10日生效);(iii)第815/2023号皇家法令,涉及国家证券市场委员会的官方登记处,与其他主管部门的合作及对投资服务公司的监管(2023年11月10日生效)。
2024年10月8日,欧盟理事会批准了《上市法案》,这是一项旨在简化和增强欧盟内部资本市场准入吸引力的一揽子立法,尤其是对中小企业而言。《上市法案》更新了各种披露要求,并扩大了编制招股说明书义务的可用豁免。虽然《上市法案》下的许多变更已于2024年12月4日生效,但有些条款将在2026年3月5日或2026年6月5日之前不适用。
164
d. |
出售股东 |
不适用。
e. |
稀释 |
不适用。
f. |
发行费用 |
不适用。
项目10.补充资料
a. |
股本 |
不适用。
b. |
组织章程大纲及章程细则 |
以下为经修订及现行有效的《公司章程》及《董事会规例》的重要条款摘要。本摘要并不意味着完整,并通过参考《公司章程》和《董事会章程》中的每一条对其整体进行限定。因为这是一个总结,它并不包含所有可能对你很重要的信息。应认真阅读《公司章程》和《董事会章程》。当前的公司章程作为20-F表格的年度报告的附件 1.1和附件 1.2(英文翻译)。公司章程和董事会条例也可在我们的网站上查阅,该网站不构成本年度报告的20-F表格的一部分,网址为www.grifols.com,标题为“投资者——公司治理——公司章程”和“投资者——公司治理——董事会、条例”。
165
《公司章程》最初于1987年6月22日获批准并与商业注册处合并。董事会条例最初于2006年4月5日获董事会批准。
在2015年5月29日召开的股东大会上,股东们投票决定就公司治理相关事项修改我们的《公司章程》,以确保遵守修订后的《西班牙公司法》。股东再次向董事会授权,在会议日期后一年内,通过减少面值和增加此类股份的数量,实现A类和B类股份的二比一拆分,而不改变股本的总面值。最后,股东就库存股的衍生收购向董事会提供授权,从而撤销并使在2011年1月25日举行的关于特别事项的股东大会期间授予董事会的授权失效。
在2016年5月27日举行的股东大会上,股东投票决定向董事会授予在其任何成员中具有完全替代权的一次或多次及在任何特定时刻增加公司股本的权力,最长期限为自2016年5月27日股东大会之日起五(5)年,且在任何情况下不得超过本授权时公司股本的一半。根据该授权,股本增加将酌情透过发行及配售新股份(不论是A类及B类、专属于A类或专属于B类)进行,不论是否有股份溢价,代价包括现金出资。只要有无表决权的B类股流通,增资将在适用时遵守公司章程中关于可能对应于上述增资的优先收购权的规定。同样,只要B类股份持有《公司章程》第6条之二第4款预见的赎回权,在执行本次授权时可能发行的B类股份的面值不得超过增资决议所产生的股本总额的四分之一。
在2017年5月26日召开的股东大会上,股东们投票决定修改我们的《公司章程》,涉及审计委员会的组成和职能,以使其内容与现行有效的《审计法》引入的《公司法》最新修正案相一致。股东们还投票决定修订关于股东大会的规定,涉及股东大会的权限,以使其内容适应《公司法》的最新修正案,该修正案由促进商业融资的第5/2015号法律(Ley 5/2005 de fomento de la financiaci ó n empresarial)引入,关于发行债券和其他证券的事项。该修正案包括取消发行编号系列债券或其他证券,无论是否可转换,可能承认或产生明确为股东大会权限的债务。股东还在会议日期后三年内通过A类ADS续签了申请A类股在纳斯达克上市的授权。
在2019年5月24日举行的股东大会上,股东投票通过修订我们的《公司章程》和《股东大会章程》中有关通过股东大会远程投票系统进行有效投票的规定,以便将收到选票的截止日期延长至股东大会第一次或第二次召集会议排定日期的前一天的午夜之前。
在2020年10月9日召开的股东大会上,股东们投票通过修改我们的《公司章程》和《股东大会章程》中关于出席股东大会的权利、代理权授予和代表权的规定,目的是明确确立通过远程、同步和双向连接方式通过远程信息处理方式出席股东大会的可能性。股东亦就衍生工具收购库存股向董事会续期授权,从而撤销于2015年5月29日举行的股东大会期间授予董事会的授权并使其作废。此类授权的最长期限为五年。此外,股东在会议日期后三年内通过A类ADS续签了申请A类股在纳斯达克上市的授权。
166
于2021年5月21日举行的股东大会上,股东投票决定延长向董事会授权增加公司股本的授权,从而撤销于2016年5月27日举行的股东大会上授予董事会的授权并作废。该授权自股东大会召开之日起最长期限为五年。
在2022年6月10日举行的股东大会上,股东投票通过修改我们的《公司章程》和《股东大会条例》,以使其措辞符合西班牙公司法规则和条例的最新修订,其中关于(1)出席权、股东大会上的代理授予和代表以及通过远程投票系统进行投票;(2)董事会薪酬;(3)审计委员会和年度账目;(4)股东大会召开前可获得的信息权;(5)虚拟出席、远程投票和股东大会会议记录。
在2023年6月16日举行的股东大会上,股东投票通过修订我们的《公司章程》,以便将交付股份或购股权或提及股份价值的金额包括在内,作为董事履行行政职责的薪酬。
在2024年6月14日召开的股东大会上,Grifols的股东投票决定修改我们的《公司章程》,以便变更公司注册办事处。
董事会,在其任何成员中具有完全替代权,有权设定增资的条款和条件以及股东大会未预见的所有方面的股份特征,以及在行使优先认购权的期限内自由发售新的未认购股份;确立,在认购不完整的情况下,股本将仅在有效进行的认购金额中增加;重新起草《公司章程》中有关股本和股份数量的条款;根据《公司法》第506条的规定,排除其中规定的条款和条件中的优先购买权,最高不超过公司股本的20%;酌情申请根据本授权发行的股份上市,以及开展所有必要的行动和程序,并向上述证券交易所市场的主管机构提交可能需要的文件,以允许因商定增资而发行的新股上市;明确记录在案的是,Grifols同意受与证券交易所事项相关的现有和未来规则的约束,特别是在订约方面,永久性和被排除在正式上市之外;请求将新股纳入Sociedad de Gesti ó n de los Sistemas de Registro,Compensaci ó n y Liquidaci ó n de Valores,S.A.U.(Iberclear)公司的会计登记处。
上文详述的《公司章程》修订全文可于本网站查阅,该修订并不构成本年度报告表格20-F的一部分,网址为www.grifols.com,标题为“投资者——公司治理”。
一般
截至2024年12月31日,我们的股本为119,603,705欧元,包括:
| ● | A类股:426,129,798股普通股,每股面值0.25欧元。A类份额全部属于同一类别和系列。 |
| ● | B类股:261,425,110股无投票权优先股,每股面值0.05欧元。所有B类股份均属于同一类别和系列,并享有《公司章程》规定的优先权。 |
我们所有的股份均已缴足,不可评税。两种股票类别均以记账式形式发行,受经修订的《证券市场法》和可能适用的其他规定管辖。记账式登记处由Iberclear及其参与实体维护。
注册
We are a public limited trading company registered with the Commercial Registry of Barcelona.我们是一家在巴塞罗那商业登记处注册的公共有限贸易公司。我们的财政识别号码是A-58389123。
167
我们的注册和主要行政办公室位于Avinguda de la Generalitat,152 Parque Empresarial Can Sant Joan,08174 Sant Cugat del Vall è s,Barcelona,Spain。我们于1987年6月22日成立。我们的财政年度从1月1日到12月31日。
公司宗旨
《公司章程》第二条指出,我们的企业宗旨是提供公司和业务的行政、管理和监督服务以及对个人和不动产资产的投资。
董事会
根据《董事会条例》第三十一条,董事应回避出席或干预影响其本人(或与其相关的任何人)直接或间接参与的事项的审议。董事不能直接或间接与我们进行专业或商业交易,除非他/她之前将利益冲突告知董事会,并且董事会根据我们的任命和薪酬委员会的报告批准交易。
根据《董事会条例》第十五条,委任及薪酬委员会在任何情况下均由非执行董事全面组成,其中两名为独立董事,主席须为独立董事。
董事会根据委任及薪酬委员会的意见,制定董事薪酬。本章程第二十条之二规定,董事薪酬由股东大会批准,最多适用三个会计年度。新董事的薪酬政策必须在前一政策的最后适用年度之前获得股东大会的批准,任何获批准的新政策可自批准之日起至股东大会确定的其后三年适用。根据《董事会条例》第27条的规定,非执行董事应被排除在与我们的利润或福利制度相关的薪酬之外,而不是他们在辞去董事职务之前必须持有的Grifols股份。此外,董事会成员参与的股权补偿方案的设立必须得到《公司章程》的授权,并需要股东在股东大会上的事先批准。此外,应计算非执行董事的薪酬金额,以激励奉献精神,但不会成为独立性的障碍。
有关关联交易的更多信息,见本第一部分第7项,“主要股东与关联交易—— B.关联交易。”
我们不对董事退休或不退休规定年龄限制。我们也不对董事资格规定持股要求。然而,《董事会条例》第6条确实规定,如果董事在我们拥有大量股权,则不能符合独立外部董事的资格。
有关适用于董事会的《公司章程》条款的信息,见本第一部分第6项“董事、高级管理人员和员工—— A.董事和高级管理人员——董事”和“董事、高级管理人员和员工—— C.董事会惯例”。
股东权利
以下有关我们股本的重大考虑的摘要简要描述了公司章程和西班牙法律中有关我们股本的某些重大规定。因为它是一个摘要,它并不意味着是完整的,是通过参考适用的西班牙法律和我们的公司章程来限定的,并不包含所有可能对您很重要的信息。
西班牙法律和我们的公司章程均未限制拥有我们证券的权利,包括非居民或外国股东持有或行使证券投票权的权利。
168
根据西班牙法律,股东的权利只能通过修改符合下文“— A类股—股东大会和投票权”下解释的要求的公司章程来改变。我们的《公司章程》没有进一步规定需要采取哪些行动或法定人数来改变我们的股东的权利,只是它们将对其的修订归类为非常事项,如下文“— B类股—在股东大会上就非常事项进行单独投票”中所述。
A类股
股东大会和表决权
根据我们的《公司章程》第13条和《西班牙公司法》,年度普通股东大会应在每个财政年度的前六个月在董事会确定的日期举行。在正式组成的股东大会上提出的决议,除本文另有说明外,均以出席会议或有代表的有表决权资本的简单多数票通过。
董事会可在其认为适当时或应至少占我们股本3%的一名或多名股东的要求召开特别会议。提出要求的股东必须在其请求中说明将在会议上处理的事项。根据西班牙法律和《公司章程》,我们被要求发布“召集会议”,其中列出了每次股东大会将表决的事项,至少在为会议设定的日期前一个月在以下网站发布:(i)商业登记处的官方公报(Bolet í n Oficial del Registro Mercantil)或我们所在省份(目前为西班牙巴塞罗那)广泛发行的当地报纸之一;(ii)CNMV的网站;以及(iii)我们的网站。
在Iberclear及其参与实体保存的记账记录中正式登记的普通股和B类股持有人,可在股东大会预定召开之日至少五天前,按照该会议通知规定的方式(亲自或由代理人代表)出席该会议,并在有此权利的情况下,可参加投票。我们的B类股持有人一般没有投票权,除非涉及某些需要获得我们已发行B类股多数批准的特殊事项,如下文“— B类股—在股东大会上就特殊事项进行单独投票”中所述。
对于在第一次电话会议上正式组成的普通或特别股东大会,需要代表我们已发行有表决权股本25%的股东亲自出席或委托代理人出席,以构成法定人数并进行。第一次召集未达到法定人数的,第二次召集即有效召开会议,无论出席股本多少。
根据西班牙法律,以下股东行动需要亲自出席或由代理人代表出席正式组成的我们A类股份持有人会议的多数我们A类股份持有人的赞成票批准,在该会议上,如果(i)在第一次召集时,至少有50%的已发行有表决权股本的法定人数出席或由代理人代表,或(ii)在第二次召集时,至少25%的已发行有表决权股本的法定人数出席或由代理人代表(除非在该第二次召集时,少于50%的已发行有表决权股本出席或由代理人代表,在这种情况下,这些事项需要至少三分之二的出席或代表出席该次会议的股本的赞成票):
| ● | 发行债券; |
| ● | 股本增加或减少,或在新股发行中压制/限制优先认购权; |
| ● | Grifols的转型(企业性质的改变); |
| ● | 受第3/2009号法律规限的合并、分拆、分拆或其他结构变动; |
| ● | 公司章程的任何其他修订;及 |
169
| ● | 解散。 |
为确定法定人数,根据Grifols,S.A(Reglamento de la Junta General de Accionistas)股东大会规定,通过邮寄或互联网投票的股东被视为出席会议。此类规定可在我们的网站上查阅,该网站不构成本年度报告表格20-F的一部分,网址为www.grifols.com,标题为“投资者——公司治理——股东大会——股东大会规定”。
一般情况下,股东大会通过的决议对全体股东具有约束力。在非常有限的情况下,西班牙法律赋予持异议或缺席的股东,包括持有B类股票的股东,有权让我们按照既定公式或标准确定的价格赎回他们的Grifols股票。
股息
支付股息必须由董事会提出,并由我们的股东在股东大会上授权。董事会可根据当时财政年度的利润宣派中期股息,但须受若干限制。
西班牙法律要求每家公司每年至少将其净收入的10%用于法定准备金,直到该准备金的余额至少相当于该公司已发行股本的20%。公司法定准备金除在该公司清算时外,不得向其股东进行分配。根据西班牙法律,只有当一家公司的净值不低于该公司的股本,而且由于分配的结果也不会低于该公司的股本时,才能从利润(扣除法定准备金所要求的任何金额后)或可分配准备金中支付股息。
此外,不得分配利润,除非可分配准备金的金额至少等于公司合并资产负债表上作为资产记录的研发费用金额。
西班牙法律还要求设立与公司合并资产负债表上记录为资产的商誉金额相等的不可分配准备金,并要求至少相当于此类商誉5%的金额从每个财政年度的利润转入此类不可分配准备金,直到不可分配准备金的金额至少等于该公司合并资产负债表上记录的商誉。如果在任何特定的财政年度,没有或没有足够的利润来转移相当于公司合并财务报表上记录为资产的商誉的5%的金额,西班牙法律要求将不足部分从可自由分配的准备金转入不可分配的法定准备金。
减持股本冲减亏损的,法定公积金达到新股本的10%前不得分红。
向我们的A类股东派发股息将按其已缴足资本的比例进行。股东大会应决定股息的支付金额、时间和形式。如果这些细节没有如此确定,股息将在决议日期的次日在我们的注册办事处支付。
如果在支付后五年内未主张股息,则获得股息的权利失效并归还给我们。我们支付给非西班牙居民的股息可能需要缴纳19%的西班牙预扣税,自2016年1月1日起生效。然而,某些国家的居民有权享受《美利坚合众国和西班牙王国关于避免双重征税和防止对收入征税的逃税的公约》的好处,如下文“— E.税收——西班牙税收考虑”中所述。
如下文“— B类股—优先股息”所述,自我们的B类股发行以来,我们A类股东的股息权一直从属于我们B类股的每股0.01欧元的优先股息。
170
清算权
在我们清盘及清盘后,我们的A类股份及B类股份的持有人将有权按比例收取在我们的债务、税款及清算费用支付后剩余的任何资产,具体如下:(i)在任何金额分配给A类股份持有人之前,B类股份持有人将获得在发行时为该等B类股份支付的面值及股份溢价,以及(ii)一旦收到该等清算优先权,A类股和B类股的持有人将在分配的金额上享有同等权益。
认购(或优先认购)权及增加股本
根据《西班牙公司法》,可转换债券的股东和持有人拥有认购(或优先认购)权利,可以通过货币出资认购公司以增资方式发行的任何新股(或其他可转换为或可交换为股份的证券)。
根据《西班牙公司法》,在特殊情况下,可通过股东大会或董事会通过的决议(例如当我们在西班牙证券交易所上市时)放弃此类认购(或优先认购)权利,而一般股东大会将增加股本或发行可转换为或可交换为股份的证券的权利授予董事会,并放弃认购(或优先认购)权利)。见第一部分第3项,“关键信息—— D.风险因素——与我们的股票和美国存托股票相关的风险——我们的股票或ADS的美国持有人可能无法获得认购(或优先)权利。”
此外,在任何情况下,认购权(或优先认购权)在发生某些增资的情况下都将不可用,例如我们收到实物出资的那些,为满足可转换债券发行的要求而生效的那些,或作为对价发行股票的合并的那些。认购权(或优先认购权)是可以转让的,可以在西班牙自动报价系统上交易,并且可能对现有股东有价值,因为新股可能会以低于现行市场价格的价格进行认购。在以公积金转增股本的情况下,同样的规则适用于自由配售(derecho de asignaci ó n gratuita)权利。
最后,如下文“— B类股—认购权”中所述,就适用认购(或优先认购权)的证券发行而言,我们的B类股只有在我们的A类股被授予额外A类股的优先认购权的情况下,才可能被授予额外B类股的优先认购权。否则,每个类别的优先购买权必须是平等的。
登记和转让
我们的A类股票在Iberclear上是记账式的,是不可分割的。一股股份的共同持有人必须指定一个人行使其股东权利,但他们对从其股东身份产生的所有义务,例如任何未决资本催缴的支付,向我们承担连带责任。
Iberclear维护反映其每个参与实体所持股份数量的中央登记处。每个参与实体反过来维护此类股份所有者的登记处。
在西班牙证券交易所报价的股票的转让通常是通过作为西班牙证券交易所成员的信贷实体或投资公司进行的。
171
报告要求
根据第1362/2007号皇家法令,任何个人或法人实体以任何方式收购或转让西班牙被列为原产国(Estado Miembro)(定义见其中)并在欧盟官方二级证券市场或其他受监管市场上市的公司中具有投票权的股份,如果由于此类交易,该个人或法人实体持有的投票权比例达到、超过或随后低于该公司总投票权的3%门槛,则必须通知发行人和CNMV。通知义务也按5%及其倍数的阈值触发(不含55%、65%、85%、95%和100%)。对于位于指定的“避税天堂”(如第1080/1991号皇家法令所定义)或缺乏适当监管的其他司法管辖区的个人或实体,适用的门槛为1%(或其连续倍数)。
有义务提供通知的个人或法人实体必须在确认交易之日起四个工作日内,通过CNMV不时为此目的批准的表格送达通知。第1362/2007号皇家法令认为,一项交易在订立该交易之日起两个工作日内得到“承认”。
报告要求不仅适用于购买或转让有表决权的股份,而且也适用于在没有购买或转让的情况下,个人或法人实体的表决权比例达到、超过或随后低于因根据向CNMV报告并由该个人或法人实体披露的信息而导致公司表决权总数发生变化而触发报告义务的阈值的交易。
无论有表决权股份的实际所有权如何,任何有权取得、转让或行使股份表决权的个人或法人实体,以及直接或间接拥有、取得或转让授予有表决权股份取得权的其他证券或金融工具的任何个人或法人实体,也将有义务按照规定将持有重大股份的情况通知我们和CNMV。
此外,董事会所有成员必须向美国和CNMV报告他们在成为或不再是董事会成员时持有的Grifols投票权的百分比和数量。董事会所有成员还必须报告,由于我们的股份或投票权的任何收购或处置,或带有收购或处置附有投票权的股份的权利的金融工具,包括他们根据我们的任何补偿计划可能获得的任何基于股票的补偿,他们所持有的投票权百分比的任何变化,无论金额大小。
此外,根据《证券市场法》,董事会任何成员和与董事会任何成员密切相关的任何各方必须类似地报告对我们股份(在本例中为A类或B类股份)、衍生工具或与我们股份相关的其他金融工具的任何收购或处置,无论其规模大小,包括有关他们在相关交易后五个工作日内因相关交易而持有的投票权百分比的信息。在这方面,关于市场滥用的(EU)第596/2014号条例在董事通知方面引入了某些变化。从实践的角度来看,可能被通知的交易被拓宽,通知期从5个工作日减少到3个工作日,并对禁止董事和高管在中期或年度财务报告公布前的30个日历天内进行交易(限制期或“停电”)进行了监管。修订《证券市场法》并实施关于市场滥用的(EU)第594/2014号条例(EU)的《第19/2018号皇家法令》规定,一旦在一个日历年内进行的所有交易的金额之和达到20,000欧元,履行管理职责的人员以及与其密切相关的人员必须向Grifols和CNMV报告对我们股票(在这种情况下为A类或B类股票)、衍生工具或与我们股票相关的其他金融工具的任何收购或处置。
额外的披露义务适用于投票协议。在这方面,《西班牙公司法》要求各方披露某些类型的股东协议,这些协议影响在一般股东大会上行使表决权,或包含对可转换或可交换为股份的股份或债券的可转让性的限制或条件。
此外,持有我们股份净合共淡仓的人士,须于淡仓达到0.2%时,在保密基础上向CNMV报告淡仓,并于紧接相关交易后一天内通知CNMV任何其后的下跌或上涨0.1%(及其连续倍数)。CNMV发布0.5%或以上的个人净空持仓和0.2%-0.5 %之间的净空持仓汇总信息。
172
《公司章程》没有附加规定必须披露股东所有权的所有权门槛。
B类股
我们的B类股票与我们的A类股票具有基本相似的股息和其他经济权利,在上文“— A类股票”中进行了总结,但在下文概述的一些重要方面与A类股票有所不同。
投票权
我们B类股的持有人一般没有投票权,但某些非常事项除外,在这方面需要获得我们已发行B类股的多数批准。
在股东大会上就特别事项进行单独表决
尽管我们的B类股普遍缺乏投票权,但关于下文详述的事项(每一项,“非常事项”)的决议都需要我们大多数已发行的B类股的批准。
| ● | 任何决议(i)授权我们或我们的任何子公司回购或收购我们的任何A类股份,但按向我们的A类股份持有人提供的相同条款和相同价格平等提供的按比例回购除外,或(ii)批准赎回我们的任何股份和任何股本削减(通过回购、注销股份或其他方式),除(a)法律规定的赎回和(b)同样影响我们的A类股份和B类股份且在此类交易中每一B类股份被视为A类股份的赎回。 |
| ● | 任何批准发行、授予或出售(或授权董事会发行、授予或出售)(i)我们的任何股份的决议,(ii)可行使或可交换或可转换为我们的股份的任何权利或其他证券,或(iii)任何期权、认股权证或其他票据,赋予其持有人购买、转换、认购或以其他方式收取我们的任何证券的权利,除非(a)每份B类股份在有关发行、授予或出售中被视为A类股份,因此拥有优先认购权(derecho de suscripci ó n preferente)或相关发行、授予或出售中的自由配售权,如有,则与A类股份相同程度(如有),或(b)如发行是根据下文“—认购权”中所述的认购权进行。 |
| ● | 任何无条件批准或不批准(i)受第3/2009号法律约束的交易(包括但不限于合并、分拆、跨境迁移或资产和负债的全球转让)的决议,除非在此类交易中,每一B类股份被视为与A类股份相同,或(ii)我们的解散或清盘,除非法律要求此类决议。 |
| ● | 将任何Grifols股票从任何证券交易所退市的任何决议。 |
| ● | 一般而言,任何直接或间接对我们的B类股份的权利、优惠或特权产生不利影响的决议及对公司章程的任何修订(包括任何对我们的B类股份相对于我们的A类股份产生不利影响或对我们的A类股份相对于我们的B类股份产生积极影响的决议,或影响公司章程中有关我们的B类股份的规定的决议)。 |
股东大会有权就法律或《公司章程》赋予其的一切事项作出决定,特别是但不限于前述,应是有权就这些非常事项作出决定的唯一法人团体或办事处。
173
优先股息
我们的每一股B类股票都使其持有人有权在每一财政年度结束时从已发行股票的可分配利润中获得至少相当于每B类股票0.01欧元的年度优先股股息。在任何特定的财政年度,我们将向我们的B类股票持有人支付优先股息,然后再从该财政年度的可分配利润中向我们的A类股票持有人支付任何股息。所有已发行B类股的优先股息将由我们在该财政年度结束后的九个月内支付,金额不超过我们在该财政年度获得的可分配利润。
如果在一个财政年度内,我们没有获得足够的可分配利润来全额支付,从这些利润中,所有已发行的B类股票的优先股息,超过我们获得的可分配利润的优先股息金额将不会被支付,也不会作为未来应付的股息累计。
由于可分配利润不足以全额支付该财政年度的优先股息,在一个财政年度内未能支付全部或部分优先股息将不会导致我们的B类股恢复任何投票权。
正如上文“— A类股—股息”中所述,我们的A类股东的股息权利从属于本节中描述的优先股息。
其他股息
除上述优先股股息外,每股B类股有权获得与一股A类股相同的股息和其他分配(在每种情况下,无论是现金、Grifols或我们的任何子公司的证券,或任何其他证券、资产或权利)。就我们的A类股份作出的任何股息或其他分派而言,每股B类股份被视为一股A类股份,包括宣布及支付任何该等股息或分派的时间。
赎回权
如果我们的全部或部分股本的要约收购(全部或部分)被提出并结算,我们B类股份的每一持有人均有权赎回本条所述的股份,但如果我们B类股份的持有人有权(i)参与该要约,并且(ii)他们在该要约中的股份与我们A类股份的持有人平等且以相同的条件获得(包括但不限于以相同的对价),则除外。
在我们的B类股份持有人无权(i)参与和(ii)在该要约中以与我们的A类股份持有人相同的条件(包括但不限于以相同的对价)获得其股份的要约收购完成和结算(全部或部分)时,赎回程序将遵循下文详述的程序。
| ● | 我们将在赎回事件发生之日起十天内(即触发要约收购结算之日)在商业登记处宪报、西班牙证券交易所宪报和至少两份在巴塞罗那发行量最大的报纸上发布公告,通知我们的B类股票持有人赎回事件以及与该赎回事件有关的行使赎回权的过程。 |
| ● | 我们B类股份的每位持有人将有权通过通知我们其决定,在触发赎回权的要约收购的第一个结算日期起两个月内行使其赎回权。我们将确保机制到位,以便可以通过Iberclear发出行使赎回权的通知。 |
174
| ● | 我们将就已行使赎回权的每一B类份额支付的赎回价格将为(i)在要约收购中支付的触发赎回权的最高对价的欧元金额加上(ii)(i)中提及的金额的利息之和,自该要约首次结算之日起至全额支付赎回价格之日止,利率等于1年期欧元同业拆借利率加上300个基点。就此计算而言,在要约收购中支付的任何非现金对价对应的欧元金额将是该非现金对价在要约收购首次结算之日的市场价值。该市值的计算应得到至少两名我们从国际知名审计事务所指定的独立专家的支持。 |
| ● | 我们将在要约收购后行使赎回权的通知期失效之日起40天内,采取一切必要行动(i)有效支付我们已行使赎回权的B类股份的赎回价格,并完成赎回所需的资本削减,以及(ii)反映因赎回而对《公司章程》第6条(有关股本)的修订。 |
我们赎回的B类股份的数目,不得占我们在提出要约时已发行和流通的B类股份总数的百分比,不得超过要约所针对的我们的A类股份(i)的总和的百分比,(ii)由要约人在该要约中持有,及(iii)由与要约人一致行动的人或与要约人就要约达成协议的人持有,代表在要约提出时已发行和流通的A类股份总数,导致我们的B类股份被赎回。
赎回价格的支付将取决于我们是否有足够的可分配储备,但在要约收购发生后,直到我们的B类股份的赎回价格全额支付,我们将无法向我们的股东宣布或支付任何股息或任何其他分配(在每种情况下,无论是现金、Grifols或我们的任何子公司的证券,或任何其他证券、资产或权利)。
清算权
每份B类股份赋予其持有人在我们清盘及清盘时收取相当于(i)该B类股份的面值及(ii)认购该B类股份时已缴付的股份溢价之和的金额的权利。
我们将向我们的B类股票持有人支付清算金额,然后再向我们的A类股票持有人支付清算账户的任何金额。
我们的每一股B类股票都赋予其持有人权利,除了清算优先金额外,还可以获得为A类股票支付的相同清算金额。
认购权
每份B类股份赋予其持有人与任何发行、授予或出售(i)Grifols的任何股份、(ii)可行使、可交换或可转换为Grifols股份的任何权利或其他证券或(iii)任何期权、认股权证或其他赋予其持有人购买、转换、认购或以其他方式接收Grifols任何证券的权利的任何A类股份相同的权利(包括优先认购权和自由配售权)。
作为例外,B类股份的优先认购权和自由配售权将仅适用于新的B类股份或给予购买、转换、认购或以其他方式收取B类股份权利的工具,A类股份的优先认购权和自由配售权将仅适用于新的A类股份或给予购买、转换、认购或以其他方式收取A类股份权利的工具,对于满足以下三个要求的每一次增资或发行:(i)A类股和B类股的发行与其在增资决议通过时所代表的股本比例相同;(ii)B类股的优先认购权或自由配售权(如适用)的授予与B类股的优先认购权或自由配售权(如适用)的条款相同,就A类股份授予A类股份;及(iii)并无发行其他股份或证券。
175
登记和转让
B类股份在Iberclear上采用记账式形式,不可分割,如上文“— A类股份—登记和转让”中关于A类股份所示。
控制权变更
《公司章程》不包含任何具有延迟、推迟或阻止Grifols控制权变更效力的条款。
股本变动
股本变动被视为非常事项,必须按照上述“— A类股—股东大会和表决权”和“— B类股—股东大会关于非常事项的单独表决”中说明的程序,由我们的股东批准。
可通过发行新股或增加现有股份面值的方式进行增资。减资可以通过减少现有股份的面值或通过赎回或回购现有股份来实现。
426,129,798股A类股目前已发行在外流通,每股面值为0.25欧元,261,425,110股B类股目前已发行在外流通,每股面值为0.05欧元。截至2024年12月31日,我们的总股本为119,603,705欧元。
下沉基金
《公司章程》未包含任何偿债基金条款。
c. |
材料合同 |
以下合同是我们在紧接本年度报告表格20-F日期之前的两年内订立的,或包含我们或Grifols集团的其他成员对我们具有重大意义的义务或权利的条款:
2019年笔记
有关2019年票据的重要条款摘要,请参阅本第一部分的项目5,“经营和财务审查与前景—— B.流动性和资本资源——信贷来源—— 2019年票据。”
2021年笔记
有关2021年票据的重要条款摘要,请参阅本第一部分的项目5,“经营和财务审查与前景—— B.流动性和资本资源——信贷来源—— 2021年票据。”
2024年4月票据
关于2024年4月票据的重要条款摘要,见第一部分项目5,“运营和财务审查与前景—— B.流动性和资本资源——信贷来源—— 2024年4月票据。”
2024年12月笔记
关于2024年12月票据的重要条款摘要,见第一部分项目5,“运营和财务审查与前景—— B.流动性和资本资源——信贷来源—— 2024年12月票据。”
176
第一留置权信贷便利
有关第一留置权信贷便利的重要条款摘要,请参阅本第一部分第5项,“经营和财务审查与前景—— B.流动性和资本资源——信贷来源——第一留置权信贷便利。”
欧洲投资银行定期贷款
有关欧洲投资银行定期贷款的实质性条款摘要,见本第一部分第5项,“运营和财务审查与前景—— B.流动性和资本资源——信贷来源——欧洲投资银行定期贷款。”
收购
有关我们在2024年、2023年和2022年基本完成的收购的重要条款摘要,请参阅本第一部分第5项,“经营和财务审查与前景—— A.经营成果——影响我们的财务状况和经营成果的因素——收购。”
d. |
外汇管制 |
对外国投资的限制
根据现行法规,外国投资者可以将投入的资本、资本收益和股息转移出西班牙,但不受适用税收以外的金额限制。经修订的2003年7月4日第19/2003号法律更新了西班牙外汇管制和洗钱预防条款,承认西班牙居民和非居民之间资本自由流动的原则,除非它们属于2022年12月通过第20/2022号皇家法令颁布的第19/2003号法律第7条之二的范围,或——仅涉及国防部门的投资—— 2023年7月4日第571/2023号皇家法令第18条。
该法规定了为行政或统计信息目的申报资本流动的程序,并授权西班牙政府以公共政策或公共安全和公共卫生为由采取正当措施。第19/2003号法律第7条之二基于公共秩序、公共卫生和公共安全原因,为非欧盟和非欧洲自由贸易联盟居民的某些投资建立了筛选机制。它还提供了对第三国采取例外措施的机制,如果此类措施已获得欧盟或西班牙作为缔约方的国际组织的批准。
违反筛选机制可以使交易无效,罚款最高可达投资价值。非西班牙外国投资者,不包括避税天堂的投资者,必须为统计、经济和行政目的(如7月4日第571/2023号皇家法令所规定)在投资后通知西班牙外国投资登记处。避税天堂的居民需要事先和事后通知,特殊情况除外。附加规定适用于某些行业,如航空运输、采矿和国防相关活动。欧盟居民一般不受这些限制,但与国防相关的部门以及为非军事目的制造武器和爆炸物的部门除外。
外汇管制
关于防止洗钱和资助恐怖主义的第10/2010号法律于2010年4月28日通过,并于2010年4月30日生效。这项法律要求,移动(i)任何货币的纸币和硬币,(ii)任何货币的无记名支票或(iii)任何其他实体媒介,包括电子媒体,旨在用作向持票人付款的人,如果超过10,000欧元(或等值外币),则必须向西班牙外汇管制当局申报此类付款。
177
e. |
税收 |
一般情况
ADS持有人的待遇
本节介绍拥有股票或ADS的重大美国联邦收入和西班牙税收后果。仅当您出于税收目的将您的股票或ADS作为资本资产持有时,它才适用于您。如果您是受特殊规则约束的特殊持有人类别的成员,则本节不适用于您,包括:
| ● | 证券交易商; |
| ● | 选择对证券持仓采用盯市方法核算的证券交易者; |
| ● | 免税组织; |
| ● | 一家人寿保险公司; |
| ● | 根据《守则》(定义见下文)对替代最低税负有责任的人; |
| ● | 实际或建设性地拥有我国10%或以上有表决权股份的人; |
| ● | 作为跨式交易或对冲或转换交易的一部分持有股票或ADS的人;或者 |
| ● | 功能货币不是美元的美国持有者(定义见下文)。 |
本节以经修订的1986年《国内税收法》或《法典》、其立法历史、现有和拟议的条例、已公布的裁决和法院判决为基础,在每种情况下自本协议之日起生效,所有这些都可能发生变化,可能具有追溯力,以及西班牙的税法及其下的条例和《美利坚合众国和西班牙王国关于避免双重征税和防止对收入征税的逃税的公约》或《条约》,在每种情况下,自本协议之日起生效,并可能发生变化。
如果你是股票或ADS的实益拥有人,你就是“美国持有人”,而且你:
| ● | 美国公民或居民; |
| ● | 在美国、其任何州或哥伦比亚特区的法律中或根据其法律创建或组织的公司或作为公司应纳税的其他实体; |
| ● | 无论其来源如何,其收入均需缴纳美国联邦所得税的遗产;或 |
| ● | 如果美国法院可以对信托的管理行使主要监督,并且一名或多名美国人被授权控制信托的所有重大决定,则为信托。 |
“合格美国持有人”是指符合以下条件的美国持有人:
| ● | 就条约而言是美国的居民; |
| ● | 没有在西班牙维持一个可归属于股票或ADS的常设机构或固定基地,并且美国持有人通过该机构开展或已经开展业务(或者,就个人而言,开展或已经开展独立的个人服务);和 |
178
| ● | 在其他方面有资格获得条约规定的与股份或ADS的收入和收益有关的利益。 |
“非美国持有人”是指非美国持有人的股票或ADS的实益拥有人。
此外,如果合伙企业(包括出于美国联邦所得税目的被视为合伙企业的任何实体)是股份或ADS的受益所有人,合伙企业中合伙人的税务待遇一般将取决于合伙人的地位和合伙企业的活动。作为合伙企业的股份或ADS的实益拥有人,以及此类合伙企业的合伙人,应就拥有和处置股份或ADS的税务后果咨询其自己的税务顾问。
您应该咨询您自己的税务顾问关于在您的特定情况下拥有和处置股票和ADS的美国联邦、州和地方以及西班牙和其他税务后果。特别是,您应该与您的顾问确认您作为合格美国持有人的身份,并且应该讨论未能获得合格美国持有人资格的任何可能后果。
本次讨论仅涉及美国联邦所得税和西班牙所得税、赠与和遗产税、财富税和转让税。
ADR持有人的待遇
一般来说,考虑到之前的假设,出于美国联邦收入和西班牙税收目的,如果您持有ADR证明ADS,您将被视为这些ADR所代表的股份的所有者。以股票交换ADR,以ADR交换股票,一般不需要缴纳美国联邦收入或西班牙税。
西班牙税务考虑
这种对西班牙税收后果的讨论仅适用于符合条件的美国持有者的ADS或股票所有者。以下是西班牙重大税务事项的摘要,并不是详尽无遗的收购、拥有和处置ADS或股份对个人或实体可能产生的所有税务后果。
股息征税
根据西班牙法律,包括经第26/2014号法律(自2015年1月1日起生效)修订的2004年3月5日第5/2004号皇家立法法令,关于非居民所得税法,西班牙居民公司支付给非为税收目的居住在西班牙且非通过西班牙常设机构运营的普通股或ADS持有人的股息需缴纳19%的西班牙非居民所得税。
我们将按照2000年4月13日西班牙部长令或命令规定的程序,按19%的税率对股息总额征收初始预扣税。然而,根据《条约》,在满足某些要求的情况下,个人和实体可能有权获得15%的降低税率。
要从条约降低的15%税率中受益,个人或实体必须向保存人提供美国国内税务局(IRS)的证明,说明据IRS所知,它是条约含义内的美国居民。IRS证书可通过提交IRS表格8802获得,自签发之日起有效期为一年,除非其中包括被视为税务居民的特定年份,在这种情况下,该证书将被视为在该年度适用。
根据2000年4月13日的命令,要获得直接适用条约降低的15%的税率,上述证书必须在我们可分配股息的月份结束后的第十天之前提供给保存人。如果个人或实体未能及时向保存人提供所需文件,它可能会按照以下程序获得西班牙税务当局将导致的4%超额预扣税的退款。
179
西班牙退款程序
根据经修订的2004年7月30日第1776/2004号皇家法令,该法令进一步发展了关于非居民所得税法的第5/2004号皇家立法法令,可以从西班牙相关税务当局获得超过条约规定的税率的预扣金额的退款。符合条件的美国持有人可以通过提交以下所有内容来追求退款索赔:
| ● | a西班牙文210表格; |
| ● | 上述“—股息征税;”中提到的美国国税局的证明;以及 |
| ● | 非居民所得税被扣缴的证据。 |
西班牙税务局必须在提出退款要求后的六个月内进行退款。如果该期限失效而未收到退款,持有人有权获得所要求的退款金额的逾期付款利息。
180
退款要求必须在西班牙税务当局征收预扣税款之日起四年内提出。根据2010年12月17日的EHA/3316号令,对于截至2011年1月支付的股息,210表格必须自支付股息的次年的2月1日起提交。
敦促个人和实体就退款程序和退款程序对美国税收的任何影响咨询他们自己的税务顾问。
资本收益征税
根据西班牙法律,居住在西班牙的人为税收目的发行的证券所获得的任何资本收益均被视为西班牙来源收入,因此在西班牙应纳税。对美国居民而言,出售ADS或股票的收入将被视为西班牙税收目的的资本收益。西班牙非居民所得税按19%的税率对非居住在西班牙的人为税收目的而实现的资本收益征收,这些人无权享受任何适用的避免双重征税条约的好处。资本利得和损失将针对每笔交易单独计算,损失可能不会与资本收益相抵。
尽管有上述规定,任何持有人在西班牙官方二级证券市场上转让股份所获得的资本收益,如果是与西班牙签订了含有“信息交流”条款的避免双重征税条约(定义见2006年11月30日第36/2006号法律,与防止税务欺诈措施有关)的国家的居民,则在西班牙将免税。此外,根据该条约,个人或实体在处置ADS或股份时实现的资本收益将不会在西班牙征税。个人或实体必须在股份转让发生的次年1月1日至1月20日期间,通过向相关西班牙税务机关提供IRS在美国的居住证明以及适当的西班牙210税表,证明其有权获得这项豁免。
西班牙财富税
出于税收目的而非居住在西班牙的个人,如果持有位于西班牙的股票或ADS,则需缴纳西班牙财富税(第19/1991号法律),该税对位于西班牙或可在任何一年的最后一天在西班牙领土内行使的财产和权利征税。西班牙税务当局可能认为,出于西班牙税务目的,西班牙公司的所有股份和代表此类股份的所有ADS都位于西班牙。如果税务当局持这种观点,在任何一年的最后一天持有股票或ADS的非西班牙居民将在该年度的最后一个季度就这类股票或ADS的平均市值缴纳该年度的西班牙财富税(这一上市股票的平均价格每年在官方国家公报上公布)。第4/2008号法律修订了西班牙财富税法,引入了100%的退税,并取消了自2008年1月1日开始的税期提交任何表格的义务。然而,这一100%的退税自2011财年起被暂时取消,此后这种情况每年都在延长。从2021年起,取消返利被确定为无限期,从而无需规定延期。尽管如此,仍有70万欧元的免税津贴。
由于上述立法,根据西班牙财富税法,持有或持有位于西班牙的股票、ADS或其他资产或权利的非西班牙居民,在一年的最后一天,其总价值超过700,000欧元,可能会按0.2%至3.5%的边际税率对该超额金额征收西班牙财富税(自2021年以来最高档增加了1%),并将有义务提交相应的财富纳税申报表。
第11/2021号法律修订了财富税法,明确所有非居民纳税人(而不仅仅是那些居住在欧盟和欧洲经济区司法管辖区的人)都有权适用西班牙地区批准的税收减免。
181
对大笔财富征收团结税
2022年12月29日,一项针对巨额财富的新的团结税开始生效,意在对上述财富税进行补充。新的团结税是对截至每年12月31日净财富超过300万欧元的个人征收的直接和个人税。非西班牙居民将被征收此税,仅考虑到他们的西班牙净财富。这一新税种在最基本的方面(如豁免、应税和净应税基数、税率和应纳税额限制)与西班牙财富税的规定一致。团结税被设计为临时性的,并在两个日历年(即2022年和2023年)内继续有效,尽管该法律包括一项审查条款,允许立法者在初始期结束时评估是否延长它。在最近的《第8/2023号皇家法令》公布后,团结税被无限期延长(从2024年开始生效),直到在自治社区金融系统的背景下对财富税进行修订。为避免双重征税,适用于新团结税的规则允许个人从其应缴团结税总额中扣除已作为西班牙财富税缴纳的金额
西班牙遗产和赠与税
根据第29/1987号法律,如果受让人出于税收目的是西班牙居民,或者如果股份或ADS在赠与或死亡时位于西班牙,或者其附带的权利可以在西班牙领土上行使或必须在西班牙领土上履行,无论受益人的居住地如何,则在死亡或通过赠与转让股份或ADS需缴纳西班牙遗产税和赠与税。在这方面,西班牙税务当局可以确定,出于西班牙税务目的,西班牙公司的所有股份和代表这类股份的所有ADS都位于西班牙。适用的税率,在适用所有相关因素后,对个人而言介于0%至81.6%之间。第11/2021号法律修订了《赠与和遗产税法》,明确所有非居民纳税人(而不仅仅是那些居住在欧盟和欧洲经济区司法管辖区的人)都有权根据西班牙最高法院的判例法适用西班牙各地区批准的税收减免。
授予非西班牙居民企业的赠与需缴纳西班牙非居民所得税,税率为股票公平市场价值的19%,作为资本收益。如果受赠方是一家美国公司,则将适用上述“—资本收益征税”中所述的条约规定的除外情形。
转账费用
转让ADS或股票将免征任何西班牙转让税或增值税。此外,此类转让不征收西班牙印花税。股份或ADS的转让可能需要缴纳西班牙金融交易税(“西班牙FTT”)。实施西班牙FTT的西班牙法律(“FTT法”)于2020年10月7日获得批准,并于2020年10月16日在西班牙官方公报(Bolet í n Oficial del Estado)上公布。西班牙FTT在FTT法公布三个月后生效(即2021年1月16日),将对市值超过10亿欧元(10亿欧元)的西班牙公司(包括ADS)发行的上市股票的特定收购收取0.2%的费率(这可能是Grifols的情况),而不考虑交易相关方的居住管辖权。一级市场的交易(如增资)不受西班牙FTT的约束。不过,西班牙FTT将视Grifols的市值而对涉及收购股份或ADS的其他交易进行监管。建议潜在投资者就西班牙FTT寻求自己的专业建议。
182
美国联邦所得税考虑因素
股息征税
美国持有者
根据美国联邦所得税法,并根据下文讨论的被动外国投资公司(“PFIC”)规则,如果您是美国持有人,我们从当前或累计收益和利润中支付的任何股息(包括我们B类股票的任何优先股息)的总额(根据美国联邦所得税目的确定)需缴纳美国联邦所得税。如果您是非公司美国持有人,支付给您的构成合格股息收入的股息(包括我们B类股票的任何优先股息)将按最高20%的税率向您征税,前提是您在除息日前60天开始的121天期间内持有股票或ADS超过60天,并满足其他持有期要求。我们就股票或ADS支付的股息(包括我们B类股票的任何优先股股息)通常将是合格的股息收入。
对于我们支付的任何股息(包括我们B类股票的任何优先股息),您必须将从股息支付中预扣的任何西班牙税款计入此类股息的总额,即使您实际上并未收到。当您(在股票的情况下)或存托人(在ADS的情况下)实际或建设性地收到此类股息时,股息应向您征税。此类股息将不符合美国公司从其他美国公司收到的股息一般允许的股息收到的扣除条件。作为美国持有者,您必须包含在收入中的股息分配金额将是所支付的欧元的美元价值,以股息分配包含在您的收入中之日的即期欧元/美元汇率确定,无论支付是否实际上已转换为美元。通常,从您将股息支付计入收入之日起至您将支付款项转换为美元之日期间,因汇率波动而产生的任何收益或损失将被视为普通收入或损失,并且不符合适用于合格股息收入的特别税率。收益或损失一般将是来自美国境内来源的收入或损失,用于外国税收抵免限制目的。为美国联邦所得税目的确定的超过当前和累计收益和利润的分配,将被视为在股票或ADS中调整后的税基范围内的资本的非应税回报,此后,将被视为资本收益。
在一定的限制下,根据条约代扣代缴给西班牙的西班牙税款将可抵扣或可从您的美国联邦所得税负债中扣除。在确定适用最高20%税率的股息的外国税收抵免限制时适用特殊规则。如果根据西班牙法律或条约,您可以获得预扣税款的退款,则可退还的预扣税款金额将不符合抵减您的美国联邦所得税负债的条件。获得退税的程序见上文“—西班牙税务注意事项—西班牙退税程序”。
股息将是来自美国以外来源的收入,支付的股息将根据您的情况,是“被动”或“一般”收入,在任何一种情况下,为了计算您可以获得的外国税收抵免,这些收入将与其他类型的收入分开处理。
美国持有者可以选择将支付的所有外国税款视为计算应税收入时的可扣除费用,而不是作为抵税,但须遵守普遍适用的限制。这样的选举一旦作出,就适用于在受选举影响的纳税年度缴纳的所有外国税款。管理外国税收抵免的规则很复杂,因此,强烈鼓励美国持有者咨询他们自己的税务顾问,以确定他们是否受到任何可能限制他们有效利用外国税收抵免的能力的特殊规则的约束,以及根据他们的具体情况进行选举是否合适。
183
非美国持有者
如果您是非美国持有者,就股票或ADS向您支付的股息(包括我们B类股的任何优先股息)将不需缴纳美国联邦所得税,除非此类股息与您在美国境内的贸易或业务行为“有效关联”,并且此类股息可归属于您在美国维持的常设机构,前提是适用的所得税条约要求将其作为以净收入为基础对您进行美国征税的条件。在这种情况下,你通常会以与美国持有者相同的方式被征税。如果您是公司非美国持有者,在某些情况下,如果您有资格享受规定较低税率的所得税条约的好处,“有效关联”股息可能需要按30%的税率或更低的税率缴纳额外的“分支机构利得税”。
资本收益征税
美国持有者
根据下文讨论的PFIC规则,如果您是美国持有人,并且您出售或以其他方式处置您的股票或ADS,您将为美国联邦所得税目的确认资本收益或损失,等于您实现的金额的美元价值与您调整后的税基之间的差额,以美元确定,在您的股票或ADS中。非公司美国持有人的资本利得一般按最高20%的税率征税,如果这类非公司美国持有人的持有期超过一年。这种收益或损失通常将是出于外国税收抵免限制目的而从美国境内来源获得的收入或损失。
非美国持有者
如果您是非美国持有者,您将不会因出售或以其他方式处置您的股票或ADS而确认的收益而被征收美国联邦所得税,除非:
| ● | 该收益与您在美国进行的贸易或业务“有效关联”,如果适用的所得税条约要求将该收益作为以净收入为基础对您进行美国征税的条件,则该收益可归属于您在美国维持的常设机构;或者 |
| ● | 您是个人,您在销售的纳税年度内在美国停留183天或以上,并且存在某些其他条件。 |
如果您是企业非美国持有者,在某些情况下,如果您有资格享受规定较低税率的所得税条约的好处,您确认的“有效连接”收益也可能需要按30%的税率或更低的税率缴纳额外的“分支机构利得税”。
184
被动外资公司考虑
我们认为,出于美国联邦所得税目的,我们的股票和ADS不应被视为PFIC的股票,但这一结论是每年做出的事实认定,因此可能会发生变化。如果我们被视为PFIC,那么在出售或以其他方式处置您的股票或ADS时实现的收益一般不会被视为资本收益。相反,如果您是美国持有人,您将被视为在您的股票或ADS持有期内按比例实现了此类收益和某些“超额分配”,并将按收益分配到的每一年有效的最高税率征税,以及与每一年应占税款相关的利息费用。除某些例外情况外,如果我们在您持有您的股票或ADS期间的任何时间都是PFIC,则您的股票或ADS将被视为PFIC的股票。某些选举(例如按市值计价的选举或合格的选举基金(“QE”)选举)可能会导致ADS或股票的替代处理。如果我们在分配的纳税年度或上一个纳税年度被视为与您相关的PFIC,则您从我们收到的股息将没有资格获得适用于合格股息收入的特殊税率,而是将按照适用于普通收入的税率征税。
非劳动收入的医疗保险缴款税
作为个人的美国持有人须就(1)该美国持有人在相关纳税年度的“净投资收入”和(2)该美国持有人在该纳税年度的修正调整后总收入超过一定门槛(125,000美元至250,000美元之间,视个人情况而定)中的较小者缴纳3.8%的税款。作为遗产的美国持有人,或不属于豁免此类税收的特殊信托类别的信托,须按(1)该美国持有人在相关纳税年度的未分配“净投资收入”和(2)该美国持有人在该纳税年度的调整后总收入超过该纳税年度最高税级开始的金额(2024年为15,200美元)中的较小者缴纳3.8%的税。美国持有人的净投资收益通常包括(其中包括)股息收入毛额以及该美国持有人处置你的股票或ADS的任何净收益金额,除非此类股息或净收益是在贸易或业务的正常进行过程中获得的(由某些被动或交易活动组成的贸易或业务除外)。作为个人、遗产或信托的美国持有人应咨询他们自己的税务顾问,了解这项税收对他们投资于股票或ADS的收入和收益的适用性。
备用扣缴和信息报告
如果您是非公司美国持有者,信息报告要求,在美国国税局1099表格上,一般会适用于:
| ● | 在美国境内向您支付的股息或其他应税分配;和 |
| ● | 在经纪商的美国办事处向您支付出售股票或ADS的收益。 |
此外,如果您是非公司美国持有人,以下情况可能适用备用预扣税:
| ● | 未提供准确的纳税人识别号; |
| ● | 收到美国国税局通知,您未能报告联邦所得税申报表上要求显示的所有利息和股息;或者 |
| ● | 在某些情况下,未能遵守适用的认证要求。 |
如果您是非美国持有者,您通常可以在以下方面免于备用预扣和信息报告要求:
| ● | 我们或其他非美国支付方在美国境外向您支付的股息;和 |
185
| ● | 其他股息支付以及在经纪商的美国办事处进行的出售股票或ADS收益的支付,如果与此类支付相关的收入在其他情况下免征美国联邦所得税;以及: |
| ● | 付款人或经纪人不知道或没有理由知道您是美国人,并且您向付款人或经纪人提供了以下情况之一: |
| ● | 美国国税局W-8BEN表格、W-8BEN-E表格或可接受的替代表格,您在该表格上根据伪证罪的处罚证明您是非美国人,或 |
| ● | 根据美国财政部的规定,它可能依赖的其他文件将付款视为支付给非美国人,或 |
| ● | 否则您将建立豁免。 |
在经纪商的外国办事处进行的出售股票或ADS收益的支付一般不会受到信息报告或备用预扣的约束。然而,在以下情况下,在经纪商的外国办事处进行的股票或ADS出售将受到信息报告和备用扣缴的约束:
| ● | 收益转入您在美国开立的账户; |
| ● | 收益的支付或销售确认书在美国地址邮寄给您;或 |
| ● | 该销售与美国财政部法规中规定的美国有其他特定联系,除非经纪人没有实际知识或理由知道您是美国人,并且满足了上述文件要求或您以其他方式确立了豁免。 |
此外,在经纪商的外国办事处进行的股票或ADS出售将受到信息报告的约束,如果经纪商:
| ● | a美国人; |
| ● | 为美国联邦所得税目的的受控外国公司; |
| ● | 毛收入的50%或以上的外国人,在规定的三年期间内与美国贸易或业务的进行有效关联;或 |
| ● | 外国合伙企业,如在其纳税年度内的任何时间: |
| ● | 其一个或多个合伙人是美国财政部法规中定义的“美国人”,合计持有合伙企业50%以上的收入或资本权益,或 |
| ● | 此类外国伙伴关系从事美国贸易或业务,除非经纪人没有实际知识或理由知道您是美国人,并且满足上述文件要求或您以其他方式确立豁免。如果销售受制于信息报告,并且经纪人实际知道您是美国人,则将适用备用预扣税。 |
备用预扣税不是附加税。通常,您可以通过向美国国税局提出退款申请,获得根据备用预扣税规则预扣的超过您的所得税责任的任何金额的退款。
186
对外金融资产方面的信息披露
某些美国个人在该持有人的纳税年度内持有“特定外国金融资产”(包括我们的股票或ADS)的任何权益,如果所有此类资产的总价值超过50,000美元(或美国国税局规定的更高美元金额),则必须在其该年度的美国纳税申报表中附上与每项此类资产有关的某些信息,除非此类股票或ADS存放在美国付款人(例如美国金融机构或外国银行或保险公司的美国分支机构)维护的账户中。为此,“特定外国金融资产”包括外国金融机构维持的任何存管、托管或其他金融账户,以及不在金融机构维持的账户中持有的某些资产,包括由非美国人发行的任何股票或证券。受这些规则约束的纳税人如果未能提供所需信息,可能会被处以10,000美元的罚款,如果在美国国税局通知纳税人此类失败后,该失败持续超过90天,则可能会适用额外的罚款,除非纳税人证明了此类不遵守的合理原因。对可归因于“未披露的外国金融资产少报”的少缴税款处以40%的与准确性相关的罚款,为此目的,任何纳税年度的毛收入少报部分可归因于涉及“未披露的外国金融资产”的任何交易,包括根据本规则须遵守信息报告要求的任何资产,如果满足上述美元门槛,这将包括我们的股票或ADS。如果纳税人从总收入中遗漏了超过5,000美元,而这种遗漏可归因于根据上段所述规则要求报告的外国金融资产,或者如果适用此类规则而不考虑美元门槛或美国国税局规定的任何其他例外情况,则将如此要求,则适用的美国联邦所得税评估时效延长至六年。此外,如果纳税人未能及时提供与要求报告的特定外国金融资产有关的信息或PFIC股票持有人所需的年度信息报告,包括进行量化宽松基金选择的PFIC股票,则诉讼时效将被暂停。你应该咨询你自己的税务顾问,关于你可能需要向美国国税局提供信息的任何义务,因为你持有我们的股票或ADS。
f. |
股息和支付代理 |
不适用。
g. |
专家声明 |
不适用。
h. |
展示文件 |
我们受《交易法》的信息要求约束,但作为外国私人发行人,我们不受《交易法》的代理规则或短线利润披露规则约束。根据这些信息要求,我们向SEC提交或提供报告和其他信息。我们向SEC提交或提供的报告和其他信息可在SEC维护的公共参考设施中检查和复制,地址为Room 1024,100 F Street,N.E.,Washington,D.C. 20549,以及SEC的区域办事处,地址为233 Broadway,New York,New York 10279和Northwestern Atrium Center,500 West Madison Street,Suite 1400,Chicago,Illinois 60661-2511。
此类材料的副本也可能会在NASDAQ,4 Times Square,New York,New York 10036的办公室进行检查,我们的ADS就列于这些办公室。此外,以电子方式向SEC提交的信息可在SEC网站上公开获取,该网站不构成这份20-F表格年度报告的一部分,网址为http://www.sec.gov。
i. |
子公司信息 |
不适用。
j. |
向证券持有人提交的年度报告 |
如果我们被要求根据表格6-K的要求向证券持有人提供年度报告,我们将根据EDGAR申报人手册以电子格式向证券持有人提交年度报告。
187
项目11.关于市场风险的定量和定性披露
我们对市场敏感的工具所固有的风险是利率、外汇汇率和市场价格的不利变化可能产生的潜在损失。我们面临利率变化导致的市场风险,因为这种变化可能会影响我们获得融资的成本。我们以外币计价的债务面临汇率风险。
请参阅本年度报告表格20-F中包含的我们经审计的综合财务报表附注30。
货币风险
我们在国际上经营,在以外币经营时面临货币风险,特别是在美元方面。货币风险与未来的商业交易、确认的资产和负债以及外国业务的净投资有关。
我们在国外经营中持有几笔投资,其净资产面临货币风险。影响我们海外业务以美元计算的净资产的货币风险主要通过相关外币借款来缓解。我们面临的主要货币风险敞口是美元,在我们相当大比例的外币交易中使用了美元。
如果美元兑欧元在2024年12月31日和2023年12月31日走强10%,权益将分别增加10.679亿欧元和8.206亿欧元,利润将分别减少27.0和20.1百万欧元。该分析假设所有其他变量保持不变,尤其是利率保持不变。在所有其他变量保持不变的情况下,美元兑欧元在2024年12月31日和2023年12月31日贬值10%将对上述金额产生相反的影响。
我们使用套期会计来部分对冲我们的货币风险敞口。见本年度报告表格20-F所载经审核综合财务报表附注30(c)。
利率风险
我们的利率风险来自流动和非流动借款。浮动利率借款使我们面临现金流利率风险。管理利率风险的目的是平衡债务结构,将部分借款维持在固定利率水平,对冲部分浮动利率债务。
截至2024年12月31日,我们的浮动利率(SOFR和EURIBOR)债务占我们总债务的29.0%(2023年12月31日为43.0%),主要包括优先担保债务。见第一部分第3项,“关键信息—— D.风险因素——与公司和我们业务相关的风险——我们容易受到利率变化的影响。”另见本年度报告表格20-F所载经审核综合财务报表附注21(b)及30(c)(四)
188
截至本年度报告日期,我们没有参与欧元或美元的利率对冲。在前几年,利率互换的公允价值,收缩以减少浮动利率(SOFR和EURIBOR)上升的影响,按月入账。这些衍生金融工具符合套期会计要求。
如果2024年12月31日利率高出100个基点,利息支出将增加2370万欧元。如果利率在2024年12月31日下降100个基点,则上述金额会产生相反的效果。由于我们没有任何对冲衍生工具,对现金利息支付的净影响将增加相同数量。
市场价格风险
我们面临原材料方面的价格风险,这种风险由于血液衍生物业务在一个高度集中的行业进行垂直整合而得到缓解。
项目12.权益类证券以外的证券的说明
a. |
债务证券 |
不适用。
b. |
认股权证及权利 |
不适用。
c. |
其他证券 |
不适用。
d. |
美国存托股票 |
德意志银行信托公司Americas担任我们A类ADS和B类ADS的存托人,其主要执行办公室位于60 Wall Street,New York,NY 10005,USA。托管人为德意志银行 Sociedad An ó nima Espa ñ ola,其在西班牙的主要办事处位于Ronda General Mitre 72-74,08017 Barcelona,Spain。
每份A类ADS代表有权获得Grifols一股A类普通股的一半。每份B类ADS代表获得Grifols一股B类无投票权优先股的权利。
189
以下是A类ADS和B类ADS各自的存款协议的费用规定摘要。想了解更完整的信息,你应该完整阅读每一份存款协议。
连带费用 |
|
保存行动 |
每100份ADS(或100份ADS的一部分)5.00美元(或更少) |
发行ADS,包括因分配股份或权利或其他财产而产生的发行。以提现为目的注销ADS,包括在存款协议终止的情况下。 |
|
每100个ADS(或100个ADS的一部分)2.00美元(或更少) |
派发现金所得款项,包括派发现金股息或出售权利及其他应享权利。 |
|
每个日历年每100个ADS(或100个ADS的一部分)2.00美元(或更少),但这一费用与现金收益分配费用(包括现金股息或出售权利和其他权利)相结合时,在任何日历年不得超过每100个ADS(或100个ADS的一部分)2.00美元(或更少) |
存管运维成本。 |
|
每100份ADS年费1.00美元 |
检查有关股份登记册。 |
|
注册或转让费用 |
当您存入或提取我们的股份时,将我们的股份在其股份登记册上转让或登记至存托人或其代理人的名下。 |
|
保存人的开支 |
电缆、电传和传真传输(在订金协议中明确规定的情况下)。外币兑换美元。 |
|
存托人或托管人必须为任何ADS或ADS基础股份支付的税款和其他政府费用,包括任何适用的利息和罚款以及任何股份转让或其他税款或政府费用,例如股票转让税、印花税或预扣税 |
视需要。 |
|
存托人因遵守适用的外汇管制和其他法规兑换外币、交付已存入证券而产生的任何费用和开支,包括中央存管机构的任何费用,以及存托人可能不时产生的任何额外费用、收费、成本或开支 |
视需要。 |
|
保存人可能不时招致的任何额外费用、收费、成本或开支。 |
视需要。 |
存托人直接向为退出目的而存入股票或交出我们的ADS的投资者或向代理他们的中介机构收取其发行和注销我们的ADS的费用。存托人通过从分配的金额中扣除这些费用或通过出售部分可分配财产来支付费用来收取向投资者进行分配的费用。存托人可以通过现金分配扣除、直接向投资者开单或者向参与者代理的记账式系统账户收取存托人服务年费的方式收取。保存人一般可以拒绝提供吸引费用的服务,直到其对这些服务的费用得到支付。
190
我们的ADS持有人可能需要支付的费用和收费可能会随着时间的推移而变化,并且可能会由我们和存托人进行更改。我们的ADS持有者将收到此类变更的事先通知。
保存人向Grifols支付的费用
作为存托人的德意志银行信托公司Americas已同意偿还或代表Grifols支付与我们的ADR计划相关以及我们与这些计划相关的某些合理费用,例如投资者关系活动以及持续的维护费用和上市费用。它已支付了我们在2024年期间发生的所有此类费用,金额为260万美元。存托人偿还或支付的金额与其向ADS持有人收取的费用没有必然联系。
术语汇总表
“340B计划”是指根据《小灵通法案》第340B条建立的联邦医疗保健计划,该计划要求参与Medicaid的制造商同意以大幅降低的价格向涵盖的实体提供门诊药物,包括各种社区健康诊所和接受某些政府医疗保健赠款的某些其他实体,以及为某些低收入个人、某些癌症中心、儿童医院、重症接诊医院和农村转诊中心提供不成比例的服务的医院。
“AAT”意为α 1-抗胰蛋白酶,一种保护肺部的蛋白质。
“ACA”是指经修订的美国《平价医疗法案》和《伴随的医疗保健和教育和解法案》,两项法案均于2010年3月颁布。
“AlphaID”是一种免费的面颊拭子,用于检测患者的α-1缺乏症。
“AEMPS”指的是西班牙药品和医疗产品管理局。
“AMP”通常是指根据联邦法规中规定的方法定义的制造商平均价格,即批发商和其他大型采购商向制造商支付医疗补助覆盖的某些门诊处方药的费用,除其他外,用于帮助计算某些药品制造商支付的回扣,这些回扣由美国和州政府共享,用于医疗补助覆盖的门诊药物。
“阿尔茨海默病”是最常见的痴呆症。这种无法治愈的、退行性的、绝症的疾病于1906年由德国精神病学家和神经病理学家Alois Alzheimer首次描述,并以他的名字命名。
“白蛋白”是最丰富的血浆蛋白,在肝脏中产生,在所有血浆中占很大比例。白蛋白通常占人体血浆的60%左右。它通过维持血舱的溶瘤压力,在调节血量方面具有重要意义。
“ASP”是指医保B部分覆盖的某些门诊药品的平均销售价格,用于帮助计算此类药品的报销。
“检测”是旨在检测抗体、抗原或感染因子核酸的系统。例如,WNV检测检测献血中是否存在西尼罗河病毒。用于血液筛查的主要分析类型是免疫分析和核酸技术,或NAT分析。
“ATIII”是指肌内(超免疫)免疫球蛋白。
“A1PI”是指α-1蛋白酶抑制剂。
“BIDSXT”是指一种软件工具,允许分析、解释和数据库管理将结果传输给LIS。
191
“BLA”(Biologics License Application)是FDA颁发的生物许可申请,作为某些生物药产品的美国上市许可。
“BlisPack”吸塑处理机。
“BLOODChip”血型基因分型测试由Progenika制造,该公司是Grifols拥有多数股权的一家公司。
“最优惠价格”通常是指针对特定购买者,例如批发商、零售商、医疗保健提供者和其他指定实体,根据联邦法规中规定的方法定义的最低价格,可从制造商处获得由Medicaid报销的某些门诊药物。除其他外,Best Price用于帮助计算某些药品制造商支付的回扣,这些回扣由美国和州政府分享,用于医疗补助覆盖的门诊药物。
“CCPR”指的是美国加利福尼亚州通过的一项法规《加州消费者保护法》。
“CFIUS”指美国外国投资委员会。
“cGMP”是指当前的良好生产规范。
“CIDP”是指慢性炎症性脱髓鞘多发性神经病,这是一种导致虚弱、麻木、疼痛和行走困难的神经系统疾病。
“肝硬化”是一种由晚期肝病导致的病症。其特点是肝组织被纤维化(疤痕组织)和再生结节(由于试图修复受损组织而出现的肿块)所取代。
“先天性Alpha-1抗胰蛋白酶缺乏症”是一种遗传性疾病,其特征是血液中的物质Alpha-1抗胰蛋白酶或AAT水平降低。这种物质是一种蛋白质,通常由肝脏制造,释放到血液循环后到达其他器官(如肺)。
“CLL”是指慢性淋巴细胞白血病。
“CMS”指的是美国医疗保险和医疗补助服务中心。
“CMV”是指巨细胞病毒,一种感染所有年龄段人群的常见病毒。
“CNMV”是指国家商业委员会(Commisi ó n Nacional del Mercado de Valores)。
“CPI-U”是指城市全体消费者的居民消费价格指数,衡量的是城市消费者购买的一篮子商品和服务的价格变化。
“CPP”是医药产品的证书,是按照世界卫生组织推荐的格式颁发的证书,它确立了医药产品和证书申请人在相关出口国的地位。
“证监会”是指中国证监会。
“DHPR”是指二氢吡啶受体。
“糖尿病”是一种代谢性疾病,人的血糖高,要么是因为胰腺不能产生足够的胰岛素,要么是因为细胞对产生的胰岛素没有反应。
“DOJ”指的是美国司法部。
“ELISA”是指酶联免疫吸附试验。
192
“EMA”指的是欧洲药品管理局。
“Erytra Eflexis”是一款全自动中型分析仪,使用DG Gel技术进行输血前兼容性测试。
“VIII因子”或“FVIII”是一种必需的凝血因子,也被称为抗嗜血因子,即AHF。在人类中,因子VIII由F8基因编码。这种基因的缺陷会导致血友病A,这是一种与性别相关的疾病,主要发生在男性身上。捐献血浆中浓缩的FVIII,或替代重组FVIII,或rFVIII,可给予血友病患者恢复止血。
“IX因子”是一种重要的凝血因子,又称圣诞因子或血浆促凝血酶原激素组分,即PTC。它是凝血系统的丝氨酸蛋白酶之一,属于肽酶家族S1。在人类中,这种蛋白质的缺乏会导致B型血友病,这是一种与性别相关的疾病,主要发生在男性身上。
“FDA”是美国食品药品监督管理局。
“纤维蛋白密封胶”是一种外科用胶粘剂材料,可用于多种外科手术情况。
“分馏”是对等离子体进行分馏,或将其分离成其不同成分或等离子体衍生物的过程。
“FSS”指的是联邦供应计划,这是一个由美国退伍军人事务部管理的计划,为获得授权的政府用户提供折扣药品定价。
“GMP”是指良好的生产规范。
“GPO”即团购组织。
“GDPR”是指欧盟法规《通用数据保护条例》。
“Gri-fill system”是一种柔性材料袋的无菌灌装工艺。
“HBV”是指乙肝病毒。
“HBC”是丙型肝炎病毒的意思。
“血液学”是对血液、造血器官、血液疾病的研究。
“血红素”是一种通过人血浆分馏得到的物质。
“A型血友病”是凝血因子VIII的遗传缺陷,导致出血增加(通常影响男性)。
“止血”是导致出血过程停止的复杂过程。它指的是将血液保持在受损血管内的过程(止血的反面是出血)。大多数情况下,这包括血液从液体转变为固态。完整的血管是缓和血液凝结倾向的核心。止血有三个主要步骤:1)血管收缩,2)用血小板塞子暂时阻断断裂,3)血液凝固,或形成一个封闭孔洞的凝块,直到组织得到修复。
“HHS”是指美国卫生与公众服务部。
“HIPAA”是指经修订的1996年《美国健康保险携带和责任法案》及其下颁布的法规,一项美国健康信息隐私、安全和违规通知。
“HIV”是指人体免疫缺陷病毒。
193
“HRSA”是指卫生资源与服务管理局,是HHS的下属机构,除其他外,负责监督340B计划。HRSA主要负责确保没有保险的人获得医疗保健服务,包括通过赠款资助计划。
“IFX”意为英夫利昔单抗,一种用于治疗克罗恩病和溃疡性结肠炎的药物。
“IG”是指免疫球蛋白,它包含从血浆中提取的汇集后的IGG(免疫球蛋白(抗体)G)。
“免疫血液学”是血液学的一个分支,涉及抗原和抗体及其对血液的影响以及血液紊乱与免疫系统之间的关系的研究。
“免疫学”是生物医学科学的一个广泛分支,涵盖了生物体免疫系统各个方面的研究。它涉及免疫系统在健康和疾病状态下的生理功能;免疫系统在免疫性疾病(自身免疫性疾病、超敏反应、免疫缺陷、移植排斥)中的功能障碍;免疫系统成分在体外、原位和体内的物理、化学和生理特征。
“IND”是指研究性新药申请,这是在某些药物申办者开始涉及人类受试者的临床试验之前必须被FDA接受并有效的申请。
“IRB”是指机构审查委员会、批准和监督临床试验的监督委员会,以保护人类受试者的权利和福利。
“ITP”是指特发性血小板减少性紫癜。
“IVIG”是指静脉注射免疫球蛋白,是一种静脉给药的血液制品。它含有从血浆中提取的汇集IgG(免疫球蛋白(抗体)G)。它主要用于四大类治疗:(i)免疫缺陷,(ii)炎症和自身免疫性疾病,(iii)神经系统疾病和(iv)急性感染。
“川崎病”是一种罕见的自身免疫性疾病,主要影响儿童,会引起血管炎症、发热和皮疹。这种病可以用IVIG治疗。
“Koate-DVI”是一种用于控制和预防VIII因子水平低(A型血友病)人群出血发作的药物。
“LIS”是指实验室信息系统。
“医疗补助”是美国一项面向低收入和有资源的个人的社会医疗保健计划。
“医疗保险”是一项美国联邦医疗保险计划,适用于65岁及以上的个人和某些年轻的残疾人士。
“Medicare Part B”是Medicare计划的一部分,通常是为医生和其他医疗保健从业者等医疗服务以及某些门诊服务、设备、用品和某些药物提供按服务收费的报销,包括医生管理的药物和在医院门诊环境中提供的药物。
“医疗保险D部分”是医疗保险计划的一部分,通常包括品牌名称和非专利处方药的可选保险分配给医疗保险受益人,通常由零售药店提供。比如,Medicare C部分,Medicare D部分是由与Medicare签约的私人健康保险公司提供的。参加Medicare D部分的个人一般可以选择通过独立的处方药计划,或通过提供包括药物在内的综合医疗覆盖的Medicare C部分处方药计划获得福利。
“MM”是指多发性骨髓瘤。
194
“MRB”指的是Market Research Bureau,Inc.,这是一家独立的市场研究公司,在全球范围内提供血液和血浆制品行业数据。
“NAT”即核酸检测。
“NVD”是指股份和资产协议,与诺华疫苗和诊断公司执行。
“OIG”是监察长的HHS办公室,负责保护HSS计划的完整性,包括医疗保险和医疗补助计划。
“孤儿药”是专门为治疗一种罕见的医学疾病而开发的药剂,这种疾病本身被称为孤儿疾病。将孤儿身份分配给一种疾病以及为治疗这种疾病而开发的任何药物是许多国家的公共政策问题,并导致了由于药物研发的经济性而可能无法实现的医学突破美国1983年1月在国家罕见疾病组织的游说下通过的《孤儿药物法案》(ODA),意在鼓励制药公司为市场很小的疾病开发药物。根据该法律,开发这种药物(一种针对在美国影响不到20万人的疾病的药物)的公司可能会被授予七年的市场独占权,并可能获得临床试验税收优惠。
“开放式支付计划”对药品和医疗设备制造商提出了新的报告和披露要求,涉及向某些美国覆盖的医疗保健从业者(如医生)和学术医疗中心进行的付款或其他价值转移,以及此类从业者在报告实体中持有的某些所有权权益。
“PDUFA”是《处方药用户费用法案》,对某些人类药物应用程序征收用户费用。
“血浆”是血液中的液体部分。等离子体大部分由水组成。剩下的是必要的蛋白质和抗体,有助于维持我们身体的重要功能。缺乏这些血浆蛋白中的任何一种,例如白蛋白或免疫球蛋白,都可能导致许多危及生命的疾病之一。
“血浆置换术”是一种将血浆与其他血液成分,如红细胞、血小板和其他细胞分离的技术。这些未使用的血液成分被悬浮在盐水溶液中,并在血浆采集过程进行时立即重新注入捐献者体内。由于捐献者提供的只是血浆而不是全血,因此康复过程更快、耐受性更好,捐献者因此能够更频繁地进行捐献。血浆置换术是由Jose Antonio Grifols Lucas在1951年开发的。它是唯一能够获得足够数量的血浆以满足制造我们许多不同血浆蛋白疗法的需求的程序。
“血浆衍生物”是在人体血浆中发现的蛋白质,一旦分离纯化,就具有治疗价值。
“PTC”是指血浆促凝血酶原激素组分。
“Prolastin”是一种浓缩形式的α 1-抗胰蛋白酶,即AAT,由Grifols生产,来源于人的血浆,仅被批准用于由遗传性AAT缺乏引起的肺气肿患者的慢性或正在进行的替代治疗。按规定给药,Prolastin可提高血液和肺部的AAT水平。提高AAT水平,或许有助于减少破坏性酶对肺部造成的损害。
“Promonitor”高特异性ELISA试剂盒,用于量化各种生物药的血清药物水平和抗药物抗体
“Q-coagulometer,Q-smart Q-next和Q-expert分析仪”全自动止血分析仪,使用试剂测量血凝水平。
“RFID”是指射频识别。
“RNA”是指核糖核酸。
195
“SCAP”是指重症社区获得性肺炎。
“SCIG”是指皮下免疫球蛋白,是一种皮下给药的血液制品。它包含从血浆中提取的汇集IgG(免疫球蛋白(抗体)G),主要用于四大类的治疗:(i)免疫缺陷,(ii)炎症和自身免疫性疾病,(iii)神经系统疾病和(iv)急性感染。
“中小企业”是指中小企业。
“SYK-抑制剂”是指一组新的小分子抑制剂,已被提出用于治疗淋巴瘤和慢性淋巴细胞白血病。
“TMA”是转录介导的扩增,这项技术允许临床实验室以更少的步骤、更少的处理时间和更快的结果进行血液筛查的检测。应用于分子生物学、法医学、医学等领域,用于病原菌的快速鉴定和诊断。
“treatment-naive”是指,就任何人而言,这类人从未因特定病情、药物或疗法而接受过治疗。
“Triturus分析仪”用于ELISA(酶联免疫吸收剂测定)的开放式全自动分析仪,具有多测试/多批次能力的测试。
“血管性血友病”是人类描述的最常见的遗传性凝血异常,尽管它也可能是其他医疗条件导致的结果。它是由血管性血友病因子(一种血小板粘附所需的多聚体蛋白)的质或量缺陷引起的。
“WADiana/Erytra分析仪”是指使用凝胶凝集技术实现DG凝胶自动处理的自动化免疫血液分析仪®血液决定卡。
“世卫组织”指的是世界卫生组织。
196
第二部分
项目13.违约、拖欠股息和拖欠
没有。
项目14.对证券持有人权利和所得款项用途的重大修改
没有。
项目15.控制和程序
a. |
评估披露控制和程序 |
我们的首席执行官(“CEO”)和我们的首席财务官(“CFO”)在评估了截至本年度报告表格20-F所涵盖期间结束时我们的披露控制和程序(定义见《交易法》规则13a-15(e)和15d-15(e))的有效性后得出结论,截至该日期,由于下述重大缺陷,我们的披露控制和程序并不有效。
b. |
先前披露的材料弱点 |
在2023财年,我们发现了与信息技术一般控制(“ITGC”)相关的重大弱点,以及对某些日记账分录的审查和批准缺乏控制。在2024年期间,我们对财务报告的内部控制进行了某些更改,以解决我们在2023年发现的重大弱点。我们的首席执行官和首席财务官,连同审计委员会:
(1)就ITGC和政策的重要性为控制所有者举办了培训课程,重点是角色和责任,以及制定和维护文件。
(2)制定了增强的风险评估程序和控制措施,以改进财务相关IT系统和支持工具的识别。
(3)设计并实施了对访问安全和变更管理的额外控制。
(4)设计并实现了人工日记账分录审核自动化审批工作流程以及支持审批工作流程操作的人工和自动化控制。
由于相关控制措施已经设计、实施并在足够的时间内有效运作,管理层,包括我们的首席执行官和首席财务官,得出结论认为,截至2024年12月31日,上一年发现的两个重大弱点已得到纠正。
197
c. |
管理层关于财务报告内部控制的报告 |
我们的管理层在首席执行官和首席财务官的监督下,负责根据《交易法》规则13a-15(f)和15d-15(f)建立和维护对财务报告的充分内部控制。我们的内部控制系统旨在为财务报告的可靠性和根据公认会计原则编制已公布的财务报表提供合理保证。对于GRIFOLS, S.A.而言,“一般接受会计原则”是指由IASB发布的国际财务报告准则。
我们对财务报告的内部控制包括以下政策和程序:(i)与维护记录有关,这些记录以合理的细节准确和公平地反映我们公司资产的交易和处置;(ii)提供合理保证,交易记录是必要的,以允许根据公认会计原则编制财务报表,并且我们公司的收支仅根据我们公司管理层和董事的授权进行;以及(iii)就防止或及时发现未经授权的收购提供合理保证,使用或处置可能对财务报表产生重大影响的我们公司资产。
任何内部控制制度,无论设计得多么好,都有其固有的局限性,包括可能发生人为错误和规避或压倒控制和程序,这可能无法防止或发现错报。
我们的管理层评估了截至2024年12月31日我们对财务报告的内部控制的有效性。在进行这一评估时,我们使用了Treadway委员会发起组织委员会发布的《内部控制-综合框架(2013年)》(“COSOF框架”)中确立的标准。根据我们在这些标准下的评估,我们的管理层确定,截至2024年12月31日,我们对财务报告的内部控制不有效,原因如下文所述的重大弱点。
重大缺陷是指财务报告内部控制的缺陷或缺陷的组合,从而有合理的可能性无法及时防止或发现注册人年度或中期财务报表的重大错报。
2024年期间,在编制合并财务报表期间发现了复杂交易的会计核算错误。这些错误导致对截至2022年12月31日和2023年12月31日止年度的比较财务信息进行重述,如2024年12月31日财务报表附注2.d所述。这些错误陈述是由于以下重大弱点造成的:
COSOO框架的控制环境部分存在重大缺陷,因为公司缺乏与复杂交易相关的充分资源补充,在编制合并财务报表时需要做出重大判断。
2025年整治计划
我们的管理层制定了几个步骤,以改善对需要重大判断的复杂交易的控制,并继续监测已设计和实施的控制的成熟度和运营有效性。
为此,我们的管理层计划实施适当的纠正措施,包括:
198
(2)继续与外部公司接洽,协助对需要重大判断的复杂交易进行会计处理。
(3)加强权力和责任,在参与财务报告的部门和团队之间建立问责制,并对编制合并财务报表时需要作出重大判断的复杂交易进行会计核算的内部控制。
随着我们继续评估并努力补救导致实质性弱点的控制缺陷,我们可能会确定需要额外的措施或时间来解决控制缺陷,或者我们需要修改或以其他方式调整上述补救措施。一旦适用的控制措施运行了足够长的时间并且管理层能够通过测试得出控制措施有效运行的结论,就会认为实质性弱点得到了补救。
D.注册会计师事务所的鉴证报告
Deloitte Auditores,S.L.,一家独立注册会计师事务所,也审计了集团2024年的合并财务报表,已审计了Grifols S.A.对财务报告的内部控制的有效性,并就此出具了一份负面审计报告,该报告载于截至2024年12月31日的财政年度表格20-F年度报告第F-4页。
E.财务报告内部控制的变化
除上述变动外,在本年度报告表格20-F所涵盖的期间内,我们对财务报告的内部控制没有发生任何已对我们的财务报告内部控制产生重大影响或合理可能产生重大影响的变化。
199
项目16. [保留]
项目16.审计委员会财务专家
董事会已确定í ñ igo S á nchez-Asia í n Mardones先生是20-F表16A项所定义的“审计委员会财务专家”,并且是《交易法》第10A-3条规定的独立董事。
项目16.道德守则
我们采纳了员工行为准则,该准则适用于我们的所有员工、董事和高级管理人员,包括我们的首席执行官、首席财务官和首席会计官。这一守则(可在我们的网站www.grifols.com上查阅)旨在满足表格20-F第16B项下“道德守则”的定义。
如果《Grifols员工行为准则》被修订,或者被授予豁免,我们将在我们的网站上披露此类修订或豁免。
项目16.国民账户会计费用和服务
下表列出就2024年和2023年提供的服务向Deloitte Auditores,S.L.、我们的主要会计师或同一组织的成员支付的总费用:
|
2024 |
|
2023 |
|
(单位:千欧元) |
||||
审计 |
6,749 |
|
189 |
|
审计相关费用(1) |
1,201 |
|
— |
|
合计 |
7,950 |
|
189 |
|
(1) |
与审计相关的费用包括与执行审计或审查注册人财务报表合理相关的总会计师的鉴证和相关服务的费用,包括根据适用的会计准则对中期财务报表和财务报表的审计进行有限的审查。 |
下表列出了2024年和2023年就所提供服务向其他审计员支付的费用总额,并按服务类别细分了这些金额:
|
2024 |
|
2023 |
|
(单位:千欧元) |
||||
审计服务 |
|
22 |
|
5,651 |
审计相关 |
|
— |
|
1,951 |
税务顾问费 |
|
— |
|
4 |
合计 |
|
22 |
|
7,733 |
审批前政策与程序
在独立审计师根据西班牙法律获得股东批准的情况下,审计委员会就独立审计师的任命、聘用和更换向董事会提出建议。审计委员会还直接负责独立审计师的薪酬和工作监督。根据西班牙《审计法》和2002年《萨班斯-奥克斯利法案》,我们制定了关于外部审计员聘用专业服务的政策。这项政策一般规定,我们不会聘请我们的独立审计师提供审计或非审计服务,除非该服务事先得到审计委员会的特别批准。
根据预先批准政策,我们的主要会计师或其任何关联公司为我们提供的所有审计和允许的非审计服务均获得审计委员会的批准,该委员会得出结论认为,独立会计师提供此类服务与维持该事务所在履行其审计职能方面的独立性相一致。
200
项目16.免除审计委员会的列名标准
不适用。
项目16.发行人和关联购买者购买股票
截至2024年12月31日止年度,我们没有回购任何股本证券。
截至2024年12月31日,我们持有3,944,430股A类股和3,201,374股B类股库存。2024年,我们向符合条件的员工交付了1,316,825股B类库存股,作为限制性股票单位保留计划的补偿,其中212,790股给予了GRIFOLS, S.A.员工。见本年度报告所载我们经审计的综合财务报表附注29。
项目16.登记人核证账户的FCHANGE
不适用。
项目16.全球公司治理
根据纳斯达克上市规则,作为外国私人发行人,我们可以选择遵循我们本国的惯例,以代替纳斯达克上市规则5600系列的公司治理要求,但根据纳斯达克上市规则5615(a)(3)的规定需要遵守的规则除外。在纳斯达克上市规则5615(a)(3)允许的范围内,我们选择遵循西班牙的做法,以代替纳斯达克上市规则5600系列的要求。下文概述了我们根据西班牙法律遵循的公司治理实践(截至2024年12月31日生效)与在纳斯达克上市的美国国内发行人遵循的显着差异。
公司治理
根据纳斯达克上市规则,美国国内发行人必须为任何普通股持有人会议确定其章程中规定的法定人数,但前提是该法定人数不得低于有表决权股票已发行股份的33%。《公司章程》规定,在我们的一般股东大会第一次召集时,正式组成的会议要求至少达到我们有表决权的认缴股本的25%的法定人数,并且,如果第一次召集时未达到法定人数,则在第二次召集时有效召开会议,无论出席的股本如何。然而,某些重大公司行动(例如发行额外普通股、增加或减少我们的股本、发行债务证券、修订公司章程或批准合并交易)需要股东在一次会议上批准,在该会议上,我们至少50%的已认购有表决权的股本在第一次电话会议上出席或代表,或至少25%的有表决权的股本在第二次电话会议上出席或代表。然而,当出席我们会议的股东人数占我们有表决权的认缴股本的50%以下时,有关任何该等重大公司行动的决议必须以出席或代表出席该会议的股本的至少三分之二的赞成票通过。
此外,《公司章程》第6条之二所述的所有被视为影响我们B类股经济权利的行为,必须在股东大会上获得至少B类股多数股东的批准。
根据纳斯达克上市规则,美国国内发行人被要求征集代理,为所有股东大会提供代理声明,并向纳斯达克提供此类代理材料的副本。作为一家外国私人发行人,我们一般不受SEC关于征集股东代理人的规则的约束。然而,根据西班牙法律和《公司章程》,我们必须至少在为每一次一般股东大会确定的日期前一个月在以下网站上发布会议召集:(i)商业登记处的官方公报或我们所在省份(目前为西班牙巴塞罗那)广泛发行的当地报纸之一;(ii)CNMV的网站;以及(iii)我们的网站。我们向美国股东分发会议通知副本和代理表格,并在会议召开前通过我们的网站提供这些材料。
201
根据纳斯达克上市规则,美国国内发行人的股东必须有机会就股权补偿计划及其重大修订进行投票,纳斯达克上市规则中规定了有限的例外情况,包括遵循本国法律的外国私人发行人的例外情况。根据西班牙法律,涉及发行我们证券的股权补偿计划需要事先获得股东批准。此外,我们的高级职员和员工参与的股权薪酬计划可以由董事会批准,而无需股东批准。不过,设立董事会成员参与的股权补偿方案,必须得到《公司章程》的授权,并需股东事先在股东大会上批准。
根据纳斯达克上市规则,美国国内发行人的股东必须批准发行证券,如果这种发行将导致该发行人的控制权发生变化。根据西班牙法律,我们证券的任何发行,无论此类发行是否会导致控制权变更,都需要事先获得股东批准。
在西班牙,有证券在西班牙证券交易所上市的公司有:
(i)建议遵循CNMV治理守则的规定;
(二)法律要求在其网站上发布公司治理年度报告以及公司治理信息;
(iii)法律规定须刊发董事会成员的薪酬年度报告;及
(iv)法律要求遵守经修订的《西班牙公司法》中关于审计委员会以及任命和薪酬委员会的规定。
董事会惯例
董事的独立性
根据纳斯达克上市规则,美国上市公司的多数董事被要求“独立”,这一术语由纳斯达克上市规则定义。作为一家外国私人发行商,我们免于此类要求,西班牙法律不包含任何此类要求。
西班牙法律确立了董事的类别以及确定其独立性的不可或缺的要求。董事会条例与西班牙法律一致,承认两类主要董事:(i)执行董事;(ii)外部董事,可分为(a)专有董事、(b)独立董事和(c)不能被视为专有或独立的其他董事。
西班牙法律对“独立董事”的定义规定,下列人员不得被提名或指定为独立董事。
(i)任何集团公司的雇员或执行董事,除非自关系终止后已分别过去三年或五年。
(ii)除董事薪酬外,已从我们或集团收取若干款项的人士,除非所涉金额对董事而言并不重大。董事因先前受雇或专业服务而收到的股息或养老金补充不包括在内,前提是此类付款不是或有的(即,付款公司没有酌情权暂停、修改或撤销付款)。
(iii)在过去三年内曾是外聘核数师或负责审计报告的事务所的合伙人的人士,不论就我们或集团内任何其他公司在该等年度的审计而言。
(iv)我们的任何执行董事或高级管理人员担任外部董事的其他公司的执行董事或高级管理人员。
202
(v)在过去一年内与我们或集团内任何其他公司有或曾有重大业务关系的人士,不论是以其个人名义或作为有或曾有此种关系的公司的重要股东、董事或高级管理人员。就本款(五)而言,“业务关系”是指与商品或服务供应商的任何关系,包括财务、咨询和咨询服务。
(vi)实体的重要股东、执行董事或高级管理人员在过去三年内收到或已经收到来自我们或集团的重大捐赠。这一规定不适用于那些仅仅是接受捐赠的基金会受托人的人。
(vii)我们的一名执行董事或高级管理人员的配偶或保持类似关系的相关人士或近亲属。
(viii)任何未获委任及薪酬委员会建议委任或续任的人。
(ix)就重要股东或有董事会代表的股东而言,具有上述(i)、(v)、(vi)或(vii)所列任何情况的人。对于上述(vii)中所述的家庭关系,该限制不仅适用于股东,也适用于我们的专有董事。
(x)连续12年担任董事的人员。
因其所代表的股东出售股权而失去这一地位的自营董事,只有在该股东出售其股份总额后,才能连任独立董事。
最后,任何拥有我们股份的董事会成员都可以被视为独立,只要持股不重大并满足上述所有条件。
我们尚未确定我们的董事是否会根据纳斯达克上市规则被视为独立,但作为审计委员会成员的三名董事除外,因此必须符合纳斯达克的独立性标准。截至本报告日,根据《董事会条例》和CNMV治理准则,董事会六名成员为独立董事。
此外,我们遵循《西班牙公司法》,与纳斯达克上市规则不同,该法不要求独立董事在只有此类独立董事出席的情况下举行会议。
关于我们审计委员会的组成、职责和条款的详细讨论,见第一部分第6项,“董事、高级管理人员和员工—— C.董事会惯例——董事会各委员会——审计委员会。”
审计委员会
职责和条款。根据纳斯达克上市规则,我们的审计委员会负责为编制和发布任何审计报告、或执行其他审计审查或相关服务而聘用的任何注册会计师事务所的服务的任命、薪酬、保留和监督。尽管有上述规定,西班牙法律为我们的股东提供了在股东大会上任命和更换独立审计师的权力。
审计委员会的独立性。我们审计委员会的所有成员都符合纳斯达克上市规则中规定的独立性标准。在第31/2014号法律和第22/2015号法律生效后,西班牙法律要求(a)审计委员会由外部董事组成(其中大多数是独立的,其中一位是由于其在会计或审计事务方面的知识和经验而被任命的)和(b)审计委员会主席是独立董事。关于我们审计委员会组成的进一步讨论,见第一部分第6项,“董事、高级管理人员和员工—— C.董事会惯例——董事会各委员会——审计委员会。”
203
内部审计部门。我们设有内部审计部门,负责内部审计事项,并确保我们不同业务单位内部审计控制流程的效率。我们的内部审计部门直接向审计委员会报告,支持其充分履行所有职能。
委任及薪酬委员会
根据纳斯达克上市规则,外国私人发行人可豁免有关独立提名和薪酬委员会的要求。允许外国私人发行人在这方面遵循其母国公司治理实践。
西班牙法律要求,所有西班牙上市公司都有一个由外部董事组成的任命和薪酬委员会,其中至少两名董事必须是独立的,任命和薪酬委员会的主席必须是独立董事。
我们的任命和薪酬委员会完全由外部独立董事组成。有关我们的委任与薪酬委员会的详细讨论,请参阅第一部分第6项,“董事、高级管理人员及雇员—— C.董事会惯例——董事会各委员会——委任与薪酬委员会。”
关于证券市场和商业道德相关事项的内部行为准则
根据纳斯达克上市规则,我们必须采用适用于所有董事、高级职员和员工的商业行为和道德准则,这些准则必须公开。根据西班牙法律,上市公司此前被要求就证券市场相关事项制定内部行为准则。然而,随着2018年11月23日关于支付服务和其他紧急金融措施的第19/2018号王室立法法令生效,这一义务已被取消。
尽管如此,Grifols将继续适用董事会于2016年10月28日召开的会议上批准的证券市场内部行为准则,以防止内幕交易、不当行为,并控制可能的利益冲突。证券市场相关事项的内部行为准则作为附件 11.1包含在本年度报告中。
此外,董事会条例详细规定了董事在商业机会、使用Grifols资产、保密和不竞争方面的利益冲突方面的主要义务。尽管根据西班牙法律不是强制性的,但董事会还批准了Grifols员工行为准则。董事会条例和Grifols员工行为准则均不构成这份20-F表格年度报告的一部分,可在www.grifols.com上公开查阅。
项目16. HMINE安全披露
不适用。
项目16.关于阻止检查的外国法域的情况说明
不适用。
项目16.金赛得交易政策
我们制定了有关董事、高级管理层和员工购买、出售和其他处置我们证券的政策和程序。我们的内幕交易政策和程序已包含在我们的《证券市场相关事项内部行为准则》中,该准则作为附件 11.1附于本年度报告中。
204
项目16.KCYBERSECURITY
风险管理和战略
网络安全风险管理是我们整体企业风险管理方案的组成部分。我们的网络安全风险管理计划提供了一个处理网络安全威胁和事件的框架,包括与使用第三方服务提供商提供的服务相关的威胁和事件,旨在促进Grifols集团不同部门在处理此类网络安全威胁和事件方面的协调。该框架对网络安全采取基于风险的方法,与国际公认的框架保持一致,包括NIST(美国国家标准与技术研究院)和ISO 27001,并包括评估网络安全威胁的严重性、确定网络安全威胁的来源(包括网络安全威胁是否与第三方服务提供商相关联)、实施网络安全对策和缓解战略的步骤,以及如后面更详细解释的那样,向管理层和我们的董事会通报重大网络安全威胁和事件。
我们的安全运营中心(SOC)和事件响应团队(IRT)每天24小时运作,提供跨越我们的数据中心、边界和工作站的持续监控。SOC利用安全信息和事件管理(SIEM)系统,该系统处理警报并能够快速检测和响应网络安全事件。此外,我们的网络情报能力追踪新出现的威胁,允许采取主动缓解战略。
随着网络攻击的发展和变得更加复杂,我们加强了预防和监测工作。在过去几年中,我们加强了网络安全和信息安全措施,旨在确保充分保护我们的信息和支持业务流程的资产。我们的首席数字信息官(“CDIO”)的任务是加速我们的公司利用数字平台、数据科学和新技术来转变和加强关键业务活动,例如与血浆捐赠者和客户的关系以及制造业务、新疗法的开发和网络安全。
我们的网络安全政策旨在加强我们的数字安全框架。该政策侧重于维护安全和有弹性的系统、持续评估和缓解网络安全风险、实施保护措施以及适应技术变化。它还确保有效的事件响应和监管合规,支持合格的网络安全团队,为员工和高管提供培训,并促进与行业同行和政府机构的协作。
我们在过去几年采取了安全措施,意在:(i)确保业务流程的端到端保护,考虑到逻辑和物理安全、隐私和欺诈管理问题,(ii)确保符合设计原则的安全和隐私;(iii)从安全和用户体验的角度改进与在线服务相关的客户端访问控制和认证服务。我们的ISO 27001认证强调了我们对网络安全的承诺,反映了我们对数据安全最高标准的遵守。
为了保护我们的数字基础设施,我们采用了网络隔离策略,包括启用防火墙,将仪器与更广泛的网络隔离开来,只允许授权的数据流。我们的诊断系统利用应用程序白名单来阻止恶意软件并确保系统完整性。此外,我们对跨信息系统的连接和通信进行加密,以在传输过程中维护数据机密性,例如使用虚拟专用网络(VPN)。我们实施严格的用户访问控制,确保人员只访问其角色所需的数据。在我们的产品开发中,我们集成了先进的网络安全措施,以确保敏感数据得到安全保护。这一承诺延伸到我们的诊断解决方案,这些解决方案的设计特点是为我们的客户和利益相关者提供安心。
我们的方法包括持续识别和评估网络安全风险,对这些风险进行彻底分析,以确定当前和未来可能产生的影响。作为架构和服务演进的一部分,进行第三方评估。我们定期聘请多个服务提供商对我们的网络安全态势进行定期审查和评估。作为定期更新的一部分,我们将结果分享给IT和执行委员会。这些审查涵盖范围广泛的领域,包括但不限于信息技术系统复原力、网络安全风险评估、信息安全方案评估、外部威胁环境审查、内部网络安全政策合规性以及识别或不确认威胁行为者潜在参与的近期事件响应。我们保持着一支由管理、信息技术、法律专家组成的高素质网络安全团队。
205
此外,SOC运营和事件响应团队由网络安全领域的顶级公司提供,以确保拥有最合适的网络安全知识的配置文件,并具备处理事件管理、优先排序和事件解决等活动的适当能力。在对事件进行分类时,会考虑到影响、受影响的用户数量、泄露的信息类型、涉及的威胁行为者以及行业趋势等因素。此外,每月在与供应商的后续会议上审查事件,在每周的IT委员会会议上分享,并在网络安全委员会每月讨论。定期为员工、高管和董事举办培训计划,以提高人们对网络安全风险以及保护敏感和个人数据重要性的认识。
根据我们的持续改进承诺,我们更新了2025-2027年期间的网络安全总监计划。该计划勾勒出全面的路线图,以实现超过同行公司的网络安全成熟度水平。
在2024年12月17日的董事会会议上提出的计划概述了主要行动路线,按照西班牙国家标准与技术研究院(“NIST”)建立的领域分类:治理、识别、保护、检测、响应和恢复。
此外,我们不断开展与安全和隐私相关的培训和意识举措,促进员工的培训和意识活动。其中涉及的一些主题包括个人信息保护、安全密码管理、设备保护(笔记本电脑、智能手机等)、社会工程(钓鱼、smishing、vishing)、恶意软件等技术攻击检测、骗局检测、网购安全以及一旦出现安全事件如何应对。
截至本20-F表格年度报告之日,我们没有发现任何对我们的业务战略、运营结果或财务状况产生重大影响或合理可能产生重大影响的网络安全威胁,包括由于之前的任何网络安全事件造成的威胁。然而,尽管我们做出了努力,但我们无法消除来自网络安全威胁的所有风险,或者保证我们没有经历过未被发现的网络安全事件。有关这些风险的更多信息,请参阅第一部分第3项,“D.风险因素——与公司和我们业务相关的风险——网络攻击或其他隐私和数据安全事件可能会扰乱我们的业务,并使我们面临重大损失、责任和声誉损害。”
治理
我们的董事会,通过审计委员会,负责监督和评估对网络安全的控制和管理的效率。我们的内部审计和企业风险管理部支持审计委员会履行这一职责,其中包括监督我们的威胁形势、态势、绩效和与网络安全相关的战略。审计委员会还负责监督网络安全事件趋势和已处理的事件。由于2024年没有发生有影响的事件,因此没有与审计委员会进行沟通。如果发生具有影响的事件,信息安全办公室负责人将联系首席数字和信息官,后者将在执行委员会和内部审计中与相关方进行联络,以介绍事件和影响。同一受众将定期更新关于根本原因的信息,以及在即将召开的审计委员会会议之外实施的对策。
206
为支持部署我们的网络安全战略和流程的原则,我们创建并实施了信息安全流程和管理系统(“ISMS”)。ISMS基于对目标、角色和责任、政策和程序以及技术的适当定义,以:(i)识别网络安全威胁和相关风险;(ii)保护关键资产;(iii)检测和应对网络安全威胁和网络安全事件;(iv)因网络安全事件而恢复业务服务。
我们的信息安全办公室(“ISEC”)负责人向CDIO报告,并有权制定和实施我们的网络安全政策、标准、程序,并监督ISMS的实施和有效性。我们ISEC负责人有20多年网络安全实践经验,曾在“四大”会计师事务所从事风险管理实践工作九年,担任首席信息安全官和数据保护官。她是一名电信工程师,曾获得CISA、CISM和ISO首席审计员271001认证等。她还是西班牙ISMS论坛(La ASociaci ó n Espa ñ ola para el Fomento de la Seguridad de la Informaci ó n)的成员,并参加多个圆桌会议,与最新的网络安全趋势保持联系。我们的首席数字信息官拥有超过27年的跨多个行业工作经验,曾任职于世界百强企业,如IBM、宝洁、惠普和德国邮政DHL。我们还正在为我们新的全球网络安全委员会挑选和任命成员。该委员会将促进网络安全举措与业务目标保持一致;确保ISMS的全球覆盖;在安全举措和项目的优先顺序和执行方面开展合作;并在整个Grifols Group实体中促进防范网络安全威胁的文化。该委员会将由业务部门、信息技术和法律人员以及运营和服务领域的代表组成。
除了与包括律师、会计师和信息技术专家在内的各个领域的代表定期举行会议,以及持续开放的沟通渠道外,ISEC负责人和CDIO每年至少两次向审计委员会更新有关网络安全控制和管理的信息。
207
第三部分
项目17.财务报表
我们选择根据本第三部分第18项提供财务报表。
项目18.财务报表
本第三部第18项所规定的经审核综合财务报表于本年度报告第F-1页开始以表格20-F格式附后。我们的独立注册会计师事务所Deloitte Auditores,S.L.的审计报告于经审核综合财务报表之前载列于此。
项目19.展览
附件 |
|
说明 |
|---|---|---|
1.1 |
||
2.1 |
||
2.2 |
||
2.3 |
||
2.4 |
||
2.5 |
||
2025年到期的1.625%优先票据的表格(通过参考我们于2020年4月6日提交的20-F表格年度报告(文件编号001-35193)的附件 2.6并入本文) |
||
2027年到期的2.250%优先票据的表格(通过参考我们于2020年4月6日提交的20-F表格年度报告(文件编号:001-35193)的附件 2.6并入本文) |
||
2.6 |
||
208
附件 |
|
说明 |
|---|---|---|
2.7 |
||
2.8 |
||
2.9 |
||
2.10 |
||
2028年到期的美元4.750%优先票据表格(通过引用我们于2022年4月29日提交的20-F表格年度报告(文件编号:001-35193)的附件 2.9并入本文) |
||
2028年到期的3.875%欧元优先票据表格(通过参考我们于2022年4月29日提交的20-F表格年度报告(文件编号:001-35193)的附件 2.9并入本文) |
||
2.11 |
||
2.12 |
||
2.13 |
||
2.14 |
||
2.15 |
||
2.16 |
||
209
附件 |
|
说明 |
|---|---|---|
4.1 |
||
4.2 |
||
4.3 |
||
4.4 |
||
4.5 |
||
4.6 |
||
4.7 |
||
4.8 |
||
4.9 |
证券说明(通过参考我们于2021年4月9日提交的20-F表格年度报告(文件编号:001-35193)的附件 4.7并入本文) |
|
4.10 |
||
8.1 |
||
10.1 |
||
11.1 |
210
附件 |
|
说明 |
|---|---|---|
12.1 |
||
12.2 |
||
13.1 |
||
97.1 |
高管薪酬追回政策(通过参考我们于2024年4月19日提交的20-F表格年度报告(文件编号:001-35193)的97.1的附件并入本文) |
|
101 |
交互式数据文件 |
|
101.INS |
内联XBRL实例文档-实例文档不会出现在交互式数据文件中,因为它的XBRL标记嵌入到内联XBRL文档中 |
|
101.SCH |
内联XBRL分类学扩展架构 |
|
101.CAL |
内联XBRL分类法扩展架构计算linkbase |
|
101.DEF |
内联XBRL分类学扩展架构定义linkbase |
|
101.LAB |
内联XBRL分类学扩展架构标签linkbase |
|
101.PRE |
内联XBRL分类学扩展架构演示linkbase |
|
104 |
封面页交互式日期文件(格式为内联XBRL,包含在附件 101中) |
* |
随函提交。 |
211
212
F-1
F-2

独立注册会计师事务所的报告
致股东及董事会
GRIFOLS, S.A.:
关于合并财务报表的意见
我们审计了所附的GRIFOLS, S.A.及附属公司(本公司)截至2023年12月31日和2023年1月1日的合并资产负债表、截至2023年12月31日止两年期间各年度的相关合并损益表、综合收益表、现金流量表、合并权益变动表以及相关附注和附录一至五(统称为合并财务报表)。我们认为,合并财务报表按照国际会计准则理事会颁布的国际财务报告准则和欧盟采用的国际财务报告准则,在所有重大方面公允反映了公司截至2023年12月31日和2023年1月1日的财务状况以及截至2023年12月31日的两年期间各年度的经营业绩和现金流量。
更正错误
如综合财务报表附注(2)d)所述,2023及2022年度综合财务报表已重列以更正错误。
意见依据
这些合并财务报表由公司管理层负责。我们的责任是根据我们的审计对这些合并财务报表发表意见。我们是一家在美国上市公司会计监督委员会(PCAOB)注册的公共会计师事务所,根据美国联邦证券法以及证券交易委员会和PCAOB的适用规则和条例,我们被要求对公司具有独立性。
我们按照PCAOB的标准进行了审计。这些准则要求我们计划和执行审计,以获取关于合并财务报表是否不存在重大错报的合理保证,无论是由于错误还是欺诈。我们的审计包括执行程序以评估合并财务报表的重大错报风险,无论是由于错误还是欺诈,以及执行应对这些风险的程序。这些程序包括在测试的基础上审查有关合并财务报表中的数额和披露的证据。我们的审计还包括评估管理层使用的会计原则和作出的重大估计,以及评估合并财务报表的总体列报方式。我们认为,我们的审计为我们的意见提供了合理的基础。
/s/KPMG Auditores,S.L。
我们曾于1990年至2023年担任公司的核数师。
西班牙巴塞罗那
2025年4月11日
F-3

独立注册会计师事务所报告
致GRIFOLS, S.A.的股东和董事会,
关于合并财务报表的意见
我们审计了随附的GRIFOLS, S.A.及子公司(“公司”)截至2024年12月31日的合并资产负债表、截至2024年12月31日止年度的相关合并损益表、综合收益表、合并权益变动表、合并现金流量表及相关附注及附录一至五(统称“合并财务报表”)。我们认为,合并财务报表按照国际会计准则理事会颁布的《国际财务报告准则》,在所有重大方面公允地反映了公司截至2024年12月31日的财务状况以及该日终了年度的经营成果和现金流量。
我们还根据美国上市公司会计监督委员会(PCAOB)的标准,根据Treadway委员会发起组织委员会发布的《内部控制——综合框架(2013)》中确立的标准,对公司截至2024年12月31日的财务报告内部控制进行了审计,我们于2025年4月11日的报告对公司的财务报告内部控制发表了否定意见,因为存在重大缺陷。
意见依据
这些财务报表由公司管理层负责。我们的责任是在我们审计的基础上对公司的合并财务报表发表意见。我们是一家在PCAOB注册的公共会计师事务所,根据美国联邦证券法以及美国证券交易委员会和PCAOB的适用规则和条例,我们被要求对公司具有独立性。
我们按照PCAOB的标准进行了审计。这些准则要求我们计划和执行审计,以就合并财务报表是否不存在重大错报获取合理保证,无论是由于错误还是欺诈。我们的审计包括执行程序以评估合并财务报表的重大错报风险,无论是由于错误还是欺诈,以及执行应对这些风险的程序。这些程序包括在测试的基础上审查有关合并财务报表中的数额和披露的证据。我们的审计还包括评估管理层使用的会计原则和作出的重大估计,以及评估合并财务报表的总体列报方式。我们认为,我们的审计为我们的意见提供了合理的基础。
关键审计事项
下文通报的关键审计事项是合并财务报表当期审计产生的、已传达或要求传达给审计委员会的事项,(1)涉及对合并财务报表具有重要意义的账目或披露,(2)涉及我们特别具有挑战性、主观或复杂的判断。关键审计事项的沟通不会以任何方式改变我们对合并财务报表的意见,作为一个整体,我们也不会通过传达下文的关键审计事项,就关键审计事项或与其相关的账目或披露提供单独的意见。
F-4
评估诊断CGU(现金产生单位)商誉减值分析
关键审计事项说明
如合并财务报表附注6所述,截至2024年12月31日的商誉余额为7,403,056千欧元,其中2,844,911千欧元与诊断现金产生单位(CGU)有关。公司每年并在出现减值指标时评估商誉的可收回金额以及与每个现金产生单位相关的净资产,为此公司采用与预计收益和必要投资相一致的现金流量预测。
特别是,公司采用贴现现金流(DCF)法按公允价值减去出售成本计算诊断现金产生单位的商誉可收回金额。此外,公司获得外部估值报告(“外部估值”),与通过自身DCF模型获得的结果进行比较,作为价值的基准。
我们将对诊断现金产生单位的商誉减值分析的评估确定为关键审计事项,因为需要做出重大判断和加大审计工作,包括我们的估值专家的参与,以评估使用DCF模型进行的公司减值测试。DCF模型包括与销售额、EBITDA(息税折旧摊销前利润)和资本支出(资本支出)预测相关的假设,用于分子供体筛查(MDS)、血型分析解决方案(BTS)和临床诊断(CDX)业务线、永续增长率和贴现率。这些假设的微小变化可能会对公司确定商誉的可收回金额产生重大影响。
审计中如何应对关键审计事项
我们有关管理层评估商誉减值的审计程序包括以下内容,其中包括:
· |
我们了解了公司评估商誉可收回金额所遵循的流程,并测试了与公司商誉减值评估流程相关的某些内部控制的设计、实施和运营有效性。 |
· |
我们邀请了我们的估值专家,他们协助评估了: |
- |
公司在减值测试中采用的方法的合理性,包括对DCF数学准确性的验证。 |
- |
纳入公司DCF的诊断CGU折现率和永续增长率与可比主体公开市场数据对比的合理性。 |
- |
外部估值中使用的假设,其中包括通过检查可用的公开数据和行业报告对MDS、BTS和CDX业务线的预测。 |
· |
我们评估了公司对外签约进行估值作为业绩计算价值基准的能力、能力和客观性,以及对外方工作作为审计证据使用的充分性。 |
· |
我们通过将实际结果与历史预测以及上述各业务线销售预期的行业报告进行比较,评估了公司编制和审查MDS、BTS和CDX业务线预测预测的能力。 |
· |
我们对公司DCF中的销售额、EBITDA利润率、贴现率和增长率假设进行了敏感性分析,以评估它们对诊断现金产生单位可收回金额的影响。 |
F-5
· |
我们同意所附综合财务报表附注4.g和6中包含的与该事项相关的披露,包括上述关键假设的敏感性分析,与适用于本集团的监管财务报告框架要求的披露一致。 |
出售上海RAAS血液制品有限公司20%所有权权益
关键审计事项说明
如附注12所示,于2024年6月18日,集团完成出售上海RAAS血液制品有限公司(SRAAS)的20%所有权权益,出售价格为160.75万欧元。此外,如随附的综合财务报表附注29.e所示,此次出售还包括双方之间承担的其他义务。
上述交易的重要性,在此之前重述了2023年的比较数字,以便正确确认先前持有的股权的价值,以及考虑交易各方内部商定的不同义务所产生的影响,需要公司董事在确定会计影响时作出重大判断和估计,因此该事项在我们的审计中被确定为关键事项。
审计中如何应对关键审计事项
我们与出售上海RAAS血液制品有限公司20%所有权权益相关的审计程序包括以下各项,其中包括:
· |
我们了解了公司为识别金融工具销售合同产生的各种义务以及根据适用的监管财务报告框架对收到的对价进行相应分配所遵循的流程。 |
· |
我们测试了有关重大异常交易的某些控制的设计和实施。 |
· |
我们还获取并检查了各方之间执行的合同,测试管理层关于控制权转让的结论、所有权权益出售的确认时间,以及其金额和收到的对价的相应分配。 |
· |
我们对不同合同条款的会计影响进行了评估,并验证了所得结果对交易的算术正确性。 |
· |
我们评估了管理层在综合损益表中对销售的分类,并获得了支持收到金额的证据。 |
· |
最后,我们评估了所附合并财务报表附注12和29.e中包含的与此事项相关的披露是否符合适用的监管财务报告框架的要求。 |
/s/Deloitte Auditores,S.L。
西班牙巴塞罗那
2025年4月11日
我们自2024年起担任公司的核数师。
F-6

独立注册会计师事务所报告
致GRIFOLS, S.A.的股东和董事会,
关于财务报告内部控制的意见
我们根据Treadway委员会(COSOO)发起组织委员会发布的《内部控制— Integrated Framework(2013)》中确立的标准,对GRIFOLS, S.A.及其子公司(“公司”)截至2024年12月31日的财务报告内部控制进行了审计。我们认为,由于下文确定的重大弱点对实现控制准则目标的影响,截至2024年12月31日,公司未根据COSO发布的《内部控制——综合框架(2013)》中确立的标准对财务报告保持有效的内部控制。
我们亦已根据美国公众公司会计监督委员会(PCAOB)的标准,对公司截至2024年12月31日止年度的合并财务报表及我们日期为2025年4月11日的报告进行审计,对该等财务报表发表无保留意见。
意见依据
公司管理层负责维持有效的财务报告内部控制,并负责评估财务报告内部控制的有效性,包括在随附的管理层财务报告内部控制报告中。我们的责任是在我们审计的基础上,对公司财务报告内部控制发表意见。我们是一家在PCAOB注册的公共会计师事务所,根据美国联邦证券法以及证券交易委员会和PCAOB的适用规则和条例,我们被要求对公司具有独立性。
我们按照PCAOB的标准进行了审计。这些准则要求我们计划和执行审计,以获得关于是否在所有重大方面保持了有效的财务报告内部控制的合理保证。我们的审计包括了解财务报告内部控制,评估存在重大缺陷的风险,根据评估的风险测试和评估内部控制的设计和运行有效性,以及在当时情况下执行我们认为必要的其他程序。我们认为,我们的审计为我们的意见提供了合理的基础。
财务报告内部控制的定义和局限性
公司对财务报告的内部控制是旨在根据公认会计原则为财务报告的可靠性和为外部目的编制财务报表提供合理保证的过程。公司对财务报告的内部控制包括:(1)与维护记录有关的政策和程序,这些记录以合理的细节准确和公平地反映公司资产的交易和处置;(2)提供合理保证,交易记录是必要的,以允许按照公认会计原则编制财务报表,并且公司的收支仅根据公司管理层和董事的授权进行;(3)就防止或及时发现未经授权的获取、使用、或处置可能对财务报表产生重大影响的公司资产。
F-7
财务报告内部控制由于其固有的局限性,可能无法防止或发现错报。此外,对未来期间的任何有效性评估的预测都受到以下风险的影响:由于条件的变化,控制可能变得不充分,或者政策或程序的遵守程度可能恶化。
材料薄弱
重大缺陷是指财务报告内部控制的缺陷,或缺陷的组合,从而存在不能及时防止或发现公司年度或中期财务报表重大错报的合理可能性。已确定并纳入管理层评估的以下重大弱点:
COSOO框架的控制环境部分存在重大缺陷,因为公司缺乏与复杂交易相关的充分资源补充,在编制合并财务报表时需要做出重大判断。
在确定我们对公司截至2024年12月31日止年度的合并财务报表审计所采用的审计测试的性质、时间和范围时考虑了这一重大弱点,本报告不影响我们对此类财务报表的报告。
/s/Deloitte Auditores,S.L。
西班牙巴塞罗那
2025年4月11日
F-8
GRIFOLS,S.A.和子公司
合并资产负债表
截至2024年12月31日及2023年12月31日
(以千欧元表示)
物业、厂房及设备 |
|
参考 |
|
31/12/2024 |
|
31/12/2023 (*) |
|
1/1/2023 (*) |
商誉 |
注6 |
7,403,056 |
6,802,127 |
7,011,909 |
||||
其他无形资产 |
注7 |
2,926,132 |
2,832,196 |
2,949,147 |
||||
使用权 |
附注8 |
968,304 |
945,240 |
981,260 |
||||
物业、厂房及设备 |
附注9 |
3,341,846 |
3,247,123 |
3,302,858 |
||||
对权益核算被投资单位的投资 |
注10 |
68,996 |
421,763 |
1,497,959 |
||||
以公允价值计量的非流动金融资产 |
423,439 |
12,182 |
38,570 |
|||||
以摊余成本计量的非流动金融资产 |
67,053 |
164,494 |
458,043 |
|||||
非流动金融资产合计 |
附注11 |
490,492 |
176,676 |
496,613 |
||||
其他非流动合同资产 |
59 |
— |
— |
|||||
其他非流动资产 |
注10 |
137,141 |
135,633 |
124,191 |
||||
递延所得税资产 |
附注28 |
341,673 |
300,329 |
174,923 |
||||
非流动资产合计 |
15,677,699 |
14,861,087 |
16,538,860 |
|||||
持有待售的非流动资产 |
附注12 |
— |
1,089,856 |
4,969 |
||||
库存 |
附注13 |
3,560,098 |
3,482,399 |
3,236,010 |
||||
当前合同资产 |
附注14 |
35,978 |
47,751 |
35,154 |
||||
贸易和其他应收款 |
||||||||
应收账款 |
705,452 |
645,113 |
609,081 |
|||||
其他应收款 |
77,556 |
74,933 |
73,181 |
|||||
当期所得税资产 |
52,589 |
47,213 |
56,782 |
|||||
贸易和其他应收款 |
附注15 |
835,597 |
767,259 |
739,044 |
||||
其他流动金融资产 |
||||||||
以公允价值计量的流动金融资产 |
6,064 |
23,644 |
12,629 |
|||||
以摊余成本计量的流动金融资产 |
237,510 |
116,588 |
31,034 |
|||||
流动金融资产合计 |
附注11 |
243,574 |
140,232 |
43,663 |
||||
其他流动资产 |
72,515 |
73,942 |
82,677 |
|||||
现金及现金等价物 |
附注16 |
979,780 |
529,577 |
549,207 |
||||
流动资产总额 |
5,727,542 |
6,131,016 |
4,690,724 |
|||||
总资产 |
21,405,241 |
20,992,103 |
21,229,584 |
(*)重报数字(附注2.d)
随附的附注构成综合财务报表的组成部分。
F-9
GRIFOLS,S.A.和子公司
合并资产负债表
截至2024年12月31日及2023年12月31日
(以千欧元表示)
权益与负债 |
|
参考 |
|
31/12/2024 |
|
31/12/2023 (*) |
|
1/1/2023 (*) |
股本 |
119,604 |
119,604 |
119,604 |
|||||
股份溢价 |
910,728 |
910,728 |
910,728 |
|||||
储备金 |
4,054,505 |
4,040,961 |
4,053,156 |
|||||
库存股票 |
(134,448) |
(152,748) |
(162,220) |
|||||
年内归母溢利 |
156,920 |
42,318 |
— |
|||||
股东权益合计 |
5,107,309 |
4,960,863 |
4,921,268 |
|||||
现金流量套期 |
(270) |
998 |
(438) |
|||||
其他综合收益 |
(8,787) |
(9,117) |
(8,084) |
|||||
持有待售非流动资产产生的其他综合收益 |
— |
1,520 |
— |
|||||
金融工具估值产生的其他综合收益 |
附注11 |
(18,351) |
— |
— |
||||
翻译差异 |
803,826 |
414,112 |
735,777 |
|||||
其他综合费用 |
776,418 |
407,513 |
727,255 |
|||||
归属母公司权益 |
附注17 |
5,883,727 |
5,368,376 |
5,648,523 |
||||
非控股权益 |
附注19 |
2,723,298 |
2,145,319 |
2,327,606 |
||||
总股本 |
8,607,025 |
7,513,695 |
7,976,129 |
|||||
负债 |
|
|||||||
赠款 |
13,944 |
13,807 |
15,123 |
|||||
规定 |
附注20 |
125,048 |
116,925 |
110,063 |
||||
非流动金融负债 |
Nota 21 |
9,490,644 |
10,033,604 |
10,074,155 |
||||
其他非流动负债 |
730 |
— |
15 |
|||||
递延所得税负债 |
Nota 28 |
1,011,704 |
988,629 |
1,034,823 |
||||
非流动负债合计 |
10,642,070 |
11,152,965 |
11,234,179 |
|||||
规定 |
附注20 |
38,613 |
47,806 |
56,339 |
||||
流动其他金融负债 |
附注21 |
676,087 |
1,023,614 |
800,939 |
||||
贸易及其他应付款项 |
||||||||
供应商 |
852,305 |
822,953 |
787,964 |
|||||
其他应付款 |
210,179 |
133,181 |
114,927 |
|||||
当期所得税负债 |
60,535 |
14,523 |
15,687 |
|||||
贸易和其他应付款项总额 |
附注22 |
1,123,019 |
970,657 |
918,578 |
||||
其他流动负债 |
附注23 |
318,427 |
283,366 |
243,420 |
||||
流动负债合计 |
2,156,146 |
2,325,443 |
2,019,276 |
|||||
负债总额 |
12,798,216 |
13,478,408 |
13,253,455 |
|||||
总权益和负债 |
21,405,241 |
20,992,103 |
21,229,584 |
(*)重报数字(附注2.d)
随附的附注构成综合财务报表的组成部分。
歼10
GRIFOLS,S.A.和子公司
合并损益表
截至2024年12月31日止年度、2023年及2022年
(以千欧元表示)
|
参考 |
|
2024 |
|
2023 (*) |
|
2022 (*) |
|
持续经营 |
|
|
|
|
|
|
||
净收入 |
附注5和24 |
|
7,212,382 |
|
6,591,977 |
|
6,063,967 |
|
销售成本 |
|
(4,417,844) |
|
(4,108,495) |
|
(3,850,257) |
||
毛利率 |
|
2,794,538 |
|
2,483,482 |
|
2,213,710 |
||
研究与开发 |
|
(384,036) |
|
(395,282) |
|
(361,140) |
||
销售、一般和管理费用 |
|
(1,255,291) |
|
(1,372,665) |
|
(1,195,847) |
||
营业费用 |
|
(1,639,327) |
|
(1,767,947) |
|
(1,556,987) |
||
其他收益 |
|
|
22,235 |
|||||
与本集团有类似活动的权益入账被投资单位的利润 |
注10 |
|
|
103,478 |
||||
经营成果 |
|
|
|
|
|
782,436 |
||
财务收入 |
|
|
|
|
|
33,859 |
||
财务费用 |
|
(714,765) |
|
(596,884) |
|
(478,323) |
||
股息 |
2,060 |
— |
— |
|||||
出售贸易应收款项的财务成本 |
附注15 |
(30,782) |
(24,993) |
(18,201) |
||||
金融工具公允价值变动 |
|
|
|
|
|
11,999 |
||
金融资产减值 |
(9,081) |
— |
— |
|||||
汇兑差额 |
|
(59,756) |
|
(16,386) |
|
7,725 |
||
财务结果 |
附注27 |
|
(748,019) |
|
(574,374) |
|
(442,941) |
|
其他权益入账被投资单位的利润/(亏损) |
注10 |
|
— |
|
(922) |
|
(1,482) |
|
所得税前利润 |
|
443,996 |
|
207,021 |
|
338,013 |
||
所得税费用 |
附注28 |
|
(231,190) |
|
(43,349) |
|
(90,111) |
|
合并净利润 |
|
|
|
|
|
247,902 |
||
合并净利润归属于: |
|
|
247,902 |
|||||
归母利润 |
|
|
|
|
|
185,035 |
||
非控股权益应占溢利 |
附注19 |
|
|
|
|
|
62,867 |
|
基本每股收益(欧元) |
附注18 |
|
|
|
|
|
|
|
稀释每股收益(欧元) |
附注18 |
|
|
|
|
|
|
(*)重报数字(附注2.d)
随附的附注构成综合财务报表的组成部分。
F-11
GRIFOLS,S.A.和子公司
综合全面收益表
截至2024年12月31日止年度、2023年及2022年
(以千欧元表示)
|
参考 |
|
2024 |
|
2023 (*) |
|
2022 (*) |
|
合并净利润 |
212,806 |
163,672 |
247,902 |
|||||
翻译差异 |
513,450 |
(303,352) |
531,238 |
|||||
权益入账被投资方/折算差额 |
注10 |
(18,466) |
(62,191) |
(30,771) |
||||
持有待售非流动资产产生的其他综合收益 |
(1,520) |
1,520 |
|
|||||
现金流量套期-公允价值变动的有效部分 |
2,007 |
(20,807) |
40,052 |
|||||
现金流量套期-计入损益的金额 |
(3,697) |
22,722 |
(44,809) |
|||||
税收效应 |
423 |
(479) |
1,189 |
|||||
当年确认的、后续可能重分类至损益的其他综合(亏损)收益合计 |
492,197 |
(362,587) |
496,899 |
|||||
设定受益计划收益(损失) |
3,231 |
(2,842) |
(11,776) |
|||||
以公允价值计量且其变动计入综合收益的金融资产产生的收益(亏损) |
(24,468) |
|
|
|||||
税收效应 |
|
1,810 |
4,560 |
|||||
年内确认的后续不会重分类进损益的其他综合收益(亏损)总额 |
(18,021) |
(1,032) |
(7,216) |
|||||
本年其他综合收益(亏损)合计 |
|
(363,619) |
489,683 |
|||||
年度综合收益(亏损)总额 |
|
(199,947) |
737,585 |
|||||
归属于母公司的综合收益总额 |
525,824 |
(277,424) |
576,938 |
|||||
归属于非控股权益的全面收益总额 |
161,158 |
77,477 |
160,647 |
|||||
(*)重报数字(附注2.d)
随附的附注构成综合财务报表的组成部分。
F-12
GRIFOLS,S.A.和子公司
合并现金流量表
2024年12月31日、2023年和2022年
(以千欧元表示)
|
参考 |
|
2024 |
|
2023 (*) |
|
2022 (*) |
|
经营活动产生的现金流量 |
|
|
||||||
所得税前利润 |
443,996 |
207,021 |
338,013 |
|||||
调整: |
1,182,734 |
1,034,458 |
788,272 |
|||||
摊销和折旧 |
附注26 |
437,897 |
446,422 |
410,980 |
||||
其他调整: |
744,837 |
588,036 |
377,292 |
|||||
权益入账投资(利润)/亏损 |
注10 |
(36,804) |
(62,818) |
(101,996) |
||||
资产减值和净拨备费用 |
73,259 |
100,943 |
69,982 |
|||||
固定资产处置(利润)/损失 |
1,378 |
7,182 |
(1,731) |
|||||
计入收入的政府补助 |
(15,254) |
(10,260) |
(16,440) |
|||||
财务成本/(收入) |
681,122 |
555,795 |
445,027 |
|||||
其他调整 |
41,136 |
(2,806) |
(17,550) |
|||||
经营性资产负债变动 |
22,376 |
(362,843) |
(584,351) |
|||||
库存变化 |
25,819 |
(411,441) |
(631,122) |
|||||
贸易及其他应收款变动 |
(41,883) |
(68,815) |
(77,494) |
|||||
流动金融资产和其他流动资产变动 |
9,644 |
12,944 |
(2,252) |
|||||
本期贸易及其他应付款项变动 |
28,796 |
104,469 |
126,517 |
|||||
经营活动使用的其他现金流量 |
(746,938) |
(659,946) |
(543,361) |
|||||
已付利息 |
附注21(e) |
(571,487) |
(528,942) |
(350,387) |
||||
收到的利息 |
10,806 |
13,747 |
4,054 |
|||||
缴纳的所得税 |
(175,563) |
(158,854) |
(196,436) |
|||||
其他已付 |
(10,694) |
14,103 |
(592) |
|||||
来自/(用于)经营活动的净现金 |
902,168 |
218,690 |
(1,427) |
|||||
投资活动产生的现金流量 |
||||||||
投资付款 |
(701,091) |
(433,102) |
(2,090,792) |
|||||
集团公司、联营公司和业务单位 |
附注3和10 |
(285,872) |
(29,474) |
(1,533,264) |
||||
物业、厂房及设备及无形资产 |
(371,367) |
(310,320) |
(392,872) |
|||||
物业、厂房及设备 |
注7 |
(232,538) |
(224,438) |
(283,803) |
||||
无形资产 |
附注9 |
(138,829) |
(85,882) |
(109,069) |
||||
其他金融资产 |
(43,852) |
(93,308) |
(164,656) |
|||||
出售投资所得款项 |
1,587,758 |
38,383 |
94,669 |
|||||
持有待售的非流动资产 |
附注11和12 |
1,564,256 |
— |
91,373 |
||||
物业、厂房及设备 |
23,502 |
23,247 |
3,296 |
|||||
其他金融资产 |
— |
15,136 |
— |
|||||
(用于)投资活动的现金净额 |
886,667 |
(394,719) |
(1,996,123) |
|||||
筹资活动产生的现金流量 |
||||||||
权益工具的收益及付款 |
— |
— |
(3,459) |
|||||
支付库存股 |
— |
— |
(3,459) |
|||||
金融负债工具的收益和付款 |
(1,352,269) |
170,037 |
(168,780) |
|||||
问题 |
4,006,656 |
1,637,798 |
1,142,760 |
|||||
赎回及偿还 |
(5,247,437) |
(1,351,367) |
(1,207,253) |
|||||
租赁付款 |
附注8和21(e) |
(111,488) |
(116,394) |
(104,287) |
||||
股息 |
(962) |
— |
10,125 |
|||||
支付的股息 |
(962) |
— |
(592) |
|||||
收到的股息 |
注10 |
— |
— |
10,717 |
||||
用于筹资活动的其他现金流量 |
(5,483) |
1,456 |
(2,787) |
|||||
计入债务摊余成本的融资成本 |
(57,602) |
— |
— |
|||||
来自/(用于)融资活动的其他金额 |
52,119 |
1,456 |
(2,787) |
|||||
来自/(用于)筹资活动的净现金 |
(1,358,714) |
171,493 |
(164,901) |
|||||
汇率波动对现金的影响 |
20,082 |
(15,094) |
35,551 |
|||||
现金及现金等价物净增加/(减少) |
450,203 |
(19,630) |
(2,126,900) |
|||||
年初现金及现金等价物 |
529,577 |
549,207 |
2,676,107 |
|||||
年末现金及现金等价物 |
附注16 |
979,780 |
529,577 |
549,207 |
(*)重报数字(附注2.d)
随附的附注构成综合财务报表的组成部分。
F-13
GRIFOLS,S.A.和子公司
截至年度合并权益变动表
2024年12月31日、2023年和2022年
(以千欧元表示)
归属于母公司股东 |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
累计其他综合收益 |
股权至 |
|
|
|||||||||||||||||||||
应占利润 |
其他 |
其他综合 |
其他综合 |
归属 |
||||||||||||||||||||||||||
分享 |
分享 |
到 |
临时 |
财政部 |
翻译 |
综合 |
非流动收入 |
财政收入 |
现金流 |
到 |
非控制性 |
|||||||||||||||||||
|
参考 |
|
资本 |
|
溢价 |
|
储备金 |
|
家长 |
|
股息 |
|
股票 |
|
差异 |
|
收入 |
|
持有待售资产 |
仪器估值 |
|
对冲 |
|
家长 |
|
利益 |
|
股权 |
||
2021年12月31日余额 |
119,604 |
910,728 |
4,133,388 |
188,726 |
— |
(164,189) |
333,091 |
(869) |
— |
— |
3,130 |
5,523,609 |
1,793,489 |
7,317,098 |
||||||||||||||||
因重述而作出的调整(附注2.d) |
— |
— |
(453,700) |
(4,399) |
— |
— |
(310) |
— |
— |
— |
— |
(458,409) |
— |
(458,409) |
||||||||||||||||
2021年12月31日余额(*) |
119,604 |
910,728 |
3,679,688 |
184,327 |
— |
(164,189) |
332,781 |
(869) |
— |
— |
3,130 |
5,065,200 |
1,793,489 |
6,858,689 |
||||||||||||||||
翻译差异 |
— |
— |
— |
— |
— |
— |
402,542 |
— |
— |
— |
— |
402,542 |
97,780 |
500,322 |
||||||||||||||||
现金流量套期 |
附注30 |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
(3,568) |
(3,568) |
— |
(3,568) |
|||||||||||||||
其他综合收益 |
— |
— |
— |
— |
— |
— |
— |
(7,215) |
— |
— |
— |
(7,215) |
— |
(7,215) |
||||||||||||||||
本年度其他综合收益/(费用) |
— |
— |
— |
— |
— |
— |
402,542 |
(7,215) |
— |
— |
(3,568) |
391,759 |
97,780 |
489,539 |
||||||||||||||||
本年度盈利/(亏损) |
— |
— |
— |
208,279 |
— |
— |
— |
— |
— |
— |
— |
208,279 |
62,867 |
271,146 |
||||||||||||||||
年度综合收益/(费用)总额 |
— |
— |
— |
208,279 |
— |
— |
402,542 |
(7,215) |
— |
— |
(3,568) |
600,038 |
160,647 |
760,685 |
||||||||||||||||
库存股变动净额 |
附注17(d) |
— |
— |
— |
— |
— |
1,969 |
— |
— |
— |
— |
— |
1,969 |
— |
1,969 |
|||||||||||||||
收购/出售非控股权益 |
附注17(c)和19 |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
373,468 |
373,468 |
|||||||||||||||
其他变化 |
— |
— |
4,322 |
— |
— |
— |
— |
— |
— |
— |
— |
4,322 |
2 |
4,324 |
||||||||||||||||
分配2021年度利润: |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
||||||||||||||||
储备金 |
— |
— |
184,327 |
(184,327) |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
||||||||||||||||
股息 |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
||||||||||||||||
中期股息 |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
||||||||||||||||
与股东或所有者的运营 |
— |
— |
188,649 |
(184,327) |
— |
1,969 |
— |
— |
— |
— |
— |
6,291 |
373,470 |
379,761 |
||||||||||||||||
2022年12月31日余额 |
119,604 |
910,728 |
3,868,337 |
208,279 |
— |
(162,220) |
735,323 |
(8,084) |
— |
— |
(438) |
5,671,529 |
2,327,606 |
7,999,135 |
||||||||||||||||
因重述而作出的调整(附注2.d) |
— |
— |
(216) |
(23,244) |
— |
— |
454 |
— |
— |
— |
— |
(23,006) |
— |
(23,006) |
||||||||||||||||
2022年12月31日余额(*) |
119,604 |
910,728 |
3,868,121 |
185,035 |
— |
(162,220) |
735,777 |
(8,084) |
— |
— |
(438) |
5,648,523 |
2,327,606 |
7,976,129 |
||||||||||||||||
翻译差异 |
— |
— |
— |
— |
— |
— |
(321,565) |
— |
— |
— |
— |
(321,565) |
(43,877) |
(365,442) |
||||||||||||||||
现金流量套期 |
附注30 |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
1,436 |
1,436 |
— |
1,436 |
|||||||||||||||
其他综合收益 |
— |
— |
— |
— |
— |
— |
— |
(1,033) |
— |
— |
— |
(1,033) |
— |
(1,033) |
||||||||||||||||
持有待售非流动资产产生的其他综合收益 |
— |
— |
— |
— |
— |
— |
— |
— |
1,520 |
— |
— |
1,520 |
— |
1,520 |
||||||||||||||||
本年度其他综合收益/(费用) |
— |
— |
— |
— |
— |
— |
(321,565) |
(1,033) |
1,520 |
— |
1,436 |
(319,642) |
(43,877) |
(363,519) |
||||||||||||||||
本年度盈利/(亏损) |
— |
— |
— |
59,315 |
— |
— |
— |
— |
— |
— |
— |
59,315 |
121,354 |
180,669 |
||||||||||||||||
年度综合收益/(费用)总额 |
— |
— |
— |
59,315 |
— |
— |
(321,565) |
(1,033) |
1,520 |
— |
1,436 |
(260,327) |
77,477 |
(182,850) |
||||||||||||||||
库存股变动净额 |
附注17(d) |
— |
— |
— |
— |
— |
9,472 |
— |
— |
— |
— |
— |
9,472 |
— |
9,472 |
|||||||||||||||
收购/出售非控股权益 |
附注17(c)和19 |
— |
— |
(1,525) |
— |
— |
— |
— |
— |
— |
— |
— |
(1,525) |
325 |
(1,200) |
|||||||||||||||
其他变化 |
— |
— |
(10,670) |
— |
— |
— |
— |
— |
— |
— |
— |
(10,670) |
(260,089) |
(270,759) |
||||||||||||||||
2022年度利润分配: |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
||||||||||||||||
储备金 |
— |
— |
185,035 |
(185,035) |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
||||||||||||||||
股息 |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
||||||||||||||||
中期股息 |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
||||||||||||||||
与股东或所有者的运营 |
— |
— |
172,840 |
(185,035) |
— |
9,472 |
— |
— |
— |
— |
— |
(2,723) |
(259,764) |
(262,487) |
||||||||||||||||
2023年12月31日余额 |
119,604 |
910,728 |
4,040,961 |
59,315 |
— |
(152,748) |
414,212 |
(9,117) |
1,520 |
— |
998 |
5,385,473 |
2,145,319 |
7,530,792 |
||||||||||||||||
因重述而作出的调整(附注2.d) |
— |
— |
— |
(16,997) |
— |
— |
(100) |
— |
— |
— |
— |
(17,097) |
— |
(17,097) |
||||||||||||||||
2023年12月31日余额(*) |
119,604 |
910,728 |
4,040,961 |
42,318 |
— |
(152,748) |
414,112 |
(9,117) |
1,520 |
— |
998 |
5,368,376 |
2,145,319 |
7,513,695 |
||||||||||||||||
翻译差异 |
— |
— |
— |
— |
— |
— |
389,714 |
— |
— |
— |
— |
389,714 |
105,271 |
494,985 |
||||||||||||||||
现金流量套期 |
附注30 |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
(1,268) |
(1,268) |
— |
(1,268) |
|||||||||||||||
其他综合收益 |
— |
— |
— |
— |
— |
— |
— |
330 |
— |
— |
— |
330 |
— |
330 |
||||||||||||||||
持有待售非流动资产产生的其他综合收益 |
— |
— |
— |
— |
— |
— |
— |
— |
(1,520) |
— |
— |
(1,520) |
— |
(1,520) |
||||||||||||||||
金融工具估值产生的其他综合收益 |
— |
— |
— |
— |
— |
— |
— |
— |
— |
(18,351) |
— |
(18,351) |
— |
(18,351) |
||||||||||||||||
本年度其他综合收益/(费用) |
— |
— |
— |
— |
— |
— |
389,714 |
330 |
(1,520) |
(18,351) |
(1,268) |
368,905 |
105,271 |
474,176 |
||||||||||||||||
本年度盈利/(亏损) |
— |
— |
— |
156,920 |
— |
— |
— |
— |
— |
— |
— |
156,920 |
55,886 |
212,806 |
||||||||||||||||
年度综合收益/(费用)总额 |
— |
— |
— |
156,920 |
— |
— |
389,714 |
330 |
(1,520) |
(18,351) |
(1,268) |
525,825 |
161,157 |
686,982 |
||||||||||||||||
库存股变动净额 |
附注17(d) |
— |
— |
— |
— |
— |
18,300 |
— |
— |
— |
— |
— |
18,300 |
— |
18,300 |
|||||||||||||||
收购/出售非控股权益 |
附注17(c)和19 |
— |
— |
(9,699) |
— |
— |
— |
— |
— |
— |
— |
— |
(9,699) |
(25,519) |
(35,218) |
|||||||||||||||
其他变化 |
注10 |
— |
— |
(19,075) |
— |
— |
— |
— |
— |
— |
— |
— |
(19,075) |
508,212 |
489,137 |
|||||||||||||||
分配2023年利润: |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
||||||||||||||||
储备金 |
— |
— |
42,318 |
(42,318) |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
||||||||||||||||
股息 |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
(65,871) |
(65,871) |
||||||||||||||||
中期股息 |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
||||||||||||||||
与股东或所有者的运营 |
— |
— |
13,544 |
(42,318) |
— |
18,300 |
— |
— |
— |
— |
— |
(10,474) |
416,822 |
406,348 |
||||||||||||||||
2024年12月31日余额 |
119,604 |
910,728 |
4,054,505 |
156,920 |
— |
(134,448) |
803,826 |
(8,787) |
— |
(18,351) |
(270) |
5,883,727 |
2,723,298 |
8,607,025 |
||||||||||||||||
(*)重报数字(附注2.d)
随附的附注构成综合财务报表的组成部分。
F-14
(1) |
性质、主要活动及附属公司 |
GRIFOLS, S.A.(以下本公司)于1987年6月22日根据西班牙法律注册成立为有限责任公司。其注册和税务办事处位于Avinguda de la Generalitat 152-158,08174 Sant Cugat del Valles,Barcelona。该公司的法定活动包括提供企业和工商管理、管理和控制服务,以及对资产和财产进行投资。其主要活动涉及向其附属公司提供行政、管理和控制服务。
2006年5月17日,公司通过公开发行71,000,000股每股面值0.50欧元的普通股和每股3.90欧元的股份溢价,完成了在西班牙证券市场的上市。此次增资总额(含股份溢价)为3.124亿欧元,折合每股价格为4.40欧元。
公司股票于2008年1月2日在西班牙证券交易所IBEX-35指数上市。
公司所有股票均在巴塞罗那、马德里、巴伦西亚和毕尔巴鄂证券市场和西班牙自动报价系统(SIBE/连续市场)上市。2011年6月2日,B类无投票权股票(ADR)在纳斯达克(美国)和西班牙自动报价系统(SIBE/连续市场)上市。
GRIFOLS, S.A.为本综合财务报表附注一所列附属公司的母公司。
GRIFOLS, S.A.及附属公司(以下集团)在综合基础上及在共同管理下行事,其主要活动为采购、制造、制备及商业化基本血浆药物、非血浆疗法及诊断解决方案。
集团西班牙公司的主要工厂位于Parets del Vall é s(巴塞罗那)和Torres de Cotilla(穆尔西亚),美国公司位于洛杉矶(加利福尼亚州)、克莱顿(北卡罗来纳州)、埃默里维尔(加利福尼亚州)、圣地亚哥(加利福尼亚州)。此外,集团在都柏林(爱尔兰)、蒙特利尔(加拿大)和Dreieich(德国)设有制造工厂。
(二)列报依据
合并财务报表乃根据GRIFOLS, S.A.及集团公司的会计记录编制。2024年合并财务报表及其比较数字是根据国际会计准则理事会(IFRS-IASB)颁布的国际财务报告准则编制的,就Grifols集团而言,该准则与欧盟采用的国际财务报告准则(IFRS-EU)相同,以公允列报GRIFOLS, S.A.及其子公司2024年、2023年和2022年的合并权益和合并财务状况,以及该日终了年度的合并经营业绩、合并现金流量和合并权益变动。
在2025年4月10日举行的会议上,GRIFOLS, S.A.董事会授权发布2024年合并财务报表。
除非另有说明,这些综合财务报表所列数字均以千欧元表示。
这些2024年综合财务报表显示了2023年和2022年的比较数字,来自综合损益表、综合全面收益表、综合权益变动表和综合现金流量表及其相应附注。为比较2024年、2023年和2022年的综合损益表和2024年和2023年的综合资产负债表,必须考虑附注2所述应用新准则的影响。
根据《2014年爱尔兰公司法》第357条的规定,公司已不可撤销地为爱尔兰子公司Grifols Worldwide Operations Limited(Ireland)(见附录I)在该法案第1(b)小节提及的截至2024年12月31日的财政年度的所有负债提供担保,目的是使Grifols Worldwide Operations Limited能够要求豁免在爱尔兰提交自己的财务报表的要求。
F-15
a)应用会计原则时使用的相关会计估计、假设和判断
按照IFRS-EU编制合并财务报表要求管理层做出影响集团会计政策应用的判断、估计和假设。以下附注包括应用对综合财务报表中确认的金额有最重大影响的会计政策所使用的相关会计估计和判断的摘要。
| ● | 用于测试非金融资产减值的假设。相关现金产生单位至少每年进行一次减值测试。这些是基于风险调整后的未来现金流,使用适当的利率进行贴现。与风险调整后的未来现金流和贴现率相关的假设是基于业务预测,因此具有内在的主观性。未来事件可能导致业务预测发生变化,从而对集团未来业绩产生不利影响。 |
| ● | 企业合并中被收购资产和承担负债的公允价值的确定和收购价格的分配(见附注3和4a)。 |
| ● | 开发成本资本化的评估(见附注4(d))。关键假设与项目未来足够经济效益的估计有关。 |
| ● | 存货的估值及评估存货账面价值的可回收性。关键假设考虑监管批准及集团所营销产品的预测需求。 |
| ● | 所得税费用的计算需要Grifols经营所在司法管辖区的税收立法解释。关于税务机关是否会接受特定不确定的税务处理以及未决诉讼的预期结果的决定需要做出重大的估计和判断。同样,Grifols根据管理层关于未来应课税利润的金额和支付的假设(见附注4(q)和28),确认递延所得税资产,主要来自税收抵免和在很可能有足够的应课税收入可用于抵销暂时性差异的情况下进行扣除的权利。 |
| ● | 对美国某些客户的退单裁定(见附注4(p))。 |
| ● | 用于计算金融工具公允价值的假设(见附注29和30)。 |
| ● | 对在特定情况下可能导致现金流出的某些金融工具分类为权益工具的评估(见附注17a)。 |
| ● | 评估Grifols是否控制一家子公司,分析合同协议衍生的权利等因素,以及实际和潜在的投票权,为这些目的考虑Grifols在其财政年度结束日可行使的潜在投票权(见附注10和19)。 |
| ● | 对Grifols不存在合同义务的评估。S.A.在与海尔签署的协议框架内出售
|
与现有不确定因素有关的过往年度判断并无变动。
集团亦面临利率及货币风险。参见附注30中的敏感性分析。
F-16
b)合并基础
附录一详细列示了公司于2024年12月31日、2023年和2022年12月31日直接或间接拥有子公司的百分比,以及为编制随附的合并财务报表而在每种情况下使用的合并方法。
公司直接或间接拥有多数股权或表决权的子公司并表。公司拥有20%以上表决权且对其没有控制权但确有重大影响的联营企业,已按权益法核算。
尽管集团直到2024年11月才拥有Grifols Malaysia Sdn Bhd的100%股权,但此前,通过与另一股东的合同和对其股份的质押,持有49%的有投票权的股份,其控制了该公司的大部分经济决策和投票权,因此,此前被合并。
另一方面,集团持有Biotek America LLC(“ITK JV”)75%的投票权,该公司是与Immunotek GH,LLC(Immunotek)合作创建的公司,旨在建设和管理28个血浆供体中心(见附注10)。该等合作协议已作为共同协议在该等综合财务报表中入账。
实体Haema GmbH(前身为Haema AG)和BPC Plasma,Inc.,以及之前的Haema Plasma KFT.直至2024年10月被收购,其中Grifols不持有股份,但对其存在控制权(见附注19),已被合并。
Grifols(Thailand)Ltd.拥有两类股份,集团通过其拥有的股份类别持有多数投票权。因此,它得到了巩固。
由于失去对其权益的重大影响力,MECWINS自2024年5月起不再是Progenika BioPharma,S.A.的联营公司。
联营公司及共同控制实体的变动详见附注10。
子公司变动情况
2024年:
| ● | 合并协议 |
在当前的2024财政年度,Biotest Italy,S.R.L.、Biotest Medical,S.L.U.、Biotest Farmaceutica LTDA和Biotest France SAS签订了合并协议,由此产生的公司分别为Grifols Italia S.P.A.、Grifols Movaco,S.A.、Grifols Biotest Ltda和Grifols France S.A.R.L.。
| ● | Grifols Pyrenees Reserarch Center,S.L。 |
截至2024年7月25日,Grifols通过其全资子公司Grifols Innovation and New Technologies Ltd,以20万欧元的金额收购了属于安道尔政府的剩余20%股份。
F-17
| ● | Haema Plasma KFT。 |
截至2024年10月31日,Grifols通过其子公司Grifols Worldwide Operations Limited以3500万欧元从Scranton Plasma,B.V.(与集团相关的实体)收购Haema Plasma KFT. 100%的资本,其价值得到独立专家出具的公平意见的支持。鉴于Grifols在收购之前已经对该子公司行使了控制权,该交易对2024财年的综合损益表没有影响,因为这是一项具有非控股权益的交易,其中Grifols保留对Haema Plasma KFT的控制权。(见附注3(e)和附注31)。因此,截至2024年12月31日,已支付金额与少数股东权益减少之间的差额已在归属于母公司的准备金中记录为负数14,022千欧元。
| ● | Grifols马来西亚SDN BHD |
自2024年10月7日起,Grifols通过其全资子公司Grifols Asia Pacific PTE LTD以1.6亿欧元收购Grifols Malaysia SDN BHD剩余51%的股份。
2023年:
| ● | Grifols Escrow Issuer,S.A.和Gripdan Invest,S.L。 |
自2023年1月1日起,Grifols Escrow Issuer,S.A.、Gripdan Invest,S.L.(均为全资附属公司)与GRIFOLS, S.A.订立合并协议,而GRIFOLS, S.A.为存续公司。
这一操作对合并财务报表没有影响。
| ● | Access Biologicals LLC.和Chiquito Acquisition Corp。 |
自2023年4月1日起,Access Biologicals LLC、Chiquito Acquisition Corp.和Grifols Bio Supplies,Inc.(均为全资子公司)订立合并协议,Grifols Bio Supplies,Inc.为存续公司。
这一操作对合并财务报表没有影响。
| • | 歌德科技有限责任公司 |
2023年6月30日,公司Geotech LLC(D/B/A MedKeeper)已解散。
这一操作对合并财务报表没有影响。
| • | Kiro Grifols,S.L。 |
2023年7月27日,Grifols达成协议,收购Kiro Grifols,S.L.剩余10%的股份,总金额为116.1万欧元。Grifols现在拥有其100%的股份。
| • | AlbaJuna Therapeutics,S.L。 |
2023年10月9日,Grifols通过其全资子公司Grifols Innovation and New Technologies Limited,Inc.达成协议,收购AlbaJuna Therapeutics,S.L.剩余51%的股份,总金额为1欧元(见附注3(c))。
F-18
| • | Biotest(英国)有限公司。 |
2023年6月1日,Grifols U.K.,Ltd.与Biotest AG达成协议,收购Biotest(U.K. Ltd.)100%的股份,总金额为20,079千欧元。自2023年11月1日起,Biotest(U.K.,Ltd.)已将其净资产转让给Grifols U.K.,导致合并。
以下公司于2023年成立,并成为Grifols集团合并的一部分:
| ● | Biomat Holdings,LLC |
| ● | Canada,Inc.(后更名为Grifols Plasma Canada-Ontario Inc.) |
2022年:
| ● | Albimmune,S.L。 |
2022年1月13日,Grifols通过其全资子公司Grifols Innovation and New Technologies Limited,Inc.达成协议,收购Albimmune,S.L. 51%的股份,总金额为3,000欧元。
| ● | VCN Biosciences,S.L。 |
2022年3月10日,Grifols与其他股东达成协议,以7700万美元出售VCN Bioscience,S.L. 100%的已发行流通股。
由于此次撤资,集团已在综合损益表中确认收入7,557千欧元。
| ● | Biomat USA,Inc。 |
自2022年4月1日起,Biomat USA Inc.与Talecris Plasma Resources,Inc.订立合并协议,由此产生的公司为Biomat USA,Inc.。
| ● | Biotest,AG和Grifols Biotest Holdings,GmbH |
2022年4月25日,在获得所有监管批准后,Grifols完成了以1,460,853千欧元收购Biotest AG的70.18%股本和Tiancheng(Germany)Pharmaceutical Holdings AG的全部股本,后者目前的公司名称为Grifols Biotest Holdings GmbH(见附注3)。
| ● | Access Biologicals LLC。 |
2022年6月15日,Grifols通过其全资子公司Chiquito Acquisition Corp.行使看涨期权,购买Access Biologicals LLC剩余51%的股份,总价为1.42亿美元(见附注3和10)。
| ● | Grifols M é xico,S.A. de C.V。 |
自2022年12月15日起,Grifols M é xico,S.A. de C.V.和Log í stica GRIFOLS, S.A. de C.V.签订合并协议,由此产生的公司为Grifols M é xico,S.A. de C.V。
F-19
c)2024年国际财务报告准则修订
截至本年度财务报表编制之日,由国际会计准则理事会和国际财务报告准则解释委员会公布并由欧盟采纳并在欧洲适用的以下准则已生效,因此在编制本综合财务报表时已予以考虑:
2024年生效
|
|
|
强制申请年度期间 |
|||
开始于或之后: |
||||||
标准 |
欧盟生效日期 |
|
国际会计准则理事会生效日期 |
|||
国际会计准则第1号 |
|
国际会计准则第1号财务报表列报的修订: -将负债分类为流动或非流动日期(2020年1月23日发布); -将负债分类为流动或非流动-推迟生效日期(2020年7月15日发布);和 -附有契诺的非流动负债(2022年10月31日发行) |
2024年1月1日 |
2024年1月1日 |
||
|
||||||
国际财务报告准则第16号 |
|
IFRS 16租赁的修订:售后回租中的租赁负债(2022年9月22日发布) |
2024年1月1日 |
2024年1月1日 |
||
国际会计准则第7号 |
|
对IAS7现金流量表和NIIF7金融工具的修订:应披露的信息:与供应商的财务协议(2023年5月25日发布)。 |
2024年1月1日 |
2024年1月1日 |
||
应用该等准则及解释对该等综合财务报表并无重大影响。
2024年发布但未生效的标准
在这些合并财务报表获授权发布之日,国际会计准则理事会已公布以下国际财务报告准则和修订,但在以下所示的未来期间之前,它们的应用不是强制性的:
|
|
|
强制申请年度期间 |
|||
开始于或之后: |
||||||
标准 |
欧盟生效日期 |
国际会计准则理事会生效日期 |
||||
国际会计准则第21号 |
|
国际会计准则第21号修订外币兑换对汇率变动的影响:不存在可兑换性 |
|
2025年1月1日 |
|
2025年1月1日 |
国际财务报告准则第18号 |
|
财务报表中的列报和披露(2024年4月9日发布) |
待定 |
2027年1月1日 |
||
国际财务报告准则第19号 |
|
未公开问责子公司:披露事项(2024年5月9日发布) |
|
待定 |
|
2027年1月1日 |
国际财务报告准则第9号/ |
金融工具分类和计量的修订(对IFRS 9和IFRS 7的修订)(2024年5月30日发布) |
待定 |
2026年1月1日 |
|||
年度改进第11卷(2024年7月18日发布) |
待定 |
2026年1月1日 |
||||
国际财务报告准则第9号/ |
参考自然依赖电力的合同–对IFRS 9和IFRS 7的修订(2024年12月18日发布) |
待定 |
2026年1月1日 |
|||
本集团并无在任何该等准则或解释的生效日期前应用该等准则或解释。
歼20
适用这些准则和解释不会对这些合并财务报表产生重大影响。
d)会计准则变更及差错更正
为进行比较而呈列的截至2023年12月31日的财务资料,与母公司于2024年6月14日的普通股东大会所批准的财务资料有所不同,原因为附注10详述的综合全面收益表子标题之间的重新分类以及以下原因:
Biotek America LLC(见附注10)
2021年7月,Grifols(通过Grifols Bio North America LLC或GBNA)与ImmunoTek GH,LLC(ImmunoTek)订立合作协议,以开设和管理28个血浆捐赠中心(“ImmunoTek合作协议”)。ImmunoTek合作协议是通过在美国创建一家共同控制的公司Biotek America LLC(“ITK JV”)来实施的。
直到2022年,Grifols一直指责其对ITK合资企业的兴趣是一种财务投资。2024年,在与西班牙国家证券市场委员会(CNMV)进行讨论后,得出的结论是,ImmunoTek合作协议应作为一项共同安排进行会计处理,因此应确认ITK合资企业的资产、负债和结果。因此,在2023年12月31日的合并财务报表中,ITK合资公司的资产和负债分别以1.51亿欧元和1.91亿欧元的金额反映,确认了4000万欧元的准备金负调整,扣除折算差额。此次整合于2023年1月1日起前瞻性开展。此次准备金负向调整主要与ITK合资公司在2021、2022和2023年的亏损有关。
为在各期损益表中准确列报ITK JV的这些损失,2023年和2022年损益表对应的比较数字已在2024年合并财务报表中重列,其影响分别为业绩减少1700万欧元和2300万欧元。
上海RAAS
2020年3月30日,Grifols收到上海RAAS血液制品股份有限公司(以下简称“SRAAS”)对应26.2%股本的股份,作为交换,此前已根据2019年与SRAAS订立的互换协议交付了代表其子公司Grifols Diagnostic Solutions,Inc.(以下简称“GDS”)45%经济权利的股份。因此,Grifols持有一家联营公司的股份,而该联营公司又持有GDS子公司的股份。
由于对联营公司的投资拥有集团公司的股权,国际财务报告准则(IFRS)未涉及非控制性权益的会计处理,因此Grifols选择的会计政策是(i)将通过持有SRAAS的股权而获得的间接权益Grifols在GDS中归属于Grifols的所有权百分比增加11.79%(占45%的26.2%),从而将非控制性权益减少该百分比,以及(ii)将SRAAS就其在GDS的股权确认的任何金额从对SRAAS的权益法投资中排除,因为Grifols合并了GDS净资产的100%。
因此,由于2020年3月采用的会计政策,Grifols拥有GDS 66.79%(55% + 11.79%)的应占股权,而非控股权益则由45%减少至33.21%,金额为4.03亿欧元。归属于非控股权益的净权益减少额被综合储备抵销,因为这是与少数股东的交易,没有失去控制权。
F-21
由于在2024年出售了SRAAS的20%股权(见附注12),经识别,对SRAAS投资的初始确认本应不包括根据Grifols在交易日的会计政策SRAAS在GDS中持有的金额,金额为4.57亿欧元。因此,归属于非控股权益的权益减少本应减少对SRAAS的权益核算被投资方的投资,而不是影响合并储备。因此,在2020年至2023年期间,SRAAS的股份和综合储备都被高估了4.57亿欧元。
4.57亿欧元与最初记录的4.03亿欧元之间的差额,对应的是Grifols通过其在SRAAS的股份而间接获得的GDS股份的价值重估。这一调整涉及合并准备金的减少,因为这是与少数股东的交易,没有失去控制权。
在此背景下,截至2023年1月1日的‘对权益核算的被投资单位的投资’和‘合并准备金’以及截至2023年12月31日的‘对权益核算的被投资单位的投资’、‘持有待售的非流动资产’和‘合并准备金’相关金额已在比较资料中重列,详见下表。
尽管这一更正导致合并权益减少4.57亿欧元,但它对合并损益表没有影响;它代表了一种不正确的会计处理,但不会影响每个受影响财政年度的正确结果。因此,在2020年至2023年合并财务报表中以权益法投资SRAAS确认的业绩以及归属于母公司和GDS非控股权益的业绩均得到正确核算。此外,在这一降低了SRAAS投资账面价值的更正之后,出售SRAAS 20%股权所录得的净收益在2024年财务报表中得到了准确的核算。
F-22
下表汇总了因上述原因对合并资产负债表和合并损益表中比较信息的影响:
合并资产负债表
截至2023年1月1日
(以千欧元表示)
|
|
|
|
一体化 |
|
|
||||
调整 |
调整 |
重述 |
||||||||
物业、厂房及设备 |
参考 |
1/1/2023 |
Biotek美国 |
SRAAS |
1/1/2023 |
|||||
使用权 |
|
附注8 |
897,552 |
|
83,708 |
|
— |
|
981,260 |
|
物业、厂房及设备 |
|
附注9 |
3,270,937 |
|
31,921 |
|
— |
|
3,302,858 |
|
对权益核算被投资单位的投资 |
|
注10 |
1,955,177 |
|
— |
|
(457,218) |
|
1,497,959 |
|
以摊余成本计量的非流动金融资产 |
|
附注11 |
582,175 |
|
(124,132) |
|
— |
|
458,043 |
|
其他非流动资产 |
|
注10 |
— |
|
124,191 |
|
— |
|
124,191 |
|
非流动资产合计 |
|
16,880,390 |
|
115,688 |
|
(457,218) |
|
16,538,860 |
||
库存 |
|
附注13 |
3,201,357 |
|
34,653 |
|
— |
|
3,236,010 |
|
应收账款 |
|
附注15 |
608,688 |
|
393 |
|
— |
|
609,081 |
|
其他流动资产 |
|
81,814 |
|
863 |
|
— |
|
82,677 |
||
现金及现金等价物 |
|
附注16 |
547,979 |
|
1,228 |
|
— |
|
549,207 |
|
流动资产总额 |
|
4,653,587 |
|
37,137 |
|
— |
|
4,690,724 |
||
总资产 |
|
21,533,977 |
|
152,825 |
|
(457,218) |
|
21,229,584 |
||
权益与负债 |
|
|
|
|
|
|
|
|
||
储备金 |
|
4,534,715 |
|
(24,341) |
|
(457,218) |
|
4,053,156 |
||
总股本 |
|
5,402,827 |
|
(24,341) |
|
(457,218) |
|
4,921,268 |
||
翻译差异 |
|
735,633 |
|
144 |
|
— |
|
735,777 |
||
归属母公司权益 |
|
6,129,938 |
|
(24,197) |
|
(457,218) |
|
5,648,523 |
||
总股本 |
|
附注17 |
8,457,544 |
|
(24,197) |
|
(457,218) |
|
7,976,129 |
|
非流动金融负债 |
|
附注21 |
9,960,562 |
|
113,593 |
|
— |
|
10,074,155 |
|
非流动负债合计 |
|
11,120,586 |
|
113,593 |
|
— |
|
11,234,179 |
||
流动金融负债 |
|
附注21 |
795,686 |
|
5,253 |
|
— |
|
800,939 |
|
贸易及其他应付款项 |
|
附注22 |
862,335 |
|
56,243 |
|
— |
|
918,578 |
|
其他流动负债 |
|
附注23 |
241,487 |
|
1,933 |
|
— |
|
243,420 |
|
流动负债合计 |
|
1,955,847 |
|
63,429 |
|
— |
|
2,019,276 |
||
负债总额 |
|
13,076,433 |
|
177,022 |
|
— |
|
13,253,455 |
||
总权益和负债 |
|
21,533,977 |
|
152,825 |
|
(457,218) |
|
21,229,584 |
F-23
合并资产负债表
于2023年12月31日
(以千欧元表示)
|
|
|
|
一体化 |
|
|
||||
调整 |
调整 |
重述 |
||||||||
物业、厂房及设备 |
参考 |
31/12/2023 |
Biotek美国 |
SRAAS |
31/12/2023 |
|||||
对权益核算被投资单位的投资 |
|
注10 |
534,970 |
|
— |
|
(113,207) |
|
421,763 |
|
其他非流动资产 |
|
注10 |
145,522 |
|
(9,889) |
|
— |
|
135,633 |
|
递延所得税资产 |
|
附注28 |
305,295 |
|
(4,966) |
|
— |
|
300,329 |
|
非流动资产合计 |
|
14,989,149 |
|
(14,855) |
|
(113,207) |
|
14,861,087 |
||
持有待售的非流动资产 |
|
附注12 |
1,433,867 |
|
— |
|
(344,011) |
|
1,089,856 |
|
库存 |
|
附注13 |
3,459,277 |
|
23,122 |
|
— |
|
3,482,399 |
|
流动资产总额 |
|
6,451,905 |
|
23,122 |
|
(344,011) |
|
6,131,016 |
||
总资产 |
|
21,441,054 |
|
8,267 |
|
(457,218) |
|
20,992,103 |
||
权益与负债 |
|
|
|
|
|
|
|
|
||
储备金 |
|
4,482,798 |
|
15,381 |
|
(457,218) |
|
4,040,961 |
||
年内归母溢利 |
|
59,315 |
|
(16,997) |
|
— |
|
42,318 |
||
总股本 |
|
5,419,697 |
|
(1,616) |
|
(457,218) |
|
4,960,863 |
||
翻译差异 |
|
414,068 |
|
44 |
|
— |
|
414,112 |
||
归属母公司权益 |
|
5,827,166 |
|
(1,572) |
|
(457,218) |
|
5,368,376 |
||
总股本 |
|
附注17 |
7,972,485 |
|
(1,572) |
|
(457,218) |
|
7,513,695 |
|
贸易和其他应付款项总额 |
|
附注22 |
960,818 |
|
9,839 |
|
— |
|
970,657 |
|
负债总额 |
|
13,468,569 |
|
9,839 |
|
— |
|
13,478,408 |
||
总权益和负债 |
|
21,441,054 |
|
8,267 |
|
(457,218) |
|
20,992,103 |
F-24
合并损益表
于2022年12月31日
(以千欧元表示)
|
|
|
|
一体化 |
|
|||
调整 |
重述 |
|||||||
参考 |
2022 |
Biotek美国 |
2022 |
|||||
净收入 |
|
附注5和24 |
6,063,967 |
|
— |
|
6,063,967 |
|
销售成本 |
|
附注25和26 |
(3,832,437) |
|
(17,820) |
|
(3,850,257) |
|
毛利率 |
|
2,231,530 |
|
(17,820) |
|
2,213,710 |
||
营业费用 |
|
附注25和26 |
(1,551,563) |
|
(5,424) |
|
(1,556,987) |
|
其他收益 |
|
22,235 |
|
22,235 |
|
|
||
与本集团有类似活动的权益入账被投资单位的利润 |
|
注10 |
103,478 |
|
— |
|
103,478 |
|
经营成果 |
|
805,680 |
|
(23,244) |
|
782,436 |
||
财务结果 |
|
附注27 |
(442,941) |
|
— |
|
(442,941) |
|
权益入账被投资单位的利润/(亏损) |
|
注10 |
(1,482) |
|
— |
|
(1,482) |
|
持续经营业务的所得税前利润 |
|
361,257 |
|
(23,244) |
|
338,013 |
||
所得税费用 |
|
附注28 |
(90,111) |
|
— |
|
(90,111) |
|
持续经营业务的所得税后利润 |
|
271,146 |
|
(23,244) |
|
247,902 |
||
本年度综合溢利 |
|
271,146 |
|
(23,244) |
|
247,902 |
||
归母利润 |
|
208,279 |
|
(23,244) |
|
185,035 |
||
非控股权益应占溢利 |
|
附注19 |
62,867 |
|
— |
|
62,867 |
|
基本每股收益(欧元) |
|
附注18 |
0.31 |
|
(0.04) |
|
0.27 |
|
稀释每股收益(欧元) |
|
附注18 |
0.31 |
|
(0.04) |
|
0.27 |
F-25
合并损益表
于2023年12月31日
(以千欧元表示)
|
|
|
|
一体化 |
|
|||
调整 |
重述 |
|||||||
2023 |
Biotek美国 |
2023 |
||||||
净收入 |
|
附注5和24 |
6,591,977 |
|
— |
|
6,591,977 |
|
销售成本 |
|
附注25和26 |
(4,097,406) |
|
(11,089) |
|
(4,108,495) |
|
毛利率 |
|
2,494,571 |
|
(11,089) |
|
2,483,482 |
||
营业费用 |
|
附注25和26 |
(1,761,955) |
|
(5,992) |
|
(1,767,947) |
|
其他收益 |
|
3,042 |
|
— |
|
3,042 |
||
与本集团有类似活动的权益入账被投资单位的利润 |
|
注10 |
63,740 |
|
— |
|
63,740 |
|
经营成果 |
|
799,398 |
|
(17,081) |
|
782,317 |
||
财务结果 |
|
附注27 |
(574,458) |
|
84 |
|
(574,374) |
|
权益入账被投资单位的利润/(亏损) |
|
注10 |
(922) |
|
— |
|
(922) |
|
持续经营业务的所得税前利润 |
|
224,018 |
|
(16,997) |
|
207,021 |
||
所得税费用 |
|
附注28 |
(43,349) |
|
— |
|
(43,349) |
|
持续经营业务的所得税后利润 |
|
180,669 |
|
(16,997) |
|
163,672 |
||
本年度综合溢利 |
|
180,669 |
|
(16,997) |
|
163,672 |
||
归母利润 |
|
59,315 |
|
(16,997) |
|
42,318 |
||
非控股权益应占溢利 |
|
附注19 |
121,354 |
|
— |
|
121,354 |
|
基本每股收益(欧元) |
|
附注18 |
0.09 |
|
(0.03) |
|
0.06 |
|
稀释每股收益(欧元) |
|
附注18 |
0.09 |
|
(0.03) |
|
0.06 |
前几表汇总的对合并资产负债表和合并损益表比较信息的影响转入合并现金流量表,对现金流无实质性影响。
(三)业务合并与剥离
2024
| a) | ImmunoTek血浆中心 |
由于ImmunoTek合作协议(见注10),Grifols于2024年4月1日收购了7个血浆捐赠中心(每个cnter为134,902千美元),并于2024年7月1日收购了7个血浆捐赠中心(每个中心为130,956千美元)。这些收购使Grifols在2024年各自的收购日期获得了对这14个中心的控制权,此前这些中心被视为联合运营。
因此,Grifols应用了分阶段进行的业务合并的要求。然而,考虑到(i)Grifols有效参与共同经营无效及(ii)与共同经营相关的所有资产和负债已在综合财务报表中确认,已支付的对价与资产和负债的公允价值之间的差额(与其账面值没有差异)已在收购日期确认为临时商誉。
F-26
截至收购日,企业合并成本和中期商誉合计详情如下:
|
千个 |
|
千美 |
|
欧元 |
美元 |
|||
已付代价 |
|
245,798 |
|
265,858 |
净资产阶梯式增长1 |
|
— |
|
— |
商誉 |
|
245,798 |
|
265,858 |
收购带来的调整2 |
|
(12,377) |
|
(13,092) |
商誉,调整后净额 |
|
233,421 |
|
252,766 |
1由于公允价值和账面值没有明显差异,因此没有资产净值的阶梯式上升。此外,该净资产此前已在合并财务报表中确认为共同经营的一部分。
2收购导致的调整主要对应于消除筒仓与Immunotek保持的应付净余额。净额指根据合同条款分配给Immunotek的筒仓的累计损失(见附注10)
由此产生的商誉已分配给生物制药部门,包括捐助者数据库、许可证和劳动力。
自与Immunotek达成协议(见附注10)开始以来,这些中心的业务就已经合并,因此,鉴于所有销售交易都在合并过程中消除,因此对营业额没有影响,如果这两笔交易都发生在2024年1月1日,则对结果没有影响。
| b) | 萨斯卡通等离子体中心 |
2023年7月7日,Grifols通过其100%拥有的子公司Grifols Canada Plasma,Inc.(前身为Prometic Plasma Resources,Inc.)从加拿大Plasma Resources Corporation收购了一个血浆捐赠中心,该中心是根据IFRS 3开展的业务。收购价格为11,558千加元(8,018千欧元)。
企业合并的成本、暂定取得的净资产公允价值和暂定取得日商誉的合计明细如下:
|
|
|
|
|
千人 |
|
参考 |
千欧元 |
加元 |
||||
企业合并成本 |
|
|
|
|
|
|
已付代价 |
|
|
|
8,018 |
|
11,558 |
已付总代价 |
|
|
|
8,018 |
|
11,558 |
取得的净资产公允价值 |
|
|
|
160 |
|
231 |
商誉(企业合并成本超过取得的净资产公允价值的部分) |
|
注6 |
|
7,858 |
|
11,327 |
F-27
所收购资产在收购日确定的金额如下:
|
公允价值 |
|||
千人 |
||||
千欧元 |
加元 |
|||
物业、厂房及设备 |
|
96 |
|
138 |
库存 |
|
64 |
|
93 |
总资产 |
|
160 |
|
231 |
取得的净资产总额 |
|
160 |
|
231 |
由此产生的商誉分配给生物制药部门,包括捐助者数据库、许可证和劳动力。整个商誉被认为可以抵税。
| c) | Albajuna Therapeutics,S.L。 |
2023年10月9日,Grifols通过其100%持股的子公司Grifols Innovation and New Technologies Limited(GIANT)达成协议,收购Albajuna Therapeutics,S.L.(以下简称“Albajuna”)剩余51%的股份,总金额为1欧元。
2016年,Grifols进行了375万欧元的资本投资,以换取Albajuna Therapeutics,S.L. 30%的股份。自2018年起,由于根据2016年1月的股东协议计划投资,Grifols持有公司资本的49%的股份。Albajuna Therapeutics,S.L.是一家西班牙研究公司,成立于2016年,主要活动是开发和制造针对HIV的治疗性抗体。
企业合并成本、取得的净资产暂定公允价值和取得日暂定商誉合计明细如下:
|
参考 |
|
千欧元 |
|
企业合并成本 |
|
|
|
|
已付代价 |
|
|
|
— |
已付总代价 |
|
|
|
— |
取得的净资产公允价值 |
|
|
|
(1,794) |
商誉(企业合并成本超过取得的净资产公允价值的部分) |
|
注6 |
|
1,794 |
F-28
取得的资产、负债和或有负债在取得日确定的金额如下:
|
公允价值 |
|
千欧元 |
||
非流动金融资产 |
|
165 |
递延所得税资产 |
|
239 |
贸易和其他应收款 |
|
185 |
现金及现金等价物 |
|
86 |
总资产 |
|
675 |
非流动金融负债 |
|
(2,300) |
流动金融负债 |
|
(164) |
贸易及其他应付款项 |
|
(5) |
负债和或有负债合计 |
|
(2,469) |
取得的净资产总额 |
|
(1,794) |
由于在收购日无法估计未来的经济利益,分配给商誉的总金额在确认时已立即全部减值(见附注6)。
2022
| d) | Grifols Canada Plasma,Inc。 |
2021年12月31日,Grifols通过全资子公司Grifols Canada Therapeutics,Inc.以总计11,127千加元(7,757千欧元)收购Prometic Plasma Resources Inc.的全部股份。
企业合并成本、取得的净资产公允价值和取得日商誉合计明细如下:
千人 |
||||||
|
参考 |
|
千欧元 |
|
加元 |
|
企业合并成本 |
|
|
|
|
|
|
已付代价 |
|
|
|
7,757 |
|
11,127 |
已付总代价 |
|
|
|
7,757 |
|
11,127 |
取得的净资产公允价值 |
|
|
|
4,933 |
|
7,075 |
商誉(企业合并成本超过取得的净资产公允价值的部分) |
|
注6 |
|
2,824 |
|
4,052 |
在交易日,支付的总对价分配给商誉,并根据次年取得的净资产的公允价值重列金额。因此,附注6中反映的金额是两种影响之间的变动,而上一表中的金额显示了最终余额。
F-29
取得的资产、负债和或有负债在取得日确定的金额如下:
公允价值 |
||||
|
|
数千名加拿大人 |
||
千欧元 |
美元 |
|||
其他无形资产 |
|
551 |
|
791 |
使用权 |
|
238 |
|
341 |
物业、厂房及设备 |
|
36 |
|
51 |
库存 |
|
71 |
|
102 |
贸易和其他应收款项 |
|
4,603 |
|
6,602 |
其他流动资产 |
|
9 |
|
13 |
现金及现金等价物 |
|
32 |
|
46 |
总资产 |
|
5,540 |
|
7,946 |
非流动金融负债 |
|
(32) |
|
(46) |
流动金融负债 |
|
(264) |
|
(379) |
贸易及其他应付款项 |
|
(311) |
|
(446) |
负债总额 |
|
(607) |
|
(871) |
取得的净资产总额 |
|
4,933 |
|
7,075 |
由此产生的商誉分配给生物制药部门,包括捐助者数据库、许可证和劳动力。
Grifols Canada Plasma,Inc.收购对集团产生了3,933千欧元的收益影响,从收购之日起至2022财年末。
| e) | Haema Plasma KFT |
2021年2月1日,Scranton Plasma B.V.收购Haema Plasma KFT 100%股权。Scranton Enterprises B.V.(Scranton Plasma B.V.的母公司)是Grifols的股东。
于2021年2月1日,集团就Haema Plasma KFT的股份签署了一份认购期权,该期权于签署后仅12个月可由集团行使,自该期权成为可行使之日起48个月届满。期权价格定为EBITDA减去净债务的13倍。Grifols在签署协议时没有对购买期权协议进行任何金钱上的考虑。
集团拥有购买股权选择权所产生的潜在投票权,这些是实质性的,基于:
| ● | Grifols的看涨期权,该期权赋予其在2022年2月1日之后的任何时间收购Haema Plasma KFT股权的不可撤销的排他性权利(不是义务)。 |
| ● | Grifols致力于提供收集、加工和分发业务方面的支持服务来自捐赠中心的血浆。还有一项血浆供应协议,根据该协议,这些实体生产的血浆将几乎完全用于满足Grifols的需求。 |
| ● | 没有股东协议规定相关决定以非多数表决方式获得批准。 |
以上是Grifols获得对该实体的权力的指标,考虑到看涨期权很可能会被行使,并且Grifols将拥有执行该期权的财务能力。
歼30
因此,在该期权可行使时,该期权赋予了Grifols权力,即使尚未行使,Haema Plasma KFT.因此从2022年起并入Grifols的合并财务报表。
企业合并成本、取得的净资产公允价值和取得日商誉合计明细如下:
|
|
千人 |
|
千人 |
||
参考 |
欧元 |
匈牙利福林 |
||||
看涨期权价格 |
|
|
|
16,948 |
|
6,228,796 |
看涨期权总价格 |
|
|
|
16,948 |
|
6,228,796 |
取得的净资产公允价值 |
|
|
|
2,209 |
|
812,371 |
商誉(企业合并成本超过取得的净资产公允价值的部分) |
|
注6 |
|
14,739 |
|
5,416,425 |
Grifols没有对这一购买选择给出任何金钱上的考虑。
收购的资产、负债和或有负债在合并之日确定的金额如下:
公允价值 |
||||
|
|
千名匈牙利人 |
||
千欧元 |
福林 |
|||
其他无形资产 |
|
37 |
|
13,620 |
使用权 |
|
3,421 |
|
1,257,286 |
物业、厂房及设备 |
|
1,301 |
|
478,222 |
其他非流动资产 |
|
302 |
|
110,810 |
递延所得税资产 |
|
13 |
|
4,742 |
库存 |
|
2,784 |
|
1,022,926 |
贸易和其他应收款 |
|
357 |
|
131,821 |
其他流动资产 |
|
252 |
|
92,769 |
现金及现金等价物 |
|
3,343 |
|
1,228,356 |
总资产 |
|
11,810 |
|
4,340,552 |
规定 |
|
(169) |
|
(61,946) |
非流动金融负债 |
|
(2,517) |
|
(925,074) |
流动金融负债 |
|
(4,281) |
|
(1,573,216) |
贸易及其他应付款项 |
|
(2,100) |
|
(771,861) |
其他流动负债 |
|
(534) |
|
(196,084) |
负债和或有负债合计 |
|
(9,601) |
|
(3,528,181) |
取得的净资产总额 |
|
2,209 |
|
812,371 |
由此产生的商誉分配给生物制药部门,包括捐助者数据库、许可证和劳动力。整个商誉不被视为可抵税。
| f) | VCN Biosciences,S.L。 |
2022年3月10日,Grifols与其他股东达成协议,以7700万美元(690.01万欧元)出售VCN Bioscience,S.L. 100%的已发行流通股。
F-31
由于此次撤资,集团在损益表中的“其他收入”项下确认了7,557千欧元的收入。VCN的净资产于所示日期从合并集团终止确认。
| g) | 生物测试公司 |
2022年4月25日,在获得所有监管批准后,Grifols以146.0853万欧元完成了对Biotest AG 70.18%股本的收购。该交易的结构如下:
| ● | Grifols以欧元收购Tiancheng(Germany)Pharmaceutical Holdings AG全部股权
|
| ● | 交易同时,Grifols向全体股东关闭自愿收购要约,涉及支付欧元
|
此次收购通过2021年发行债券融资(见附注21)。
对Biotest的投资将显着加强Grifols的能力,包括其科技能力,帮助加强血浆药物的可及性、商业存在和研发管道。随着2个新中心的开设,Biotest目前在欧洲拥有28个血浆捐赠中心。
企业合并成本、取得的净资产公允价值和取得日商誉合计明细如下:
|
参考 |
|
千欧元 |
|
企业合并成本 |
|
|
|
|
已付代价 |
|
|
|
1,460,853 |
已付总代价 |
|
|
|
1,460,853 |
取得的净资产公允价值 |
|
|
|
1,157,229 |
商誉(企业合并成本超过取得的净资产公允价值的部分) |
|
注6 |
|
303,624 |
由此产生的商誉分配给生物制药部门。
F-32
收购的资产、负债和或有负债在合并之日确定的金额如下:
公允价值 |
||
|
千欧元 |
|
其他无形资产 |
|
1,172,582 |
使用权 |
|
25,256 |
物业、厂房及设备 |
|
545,667 |
其他非流动资产 |
|
13,969 |
递延所得税资产 |
|
9,109 |
库存 |
|
259,316 |
合同资产 |
|
35,319 |
贸易和其他应收款 |
|
88,249 |
其他流动资产 |
|
25,644 |
现金及现金等价物 |
|
94,662 |
总资产 |
|
2,269,773 |
非控股权益 |
|
(356,386) |
非流动准备金 |
|
(120,298) |
非流动金融负债 |
|
(182,761) |
其他非流动负债 |
|
(9) |
递延所得税负债 |
|
(347,192) |
现行规定 |
|
(18,239) |
流动金融负债 |
|
(35,052) |
贸易及其他应付款项 |
|
(40,489) |
其他流动负债 |
|
(12,118) |
负债和或有负债合计 |
|
(1,112,544) |
取得的净资产总额 |
|
1,157,229 |
作为购买价格分配的一部分,公司确定可识别的无形资产为价值9.46亿欧元的正在进行的研发项目、价值2.02亿欧元的当前产品组合以及价值2400万欧元的某些分销协议。
无形资产的公允价值采用收益法估计,预计现金流量采用8.6%至11%的折现率进行折现。现金流基于用于确定交易价格的估计,并参考交易模型的隐含收益率和加权平均资金成本对所应用的贴现率进行比较。
涉及血浆疗法的在研项目(纤维蛋白原、IGM和IGG)的公允价值按照基于多期超额收益法的收益法进行估算,对于该应用,该等项目的结果在交易发生之日根据项目的临床阶段对成功概率进行了调整。
目前的产品组合包括监管批准、商标、患者关系和与Biotest目前在交易时刻销售的产品相关的医生关系。被确定为无形资产的分销协议涉及在不同地理区域分销某些产品。在这两种情况下,公允价值均采用多期超额收益法确定。
研发进行中项目,目前的产品组合和分销协议分别按20年、30年和7.5年的平均期限按直线法摊销。
F-33
如果收购发生在2022年1月1日,收入将变化154,846千欧元,集团结果将变化(15,434)千欧元。
Biotest集团的收购对集团产生了15,605千欧元的损失,该损失从收购日期一直持续到2022财年末。
本集团在综合损益表“销售、一般及管理费用”项下确认交易费用金额23,600千欧元。
| h) | Access Biologicals LLC。 |
2022年6月15日,Grifols通过其全资子公司Chiquito Acquisition Corp.,通过行使认购期权的方式获得Access Biologicals LLC剩余51%的股份,金额共计1.42亿美元。通过收购100%股权,Grifols获得了对Access Biologicals LLC的控制权,因此被视为集团公司,在完全合并法下并表。先前持股的公允价值与确认账面值之间的差额为72,984千欧元(77,209千美元),该金额的收益在综合损益表“权益入账的被投资方的利润/(亏损)”项下确认(见附注10)。
Access Biologicals LLC的核心业务是收集和制造广泛的生物产品组合。结合封闭式材料采购流程,为体外诊断、生物制药、细胞培养和诊断研发等不同市场提供支持服务。
企业合并成本、取得的净资产公允价值和取得日商誉合计明细如下:
|
|
|
千美 |
|||
参考 |
千欧元 |
美元 |
||||
企业合并成本 |
|
|
|
|
|
|
买入首个49% |
|
|
|
48,218 |
|
51,010 |
购买剩余的51%(现值) |
|
134,742 |
|
142,544 |
||
已付总代价 |
|
|
|
182,960 |
|
193,554 |
先前持有的投资收益 |
|
72,984 |
|
77,209 |
||
收购日之前权益法累计利得 |
|
8,256 |
|
8,735 |
||
提高先前持有的投资 |
|
81,240 |
|
85,944 |
||
取得的净资产公允价值 |
|
|
|
(83,366) |
|
(88,193) |
商誉(企业合并成本超过取得的净资产公允价值的部分) |
|
注6 |
|
180,834 |
|
191,305 |
F-34
收购的资产、负债和或有负债在合并之日确定的金额如下:
公允价值 |
||||
|
千人 |
|
千美 |
|
欧元 |
美元 |
|||
其他无形资产 |
|
82,080 |
|
86,832 |
物业、厂房及设备 |
|
2,589 |
|
2,739 |
其他非流动资产 |
|
75 |
|
79 |
库存 |
|
16,836 |
|
17,811 |
贸易和其他应收款 |
|
7,522 |
|
7,958 |
其他流动资产 |
|
1,529 |
|
1,618 |
现金及现金等价物 |
|
2,987 |
|
3,160 |
总资产 |
|
113,618 |
|
120,197 |
贸易及其他应付款项 |
|
(7,249) |
|
(7,669) |
递延所得税负债 |
|
(22,981) |
|
(24,312) |
其他非流动负债 |
|
(22) |
|
(23) |
负债和或有负债合计 |
|
(30,252) |
|
(32,004) |
取得的净资产总额 |
|
83,366 |
|
88,193 |
由此产生的商誉分配给了生物供应部门。
作为购买价格分配的一部分,公司确定可识别的无形资产为客户关系。
客户关系采用多期超额收益法估值,应用时考虑8.1%的贴现率和平均使用寿命14年的递减率。现金流基于用于确定交易价格的估计,并参考交易模型的隐含收益率和加权平均资金成本对所应用的贴现率进行了比较。收购价款超过所收购净资产预计公允价值的部分,记为商誉。促成其获得认可的因素是获得的劳动力以及集团活动组合的预期收益。
如果收购发生在2022年1月1日,则合并收入将变化4,402千欧元,集团结果将变化1,819千欧元。
Access Biologicals LLC收购对集团产生了9,479千欧元的收益影响,从收购之日起至2022财年末。
本集团在综合损益表营业费用项下确认交易费用48.6万欧元。
| 一) | 歌德科技有限责任公司 |
2022年7月,Grifols达成了一项协议,以现金出售其子公司Goetech LLC(商品名为MedKeeper)的几乎所有资产,企业价值为91,635千美元(9,0002千欧元)。MedKeeper开发和销售创新的移动和基于云的IT应用程序,旨在帮助医院药房提高生产力、流程安全性和合规性。
由于此次撤资,集团在损益表账户中确认了23,106千欧元的收入。歌德科技于指明日期的净资产已从合并集团终止确认。
F-35
(四)重要会计政策
a) |
合并 |
子公司
附属公司被视为集团行使控制权的附属公司。当一家子公司因参与其中而面临或有权获得可变回报,并有能力通过其对其行使的权力影响这种回报时,该子公司即被控制。
子公司的收入、费用及现金流量自取得之日起计入合并报表,该日为本集团有效取得子公司控制权之日。子公司自丧失控制权之日起被排除在合并范围之外。
与集团公司的往来和结余及未实现损益已在合并中予以抵销。
附属公司的会计政策已与集团就类似情况下发生的交易及其他事项的会计政策作出调整。
合并过程中使用的子公司的财务报表与母公司的财务报表截至同一报告日和同一期间。
附录一包括有关纳入集团合并范围的附属公司的资料。
企业合并
采用收购法对企业合并中的收购业务进行会计处理。收购日期为集团取得所收购业务控制权的日期。
企业的收购成本在收购日期确定,包括(i)所收购资产的公允价值,(ii)发生或承担的负债,(iii)已发行的权益工具,(iv)或有对价安排产生的任何资产或负债的公允价值,以及(v)该企业任何先前权益的公允价值。不属于所收购业务交换的任何支出均被排除在外。
购置相关成本在发生时计入费用。
本集团确认取得的可辨认资产以及在取得日按公允价值承担的负债和或有负债。持有待售的非流动资产、职工薪酬负债、以权益工具为基础的支付往来、递延所得税资产和负债及使用权资产和负债及租赁负债不适用本准则。
转让所收购业务的任何非控制性权益的金额的对价以及所收购业务的任何先前权益的收购日公允价值超过可辨认净资产公允价值的部分记录为商誉。如果这些金额低于被收购子公司可辨认净资产的公允价值,则差额作为议价购买在损益中确认。
当现金对价的任何部分递延结算时,未来应付的金额折现为其在兑换日的现值。
或有对价分类为权益或金融负债。分类为金融负债的金额随后按公允价值重新计量,公允价值变动计入损益。
F-36
当企业合并只能临时确定时,可辨认净资产按其暂定值初始入账,确认在计量期间所作的调整,如同在收购日已知一样,在适用时重述上一年度的比较数字。对暂定值的调整仅包含与购置日期存在的事实和情况有关的信息,如果这些信息是已知的,则会影响在该日期确认的金额。计量期自取得之日起不超过十二个月。
如果企业合并是分阶段进行的,则先前持有的被购买方股权的购买日账面金额按其购买日的公允价值重新计量,由此产生的任何收益或损失在损益中确认。
非控股权益
子公司的非控股权益在收购日按其在可辨认净资产公允价值中的权益百分比入账,不考虑潜在的投票权。此外,分配予非控股权益的年内损益及其他全面收益的各组成部分按其拥有权益的百分比按比例分配。业绩中的非控股权益及附属公司的权益分别于综合损益表、综合全面收益表、综合权益变动表及综合资产负债表中分别列示。
在保持控制权的情况下增加和减少子公司的非控制性权益,确认为储备中的权益交易。
联营公司
联营公司是指集团对其施加重大影响的实体,理解为干预财务和经营决策的能力,不存在控制或共同控制。
对联营公司的投资自存在重大影响之日起至公司无法证明存在重大影响之日止,采用权益法核算。
对联营公司的投资最初按收购成本确认,包括直接归属于收购的成本以及取决于未来事件或某些条件达成的任何主动或被动或有对价。
投资成本与本集团应占可辨认净资产公允价值之间的超出部分记为商誉,计入投资账面值。投资成本的金额以及对联营公司净资产的识别和估值一旦评估完毕,不足部分将在确定投资者在其被收购当年的联营公司业绩中所占份额时记录为收入。
联营公司的会计政策已按附属公司所指的相同条款受制于时间和估值标准化。
当被投资公司开展与附注1所述的本集团企业宗旨相同的活动时,本集团在自存在重大影响之日起取得的联营公司的利润或亏损中所占份额记录为贷记或借记为“与本集团活动类似的权益入账被投资方的利润”的投资价值的增加或减少,否则记录为“权益入账被投资方的利润/(亏损)”。同样,集团自日期起取得的联营公司的其他全面收益中所占的份额存在重大影响,则作为联营公司投资价值的增加或减少入账,而按性质划分的平衡分录则在其他全面收益中确认。股息分配记录为投资价值的减少。
当本集团在一项权益入账投资上分担的损失等于或超过其在被投资方的权益时,除非本集团已承担义务或代表被投资方支付了款项,否则本集团不确认额外损失。
F-37
集团应占联营公司损益及权益变动乃根据年末的所有权权益厘定,不考虑潜在投票权的可能行使或转换。然而,集团的份额是在考虑可能行使潜在投票权和其他衍生金融工具的情况下确定的,这些工具实质上给予当前获得与所有权权益相关的经济利益的机会,即参与未来股息和联营公司价值变化的权利。
采用权益法后,本集团评估对联营公司的净投资是否存在减值的客观证据。一些主要证据包括重大累积损失、合同违约、财务困难以及影响联营公司的技术、行业或经济的不利变化。减值计算乃通过比较于联营公司的投资净额的账面值与其可收回金额而厘定,其中可收回金额为使用价值或公允价值减处置成本两者中较高者。在这方面,使用中的价值是根据集团在日常活动产生的估计现金流量现值中所占份额以及最终处置联营公司可能产生的金额计算得出的。对联营公司投资的可收回金额按各联营公司评估(见附注10),除非该投资不构成现金产生单位(CGU)。应用收购方法产生的对联营公司的投资所隐含的商誉或其他资产不计入减值损失。在以后年度,投资价值的转回在收入中确认,但以可收回价值增加为限。减值亏损与集团应占联营公司业绩分开列报。
附录一包括纳入集团合并范围的附属公司和联营公司的信息。
联合协议
合营安排是指存在对一项经济活动分享控制权的合同协议,从而有关活动的决定需要集团和其他参与者的一致同意。对合营安排的投资被归类为共同经营或合营企业,这取决于每个投资者的合同权利和义务,而不是合营安排的法律结构。
当合营安排的参与者有权获得与负债有关的资产和义务时,则考虑共同经营。这类安排按比例合并,整合了附注10所述与交易相关的资产和负债。
合营企业是指协议参与方对净资产享有权利的企业。如附注10所述,这类安排采用权益法纳入综合财务报表。
b)外币交易和余额
以外币进行的交易,在与交易发生日的汇率没有显著差异的情况下,采用上月平均汇率折算为记账本位币。因结算这些交易以及按收盘汇率换算以外币计价的货币资产和负债而产生的外币损益在损益中确认,除非存在递延至权益的合格现金流量套期和合格净投资套期。
汇率变动对外币现金及现金等价物的影响在现金流量表中作为“汇率变动对现金的影响”单独列示。
本位币不是恶性通货膨胀国家本位币的对外业务,采用以下标准进行换算:
| ● | 资产和负债,包括因收购业务而产生的商誉和净资产调整,按每个资产负债表日的收盘汇率折算; |
F-38
| ● | 收入、收入、费用和亏损按上月平均汇率折算,作为交易日汇率的近似值; |
| ● | 因适用上述准则而产生的折算差额在其他综合收益中确认。 |
c)商誉
初步确认后,商誉按成本入账,减任何累计减值亏损,不可扭转。商誉不摊销,但在已识别出表明资产价值潜在损失的事件时,每年或更频繁地进行减值测试。为此目的,业务合并产生的商誉分配给预期将受益于合并协同效应的每个现金产生单位(CGU)或CGU组,并适用附注6中提及的标准。现金产生单位或现金产生单位组别在为内部管理目的而控制商誉的最低层级识别(注6)。
d)无形资产
无形资产按成本(收购或开发)入账,或在企业合并中收购时按公允价值入账,减去累计摊销和任何累计减值损失。
项目研究阶段发生的任何费用,在发生时确认为费用。
与内部产生的无形资产的开发活动相关的成本在以下情况下予以资本化:
| ● | 集团有技术研究证明生产过程的可行性; |
| ● | 有集团承诺完成该资产的生产,使其处于可出售或内部使用的条件; |
| ● | 该资产将产生足够的经济效益; |
| ● | 集团拥有完成该资产开发的技术和财务资源,并开发了预算控制和分析会计系统,使其能够监测预算成本、引入的修改以及实际向各个项目收取的成本。 |
关于新产品或药物的开发成本,只要其经济盈利能力得到合理保证,并且当它们处于关键阶段或与目前在各个市场上市的产品相关的项目相对应时,它们就被资本化,在这两种情况下都具有预期的技术可行性。以前确认为费用的开发成本不在以后期间确认为资产。
根据国际会计准则第38号的规定,单独收购或通过业务合并进行中的研发项目在任何情况下均予以资本化,因为为收购支付的价格反映了对该资产的未来经济利益被本集团使用的可能性的预期。后续成本按照内部产生的无形资产拨备入账。
F-39
本集团对使用寿命有限的无形资产按以下标准按直线法分摊资产成本进行摊销:
|
摊销法 |
|
费率 |
|
开发费用 |
|
直线 |
|
10% |
特许权、专利、许可、商标和类似 |
|
直线 |
|
4% - 20% |
计算机软件 |
|
直线 |
|
33% |
目前已上市产品 |
|
直线 |
|
3% - 10% |
使用寿命不确定的无形资产不进行摊销,但至少每年进行一次减值测试。
集团于每年年底检讨无形资产的可使用年期。最初确定的标准的变化被确认为估计的变化。
e)物业、厂房及设备
物业、厂房及设备按成本减累计折旧及(如适用)累计减值亏损列账。
成本包括(其中包括)建造该资产所使用的直接人工成本及间接归属于该资产的部分成本。
在资产达到可使用状态之前直接归属于该资产的购置或建造所产生的财务费用也构成成本的一部分。
同样,当扩张或改善成本代表资产容量的增加或使用寿命的延长时,它们被列为资产价值的增加。然而,维修费用于发生时在收入中确认。
物业、厂房及设备折旧按资产估计可使用年限减其残值后的直线法计提。
物业、厂房及设备折旧按以下标准厘定:
|
折旧法 |
|
费率 |
|
建筑物 |
|
直线 |
|
1% - 3% |
其他财产、技术设备和机器 |
|
直线 |
|
4% - 10% |
其他不动产、厂房和设备 |
|
直线 |
|
7% - 33% |
集团于各报告期末检讨物业、厂房及设备的残值、使用年限及折旧方法。最初确定的标准的变化被确认为估计的变化。
f)租赁
承租人
确定一项合同是否为或包含租赁,是基于对合同安排的分析,需要评估承租人是否有权控制已识别资产的使用,并在整个租赁期内获得使用该资产的全部经济利益。
租赁期限为考虑到每项合同的初始期限的不可撤销期间,除非集团拥有单方面延期或终止选择权,且有合理把握将行使该选择权,在此情况下将考虑相应的延期或提前终止期限。
歼40
在本集团作为承租人的租赁合同中,在租赁开始日(即标的资产可供使用之日)确认:
| ● | 租赁期限内分期支付的现值负债,在合同明示的情况下,以增量借款或利率作为贴现率, |
| ● | 使用权资产,代表标的租赁资产在租赁期内的使用权。 |
租赁负债包括固定租赁付款减去任何奖励,以及取决于租赁开始日期已知的指数或利率的可变付款。还包括在承租人合理确定行使购买选择权时的行权价格。初始确认后,负债由租赁负债的利息增加,由支付的款项减少。如果应付金额和租赁条款发生变化,负债也会重新计量。包含在租赁付款中的与维修、电力、水、燃气、安保、清洁等相应的付款不属于租赁负债的一部分,确认为费用。
增量借款利率的确定考虑到:(i)地理区域、(ii)财务期限、(iii)租赁期限、(iv)作为参考利率的无风险利率和(v)财务利差。
使用权资产按成本减累计摊销和减值损失(如有)计量,并因重新计量租赁负债而调整。成本包括租赁负债的初始估值金额,以及先前在租赁开始日期之前或在租赁开始日期支付给出租人的任何金额减去出租人收到的任何奖励和解除租赁资产的估计成本。使用权的摊销按资产的预计使用寿命或租赁期中较短者按直线法进行。
本集团对租赁期为12个月或以下或租赁资产价值(个别)在新建时低于5,000美元或等值其他货币的合同适用确认例外情况。因此,在这些情况下,应计金额将在租赁期内确认为费用。
出租人
当集团作为出租人时,它将经营租赁和融资租赁之间的合同分类。本集团作为出租人同时保留租赁资产所有权附带的很大一部分风险和报酬的租赁被视为经营租赁。否则,该租赁作为融资租赁处理。
g)非金融资产减值
商誉和使用寿命不确定的无形资产不进行摊销,每年进行减值测试,或在发生表明可能发生减值的事件或情况变化时更频繁地进行减值测试。
每当有事件或情况变化显示账面值可能无法收回时,其他资产均会进行减值测试。
当可收回金额低于资产账面值时,两项金额之间的差额在综合损益表中确认减值亏损。
可收回金额为资产的公允价值减去处置成本后与基于使用该资产预期产生的贴现未来现金流量的使用中估计价值两者中的较高者。使用中价值的估计考虑了对现金流量的数量或时间、货币的时间价值、承担与资产相关的不确定性所需支付的价格以及影响与资产相关的未来现金流量估值的其他因素的可能变化的预期。
F-41
为评估减值损失,资产按有可单独识别的现金流入且在很大程度上独立于其他资产或资产组(现金产生单位)的现金流入的最低层级进行分组。非金融资产(商誉除外)的减值损失在每个报告期末进行可能转回的审查。
与现金产生单位减值有关的亏损初步分配以减少(如适用)归属于现金产生单位的商誉价值,然后根据每项资产的账面值按比例分配给现金产生单位的其他资产,每项资产的限额为其公允价值减去处置成本、其使用价值和零中的较高者。
与商誉相关的减值损失是不可逆的。
h)金融工具
金融资产
排名
金融资产的分类是根据这些资产的合同现金流量特征以及代表如何管理金融资产以实现特定业务目标的业务模式确定的。在确定现金流量是否通过从资产收到合同现金流量而获得时,考虑了以前期间销售的频率、价值和时间、这些销售的原因以及对未来销售活动的预期。这些信息提供了指示性数据,说明集团关于金融资产管理的既定目标是如何实现的,更具体地说,是如何获得现金流量的。
因此,金融资产根据业务模式按以下估值类别分类,仅在且仅在其管理金融资产的业务模式发生变化时才重新分类:
a) |
以摊余成本计量的金融资产:包括金融资产,包括那些允许在有组织的市场上交易的金融资产,本集团在以持有金融资产为目标的业务模式下持有该投资以收取执行合同产生的现金流量,而该资产的合同条款在特定日期产生的现金流量仅是本金和未偿本金利息的收取。 |
总体而言,以下被列入这一类别:
一) |
贸易应收款项:为延期付款的贸易交易销售货物或提供服务而产生,以及 |
二) |
应收非贸易业务款项:这些款项产生自本集团授予的贷款或信贷,其收款金额已确定或可确定。 |
b) |
以公允价值计量且其变动计入其他综合收益的金融资产:这一类别包括其合同条件在特定日期产生现金流量的金融资产,这些现金流量仅是对未偿还本金金额的本金和利息的收取,并在其目标是通过获取合同现金流量和出售金融资产来实现的业务模式框架内持有。本集团在初始确认时不可撤销地指定的权益工具投资也包括在这一类别中,前提是这些投资不是为交易而持有,也不以成本计价。 |
c) |
以公允价值计量且其变动计入损益的金融资产:包括为交易而持有的金融资产以及未被划分为上述任何类别的金融资产。也包括在这一类别中的是集团在初始确认时可选择指定的金融资产,否则这些资产将被包括在另一类别中,因为这种指定消除或显着减少了否则会产生的估值不一致或会计不匹配。 |
F-42
初步测量
金融资产一般按所给予代价的公允价值加上可直接归属的交易成本初始入账。然而,直接归属于以公允价值计量且其变动计入损益的资产的交易成本在当年损益表中确认。
后续测量
以摊余成本计量的金融资产采用该估值标准入账,采用实际利率法将应计利息计入损益表。
计入公允价值类别且其变动计入其他综合收益的金融资产按公允价值入账,未扣除处置可能产生的任何交易费用。公允价值变动直接记入权益,直至该金融资产被终止确认或减值,此时如此确认的金额计入损益表。
以公允价值计量且其变动计入损益的金融资产以公允价值计量,公允价值变动结果计入损益表。
金融资产处置
金融资产在收取与其相关的现金流量的权利已届满或已转移且本集团已实质转移所有权的风险和报酬时终止确认。同样地,它们在发生催收权转让时从资产负债表中处置,其某些风险与要素共担,例如违约风险,但存在控制权向要素转移的情况,理解为单方面有能力将这些资产出售给非关联第三方,而无需对出售实施额外限制。
减值
本集团在未来的基础上评估与其以摊余成本和以公允价值计入其他综合收益的债务工具相关的预期信用损失。所应用的减值方法取决于信用风险是否已显着增加。
对于贸易应收款项,本集团采用IFRS 9允许的简化方法,该方法要求从初始确认应收款项开始记录预期损失,从而本集团将预期信用损失确定为该金融工具预期存续期内该等损失的概率加权估计。
所使用的实际解决方案是使用基于细分为同质资产组的拨备矩阵,应用这些组的违约率历史信息,并应用未来经济状况的合理信息。
违约率是根据过去一年的当前违约经验计算的,因为这是一个非常动态的市场,并根据当前和历史经济状况之间的差异并考虑预测信息进行调整,这是合理可用的。
金融负债
本集团承担或发生的金融负债按以下计量类别分类:
a) |
以摊余成本计量的金融负债:指本集团因购买商品和服务进行贸易经营而产生的借项和应付款项,或不具有商业渊源、不属于衍生工具、由本集团收到的贷款或信贷经营而产生的借项和应付款项。 |
F-43
这些负债按已收对价的公允价值进行初始计量,并根据可直接归属的交易成本进行调整。所收到的金额与其偿还值之间的任何差额,在债务偿还期内采用实际利率法在综合损益表中确认。
b)以公允价值计量且其变动计入损益的金融负债。
负债衍生金融工具以公允价值计量,遵循与上一节所述以公允价值计量且其变动计入损益的金融资产相对应的相同标准。
本集团在产生金融负债的义务消灭时终止确认金融负债,特别是在向供应商支付货物和服务款项的商业交易中。
资产和负债在资产负债表中单独列报,并仅在本集团拥有可强制执行的权利以抵消已确认的金额,此外打算以净额结算金额或同时变现资产和清偿负债时,才按其净额列报。
权益工具
本集团持有以公允价值计量的金融资产,主要为权益工具。当集团管理层已选择在其他综合收益中以权益投资的公允价值列示损益时,初始确认后,权益工具以公允价值计量,在其他综合收益中确认损益。在其他全面收益中确认的金额不会重新分类至损益,而是在工具终止确认时重新分类至储备。当集团收取付款的权利确立时,此类投资的股息继续在损益中确认为其他收入。
i)衍生金融工具和套期保值活动
金融衍生工具在合约日和每年年末按公允价值确认。确认收益或损失的方法取决于衍生工具是否被归类为套期工具,如果是,则被套期资产的性质。
出于会计目的,它们分类如下:
(一)符合现金流量套期会计条件的衍生工具
套期保值有效性
套期有效性在套期关系开始时确定,并通过定期的预期有效性评估,确保被套期项目与套期工具之间存在经济关系。
在欧元/美元交叉货币互换等衍生工具中,本集团采用假设衍生工具方法评估有效性。这种假设的衍生工具是在不包含信用风险和货币利差的情况下构建的。在假设派生法下,实际货币互换公允价值的累计变动,剔除货币价差的影响,将与假设互换公允价值的累计变动进行比较。因此,假设衍生工具被构建为具有固定欧元支付、固定美元收据且不包含信用风险和外币利差且在指定日期公允价值为零的交叉货币互换。
认可
在套期关系开始时,本集团记录套期工具与被套期项目之间的经济关系,包括套期工具的现金流量变动是否预计会抵消被套期项目的现金流量变动。集团记录其风险管理目标和策略,以进行其对冲交易。
F-44
指定分类为现金流量套期的衍生工具公允价值变动的有效部分,在“现金流量套期准备”项下确认为权益。在交叉货币互换的情况下,将套期保值关系的货币价差排除在外,作为权益中的套期保值成本处理。无效部分对应的损益在“金融工具公允价值变动”项下立即计入当年损益。
计入股东权益的套期保值准备金累计金额,在被套期项目影响损益或被认定无效时转入损益。
被指定为套期的衍生工具的公允价值详见附注30计入股东权益的套期储备变动情况详见附注17(c)。
(二)不符合套期会计条件的衍生工具
当衍生品不符合套期保值会计准则时,被归为“为交易而持有”。公允价值变动立即在综合损益表中确认。
此外,Grifols还评估嵌入衍生工具是否存在于合约和金融工具中。结合了主合同和金融衍生工具(嵌入式衍生工具)的金融工具被称为混合型金融工具。在混合金融工具中,本集团评估衍生工具的风险和特征是否与主合同的风险和特征密切相关。如确定衍生工具的价值与合同的公允价值密切相关,本集团不对衍生工具进行单独核算。反之,如果衍生工具的风险和特征与主合同的风险和特征不密切相关,且主合同不以公允价值计量,则确认衍生工具并在合并损益表中单独确认公允价值变动入账。目前没有与主合同分开的金融工具。
j)自有权益工具
库存股收购按收购成本入账,减少股权直至处置时。库存股票处置收益或损失记入合并资产负债表“准备金”项下。与自有权益工具相关的交易成本,扣除税项后,记为权益减少。
k)存货
存货按加权平均成本或可变现净值孰低列示。可变现净值是在正常经营过程中的预计售价,减去完成生产的预计成本和进行销售所必需的成本。对于原材料和其他用品来说,就是重置成本。
成本包括直接材料、直接人工和适当比例的间接可变成本和固定成本,后者按生产资料正常工作能力分摊。血浆库存成本包括交付给捐献者的金额,或卖方从第三方购买时开具发票的金额,以及收集过程中使用的产品和设备的成本,以及租赁和储存成本。外购存货的成本在确定其特许权的条件很可能得到满足时,在扣除折扣和返利后确定。管理和行政管理费用等间接费用在发生期间确认为费用。
任何先前确认的存货减值调整在导致减值的情况不再存在或有明确证据表明经济环境变化导致可变现净值增加时,从“销售成本”项下的收入中转回。存货减值调整的转回仅限于成本与存货新增可变现净值孰低者。
F-45
l)现金及现金等价物
现金及现金等价物包括库存现金、银行活期存款、原期限为三个月及以下、易于转换为已知金额现金、价值变动风险不大的其他短期高流动性投资。
m)政府补助
政府补助在有合理保证满足补助所附条件并收取补助时予以确认。
不可退还的资本赠款按原始授予金额记入合并资产负债表的负债端,并在相关融资资产折旧时在合并损益表中确认。
作为已发生的费用或损失的补偿或为提供与未来费用无关的即时财务支持而收到的赠款,记入综合损益表。
以适用低于市场利率的形式包含隐性援助的金融负债,初始按公允价值确认。这一价值之间的差额,酌情根据发放金融负债的成本与收到的金额进行调整,根据赠款的性质记录为政府赠款。
n)雇员福利
(i)界定缴款计划
本集团将向界定缴款计划作出的缴款在其产生时予以记录。应计供款金额于供款有关年度于综合损益表「人事开支」项下入账。
(二)设定受益计划
确认的负债对应于合并资产负债表日该义务的现值减去计划资产的公允价值。设定受益义务每年由独立精算师使用预计单位贷记法计算。债务的现值是通过按以将支付福利的货币计价且期限与相关债务类似的债券的利率对估计的未来现金流量进行折现确定的。精算假设变动或假设与实际差异产生的精算损益在“其他综合收益”项下确认权益。过往服务成本在综合损益表“人事费用”项下确认。
(三)解雇福利
终止福利于以下日期中较早的日期确认:(a)当集团无法再撤回要约时或(b)当集团在IAS 37范围内确认重组成本并因此导致支付终止福利时。
(四)短期雇员福利
本集团以带薪休假形式确认短期补偿的预期成本,其权利随着雇员提供使其有权获得的服务而产生。
本集团确认利润分享或员工激励计划的预期成本时,由于过去的事件而存在当前的法定或推定义务,并且能够对该义务的价值作出可靠估计。
F-46
(五)股份支付
集团已根据权益工具向为公司提供服务的若干管理团队成员授予不同的激励计划,将视计划以权益工具或现金结算。
授予的权益工具在员工完成一定服务期和/或达到激励计划规定的目标时归属。Grifols将在归属期内提供此类服务时从其雇员获得的服务确认为综合损益表中的人事费用,如果交易以权益结算,则确认为相应的权益增加,如果交易以现金结算,则确认为相应的负债,金额基于权益工具的价值。
在与员工进行的以权益结算的交易中,确认的金额对应于一旦满足约定条件将被结算的金额,在归属期内不会被审查或重新估值,因为该承诺是以权益结算的。所获得服务的公允价值是通过估计在授予日授予的股份的公允价值(扣除雇员在业绩期间无权获得的估计股息)来估计的。
对于以现金结算的计划,所接受的服务和相应的负债按负债的公允价值确认,参考满足确认要求的日期。随后,直至结算,相应负债按其在每年结账日的公允价值计量,年内发生的任何估值变动均在综合损益表中确认。公允价值乃参考于估计日期的股份市值,扣除雇员在业绩期内无权获得的估计股息后厘定。
o)条文
当集团因过去的事件而产生现时的法定或推定义务、很可能需要体现经济利益的资源流出以结清该义务且能够对该义务的金额作出可靠估计时,确认拨备。未就未来经营亏损确认拨备。
拨备金额对应于结清现时债务所需的付款截止日期的最佳估计,在考虑到与拨备相关的风险和不确定性以及(当重大时)贴现的财务影响后,前提是每一期的付款能够可靠地确定。
p)收入确认
销售商品或服务的收入按反映集团预期在客户取得对所提供商品或服务的控制权时(即当客户有能力指导使用商品或服务时)因向客户转让商品或服务而有权收取的对价的金额确认。在与客户的合同中承诺的对价可能包括固定金额、可变金额,或两者兼而有之。对价金额可能因折扣、回扣、奖励、绩效奖金、罚款或其他类似项目而有所不同。可变对价仅在确认的收入金额很可能不会在未来发生重大转回时才计入交易价格。收入列报时扣除增值税和任何其他金额或税项,这些金额或税项实质上对应于代表第三方收到的金额。
(一)货物销售
当集团通过向客户转让承诺的货物来履行履约义务时,确认销售货物的收入。当客户获得对该资产的控制权时,商品即被转让。在评估履约义务的履行情况时,本集团考虑控制权转移的以下指标,其中包括但不限于:
| ● | 集团目前有权就货物付款 |
F-47
| ● | 顾客拥有合法的向善权利 |
| ● | 集团已转让实物拥有的货品 |
| ● | 客户具有资产所有权的重大风险和报酬 |
| ● | 顾客接受了好东西 |
集团承诺转让的货物性质主要为:销售货物、销售设备、通行费合同、维修和技术服务合同、培训、许可、特许权使用费和专有技术及工程合同等。
在确定交易价格时,假定货物和/或服务是按照合同条款转让的。承诺给客户的对价可能包括固定金额、可变金额,或两者兼而有之。价格的估计应考虑到退货、退单/批量折扣或其他激励措施的可变对价(如适用)的影响,前提是同样的可能性很大。
集团参与美国各州医疗补助计划。医疗补助回扣准备金在销售记录时记录,金额等于可归属于此类销售的估计医疗补助回扣索赔。集团主要根据历史上的医疗补助回扣经验、与医疗补助计划相关的适用法律的法律解释以及有关可能影响回扣金额的医疗补助计划指导方针和法规变化的任何新信息来确定医疗补助回扣的应计估计。集团考虑未决的医疗补助索赔、医疗补助付款以及分销渠道中的库存水平,并定期调整拨备以反映实际经验。尽管返利支付通常会滞后一到两个季度,但针对实际经验的调整并不重要。
按照标准行业惯例,若干客户已与集团订立合约,以取得根据最低采购数量、数量折扣或现金折扣而有资格获得价格折扣的采购。这些折扣是根据客户的实际采购数据和后来知道客户实际采购数据时的历史经验,在确认收入的同月作为收入和应收账款的减少入账。
在美国,本集团与某些客户订立协议,以确定商品的合同价格,这些实体从其选择的授权批发商或分销商(统称“批发商”)处采购。因此,当这些实体以低于本集团向批发商收取的价格的合同价格向批发商购买产品时,本集团向批发商提供称为退款的信贷。本集团于出售时将应计退款入账。退单的备抵账户是基于集团对批发商库存水平的估计以及批发商根据过去的退单历史和其他因素按合同价格直接销售产品的预期。集团定期监测影响回扣估计的因素,并在认为实际回扣可能与既定备抵账户不同时进行调整。这些调整发生在相对较短的时间内。由于这些退款通常在销售后30至45天内结算,因此对实际金额的调整并不重要。
剩余贴现的平仓金额,视拨备类型在90至180天内于次年结算。
(二)提供服务
提供服务的收入将随着时间的推移而确认,前提是满足以下标准:(i)客户在Grifols的活动进行时同时获得和消耗其提供的利益;(ii)Grifols生产或改进客户在资产生产时控制的资产;(iii)Grifols为客户生产特定资产,不能给予其替代用途,并且对迄今已开展的活动拥有可强制执行的收款权。如果履约义务随着时间的推移而得到履行,则考虑完成的百分比,在其得到满足时确认收入。如果履约义务不符合上述条件,则通过以下指标进行评估,确定该资产的控制权已转移给委托人:(i)通过实物占有资产而Grifols有权要求其付款;(ii)委托人已接受该资产,该资产所有权固有的重大风险和报酬并具有法定所有权。在特定日期履行履约义务的,在该日期确认相应收入。
F-48
q)所得税
当年的所得税费用或税收抵免包括当期税项和递延税项。
当期税是按各辖区适用税率计算的当年应纳税所得额的应纳税额。它是根据子公司和联营公司经营和产生应税收入的国家在资产负债表日已颁布或即将颁布的法律计算的。集团定期评估有关适用税务条例须予解释的情况在税务申报表中采取的立场,并在确定相应的税务收益或损失、税基、未使用的税收抵免或税率时考虑不确定税务处理中的此类不确定性。
递延税项乃就资产及负债的计税基础与其于综合财务报表的账面值之间产生的暂时性差异确认。采用相关递延所得税资产变现或递延所得税负债清偿时预计适用的资产负债表日已颁布或即将颁布的税率(及法律)确定。
确认递延税项负债和资产:
| ● | 确认递延所得税负债: |
本集团在所有情况下确认递延税项负债,但以下情形除外:
| o | 因初始确认商誉或非企业合并的交易中的一项资产或负债而产生,在交易发生日既不影响会计核算结果也不影响计税基数且在交易发生日不对同一金额提出应税可抵扣暂时性差异。 |
| o | 或对应于本集团有能力控制其转回时间且在可预见的未来不大可能发生转回的子公司、联营公司及合营企业投资相关的差异。 |
| ● | 确认递延所得税资产: |
本集团在以下情况下确认递延税项资产:
| o | 很可能会有足够的未来税收利润来抵消这些利润,或者当税收立法考虑未来将递延税收资产转换为应付公共行政当局的索赔的可能性时。但非企业合并的交易中初始确认资产或负债产生的资产,在交易发生日既不影响会计核算结果也不影响计税基数且在交易发生日不提出相同金额的应纳税、可抵扣暂时性差异的,不予确认。 |
| o | 它们对应于与子公司、联营公司和合营企业投资相关的暂时性差异,前提是该暂时性差异将在可预见的未来转回,并预计将产生正的未来税收利润以抵消该差异。 |
当公司能够控制暂时性差异转回的日期且该暂时性差异在可预见的未来很可能不会转回时,对外业务投资的账面价值与计税基础之间的暂时性差异不确认递延所得税资产和负债。同样,如果递延税项负债是由商誉的初始确认产生的,则不确认这些负债。最后,递延所得税资产只有在很可能有足够的未来应课税利润可用于抵销时才予以确认。
递延所得税资产和负债在具有抵销当期所得税资产和负债的法定可执行权且递延所得税余额涉及同一税务机关时予以抵销。当主体具有依法可执行的抵销权并拟以净额结算或同时变现资产和清偿负债时,当期税收资产和负债予以抵销。
F-49
当期或递延所得税在损益中确认,除非产生于已在其他综合收益中确认或直接在权益中确认的交易或经济事件。在这种情况下,该税款也分别在其他综合收益或直接在权益中确认。
r)分部报告
经营分部是集团的一个组成部分,从事可能从中赚取收入和产生费用的业务活动,其经营业绩由集团的主要经营决策者定期审查,以便决定分配给该分部的资源、评估其业绩并可获得离散的财务信息。
s)环境
该集团开展的业务的主要目的是防止、减少或修复因其活动而对环境造成的损害。
为在其活动中持久使用而购置的不动产、厂房和设备项目,其主要目的是尽量减少环境影响以及保护和改善环境,包括减少或消除集团经营活动产生的未来污染,通过应用与附注4(e)所述一致的计量、列报和披露标准确认为资产。
t)持有待售的非流动资产
仅当集团确定出售的可能性很大、管理层致力于出售的决定以及完成出售所需的所有行动表明不太可能对出售作出重大改变或决定将被撤回时,才视为符合持有待售分类的标准。这些资产按其账面价值和公允价值减去其转让成本两者中的较低者计量。一旦归类为持有待售,它们不再折旧或摊销。
如果由于Grifols无法控制的事件或情况造成一些延误,且有充分证据表明该出售承诺,尽管完成出售的期限延长至一年以上,本集团仍将该等资产呈列为持有待售资产。
持有待售的非流动资产在财务状况表中分别列示为负债(如存在)的“持有待售的非流动资产和处置组”和“与持有待售的非流动资产和处置组相关的负债”。
此外,集团将代表单独的主要业务线或地理区域的重要且可与其余部分分开考虑的组件(现金产生单元)视为已终止经营业务,这些组件以替代方式出售或处置或符合列报为持有待售的要求。同样,那些完全以最终结果被转售的实体被视为已终止经营。这些已终止经营业务的除税后结果在综合损益表中单独列示为“已终止经营业务的除税后结果”。
u)集团公司之间的交易
集团公司之间的交易,除与合并、分拆和非现金业务贡献有关的交易外,按所给予或收到的对价的公允价值确认。该价值与约定金额之间的差额根据交易的基础经济实质予以确认。
在对集团公司的非货币出资中,出资人将按股权投资的账面价值对其权益进行估值,在交易发生之日的合并财务报表中。
出资人收到的分配给利息的价值与出资投资的账面值之间的任何差额将在准备金中确认。
F-50
(五)分部报告
根据国际财务报告准则第8号“经营分部”,经营分部的财务信息在随附的附录二中报告,该附录构成本合并财务报表附注的组成部分。
经营分部的定义是基于集团开展的不同活动及其重要意义,以及管理业务的组织结构。它还考虑管理层和管理人员如何分析关键的运营和财务指标,以做出有关资源分配的决策并评估集团的业绩。
经营分部的资产、负债、收入和支出包括直接可靠的应占项目。集团未归属于经营分部的项目有:
| ● | 资产负债表:权益、现金及现金等价物和贷款及借款。 |
| ● | 损益表:财务业绩及所得税。 |
a) |
经营分部 |
经营分部如下:
| ● | BioPharma:将所有与人血浆衍生产品相关的活动集中用于治疗用途。 |
| ● | 诊断:包括诊断检测设备、试剂等设备的营销,由集团或其他公司制造。 |
| ● | Bio Supplies:包括与用于非治疗用途的生物制品和向第三方销售血浆相关的交易。 |
| ● | 其他:包括向第三方提供制造服务和研究活动。它还包括由集团制造并拟用于医院药房的医药产品,以及与集团自身产品互补的产品的营销。 |
2024年度、2023年度及2022年度按产品组别划分的净收益详情如下:
千欧元 |
||||||
|
2024 |
|
2023 |
|
2022 |
|
生物制药 |
|
|
|
|||
血红素衍生物 |
|
6,142,588 |
|
5,558,301 |
|
5,005,382 |
诊断 |
|
|||||
输血医学 |
|
625,217 |
|
648,479 |
|
640,604 |
其他诊断 |
|
19,681 |
|
21,790 |
|
21,740 |
生物用品 |
215,664 |
159,957 |
146,076 |
|||
其他 |
|
209,232 |
|
203,450 |
250,165 |
|
合计 |
|
7,212,382 |
|
6,591,977 |
6,063,967 |
|
集团得出结论,血液衍生产品具有足够的相似性,可以作为一个整体来考虑,原因如下:
| ● | 所有这些产品都是人类血浆衍生物,并以类似方式制造。 |
| ● | 分销这些产品的客户和方法是相似的。 |
| ● | 所有这些产品都受制于相同的生产法规和相同的监管环境。 |
F-51
截至2024年12月31日,销售商品和服务净收入的94.9%已在某个时间点确认(2023年为98.0%,2022年为97.6%)。
b)地理信息
地理信息分为四个方面:
| ● | 美利坚合众国和加拿大 |
| ● | 西班牙 |
| ● | 欧盟其他地区 |
| ● | 世界其他地区 |
这四个经营分部的定义主要是由于集团管理层在应对特定经济情景时为管理其收入而设置的地理级别。集团的主要框架与这一地理分部分组一致,包括对其商业运营及其信息系统的监控。
为地理区域报告的财务信息是基于在这些市场上向第三方的销售以及资产的位置。
c)主要客户
于2024年及2022年,均没有任何客户占集团毛收入的10%以上。于2023年,生物制药经营分部的一名客户约占集团毛收入的10.37%。
F-52
(六)商誉
2024年12月31日合并资产负债表本标题的详细情况和变动情况如下:
千欧元 |
||||||||||||||
|
|
余额 |
|
商业 |
|
|
|
翻译 |
|
余额 |
||||
段 |
31/12/2023 |
组合 |
处置 |
减值 |
差异 |
31/12/2024 |
||||||||
净值 |
|
|
|
|||||||||||
Grifols英国有限公司(英国) |
|
生物制药 |
7,907 |
— |
— |
— |
380 |
8,287 |
||||||
Grifols Italia S.P.A。(意大利) |
|
生物制药 |
6,118 |
— |
— |
— |
— |
6,118 |
||||||
Biomat USA,Inc.(美国) |
|
生物制药 |
868,674 |
— |
(11,037) |
— |
54,756 |
912,393 |
||||||
Grifols Australia Pty Ltd.(澳大利亚)/Medion Diagnostics AG(瑞士) |
|
诊断 |
9,846 |
— |
— |
— |
(251) |
9,595 |
||||||
Grifols Therapeutics,Inc.(美国) |
|
生物制药 |
2,011,030 |
— |
— |
— |
127,952 |
2,138,982 |
||||||
Progenika BioPharma,S.A.(西班牙) |
|
诊断 |
40,516 |
— |
— |
— |
— |
40,516 |
||||||
Grifols Diagnostic(Novartis & Hologic)(美国、西班牙和香港) |
|
诊断 |
2,628,995 |
— |
— |
— |
165,805 |
2,794,800 |
||||||
Kiro Grifols,S.L.(西班牙) |
其他 |
24,376 |
— |
— |
(8,961) |
— |
15,415 |
|||||||
Haema,AG。(德国) |
生物制药 |
190,014 |
— |
— |
— |
— |
190,014 |
|||||||
BPC Plasma,Inc.(原Biotest Pharma,Corp.)(美国) |
生物制药 |
155,370 |
— |
— |
— |
9,885 |
165,255 |
|||||||
Plasmavita Healthcare GmbH(德国) |
生物制药 |
9,987 |
— |
— |
— |
— |
9,987 |
|||||||
Alkahest,Inc(美国) |
其他 |
79,615 |
— |
— |
— |
5,066 |
84,681 |
|||||||
Grifols Canada Therapeutics,Inc(加拿大) |
生物制药 |
152,841 |
— |
— |
— |
(3,129) |
149,712 |
|||||||
GigaGen,Inc(美国) |
其他 |
115,434 |
— |
— |
— |
7,344 |
122,778 |
|||||||
Haema Plasma KFT。(匈牙利) |
生物制药 |
14,149 |
— |
— |
— |
(982) |
13,167 |
|||||||
Grifols Canada Plasma,Inc.(原Prometic Plasma Resources,Inc.)(加拿大) |
生物制药 |
10,503 |
— |
— |
— |
(215) |
10,288 |
|||||||
Grifols Biotest Holdings GmbH/Biotest AG(德国) |
生物制药 |
303,624 |
— |
— |
— |
— |
303,624 |
|||||||
Grifols Bio Supplies Inc(美国) |
生物用品 |
173,128 |
— |
— |
— |
11,015 |
184,143 |
|||||||
Biomat Holdings LLC(美国) |
其他 |
— |
233,421 |
— |
— |
9,880 |
243,301 |
|||||||
|
|
6,802,127 |
233,421 |
(11,037) |
(8,961) |
387,506 |
7,403,056 |
|||||||
(见注3) |
||||||||||||||
F-53
截至2023年12月31日的合并资产负债表的这一标题的详细情况和变动情况如下:
千欧元 |
||||||||||||||
|
|
余额 |
|
商业 |
|
|
|
翻译 |
|
余额 |
||||
段 |
31/12/2022 |
组合 |
处置 |
转让 |
差异 |
31/12/2023 |
||||||||
净值 |
|
|
|
|||||||||||
Grifols英国有限公司(英国) |
|
生物制药 |
7,747 |
— |
— |
— |
160 |
7,907 |
||||||
Grifols Italia S.P.A。(意大利) |
|
生物制药 |
6,118 |
— |
— |
— |
— |
6,118 |
||||||
Biomat USA,Inc.(美国) |
|
生物制药 |
899,948 |
— |
— |
— |
(31,274) |
868,674 |
||||||
Grifols Australia Pty Ltd.(澳大利亚)/Medion Diagnostics AG(瑞士) |
|
诊断 |
9,859 |
— |
— |
— |
(13) |
9,846 |
||||||
Grifols Therapeutics,Inc.(美国) |
|
生物制药 |
2,083,432 |
— |
— |
— |
(72,402) |
2,011,030 |
||||||
Progenika BioPharma,S.A.(西班牙) |
|
诊断 |
40,516 |
— |
— |
— |
— |
40,516 |
||||||
Grifols Diagnostic(Novartis & Hologic)(美国、西班牙和香港) |
|
诊断 |
2,722,785 |
— |
— |
— |
(93,790) |
2,628,995 |
||||||
Kiro Grifols,S.L.(西班牙) |
奥特罗斯 |
24,376 |
— |
— |
— |
— |
24,376 |
|||||||
Haema,AG。(德国) |
生物制药 |
190,014 |
— |
— |
— |
— |
190,014 |
|||||||
BPC Plasma,Inc.(原Biotest Pharma,Corp.)(美国) |
生物制药 |
160,964 |
— |
— |
— |
(5,594) |
155,370 |
|||||||
Plasmavita Healthcare GmbH(德国) |
生物制药 |
9,987 |
— |
— |
— |
— |
9,987 |
|||||||
Alkahest,Inc(美国) |
奥特罗斯 |
82,481 |
— |
— |
— |
(2,866) |
79,615 |
|||||||
Grifols Canada Therapeutics,Inc(加拿大) |
|
生物制药 |
154,775 |
— |
— |
— |
(1,934) |
152,841 |
||||||
GigaGen,Inc(美国) |
奥特罗斯 |
119,590 |
— |
— |
— |
(4,156) |
115,434 |
|||||||
Haema Plasma KFT。(匈牙利) |
生物制药 |
13,529 |
— |
— |
— |
620 |
14,149 |
|||||||
Grifols Canada Plasma,Inc.(原Prometic Plasma Resources,Inc.)(加拿大) |
生物制药 |
2,802 |
7,858 |
— |
— |
(157) |
10,503 |
|||||||
Grifols Biotest Holdings GmbH/Biotest AG(德国) |
生物制药 |
303,624 |
— |
— |
— |
— |
303,624 |
|||||||
Access Biologicals,LLC(美国) |
生物用品 |
179,362 |
— |
— |
(174,427) |
(4,935) |
— |
|||||||
Grifols Bio Supplies Inc(美国) |
生物用品 |
— |
— |
— |
174,427 |
(1,299) |
173,128 |
|||||||
AlbaJuna Therapeutics,S.L(西班牙) |
奥特罗斯 |
— |
1,794 |
(1,794) |
— |
— |
— |
|||||||
7,011,909 |
9,652 |
(1,794) |
— |
(217,640) |
6,802,127 |
|||||||||
(见注3) |
||||||||||||||
减值测试:
CGU对应于报告分部,但Others分部对应Kiro Grifols、Alkahest和GigaGen作为独立的CGU。
由于于二零一一年收购Talecris,并为减值测试目的,集团将分配给生物制药分部的现金产生单位合并,在分部层面将它们组合在一起,因为预期收购Talecris将产生重大协同效应,以及由于业务的垂直整合和产品缺乏独立的有组织的市场。由于协同效应在全球范围内有利于生物制药部门,因此它们不能分配给单个CGU。生物制药分部是分配商誉的最低水平,并受集团管理层出于内部控制目的的控制。
由于于2014年收购诺华的诊断业务部门,集团决定将Araclon、Progenika、澳大利亚和Hologic在NAT供体筛查单位收购中的份额合并为诊断业务的单一CGU,因为收购不仅支持垂直整合业务,而且支持交叉销售机会。此外,出于管理目的,集团管理层更专注于业务而非地理区域或个别公司。
此外,由于于2022年收购了Access Biologicals LLC的剩余51%股权,为生物用品业务确定了一个新的现金产生单位(注3)。
F-54
Grifols管理层建立的CGU有:
| ● | 生物制药 |
| ● | 诊断 |
| ● | 生物用品 |
| ● | Kiro Grifols |
| ● | GigaGen |
| ● | 阿尔卡赫斯特 |
Biopharma CGU、Bio Supplies和Kiro Grifols CGU的可收回金额已根据其在用价值计算为五年未来现金流量按考虑相关固有风险的贴现率贴现的现值。
诊断现金产生单位的可收回金额是根据其公允价值减去销售成本计算得出的,该公允价值计算为管理层批准的未来现金流量的现值,在考虑到固有风险的情况下按贴现率贴现。由于重组提振业务部门,批准了一项长期战略计划,以便通过投资改造诊断业务部门,这将导致超过五年的增长。因此,管理层对2025-2034年期间的未来现金流量进行了估计。
对于可收回金额的计算,管理层已考虑:
| ● | 基于历史业绩和实际情况的毛利率 |
| ● | 国际市场发展前景 |
| ● | 当前投资 |
| ● | 对于那些考虑了公允价值的案例而言,这将意味着产能显着增长的投资 |
现金产生单位实现稳定增长当年估计的现金流量,采用如下所示的估计增长率进行推断。永续增长率与行业报告中包含的预测一致。
GigaGen现金产生单位的可收回金额已根据公允价值减销售成本确定,计算为主要为已获管理层批准的研发项目的未来现金流量的现值,经成功概率调整并按包含其固有风险的贴现率贴现。现金流量的估计考虑了自产品推出起20年的使用寿命及其截至第六年的减少。
Alkahest的商誉是作为对应于因分配超出收购净资产的购买价款而确认的无形资产的递延所得税负债而产生的。
F-55
Alkahest现金产生单位的可收回金额已根据公允价值减去销售成本确定,计算为未来现金流的现值主要是四个已获管理层批准的研发项目,经成功概率调整并按包含其固有风险的贴现率进行折现。现金流估计已考虑到从产品推出起20年的使用寿命。
计算2024年现金产生单位的减值测试所使用的关键假设如下:
|
永续增长率 |
|
税前贴现率 |
|
|
生物制药 |
|
2.1 |
% |
11.4 |
% |
诊断 |
|
2.0 |
% |
10.6 |
% |
生物用品 |
1.9 |
% |
10.6 |
% |
|
Kiro Grifols |
1.6 |
% |
11.6 |
% |
|
GigaGen |
不适用 |
17.9 |
% |
||
阿尔卡赫斯特 |
不适用 |
25.9% - 39.8 |
% |
此外,以下关键假设已被用于2024年的GigaGen和Alkahest CGU减值测试:
|
汇率 |
|
成功率 |
|
|
GigaGen |
|
5.0 |
% |
20.0 |
% |
阿尔卡赫斯特 |
|
不适用 |
12.0% - 17.0 |
% |
同样,对于2024年诊断CGU的减值测试,分子供体筛查(MDS)、血型分析解决方案(BTS)和临床诊断(CDX)的销售额已被视为基于以下详述的CGU销售额和EBITDA信息的关键假设:
|
复合年增长率 |
|
复合年增长率 |
|
复合年增长率 |
|
复合年增长率 |
|
|
销售 |
销售 |
EBITDA |
EBITDA |
||||||
2024-2029 |
2029-2034 |
2024-2029 |
2029-2034 |
||||||
诊断 |
5 |
% |
9 |
% |
10 |
% |
15 |
% |
所使用的贴现率反映了与现金产生单位及其经营所在国家有关的特定风险。确定贴现率所采用的主要假设如下:
| ● | 无风险利率:正常化国债在 |
| ● | 市场风险溢价:基于市场调研的溢价。 |
| ● | 无杠杆贝塔:平均市场贝塔。 |
| ● | 债务权益比:市场平均比率。 |
计算2023年现金产生单位减值测试所采用的关键假设如下:
|
永续增长率 |
|
税前贴现率 |
|
生物制药 |
|
2.0% |
|
11.3% |
诊断 |
|
2.0% |
|
10.1% |
生物用品 |
|
2.0% |
|
11.4% |
Kiro Grifols |
1.6% |
12.0% |
||
GigaGen |
|
不适用 |
|
19.8% |
阿尔卡赫斯特 |
|
不适用 |
|
25.9% - 39.8% |
F-56
此外,2023年GigaGen和Alkahest CGU减值测试采用了以下关键假设:
|
汇率 |
|
成功率 |
|
|
GigaGen |
|
5.0 |
% |
20.0 |
% |
阿尔卡赫斯特 |
|
不适用 |
12.0% - 17.0 |
% |
同样,对于2023年诊断CGU的减值测试,分子供体筛查(MDS)、血型分析解决方案(BTS)和临床诊断(CDX)的销售额被视为关键假设。
2024年,对Kiro Grifols CGU的商誉确认了减值损失,金额为8,961千欧元。
此外,在2024年,母公司将诊断CGU减值测试中获得的结果与独立第三方专家编写的报告进行了比较。
2024年,并根据当前经济背景,现金产生单位减值测试考虑的合理可能变动为贴现率的变动,以及估计的永续增长率,相互独立变动,具体如下:
|
永续增长率 |
|
税前贴现率 |
|
生物制药 |
|
+/-50个基点 |
|
+/-50个基点 |
诊断 |
+/-50个基点 |
+/-100bps |
||
生物用品 |
+/-50个基点 |
+/-50个基点 |
||
Kiro Grifols |
+/-50个基点 |
+/-50个基点 |
||
GigaGen |
|
不适用 |
|
+/-200bps |
阿尔卡赫斯特 |
|
不适用 |
|
+/-200bps |
此外,对于2024年诊断现金产生单位的减值测试,还考虑了以下对MDS、BTS和CDX业务线销售变化的敏感性情景:
| ● | MDS销售敏感性情景:较最初预测的销售额预测低,估计约
|
| ● | 防弹少年团销售敏感度假设:较最初预测低的销售预测已估计约
|
| ● | CDX销售敏感性情景:已估算出一种预测,因此从2031年起CDX销售平均约
|
| ● | 对MDS、BTS和CDX销售的聚合敏感性情景:一种情景已作为先前敏感性情景的结果进行了估计。 |
此外,为2024年的GigaGen CGU减值测试考虑了以下合理可能的变化:
|
汇率 |
|
GigaGen |
|
+/-100bps |
管理层在计算生物制药和生物用品现金产生单位的可收回金额时考虑的关键假设的合理可能变动不会导致账面值超过其可收回金额。
F-57
管理层在计算不同现金产生单位可收回金额时考虑的关键假设的合理可能变动将导致账面值超过其可收回金额如下:
|
%资产价值 |
|
|
对MDS、BTS和CDX销售的聚合敏感性情景 |
|
-10 |
% |
贴现率敏感度GigaGen + 200bps |
-7 |
% |
|
贴现率敏感度Alkahest + 200bps |
-17 |
% |
|
贴现率敏感度Kiro + 50bps |
-5 |
% |
|
永续增长率Kiro-50 bps |
-4 |
% |
按分部价值划分的资产详情载于附录二。
2023年,诊断现金产生单位减值测试考虑的合理可能变动为贴现率的变动,以及估计的永续增长率,相互独立变动,具体如下:
|
永续增长率 |
|
税前贴现率 |
|
生物制药 |
|
+/-50个基点 |
|
+/-50个基点 |
诊断 |
|
+/-50个基点 |
|
+/-100bps |
生物用品 |
|
+/-50个基点 |
|
+/-50个基点 |
Kiro Grifols |
|
+/-50个基点 |
|
+/-50个基点 |
GigaGen |
|
不适用 |
|
+/-200bps |
此外,对于诊断现金产生单位2023年的减值测试,还考虑了以下对MDS、BTS和CDX业务线销售变化的敏感性情景:
| ● | MDS销售敏感性假设:较最初预测的销售额预测低了大约
|
| ● | 防弹少年团销售敏感度假设:较最初预测低的销售预测估计约
|
| ● | CDX销售额敏感情景:进行了一项预测,因此从2030年起CDX销售额平均约
|
| ● | 对MDS、BTS和CDX销售的聚合敏感性情景:由于之前的敏感性情景估计了一种情景,导致
|
此外,对GigaGen CGU减值测试考虑了以下2023年合理可能的变化:
|
汇率 |
|
GigaGen |
|
+/-100bps |
F-58
(七)其他无形资产
截至2024年12月31日及2023年12月31日止年度的其他无形资产及变动详情载于附录三,构成该等综合财务报表附注的组成部分。
从Talecris收购的无形资产主要包括目前已上市的产品。可辨认无形资产对应Gamunex,在Talecris收购日已按公允价值确认,分类为目前已上市产品。确认的无形资产包括Gamunex产品的权利、其商业化和分销许可、商标,以及与医院的关系。这些组件中的每一个都紧密相连并充分互补,面临类似的风险,并具有类似的监管审批流程。
从Progenika收购的无形资产主要包括目前已上市的产品。可辨认无形资产对应血液、免疫学和心血管基因分型。这些资产已在Progenika收购日按公允价值确认,并归类为目前已上市产品。
从Biotest收购的无形资产主要包括收购的产品组合。可识别无形资产对应于血浆疗法分部,在收购Biotest之日已按公允价值入账,并归类为收购产品组合。
从Access Biologicals LLC收购的无形资产主要包括客户关系。该资产已按收购Access Biologicals LLC之日的公允价值入账,并归类为收购的客户关系。
从Talecris获得的目前已上市产品的估计使用寿命被认为是有限的,已根据产品的预期生命周期(Gamunex)估计为30年,并按直线法摊销。
截至2024年12月31日,目前已上市产品的剩余使用寿命为16年5个月(截至2023年12月31日为17年5个月)。
从Progenika获得的目前已上市产品的估计使用寿命被认为是有限的,已根据产品的预期生命周期估计为10年,并按直线法摊销。2023年,目前已上市的产品达到使用年限。
从Biotest获得的产品组合的估计使用寿命被认为是有限的,并根据产品的预期生命周期估计为30年。摊销法是线性的。
从Access Biologicals LLC获得的客户关系的估计使用寿命被认为是有限的,根据相同的下降速度估计为14年。摊销法是线性的。
a) |
内部开发的无形资产 |
截至2024年12月31日,集团已在综合损益表中确认106,902千欧元为自建无形资产(2023年12月31日为50,043千欧元)。
b) |
采购承诺 |
于2024年12月31日及2023年12月31日,本集团并无任何重大无形采购承诺。
F-59
c) |
其他在建无形资产 |
截至2024年12月31日,集团有1,471,975千欧元作为在建开发成本(截至2023年12月31日为1,366,893千欧元)。该金额包括截至2024年12月31日的302433千欧元(截至2023年12月31日为284341千欧元),对应于从Alkahest获得的用于神经退行性疾病、神经肌肉疾病和眼科疾病产品的正在进行的研发项目。同样,这一数额还包括截至2024年12月31日的878,872千欧元(截至2023年12月31日为861,950千欧元),对应于从Biotest获得的血浆疗法(纤维蛋白原和三调素)的正在进行的研发项目。
d) |
无形资产处置结果 |
2024年处置和出售无形资产的总损失达14.4万欧元(2023年损失28.3万欧元)。
e) |
减值测试 |
无限期无形资产已分配至相应的现金产生单位(CGU)。该等资产已连同商誉进行减值测试(见附注6)。
对每一项进行中的无形资产进行了减值测试分析,方法是根据项目临床阶段按成功概率调整的自由现金流折现,根据其公允价值计算其可收回金额。
(八)租赁
2024年12月31日和2023年12月31日合并资产负债表中的租赁详情如下:
使用权资产 |
|
千欧元 |
||
|
31/12/2024 |
|
31/12/2023 |
|
土地和建筑物 |
|
956,617 |
933,304 |
|
机械 |
|
3,173 |
3,718 |
|
电脑设备 |
|
1,032 |
764 |
|
车辆 |
|
7,482 |
7,454 |
|
|
968,304 |
945,240 |
||
租赁负债 |
|
千欧元 |
||||
|
参考 |
31/12/2024 |
|
31/12/2023 |
||
非现行 |
|
附注21 |
1,024,845 |
1,004,227 |
||
当前 |
|
附注21 |
116,534 |
107,101 |
||
|
1,141,379 |
1,111,328 |
||||
歼60
截至2024年12月31日和2023年12月31日的租赁负债构成如下所示。按到期日分类的未贴现未来付款与金融贴现的影响一起列报:
千欧元 |
||||
|
31/12/2024 |
|
31/12/2023 |
|
成熟度: |
|
|
|
|
一年内 |
|
116,534 |
|
107,101 |
第二年 |
|
117,233 |
|
126,133 |
第三至第五年 |
|
319,410 |
|
326,253 |
第五年后 |
|
1,221,344 |
|
1,003,424 |
|
1,774,521 |
|
1,562,911 |
|
贴现效应 |
|
(633,142) |
|
(451,581) |
租赁负债总额 |
|
1,141,379 |
|
1,111,328 |
截至2024年12月31日,集团已确认与增加使用权资产相关的金额79,051千欧元(截至2023年12月31日为102,904千欧元)。2024年12月31日和2023年12月31日的变动情况载于附录四,构成这些综合财务报表附注的组成部分。
于2024年12月31日及2023年12月31日,在综合损益表确认的与租赁协议有关的金额为:
使用权折旧 |
|
千欧元 |
||
|
2024 |
|
2023 |
|
建筑物 |
|
74,929 |
71,157 |
|
机械 |
|
1,522 |
1,507 |
|
电脑设备 |
|
559 |
860 |
|
车辆 |
|
5,106 |
5,019 |
|
|
82,116 |
78,543 |
||
|
千欧元 |
|||||
|
参考 |
|
2024 |
|
2023 |
|
融资租赁费用 |
|
附注27 |
50,870 |
44,587 |
||
|
50,870 |
44,587 |
||||
|
千欧元 |
|||
|
2024 |
|
2023 |
|
与短期合同有关的费用 |
|
1,295 |
1,117 |
|
与低价值合同相关的费用 |
15,865 |
14,345 |
||
其他经营租赁费用 |
|
30,101 |
27,577 |
|
|
47,261 |
43,039 |
||
截至2024年12月31日,集团已支付与租赁合同相关的款项总额为111,488千欧元(截至2023年12月31日为116,394千欧元)。
在综合资产负债表中确认的总金额对应于本集团作为承租人的租赁合同。
F-61
(九)物业、厂房及设备
2024年12月31日和2023年12月31日合并资产负债表中的不动产、厂房和设备及变动详情载于附录五,构成合并财务报表本附注的组成部分。
于2024年12月31日及2023年12月31日在建物业、厂房及发展项目,主要包括为延长公司设备及提高其生产能力而进行的投资。
2024年,集团已将借款费用资本化,总额为27,772千欧元(2023年为36,892千欧元)(附注27)。
a) |
保险 |
团体保单是针对财产、厂房和设备损坏的风险,订约充足的保险范围。于2024年12月31日,集团拥有集团所有公司的合并保单,足以覆盖集团所有物业、厂房及设备的账面值。
b) |
处置不动产、厂房和设备的损失 |
2024年处置不动产、厂房和设备产生的损失总额为3,465千欧元(2023年损失为5,813千欧元)。
c) |
自建物业、厂房及设备 |
于2024年12月31日,集团已在综合损益表中确认自建物业、厂房及设备62,638千欧元(于2023年12月31日为82,615千欧元)。
d) |
采购承诺 |
截至2024年12月31日,集团的不动产、厂房和设备采购承付款为3500.9万欧元(2023年12月31日为3648.7万欧元)。
e) |
在建物业、厂房及设备 |
截至2024年12月31日,在建物业、厂房和设备金额为802,313千欧元(2023年为910,671千欧元),主要对应于在美国、加拿大和爱尔兰扩建公司设施及其生产能力所产生的投资(附注29)。
f) |
减值测试 |
截至2024年12月31日,集团已确认减值损失达1,370千欧元。
于2023年,集团出售物业、厂房及设备,作为重组美国捐赠中心网络的一部分。在这方面,注销了属于生物制药部门的这些资产所对应的减值,总金额为530万欧元。
F-62
(十)权益类被投资单位及联营企业
2024年12月31日和2023年12月31日合并资产负债表中这一标题的详细情况如下:
|
|
千欧元 |
|
|
千欧元 |
|||
%所有权(*) |
31/12/2024 |
%所有权(*) |
31/12/2023 (') |
|||||
上海RAAS血液制品有限公司。 |
|
— |
% |
— |
|
6.58 |
% |
361,394 |
Grifols埃及血浆衍生物 |
|
49.00 |
% |
63,063 |
|
49.00 |
% |
46,263 |
BioDarou P.J.S.公司。 |
49.00 |
% |
5,933 |
49.00 |
% |
11,265 |
||
与本集团有类似活动的权益入账被投资单位合计 |
|
68,996 |
|
418,922 |
||||
MecWins,S.A。 |
— |
% |
— |
24.59 |
% |
2,841 |
||
其余权益入账被投资单位合计 |
— |
2,841 |
||||||
权益核算被投资单位合计 |
68,996 |
421,763 |
(*)这个百分比也是指投票权益。
(‘)重报数字(注2.d.)
截至2024年12月31日止年度以权益入账的被投资单位的投资变动情况如下:
千欧元 |
||||||||||||||
2024 |
||||||||||||||
与本集团有类似活动的权益入账被投资单位 |
其余权益入账被投资单位 |
|||||||||||||
上海 |
||||||||||||||
RAAS血液 |
Grifols埃及 |
|||||||||||||
产品公司, |
等离子体 |
BioDarou P.J.S。 |
梅克温斯, |
|||||||||||
|
有限公司。 |
|
衍生品 |
公司。 |
合计 |
|
S.A。 |
|
合计 |
|
合计 |
|||
1月1日余额(*) |
|
361,394 |
|
46,263 |
11,265 |
418,922 |
|
2,841 |
|
2,841 |
|
421,763 |
||
收购 |
|
— |
|
40,250 |
— |
40,250 |
|
— |
|
— |
|
40,250 |
||
应占利润/(亏损) |
|
12,595 |
|
333 |
(4,388) |
8,540 |
|
— |
|
— |
|
8,540 |
||
应占其他综合收益/折算差额 |
|
435 |
|
(23,783) |
4,882 |
(18,466) |
|
— |
|
— |
|
(18,466) |
||
收取的股息 |
|
(6,724) |
|
— |
— |
(6,724) |
|
— |
|
— |
|
(6,724) |
||
减值损失 |
— |
— |
(5,826) |
(5,826) |
— |
— |
(5,826) |
|||||||
转让 |
(367,700) |
— |
— |
(367,700) |
(2,841) |
(2,841) |
(370,541) |
|||||||
12月31日余额 |
|
— |
|
63,063 |
5,933 |
68,996 |
|
— |
|
— |
|
68,996 |
||
(*)重报数字(注2.d.)
此外,由于出售SRAAS(附注12),产生了34,090千欧元的经营利润,该利润已在所附综合损益表的“与本集团活动类似的权益入账被投资方的利润”标题下记录。
截至2023年12月31日止年度以权益入账的被投资单位的投资变动情况如下:
2023 |
||||||||||||||||
与本集团有类似活动的权益入账被投资单位 |
其余权益入账被投资单位 |
|||||||||||||||
上海RAAS |
Grifols埃及 |
阿尔巴朱纳 |
||||||||||||||
血液制品 |
等离子体 |
BioDarou |
治疗学, |
|||||||||||||
|
株式会社。 |
|
衍生品 |
|
P.J.S.公司。 |
|
合计 |
|
S.L。 |
|
MecWins,S.A。 |
|
合计 |
|
合计 |
|
1月1日余额(*) |
|
1,453,210 |
|
36,111 |
|
5,051 |
1,494,372 |
|
622 |
2,965 |
|
3,587 |
|
1,497,959 |
||
收购 |
|
— |
|
20,342 |
|
— |
20,342 |
|
— |
— |
|
— |
|
20,342 |
||
应占利润/(亏损) |
|
61,979 |
|
(1,025) |
|
2,786 |
63,740 |
|
(798) |
(124) |
|
(922) |
|
62,818 |
||
应占其他综合收益/折算差额(1) |
|
(57,048) |
|
(9,165) |
|
3,846 |
(62,367) |
|
176 |
— |
|
176 |
|
(62,191) |
||
收取的股息 |
|
(6,891) |
|
— |
|
— |
(6,891) |
|
— |
— |
|
— |
|
(6,891) |
||
未收股息 |
|
— |
|
— |
|
(418) |
(418) |
|
— |
— |
|
— |
|
(418) |
||
转账(*) |
(1,089,856) |
— |
— |
(1,089,856) |
— |
— |
— |
(1,089,856) |
||||||||
12月31日余额(*) |
|
361,394 |
|
46,263 |
|
11,265 |
418,922 |
|
— |
2,841 |
|
2,841 |
|
421,763 |
||
(*)重报数字(注2.d.)
F-63
(1)由于2023和2022年度合并综合收益表的小标题“权益入账的被投资单位/折算差额”的符号不准确,在本财政年度,该标题的符号被修改,对应项目为合并综合收益表的小标题“折算差额”。由于这一不精确之处,本子标题被修改为截至2023年12月31日和2022年12月31日的金额分别为1.24亿欧元和0.61亿欧元,对照小标题“权益法核算的投资的其他综合收益的参与-折算差额”。这一不精确性并未对综合资产负债表中全球范围内考虑的总标题“换算差异”产生任何影响。
截至2022年12月31日止年度以权益入账的被投资单位的投资变动情况如下:
千欧元 |
||||||||||||||||||
2022 |
||||||||||||||||||
与本集团有类似活动的权益入账被投资单位 |
其余权益入账被投资单位 |
|||||||||||||||||
存取 |
上海RAAS |
Grifols埃及 |
阿尔巴朱纳 |
|||||||||||||||
生物制剂 |
血液制品 |
等离子体 |
BioDarou |
治疗学, |
梅克温斯, |
|||||||||||||
|
有限责任公司 |
|
株式会社。 |
|
衍生品 |
|
P.J.S.公司。 |
|
合计 |
|
S.L |
|
S.A。 |
|
合计 |
|
合计 |
|
1月1日余额(*) |
53,264 |
1,452,378 |
31,847 |
— |
1,537,489 |
1,910 |
3,159 |
5,069 |
1,542,558 |
|||||||||
收购 |
|
— |
|
— |
|
— |
|
4,534 |
4,534 |
|
— |
|
— |
|
— |
|
4,534 |
|
转让 |
|
(129,459) |
|
— |
|
— |
|
— |
(129,459) |
|
— |
|
— |
|
— |
|
(129,459) |
|
应占利润/(亏损) |
|
76,895 |
|
26,680 |
|
865 |
|
(962) |
103,478 |
|
(1,288) |
|
(194) |
|
(1,482) |
|
101,996 |
|
应占其他综合收益/折算差额 |
|
3,028 |
|
(18,859) |
|
(16,419) |
|
1,479 |
(30,771) |
|
— |
|
— |
|
— |
|
(30,771) |
|
收取的股息 |
|
(3,728) |
|
(6,989) |
|
— |
|
— |
(10,717) |
|
— |
|
— |
|
— |
|
(10,717) |
|
其他 |
|
— |
|
— |
|
19,818 |
|
— |
19,818 |
|
— |
|
— |
|
— |
|
19,818 |
|
12月31日余额(*) |
|
— |
|
1,453,210 |
|
36,111 |
|
5,051 |
1,494,372 |
|
622 |
|
2,965 |
|
3,587 |
|
1,497,959 |
|
(*)重报数字(注2.d.)
(1)由于2023和2022年度合并综合收益表的小标题“权益核算被投资单位/折算差额”的符号不准确,在本财政年度,该标题的符号已被修改,对应项目为合并综合收益表的小标题“折算差额”。由于这一不精确之处,本子标题被修改为截至2023年12月31日和2022年12月31日的金额分别为1.24亿欧元和0.61亿欧元,对应子标题“权益法核算的投资的其他综合收益的参与-折算差额”。这一不精确性并未对综合资产负债表中全球范围内考虑的总标题“换算差异”产生任何影响。
与本集团有类似活动的权益核算被投资单位的主要变动情况说明如下:
Grifols Egypt for Plasma Derivatives(S.A.E.)
2021年7月29日,与国家服务项目组织(NSPO)签署合作协议,帮助搭建平台,为埃及带来血浆衍生药物的自给自足。公司首次出资36,750千美元(合并日相当于30,454千欧元),作为交换,获得Grifols Egypt以占其股本49%的Plasma Derivatives(S.A.E.)股份,将达3亿美元。公司已承诺在资本要求获得批准时,为其利息对应的未偿还金额作出贡献。因此,集团于2024年期间进一步出资4.41万美元(2023及2022年分别为22.05万美元及22.05万美元),相当于9000万美元增资总额(2023及2022年分别为0.45及0.45亿美元)的49%。因此,集团作出的出资总额为124,950千美元,相当于其股本的49%,其总金额为2.55亿美元。此外,集团已承诺于2025年第二季度作出22,050千美元的出资。
上海RAAS血液制品有限公司。
2023年12月29日,Grifols与海尔就出售20%的股权达成协议,但须获得监管机构的批准以及股份购买协议中约定的其他条件。由于股份购买协议,于2023年12月31日,相当于SRAAS 20%股权的金额以1,089,856千欧元(附注12)重新分类为持有待售的非流动资产。
F-64
根据与海尔交易隐含的公允价值,截至2023年12月31日,SRAAS投资不存在减值迹象。于2023年12月31日,上海RAAS血液制品股份有限公司股票市值总计人民币531.64亿元(2022年12月31日为人民币427.37亿元)。
|
交易中约定价格 |
|
|
|||
与海尔 |
31/12/2023 |
收购日期 |
||||
SRAAS股价 |
9.405元 |
8.00元 |
7.91元 |
2024年6月18日,出售交易结束,Grifols在交易结束时失去了对其在SRAAS权益的重大影响力。SRAAS股份余下6.58%权益于交易日被视为以公允价值计量且其变动计入“其他全面收益”的金融资产,并已重分类至金融资产(附注11及12)。
Access Biologicals LLC
2017年1月12日,集团宣布收购总部位于美国加利福尼亚州圣地亚哥的公司Access Biologicals LLC 49%的投票权,金额为5100万美元。Grifols于2022年签订了一份期权协议,将在五年内购买剩余的51%投票权。Grifols还签署了一项供应协议,向Access Biologicals LLC销售不用于治疗用途的生物制品。
Access Biologicals LLC的主要业务活动是收集和制造广泛的生物产品组合。结合闭环材料采购,为体外诊断制造、生物制药、细胞培养和诊断研发等各类市场提供关键支撑。
2022年6月15日,Grifols通过全资子公司Chiquito Acquisition Corp.达成协议,收购Access Biologicals LLC的全部股份,行使剩余51%的看涨期权,合计1.42亿美元。通过收购100%的投票权,Grifols获得了对Access Biologicals LLC的控制权,因此,它被视为集团公司,并在完全合并法下合并(附注3)。2023年,所有全资子公司Access Biologicals,LLC、Chiquito Acquisition Corp.和Grifols Bio Supplies,Inc.订立合并协议,存续公司为Grifols Bio Supplies,Inc.(注2)。
BioDarou P.J.S.公司。
2022年4月25日,在获得所有监管批准后,Grifols以146.0853万欧元完成了对Biotest AG 70.18%股本的收购(注3)。Biotest AG是一组合并公司的母公司,该公司包括Biotest Pharma GmbH持有的BioDarou P.J.S. Co 49%权益对应的合资投资,该公司的注册办事处位于伊朗德黑兰,采用权益法核算。
被投资方的目标是采集血浆,通过Biotest AG将其加工成免疫球蛋白、因子和人血白蛋白,然后在伊朗销售成品。
Albajuna Therapeutics,S.L。
2016年,Grifols进行了375万欧元的资本投资,以换取Albajuna Therapeutics,S.L. 30%的股份。自2018年起,由于根据2016年1月的股东协议进行计划投资,Grifols持有公司资本的49%股权。Albajuna Therapeutics,S.L.是一家西班牙研究公司,成立于2016年,主要活动是开发和制造针对HIV的治疗性抗体。
2023年10月9日,Grifols通过其100%拥有的子公司Grifols Innovation and New Technologies Limited达成协议,以1欧元的总金额收购Albajuna Therapeutics,S.L.剩余51%的全部股份。通过收购100%的股份,Grifols获得了对Albajuna Therapeutics,S.L.的控制权,因此,它已成为一家集团公司并被合并(附注3)。
F-65
Medcom Advance,S.A。
2019年2月,集团完成收购Medcom Advance,S.A. 45%的股份,金额为8,602千欧元。Medcom Advance,S.A.是一家致力于研发的公司,旨在利用纳米技术创造专有专利。该公司以权益法核算。截至2023年12月31日和2024年12月31日,此项投资已全部减值。
MecWins,S.A。
2018年10月22日,Grifols通过Progenika Biopharma向MecWins增资划拨200万欧元,达到总资本的24.99%。
MecWins是科学研究中心(CSIC)的微纳米技术研究所的衍生公司,专门开发用于疾病诊断和预后的创新纳米技术分析工具。
MecWins开发了纳米传感器的超灵敏光学读取免疫分析技术,用于检测血液中的蛋白质生物标志物。该技术在肿瘤学、心血管和传染病等领域具有潜在应用。
CRB Inverbio也以额外的200万欧元参与了此次注资,这将使MecWins能够开始开发这项技术的预商用原型,并使Grifols能够在应用于诊断的纳米技术领域中定位自己。
2021年,MecWins,S.A.从Progenika Biopharma,S.A.收购了自己的股份,以产生库存股。此次收购导致MecWins,S.A.的持股比例降至24.59%。
截至2023年12月31日,Grifols维持采用权益法核算的投资。截至2024年12月31日,由于集团不再在董事会中拥有代表权且无法干预财务政策决策或其经营,因此该投资已重新分类为金融资产,并在“其他综合收益”中有所变动(附注11)。
Grifols的主要权益类投资可获得的最新财务报表如下:
资产负债表:
千欧元 |
||||||
31/12/2024 |
31/12/2023 |
|||||
上海RAAS |
||||||
Grifols埃及 |
血液制品公司。 |
Grifols埃及 |
||||
血浆衍生物 |
有限公司。 |
血浆衍生物 |
||||
非流动资产 |
71,167 |
2,990,702 |
|
74,169 |
||
流动资产 |
|
64,680 |
|
561,804 |
|
28,131 |
现金及现金等价物 |
|
47,993 |
|
512,309 |
|
36,947 |
非流动负债 |
|
(1,296) |
|
(2,182) |
|
(1,996) |
非流动金融负债 |
|
(8,048) |
|
(211) |
|
(11,044) |
流动负债 |
|
(45,796) |
|
(263,827) |
|
(31,793) |
净资产 |
|
128,700 |
|
3,798,595 |
|
94,414 |
F-66
损益:
千欧元 |
||||||||||
2024 |
2023 |
2022 |
||||||||
|
Grifols埃及 |
|
上海RAAS |
|
Grifols埃及 |
|
上海RAAS |
|
Grifols埃及 |
|
等离子体 |
血液制品 |
等离子体 |
血液制品 |
等离子体 |
||||||
衍生品 |
株式会社。 |
衍生品 |
株式会社。 |
衍生品 |
||||||
净收入 |
13,941 |
778,328 |
196 |
|
700,831 |
— |
||||
净利润 |
|
(2,318) |
|
234,416 |
|
(4,423) |
227,000 |
3,397 |
||
联合安排:
Biotek美国有限责任公司
Grifols与ImmunoTek GH,LLC(ImmunoTek)就28个血浆供体中心的开放和管理订立合作协议。该交易是通过创建Biotek America LLC(“ITK JV”)来执行的,该公司为每个中心(筒仓)创建了一系列股份。Grifols持有各系列75%的股份,ImmunoTek持有剩余的25%。每个中心开业大约三年后,根据协议,Grifols获得捐赠中心。截至2024年12月31日,Grifols已收购14家血浆中心(见附注3.a.)。
集团与Immunotek的合作协议涉及,截至2024年12月31日及2023年12月31日:
| ● | ImmunoTek的建设、许可、调试共
|
| ● | 每个中心开业约3年后出售给Grifols,金额约为美元
|
| ● | Grifols的预付款高达美元
|
| ● | ITK JV通过
|
| ● | ImmunoTek独家管理中心换取管理费,金额达欧元
|
| ● | 作为管理者,可以在其唯一和专属的责任下进行其认为必要的所有行为,但始终在各方同意的活动范围内。只有在当事人一致同意的情况下才能终止。然而,经理并不是以授权的权力行事,只要它有管理费用和实现目标以最大化每个系列的售价的风险敞口。 |
| ● | 在ITK JV清算的情况下,一旦ITK JV或每一系列的债权人得到偿付,单位持有人贡献的垫款随后必须归还,在这种情况下,由Grifols Group贡献的垫款和剩余部分(如果有的话)将按其参与股本的比例分配给每一位股东(ImmunoTek
|
| ● | 任何一个系列都不应对其他系列产生或归因于其他系列的费用负责。所有利润、亏损、收入和费用项目将分配给ImmunoTek,包括由此产生的任何税收优惠。然而,所有资产和负债都对应于每个系列。因此,每个系列都有单独的法人资格,资产和负债与其余部分隔离,即每个系列都是一个SILO。 |
F-67
| ● | Grifols,通过Grifols Shared Services North America,Inc.担任担保人
|
应支付的金额扣除押金并根据购买时中心的最低生产和存在,将根据估计的付款时间表为以下金额:
|
千 |
|||
美元 |
|
欧元 |
||
2025 |
|
78,888 |
|
75,131 |
2026 |
|
62,428 |
|
59,455 |
合计 |
|
141,316 |
|
134,586 |
截至2023年12月,收购血浆中心的承诺金额为378,920千欧元(2024年为248,785千欧元,2025年为73,853千欧元,2026年为56,282)。
无论Grifols是否持有75%的股权,以及管理层是否已转移至ImmunoTek,在Grifols收购这些中心之前都存在共同控制,并将根据合同条件作为共同经营入账:(i)对相关活动的共同决策权;(ii)Grifols对75%股权、已支付的预付款、授予的担保和购买血浆供应的合同的风险;(iii)另一股东对产生的筒仓结果及其费用的重大风险敞口,因为它没有以授权的权力行事,并且,(iv)两者之间的关系。
因此,如果存在共同控制,且每个系列都代表一个SILO,并被设计和创建用于将收集到的所有血浆出售给Grifols,并为该系列的开发预支必要的资金并保证义务,则它们应被视为共同协议。然而,Grifols在该系列中的百分比股权(达75%)与资产和负债的经济风险敞口100%之间存在不成比例的情况,而从收购前一段时间产生的收入和费用以及由此产生的税收优惠必须归于ImmunoTek。因此,该系列在收购前期间产生的亏损属于税务透明度制度下的另一股东。
如附注2d)所述,该系列已根据IFRS 11联合安排进行了整合,并相应重述了2023年和2022年的比较数字。
以下是截至2024年12月31日的14个中心和截至2023年12月31日的28个中心的总余额细分,不包括与Grifols的余额:
千人 |
||||||||
美元 |
欧元 |
|||||||
|
31/12/2024 |
|
31/12/2023* |
|
31/12/2024 |
|
31/12/2023* |
|
非流动资产 |
|
54,309 |
|
120,133 |
|
52,275 |
|
108,718 |
流动资产 |
|
26,623 |
|
46,877 |
|
25,626 |
|
42,423 |
总资产 |
|
80,932 |
|
167,010 |
|
77,901 |
|
151,141 |
非流动负债 |
|
55,674 |
|
119,449 |
|
53,589 |
|
108,099 |
流动负债 |
|
46,759 |
|
71,706 |
|
45,008 |
|
64,892 |
负债总额 |
|
102,433 |
|
191,155 |
|
98,597 |
|
172,991 |
Grifols的余额 |
5,965 |
12,556 |
5,742 |
11,363 |
||||
总股本 |
|
(21,501) |
|
(36,701) |
|
(20,696) |
|
(33,213) |
F-68
千人 |
||||||||
美元 |
欧元 |
|||||||
|
2024 |
|
2023 |
|
2024 |
|
2023 |
|
净收入 |
|
206,125 |
|
271,693 |
|
189,957 |
|
251,805 |
净利润 |
|
6,248 |
|
(18,453) |
|
5,743 |
|
(16,997) |
(*)重报数字(注2.d.)
(十一)金融资产
2024年12月31日和2023年12月31日合并资产负债表上的非流动金融资产明细如下:
千欧元 |
||||||
|
参考 |
|
31/12/2024 |
|
31/12/2023 |
|
其他非流动投资 |
|
422,258 |
|
11,139 |
||
非流动衍生品 |
附注30 |
1,181 |
1,043 |
|||
以公允价值计量的非流动金融资产合计 |
423,439 |
12,182 |
||||
非流动保函存款 |
|
9,420 |
|
8,872 |
||
其他非流动金融资产 |
|
(a) |
37,718 |
|
18,996 |
|
非流动贷款 |
(b) |
19,915 |
136,626 |
|||
以摊余成本计量的非流动金融资产合计 |
|
67,053 |
|
164,494 |
||
在非流动保证存款中,有于2024年12月31日为94.3万欧元的关联方长期存款(2023年12月31日为93.4万欧元)(附注31)。
SRAAS股份剩余6.58%权益计入“其他非流动投资”项下。该投资已被视为一项以公允价值计量且有‘金融投资的其他综合收益’变动的金融资产,其于2024年12月31日的公允价值已根据当日的SRAAS股价(每股7.22元)计算,金额为416,131千欧元,在其他综合收益项下确认税后亏损18,351千欧元。
2024年12月31日、2023年12月31日合并资产负债表流动金融资产明细如下:
千欧元 |
||||||
|
参考 |
|
31/12/2024 |
|
31/12/2023 |
|
当前衍生品 |
附注31 |
6,064 |
23,644 |
|||
以公允价值计量的非流动金融资产合计 |
|
6,064 |
|
23,644 |
||
千欧元 |
||||||
|
参考 |
|
31/12/2024 |
|
31/12/2023 |
|
存款和担保 |
|
3,000 |
|
325 |
||
其他流动金融资产 |
(a) |
21,179 |
14,926 |
|||
流动贷款 |
|
(b) |
213,331 |
|
101,337 |
|
以摊余成本计量的其他流动金融资产合计 |
|
237,510 |
|
116,588 |
||
F-69
a) |
其他非流动和流动金融资产 |
其他非流动和流动金融资产明细如下:
千欧元 |
||||||
|
参考 |
|
31/12/2024 |
31/12/2023 |
||
与关联方的其他金融资产 |
|
附注31 |
418 |
|
418 |
|
与第三方的其他金融资产 |
|
58,479 |
|
33,504 |
||
其他非流动和流动金融资产合计 |
|
58,897 |
|
33,922 |
||
b)非流动和流动贷款
非流动及流动贷款详情如下:
千欧元 |
||||||
参考 |
31/12/2024 |
31/12/2023 |
||||
对关联方的贷款 |
|
附注31 |
|
214,119 |
|
216,426 |
对第三方的贷款 |
|
|
|
19,127 |
|
21,537 |
流动和非流动贷款总额 |
|
|
|
233,246 |
|
237,963 |
“关联方贷款”包括金额为82,255千欧元(截至2023年12月31日为101,217千欧元)的Haema GmbH和BPC Plasma,Inc.与Scranton Plasma B.V.(附注31)的现金池未平仓余额。尽管它们的到期日是2027年,但由于预计未来一年将通过收取股息来恢复,这些债券在短期内一直保持不变。2024年和2023年,BPC Plasma Inc.均向其股东Scranton Plasma B.V.分配了一笔没有现金流出补偿“关联方贷款”的股息。2024年的股息为39,509千欧元,是前4年的结果在2023年分配的股息,价值为266,406千欧元。该分派对集团的非控股权益储备产生影响(见附注19)。此外,通过于2024年10月31日执行配额转让协议,Grifols Worldwide Operations Limited(“GWWO”)作为买方,从Scranton Plasma B.V.作为卖方(“SPA”)收购Haema Plasma KFT 100%的股本,全部以3.5万欧元(“购买价格”)作为交换。购买价款已由GWWO向Scranton Plasma B.V.通过GWWO向Scranton Plasma B.V.部分转让GWWO对Haema GmbH持有的某些应收款(根据GWWO过去就购买血浆向Haema GmbH支付的某些预付款(“Plasma预收账款”))以购买价款(“转让应收款”)的金额向Scranton Plasma B.V.支付。因此,现在Plasma预收账款的金额已减少为转让应收账款的金额。反过来,此外,在Scranton Plasma B.V.收到所转让的应收款项后,Scranton Plasma B.V.作为所转让的应收款项下的债权人针对Haema GmbH,作为其下的债务人,已按所转让的应收款项的金额结清其在现金池融资协议下的债务头寸(因此,Haema GmbH作为债权人与Scranton Plasma B.V.作为债务人之间的现金池安排下的未偿金额已按所转让的应收款项的金额减少)。
此外,本标题包括集团授予Scranton Enterprises BV的贷款,涉及支付出售BPC Plasma,Inc.和Haema,GmbH的股份(附注31)。贷款初始金额为9.5万美元(约合86,969千欧元)。此外,在2023年,根据与原始贷款相同的条款提取了15,000欧元的额外金额。截至2024年12月31日,记录金额为131,864千欧元,包括迄今的应计利息和资本化利息(截至2023年12月31日为115,209千欧元)。
F-70
(十二)持有待售的非流动资产
2023年12月29日,Grifols与海尔集团公司就以人民币12,500,000千元出售上海RAAS(SRAAS)20%股权达成协议。根据国际财务报告准则第5号,在截至2023年12月31日的综合财务状况表中,受出售交易约束的此类股权被视为“持有待售的非流动资产”,金额为1,089,856千欧元。
2024年6月18日,在获得所需监管机构的必要授权并满足某些商定条件后,出售发生金额为人民币12,163,730千元,扣除在中国支付的税款(按交易日汇率计算为1,564,256千欧元)。为了减少欧元/人民币汇率波动的风险敞口,并确保以欧元收取的金额,Grifols签约了欧元/人民币远期汇率金融工具(FX Forward),该工具不作为套期会计记录。
2024年7月5日,这些资金存入Grifols欧元银行账户,按订约远期汇率计算,金额为1,559,943千欧元,确认在“外汇差额”标题下列报的外汇损失17,790千欧元,以及在“金融工具公允价值变动”标题下确认的衍生工具财务收益13,476千欧元(附注27)。这些资金已用于减少集团的债务(附注21)。
由于此次出售交易,Grifols在交易结束时失去了对其在SRAAS的权益的重大影响力。SRAAS股份余下的6.58%股权被视为一项按公允价值估值且“通过OCI计算的FV变动”的金融资产,该金融资产在交易日期的公允价值是根据SRAAS股份在该日期的挂牌价格计算的,金额为434,481千欧元(附注11)。Grifols还失去了通过持股SRAAS而间接持有的GDS股权,导致少数股东权益应占权益增加507,803千欧元。此外,作为交易的一部分,签署了一系列协议(附注29),包括延长白蛋白的独家分销协议。
本次交易未对2024年合并损益表产生实质性影响,计算如下:
千人 |
||
|
欧元 |
|
售价 |
1,607,500 |
|
SRAAS公允价值6.58% |
434,481 |
|
减:持有待售非流动资产账面价值及交易费用 |
|
(1,123,588) |
减:以权益法核算的投资账面价值为重大影响损失日 |
|
(367,700) |
Minus:增加GDS少数股东权益(见附注19) |
|
(507,803) |
其他合同义务(见附注32) |
|
(10,433) |
翻译差异重新分类前的结果 |
|
32,457 |
权益累计折算差额 |
|
1,633 |
交易结果:利润 |
|
34,090 |
对中国和西班牙的利润征税 |
|
(34,544) |
结果税后净额 |
|
(454) |
交易结果包括与Grifols在SRAAS中按公允价值保留的投资重估相应的未实现收益68,414千欧元。
F-71
(13) |
库存 |
2024年12月31日及2023年的存货详情如下:
千欧元 |
||||
|
31/12/2024 |
|
31/12/2023 (*) |
|
商品转售 |
|
164,624 |
|
167,894 |
原材料和用品 |
|
955,503 |
|
1,092,301 |
在产品和半成品 |
|
1,405,231 |
|
1,210,085 |
成品 |
|
1,034,740 |
|
1,012,119 |
|
3,560,098 |
|
3,482,399 |
|
(*)重报数字(附注2.d)
存货拨备变动情况如下:
千欧元 |
||||||
|
31/12/2024 |
|
31/12/2023 |
|
31/12/2022 |
|
1月1日余额 |
|
123,656 |
|
84,740 |
|
158,724 |
当年净收费 |
|
22,711 |
|
57,041 |
|
(66,647) |
本年度取消 |
|
(133) |
|
(15,985) |
|
(12,155) |
翻译差异 |
|
4,198 |
|
(2,140) |
|
4,818 |
12月31日余额 |
|
150,432 |
|
123,656 |
|
84,740 |
(14) |
合同资产 |
短期合同资产涉及Biotest AG订立的合同分馏协议的合同义务。Biotest通常会在长达12个月的时间内履行由此产生的履约义务。这项业务的应收款项,通常到期日在90至120天之间,在收取对价的权利成为无条件时予以确认。客户提供的血浆生产的生物药交付给客户,就是这种情况。这些是服务交易,如果可以估计,则按相应的销售成本加上利润率进行估值。
2024年12月31日、2023年短期合同资产明细如下:
千欧元 |
||||
|
31/12/2024 |
|
31/12/2023 |
|
合同资产(毛额) |
|
36,074 |
|
47,839 |
预期信贷损失备抵 |
|
(96) |
|
(88) |
合同资产(净额) |
|
35,978 |
|
47,751 |
违约风险通过对合同资产进行价值调整进行核算。预期信用损失准备按合同资产名义金额与预计可收回金额的差额计算。
与合同资产相对应的预期信用损失备抵变动载于附注30。
F-72
(15) |
贸易和其他应收款 |
截至2024年12月31日及2023年12月31日的详情如下:
千欧元 |
||||||
|
参考 |
|
31/12/2024 |
|
31/12/2023 |
|
应收账款 |
|
677,147 |
|
449,139 |
||
应收联营公司款项 |
|
附注31 |
38,657 |
|
227,550 |
|
减值损失 |
|
附注30(i) |
(10,352) |
|
(31,576) |
|
应收账款 |
|
705,452 |
|
645,113 |
||
其他应收款 |
|
附注30(i) |
10,529 |
|
27,444 |
|
人事 |
|
1,489 |
|
1,123 |
||
预付款 |
|
附注30(i) |
5,590 |
|
4,150 |
|
税务机关、增值税可追缴 |
|
53,532 |
|
32,587 |
||
其他公共实体 |
|
6,416 |
|
9,629 |
||
其他应收款 |
|
77,556 |
|
74,933 |
||
当期所得税资产 |
|
52,589 |
|
47,213 |
||
贸易和其他应收款总额 |
|
835,597 |
|
767,259 |
||
债权转让
在2024、2023和2022年期间,Grifols集团向一些金融机构(因子)出售了无追索权的应收账款,这些金融机构(因子)与所转让债权的所有权所固有的风险和收益发生了实质性转移。此外,对所分配的信贷的控制,理解为要素单方面和不受限制地将其出售给无关联第三方的能力,已转移给要素。
这些合同的主要条件包括,对名义金额70%至100%之间变动的已分配债权的提前催收,以及对因子端的破产风险覆盖的百分比,在所分配债权名义金额的90%至100%之间变动。
这些合同被视为无追索权保理,由保理垫付的金额已从资产负债表中终止确认。
同样,在2024、2023和2022财政年度,一些应收款转让合同是与一家金融机构签订的,在该合同中,本集团保留了所转让信贷所有权所固有的风险和收益。这些合同已被视为与recource的保理,分配的金额在年底保留在综合资产负债表中,并确认一笔短期债务,金额等于从转让的保理收到的对价。2024年12月31日没有确认金额(2023年12月31日为16,985千欧元)。
于2024年12月31日,为集团出售的信贷权的融资成本总额为30,782千欧元,已在综合损益表的融资成本项下确认(2023年为24,993千欧元,2022年为18,201千欧元)(附注27)。
出售给各金融机构的无追索权发票数量按到期日计算在2024年12月31日将无法收取,总计334,430千欧元(2023年12月31日为391,886千欧元)。
与关联方的余额详情载于附注31。
F-73
(16) |
现金及现金等价物 |
2024年12月31日和2023年12月31日合并资产负债表的这一标题详情如下:
千欧元 |
||||
|
31/12/2024 |
|
31/12/2023 |
|
活期存款 |
|
5,100 |
|
6,506 |
在手现金和在银行 |
|
974,680 |
|
523,071 |
现金和现金等价物合计 |
|
979,780 |
|
529,577 |
(17) |
股权 |
合并权益及变动详情载于合并权益变动表。
a) |
股本 |
截至2024年12月31日和2023年12月31日,公司股本为119,603,705欧元,包括:
| ● | A类股:
|
| ● | B类股:
|
B类股
我们的B类股票具有与我们的A类股票基本相似的股息和其他经济权利,但在以下概述的一些重要方面与A类股票不同。
投票权
我们B类股的持有人一般没有投票权,但某些非常事项除外,在这方面需要获得我们已发行B类股的多数批准。
在股东大会上就特别事项进行单独表决
尽管我们的B类股普遍缺乏投票权,但关于下文详述的事项(每一项,“非常事项”)的决议都需要我们大多数已发行的B类股的批准。
| ● | 任何决议(i)授权我们或我们的任何子公司回购或收购我们的任何A类股份,但按向我们的A类股份持有人提供的相同条款和相同价格平等提供的按比例回购除外,或(ii)批准赎回我们的任何股份和任何股本削减(通过回购、注销股份或其他方式),除(a)法律规定的赎回和(b)同样影响我们的A类股份和B类股份且在此类交易中每一B类股份被视为A类股份的赎回。 |
| ● | 任何批准发行、授予或出售(或授权董事会发行、授予或出售)的决议(i)我们的任何股份,(ii)可行使或可交换或可转换为我们股份的任何权利或其他证券,或(iii)任何期权、认股权证或其他票据,赋予其持有人购买、转换、认购或以其他方式接收我们的任何证券的权利,除非(a)每一B类股份在相关发行、授予或出售中被视为A类股份,因此,在相关发行、授予或出售中拥有优先认购权(derecho de suscripci ó n preferente)或自由配售权,其程度(如有)与A类股份相同,或(b)如果发行是根据下文“认购权”中所述的认购权进行的。 |
F-74
| ● | 任何无条件批准或不批准(i)受第3/2009号法律约束的交易(包括但不限于合并、分拆、跨境迁移或资产和负债的全球转让)的决议,除非在此类交易中,每一B类股份被视为与A类股份相同,或(ii)我们的解散或清盘,除非法律要求此类决议。 |
| ● | 将任何Grifols股票从任何证券交易所退市的任何决议。 |
| ● | 一般而言,任何直接或间接对我们的B类股份的权利、优惠或特权产生不利影响的决议及对公司章程的任何修订(包括任何对我们的B类股份相对于我们的A类股份产生不利影响或对我们的A类股份相对于我们的B类股份产生积极影响的决议,或影响公司章程中有关我们的B类股份的规定的决议)。 |
股东大会有权就法律或《公司章程》赋予其的一切事项作出决定,特别是但不限于前述,应是有权就这些非常事项作出决定的唯一法人团体或办事处。
优先股息
我们的每一股B类股票使其持有人有权在每个已发行股票的财政年度结束时从可分配利润中获得最低年度优先股股息,相当于每股B类股票0.01欧元。在任何特定的财政年度,我们将向我们的B类股票持有人支付优先股息,然后再从该财政年度的可分配利润中向我们的A类股票持有人支付任何股息。所有已发行B类股的优先股息将由我们在该财政年度结束后的九个月内支付,金额不超过我们在该财政年度获得的可分配利润。
如果在一个财政年度内,我们没有获得足够的可分配利润来全额支付,从这些利润中,所有已发行的B类股票的优先股息,超过我们获得的可分配利润的优先股息金额将不会被支付,也不会作为未来应付的股息累计。
由于可分配利润不足以全额支付该财政年度的优先股息,在一个财政年度内未能支付全部或部分优先股息将不会导致我们的B类股恢复任何投票权。
其他股息
除上述优先股股息外,每股B类股有权获得与一股A类股相同的股息和其他分配(在每种情况下,无论是现金、Grifols或我们的任何子公司的证券,或任何其他证券、资产或权利)。就我们的A类股份作出的任何股息或其他分派而言,每股B类股份被视为一股A类股份,包括宣布及支付任何该等股息或分派的时间。
赎回权
如果我们的全部或部分股本的要约收购(全部或部分)被提出并结算,我们B类股份的每一持有人均有权赎回本条所述的股份,但如果我们B类股份的持有人有权(i)参与该要约,并且(ii)他们在该要约中的股份与我们A类股份的持有人平等且以相同的条件获得(包括但不限于以相同的对价),则除外。
F-75
在我们的B类股份持有人无权(i)参与和(ii)在该要约中以与我们的A类股份持有人相同的条件(包括但不限于以相同的对价)获得其股份的要约收购完成和结算(全部或部分)时,赎回程序将遵循下文详述的程序。
| ● | 我们将在赎回事件发生之日起十天内(即触发要约收购结算之日)在商业登记处宪报、西班牙证券交易所宪报和至少两份在巴塞罗那发行量最大的报纸上发布公告,通知我们的B类股票持有人赎回事件以及与该赎回事件有关的行使赎回权的过程。 |
| ● | 我们B类股份的每位持有人将有权通过通知我们其决定,在触发赎回权的要约收购的第一个结算日期起两个月内行使其赎回权。我们将确保机制到位,以便可以通过Iberclear发出行使赎回权的通知。 |
| ● | 我们将就已行使赎回权的每一B类股份支付的赎回价格将为(i)在要约收购中支付的触发赎回权的最高对价的欧元金额加上(ii)(i)中提及的金额的利息之和,自该要约收购首次结算之日起至全额支付赎回价格之日止,利率等于1年期欧元同业拆借利率加上基点。就此计算而言,在要约收购中支付的任何非现金对价对应的欧元金额将是该非现金对价在要约收购首次结算之日的市场价值。该市值的计算应得到至少两名我们从国际知名审计事务所指定的独立专家的支持。 |
| ● | 我们将,在 |
我们赎回的B类股份的数目,不得占我们在提出要约时已发行和流通的B类股份总数的百分比,不得超过要约所针对的我们的A类股份(i)的总和的百分比,(ii)由要约人在该要约中持有,及(iii)由与要约人一致行动的人或与要约人就要约达成协议的人持有,代表在要约提出时已发行和流通的A类股份总数,导致我们的B类股份被赎回。
赎回价格的支付将取决于我们是否有足够的可分配储备,但在要约收购发生后,直到我们的B类股份的赎回价格全额支付,我们将无法向我们的股东宣布或支付任何股息或任何其他分配(在每种情况下,无论是现金、Grifols或我们的任何子公司的证券,或任何其他证券、资产或权利)。
清算权
每份B类股份赋予其持有人在我们清盘及清盘时收取相当于(i)该B类股份的面值及(ii)认购该B类股份时已缴付的股份溢价之和的金额的权利。
我们将向我们的B类股票持有人支付清算金额,然后再向我们的A类股票持有人支付清算账户的任何金额。
我们的每一股B类股票都赋予其持有人权利,除了清算优先金额外,还可以获得为A类股票支付的相同清算金额。
认购权
每份B类股份赋予其持有人与任何发行、授予或出售(i)Grifols的任何股份、(ii)可行使、可交换或可转换为Grifols股份的任何权利或其他证券或(iii)任何期权、认股权证或其他赋予其持有人购买、转换、认购或以其他方式接收Grifols任何证券的权利的任何A类股份相同的权利(包括优先认购权和自由配售权)。
F-76
作为例外,B类股份的优先认购权和自由配售权将仅适用于新的B类股份或给予购买、转换、认购或以其他方式收取B类股份权利的工具,A类股份的优先认购权和自由配售权将仅适用于新的A类股份或给予购买、转换、认购或以其他方式收取A类股份权利的工具,对于满足以下三个要求的每一次增资或发行:(i)A类股和B类股的发行与其在增资决议通过时所代表的股本比例相同;(ii)B类股的优先认购权或自由配售权(如适用)的授予与B类股的优先认购权或自由配售权(如适用)的条款相同,就A类股份而授予A类股份;及(iii)并无发行其他股份或证券。
登记和转让
B类股票在Iberclear上采用记账式,不可分割,条款与A类股票相同。
自2012年7月23日以来,代表Grifols B类股份(无投票权股份)的ADS(美国存托股份)相对于B类股份的交换比例为1:1,即1 ADS代表1 B类股份。此前的费率为每1只B类份额2份ADS。
公司对其股东的了解是基于自愿提供的信息或符合适用的法律。根据公司可获得的资料,于2024年12月31日及2023年12月31日,并无任何权益占公司总资本的10%以上(附注17(g))。
截至2024年12月31日和2023年12月31日,流通股数量等于公司股份总数,减去库存股。
2024年期间流通股变动情况如下:
|
参考 |
|
A类股 |
|
B类股 |
|
2024年1月1日余额 |
|
422,185,368 |
|
256,906,911 |
||
(收购)/处置库存股 |
|
附注17(d) |
— |
|
1,316,825 |
|
2024年12月31日余额 |
|
422,185,368 |
|
258,223,736 |
2023年期间流通股变动情况如下:
|
参考 |
|
A类股 |
|
B类股 |
|
2023年1月1日余额 |
|
422,185,368 |
|
256,225,326 |
||
(收购)/处置库存股 |
|
附注17(d) |
— |
|
681,585 |
|
2023年12月31日余额 |
|
422,185,368 |
|
256,906,911 |
b) |
股份溢价 |
股份溢价变动载于综合权益变动表,构成本综合财务报表附注的组成部分。
c) |
储备金 |
累计收益的提取须遵守适用于各集团公司的立法。
截至2024年12月31日、2023年和2022年12月31日止年度的合并资产负债表本标题的变动反映在合并权益变动表中。本年度最重大的变动涉及收购Haema Plasma KFT、Grifols Pyrenees Research Center,S.L.和Grifols Malaysia SDN BHD(注2)。前两项收购对储备产生了负面影响,分别减少了14,022千欧元和356千欧元。另一方面,收购Grifols Malaysia SDN BHD产生积极影响,增加储备金4,679千欧元。
F-77
法定准备金
西班牙的公司有义务将每年利润的10%转入法定准备金,直到这一准备金达到相当于股本20%的数额。该准备金不向股东分配,只有在没有其他准备金可用的情况下才可用于冲减亏损。在一定条件下,可以用于增加股本,条件是留在准备金上的余额至少等于增加后总股本面值的10%。
截至2024年12月31日和2023年12月31日,母公司的法定准备金为23,921千欧元,相当于股本的20%。
西班牙公司法定准备金的分配受到与公司相同的限制,截至2024年12月31日,其他西班牙公司的法定准备金余额为2,171千欧元(2023年12月31日为1,711千欧元)。
其他外国集团公司截至2024年12月31日的法定准备金为3,744千欧元(截至2023年12月31日为4,227千欧元)。
未动用储备金
根据适用法律,截至2024年12月31日,相当于某些西班牙公司待摊销开发成本账面金额的18,925千欧元(2023年12月31日为7,179千欧元)是一项分配限制,直到这些开发成本已摊销完毕。
套期保值准备金
套期保值准备金包括现金流量套期保值准备金和套期保值准备金的成本,详见附注4(i)或详见。现金流量套期储备用于确认被指定并符合现金流量套期条件的衍生工具损益的有效部分,如附注30所述。
本集团在套期保值准备金成本中递延远期合约远期要素和期权合约时间价值的变动。
d) |
库存股票 |
截至2024年12月31日,母公司持有的A类和B类库存股相当于其资本的1.0%(截至2023年12月31日,其A类和B类库存股资本的1.2%)。
库存股A类
在截至2024年12月31日和2023年12月31日的年度内,A类库存股没有任何变动,总额为3,944,430股和89,959千欧元。
F-78
库存股B类
2024年B类库存股票变动情况如下:
|
乙类编号 |
|
||
股份 |
千欧元 |
|||
2024年1月1日余额 |
|
4,518,199 |
|
62,789 |
出售B类股份 |
|
(1,316,825) |
|
(18,300) |
2024年12月31日余额 |
|
3,201,374 |
|
44,489 |
于2024年4月及10月,集团根据受限制股份单位保留计划向合资格雇员交付1,316,825股库存股(B类股份)作为补偿。
2023年B类库存股变动情况如下:
|
乙类编号 |
|
||
股份 |
千欧元 |
|||
2023年1月1日余额 |
|
5,199,784 |
|
72,261 |
出售B类股份 |
|
(681,585) |
|
(9,472) |
2023年12月31日余额 |
|
4,518,199 |
|
62,789 |
于2023年3月、5月及10月,集团根据受限制股份单位保留计划向合资格雇员交付681,585股库存股(B类股份)作为补偿。
e) |
分配利润及股息 |
GRIFOLS, S.A.及子公司的利润将在各自的股东大会上按照约定进行分配。
于2024年6月14日举行的股东大会上提呈的母公司GRIFOLS, S.A.截至2024年12月31日止年度的建议分配利润及批准的2023年利润分配如下:
千欧元 |
||||
|
31/12/2024 |
|
31/12/2023 |
|
自愿准备金 |
|
(83,138) |
|
(246,735) |
母公司的亏损 |
|
(83,138) |
|
(246,735) |
于综合权益变动表呈列的截至2024年12月31日及2023年12月31日止年度的利润分配。
于2024年12月31日及2023年12月31日,未派发股息或中期股息
f)受限制股份单位保留计划
集团已设立受限制股份单位保留计划(以下受限制股份单位计划)及若干雇员的长期激励计划(附注29)。该承诺将使用权益工具结算,截至2024年12月31日累计应计金额为6,648千欧元(2023年为8,282千欧元)。
已向某些员工授予权益工具作为其薪酬一揽子计划的一部分的激励计划,取决于各种指标的实现情况,包括财务和非财务指标。该计划已通过计算估值日的期权单位价值并乘以拟授予的期权总数进行评估。随后,这一单位价值将根据实现规定目标的可能性进行调整。
F-79
g)重要股东
根据向公司提供的公开资料或通讯资料,截至2024年12月31日,GRIFOLS, S.A.的股本中最重要的持股情况如下:
投票权百分比 |
占总量% |
||||||||||
投票权百分比 |
通过金融 |
投票 |
|||||||||
附属于股份 |
仪器 |
权利 |
|||||||||
股东名称或公司名称 |
|
直接 |
|
间接 |
|
直接 |
|
间接 |
|
|
|
马克·安德森 |
|
— |
% |
3.13 |
% |
— |
% |
— |
% |
3.13 |
% |
贝莱德,公司。 |
|
— |
% |
2.90 |
% |
— |
% |
1.41 |
% |
4.31 |
% |
资本研究与管理公司 |
|
— |
% |
3.68 |
% |
— |
% |
0.90 |
% |
4.58 |
% |
Deria,S.A。 |
|
9.20 |
% |
— |
% |
— |
% |
— |
% |
9.20 |
% |
欧洲太平洋增长基金 |
|
2.88 |
% |
— |
% |
0.35 |
% |
— |
% |
3.23 |
% |
平足有限责任公司。 |
|
— |
% |
3.13 |
% |
— |
% |
— |
% |
3.13 |
% |
摩根大通公司。 |
|
— |
% |
— |
% |
— |
% |
3.32 |
% |
3.32 |
% |
Mason Capital Master Fund L.P。 |
|
— |
% |
2.11 |
% |
— |
% |
— |
% |
2.11 |
% |
Melqart Opportunities Master Fund Ltd。 |
|
— |
% |
— |
% |
1.06 |
% |
— |
% |
1.06 |
% |
Ponder Trade,S.L。 |
|
7.09 |
% |
— |
% |
— |
% |
— |
% |
7.09 |
% |
Ralledor Holding Spain,S.L。 |
|
6.15 |
% |
— |
% |
— |
% |
— |
% |
6.15 |
% |
Rokos Global Macro Master Fund LP。 |
|
— |
% |
— |
% |
1.14 |
% |
— |
% |
1.14 |
% |
Scranton Enterprises,B.V。 |
|
8.40 |
% |
— |
% |
— |
% |
— |
% |
8.40 |
% |
停战资本总基金有限公司 |
|
1.06 |
% |
— |
% |
— |
% |
— |
% |
1.06 |
% |
(18) |
每股收益 |
a) |
基本每股收益 |
基本每股收益的计算依据是归母净利润除以全年发行在外的加权平均股数,不包括库存股。
基本每股收益的计算详情如下:
|
2024 |
|
2023 (*) |
|
2022 (*) |
|
归属于母公司股东的年度利润(千欧元) |
|
156,920 |
|
42,318 |
|
185,035 |
已发行普通股加权平均数 |
|
679,668,551 |
|
679,756,294 |
|
679,805,142 |
基本每股收益(每股欧元) |
|
0.23 |
|
0.06 |
|
0.27 |
(*)重报数字(附注2.d)
附注2(d)详述的重述前的2023年度和2022年度的基本每股收益(每股欧元)分别为0.09欧元和0.31欧元。
已发行普通股加权平均数(基本)如下:
股份数量 |
||||||
|
2024 |
|
2023 |
|
2022 |
|
截至1月1日已发行在外股份 |
|
679,092,279 |
|
679,469,076 |
|
679,598,330 |
库存股的影响 |
|
576,272 |
|
287,218 |
|
206,812 |
已发行普通股加权平均数(基本) |
|
679,668,551 |
|
679,756,294 |
|
679,805,142 |
F-80
b)稀释每股收益
考虑到潜在普通股的稀释影响,稀释每股收益的计算方法是将归属于母公司的利润除以已发行普通股的加权平均数。
集团授予并以股份支付的受限制股份单位,假设存在稀释性潜在股份。稀释后每股收益计算如下:
|
2024 |
|
2023(*) |
|
2022(*) |
|
归母利润(千欧元) |
|
156,920 |
42,318 |
185,035 |
||
已发行普通股加权平均数(稀释) |
|
679,916,715 |
|
677,101,992 |
|
679,292,729 |
稀释每股收益(每股欧元) |
|
0.23 |
|
0.06 |
|
0.27 |
(*)重报数字(附注2.d)
附注2(d)中详述的重述前的2023年和2022年的稀释后每股收益(每股欧元)分别为0.09欧元和0.31欧元。
加权平均已发行普通股稀释股数计算如下:
股份数量 |
||||||
|
2024 |
|
2023 |
|
2022 |
|
1月1日到期的普通股 |
|
679,092,279 |
|
679,469,076 |
|
679,598,330 |
股份权利计划 |
248,164 |
(2,654,302) |
(512,413) |
|||
库存股的影响 |
|
576,272 |
|
287,218 |
|
206,812 |
已发行普通股加权平均数(稀释) |
|
679,916,715 |
|
677,101,992 |
|
679,292,729 |
(19) |
非控股权益 |
非控股权益及于2024年12月31日的变动详情如下:
千欧元 |
||||||||||||||||
商业 |
||||||||||||||||
|
|
余额 |
|
|
组合/ |
|
其他 |
|
翻译 |
|
余额 |
|||||
参考 |
31/12/2023 |
新增 |
新增 |
|
股息 |
|
动作 |
差异 |
31/12/2024 |
|||||||
Grifols(Thailand)Pte Ltd |
|
5,244 |
213 |
— |
(65) |
— |
345 |
5,737 |
||||||||
Grifols Malaysia Sdn Bhd |
|
4,230 |
180 |
(4,697) |
— |
— |
287 |
— |
||||||||
Araclon Biotech,S.A。 |
|
(1,137) |
(267) |
— |
— |
— |
— |
(1,404) |
||||||||
Haema GmbH |
253,620 |
6,191 |
— |
— |
— |
— |
259,811 |
|||||||||
BPC Plasma,Inc |
147,657 |
27,722 |
— |
(39,509) |
14 |
9,718 |
145,602 |
|||||||||
Grifols诊断解决方案公司。 |
1,347,323 |
47,619 |
507,803 |
(25,400) |
396 |
92,365 |
1,970,106 |
|||||||||
Plasmavita医疗保健 |
12,768 |
3,693 |
— |
— |
— |
— |
16,461 |
|||||||||
Haema Plasma KFT |
附注2(b) |
20,344 |
204 |
(20,978) |
— |
— |
430 |
— |
||||||||
G比利牛斯研究中心 |
22 |
(179) |
157 |
— |
— |
— |
— |
|||||||||
白化免疫SL |
(1,762) |
(805) |
— |
— |
— |
— |
(2,567) |
|||||||||
生物测试公司 |
357,010 |
(28,685) |
— |
(898) |
— |
2,125 |
329,552 |
|||||||||
|
2,145,319 |
55,886 |
482,285 |
(65,872) |
410 |
105,270 |
2,723,298 |
|||||||||
于2024年10月22日,集团收购了Haema Plasma KFT.的全部股权,详见附注2(b),这已导致上述非控股权益的全部减少。
F-81
此外,就出售SRAAS20 %股权的协议(附注12)而言,Grifols Diagnostic Solutions Inc.的非控股权益的有效百分比增加了11.96%,达到45%,即归属于少数方的权益增加了507,803千欧元。
2024年,Grifols Diagnostic Solutions Inc.已派发股息6000万美元,对集团非控股储备产生影响2.54万欧元。此外,BPC Plasma,Inc.在没有现金流出的情况下进行了股息分配,并作为对其股东Scranton Plasma B.V.的“其他关联方借款”的补偿,价值3950.9万欧元(附注11和31)。
2023年12月31日非控股权益及变动详情如下:
千欧元 |
||||||||||||||||
商业 |
||||||||||||||||
组合/ |
||||||||||||||||
|
余额 |
|
|
周长 |
|
其他 |
|
翻译 |
|
余额 |
||||||
|
参考 |
|
31/12/2022 |
|
新增 |
|
新增 |
|
股息 |
|
动作 |
|
差异 |
|
31/12/2023 |
|
Grifols(Thailand)Pte Ltd |
|
4,779 |
642 |
— |
(28) |
— |
(149) |
5,244 |
||||||||
Grifols Malaysia Sdn Bhd |
|
3,663 |
850 |
— |
— |
— |
(283) |
4,230 |
||||||||
Araclon Biotech,S.A。 |
|
(593) |
(544) |
— |
— |
— |
— |
(1,137) |
||||||||
Kiro Grifols,S.L。 |
|
(25) |
(301) |
326 |
— |
— |
— |
— |
||||||||
Haema GmbH |
228,684 |
24,936 |
— |
— |
— |
— |
253,620 |
|||||||||
BPC Plasma,Inc |
354,502 |
67,892 |
— |
(266,406) |
11 |
(8,342) |
147,657 |
|||||||||
Grifols诊断解决方案公司。 |
1,353,674 |
39,670 |
— |
— |
74 |
(46,095) |
1,347,323 |
|||||||||
Plasmavita医疗保健 |
10,134 |
2,634 |
— |
— |
— |
— |
12,768 |
|||||||||
Haema Plasma KFT |
附注2(b) |
11,939 |
7,769 |
— |
— |
— |
636 |
20,344 |
||||||||
G比利牛斯研究中心 |
(6) |
(12) |
— |
— |
40 |
— |
22 |
|||||||||
白化免疫SL |
(741) |
(1,021) |
— |
— |
— |
— |
(1,762) |
|||||||||
生物测试公司 |
|
361,596 |
(21,161) |
6,283 |
— |
(64) |
10,356 |
357,010 |
||||||||
2,327,606 |
121,354 |
6,609 |
(266,434) |
61 |
(43,877) |
2,145,319 |
||||||||||
在2023财年,BPC Plasma,Inc.在没有现金流出的情况下派发了股息,以补偿“对关联方的其他贷款”。这笔股息对应于前4个财政年度的结果,价值266,406千欧元给其股东Scranton Plasma B.V。此项分派对集团的非控股权益储备(附注11)产生影响。
2023年期间,由于购买了SRAAS自己的股份,Grifols在SRAAS的股份从26.20%增加到26.58%。因此,非控股权益的有效百分比由33.21%降至33.04%。
于2024年12月31日及2023年12月31日,最重要非控股权益的资产负债表主要项目如下:
千欧元 |
||||||||||||||
31/12/2024 |
||||||||||||||
合并权益合计 |
||||||||||||||
非现行 |
当前 |
非现行 |
当前 |
(公司间除外 |
%非控制性 |
非控制性 |
||||||||
物业、厂房及设备 |
物业、厂房及设备 |
负债 |
负债 |
消除) |
利息 |
利益 |
||||||||
生物测试集团 |
|
2,129,723 |
|
779,584 |
|
(539,279) |
|
(656,572) |
|
1,105,139 |
|
29.8 |
% |
329,552 |
GDS集团 |
|
4,626,938 |
|
253,256 |
|
(367,987) |
|
(134,193) |
|
4,378,013 |
|
45.0 |
% |
1,970,106 |
Haema GmbH |
|
229,931 |
|
120,724 |
|
(33,986) |
|
(50,293) |
|
259,811 |
|
100 |
% |
259,811 |
BPC Plasma,Inc |
|
239,579 |
|
25,975 |
|
(53,382) |
|
(22,236) |
|
145,602 |
|
100 |
% |
145,602 |
|
7,226,171 |
|
1,179,539 |
|
(994,634) |
|
(863,294) |
|
5,888,565 |
|
2,705,071 |
|||
F-82
千欧元 |
||||||||||||||
31/12/2023 |
||||||||||||||
合并权益合计 |
||||||||||||||
非现行 |
当前 |
非现行 |
当前 |
(公司间除外 |
%非控制性 |
非控制性 |
||||||||
物业、厂房及设备 |
物业、厂房及设备 |
负债 |
负债 |
消除) |
利息 |
利益 |
||||||||
生物测试集团 |
|
2,151,817 |
|
695,652 |
|
(537,781) |
|
(650,627) |
|
1,197,218 |
|
29.8 |
% |
357,010 |
GDS集团 |
|
4,216,198 |
|
273,576 |
|
(323,673) |
|
(109,121) |
|
4,056,980 |
|
33.2 |
% |
1,347,323 |
Haema GmbH |
|
232,428 |
|
127,726 |
|
(28,859) |
|
(74,680) |
|
253,620 |
|
100 |
% |
253,620 |
BPC Plasma,Inc |
|
228,306 |
|
23,004 |
|
(48,510) |
|
(19,329) |
|
147,657 |
|
100 |
% |
147,657 |
|
6,828,749 |
|
1,119,958 |
|
(938,823) |
|
(853,757) |
|
5,655,475 |
|
2,105,610 |
|||
千欧元 |
千欧元 |
|||||||||||||||
2024 |
2023 |
|||||||||||||||
合并 |
%非- |
非- |
合并 |
%非- |
非- |
|||||||||||
普通 |
净 |
控制 |
控制 |
普通 |
净 |
控制 |
控制 |
|||||||||
收入 |
收入 |
利息 |
利益 |
收入 |
收入 |
利息 |
利益 |
|||||||||
生物测试集团 |
|
726,317 |
|
(96,194) |
|
29.8 |
% |
(28,685) |
|
684,521 |
|
(70,962) |
|
29.8 |
% |
(21,161) |
GDS集团 |
|
578,000 |
|
122,440 |
|
45.0 |
% |
47,619 |
|
605,851 |
|
119,453 |
|
33.2 |
% |
39,670 |
Haema GmbH |
|
203,664 |
|
6,191 |
|
100.0 |
% |
6,191 |
|
194,892 |
|
24,936 |
|
100.0 |
% |
24,936 |
BPC Plasma,Inc |
|
223,755 |
|
27,720 |
|
100.0 |
% |
27,722 |
|
248,918 |
|
67,892 |
|
100.0 |
% |
67,892 |
|
1,731,736 |
|
60,157 |
|
52,847 |
|
1,734,182 |
|
141,319 |
|
111,337 |
|||||
最重要非控股权益的现金流量详情如下:
|
千欧元 |
|||||||||||||||
|
2024 |
2023 |
||||||||||||||
Haema GmbH |
|
BPC等离子体 |
|
生物测试集团 |
|
GDS集团 |
|
Haema GmbH |
|
BPC等离子体 |
|
生物测试集团 |
|
GDS集团 |
||
经营活动产生的现金流量净额 |
|
17,640 |
39,188 |
|
62,960 |
212,945 |
23,278 |
5,814 |
(3,608) |
232,418 |
||||||
投资活动产生的现金流量净额 |
|
(11,474) |
(32,996) |
|
(26,702) |
(53,711) |
(28,367) |
(8,421) |
209 |
(204,591) |
||||||
筹资活动产生的现金流量净额 |
|
— |
— |
|
(36,427) |
(159,695) |
— |
— |
(4,829) |
(27,378) |
||||||
6,166 |
6,192 |
(169) |
(461) |
(5,089) |
(2,607) |
(8,228) |
449 |
|||||||||
Haema GmbH和BPC Plasma,Inc。
2018年年中,Grifols收购了Haema GmbH和BPC Plasma,Inc.的100%股份,随后于2018年12月将其出售给Scranton,收购金额和条件与其相同。
以下指标支持Grifols对这些公司保持的权力,即使在将其出售给Scranton之后也是如此,因此,它根据IFRS 10保留了对Haema和BPC的控制权:
| - | Grifols拥有回购选择权
|
| - | 没有股东协议确定相关决定以不同于多数表决的方式获得批准。 |
| - | Grifols具备行使购买选择权的财务能力; |
| - | 尽管Grifols没有投票权,但它通过行使授予其潜在投票权的回购选择权的能力,在两家公司都保持着权力; |
F-83
| - | 此外,在捐赠中心的血浆采集业务中,Grifols通过管理合同成为两家公司的管理人,其中包括一般管理和共同批准商业计划、授予知识产权许可和专有技术。 |
| - | 此外,还有一份血浆供应协议 |
| - | 因此,尽管Scranton拥有所有投票权,但Grifols管理业务并收购
|
由于上述所有情况,Grifols有权指挥这些公司的相关活动,因为它对它们进行管理并共同确定它们的商业计划,拥有单方面回购两家公司100%的权利。Grifols拥有当前可行使的购买选择权这一事实意味着,它在(i)通过管理合同和(ii)通过未授权上述权力的方式行使权力时作为委托人。因此,Grifols保持对这两家公司的控制权,并因此巩固了它们。
就购买选择权而言,鉴于其基于可变股份数量和可变收购价格,该工具是一种衍生金融工具,必须在损益表中以公允价值进行估值。
根据上述合同条件,Grifols对行使回购选择权的价值估计如下:(i)出售公司向Scranton出售股份的价格(总计538,000,000美元)增加了与完成相关股份购买协议中所设想的交易有关的任何费用,加上(ii)营运资金的变化。基于Haema和BPC的业务模式,预计营运资金的这一变化将主要反映回购选择权行使时的未分配利润。鉴于行使回购选择权的价格与BPC和Haema的公允价值密切一致,因此认为该期权的整体价值并不重要。此外,由于期权的估值依赖于不可观察的市场因素,因此属于公允价值层次的第3级。考虑到期权估值的潜在不确定性,因为它涉及不可观察的变量,并且相同的价值并不重要,所述价值未被确认为2024年12月31日和2023年(而不是29日)。
GDS集团
在出售SRAAS的20%参与之前,有一个间接参与:
| - | Grifols拥有一个
|
| - | SRAAS拥有一个
|
由于IAS 28没有涉及如何对交叉参与进行会计处理,因此Grifols选择了:在SRAAS结果整合的权益法中,SRAAS在以其参与百分比(GDS的45%)整合GDS结果时确认的结果被排除在外。因此,Grifols的合并业绩不包括在SRAAS中确认的GDS业绩的11.96%(相当于45%*26.58%)以避免重复,因为GDS集团是通过全球一体化来巩固的。
在确定分配归属于非控股权益(SRAAS)的GDS结果时,SRAAS参与GDS的百分比调整了11.96%,因此,归属于该结果的百分比分别为截至2023年12月31日和2022年12月31日止期间的33.04%(45%-11.96%)和33.21%。
由于出售交易(附注12),Grifols现拥有SRAAS(金融投资)的6.58%参与权益,因此失去对其于SRAAS的权益的重大影响力,并因此失去其所持有的GDS资本的间接11.96%股权。于本年度,在GDS确认的非控股权益的有效百分比增加至45%。
F-84
继新股东上海RAAS血液制品有限公司(以下简称SRAAS)进入后,GRIFOLS, S.A.通过Grifols Shared Services North America,Inc(以下简称GSSNA)对Grifols Diagnostic Solutions,Inc(以下简称GDS)拥有控制权。
GRIFOLS, S.A.通过GSSNA拥有60%的A类有表决权股份和50%的B类无表决权股份,两类股份享有相同的经济权利,因此经济权利合计为55%。SRAAS拥有40%的A类股份和50%的B类股份以及45%的经济权利。
双方股东在各方出售股权的情况下均享有优先购买权。此外,SRAAS拥有一定的否决权,尽管Grifols对GDS拥有控制权,原因如下:
| ● | Grifols持有
|
| ● | 股息分配政策由Grifols单方面决定和批准。 |
| ● | 经各方在协议中明确背书,Grifols对GDS具有控制权; |
| ● | 在董事会的会议中,没有SRAAS对业务和投资计划的参考或正式批准,仅对结果进行非常笼统的介绍,并且在任何时候都不提及或与预算进行比较,而是相对于上一个比较期间进行比较; |
| ● | Grifols只需要批准对相关资产的投资或撤资,理解为这些金额大于
|
| ● | 没有控制或共同控制意味着对SRAAS业绩的风险,为减轻这一风险,最低累积EBITDA保证; |
| ● | GDS由Grifols直接指导、运营和管理,SRAAS没有任何相关参与; |
| ● | SRAAS没有任免GDS管理层的权力。 |
(二十)规定
截至2024年12月31日及2023年12月31日的拨备详情如下:
千欧元 |
||||
|
31/12/2024 |
|
31/12/2023 |
|
关于养老金和类似义务的规定(a) |
|
102,126 |
|
100,159 |
其他规定 |
|
22,922 |
|
16,766 |
非流动准备金 |
125,048 |
116,925 |
||
贸易条款 |
25,089 |
39,695 |
||
其他规定 |
13,524 |
8,111 |
||
现行规定 |
|
38,613 |
|
47,806 |
F-85
非流动和流动拨备的变动情况如下:
千欧元 |
||||||||
|
参考 |
|
31/12/2024 |
|
31/12/2023 |
|
31/12/2022 |
|
期初余额 |
|
164,731 |
166,402 |
55,529 |
||||
企业合并 |
注3 |
|
— |
— |
138,476 |
|||
净费用 |
9,261 |
28,696 |
12,588 |
|||||
净注销 |
(15,019) |
(19,571) |
(9,091) |
|||||
转让 |
3,526 |
(9,550) |
(33,575) |
|||||
翻译差异 |
1,162 |
(1,246) |
2,475 |
|||||
期末余额 |
|
163,661 |
164,731 |
166,402 |
||||
a)养老金计划
于2024年、2023年及2022年12月31日,退休金及类似拨备的余额主要包括Biotest集团就退休福利义务及与若干雇员的雇佣承诺作出的拨备。
福利根据雇员的服务年限和工资而定。退休福利义务主要涉及集团德国公司的雇员。类似的义务是在退休时一次性支付的外国义务和养老金储蓄计划的义务。这些计划是自愿养老金计划,不受法定或法律义务的约束。养老金义务的金额主要取决于利率变动和参与者的预期寿命。
于2024财政年度,资产为11,162千欧元,主要由集团旗下公司受托人根据合同信托安排(CTA)持有,作为职业养老金计划部分的外部破产保险(2023年12月31日为10,757千欧元)。由于根据IAS 19,转移的资金符合计划资产的条件,因此养老金和类似义务的准备金与转移的资产相抵。因此,养老金和类似义务的拨备相应减少。
于2024年12月31日及2023年12月31日,本集团的设定受益负债净额包括以下各项:
千欧元 |
||||
|
31/12/2024 |
|
31/12/2023 |
|
来自养老金计划 |
95,555 |
|
95,721 |
|
来自类似的义务 |
17,733 |
|
15,195 |
|
设定受益义务的净现值 |
113,288 |
110,916 |
||
养老金计划 |
9,011 |
8,738 |
||
对于类似的义务 |
2,151 |
2,019 |
||
计划资产的公允价值 |
11,162 |
10,757 |
||
来自养老金计划 |
86,544 |
86,983 |
||
来自类似的义务 |
15,582 |
13,176 |
||
设定受益负债净额 |
102,126 |
|
100,159 |
|
F-86
设定受益计划的成本由以下部分组成:
千欧元 |
||||
|
31/12/2024 |
|
31/12/2023 |
|
当前服务成本 |
|
4,704 |
5,204 |
|
净利息支出 |
|
3,361 |
3,536 |
|
在损益中确认的费用总额 |
8,065 |
8,740 |
||
因经验调整而产生的精算(收益)/损失 |
(1,914) |
(1,131) |
||
财务假设变动导致的精算(收益)/损失 |
(1,206) |
4,200 |
||
计划资产收益率(不含计入净利息费用的金额) |
(111) |
(227) |
||
直接在其他综合收益中确认的重估 |
(3,231) |
2,842 |
||
设定受益成本 |
|
4,834 |
11,582 |
|
在2024财政年度,精算收益3,120千欧元在其他综合收益中确认(截至2023年12月31日的精算损失为3,069千欧元)。其中1,206千欧元的收益来自精算假设的变化(2023年12月31日亏损4,200千欧元),这主要是由于德国主要计划的精算利率从3.5%提高到3.4%(2023年德国主要计划的精算利率从3.9%提高到3.4%)。
下表显示了设定受益义务(DBO)净现值的对账情况:
千欧元 |
||||
|
31/12/2024 |
|
31/12/2023 |
|
设定受益义务的净现值 |
|
110,916 |
102,693 |
|
当前服务成本 |
|
5,656 |
5,136 |
|
利息支出 |
3,361 |
3,536 |
||
损益表中确认的费用 |
9,017 |
8,672 |
||
经验调整造成的精算损失 |
(1,914) |
(1,131) |
||
财务假设变动导致的精算收益 |
(1,206) |
4,200 |
||
直接在其他综合收益中确认的重估 |
(3,120) |
3,069 |
||
支付的养老金福利 |
(3,525) |
(3,518) |
||
截至12月31日的设定受益义务净现值 |
|
113,288 |
110,916 |
|
下表显示了计划资产公允价值的调节情况:
千欧元 |
||||
|
31/12/2024 |
|
31/12/2023 |
|
计划资产的公允价值 |
|
10,757 |
8,622 |
|
利息收入 |
|
268 |
95 |
|
于综合损益表确认的收益 |
268 |
95 |
||
计划资产收益率(不含计入净利息支出的金额) |
(145) |
(108) |
||
直接在综合收益表中确认的重估 |
(145) |
(108) |
||
雇主的缴款 |
306 |
2,208 |
||
计划资产的付款 |
(24) |
(60) |
||
截至12月31日计划资产的公允价值 |
|
11,162 |
10,757 |
|
F-87
根据本集团目前的养老金义务,预计将在以后年度支付以下款项:
千欧元 |
||||
|
31/12/2024 |
31/12/2023 |
||
未来12个月内 |
|
6,550 |
5,239 |
|
2至5年之间 |
|
22,756 |
22,369 |
|
5至10年之间 |
30,402 |
31,307 |
||
10年后 |
127,256 |
122,746 |
||
预期付款总额 |
186,964 |
181,661 |
||
设定受益计划的加权平均期限截至2024年12月31日为11.7年(截至2023年12月31日为11.6年)。
截至报告日,本集团的计划资产投资于以下资产类别:
|
千欧元 |
|||
|
31/12/2024 |
31/12/2023 |
||
现金及现金等价物 |
|
2,941 |
102 |
|
金融投资 |
|
131 |
2,750 |
|
基金份额 |
8,090 |
7,905 |
||
总资产 |
11,162 |
10,757 |
||
转让的计划资产是按照界定的投资原则进行投资的,据此,金融工具的到期或终止选择权必须始终以协会能够履行其支付义务的方式进行选择。按照投资原则,该资产既可以投资于欧元定期存款,也可以投资于国内政府债券、抵押债券或货币市场基金或公司债券中的基金单位,均为欧元。也可以针对相应的担保向集团公司发放贷款。所有金融工具的最低评级要求为A-。
养老金计划的计算基于以下精算假设:
|
31/12/2024 |
31/12/2023 |
|||
贴现率 |
|
3.5 |
% |
3.4 |
% |
计划资产预期收益率 |
|
3.4 |
% |
1.7 |
% |
工资薪金增长幅度 |
3.4 |
% |
3.4 |
% |
|
养老金利率 |
2.0 |
% |
2.0 |
% |
|
员工流失率 |
3.0 |
% |
3.0 |
% |
精算假设主要基于历史经验值,但贴现率除外。该计算基于公布的Heubeck 2018年G死亡率表格。
根据国际会计准则第19.145号,必须在敏感性分析中披露用于计算养老金义务的基本假设参数的任何可能变化的影响。只有在下一个财政年度实际预期会发生的变化才会被考虑。
F-88
精算利率、薪酬趋势、养老金趋势和预期寿命被视为重要假设。这些参数连同关于参数变化及其对截至2024年12月31日净现值计算的影响的信息显示在以下概述中。
千欧元 |
||||
参数变化 |
对养老金的影响 |
|||
利率 |
|
上调50个基点 |
|
(5,386) |
利率 |
|
下调50个基点 |
|
5,957 |
薪资趋势 |
|
上调50个基点 |
|
93 |
薪资趋势 |
|
下调50个基点 |
|
(91) |
养老金趋势 |
|
增加100个基点 |
|
6,292 |
养老金趋势 |
|
下调100个基点 |
|
(5,360) |
预期寿命 |
|
增加一年 |
|
3,059 |
对截至2023年12月31日净现值计算的影响如下:
|
千欧元 |
|||
|
参数变化 |
|
对养老金的影响 |
|
利率 |
|
上调50个基点 |
|
(5,411) |
利率 |
|
下调50个基点 |
|
5,510 |
薪资趋势 |
上调50个基点 |
159 |
||
薪资趋势 |
下调50个基点 |
(154) |
||
养老金趋势 |
增加100个基点 |
6,737 |
||
养老金趋势 |
下调100个基点 |
(5,729) |
||
预期寿命 |
|
增加一年 |
|
3,185 |
13,460千欧元(2023年12月31日为12,100千欧元)确认为固定缴款计划的费用,细分如下:
千欧元 |
||||
|
31/12/2024 |
31/12/2023 |
||
公司的界定缴款计划 |
|
35 |
38 |
|
雇主对法定退休金计划的供款 |
|
13,425 |
12,062 |
|
13,460 |
12,100 |
|||
(二十一)金融负债
本附注提供了有关本集团金融负债的合同条件的信息,这些负债以摊余成本计量,但以公允价值估值的金融衍生工具除外。有关利率风险、货币风险和流动性风险敞口以及金融负债公允价值的进一步信息,请参见附注30。
F-89
截至2024年12月31日及2023年12月31日的详情如下:
千欧元 |
||||||
金融负债 |
|
参考 |
|
31/12/2024 |
|
31/12/2023 (*) |
非流动债券 |
|
(a) |
5,418,211 |
|
4,615,474 |
|
高级担保债务 |
|
(b) |
2,373,264 |
|
3,309,032 |
|
其他贷款 |
|
(b) |
53,125 |
|
445,249 |
|
其他非流动金融负债 |
|
(d) |
810,379 |
|
814,069 |
|
非流动金融衍生品 |
附注30 |
— |
11 |
|||
非流动租赁负债 |
附注8 |
1,024,845 |
1,004,227 |
|||
贷款交易成本 |
(189,180) |
(154,458) |
||||
非流动金融负债合计 |
|
9,490,644 |
|
10,033,604 |
||
当前债券 |
|
(a) |
113,298 |
|
145,898 |
|
高级担保债务 |
|
(b) |
25,420 |
|
34,832 |
|
其他贷款 |
|
(b) |
292,780 |
|
699,211 |
|
其他流动金融负债 |
|
(d) |
123,406 |
|
115,566 |
|
当前金融衍生品 |
|
附注30 |
5,863 |
|
10,133 |
|
流动租赁负债 |
附注8 |
116,534 |
107,101 |
|||
贷款交易成本 |
(1,214) |
(89,127) |
||||
流动金融负债合计 |
|
676,087 |
|
1,023,614 |
||
(*)重报数字(附注2.d)
a)优先票据
于2024年12月31日的优先票据详情如下:
|
千欧元 |
|||||||||||
|
发行日期 |
|
公司 |
|
名义价值 |
|
货币 |
|
年息票 |
|
成熟度 |
|
无抵押优先票据 |
5/10/2021 |
(1) |
GRIFOLS, S.A. |
(2) |
1,400,000 |
|
欧元 |
|
3.875 |
% |
2028 |
|
5/10/2021 |
(1) |
GRIFOLS, S.A. |
(2) |
705,000 |
|
美元 |
|
4.750 |
% |
2028 |
||
15/11/2019 |
(1) |
GRIFOLS, S.A. |
(2) |
770,000 |
|
欧元 |
|
2.250 |
% |
2027 |
||
有担保优先票据 |
30/4/2024 |
(1) |
1,000,000 |
|||||||||
4/6/2024 |
(1) |
GRIFOLS, S.A. |
|
300,000 |
|
欧元 |
|
7.500 |
% |
2030 |
||
19/12/2024 |
(3) |
GRIFOLS, S.A. |
|
1,300,000 |
|
欧元 |
|
7.125 |
% |
2030 |
||
(1)在爱尔兰证券交易所(ISE)泛欧交易所全球交易所市场上市
(2)由于Grifols Escrow Issuer,S.A.和GRIFOLS, S.A.在2023财年合并(见附注2)。
(3) |
目前正在准备爱尔兰证券交易所(ISE)泛欧交易所全球交易所市场上市的文件 |
F-90
2024年新债发行情况
2024年4月30日,GRIFOLS, S.A.结束了总额为10亿欧元的优先有担保公司票据(Senior Secured Notes)的发行。随后,在2024年6月4日,完成了金额为3亿欧元的额外私募优先担保票据。两项配售均于2030年5月到期,年息票为7.5%,与2019年11月15日发行的优先有担保票据具有相同的经济条款并受益于相同的个人担保和REM担保。这些票据对发行人具有惯常的控制权变更保护。所得款项已用于偿还于2025年5月到期的高级无抵押票据(“Grifols高级无抵押票据”),金额为10亿欧元,并部分偿还(金额为3亿欧元)原日期为2019年11月15日的集团信贷及担保协议(“信贷协议”)(附注21(b))的集团循环信贷额度。
2024年12月19日,GRIFOLS, S.A.结束了总额为13亿欧元的优先有担保公司票据(Senior Secured Notes)的发行,该票据将于2030年5月到期,票面年利率为7.125%。这些票据还具有惯常的控制权变更保护,此外,它们在赎回保护期(“非赎回期”)具有特殊的赎回功能,允许在此类非赎回期内以有利的赎回价格相对于补足成本。从该等发行中获得的资金净额连同可用现金已用于:(i)全额偿还2025年2月到期的GRIFOLS, S.A.的优先有担保票据(“优先有担保票据”),金额为3.43亿欧元;及(ii)全额清理根据信贷协议的循环信贷额度(附注21(b))提取的金额。
截至2024年12月31日止年度的优先票据变动详情如下:
千欧元 |
||||||||||
|
优秀 |
|
|
|
|
优秀 |
||||
余额在 |
交换 |
余额在 |
||||||||
01/01/2024 |
发行 |
取消 |
差异 |
31/12/2024 |
||||||
2017年优先无抵押公司票据 |
|
1,000,000 |
|
— |
(1,000,000) |
— |
|
— |
||
2019年优先有担保公司票据 |
|
1,577,465 |
|
— |
(837,856) |
— |
|
739,609 |
||
高级无抵押公司票据欧元2021 |
|
1,400,000 |
|
— |
— |
— |
|
1,400,000 |
||
高级无抵押公司票据美元2021 |
|
638,009 |
|
— |
— |
40,593 |
|
678,602 |
||
2024年优先有担保公司票据 |
— |
2,600,000 |
— |
— |
2,600,000 |
|||||
|
4,615,474 |
|
2,600,000 |
(1,837,856) |
40,593 |
|
5,418,211 |
|||
截至2023年12月31日止年度的优先票据变动详情如下:
千欧元 |
||||||
优秀 |
交换 |
优秀 |
||||
|
01/01/2023余额 |
|
差异 |
|
2023年12月31日余额 |
|
2017年优先无抵押公司票据 |
|
1,000,000 |
— |
1,000,000 |
||
2019年优先有担保公司票据 |
1,577,465 |
— |
1,577,465 |
|||
高级无抵押公司票据欧元2021 |
1,400,000 |
— |
1,400,000 |
|||
高级无抵押公司票据美元2021 |
660,979 |
(22,970) |
638,009 |
|||
|
4,638,444 |
(22,970) |
4,615,474 |
|||
截至2024年12月31日和2023年12月31日,本期债务标题包括向集团员工发行无记名本票,具体如下:
千欧元 |
|
||||
|
31/12/2024 |
|
31/12/2023 |
|
|
发行日期 |
|
4/5/2024 |
|
5/5/2023 |
|
到期日 |
|
4/5/2025 |
|
4/5/2024 |
|
期票名义金额(欧元) |
|
3,000 |
|
3,000 |
|
息率 |
|
5.00 |
% |
4.00 |
% |
F-91
已认购的本票 |
|
77,475 |
|
117,570 |
|
回购或赎回 |
|
(3,084) |
|
(1,842) |
|
待计利息 |
|
(1,214) |
|
(1,540) |
b)贷款和借款
于2024年12月31日及2023年12月31日的贷款及借款详情如下:
千欧元 |
||||||||||||||||
31/12/2024 |
31/12/2023 |
|||||||||||||||
金额 |
携带 |
金额 |
携带 |
|||||||||||||
信用 |
|
货币 |
|
息率 |
|
授予日期 |
|
到期日 |
|
延长 |
|
金额 |
|
延长 |
|
金额 |
优先债-B档 |
欧元 |
欧洲同业拆借利率+ 2.25% |
15/11/2019 |
15/11/2027 |
1,360,000 |
856,869 |
1,360,000 |
1,242,210 |
||||||||
优先债-B档 |
|
美元 |
SOFR + 2.00% |
15/11/2019 |
15/11/2027 |
2,343,896 |
1,516,395 |
2,343,896 |
2,066,822 |
|||||||
高级债务总额 |
|
3,703,896 |
2,373,264 |
3,703,896 |
3,309,032 |
|||||||||||
欧洲投资银行贷款 |
|
欧元 |
2.40% |
20/11/2015 |
20/11/2025 |
— |
— |
100,000 |
10,625 |
|||||||
欧洲投资银行贷款 |
欧元 |
2.02% |
22/12/2017 |
22/12/2027 |
85,000 |
21,250 |
85,000 |
31,875 |
||||||||
欧洲投资银行贷款 |
欧元 |
2.15% |
25/9/2018 |
25/9/2028 |
85,000 |
31,875 |
85,000 |
42,500 |
||||||||
欧洲投资银行贷款总额 |
170,000 |
53,125 |
270,000 |
85,000 |
||||||||||||
循环信贷 |
|
美元 |
SOFR + 2.50% |
15/11/2019 |
15/11/2025 |
414,667 |
— |
937,559 |
360,249 |
|||||||
循环信贷续发 |
美元 |
SOFR + 2.50% |
19/12/2024 |
30/5/2027 |
863,500 |
— |
— |
— |
||||||||
循环信贷总额 |
|
1,278,167 |
— |
937,559 |
360,249 |
|||||||||||
贷款交易成本 |
|
— |
(88,257) |
— |
(104,797) |
|||||||||||
非流动贷款和借款 |
|
|
|
|
|
|
|
5,152,063 |
2,338,132 |
4,911,455 |
3,649,484 |
|||||
千欧元 |
||||||||||||||||
31/12/2024 |
31/12/2023 |
|||||||||||||||
金额 |
携带 |
金额 |
携带 |
|||||||||||||
信用 |
|
货币 |
|
息率 |
|
授予日期 |
|
到期日 |
|
延长 |
|
金额 |
|
延长 |
|
金额 |
优先债-B档 |
|
欧元 |
欧洲同业拆借利率+ 2.25% |
15/11/2019 |
15/11/2027 |
(*) |
7,830 |
(*) |
13,076 |
|||||||
优先债-B档 |
美元 |
SOFR + 2.00% |
15/11/2019 |
15/11/2027 |
(*) |
17,590 |
(*) |
21,756 |
||||||||
高级债务总额 |
|
— |
25,420 |
— |
34,832 |
|||||||||||
欧洲投资银行贷款 |
|
欧元 |
2.40% |
20/11/2015 |
20/11/2025 |
(*) |
10,625 |
(*) |
10,625 |
|||||||
欧洲投资银行贷款 |
欧元 |
2.02% |
22/12/2017 |
22/12/2027 |
(*) |
10,625 |
(*) |
10,625 |
||||||||
欧洲投资银行贷款 |
欧元 |
2.15% |
25/9/2018 |
25/9/2028 |
(*) |
10,625 |
(*) |
10,625 |
||||||||
欧洲投资银行贷款总额 |
— |
31,875 |
— |
31,875 |
||||||||||||
其他流动贷款 |
|
0.10%-欧元同业拆借利率+ 7.9% |
277,048 |
260,905 |
691,514 |
667,336 |
||||||||||
贷款交易成本 |
|
— |
— |
— |
(59,735) |
|||||||||||
流动贷款和借款 |
|
|
|
|
|
|
277,048 |
318,200 |
691,514 |
674,308 |
||||||
(*)见非流动债务项下授予的金额。
当前贷款和借款包括截至2024年12月31日的应计利息25,775千欧元(截至2023年12月31日为27,468千欧元)。
在2015年至2018年期间,集团与欧洲投资银行安排了三笔总额为270,000,000欧元的长期贷款(分为两笔85,000欧元的贷款和一笔100,000,000欧元的贷款),以支持其研发投资,主要集中于寻找血浆衍生蛋白疗法的新治疗适应症。财务条款包括固定利率,期限10年,宽限期2年。截至2024年12月31日,从欧洲投资银行获得的贷款账面值为85,000欧元(2023年12月31日为116,875欧元)。
“其他流动贷款”包括来自集团公司Biotest,AG的一笔担保贷款,原期限为5年,至2024年。总额达2.4亿欧元,分为2.25亿欧元的两个定期融资(B1和B2)和1500万欧元的循环信贷融资。截至2024年12月31日,上述贷款已按照期限(2023年12月31日为223,077千欧元)全部偿还。
此外,值得一提的是,出售SRAAS获得的资金已被用于按比例摊销2027年到期的优先债B档和2025年到期的优先有担保债券(“优先有担保票据”)。预付款项用于未来八期,其余款项按比例用于剩余的分期付款。
F-92
高级担保债务
高级担保债务由一笔为期八年的贷款组成,分为两个部分:欧元的美国B档和B档。两个批次的条款和条件如下:
| ● | 美元B档: |
| ● | 原本金金额美元
|
| ● | 适用幅度
|
| ● | 准子弹偿还结构。 |
| ● | 2027年到期。 |
| ● | 欧元B档: |
| ● | 欧元原始本金金额
|
| ● | 适用幅度
|
| ● | 准子弹偿还结构。 |
| ● | 2027年到期。 |
2024年12月31日按期限划分的B档详情如下:
美国B档 |
欧元B档 |
|||||||||
本金单位:千 |
本金在 |
本金以千为单位 |
||||||||
|
货币 |
|
美元 |
|
千欧元 |
|
货币 |
|
欧元 |
|
成熟度 |
||||||||||
2026 |
美元 |
8,431 |
8,115 |
欧元 |
4,582 |
|||||
2027 |
美元 |
1,566,943 |
1,508,280 |
欧元 |
852,287 |
|||||
合计 |
|
美元 |
|
1,575,374 |
|
1,516,395 |
欧元 |
856,869 |
||
高级担保债务总额的借款人为GRIFOLS, S.A.和Grifols Worldwide Operations USA,Inc。
循环信贷额度
2024年12月11日,关于多币种循环信贷融资(RCF),据报道,该金额从10亿美元增加到12.7867亿美元,直至2025年11月。
2024年12月23日,就多币种循环信贷融资(RCF)而言,据报告将其当前金额的大部分延长18个月(“RCF延期”),新的到期日为2027年5月,金额为8.635亿美元。
F-93
多币种循环信贷工具(RCF)延期后,与该工具相关的财务费用保持不变。
循环信贷机制的变动情况如下:
千欧元 |
||||
|
31/12/2024 |
|
31/12/2023 |
|
提取的期初余额 |
|
360,249 |
|
— |
回撤 |
|
1,340,285 |
|
1,501,207 |
还款 |
|
(1,722,537) |
|
(1,131,565) |
翻译差异 |
|
22,003 |
|
(9,393) |
提取期末余额 |
|
— |
|
360,249 |
2025年2月21日,签署了金额为7450万美元的银行进一步承诺,增加了金额为7450万美元的RCF(见附注32)。
c)盟约
受限制的契约
未偿还的票据发行和信贷协议包括惯常的限制性契约,包括以下内容:
| ● | 惯常的限制性契约,但须符合市场惯例的协商例外情况,主要包括:(i)对分配股息或进行某些限制性付款或投资的限制;(ii)对产生额外债务、为债务提供担保或发行被归类为不合格股票的股权的限制;(iii)对资产设置留置权的限制。 |
| ● | 默认的习惯性事件。 |
| ● | 惯常的同等权利条款,根据该条款,优先担保票据和优先担保贷款在其他无担保和次级债务之前具有相同的排名和资历。 |
| ● | 我们的固定利率工具内的惯常提前赎回选择,但须遵守自第5年起按比例下降至面值的收回价表。 |
| ● | 控制权保护的惯常变更;一旦触发,将导致需要偿还或再融资以信贷和担保协议、优先票据和欧洲投资银行融资合同为代表的集团优先债务。 |
截至2024年12月31日及2023年12月31日,集团遵守融资协议所载的惯常受限制契诺。
担保人
票据及信贷协议项下的优先有抵押债务(包括信贷协议项下的循环贷款)由GRIFOLS, S.A.及GRIFOLS, S.A.的若干重要附属公司提供担保,而该等附属公司连同GRIFOLS, S.A.合共占集团综合EBITDA的至少60%。被担保人为:GRIFOLS, S.A.、Grifols Worldwide Operations Limited、Grifols Biologicals LLC、Grifols Shared Services North America,Inc.、Grifols Therapeutics,LLC、Instituto TERM0、Grifols Worldwide Operations USA,Inc.、Grifols USA,LLC、Grifols International,S.A.和Grifols Biotest Holdings GmbH。
F-94
d)其他金融负债
2024年12月31日及2023年12月31日其他金融负债明细如下:
千欧元 |
||||||
其他金融负债 |
|
参考 |
|
31/12/2024 |
|
31/12/2023 |
与GIC(新加坡主权财富基金)的非流动债务 |
|
(一) |
|
760,080 |
|
759,554 |
非流动优惠贷款 |
|
5,613 |
|
5,966 |
||
其他非流动金融负债 |
|
(二) |
|
44,686 |
|
48,549 |
其他非流动金融负债合计 |
|
810,379 |
|
814,069 |
||
Current debt with GIC(Sovereign Wealth Fund in Singapore) |
|
(一) |
|
84,539 |
|
81,384 |
当前优惠贷款 |
|
1,392 |
|
1,536 |
||
其他流动金融负债 |
|
|
37,475 |
|
32,646 |
|
其他流动金融负债合计 |
|
123,406 |
|
115,566 |
||
(i)与GIC的债务–新加坡主权财富基金
2021年11月收到有关当局批准与2021年6月宣布的GIC(新加坡主权基金)达成协议,据此,集团获得9.9亿美元的金额,以换取Biomat USA的10股普通B类股份和为此目的设立的新子控股公司Biomat Newco的9股普通B类股份。
与GIC协议的主要条款和条件是:
| ● | 向GIC派发年度优惠股息等值美元
|
| ● | 关于B类股票的美元赎回权
|
| ● | 自2036年12月1日起,Biomat USA的B类股票持有人将有权要求Biomat USA赎回其所持有的价值不超过美元的B类股票总额
|
| ● | 如果Biomat USA或Biomat NewCo(如适用)的股息或年度赎回未获批准、部分支付或以其他方式未支付,GIC有权在以下备选方案中获得数量未定的股份以换取(i)Biomat USA的额外股份,以代替Biomat USA发生的未付款,(ii)Biomat NewCo的额外股份,以代替Biomat NewCo发生的未付款;或(iii)Grifols S.A.的若干ADR以代替(i)或(ii)。 |
| ● | Grifols持有从第五年开始赎回所有B类股票的权利; |
| ● | Biomat USA和Biomat Newco发生清算时,GIC享有美元优先清算权
|
截至2024年12月31日,与GIC的流动债务包括34,385千欧元的应计利息加上与股份赎回权相关的50,154千欧元(34,230千欧元的应计利息加上截至2023年12月31日与股份赎回权相关的47,154千欧元)。
Grifols没有酌情权避免以现金支付,因此,该工具被记录为一项金融负债。
F-95
集团没有失去对Biomat USA的控制,并继续监督Biomat集团行政和运营的所有方面。
(二)其他非流动和流动金融负债
于2024年12月31日,“其他非流动金融负债”主要包括集团于2022年4月25日收购的公司Biotest,AG(附注3)对应的金额为4430万欧元的无抵押长期贷款(于2023年12月31日的供应合同分别为4430万欧元和340万欧元)。
其他金融负债到期情况明细如下:
千欧元 |
||||
|
31/12/2024 |
|
31/12/2023 |
|
到期时间: |
|
|
|
|
最多一年 |
|
123,405 |
|
115,566 |
两年 |
|
51,645 |
|
52,268 |
三年 |
|
51,211 |
|
48,478 |
四年 |
|
51,016 |
|
48,060 |
五年 |
|
95,262 |
|
47,848 |
五年以上 |
|
561,245 |
|
617,415 |
|
933,784 |
|
929,635 |
|
F-96
e)筹资活动产生的负债变动
千欧元 |
||||||||||||
高级担保 |
||||||||||||
债务&其他 |
融资租赁 |
其他金融 |
||||||||||
|
参考 |
|
债券 |
|
贷款 |
|
负债 |
|
负债 |
|
合计 |
|
2022年1月1日账面金额 |
|
4,743,534 |
|
3,707,048 |
|
873,724 |
|
882,935 |
|
10,207,241 |
||
新融资 |
|
112,557 |
|
990,537 |
|
— |
|
16,448 |
|
1,119,542 |
||
付款 |
|
(217,058) |
|
(944,386) |
|
(104,287) |
|
(15,685) |
|
(1,281,416) |
||
应计利息 |
|
176,317 |
|
206,901 |
|
43,640 |
|
84,586 |
|
511,444 |
||
其他运动 |
|
744 |
|
(744) |
|
123,792 |
|
— |
|
123,792 |
||
已付利息 |
|
(150,595) |
|
(156,461) |
|
— |
|
(43,331) |
|
(350,387) |
||
企业合并中承担的负债 |
|
注3 |
(1,804) |
|
121,597 |
|
30,290 |
|
31,016 |
|
181,099 |
|
外汇差额 |
|
27,965 |
|
117,029 |
|
49,785 |
|
50,154 |
|
244,933 |
||
2022年12月31日余额 |
|
4,691,660 |
|
4,041,521 |
|
1,016,944 |
|
1,006,123 |
|
10,756,248 |
||
新融资 |
113,100 |
1,505,657 |
— |
4,621 |
1,623,378 |
|||||||
付款(*) |
(121,957) |
(1,171,677) |
(116,394) |
(57,532) |
(1,467,560) |
|||||||
应计利息 |
177,482 |
352,325 |
40,105 |
85,586 |
655,498 |
|||||||
其他运动 |
— |
— |
184,186 |
3,221 |
187,407 |
|||||||
已付利息 |
(147,998) |
(308,048) |
— |
(72,896) |
(528,942) |
|||||||
企业合并中承担的负债 |
注3 |
— |
— |
— |
2,464 |
2,464 |
||||||
外汇差额(*) |
(29,971) |
(95,983) |
(13,513) |
(31,808) |
(171,275) |
|||||||
2023年12月31日余额 |
4,682,316 |
4,323,795 |
1,111,328 |
939,779 |
11,057,218 |
|||||||
新增融资(**) |
2,616,194 |
1,340,285 |
— |
(7,425) |
3,949,054 |
|||||||
付款 |
(1,956,576) |
(3,240,696) |
(111,488) |
(50,165) |
(5,358,925) |
|||||||
应计利息 |
228,085 |
399,225 |
49,102 |
69,647 |
746,059 |
|||||||
其他运动 |
— |
— |
49,356 |
2,922 |
52,278 |
|||||||
已付利息 |
(182,007) |
(317,148) |
— |
(72,332) |
(571,487) |
|||||||
外汇差额 |
41,358 |
150,873 |
43,081 |
57,222 |
292,534 |
|||||||
2024年12月31日余额 |
5,429,370 |
2,656,334 |
1,141,379 |
939,648 |
10,166,731 |
|||||||
(**)包括交易费用
(*)重报数字(附注2.d)
(22) |
贸易和其他应付款项 |
详情如下:
千欧元 |
||||
|
31/12/2024 |
|
31/12/2023 (*) |
|
供应商 |
|
852,305 |
|
822,953 |
应交增值税 |
|
13,825 |
|
13,357 |
税务机关、应付扣缴 |
|
10,626 |
|
8,892 |
应缴社保 |
|
42,692 |
|
28,180 |
其他公共实体 |
|
143,036 |
|
82,752 |
其他应付款 |
|
210,179 |
|
133,181 |
当期所得税负债 |
|
60,535 |
|
14,523 |
|
1,123,019 |
|
970,657 |
|
(*)重报数字(附注2.d)
F-97
供应商
与关联方的余额详情载于附注31。
本集团面临的与贸易和其他应付款项相关的货币风险和流动性风险在附注30中有所描述。
(23) |
其他流动负债 |
12月31日详情如下:
千欧元 |
||||
|
31/12/2024 |
|
31/12/2023 (*) |
|
应付薪金 |
|
240,650 |
|
237,099 |
其他流动债务 |
|
6,912 |
|
7,074 |
递延收入 |
|
36,500 |
|
28,870 |
收到的预付款 |
|
34,365 |
|
10,323 |
其他流动负债 |
|
318,427 |
|
283,366 |
(*)重报数字(附注2.d)
截至2024年12月31日和2023年12月31日,已收到的预付款是与Grifols已收到客户对价的未履行履约义务有关的合同负债。
(24)净利润
净收入主要来自销售商品。
2024年度、2023年度及2022年度按分部划分的净收益分布如下:
千欧元 |
||||||
|
2024 |
|
2023 |
|
2022 |
|
生物制药 |
|
6,142,588 |
|
5,558,301 |
|
5,005,382 |
诊断 |
|
644,898 |
|
670,269 |
|
671,292 |
生物用品 |
215,664 |
159,957 |
146,076 |
|||
其他 |
|
209,232 |
|
203,450 |
|
250,165 |
各部门间 |
— |
— |
(8,948) |
|||
|
7,212,382 |
|
6,591,977 |
|
6,063,967 |
|
净收入的地域分布情况如下:
千欧元 |
||||||
|
2024 |
|
2023 |
|
2022 |
|
美国和加拿大 |
|
4,087,030 |
|
3,898,961 |
|
3,855,607 |
西班牙 |
|
423,080 |
|
362,877 |
|
320,631 |
欧洲联盟 |
|
1,118,258 |
|
893,050 |
|
711,579 |
世界其他地区 |
|
1,584,014 |
|
1,437,089 |
|
1,176,150 |
合并 |
|
7,212,382 |
|
6,591,977 |
|
6,063,967 |
F-98
折扣及其他减少毛收入的详情如下:
千欧元 |
||||||
|
2024 |
|
2023 |
|
2022 |
|
总销售额 |
|
9,489,669 |
|
8,389,387 |
|
7,720,463 |
退单 |
|
(1,891,578) |
|
(1,525,210) |
|
(1,402,218) |
现金优惠 |
|
(93,024) |
|
(81,773) |
|
(76,547) |
批量返利 |
|
(76,312) |
|
(59,000) |
|
(66,280) |
医疗保险和医疗补助 |
|
(72,398) |
|
(68,353) |
|
(64,438) |
其他优惠 |
|
(143,975) |
|
(63,074) |
|
(47,013) |
净销售额 |
|
7,212,382 |
|
6,591,977 |
|
6,063,967 |
2024年期间毛收入的折扣和其他减少变动如下:
千欧元 |
||||||||||||
|
|
|
现金 |
|
成交量 |
|
医疗保险/ |
|
其他 |
|
|
|
退单 |
折扣 |
回扣 |
医疗补助 |
折扣 |
合计 |
|||||||
2023年12月31日余额 |
|
318,559 |
|
7,009 |
|
23,528 |
|
26,365 |
|
34,792 |
|
410,253 |
与本期和往期销售额相关的当前估计(1) |
|
1,891,578 |
|
93,024 |
|
76,312 |
|
72,398 |
|
143,975 |
|
2,277,287 |
(与当期销售相关的当期实际退货或贷项)(2) |
|
(1,737,477) |
|
(85,100) |
|
(37,569) |
|
(56,470) |
|
(86,765) |
|
(2,003,381) |
(与前期销售相关的当期实际退货或贷项)(3) |
|
(105,282) |
|
(7,473) |
|
(23,237) |
|
(18,404) |
|
10,322 |
|
(144,074) |
翻译差异 |
|
18,281 |
|
(640) |
|
1,946 |
|
1,567 |
|
(594) |
|
20,560 |
2024年12月31日余额 |
|
385,659 |
|
6,820 |
|
40,980 |
|
25,456 |
|
101,730 |
|
560,645 |
| (1) | 合并损益表中的净影响:本年度估计数加上往年调整数。年内作出的与往年估计数相对应的调整并不重大。 |
| (2) | 与本期拨备相抵的贷记和过账金额 |
| (3) | A与上一期间拨备相抵的贷记和过账金额 |
2023年毛收入的折扣和其他减少变动情况如下:
千欧元 |
||||||||||||
|
|
|
现金 |
|
成交量 |
|
医疗保险/ |
|
其他 |
|
|
|
退单 |
折扣 |
回扣 |
医疗补助 |
折扣 |
合计 |
|||||||
2022年12月31日余额 |
|
264,513 |
|
6,184 |
|
23,565 |
|
27,036 |
|
25,983 |
|
347,281 |
与本期和往期销售额相关的当前估计(1) |
|
1,525,210 |
|
81,773 |
|
59,000 |
|
68,353 |
|
63,074 |
|
1,797,410 |
(与当期销售相关的当期实际退货或贷项)(2) |
|
(1,324,855) |
|
(74,829) |
|
(37,078) |
|
(49,402) |
|
(30,647) |
|
(1,516,811) |
(与前期销售相关的当期实际退货或贷项)(3) |
|
(135,606) |
|
(6,443) |
|
(21,182) |
|
(18,676) |
|
(23,374) |
|
(205,281) |
翻译差异 |
|
(10,703) |
|
324 |
|
(777) |
|
(946) |
|
(244) |
|
(12,346) |
2023年12月31日余额 |
|
318,559 |
|
7,009 |
|
23,528 |
|
26,365 |
|
34,792 |
|
410,253 |
F-99
2022年毛收入的折扣和其他减少变动情况如下:
千欧元 |
||||||||||||
|
|
|
现金 |
|
成交量 |
|
医疗保险/ |
|
其他 |
|
|
|
退单 |
折扣 |
回扣 |
医疗补助 |
折扣 |
合计 |
|||||||
2021年12月31日余额 |
|
159,846 |
|
5,701 |
|
21,246 |
|
25,614 |
|
10,585 |
|
222,992 |
与本期和往期销售额相关的当前估计(1) |
|
1,402,218 |
|
76,547 |
|
66,280 |
|
64,438 |
|
47,013 |
|
1,656,496 |
(与当期销售相关的当期实际退货或贷项)(2) |
|
(1,196,670) |
|
(69,960) |
|
(43,494) |
|
(43,332) |
|
(28,818) |
|
(1,382,274) |
(与前期销售相关的当期实际退货或贷项)(3) |
|
(109,726) |
|
(6,442) |
|
(21,501) |
|
(21,271) |
|
(2,935) |
|
(161,875) |
翻译差异 |
|
8,845 |
|
338 |
|
1,034 |
|
1,587 |
|
138 |
|
11,942 |
2022年12月31日余额 |
|
264,513 |
|
6,184 |
|
23,565 |
|
27,036 |
|
25,983 |
|
347,281 |
(二十五)人员费用
按职能划分的人员费用明细如下:
千欧元 |
||||||
|
2024 |
|
2023 (*) |
|
2022 (*) |
|
销售成本 |
|
1,373,499 |
|
1,384,426 |
|
1,367,923 |
研究与开发 |
|
181,270 |
|
172,970 |
|
159,766 |
销售、一般和管理费用 |
|
497,918 |
|
528,784 |
|
472,413 |
|
2,052,687 |
|
2,086,180 |
|
2,000,102 |
|
(*)重报数字(附注2.d)
按性质划分的详情如下:
千欧元 |
||||||
|
2024 |
|
2023 (*) |
|
2022 (*) |
|
工资和薪金 |
1,668,348 |
|
1,698,415 |
|
1,621,294 |
|
对养老金计划的缴款 |
42,644 |
|
42,843 |
|
41,156 |
|
其他社会收费 |
33,994 |
|
30,868 |
|
33,678 |
|
社会保障 |
307,701 |
|
314,054 |
|
303,974 |
|
2,052,687 |
|
2,086,180 |
|
2,000,102 |
||
(*)重报数字(附注2.d)
2023年2月15日,集团宣布实施全面营运改善计划,节省大量资金。该计划包括优化血浆成本和运营,精简企业职能,以及提高组织效率的其他举措。其中还包括2023年的裁员,影响了大约8%的员工,主要是在美国的血浆业务。在2024年期间,集团已确认14,232千欧元的遣散费(2023年期间为75,348千欧元)。
F-100
(26) |
按性质分列的费用 |
a)摊销和折旧
2024年、2023年和2022年期间发生的按职能分类的无形资产、使用权资产及物业、厂房和设备的摊销和折旧费用如下:
千欧元 |
||||||
|
2024 |
|
2023 (*) |
|
2022 (*) |
|
销售成本 |
|
273,306 |
|
274,552 |
|
278,628 |
研究与开发 |
|
53,311 |
|
64,731 |
|
44,295 |
销售、一般和管理费用 |
|
111,280 |
|
107,139 |
|
88,057 |
|
437,897 |
|
446,422 |
|
410,980 |
|
(*)重报数字(附注2.d)
b)其他营业收入和支出
2024年度、2023年度和2022年度按职能划分的其他营业收入和支出情况如下:
千欧元 |
||||||
|
2024 |
|
2023 (*) |
|
2022 (*) |
|
销售成本 |
|
618,695 |
|
621,119 |
|
700,749 |
研究与开发 |
|
192,877 |
|
168,358 |
|
164,229 |
销售、一般和管理费用 |
|
712,137 |
|
798,720 |
|
584,489 |
|
1,523,709 |
|
1,588,197 |
|
1,449,467 |
|
(*)重报数字(附注2.d)
按性质划分的详情如下:
千欧元 |
||||||||
|
参考 |
|
2024 |
|
2023 (*) |
|
2022 (*) |
|
贸易条款的变化 |
|
(21,007) |
|
3,567 |
|
8,743 |
||
专业服务 |
|
379,903 |
|
424,332 |
|
307,385 |
||
佣金 |
|
28,494 |
|
44,946 |
|
40,397 |
||
用品和辅助材料 |
|
194,672 |
|
210,489 |
|
254,344 |
||
经营租赁 |
|
附注8 |
47,122 |
|
44,038 |
|
39,676 |
|
运费 |
|
186,017 |
|
187,693 |
|
191,360 |
||
维修和保养费用 |
|
269,843 |
|
243,362 |
|
223,970 |
||
广告 |
|
83,901 |
|
80,223 |
|
91,887 |
||
保险 |
|
49,242 |
|
50,971 |
|
46,809 |
||
版税 |
|
21,817 |
|
21,766 |
|
13,646 |
||
差旅费 |
|
43,883 |
|
48,119 |
|
52,606 |
||
外部服务 |
|
106,121 |
|
98,876 |
|
89,799 |
||
研发费用 |
|
108,227 |
|
98,947 |
|
94,903 |
||
资产处置收益 |
— |
(3,042) |
(22,236) |
|||||
其他 |
|
25,474 |
|
33,910 |
|
16,178 |
||
其他营业收入&支出 |
|
1,523,709 |
|
1,588,197 |
|
1,449,467 |
||
(*)重报数字(附注2.d)
F-101
于2023年2月15日,集团宣布实施全面营运改善计划,节省大量资金。该计划包括优化血浆成本和运营,精简企业职能,以及提高组织效率的其他举措。截至2024年12月31日,集团确认的费用约为22,302千欧元(2023年12月31日为79,090千欧元),主要为专业服务。
(27) |
财务结果 |
详情如下:
千欧元 |
||||||||
|
参考 |
|
2024 |
|
2023 (*) |
|
2022 |
|
财务收入 |
|
44,423 |
|
62,430 |
|
33,859 |
||
高级无抵押票据的融资成本 |
|
(230,478) |
|
(177,482) |
|
(181,149) |
||
来自优先债务的融资成本 |
|
附注21(b) |
(279,543) |
|
(257,350) |
|
(161,466) |
|
来自其他金融负债的融资成本 |
(69,452) |
(73,533) |
(81,914) |
|||||
资本化利息 |
|
附注9 |
27,772 |
|
36,892 |
|
25,184 |
|
融资租赁费用 |
|
附注8 |
(50,870) |
|
(44,587) |
|
(45,198) |
|
其他财务费用 |
(112,194) |
(80,824) |
(33,780) |
|||||
财务费用 |
|
(714,765) |
|
(596,884) |
|
(478,323) |
||
股息 |
|
2,060 |
|
— |
|
— |
||
出售贸易应收款项的财务成本 |
|
附注15 |
(30,782) |
|
(24,993) |
|
(18,201) |
|
金融工具公允价值变动 |
附注12 |
19,882 |
1,459 |
11,999 |
||||
金融投资减值 |
|
(9,081) |
|
— |
|
— |
||
汇兑差额 |
|
(59,756) |
|
(16,386) |
|
7,725 |
||
财务结果 |
|
(748,019) |
|
(574,374) |
|
(442,941) |
||
(*)重报数字(附注2.d)
2024年期间,来自优先无担保票据的标题财务费用包括本金金额为13亿欧元、按7.5%发行的优先有担保债券对应的利息产生的财务费用,这些债券用于摊销本金金额为100万欧元、年利率为3.2%的优先无担保债券。
2024年其他金融负债项下的融资成本包括与GIC收到的资金利息相关的融资成本69,452千欧元(2023年12月31日为73,533千欧元)(见附注21(d))。
于2024年期间,集团已根据所收到的融资按6.88%至7.38%的利率资本化利息(于2023年期间为6.03%至6.79%)。
(28)税收
授权GRIFOLS, S.A.在西班牙向Grifols Movaco,S.A.、Laboratorios丨Grifols,S.A. 丨GRIFOLS, S.A.以母公司身份负责合并纳税申报表的报备和结算工作,Instituto丨Grifols,S.A. GRIFOLS, S.A.,Biomat,S.A.,Grifols Viajes,S.A.,Grifols International,S.A.,Grifols Engineering,S.A.,Araclon Biotech and Aig ü es MineralsTERM3 de Vilajuiga,S.A. TERM4负责合并纳税申报表的报备和结算。根据现行税法,西班牙企业需缴纳25%的税款,可能会因某些扣除而减少。
北美公司Grifols Shared Services North America,Inc.还被授权与Grifols Biologicals Inc.、Grifols USA,LLC.、Biomat USA,Inc.和Grifols Therapeutics Inc.在美国提交合并纳税申报表。根据现行税法确定的在美国注册的公司的利润需缴纳约22%的应纳税所得额的税款,可能会因某些扣除而减少。
F-102
2021年,经合组织发布了支柱2示范规则,以应对经济数字化带来的税收挑战。这一国际税制改革侧重于为税收目的对利润进行地域分配,旨在确保跨国企业适用15%的最低有效税率。
2022年12月15日,欧盟理事会正式通过了关于支柱2的欧洲指令。截至2024年12月31日,西班牙已批准了转用欧洲指令的法律草案,以确保对跨国公司征收15%的全球最低税率。这项立法将前瞻性地适用于自2024年1月1日开始的会计期间。
2023年5月23日,国际会计准则理事会(IASB)发布了国际税务改革-第二支柱示范规则。国际会计准则第12号的拟议修订,将适用于自2023年1月1日开始的期间。对IAS 12的修订规定了在确认因实施支柱2立法而产生的递延税款余额方面的强制性临时豁免。
集团制定了与国际会计准则第12号修订一致的会计政策,据此,集团不记录因引入15%的最低有效税率而导致的递延税项资产和负债调整。在制定此会计政策时,集团亦采纳豁免,以避免提供有关自2023年1月1日开始的过渡期修订的详细资料。
2024年1月18日,宪法法院宣布《皇家法令-法律3/2016》中包含的各种税收戒律违宪。公司已评估该等拨备于2017年及其后年度产生的影响,并认为,由于其并无重大影响,故不会对该等年度的税务评估提出质疑。
a)会计核算与应纳税所得额的对账
本年度与利润相关的所得税费用及所得税具体情况如下:
千欧元 |
||||||
|
2024 |
|
2023 (*) |
|
2022 (*) |
|
持续经营业务的所得税前利润 |
|
443,996 |
|
207,021 |
|
338,013 |
税率为25% |
|
110,999 |
|
51,755 |
|
84,503 |
永久差异 |
|
66,715 |
|
(66,322) |
|
(30,796) |
不同税率的影响 |
|
(49,120) |
|
52,372 |
|
9,953 |
税收抵免(扣除额) |
|
(21,991) |
|
(1,193) |
|
3,667 |
上一年度所得税费用 |
|
16,698 |
|
2,132 |
|
12,685 |
其他所得税费用/(收入) |
|
107,889 |
|
4,605 |
|
10,099 |
所得税费用 |
|
231,190 |
|
43,349 |
|
90,111 |
递延税 |
|
(75,067) |
|
(140,095) |
|
(15,138) |
当前税 |
|
306,257 |
|
183,444 |
|
105,249 |
所得税费用 |
|
231,190 |
|
43,349 |
|
90,111 |
(*)重报数字(附注2.d)
不同税率的影响基本上是由于利润中的国家组合的变化。
截至2024年12月31日,标题“其他所得税费用/(收入)”除其他概念外,包括应计财政准备金(见附注28(c))。
F-103
b)递延税项资产和负债
递延所得税资产负债明细如下:
千欧元 |
||||||
税收效应 |
||||||
|
31/12/2024 |
|
31/12/2023 (*) |
|
31/12/2022 |
|
物业、厂房及设备 |
|
|
|
|
|
|
规定 |
|
31,444 |
|
29,663 |
|
20,511 |
库存 |
|
76,368 |
|
73,661 |
|
67,557 |
税收抵免(扣除额) |
|
26,681 |
|
76,603 |
|
33,921 |
税项亏损结转 |
|
49,664 |
|
27,804 |
|
58,159 |
固定资产、摊销和折旧 |
78,348 |
61,479 |
— |
|||
其他 |
|
90,872 |
|
44,735 |
|
6,197 |
资产小计 |
|
353,377 |
|
313,945 |
|
186,345 |
商誉 |
|
(2,027) |
|
(2,727) |
|
(3,063) |
固定资产、摊销和折旧 |
|
(9,677) |
|
(4,155) |
|
(16) |
无形资产 |
|
— |
|
— |
|
(1,349) |
其他 |
— |
(6,734) |
(6,994) |
|||
小计,负债净额 |
|
(11,704) |
|
(13,616) |
|
(11,422) |
递延税项资产,净额 |
|
341,673 |
|
300,329 |
|
174,923 |
负债 |
|
|
|
|||
商誉 |
|
(451,387) |
|
(376,520) |
|
(337,948) |
无形资产 |
|
(678,833) |
|
(658,099) |
|
(669,316) |
固定资产 |
|
(74,625) |
|
(85,082) |
|
(92,811) |
债务注销成本 |
|
(56,811) |
|
(41,894) |
|
(50,666) |
其他 |
(6,300) |
(53,503) |
— |
|||
小计,负债 |
|
(1,267,956) |
|
(1,215,098) |
|
(1,150,741) |
税项亏损结转 |
|
3,101 |
|
10,459 |
|
2,993 |
税收抵免(扣除额) |
18,259 |
68,104 |
14,578 |
|||
库存 |
|
1,904 |
|
1,848 |
|
652 |
规定 |
123,880 |
105,656 |
70,206 |
|||
其他 |
|
109,108 |
|
40,402 |
|
27,489 |
小计,净资产 |
|
256,252 |
|
226,469 |
|
115,918 |
税项递延负债净额 |
|
(1,011,704) |
|
(988,629) |
|
(1,034,823) |
(*)重报数字(附注2.d)
递延所得税资产负债变动情况如下:
千欧元 |
||||||
递延税项资产和负债 |
|
31/12/2024 |
|
31/12/2023 (*) |
|
31/12/2022 |
1月1日余额 |
|
(688,300) |
|
(859,900) |
|
(481,477) |
年内变动 |
|
75,067 |
|
140,095 |
|
15,138 |
企业合并(注3) |
|
— |
|
239 |
|
(361,051) |
翻译差异 |
|
(56,798) |
|
31,266 |
|
(32,510) |
12月31日余额 |
|
(670,031) |
|
(688,300) |
|
(859,900) |
(*)重报数字(附注2.d)
F-104
西班牙公司选择对物业、厂房和设备的某些新增项目应用加速折旧,这导致了相应的递延所得税负债。
2024年、2023年和2022年确认的剩余资产和负债在损益表中确认。
大部分待申请的税收减免来自西班牙公司,主要与研发相关,18年成熟。同样,该集团估计,实际上将在五年内应用全部金额。
本集团未将集团公司未使用的税项亏损结转的税务影响确认为递延税项资产,金额为125,153千欧元(2023年12月31日为103,303千欧元)。
截至2024年12月31日,与子公司投资相关的未确认递延所得税负债金额为79,551千欧元(截至2023年12月31日为76,348千欧元)。
西班牙公司对子公司投资拨备相关递延税项转回的承诺并不重大。
c)可供检查的年份
按照现行立法的规定,在报税表经相应税务机关审计或时效已过之前,不能将税款视为确定的结算。
税务审计
集团目前正在进行下文解释的税务审计。请注意,集团以合作和透明的方式与税务机关合作解决争议,并认为其在下文所述年份和事项中的立场是依法的,并基于对适用法规的合理解释。因此,集团打算提出所有适当的上诉和呈请,以最好地捍卫其利益。
| ● | 根据西班牙税务合并制度征税的集团某些注册地在西班牙的公司接受了西班牙国家税务管理局关于2014、2015和2016财年企业所得税以及2015和2016年增值税的审计。 |
F-105
2021年11月8日,专家组同意了由此产生的评估(“conformidad”)。集团旗下任何公司均未因任何须予审计的税项而受到处罚。
此外,鉴于这些评估已导致不同法域之间应税收入分配的调整,并鉴于其对集团转让定价地位的影响,集团现在拥有根据《欧洲消除双重征税公约》关于调整集团公司利润的规定,根据相互协议程序从相应国家法域收回某些金额的合法权利。
| ● | Grifols Shared Services North America,Inc.及其子公司在2020年收到了与2017和2018财年州所得税相关的税务审计通知。 |
美国国税局(“IRS”)表示,打算审查涉及美国的某些跨境公司间交易的定价。目前,美国国税局仍处于分析的初始阶段,才开始进行讨论。
| ● | 某些在西班牙注册、根据西班牙税收合并制度征税的集团公司最近接受了西班牙国家税务管理局的审计,涉及2017年至2019年财政年度的企业所得税以及2018年6月至2019年12月的增值税、个人所得税、非居民收入和资本所得税。集团不同意相应的评估建议(“不一致”),并已收到相应的最终评估。集团旗下任何公司并无因受该等审核程序规限的任何税项而受到任何处罚。 |
关于企业所得税,评估基于不同的定价标准方法。就增值税而言,评估依赖于对集团开展的金融活动的不同解释,以及这种差异如何影响某些费用的扣除。
集团财务报表中包含的涵盖2024年12月31日全球不确定税务处理风险的净应税负债为136,705千欧元(截至2023年12月31日为76,604千欧元),并包含在“其他公共实体”标题下。不确定税务状况的净税务负债增加与转让定价有关,这主要是由于在上述税务审计之后更新了潜在的税务负债。
F-106
转让定价事项复杂,主观性强,容易产生涉及不同税务辖区的争议。讨论中的议题很复杂,可能需要很多年才能解决。税务责任包括不确定的税务处理,这些处理是使用最有可能的金额法或预期价值法估计的,并取决于集团对税务当局采取的方法是否可能由法庭或法院维持的评估。这种评估可能在未来发生变化,以反映税务当局审查的进展,只要税务当局的任何审查已经完成;正在进行的上诉和国际程序的进展,包括根据上述评估已缴纳的税款的返还;法律规定或对这些规定的解释的变化;甚至相应的法定时效期限届满。
管理层认为,不太可能出现超出提供金额的额外负债。此外,随着审查、上诉或程序质疑税务机关的处理进展,甚至相关诉讼时效到期,所提供的金额可能会发生变化,并在未来期间部分甚至全部减轻。管理层继续认为,集团对其所有转让定价、审计和争议的立场是稳健的,集团已确认适当的税收拨备余额,包括考虑是否会根据与不同国家的适用相互协议程序提供相应的减免。
现金流的时间安排
如上所述,该集团目前正在几个国家接受税务审计,这些审计的任何解决时间都不确定。
预计可能需要就正在进行的税务审计缴纳税款,这些问题可能会在未来几年得到解决。集团认为,根据当前信息,上述税项负债适当反映了任何最终结算的预期价值。上述讨论的一些事项目前不在税务机关审核范围内,可能需要更长的时间才能解决。
最低税收(Pillar2 OECD)
截至2024年12月31日,本集团继续评估经合组织支柱2改革的影响,该改革规定了全球最低征税规则。这些规则已通过相关指令在欧盟获得通过,成员国必须将其转用于规则自2024年1月1日起适用。
除了正式合规负担显着增加外,集团预计适用这一新法规不会产生重大经济影响,因为在其经营的大部分地区,该集团已受到高于15%的有效税率,并预计将受益于“过渡性安全港”,该“安全港”允许避免额外税收并减轻正式合规负担。
上述情况的一个例外是爱尔兰,该国的名义企业所得税税率为12.5%,并且已经通过了自己的第二支柱立法,将允许其直接征收企业所得税。尽管在特定情况下,立法的复杂性可能会导致额外征税,但该集团已对2024年的这种影响进行了评估,其金额达500万欧元。
(二十九)与第三方的其他承诺及其他或有负债
a)担保
本集团并无向第三方提供重大担保。
b)与第三方承诺的担保
自2023年6月30日起,Grifols通过Grifols Shared Services North America,Inc担任不受与Biotek America LLC合作协议影响的某些ImmunoTek血浆采集中心的五份租赁合同的担保人。此外,GRIFOLS, S.A.担任购买这28家血浆中心的承诺的担保人(见附注11)。
F-107
此外,本集团还有附注19和21所述的向第三方提供的重大担保。
c)与人员的义务
集团对西班牙集团公司2024年固定缴款养老金计划的年度缴款已达1,259千欧元(2023年为1,079千欧元)。
在取得公司控制权的情况下,集团与31名雇员/董事订立协议,据此,他们可单方面解除与公司的雇佣合同,并有权获得一年至五年工资不等的解雇福利。
此外,公司为某些雇员维持的以股份为基础的薪酬计划包括条款,根据这些条款,在控制权发生变更的情况下,待交换的金额将根据上述协议中所述的条款提前结算。
集团与23名行政人员订立合约,使他们有权在不同情况下获得一至四年工资的解雇福利。
受限制股份单位保留计划
2022年3月,集团为若干员工设立了限制性股票计划(以下RSU)。根据该计划,雇员可以选择以B类无投票权普通股(Grifols B类股)或Grifols美国存托股票(Grifols ADS)的形式获得其年度奖金的最多50%,集团将为此在RSU中额外贡献50%。
B类Grifols股票和Grifols ADS在红利授予日进行估值。
这些RSU的归属期为2年零1天,随后将交换为Grifols B类股票或Grifols ADS(代表1股B类股票的美国存托股票)。
如果符合条件的员工在归属期之前离开公司或被解雇,他/她将无权获得额外的RSU。
于2024年12月31日,集团已结清金额为17,577千欧元的2022年受限制股份单位计划(与2020年受限制股份单位计划相对应的2023年12月31日为3,296千欧元)。
该承诺被视为以权益结算,截至2024年12月31日未确认累计金额(2023年12月31日为8,282千欧元)。
F-108
以权益结算的股份支付方案
2023年5月,董事会向2023年6月16日的普通股东大会提交了一份提案,该提案批准了一项长期激励计划。基于授予Grifols及其子公司的某些执行董事、高级管理层成员的股票期权。该计划对每位受益人的期限为四年,自计划第2年末授予的期权的40%归属(前提是满足其归属条件)生效之日起,剩余的60%在计划第4年末归属(前提是满足其归属条件)。将授予最多4,000,000份股票期权,代表以每股A类股8.96欧元的行权价收购公司4,000,000股A类股的权利。作为授予期权归属的条件,每个受益人必须在每个归属日期继续受雇于Grifols,必须通过个人绩效评估,此外,结算取决于具体、预先确定和可量化的目标的实现,这些目标与财务和非财务指标相关,以便通过实现计划中设定的目标来奖励价值创造。公司将分配其目前在库存中持有或可能会来持有的股份以满足计划的需要。
结算日期 |
|
分配的股份数量 |
|
单位公允价值(欧元) |
2025 |
|
1,040,000 |
|
3.05 |
2027 |
|
1,560,000 |
|
2.85 |
此外,还有一项特别薪酬计划,参照某些高管在权益工具中结算的股份价值,行使价为每股A类股8.964欧元和12.84欧元,期限为2024年和2025年。
结算日期 |
|
分配的股份数量 |
|
单位公允价值(欧元) |
31/12/2026 |
|
180,000 |
|
2.39 |
22/2/2025 |
|
700,000 |
|
1.08 |
28/2/2025 |
|
270,000 |
|
2.19 |
截至2024年12月31日的权益确认金额为5,621千欧元(2023年12月31日为2,586千欧元)。
以现金结算的股份支付方案
2023年5月,GRIFOLS, S.A.董事会批准了针对公司及其子公司管理团队某些成员的新的基于限制性股票单位(RSU)的长期激励计划。该计划的总期限为四年,其中50%授予的受限制股份单位将在计划的第二年年底结算,剩余部分将在计划的第四年年底结算。作为授予的RSU归属的条件,每个受益人必须在计划结算日继续受雇于Grifols,此外,这种结算取决于绩效目标的实现情况。受限制股份单位将以现金结算,金额相当于结算前五(5)个工作日A类股份的平均价格。截至2024年12月31日,累计总额为2,932千欧元。其中,“贸易债权人和其他应付账款”标题中有209万欧元为短期(截至2023年12月31日为161万欧元),“拨备”标题中有84.2万欧元为长期(截至2023年12月31日未计入金额)。截至2024年12月31日在综合损益表中确认的金额为1,208千欧元(2023年为1,724千欧元)。
结算日期 |
|
分配的RSU数量 |
|
单位公允价值(欧元) |
2025 |
|
268,350 |
|
9.44 |
2027 |
|
268,350 |
|
7.61 |
F-109
针对管理层的保真计划
于2024年,集团已与若干高管签订合约,建立长期股份或现金激励,作为其薪酬体系的一部分。在股份转让的情况下,这些将根据协议条款在周年日或期末以同等条件进行,并始终受制于受益人在约定的结算日期的永久性。每个受益人必须一直受雇于Grifols直到结算日期。
截至2024年12月31日,在权益中确认的金额为1,058欧元至数千欧元。
储蓄计划和利润分享计划
集团有一个固定缴款计划(储蓄计划),根据《国内税收法》(IRC)第401(k)条,该计划符合递延工资安排的条件。一旦符合条件,员工可以选择将部分工资贡献给储蓄计划,但有一定的限制。集团匹配100%的前4%的员工贡献和50%的后2%。集团和员工的贡献在贡献时完全归属。为节约计划匹配捐款的总成本在2024年为3360万美元(2023年为3340万美元)。
其他计划
根据成文法的要求,集团为德国的某些前Talecris Biotherapeutics,GmbH员工制定了固定福利养老金计划。与该计划相关的养老金成本在所述期间并不重要。
Biotest集团为主要来自其德国公司的某些员工制定了退休福利和就业承诺。这些福利是根据雇员的服务年限和工资而定的。养老金计划是自愿的,不受法定或法律义务的约束。养老金负债的多少在很大程度上取决于利率的波动和受益人的预期寿命。
d)采购承诺
集团于2024年12月31日的原材料采购承诺详情如下:
|
千欧元 |
|
2025 |
|
334,304 |
2026 |
|
198,644 |
2027 |
|
128,568 |
2028 |
|
113,570 |
2029 |
|
112,946 |
5年以上 |
128 |
购买BPC Plasma Inc.和Haema GmbH的选择权
根据日期为2018年12月28日的股份购买协议,Grifols集团通过Grifols Shares Services North America Inc(就BPC Plasma Inc,前称Biotest US Corporation(“BPC”)的股份和Grifols Worldwide Operations Limited(就Haema AG的股份,现称Haema GmbH(“Haema”))(“出售公司”)向Scranton Plasma B.V.(“Scranton”)出售BPC和Haema的100%股本股份。股份购买协议包括出售公司回购股份的选择权,授予出售公司在出售后的任何时间回购出售给Scranton的股份的不可撤销的排他性权利(尽管不是义务),但前提是当一家公司(BPC或Haema,视情况而定)的股份回购选择权被行使时,另一家公司(Haema或BPC,视情况而定)的回购选择权也同时被行使。
购买选择权涉及可变的股份数量和可变的收购价格。这一特征将其归类为需要公允估值的衍生金融工具,最终影响损益账户。
F-110
期权的行使价格将根据以下两个金额中的较高者确定:(i)向Scranton出售股份的价格的总和,加上与完成相关股份购买协议中所设想的交易有关的任何费用,加上因行使回购选择权而导致的自出售之日起至回购完成日期的净营运资金增加;(ii)全额支付Scranton与贷款实体为从出售公司购买Haema和BPC的股份而产生的债务所需的金额,金额为425,000,000美元,以及全额偿还该债务所需的任何应计利息和额外金额。
根据上述合同条件,Grifols对行使回购选择权的价值估计如下:(i)出售公司向Scranton出售股份的价格(总计538,000,000美元)增加了与完成相关股份购买协议中所设想的交易有关的任何费用,加上(ii)营运资金的变化。基于Haema和BPC的业务模式,预计营运资金的这一变化将主要反映回购选择权行使时的未分配利润。鉴于回购选择权行使的价格与BPC和Haema的公允价值密切一致,该期权的整体价值不被视为重大。此外,由于期权的估值依赖于不可观察的市场因素,因此属于公允价值层次的第3级。
2024年7月,斯克兰顿与Oaktree控制或管理的基金签订贷款协议(“贷款协议”),为斯克兰顿最初于2019年从银行获得的贷款再融资。根据贷款协议的条款,本次融资受益于以下担保和担保权益:(i)通过BPC的担保,(ii)Haema和BPC的股份质押,以及(iii)对BPC资产的质押。目前,Haema及其资产没有担保或担保这笔融资;然而,根据贷款协议的现行条款,预计Haema将需要成为担保人并为其资产提供担保,作为贷款协议的抵押品。2025年3月31日,Haema GmbH加入(作为担保人)Oaktree向Scranton Plasma BV提供的高级融资。
在贷款协议项下发生违约的情况下,出售公司可在收到违约通知后的90天内分别并同时对两家公司行使回购选择权。如果出售公司未能在该期限内行使这一选择权,他们将失去回购Haema和BPC股份的权利。截至2024年12月31日,没有根据贷款协议报告违约情况。
关于出售BPC Plasma,Inc.和Haema,GmbH的股份,Scranton Enterprises BV.于2018年12月28日与集团签署了一笔贷款,初始金额为9.5万美元(86,969千欧元)。贷款利息2% + EURIBOR,2027年7月26日到期。2023年在与初始贷款相同的条件下安排了1500万欧元的额外金额。截至2024年12月31日,记录金额为131,864千欧元,包括迄今的应计利息和资本化利息(截至2023年12月31日为115,209千欧元)(见附注11)。
向Plasmavita Healthcare GmbH购买期权
2017年11月22日,Plasmavita Healthcare GmbH(Plasmavita)在德国注册成立。目前,集团拥有50%的股份,两名个人合伙人拥有余下的50%。透过管理服务协议,其中一名合伙人(“管理合伙人”)向Plasmavita提供若干管理服务。Plasmavita的成立协议确立了有利于集团的购买选择权,该选择权授予集团在管理合伙人停止向Plasmavita提供管理服务之日起6个月内向两名个人合伙人收购Plasmavita剩余50%股权的不可撤销权利(而非义务)。购买期权的公允价值并不重要。
国家服务项目组织(Egipto)
2021年7月29日,Grifols与一家埃及公司National Service Projects Organization(“NSPO”)签署了一项协议,通过该协议,Grifols和NSPO在埃及成立了一个新实体,用于建设和运营20个血浆供体中心、一个分馏厂以及一个蛋白质纯化和加药厂。Grifols和NSPO在新实体中分别持有49%和51%的股份。该协议包括双方股东的看涨期权和看跌期权,允许他们收购或出售其全部股权给交易对手。这些期权可以在新公司成立10年后行使。由于期权基于可变股份数量和可变金额,因此存在以公允价值计量且其变动计入损益的衍生金融工具。鉴于期权价格已设定为与新实体的公允价值相近的价值,期权不具有实质性价值。
F-111
加拿大血液服务
2022年9月,Grifols与加拿大血液服务公司(CBS)签署了一项合作协议,将通过加拿大血浆中心网络向他们独家供应240万粒免疫球蛋白,该网络应在2026年7月全面开发和运营。为实现这一目标,Grifols将需要每年从加拿大Grifols拥有的血浆中心收集600,000升加拿大血浆。为此,Grifols对在加拿大收购等离子和自建中心做出了以下承诺:
欧元 |
||
2025 |
|
2026 |
|
|
|
e)合同承诺
关于出售SRAAS 20%股权的协议
由于同意将SRAAS的20%股权出售给海尔,两家公司签署了以下协议:
| ● | 与SRAAS签署的现有中国市场人血清白蛋白独家经销协议,期限为 |
| ● | Grifols承诺实现GDS的集团EBITDA总额为美元
|
| ● | Grifols承诺,只要其直接或间接控制GDS,就会使用其商业上合理的努力,不承担义务,确保GDS在交割后各年度向其股东宣派和分配的股息的金额不低于
|
| ● | Grifols已将其在SRAAS的股份质押给海尔(代表海尔和SRAAS),以确保作为债权人的GDS与作为债务人的Grifols之间的现金池协议。 |
| ● | Grifols保留向SRAAS董事会任命一名董事的权利。然而,Grifols已授予海尔(a)投票代理 |
F-112
f)司法程序和仲裁
公司或集团公司涉及的法律诉讼详情如下:
| ● | CERUS CORPORATION vs. LABORATORIOS GRIFOL,S.A。 |
Cerus Corporation(“Cerus”)与Laboratorios GRIFOLS, S.A.,S.A. TERM2(“Grifols”)于2016年订立制造和供应协议,据此,Grifols将向Cerus加工和过滤器组制造和供应,供Cerus在其自身产品中使用(“协议”)。由于Grifols决定在全球范围内停止制造、销售和支持其血袋产品业务,Grifols无法遵守该协议。2021年12月,Cerus根据协议条款在英国提交了一份仲裁通知,指控Grifols错误地终止了协议。此外,2022年1月,Cerus向Rub í(巴塞罗那)法院提交了禁令措施,要求在仲裁程序完成之前暂停关闭Grifols的血袋生产设施。
当前阶段:今年2025年1月,各方已达成一致意见,以结束仲裁,即(a)于2025年1月16日执行一项终止仲裁的和解协议,以换取Grifols向Cerus支付固定为1,091,731.31美元的法律费用,以及(b)于2025年1月28日执行一项现有制造和供应协议的变更契据,其中规定该协议将继续有效并完全生效,直至新的商定到期日,即2029年10月30日。因此,所有实质性问题现在都已解决,只有一些小的程序性步骤悬而未决,例如,支付法庭约36,000英镑的费用,这些费用将由Grifols承担。
| ● | CNMV执行委员会 |
2024年9月25日,Grifols收到通知,CNMV执行委员会已就2024年3月21日CNMV就Grifols与ImmunoTeck合作协议的会计核算达成的结论启动了行政处罚程序(见附注2(d))。该等结论已于同日由公司披露为内幕消息,并随后予以补充。针对结论和补充信息中提到的事件,拟议对Grifols的制裁不超过一百万欧元。11月7日,2024 Grifols提交了针对启动行政处罚程序的指控。
| ● | 额外诉讼 |
有几个最近提起的工资和工时以及相关的劳动法集体诉讼和/或加州私人检察官总法案诉讼已在加州提起。这些案件处于非常早期的阶段,目前尚不清楚任何案件可能导致本集团任何潜在相关现金流出的概率有多大。根据过去的诉讼和结果,Grifols声称,鉴于工资和工时违规的指控,未来有可能有一个或多个案件达到实质性水平,但目前不太可能发生。无论如何,Grifols都会大力捍卫自己,作为其内部流程的一部分,它将继续及时评估任何可能改变其风险评估的事实和情况的变化。如果这些或有事项中的任何一项变得更有可能,它将确定它们是否会导致重大现金流出。
F-113
(三十)金融工具
a)分类
以下是按性质、类别和公允价值划分的金融工具细分。集团并无提供若干金融工具的公允价值详情,因为其账面值与其公允价值非常相似,因为其期限较短。
千欧元 |
||||||||||||||||||||||
31/12/2024 |
||||||||||||||||||||||
账面金额 |
公允价值 |
|||||||||||||||||||||
金融资产 |
金融 |
金融 |
其他 |
|||||||||||||||||||
按摊销 |
金融资产 |
以FV计量的资产 |
负债在 |
金融 |
||||||||||||||||||
|
成本 |
|
在FVTPL |
|
通过OCI |
|
对冲 |
|
摊余成本 |
|
负债 |
|
合计 |
|
1级 |
|
2级 |
|
3级 |
|
合计 |
|
非流动金融资产 |
|
— |
6,127 |
|
416,131 |
— |
|
— |
|
— |
|
422,258 |
|
422,258 |
|
— |
|
— |
|
422,258 |
||
衍生工具 |
— |
— |
— |
7,246 |
— |
— |
7,246 |
— |
7,246 |
— |
7,246 |
|||||||||||
应收账款 |
— |
— |
531,674 |
— |
— |
— |
531,674 |
— |
531,674 |
— |
531,674 |
|||||||||||
以公允价值计量的金融资产 |
— |
6,127 |
|
947,805 |
7,246 |
|
— |
|
— |
|
961,178 |
|
|
|
|
|
|
|
||||
非流动金融资产 |
67,053 |
— |
|
— |
— |
|
— |
|
— |
|
67,053 |
|||||||||||
其他流动金融资产 |
|
237,510 |
— |
|
— |
— |
|
— |
|
— |
|
237,510 |
|
|
|
|
|
|
|
|
||
贸易和其他应收款 |
|
251,334 |
— |
|
— |
— |
— |
|
— |
|
251,334 |
|
|
|
|
|
|
|
|
|||
现金及现金等价物 |
|
979,780 |
— |
|
— |
— |
|
— |
|
— |
|
979,780 |
|
|
|
|
|
|
|
|
||
以摊余成本计量的金融资产 |
|
1,535,677 |
— |
|
— |
— |
|
— |
|
— |
|
1,535,677 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||||||||||||||
衍生工具 |
— |
(5,863) |
— |
— |
— |
— |
(5,863) |
— |
(5,863) |
— |
(5,863) |
|||||||||||
以公允价值计量的金融负债 |
— |
(5,863) |
— |
— |
— |
— |
(5,863) |
|||||||||||||||
高级无抵押及有担保票据 |
|
— |
— |
|
— |
— |
|
(5,356,195) |
|
— |
|
(5,356,195) |
(5,230,596) |
|
— |
|
— |
|
(5,230,596) |
|||
本票 |
|
— |
— |
|
— |
— |
|
(73,177) |
|
— |
|
(73,177) |
|
|
|
|
|
|
|
|||
高级担保债务 |
|
— |
— |
|
— |
— |
|
(2,310,427) |
|
— |
|
(2,310,427) |
|
— |
|
(2,360,113) |
|
— |
|
(2,360,113) |
||
其他银行贷款 |
|
— |
— |
|
— |
— |
|
(345,905) |
|
— |
|
(345,905) |
|
|
|
|
|
|
|
|
||
租赁负债 |
|
— |
— |
|
— |
— |
|
(1,141,379) |
|
— |
|
(1,141,379) |
|
|
|
|
|
|
|
|
||
其他金融负债 |
|
— |
— |
|
— |
— |
|
(933,784) |
|
— |
|
(933,784) |
|
|
|
|
|
|
|
|
||
贸易及其他应付款项 |
|
— |
— |
|
— |
— |
|
(1,062,483) |
|
— |
|
(1,062,483) |
|
|
|
|
|
|
|
|||
其他流动负债 |
|
— |
— |
|
— |
— |
|
— |
|
(318,427) |
|
(318,427) |
|
|
|
|
|
|
|
|
||
以摊余成本计量的金融负债 |
|
— |
— |
|
— |
— |
|
(11,223,350) |
|
(318,427) |
|
(11,541,777) |
|
|
|
|
|
|
|
|
||
|
1,535,677 |
264 |
|
947,805 |
7,246 |
|
(11,223,350) |
|
(318,427) |
|
(9,050,785) |
|
|
|
|
|
|
|
|
|||
F-114
千欧元 |
||||||||||||||||||||||
31/12/2023 |
||||||||||||||||||||||
账面金额 |
公允价值 |
|||||||||||||||||||||
金融资产 |
金融 |
金融 |
金融 |
其他 |
||||||||||||||||||
按摊销 |
资产在 |
以FV计量的资产 |
负债在 |
金融 |
||||||||||||||||||
|
成本 |
|
FVTPL |
|
通过OCI |
|
对冲 |
|
摊余成本 |
|
负债 |
|
合计 |
|
1级 |
|
2级 |
|
3级 |
|
合计 |
|
非流动金融资产 |
|
— |
7 |
|
11,131 |
— |
— |
|
— |
|
11,138 |
|
7 |
|
— |
|
11,131 |
|
11,138 |
|||
衍生工具 |
— |
— |
— |
24,688 |
— |
— |
24,688 |
— |
24,688 |
— |
24,688 |
|||||||||||
应收账款 |
|
— |
— |
|
213,231 |
— |
— |
|
— |
|
213,231 |
|
— |
|
213,231 |
|
— |
|
213,231 |
|||
以公允价值计量的金融资产(*) |
|
— |
7 |
|
224,462 |
24,688 |
— |
|
— |
|
249,057 |
|
|
|
|
|
|
|
||||
非流动金融资产 |
|
164,498 |
— |
|
— |
— |
— |
|
— |
|
164,498 |
|
|
|
|
|
|
|
|
|||
其他流动金融资产 |
|
116,588 |
— |
|
— |
— |
— |
|
— |
|
116,588 |
|
|
|
|
|
|
|
|
|||
贸易和其他应收款 |
|
506,815 |
— |
|
— |
— |
— |
— |
|
506,815 |
|
|
|
|
|
|
|
|
||||
现金及现金等价物 |
|
529,577 |
— |
|
— |
— |
— |
|
— |
|
529,577 |
|
|
|
|
|
|
|
|
|||
以摊余成本计量的金融资产(*) |
|
1,317,478 |
— |
|
— |
— |
— |
|
— |
|
1,317,478 |
|
|
|
|
|
|
|
|
|||
衍生工具 |
— |
(10,144) |
— |
— |
— |
— |
(10,144) |
— |
— |
— |
— |
|||||||||||
以公允价值计量的金融负债 |
— |
(10,144) |
— |
— |
— |
— |
(10,144) |
— |
(10,144) |
— |
(10,144) |
|||||||||||
高级无抵押及有担保票据 |
|
— |
— |
|
— |
— |
(4,568,130) |
|
— |
|
(4,568,130) |
|
— |
— |
|
— |
|
— |
||||
本票 |
|
— |
— |
|
— |
— |
(114,188) |
|
— |
|
(114,188) |
|
(4,364,798) |
|
— |
|
— |
|
(4,364,798) |
|||
高级担保债务 |
|
— |
— |
|
— |
— |
(3,179,333) |
|
— |
|
(3,179,333) |
|
— |
|
— |
|
— |
|
— |
|||
其他银行贷款 |
|
— |
— |
|
— |
— |
(1,144,459) |
|
— |
|
(1,144,459) |
|
— |
|
(3,332,560) |
|
— |
|
(3,332,560) |
|||
租赁负债 |
|
— |
— |
|
— |
— |
(1,111,329) |
|
— |
|
(1,111,329) |
|
|
|
|
|
|
|
||||
其他金融负债 |
|
— |
— |
|
— |
— |
(929,636) |
|
— |
|
(929,636) |
|
|
|
|
|
|
|
||||
贸易及其他应付款项 |
|
— |
— |
|
— |
— |
(956,136) |
|
— |
|
(956,136) |
|
|
|
|
|
|
|
||||
其他流动负债 |
|
— |
— |
|
— |
— |
— |
|
(283,366) |
|
(283,366) |
|
|
|
|
|
|
|
||||
以摊余成本计量的金融负债(*) |
|
— |
— |
|
— |
— |
(12,003,211) |
|
(283,366) |
|
(12,286,577) |
|
|
|
|
|
|
|
||||
|
1,317,478 |
(1,087) |
|
215,313 |
24,688 |
(12,003,211) |
|
(283,366) |
|
(10,730,185) |
|
|
|
|
|
|
|
|||||
(*)重报数字(注2.d.)
b)公允价值计量
为确定金融资产或负债的公允价值,本集团根据所用变量的相关性采用以下层次结构:
| ● | 第1级:基于仪器报价的估算。 |
| ● | 第2级:基于直接来自市场的重要可观察变量的估计。 |
| ● | 第3级:基于市场可观察变量以外的估值技术进行估计,主要是现金流折现。 |
c)金融风险管理
本项目提供了有关本集团与使用金融工具相关的风险敞口、本集团衡量和减轻这一风险的目标和程序以及本集团资本管理战略的信息。
本集团面临以下风险
| ● | 信用风险 |
| ● | 流动性风险 |
| ● | 市场风险:包括利率风险、货币风险和其他价格风险。 |
F-115
集团的风险管理政策旨在识别和分析集团面临的风险,定义适当的风险限额和控制,并控制风险和遵守限额。风险管理政策和程序定期审查,以反映市场状况和集团活动的变化。集团的管理程序和规则旨在创造一个严格和建设性的控制环境,让所有员工都了解他们的职责和义务。
集团的审核委员会监督管理层如何控制遵守集团的风险管理程序和政策,并考虑集团所面临的风险,审查风险管理政策是否合适。该委员会由担任主管的内部审计提供协助。内部审计对风险管理控制和程序进行定期和临时审查,并向审计委员会报告其调查结果。
(一)信用风险
信用风险是指在金融工具的客户或交易对手未能履行合同义务的情况下,本集团所面临的风险,主要产生于贸易应收款项和本集团对金融资产的投资。
主要风险涉及公共实体的逾期付款,这可以通过西班牙立法所预见的索赔利息的可能性来缓解。未检测到向私营实体销售的重大坏账或逾期付款问题。
本集团根据其对贸易及其他应收款项的预期亏损的最佳估计确认减值。确认的主要减值亏损乃由于与个别识别风险有关的特定亏损所致。截至年底,这些减值损失并不重要。
对于贸易应收款项,本集团采用简易法,估计整个存续期内的预期信用损失,而对于所有其他金融资产,本集团采用一般法计算预期信用损失。在这两种情况下,由于客户的信用评级,以及目前对新客户实行的内部分类制度并考虑到收款期限大多在30天左右,因此对集团没有重大影响。
信用风险敞口
Grifols主要通过合同资产、贸易应收款和其他应收款,以及融资活动和集团的金融资产,面临来自其经营活动的信用风险。
金融资产的账面值代表信用风险的最大敞口。2024年12月31日和2023年信用风险暴露的最大水平如下:
千欧元 |
||||||
账面金额 |
|
参考 |
|
31/12/2024 |
|
31/12/2023 |
非流动金融资产 |
|
附注11 |
|
490,492 |
|
176,676 |
其他流动金融资产 |
|
附注11 |
|
243,574 |
|
140,232 |
订约资产 |
附注14 |
36,036 |
47,751 |
|||
应收账款 |
|
附注15 |
|
705,452 |
|
645,113 |
其他应收款 |
|
附注15 |
|
16,119 |
|
31,594 |
现金及现金等价物 |
|
附注16 |
|
979,780 |
|
529,577 |
|
|
|
2,471,453 |
|
1,570,943 |
|
F-116
Grifols定期监测其与银行的信用风险敞口。本集团通过持有现金头寸和与高偿付能力金融机构的衍生合约来保持低信用风险状况。
本集团对金融资产的可收回性进行了评估,结论认为不存在重大违约风险。
按地域划分的应收款项及合约资产账面值,于2024年12月31日及2023年12月31日如下:
千欧元 |
||||
账面金额 |
|
31/12/2024 |
|
31/12/2023* |
西班牙 |
|
59,667 |
|
57,800 |
欧盟国家 |
|
116,367 |
|
79,951 |
美利坚合众国 |
|
45,644 |
|
13,572 |
其他欧洲国家 |
|
92,170 |
|
82,822 |
其他地区 |
|
427,640 |
|
458,719 |
741,488 |
692,864 |
|||
(*)重报数字(注2.d.)
减值损失
以下列示截至2024年12月31日按到期日分类的贸易及其他应收款和合同资产的账面值如下:
千欧元 |
||||||||
总净第三 |
||||||||
总携带量 |
党贸 |
|||||||
|
ECL利率 |
|
金额 |
|
规定 |
|
应收款项 |
|
未成熟 |
|
0.19 |
% |
621,498 |
|
(626) |
|
620,872 |
逾期0-30天 |
|
0.19 |
% |
18,556 |
|
(566) |
|
17,990 |
逾期31-60天 |
|
0.62 |
% |
24,577 |
|
(150) |
|
24,427 |
逾期61-90天 |
|
2.03 |
% |
17,301 |
|
(438) |
|
16,863 |
逾期91-180天 |
|
3.01 |
% |
36,366 |
|
(1,065) |
|
35,301 |
逾期181-365天 |
|
8.52 |
% |
15,930 |
|
(1,342) |
|
14,588 |
一年以上 |
|
100.00 |
% |
16,739 |
(5,292) |
11,447 |
||
— |
— |
— |
||||||
有客观减值证据的客户 |
|
|
|
11,388 |
(11,388) |
— |
||
|
762,355 |
(20,867) |
741,488 |
|||||
使用基于逾期时间长度的减值矩阵来监控个别情况下未显示任何特定减值迹象的应收账款组合。对于逾期超过一年的与中东客户相关的贸易应收款项,由于特殊的违约模式,调整了减值矩阵中的统一费率百分比。
F-117
以下列示截至2023年12月31日按到期日分类的贸易及其他应收款及合同资产的账面值如下:
千欧元 |
||||||||
总净第三 |
||||||||
总携带量 |
党贸 |
|||||||
|
ECL利率 |
|
金额 |
|
规定 |
|
应收款项 |
|
未成熟 |
|
0.19 |
% |
524,699 |
|
(560) |
|
524,136 |
逾期0-30天 |
|
0.19 |
% |
106,323 |
|
(246) |
|
106,077 |
逾期31-60天 |
|
0.62 |
% |
19,428 |
|
(119) |
|
19,309 |
逾期61-90天 |
|
2.03 |
% |
6,398 |
|
(120) |
|
6,278 |
逾期91-180天 |
|
3.01 |
% |
9,283 |
|
(279) |
|
9,004 |
逾期181-365天 |
|
8.52 |
% |
6,749 |
|
(573) |
|
6,176 |
一年以上 |
|
100.00 |
% |
25,982 |
|
(4,101) |
|
21,884 |
有客观减值证据的客户 |
|
|
|
25,578 |
|
(25,578) |
|
— |
|
724,440 |
|
(31,576) |
|
692,864 |
|||
坏账准备变动情况如下:
千欧元 |
||||||
|
31/12/2024 |
|
31/12/2023 |
|
31/12/2022 |
|
期初余额 |
|
31,576 |
|
32,291 |
|
24,009 |
当年净费用 |
|
5,302 |
|
7,322 |
|
14,074 |
当年净注销 |
|
(16,511) |
|
(7,237) |
|
(6,949) |
转让 |
— |
47 |
53 |
|||
翻译差异 |
|
500 |
|
(847) |
|
1,104 |
期末余额 |
|
20,867 |
|
31,576 |
|
32,291 |
(二)流动性风险
流动性风险是指本集团无法履行到期财务义务的风险。集团管理流动资金的方法是,在可能的情况下,确保其始终有充足的流动资金在到期日清偿其债务,无论是在正常情况下还是在财务压力时期,以避免产生不可接受的损失或损害集团的声誉。
集团根据可用现金和充足的已承诺未使用的长期信贷额度,在审慎的基础上管理流动性风险,使集团能够实施其业务计划并利用稳定和安全的融资来源开展业务。
期末流动性为225.9088万欧元(包括未提取的承诺信用额度),详情如下:
千欧元 |
||||
|
31/12/2024 |
|
31/12/2023 |
|
活期存款 |
|
5,100 |
|
6,506 |
在手现金和在银行 |
|
974,680 |
|
523,071 |
现金和现金等价物合计 |
|
979,780 |
|
529,577 |
未提取承诺授信额度 |
|
1,279,308 |
|
615,328 |
总流动性 |
|
2,259,088 |
|
1,144,905 |
信贷协议规定了截至2023年12月31日和2024年尚未超过的“循环额度”的使用限制。
F-118
集团能够根据经营活动产生的现金流量,结合现金余额和可用未使用信贷额度,提供充足的流动性,为其当前债务提供资金,并致力于通过内部产生的现金流量保持较高和充足的流动性水平。此外,目前集团没有在任何可能对资金汇回有限制的国家产生大量现金。
与往年一样,集团继续其季度营运资金优化计划,该计划主要基于无追索权出售应收款项的合同。
财政年度终了时存在的主要合同义务主要包括偿还资本和支付利息的长期金融债务义务(见附注21)。
采用利率远期曲线计算的含承诺利息的金融负债合同到期日明细如下:
千欧元 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
订约 |
6个月 |
6 - 12 |
1-2 |
2 - 5 |
超过 |
|||||||||||
账面金额 |
|
参考 |
|
31/12/2024 |
|
流量 |
|
或更少 |
|
月份 |
|
年 |
|
年 |
|
5年 |
金融负债 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
银行贷款 |
|
附注21 |
|
2,656,332 |
|
3,162,629 |
|
361,583 |
|
110,212 |
|
176,452 |
|
2,514,382 |
|
0 |
其他金融负债 |
|
附注21 |
|
933,785 |
|
1,488,690 |
|
185,618 |
|
6,871 |
|
115,842 |
|
414,309 |
|
766,050 |
债券及其他有价证券 |
|
附注21 |
|
5,429,372 |
|
6,959,491 |
|
246,359 |
|
146,625 |
|
293,250 |
|
3,673,257 |
|
2,600,000 |
租赁负债 |
|
附注21 |
|
1,141,379 |
|
1,774,521 |
|
58,267 |
|
58,267 |
|
117,233 |
|
319,410 |
|
1,221,344 |
应付供应商款项 |
|
附注22 |
|
852,305 |
|
852,305 |
|
847,854 |
|
4,451 |
|
0 |
|
0 |
|
0 |
其他流动负债 |
|
附注23 |
|
41,277 |
|
41,277 |
|
24,276 |
|
16,997 |
|
4 |
|
0 |
|
0 |
金融衍生品 |
附注30(d) |
5,863 |
5,863 |
5,863 |
0 |
0 |
0 |
0 |
||||||||
合计 |
|
|
|
11,060,313 |
|
14,284,776 |
|
1,729,820 |
|
343,423 |
|
702,777 |
|
6,921,358 |
|
4,587,394 |
千欧元 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
订约 |
6个月 |
6 - 12 |
1-2 |
2 - 5 |
超过 |
|||||||||||
账面金额 |
参考 |
31/12/2023 |
流量 |
或更少 |
月份 |
年 |
年 |
5年 |
||||||||
金融负债 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
银行贷款 |
|
附注21 |
|
4,323,792 |
|
5,329,182 |
|
611,387 |
|
327,923 |
|
650,970 |
|
3,738,902 |
|
0 |
其他金融负债 |
|
附注21 |
|
929,635 |
|
1,518,616 |
|
181,800 |
|
1,855 |
|
116,398 |
|
455,467 |
|
763,096 |
债券及其他有价证券 |
|
附注21 |
|
4,682,319 |
|
5,304,861 |
|
187,543 |
|
73,571 |
|
1,978,190 |
|
3,065,557 |
|
0 |
租赁负债(*) |
|
附注21 |
|
1,111,328 |
|
1,562,912 |
|
53,551 |
|
53,551 |
|
126,133 |
|
326,253 |
|
1,003,424 |
应付供应商款项(*) |
|
附注22 |
|
822,955 |
|
813,114 |
|
811,943 |
|
1,171 |
|
0 |
|
0 |
|
0 |
其他流动负债(*) |
|
附注23 |
|
17,398 |
|
16,651 |
|
16,496 |
|
155 |
|
0 |
|
0 |
|
0 |
金融衍生品 |
附注30(d) |
10,144 |
10,144 |
10,133 |
0 |
11 |
0 |
0 |
||||||||
合计 |
|
|
|
11,897,571 |
|
14,555,480 |
|
1,872,853 |
|
458,226 |
|
2,871,702 |
|
7,586,179 |
|
1,766,520 |
(*)重报数字(注2.d.)
合同承诺的详细情况在附注29e)和10中披露。
(三)货币风险
本集团在国际上经营,因此在使用外币经营时面临货币风险,特别是在美元方面。货币风险与未来的商业交易、确认的资产和负债以及对国外业务的净投资有关。
F-119
本集团在国外业务中持有大量投资,其净资产面临货币风险。影响集团海外业务以美元计价的净资产的转换风险主要通过该外币借款来缓解。
集团面临的主要货币风险是美元,美元在很大比例的外币功能货币交易中被使用。
以欧元获得的融资占集团金融债务总额的66%,截至2024年12月31日为59.24亿欧元(占62%,截至2023年12月31日为60.32亿欧元)。在此细分中,‘集团债务’仅指金融债务的名义金额。
直至2024年9月13日货币互换取消时,集团的部分美元债务由货币互换覆盖,以对冲相关货币风险敞口。
本集团采用套期保值成本法。这一方法使本集团能够将货币基差从指定套期工具中剔除,并在符合某些要求的情况下,在其他综合收益中确认其归属于该部分的公允价值变动。
集团的货币风险敞口详情如下:
千欧元 |
||||
31/12/2024 |
||||
|
欧元(*) |
|
美元(**) |
|
应收账款 |
|
2,818 |
|
72,051 |
应收集团公司款项 |
|
118,959 |
|
16,264 |
对集团公司的贷款 |
|
4,644,337 |
|
— |
现金及现金等价物 |
|
452,729 |
|
25,683 |
贸易应付款项 |
|
(21,791) |
|
(17,219) |
应付集团公司款项 |
|
(74,394) |
|
(44,576) |
集团公司贷款 |
|
(5,428,382) |
|
(5,849) |
银行贷款 |
|
(10,625) |
|
— |
|
|
|
|
|
资产负债表敞口 |
|
(316,349) |
|
46,354 |
(*)以美元记账本位币记账的子公司欧元余额
(**)以欧元记账本位币记账的子公司美元余额
千欧元 |
||||
31/12/2023 |
||||
|
欧元(*) |
|
美元(**) |
|
应收账款 |
|
2,278 |
|
47,772 |
应收集团公司款项 |
|
121,173 |
|
10,908 |
对集团公司的贷款 |
|
4,818,407 |
|
41 |
现金及现金等价物 |
|
7,296 |
|
2,026 |
贸易应付款项 |
|
(38,610) |
|
(43,682) |
应付集团公司款项 |
|
(119,801) |
|
(30,643) |
集团公司贷款 |
|
(4,650,080) |
|
— |
银行贷款 |
|
(336,250) |
|
— |
|
|
|
||
资产负债表敞口 |
|
(195,587) |
|
(13,578) |
(*)以美元记账本位币记账的子公司欧元余额
(**)以欧元记账本位币在子公司的美元余额
F-120
2024年底和2023年底适用的最重要汇率如下:
收盘汇率 |
||||
欧元 |
|
31/12/2024 |
|
31/12/2023 |
美元 |
|
|
|
1.1050 |
外汇波动敏感性分析如下:
如果美元兑欧元在2024年12月31日升值10%,总股本将增加1,067,890千欧元(2023年12月31日为820,616千欧元),因外汇差额产生的利润将减少27,000千欧元(2023年12月31日为20,638千欧元)。该分析假设所有其他变量保持不变,尤其是利率保持不变。
在所有其他变量保持不变的情况下,美元兑欧元在2024年12月31日和2023年12月31日贬值10%将对上述金额产生相反的影响。
本集团采用套期会计方式对货币风险敞口进行部分套期保值(见附注30(d))。
(四)利率风险
集团的利率风险产生于流动及非流动借款。浮动利率借款使集团面临现金流利率风险。固定利率借款使集团面临公允价值利率风险。
利率风险管理的目标是实现债务结构的平衡,保持部分外部资源以固定利率发行,并通过套期保值覆盖部分浮动利率债务。
所获得融资的很大一部分按固定利率计息,占集团2024年12月31日总债务的71%(2023年12月31日为59%)。主要包括企业优先票据、欧洲投资银行贷款,以及与GIC(新加坡主权基金)的协议(见附注21)。
浮动利率债务占2024年12月31日总债务的29%(2023年12月31日为41%),主要包括优先担保债务(见附注21(b))。
迄今为止,生息金融工具的利息概况如下:
千欧元 |
||||
|
31/12/2024 |
|
31/12/2023 |
|
固息金融工具 |
|
6,430,225 |
|
5,696,851 |
金融负债 |
|
6,430,225 |
|
5,696,851 |
可变利率金融工具 |
2,540,968 |
3,956,154 |
||
金融负债 |
|
2,540,968 |
|
3,956,154 |
|
8,971,193 |
|
9,653,005 |
|
如果利率在2024年12月31日上涨100个基点,利息支出将增加29,954千欧元(2023年12月31日为34,114千欧元)。由于集团没有任何对冲衍生工具,现金利息支付的净影响将增加相同的金额。
在这一细分中,“金融负债”和“总债务”仅指债务的名义金额。
F-121
d)金融衍生品
于2024年12月31日及2023年12月31日,集团已确认以下衍生工具:
千欧元 |
||||||||||||
概念在 |
概念在 |
价值在 |
价值在 |
|||||||||
金融衍生品 |
|
货币 |
|
31/12/2024 |
|
31/12/2023 |
|
31/12/2024 |
|
31/12/2023 |
|
成熟度 |
交叉货币利率互换 |
|
美元 |
|
— |
|
500,000 |
|
— |
|
20,538 |
|
15/10/2024 |
交叉货币利率互换 |
|
美元 |
|
— |
|
205,000 |
|
— |
|
(140) |
|
15/10/2024 |
外汇汇率远期 |
|
瑞士法郎 |
|
12,000 |
|
10,000 |
|
— |
|
378 |
|
11/2/2025 |
外汇汇率远期 |
|
加元 |
|
240,202 |
|
32,667 |
|
3,654 |
|
450 |
|
11/02/2025 |
外汇汇率远期 |
|
英镑 |
|
4,500 |
|
— |
|
786 |
|
— |
|
18/2/2025 |
外汇汇率远期 |
日元 |
1,200,000 |
700,000 |
438 |
— |
18/2/2025 |
||||||
外汇汇率远期 |
澳大利亚元 |
9,000 |
— |
278 |
— |
28/1/2025 |
||||||
外汇汇率远期 |
巴西雷亚尔 |
70,000 |
— |
288 |
— |
18/2/2025 |
||||||
外汇汇率远期 |
|
捷克王冠 |
|
160,000 |
|
160,000 |
|
— |
|
191 |
|
18/2/2025 |
外汇汇率远期 |
墨西哥比索 |
50,000 |
90,000 |
— |
193 |
18/2/2025 |
||||||
外汇汇率远期 |
土耳其里拉 |
— |
87,835 |
— |
44 |
31/1/2024 |
||||||
外汇汇率远期 |
美元 |
— |
7,700 |
— |
92 |
29/2/2024 |
||||||
外汇汇率远期 |
欧元 |
240,246 |
40,000 |
315 |
1,412 |
30/1/2025 |
||||||
能源PPA |
|
欧元/千瓦时 |
|
— |
|
— |
|
1,486 |
|
1,529 |
|
31/12/2032 |
衍生资产总额 |
|
|
|
7,245 |
|
24,687 |
|
|
||||
交叉货币利率互换 |
|
美元 |
|
— |
|
205,000 |
|
— |
|
(7,712) |
|
13/9/2024 |
外汇汇率远期 |
|
加元 |
|
228,917 |
|
42,560 |
|
(1,172) |
|
(2,081) |
|
11/2/2025 |
外汇汇率远期 |
|
美元 |
|
39,385 |
|
2,000 |
|
(764) |
|
(2) |
|
26/2/2025 |
外汇汇率远期 |
|
捷克王冠 |
|
160,000 |
|
160,000 |
|
(124) |
|
(13) |
|
18/2/2025 |
外汇汇率远期 |
|
英镑 |
|
4,500 |
|
8,500 |
|
(353) |
|
(122) |
|
18/2/2025 |
外汇汇率远期 |
日元 |
1,200,000 |
700,000 |
(309) |
(214) |
18/2/2025 |
||||||
外汇汇率远期 |
欧元 |
240,246 |
40,000 |
(2,615) |
— |
30/1/2025 |
||||||
外汇汇率远期 |
墨西哥比索 |
50,000 |
90,000 |
(64) |
— |
18/2/2025 |
||||||
外汇汇率远期 |
澳大利亚元 |
9,000 |
— |
(7) |
— |
28/1/2025 |
||||||
外汇汇率远期 |
|
瑞士法郎 |
|
12,000 |
|
10,000 |
|
(455) |
|
— |
|
11/2/2025 |
衍生负债总额 |
|
|
|
(5,863) |
|
(10,144) |
||||||
(一)套期保值衍生金融工具
于2021年10月5日,集团认购三笔名义金额为5亿美元的交叉货币利率掉期,以对冲于2021年10月发行的美元无抵押票据的部分等值欧元。它是一种固定对固定的美元/欧元交叉货币互换,具有以下特点:
| ● | 集团收到一笔欧元贷款
|
| ● | 集团授出一美元
|
2022年6月28日,集团认购1笔名义金额为2.05亿美元的交叉货币利率互换,用于对2021年10月发行的美元无担保票据的欧元等值剩余部分进行套期保值。它是一种固定对固定的美元/欧元交叉货币互换,具有以下特点:
| ● | 集团收到一欧元
|
| ● | 集团授出一美元
|
F-123
2024年9月13日,交叉货币互换提前终止。截至2024年12月31日,集团在综合损益表‘金融工具公允价值变动’项下确认净财务收入4,348千欧元(截至2023年12月31日为546千欧元)。
该衍生工具符合套期会计要求的标准。详见附注4(i)。
(二)以公允价值计量且其变动计入损益的衍生金融工具
集团已收缩若干远期汇率对冲,以部分覆盖公司间贷款的外币价值。由于本集团选择不采用套期会计,衍生工具公允价值变动产生的损益在综合损益表‘金融工具公允价值变动’标题下直接确认。截至2024年12月31日,集团确认净财务收入15,534千欧元(截至2023年12月31日财务费用2,005千欧元)。
(三)电力衍生品
2023年初,公司签订了电价变动套期保值协议。这份合同起到了全面覆盖购电价格抵御潜在市场价格上涨的作用。能源价格套期保值衍生工具符合应用套期会计的要求,因此该金融工具价值的变动(按税项净额)记入权益。
衍生金融工具的变动情况如下:
|
千欧元 |
|||
|
31/12/2024 |
31/12/2023 |
||
期初余额 |
14,543 |
34,923 |
||
企业合并 |
|
— |
|
— |
在权益中确认的公允价值变动 |
|
(1,690) |
|
1,914 |
转入损益 |
|
27,267 |
|
5,775 |
转入损益-折算差额 |
|
(208) |
|
(23,037) |
税收效应 |
|
(963) |
|
(84) |
收款/付款 |
|
(37,568) |
|
(4,948) |
期末余额 |
|
1,381 |
|
14,543 |
e)资本管理
董事会的政策是维持稳固的资本基础,以确保投资者、债权人和市场信心,并维持未来业务发展。董事会定义并提出支付给股东的股息水平。
通过编制战略计划定期审查资本结构,主要侧重于EBITDA(息税、摊销和折旧前利润)的连续改善、经营现金的产生和资本分配的纪律;目标和承诺降低杠杆率。
根据优先担保债务合约,集团须遵守若干契诺。于2024年12月31日及2023年12月31日,集团遵守合约内的契诺。
F-124
本集团的信用评级如下:
|
2024年12月 |
|||
穆迪投资者 |
|
企业评级 |
B3 |
|
|
高级担保债务 |
B2 |
||
|
高级无抵押债务 |
Caa2 |
||
|
透视 |
阳性 |
||
标准普尔 |
|
企业评级 |
B + |
|
|
高级担保债务 |
B + |
||
|
高级无抵押债务 |
B- |
||
|
透视 |
稳定 |
||
惠誉评级 |
|
企业评级 |
B + |
|
|
高级担保债务 |
BB- |
||
|
高级无抵押债务 |
B- |
||
|
透视 |
稳定 |
母公司于2024年12月31日持有相当于其资本1.04%的A类和B类库存股(2023年12月31日为1.23%)。
(31) |
与关联方的余额及往来 |
a)与关联方的集团结余
2024年12月31日关联方余额明细a如下:
千欧元 |
||||||||
账面金额 |
参考 |
联营公司 |
关键管理人员 |
其他关联方 |
||||
应收款项 |
|
15 |
|
38,656 |
|
— |
|
— |
当前合同资产 |
|
|
3,085 |
|
— |
|
— |
|
其他金融资产 |
|
11 |
|
418 |
|
— |
|
— |
贷款 |
|
11 |
|
— |
|
— |
|
214,119 |
保证存款 |
|
11 |
|
— |
|
— |
|
943 |
债务人共计 |
|
|
|
42,159 |
|
— |
|
215,062 |
债务 |
|
|
|
— |
|
(279) |
|
(13,952) |
债权人总数 |
|
|
|
— |
|
(279) |
|
(13,952) |
— |
— |
— |
||||||
合计 |
|
|
|
42,159 |
|
(279) |
|
201,110 |
经重列的2023年12月31日关联方余额明细与2024年关联方余额明细比较如下:
千欧元 |
||||||||||
账面金额 |
参考 |
联营公司 |
密钥管理 |
其他关联方 |
董事会 |
|||||
应收款项 |
|
15 |
|
227,550 |
|
— |
|
5,609 |
|
— |
其他金融资产 |
|
11 |
|
418 |
|
— |
|
— |
|
— |
贷款 |
|
11 |
|
— |
|
— |
|
216,426 |
|
— |
保证存款 |
|
11 |
|
— |
|
— |
|
934 |
|
— |
债务人共计 |
|
|
|
227,968 |
|
— |
|
222,969 |
|
— |
债务 |
|
|
|
— |
|
(3,611) |
|
(12,926) |
|
(3,924) |
债权人总数 |
|
|
|
— |
|
(3,611) |
|
(12,926) |
|
(3,924) |
合计 |
|
|
|
227,968 |
|
(3,611) |
|
210,043 |
|
(3,924) |
F-125
对应于联营公司的“应收款项”标题包括向联营公司销售的未偿余额,主要对应于2024年的Grifols Egypt Plasma Derivatives S.A.E.(2023年为205,537千欧元,2022年为153,120千欧元,对应于安徽通灵药业股份有限公司(上海RAAS血液制品股份有限公司集团的子公司))。截至2023年12月31日,其他关联方对应的“应收款项”余额完全对应于对Víctor Grifols Roura先生的待收款金额。这笔余额已于2024年1月结清。
标题“贷款”主要包括Scranton Enterprises BV.于2018年12月28日与集团签署的初始金额为95,000美元(86,969千欧元)的贷款(见附注11),涉及支付BPC Plasma,Inc.和Haema,GmbH的股份出售(见附注2)。截至2024年12月31日和2023年12月31日,本标题包括在2023年期间按照与初始贷款相同的条件安排的额外金额1500万欧元(见附注31(b))。截至2024年12月31日,记录金额为131,864千欧元,包括迄今为止的应计利息和资本化利息(截至2023年12月31日为115,209千欧元)。
此外,它还包括BPC Plasma,Inc和Haema,GmbH与Scranton Plasma,BV签订的现金池融资协议,该协议将于2027年到期(见附注11)。
“债务”标题包括集团公司Instituto GRIFOLS, S.A.发行的不记名本票余额对应的截至2024年12月31日的金额9,125千欧元(2023年12月31日为17,732千欧元)这些期票分别于2025年5月4日和2024年到期,每张面值为3,000欧元,年票面利息为5%(2023年为4%)。
b)与关联方的集团往来
2024年期间与关联方的集团往来情况如下:
千欧元 |
||||||||
|
|
密钥管理 |
|
其他相关 |
|
董事会 |
||
联营公司 |
人事 |
当事人 |
公司的 |
|||||
净收入 |
|
269,733 |
— |
|
117 |
|
— |
|
采购 |
(2) |
— |
|
(235) |
|
— |
||
提供服务 |
— |
— |
(4,848) |
— |
||||
薪酬 |
|
— |
(13,676) |
|
— |
|
(15,120) |
|
使用权付款 |
|
— |
— |
|
(7,202) |
|
— |
|
财务收入 |
— |
— |
18,317 |
— |
||||
已收/(已付)股息 |
6,724 |
— |
(39,510) |
— |
||||
贷款 |
|
— |
— |
|
44,937 |
|
— |
|
收购资产 |
— |
— |
(35,000) |
— |
||||
|
276,455 |
(13,676) |
|
(23,424) |
|
(15,120) |
||
F-126
2023年期间与关联方发生的集团往来如下:
千欧元 |
||||||||
|
|
密钥管理 |
|
其他相关 |
|
董事会 |
||
联营公司 |
人事 |
当事人 |
公司的 |
|||||
净收入 |
|
471,829 |
— |
|
14 |
|
— |
|
采购 |
|
(23) |
— |
(431) |
— |
|||
提供服务 |
(78) |
— |
(2,482) |
— |
||||
薪酬 |
|
— |
(23,698) |
|
— |
|
(12,163) |
|
使用权付款 |
— |
— |
(7,234) |
— |
||||
购置物业、厂房及设备 |
— |
— |
— |
— |
||||
财务收入 |
— |
— |
30,185 |
— |
||||
已收/(已付)股息 |
7,309 |
— |
(266,406) |
— |
||||
贷款 |
— |
— |
44,956 |
— |
||||
|
479,037 |
(23,698) |
|
(201,398) |
|
(12,163) |
||
2022年期间与关联方发生的集团往来情况如下:
千欧元 |
||||||||
|
|
密钥管理 |
|
其他相关 |
|
董事会 |
||
联营公司 |
人事 |
当事人 |
公司的 |
|||||
净收入 |
|
339,170 |
— |
|
— |
|
— |
|
采购 |
|
(9) |
— |
— |
— |
|||
提供服务 |
(34) |
— |
(5,467) |
— |
||||
薪酬 |
|
— |
(13,891) |
|
— |
|
(5,316) |
|
使用权付款 |
— |
— |
(6,382) |
— |
||||
购置物业、厂房及设备 |
— |
— |
3,464 |
— |
||||
财务收入 |
— |
— |
|
12,878 |
|
— |
||
已收/(已付)股息 |
|
10,717 |
— |
— |
— |
|||
贷款 |
— |
— |
80,098 |
— |
||||
|
349,844 |
(13,891) |
|
84,591 |
|
(5,316) |
||
“净收入”包括主要对应于安徽天乐药业有限公司(上海RAAS血液制品股份有限公司集团的子公司)的对联营公司的销售额(2024年为230,812千欧元,2023年为450,389千欧元,2022年为319,669千欧元)。
“其他服务费用”包括对应于2024年对非营利实体的捐款的4,304千欧元(2023年为2,174千欧元,2022财年为4,231千欧元)。
收到的股息对应的是联营公司上海RAAS血液制品股份有限公司、Bio Darou P.J.S. Co.和Access Biologicals LLC。此外,分配的股息对应于BPC Plasma Inc.(见附注11)。
“收购资产”包括以3.5万欧元收购Haema Plasma KFT,该收购已通过注销集团与Haema GmbH的一笔应收账款余额而实现。这笔余额转入Scranton Plasma B.V.,并通过这些公司持有的现金池融资协议(见附注11)进行结算。
2023年期间代表股东的董事、于2023年12月辞去董事职务的Victor Grifols Roura先生2023年的薪酬为96.5万欧元。
F-127
2024年度、2023年度和2022年度与其他关联方交易的构成情况如下:
千欧元 |
||||||||||
关联方 |
|
概念 |
|
参考 |
|
2024 |
|
2023 |
|
2022 |
Scranton Enterprises,B.V。 |
|
利息信贷 |
|
b) |
|
8,484 |
|
7,830 |
|
2,093 |
Scranton Enterprises,B.V。 |
|
融资协议:信贷 |
|
a) |
|
— |
|
15,000 |
|
— |
Scranton Plasma B.V。 |
|
利息现金池 |
|
b) |
|
9,833 |
|
22,355 |
|
10,785 |
斯克兰顿等离子体BV |
|
融资协议:现金池 |
|
a) |
|
44,937 |
|
29,956 |
|
80,098 |
斯克兰顿等离子体BV |
|
支付/收到的股息 |
|
c) |
|
(39,510) |
|
(266,406) |
|
— |
斯克兰顿等离子体BV |
|
股份收购 |
|
d) |
|
(35,000) |
|
— |
|
— |
Juve & Camps S.A。 |
|
版税 |
|
|
— |
|
14 |
|
— |
|
Juve & Camps S.A。 |
|
采购 |
|
|
(83) |
|
(8) |
|
(169) |
|
Probitas Fundaci ó n Privada |
|
管理和协作合同 |
|
f) |
|
(3,384) |
|
(1,338) |
|
(3,383) |
Fundaci ó n Privada Victor Grifols Lucas |
|
管理和协作合同 |
|
f) |
|
(465) |
|
(407) |
|
(450) |
Club Joventut Badalona,S.A.D。 |
|
提供服务 |
|
|
(300) |
|
(300) |
|
(341) |
|
Centurion Real State,S.A.U |
|
使用权付款 |
|
e) |
|
(7,141) |
|
(7,147) |
|
(6,300) |
Centurion Real State,S.A.U |
|
改善工程 |
|
|
— |
|
— |
|
3,464 |
|
Jose Antonio Grifols卢卡斯基金会 |
|
管理和协作合同 |
|
f) |
|
(455) |
|
(429) |
|
(398) |
Aurea Arrendamientos de Viviendas,S.A。 |
|
使用权付款 |
|
|
(46) |
|
(87) |
|
(82) |
|
Qardio INC |
|
采购 |
|
|
(152) |
|
(431) |
|
(726) |
|
更多关于Simplicity S.L。 |
|
提供服务 |
|
|
(41) |
|
— |
|
— |
|
Marca Grifols,S.L。 |
|
版税 |
|
g) |
|
(187) |
|
— |
|
— |
Medicover F ö rsakrings AB Magyarorsz |
|
提供服务 |
|
|
(16) |
|
— |
|
— |
|
远藤运营有限公司 |
|
提供服务 |
|
|
|
117 |
|
— |
|
— |
其他 |
|
使用权付款 |
|
|
|
(15) |
|
— |
|
— |
|
(23,424) |
|
(201,398) |
|
84,591 |
|||||
| (a) | 主要包括BPC Plasma,Inc和Haema,GmbH与Scranton Plasma,BV根据上述现金池融资协议支付的净额以及额外的欧元
|
| (b) | 主要包括Scranton Enterprises BV.于2018年12月28日与集团签订金额为美元的贷款协议所对应的应计利息
|
| (c) | 在2024年和2023年,BPC Plasma Inc.向其股东Scranton Plasma B.V.分配了一笔没有现金流出的股息,用于补偿“对关联方的贷款”(见附注11)。2024年股息达欧元
|
F-128
| (d) | 包括作为买方的GWWO和作为卖方的Scranton Plasma B.V.以欧元收购Haema Plasma KFT。
|
| (e) | 对应Sant Cugat del Vall è s的Grifols办公楼。所有租赁合同的到期日为2045年3月1日。 |
| (f) | 集团每年贡献
|
| (g) | Marca Grifols于2024年12月23日成为GRIFOLS, S.A.的关联方,收购一
|
集团并无向董事会成员或主要管理人员提供任何垫款或贷款,亦无代其承担任何担保承诺。它也没有代表董事会前任或现任成员或关键管理人员承担任何养老金或人寿保险义务。此外,某些公司董事和关键管理人员有解雇福利承诺(见附注29)。
2024年7月,斯克兰顿与Oaktree控制或管理的基金签订贷款协议(“贷款协议”),为斯克兰顿最初于2019年从银行获得的贷款再融资。根据贷款协议的条款,本次融资受益于以下担保和担保权益:(i)通过BPC的担保,(ii)Haema和BPC的股份质押,以及(iii)对BPC资产的质押。目前,Haema及其资产没有获得这笔融资;但根据贷款协议的现行条款,预计在2025财政年度期间,Haema将需要成为担保人,并为其资产提供担保,作为贷款协议的抵押品(见附注29)。
c)有关董事的利益冲突
本集团没有代董事会成员或关键管理人员成员承担的垫款、贷项或义务作为担保,也没有就董事会前任或现任成员或管理层关键成员承担的养老金和人寿保险义务。此外,某些管理人员和关键管理人员有离职承诺(见附注29)。
2024年7月,斯克兰顿与Oaktree控制或管理的基金签订贷款协议(“贷款协议”),为斯克兰顿最初于2019年从银行获得的贷款再融资。根据贷款协议的条款,本次融资受益于以下担保和担保权益:(i)BPC Plasma,Inc的担保,(ii)Haema GmbH和BPC Plasma,Inc的股份质押,以及(iii)对BPC Plasma,Inc资产的质押。目前,Haema GmbH及其资产不为本次融资提供担保或担保;然而,根据贷款协议的现行条款,预计Haema GmbH将需要成为担保人并为其资产提供担保,作为贷款协议的抵押品(见附注29)。
F-129
(三十二)后续事项
ImmunoTek
根据Grifols Bio North America LLC(“GBNA”)与Immunotek LLC(“Immunotek”)订立的有效安排(“Immunotek合作协议”)(“Immunotek合作协议”)的预定,自2025年1月2日起,GBNA从ImmunoTek购买一组8个位于美国的血浆采集中心(“Group 3中心”),总现金净额约为78,888,000美元。
此外,尽管根据Immunotek合作协议,以下定义的第4组中心的收购预计将在2026年1月进行,但为了响应优化运营效率的战略决策,Immunotek和Grifols签署了对当时有效的现有Immunotek合作协议的修订,据此,自2025年2月3日起,GBNA从Immunotek购买了最后剩余的6个美国血浆采集中心(“第4组中心”),总现金净额约为62,428,000美元,付款义务于2026年1月2日到期(如原Immunotek合作协议中所预见)。因此,Grifols在2025财政年度就集团4中心的(递延)购买价格金额确认了一项短期负债。
作为发行人的Biomat Holdings LLC与作为票据持有人的Immunotek之间的本票中记录了此类延期付款义务,金额为69,343,084美元(“本票”)(其中包括约700万美元的管理费),将于2026年1月2日到期,不计利息。Group 4 Centers作为本票的抵押品,并且(在Grifols S.A.根据Immunotek合作协议提供相同担保之后)本票由GRIFOLS, S.A.提供担保
因此,在收购Group 3 Centers和Group 4 Centers之后,Grifols在2025年的收购日期获得了14个中心的控制权(此前曾在联合经营中被考虑),现在完全拥有并将(从2025年5月1日起)通过其子公司Biomat Holdings LLC管理Immunotek根据Immunotek合作协议开发的所有28个美国血浆采集中心。与Immunotek的合作现已终止(尽管根据过渡服务协议,Immunotek将继续管理Group 4中心至2025年4月30日),并且GBNA不再是合资公司Biotek America LLC的一方。
Grifols应用了分阶段进行的企业合并的要求。然而,考虑到与共同经营有关的所有资产和负债已在综合财务报表中确认,已支付的代价与资产和负债的公允价值之间的差额,与其账面值并无差异,已于收购日期确认为临时商誉。
截至收购日,企业合并成本和中期商誉合计详情如下:
|
千欧元 |
|
千美元 |
|
考虑 |
268,457 |
281,316 |
||
预付款项 |
(133,601) |
(140,000) |
||
净对价 |
134,856 |
141,316 |
||
被收购净资产的阶梯式增长1 |
— |
— |
||
商誉 |
268,457 |
281,316 |
||
收购带来的调整2 |
(23,064) |
(24,169) |
||
商誉,调整后净额 |
245,393 |
257,147 |
1由于公允价值和账面值没有明显差异,因此没有资产净值的阶梯式上升。此外,该净资产此前已在合并财务报表中确认为共同经营的一部分。
2收购导致的调整主要对应于消除筒仓与Immunotek保持的应付净余额。净额指根据合同条款分配给Immunotek的筒仓的累计损失(见附注10)。
F-130
由此产生的商誉已分配给生物制药部门,包括捐助者数据库、许可证和劳动力。
最后,在2025年2月3日,Immunotek发布了Grifols Shared Services North America,Inc.(由Grifols集团全资拥有和管理的子公司)于2023年6月授予Immunotek的五项担保中的三项,用于与不受Biotek America LLC旗下合作影响的某些Immunotek血浆采集中心相关的租赁合同。其余两项担保,总额约为2000万美元,仍然有效,预计只要租赁协议仍然有效,以及在相关租赁期限减少时正在减少的余额。
多币种循环信贷工具(RCF)
2025年2月21日,银行签署了总额为7450万美元的进一步承诺,将多币种循环信贷融资(RCF)增加到13.53亿美元,直至2025年11月,并从该日起增加到9.38亿美元,直至2027年5月到期。扩大RCF部分的规模预计将于2025年2月27日或前后生效。
向Biotest AG股东公开摘牌收购要约
3月31日,董事会一致批准其全资子公司Grifols Biotest Holdings GmbH向Biotest AG(“Biotest”)的股东提交公开摘牌收购要约。因此,Grifols Biotest Holdings GmbH当天宣布,决定通过公开摘牌购买要约的方式购买Biotest的所有无面值无记名普通股和Biotest的所有无投票权无记名优先股,并打算提供每股普通股43.00欧元和每股优先股30.00欧元的报价。此外,Grifols和Biotest同意,不迟于接受退市要约的截止日期到期前十个工作日,他们将申请取消Biotest股票在法兰克福证券交易所的交易许可。
退市要约的条款和条件将在要约文件(“要约文件”)中传达,该文件将由Grifols准备,并在未来几周内由德国联邦金融监管机构Bundesanstalt f ü r Finanzdienstleistungsaufsicht(BaFin)进行审查。
F-131
收购/ |
31/12/2024 |
31/12/2023 |
31/12/2022 |
|
|||||||||||||||||
已注册 |
注册成立 |
%股 |
%股 |
%股 |
|
||||||||||||||||
姓名 |
|
办公室 |
|
日期 |
|
活动 |
|
法定活动 |
|
直接 |
|
间接 |
|
直接 |
|
间接 |
|
直接 |
|
间接 |
|
完全合并的公司 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
诊断型GRIFOLS, S.A. |
|
Pol í gono Levante |
|
1987 |
|
工业 |
|
诊断设备、仪器、试剂的开发、制造。 |
|
— |
% |
55.000 |
% |
— |
% |
66.790 |
% |
— |
% |
66.790 |
% |
Instituto GRIFOLS, S.A. |
|
Pol í gono Levante |
|
1987 |
|
工业 |
|
血浆分馏及血液衍生物医药产品制造。 |
|
99.998 |
% |
0.002 |
% |
99.998 |
% |
0.002 |
% |
99.998 |
% |
0.002 |
% |
Laboratorios GRIFOLS, S.A. |
|
Pol í gono Levante |
|
1989 |
|
工业 |
|
生产玻璃和塑料包装的肠外溶液、肠外和肠内营养产品 |
|
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
Biomat,S.A。 |
|
Pol í gono Levante |
|
1991 |
|
工业 |
|
Instituto GRIFOLS, S.A.所用血浆质量分析与认证它还为输血中心提供血浆病毒灭活服务(I.P.T.H)。 |
|
99.900 |
% |
0.100 |
% |
99.900 |
% |
0.100 |
% |
99.900 |
% |
0.100 |
% |
Grifols Engineering,S.A。 |
|
Pol í gono Levante |
|
2000 |
|
工业 |
|
设计和开发集团的制造装置以及在这些场所使用的部分设备和机械。该公司还向外部公司提供工程服务。 |
|
99.950 |
% |
0.050 |
% |
99.950 |
% |
0.050 |
% |
99.950 |
% |
0.050 |
% |
Biomat USA,Inc。 |
|
利利维尔大道2410号 |
|
2002 |
|
工业 |
|
采购人体血浆。 |
|
— |
% |
78.750 |
% |
— |
% |
77.500 |
% |
— |
% |
76.250 |
% |
Grifols Biologicals,LLC。 |
|
山谷大道5555号 |
|
2003 |
|
工业 |
|
等离子体分馏和血红素衍生物的生产。 |
|
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
Grifols Australia Pty Ltd。 |
|
5/80号机组费正清 |
|
2009 |
|
工业 |
|
医药产品的分销及试剂的开发和制造 |
|
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
Medion Grifols诊断股份公司 |
|
BonnStrasse,9 |
|
2009 |
|
工业 |
|
生物技术和诊断领域的开发和制造活动。 |
|
— |
% |
55.000 |
% |
— |
% |
66.790 |
% |
— |
% |
66.790 |
% |
Grifols Therapeutics,LLC。 |
|
4101研究常识 |
|
2011 |
|
工业 |
|
等离子体分馏和血红素衍生物的生产。 |
|
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
F-132
Grifols Worldwide Operations Limited |
|
农庄城堡商业园, |
|
2012 |
|
工业 |
|
医药产品的包装、标签、储存、分销、制造及开发 |
|
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
Progenika Biopharma,S.A。 |
|
Parque Tecnol ó gico de Vizcaya, |
|
2013 |
|
工业 |
|
生物技术解决方案的开发、生产和商业化。 |
|
99.990 |
% |
0.010 |
% |
99.990 |
% |
0.010 |
% |
99.990 |
% |
0.010 |
% |
Grifols诊断解决方案公司。 |
|
霍顿街4560号 |
|
2013 |
|
工业 |
|
制造及销售血液检测产品 |
|
— |
% |
55.000 |
% |
11.790 |
% |
55.000 |
% |
11.790 |
% |
55.000 |
% |
Grifols Worldwide Operations USA Inc。 |
|
13111 Temple Avenue,City of |
|
2014 |
|
工业 |
|
生物制品制造、仓储、后勤保障。 |
|
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
Grifols亚太私人有限公司 |
|
乌节路501号n º 20-01 |
|
2003 |
|
商业 |
|
分销及销售医疗及医药产品。 |
|
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
Grifols Movaco,S.A。 |
|
Pol í gono Levante |
|
1987 |
|
商业 |
|
分销和销售试剂、化学产品和其他医药专业,以及供实验室和保健中心使用的医疗和外科材料、设备和仪器。 |
|
99.999 |
% |
0.001 |
% |
99.999 |
% |
0.001 |
% |
99.999 |
% |
0.001 |
% |
Grifols Portugal Productos Farmac é uticos e Hospitalares,LDA。 |
|
Rua de Sao Sebastiao,2岁 |
|
1988 |
|
商业 |
|
医药和医院设备和产品的进出口和商业化,特别是Grifols产品。 |
|
0.010 |
% |
99.990 |
% |
0.010 |
% |
99.990 |
% |
0.010 |
% |
99.990 |
% |
Grifols Chile,S.A。 |
|
Avda。Americo Vespucio,2242 |
|
1990 |
|
商业 |
|
发展医药业务,可涉及相关产品的进口、生产、商业化及出口。 |
|
99.000 |
% |
1.000 |
% |
99.000 |
% |
1.000 |
% |
99.000 |
% |
1.000 |
% |
Grifols美国有限责任公司。 |
|
利利维尔大道2410号 |
|
1990 |
|
商业 |
|
公司产品的分销和营销。 |
|
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
Grifols Argentina,S.A。 |
|
Bartolom é Mitre 3690/3790, |
|
1991 |
|
商业 |
|
临床和生物学研究。制备试剂和治疗及饮食产品。其他医药专业的制造和商业化。 |
|
95.010 |
% |
4.990 |
% |
95.010 |
% |
4.990 |
% |
95.010 |
% |
4.990 |
% |
Grifols S.R.O。 |
|
Calle Zitna,2 |
|
1992 |
|
商业 |
|
购买、销售和分销化学药品产品,包括人血浆。 |
|
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
Grifols(Thailand)Ltd |
|
191 Silom综合楼, |
|
2003 |
|
商业 |
|
医药产品进出口、分销。 |
|
— |
% |
48.000 |
% |
— |
% |
48.000 |
% |
— |
% |
48.000 |
% |
Grifols Malaysia Sdn Bhd |
|
18层,花园北 |
|
2003 |
|
商业 |
|
分销及销售医药产品。 |
|
— |
% |
100.000 |
% |
— |
% |
49.000 |
% |
— |
% |
49.000 |
% |
F-133
59200吉隆坡 |
|||||||||||||||||||||
Grifols International,S.A。 |
|
Pol í gono Levante |
|
1997 |
|
商业 |
|
协调集团所有子公司的营销、销售和物流在其他 |
|
99.998 |
% |
0.002 |
% |
99.998 |
% |
0.002 |
% |
99.998 |
% |
0.002 |
% |
Grifols Italia S.P.A |
|
Via Carducci,62d |
|
1997 |
|
商业 |
|
化学制药产品的采购、销售及分销。 |
|
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
Grifols英国有限公司。 |
|
Gregory Rowcliffe & Milners,1 Bedford Row,伦敦WC1R 4BZ英国 |
|
1997 |
|
商业 |
|
分销及销售治疗及其他医药产品,特别是血红素衍生物。 |
|
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
Grifols Brasil,LDA。 |
|
Rua Umuarama,263 Condominio Portal da Serra Vila Perneta CEP 83.325-000 Pinhais Paran á,巴西 |
|
1998 |
|
商业 |
|
实验室、医院用医药、化工产品及医疗外科设备、器械的进出口、配制、经销、销售。 |
|
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
Grifols France,S.A.R.L。 |
|
Arteparc,Rue de la Belle du Canet,B â t。D,Route de la C ô te d'Azur,13590 Meyreuil法国 |
|
1999 |
|
商业 |
|
化学和保健产品的商业化。 |
|
99.990 |
% |
0.010 |
% |
99.990 |
% |
0.010 |
% |
99.990 |
% |
0.010 |
% |
Grifols Polska Sp.z.o.o。 |
|
Grzybowska 87 street00-844波兰华沙 |
|
2003 |
|
商业 |
|
分销及销售医药、化妆品及其他产品。 |
|
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
Grifols M é xico,S.A. de C.V。 |
|
Calle Eugenio Cuzin,n º 909-913 |
|
1993 |
|
商业 |
|
生产、制造、适配、调理、买卖、调试、代理 |
|
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
Grifols Nordic,AB |
|
Sveav ä gen 166 |
|
2010 |
|
商业 |
|
医药产品、医疗器械及前述活动衍生的任何其他资产的研发、生产、营销。 |
|
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
Grifols Colombia,LTDA |
|
卡雷拉7号71 52托雷 |
|
2010 |
|
商业 |
|
销售、商业化和分销药品、药品(包括但不限于血液衍生物)和医院产品、医疗器械、生物医学设备、实验室仪器和诊断用试剂和/或医疗保健软件。 |
|
99.990 |
% |
0.010 |
% |
99.990 |
% |
0.010 |
% |
99.990 |
% |
0.010 |
% |
Grifols Deutschland GmbH |
|
Lyoner Strasse 15,D- |
|
2011 |
|
商业 |
|
采购血浆衍生产品的生产、商业化和分销,以及试剂和化学及医药产品的进出口、分销和销售的官方许可和必要的批准,特别是用于实验室和保健中心 |
|
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
F-134
以及外科和医疗设备和仪器。 |
|||||||||||||||||||||
Grifols加拿大有限公司。 |
|
5060 Spectrum Way,Suite405 |
|
2011 |
|
商业 |
|
分销及销售生物技术产品。 |
|
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
格瑞福斯医药科技(上海)有限公司 |
|
2号塔901-902单元。 |
|
2013 |
|
商业 |
|
医药顾问服务(诊断除外)、技术及后勤顾问 |
|
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
Grifols(HK),Limited |
|
BerKshire House 1505-7单元, |
|
2014 |
|
商业 |
|
分销及销售诊断产品。 |
|
— |
% |
55.000 |
% |
— |
% |
66.790 |
% |
— |
% |
66.790 |
% |
Grifols日本K.K。 |
|
希尔顿广场西办公大楼, |
|
2014 |
|
商业 |
|
医药产品、器械和诊断仪器的研究、开发、进出口和商业化。 |
|
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
Grifols India Healthcare Private Ltd |
|
雷格斯商务中心 |
|
2014 |
|
商业 |
|
分销及销售医药产品。 |
|
99.984 |
% |
0.016 |
% |
99.984 |
% |
0.016 |
% |
99.984 |
% |
0.016 |
% |
Grifols诊断设备台湾有限公司 |
|
复兴北公路367号8楼, |
|
2016 |
|
商业 |
|
分销及销售诊断产品。 |
|
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
Grifols Viajes,S.A。 |
|
Can Guasch,2 |
|
1995 |
|
服务 |
|
专为集团公司服务的旅行社。 |
|
99.900 |
% |
0.100 |
% |
99.900 |
% |
0.100 |
% |
99.900 |
% |
0.100 |
% |
中队再保险定点活动公司 |
|
首都大厦,3rd FL。 |
|
2003 |
|
服务 |
|
集团公司保单再保险。 |
|
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
Grifols Shared Services North America,Inc。 |
|
利利维尔大道2410号 |
|
2011 |
|
服务 |
|
为血浆衍生物的收集、制造、销售和分销及相关的支持服务 |
|
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
Gripdan Invest,S.L(与Grifols S.A.合并) |
|
Avenida Diagonal 477巴塞罗那, |
|
2015 |
|
服务 |
|
工业楼宇租金 |
|
— |
% |
— |
% |
— |
% |
— |
% |
100.000 |
% |
— |
% |
Araclon Biotech,S.L。 |
|
Paseo de Sagasta,172 º |
|
2012 |
|
研究 |
|
用于检测阿尔茨海默氏病的血液诊断试剂盒的创建和商业化以及针对这种疾病的有效免疫疗法(疫苗)的开发。 |
|
— |
% |
75.880 |
% |
— |
% |
75.880 |
% |
— |
% |
75.880 |
% |
Grifols Innovation and New Technologies Limited |
|
农庄城堡商业 |
|
2016 |
|
研究 |
|
生物技术研发 |
|
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
F-135
Kiro Grifols S.L |
Pol í gono Bainuetxe,5,2 º |
2014 |
研究 |
开发机器和设备,以自动化和控制医院流程的关键点,以及医院药房流程。 |
99.700 |
% |
0.300 |
% |
99.700 |
% |
0.300 |
% |
99.700 |
% |
0.300 |
% |
|||||
Chiquito Acquisition Corp.(与Grifols Bio Supplis Inc.合并) |
2711 Centerville Road Suite 400,Wilmington,Delaware,New Castle County,United States |
2017 |
企业 |
从事根据不时修订的《特拉华州一般公司法》(“DGCL”)组织公司的任何合法行为或活动。 |
— |
% |
— |
% |
— |
% |
— |
% |
— |
% |
100.000 |
% |
|||||
Aig ü es Minerals de Vilajuiga,S.A。 |
Carrer SantSebasti à,2,17493 Vilaju ï ga,赫罗纳,西班牙 |
2017 |
工业 |
矿产药水的收集和使用,并获得所有必要的行政特许权,以便最优化和最广泛地使用这些水。 |
99.990 |
% |
0.010 |
% |
99.990 |
% |
0.010 |
% |
99.990 |
% |
0.010 |
% |
|||||
Goetech LLC(d/b/a medkeeper) |
7600 Grandview Avenue,Suite 210,Arvada,CO 80002,美国 |
2018 |
工业 |
医院药房基于网络和移动平台的开发和分发 |
— |
% |
— |
% |
— |
% |
— |
% |
— |
% |
100.000 |
% |
|||||
Grifols Bio Supplies Inc.(Interstate Blood Bank,Inc.之前) |
普莱森维尔路5700号 |
2016 |
工业 |
采购人血浆。 |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
|||||
Haema,GmbH(原Haema,AG) |
LandsteinerStrabe 1,04103莱比锡-德国 |
2018 |
工业 |
采购人血浆。 |
— |
% |
— |
% |
— |
% |
— |
% |
— |
% |
— |
% |
|||||
BPC Plasma,Inc(前身为Biotest Pharma Corp) |
大和路901号,套房 |
2018 |
工业 |
采购人血浆。 |
— |
% |
— |
% |
— |
% |
— |
% |
— |
% |
— |
% |
|||||
Haema Plasma KFT。 |
Bajcsy-Zsilinszky ú t 12., |
2021 |
工业 |
采购人血浆。 |
— |
% |
100.000 |
% |
— |
% |
— |
% |
— |
% |
— |
% |
|||||
Alkahest,Inc。 |
3500南杜邦高速公路, |
2015 |
研究 |
用于治疗衰老认知能力下降和中枢神经系统(CNS)紊乱的新型血浆类产品的开发。 |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
|||||
Plasmavita Healthcare GmbH |
科尔马勒大街22号, |
2018 |
工业 |
采购人血浆。 |
— |
% |
50.000 |
% |
— |
% |
50.000 |
% |
— |
% |
50.000 |
% |
|||||
Plasmavita Healthcare II GmbH |
Garnisongasse 4/12,1090 |
2019 |
工业 |
采购人血浆。 |
— |
% |
50.000 |
% |
— |
% |
50.000 |
% |
— |
% |
50.000 |
% |
|||||
Grifols加拿大 |
2911 Avenue Marie Curie,Arrondissement de Saint-Laurent,Quebec |
2020 |
工业 |
在药剂和药品行业开展业务 |
0.020 |
% |
99.980 |
% |
0.020 |
% |
99.980 |
% |
0.020 |
% |
99.980 |
% |
|||||
Grifols实验室解决方案公司 |
公司信托中心, |
2020 |
服务 |
从事根据《特拉华州一般公司法》可组织公司的任何合法行为或活动 |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
|||||
Grifols韩国株式会社。 |
第302届德黑兰-ro, |
2020 |
商业 |
诊断体外产品及解决方案的进口、出口。 |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
F-136
Grifols Middle East & Africa LLC |
开罗纳斯尔市Al Hay Al Sades Ramses Extension Street NamaaBuilding No.155 5层534号办公室 |
2021 |
服务 |
提供咨询(《资本市场法》第二十七条及其执行条例规定的除外)并开展法律许可的商业活动。 |
99.990 |
% |
0.010 |
% |
99.990 |
% |
0.010 |
% |
99.990 |
% |
0.010 |
% |
|||||
GigaGen公司。 |
卡博特路407号 |
2017 |
工业 |
从事根据一般公司法可组织公司的任何合法行为或活动。 |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
|||||
Grifols Pyrenees Research Center,S.L。 |
C/prat de la creu,68-76,Planta 3 ︱,Edifici Administratiu del Com ú d'Andorra la Vella |
2021 |
工业 |
组成、开发和管理在所有领域的免疫学研发中心的运营,致力于为治疗应用寻找可能的解决方案。 |
— |
% |
100.000 |
% |
— |
% |
80.000 |
% |
— |
% |
80.000 |
% |
|||||
Grifols Bio北美有限责任公司 |
251 Little Falls Drive,Wilmington,New Castle County,19808,Delaware |
2021 |
工业 |
从事该法案或公司可能开展业务的任何司法管辖区的法律允许的任何合法业务。 |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
|||||
Biomat控股有限责任公司 |
2410 Grifols Way,Los Angeles,California,90032,United States。 |
2023 |
服务 |
为Immunotek捐赠中心提供管理和融资服务。 |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
— |
% |
|||||
Biomat Holdco,LLC。 |
251 Little Falls Drive,Wilmington,New Castle County,Delaware,19808 |
2021 |
服务 |
从事根据特拉华州一般公司法可组织公司的任何合法行为或活动。 |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
|||||
Biomat Newco,Corp。 |
251 Little Falls Drive,Wilmington,New Castle County,Delaware,19808 |
2021 |
服务 |
从事根据特拉华州一般公司法可组织公司的任何合法行为或活动。 |
— |
% |
90.000 |
% |
— |
% |
88.600 |
% |
— |
% |
87.100 |
% |
|||||
Grifols Escrow Issuer,S.A.(与GRIFOLS, S.A.合并) |
Parque Empresarial Can Sant Joan,Avda de la Generalitat,152-156,Sant Cugat del Vall è s,08174,巴塞罗那 |
2021 |
服务 |
为公司及业务提供行政、管理及控制服务,以及投资物业,以及为任何被投资实体或集团公司提供顾问服务。 |
— |
% |
— |
% |
— |
% |
— |
% |
100.000 |
% |
— |
% |
|||||
Grifols Canada Plasma,Inc.(前身为Prometic Plasma Resources,Inc.) |
531布尔。大草原城,15号楼 |
2021 |
工业 |
采购人血浆。 |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
|||||
Grifols Canada Plasma – Ontario Inc.(前身为Canada Inc.) |
平均气温2911度。Marie-Curie,蒙特利尔,魁北克,H4S0B7,加拿大 |
2023 |
服务 |
直接或间接通过所属单位对血浆回收中心进行行政管理、经营管控服务。 |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
— |
% |
|||||
Access Biologicals,LLC(与Grifols Bio Supplies,Inc.合并) |
955,Park Center Drive,Vista,加利福尼亚州 92801,美国 |
2017 |
工业 |
制造生物技术和生物制药公司用于诊断领域的体外诊断、细胞培养和研发的特定血清和血浆试剂等生物制品。 |
— |
% |
— |
% |
— |
% |
— |
% |
— |
% |
100.000 |
% |
|||||
F-137
Access Biologicals IC-DISC,Inc.(与Grifols Bio Supplies,Inc.合并) |
995 Park Center Dr,Vista,加利福尼亚州 92081,美国 |
2017 |
工业 |
制造生物制品,包括特定的血清和血浆衍生试剂,生物技术和生物制药公司用于体外诊断、细胞培养以及诊断领域的研发。 |
— |
% |
— |
% |
— |
% |
— |
% |
— |
% |
100.000 |
% |
|||||
Access Cell Culture,LLC。(与Grifols Bio Supplies,Inc.合并) |
995 Park Center Dr,Vista,加利福尼亚州 92081,美国 |
2017 |
工业 |
制造生物制品,包括特定的血清和血浆衍生试剂,生物技术和生物制药公司用于体外诊断、细胞培养以及诊断领域的研发。 |
— |
% |
— |
% |
— |
% |
— |
% |
— |
% |
100.000 |
% |
|||||
Access Plasma,LLC。(与Grifols Bio Supplies,Inc.合并) |
995 Park Center Dr,Vista,加利福尼亚州 92081,美国 |
2017 |
工业 |
制造生物制品,包括特定的血清和血浆衍生试剂,生物技术和生物制药公司用于体外诊断、细胞培养以及诊断领域的研发。 |
— |
% |
— |
% |
— |
% |
— |
% |
— |
% |
100.000 |
% |
|||||
Albimmune,S.L。 |
Parque Empresarial Can Sant Joan,Avda de la Generalitat,152-156,Sant Cugat del Vall è s,08174,Barcelona Espa ñ a |
2022 |
研究 |
公司的宗旨是研究、开发和开发一个关于白蛋白作为药物应用的项目 |
— |
% |
51.000 |
% |
— |
% |
51.000 |
% |
— |
% |
51.000 |
% |
|||||
Biotest,AG |
兰德施泰纳斯特。5、D-63303 Dreieich,德国 |
2022 |
工业 |
开发、制造和分销生物、化学、制药、人类和兽医医疗、化妆品和膳食产品以及用于医疗、制药和分析目的的容器、装置、机器和配件,以及这些领域的研究。此外,在植物保护和植物育种领域、土壤、水和空气的测试和净化领域以及在空间使用的产品、材料和技术领域的活动(特别是研究开发、生产和分销)。 |
24.700 |
% |
45.480 |
% |
24.700 |
% |
45.480 |
% |
24.700 |
% |
45.480 |
% |
|||||
Biotest Austria,GmbH |
Einsiedlergasse 58,A-1050,维也纳,奥地利 |
2022 |
工业 |
医药产品分销。 |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
|||||
Biotest Italia,S.R.L.(与Grifols Italia S.P.A合并) |
Via Leonardo da Vinci 43,I-20090 Trezzano sul Naviglio MI,意大利 |
2022 |
工业 |
医药产品分销。 |
— |
% |
— |
% |
100.000 |
% |
— |
% |
— |
% |
70.180 |
% |
|||||
Biotest(UK)Ltd.(与Grifols UK,Ltd.合并) |
17 High Street,B31 2UQ Longbridge英国伯明翰 |
2022 |
工业 |
医药产品分销。 |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
70.180 |
% |
|||||
Biotest(Schweiz)AG |
Sch ü tzenstrasse 17,CH-5102 Rupperswil,瑞士 |
2022 |
工业 |
医药产品分销。 |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
|||||
Biotest匈牙利KFT |
Torb á gy utca 15/a,T ö r ö kb á lint 2045,匈牙利 |
2022 |
工业 |
采购人血浆。 |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
|||||
Biotest Farmac ê utica LTDA(与Grifols Brasil Ltda.合并) |
Rua José Ramos Guimar ã es,49 A Centro,12955-000,Bom Jesus dos Perd õ es – SP,Brasil |
2022 |
工业 |
医药产品分销。 |
— |
% |
— |
% |
100.000 |
% |
— |
% |
— |
% |
70.180 |
% |
F-138
Biotest Hellas M.E.P.E。 |
45 Michalakopoulou Str.,11528 Athens,Greece |
2022 |
研究 |
生物制药领域解决方案的研发。 |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
|||||
Biotest France SAS(与Grifols France S.A.R.L.合并) |
45/47 rue d'Hauteville,75010 Paris,France |
2022 |
服务 |
公司的宗旨是代理和支持集团公司。 |
— |
% |
— |
% |
100.000 |
% |
— |
% |
— |
% |
70.180 |
% |
|||||
Biotest Pharmaceuticals Ila ç Pazarlama Anonim Sirketi |
Nishstanbul,Coban ç esme Mahallesi,34197 Bah ç eliever,Istanbul,Turkey |
2022 |
研究 |
生物制药领域解决方案的研发。 |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
|||||
Biotest Medical,S.L.U.(与Grifols Movaco,S.A.合并) |
C/Frederic Mompou,n º 5,6 º 3 ︱ A,08960 Sant Just Desvern,西班牙巴塞罗那 |
2022 |
工业 |
医药产品分销。 |
— |
% |
— |
% |
100.000 |
% |
— |
% |
— |
% |
70.180 |
% |
|||||
Biotest Pharma,GmbH |
兰德施泰纳斯特。5、D-63303 Dreieich,德国 |
2022 |
工业 |
开展生物制药区开发生产活动。 |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
|||||
Biotest Lux S. à.r.l。 |
17、Boulevard F.W. Raiffeisen L-2411卢森堡 |
2023 |
服务 |
为Biotest公司提供融资和服务集中化。 |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
— |
% |
— |
% |
|||||
Biotest Grundst ü cksverwaltungs GmbH |
兰德施泰纳斯特。5、D-63303 Dreieich,德国 |
2022 |
服务 |
自有资产管理。 |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
|||||
Plasma Service Europe GmbH |
兰德施泰纳斯特。5、D-63303 Dreieich,德国 |
2022 |
工业 |
采购人血浆。 |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
|||||
Cara Plasma S.R.O。 |
Jungmannova 745/24-Nov é M ě sto,11000 Praha 1,Czech Republic |
2022 |
工业 |
采购人血浆。 |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
|||||
Plazmaszolg á lat KFT |
Torb á gy utca 15/a,T ö r ö kb á lint 2045,匈牙利 |
2022 |
工业 |
采购人血浆。 |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
— |
% |
70.180 |
% |
|||||
Grifols Biotest Holdings GmbH |
Colmarer STR. 22,60528 Frankfurt am Main,Germany |
2022 |
服务 |
管理自有资产以及以公司自己的名义和以自己的名义(不是第三方)收购、出售、持有和管理在德国和国外的其他公司的股份,特别是在注册办事处在Dreiech的Biotest AG。 |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
|||||
AlbaJuna Therapeutics,S.L |
Hospital Germans Trias i Pujol,carretera de canyet,s/n,Badalona,Spain |
2016 |
研究 |
抗HIV治疗性抗体的开发和制造。 |
— |
% |
100.000 |
% |
— |
% |
100.000 |
% |
— |
% |
49.000 |
% |
|||||
权益核算被投资单位及其他 |
|||||||||||||||||||||
MecWins,S.L.(不再关联) |
Avenida Fernandos Casas Novoa,37岁 |
2013 |
研究 |
纳米技术、生物技术和化学解决方案的研究和生产。 |
— |
% |
— |
% |
— |
% |
24.590 |
% |
— |
% |
24.590 |
% |
|||||
Albajuna Therapeutics,S.L(成为集团的一部分) |
德国医院Trias i Pujol,Carretera de Canyet,s/n,Badalona |
2016 |
研究 |
抗HIV治疗性抗体的开发和制造。 |
— |
% |
— |
% |
— |
% |
— |
% |
— |
% |
49.000 |
% |
|||||
Medcom Advance,S.A(已解散) |
AV。罗马,35 Entresuelo1,08018巴塞罗那;西班牙 |
2019 |
研究 |
纳米技术解决方案的研发。 |
— |
% |
— |
% |
— |
% |
45.000 |
% |
— |
% |
45.000 |
% |
|||||
上海RAAS血液制品有限公司(不再关联) |
2009上海市奉贤区望园路 |
2020 |
工业 |
引进先进适用的血液制品制造和诊断技术、仪器和科学管理系统,以提高产能、增强 |
— |
% |
— |
% |
26.200 |
% |
— |
% |
26.580 |
% |
— |
% |
F-139
血液制品质量标准达到国际水平。 |
|||||||||||||||||||||
Grifols Egypt for Plasma Derivatives(S.A.E.) |
Tolip El Narges酒店,Teseen Streett,第五定居点,开罗 |
2021 |
工业 |
建立并运营等离子体分馏厂,无论血浆是本地采集还是进口,以及其灌装和包装。 |
49.000 |
% |
— |
% |
49.000 |
% |
— |
% |
49.000 |
% |
— |
% |
|||||
Biotek America LLC(“ITK合资公司”) |
1430 East Southlake Blvd Suite 200 Southlake TX 76092 Estados Unidos |
2021 |
工业 |
建设和管理,直到美国开放供体血浆中心。 |
— |
% |
75.000 |
% |
— |
% |
75.000 |
% |
— |
% |
75.000 |
% |
|||||
BioDarou PLC |
Felestin Ave,1416653163德黑兰,伊朗 |
2022 |
工业 |
采购人血浆。 |
— |
% |
34.388 |
% |
— |
% |
34.388 |
% |
— |
% |
34.388 |
% |
本附录为综合财务报表附注2的一部分。
F-140
附录二
GRIFOLS,S.A.和子公司
截至2024年、2023年及2022年12月31日止年度的经营分部
(以千欧元表示)
生物制药 |
诊断 |
生物用品 |
其他 |
各部门间 |
合并 |
|||||||||||||||||||||||||||||||
|
2024 |
|
2023(*) |
|
2022 (*) |
2024 |
|
2023(*) |
|
2022(*) |
|
2024 |
|
2023(*) |
|
2022(*) |
|
2024 |
|
2023(*) |
|
2022(*) |
|
2024 |
|
2023(*) |
|
2022(*) |
2024 |
|
2023(*) |
|
2022(*) |
|||
来自外部客户的收入 |
|
6,142,588 |
|
5,558,301 |
|
5,005,382 |
644,898 |
|
670,269 |
|
671,292 |
|
215,664 |
|
159,957 |
|
146,076 |
|
209,232 |
|
203,450 |
|
250,165 |
|
— |
|
— |
|
(8,948) |
7,212,382 |
|
6,591,977 |
|
6,063,967 |
||
|
||||||||||||||||||||||||||||||||||||
营业总收入 |
|
6,142,588 |
|
5,558,301 |
|
5,005,382 |
644,898 |
|
670,269 |
|
671,292 |
|
215,664 |
159,957 |
146,076 |
209,232 |
203,450 |
250,165 |
— |
— |
(8,948) |
7,212,382 |
|
6,591,977 |
|
6,063,967 |
||||||||||
分部盈利/(亏损) |
|
1,271,194 |
|
886,978 |
|
768,095 |
108,829 |
|
111,694 |
|
129,968 |
|
47,793 |
43,563 |
114,397 |
39,435 |
6,632 |
(46,809) |
— |
6,979 |
35,419 |
1,467,251 |
|
1,055,846 |
|
1,001,070 |
||||||||||
未分配费用 |
|
|
|
|
|
|
|
|
|
|
|
|
(275,236) |
|
(273,529) |
|
(218,634) |
|||||||||||||||||||
营业利润/(亏损) |
|
|
|
|
|
|
|
|
|
|
|
|
1,192,015 |
|
782,317 |
|
782,436 |
|||||||||||||||||||
财务结果 |
|
|
|
|
|
|
|
|
|
|
|
|
(748,019) |
|
(574,374) |
|
(442,941) |
|||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||
应占权益入账被投资单位的利润/(亏损) |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
(922) |
(1,482) |
— |
— |
— |
— |
(922) |
(1,482) |
||||||||||||||||||
所得税费用 |
|
|
|
|
|
|
|
|
|
|
|
|
(231,190) |
|
(43,349) |
|
(90,111) |
|||||||||||||||||||
税后年度利润 |
|
|
|
|
|
|
|
|
|
|
|
|
212,806 |
|
163,672 |
|
247,902 |
|||||||||||||||||||
分部资产 |
|
14,232,889 |
|
13,419,636 |
|
13,464,608 |
3,754,840 |
|
3,528,861 |
|
3,681,632 |
|
348,789 |
380,012 |
341,876 |
889,606 |
1,840,949 |
766,139 |
— |
— |
(6,997) |
19,226,124 |
|
19,169,458 |
|
18,247,258 |
||||||||||
权益核算投资 |
|
68,996 |
|
57,529 |
|
41,162 |
— |
|
— |
|
— |
|
— |
— |
— |
— |
364,234 |
1,456,797 |
— |
— |
— |
68,996 |
|
421,763 |
|
1,497,959 |
||||||||||
未分配资产 |
|
— |
|
— |
|
— |
— |
|
— |
|
— |
|
— |
— |
— |
— |
— |
— |
— |
— |
— |
2,110,121 |
|
1,400,882 |
|
1,484,367 |
||||||||||
总资产 |
|
|
|
|
|
|
|
|
|
|
|
|
21,405,241 |
|
20,992,103 |
|
21,229,584 |
|||||||||||||||||||
分部负债 |
|
2,323,789 |
2,459,786 |
2,494,213 |
522,822 |
466,953 |
425,693 |
|
81,813 |
79,678 |
43,264 |
514,414 |
97,840 |
222,565 |
— |
— |
— |
3,442,838 |
|
3,104,257 |
|
3,185,735 |
||||||||||||||
未分配负债 |
|
— |
— |
— |
— |
— |
— |
|
— |
— |
— |
— |
— |
— |
— |
— |
— |
9,355,378 |
|
10,374,151 |
|
10,067,720 |
||||||||||||||
负债总额 |
|
|
|
|
|
|
|
|
|
|
|
|
12,798,216 |
|
13,478,408 |
|
13,253,455 |
|||||||||||||||||||
其他信息: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
分配的摊销和折旧 |
|
327,743 |
|
333,103 |
|
297,272 |
64,522 |
|
65,817 |
|
64,682 |
|
9,305 |
9,280 |
5,759 |
15,696 |
16,162 |
20,367 |
— |
— |
— |
417,266 |
|
424,362 |
|
388,080 |
||||||||||
未分配摊销和折旧 |
|
— |
|
— |
|
— |
— |
|
— |
|
— |
|
— |
— |
— |
— |
— |
— |
— |
— |
— |
20,630 |
|
22,060 |
|
22,900 |
||||||||||
不需要现金支付的分摊费用 |
|
(5,143) |
|
30,198 |
|
(71,964) |
4,613 |
|
6,995 |
|
13,639 |
|
105 |
136 |
120 |
(8,208) |
(789) |
(206) |
— |
— |
— |
(8,633) |
|
36,540 |
|
(58,411) |
||||||||||
不需要现金的未分配费用 |
|
— |
|
— |
|
— |
— |
|
— |
|
— |
|
— |
— |
— |
— |
— |
— |
— |
— |
— |
(4,310) |
|
548 |
|
(10,770) |
||||||||||
物业、厂房年度分配增加额& |
|
373,380 |
|
359,442 |
|
507,457 |
54,575 |
|
29,107 |
|
49,890 |
|
2,128 |
9,066 |
98 |
7,619 |
3,884 |
30,192 |
— |
— |
— |
437,702 |
|
401,499 |
|
587,637 |
||||||||||
物业、厂房年度未分配增加额 |
|
— |
|
— |
|
— |
— |
|
— |
|
— |
|
— |
— |
— |
— |
— |
— |
— |
— |
— |
40,488 |
|
48,618 |
|
59,866 |
||||||||||
(*)重报数字(附注2.d)
本附录构成综合财务报表附注5的组成部分。
F-141
附录二
GRIFOLS,S.A.和子公司
截至2024年、2023年及2022年12月31日止年度的经营分部
(以千欧元表示)
西班牙 |
欧盟其他地区 |
美国+加拿大 |
世界其他地区 |
合并 |
||||||||||||||||||||||||||
|
2024 |
|
2023(*) |
|
2022(*) |
|
2024 |
|
2023(*) |
|
2022(*) |
|
2024 |
|
2023(*) |
|
2022(*) |
|
2024 |
|
2023(*) |
|
2022(*) |
|
2024 |
|
2023(*) |
|
2022(*) |
|
净收入 |
|
423,080 |
|
362,877 |
|
320,631 |
|
1,118,258 |
|
893,050 |
|
711,579 |
|
4,087,030 |
|
3,898,961 |
|
3,855,607 |
|
1,584,014 |
|
1,437,089 |
|
1,176,150 |
|
7,212,382 |
|
6,591,977 |
|
6,063,967 |
按地理区域划分的资产 |
|
1,635,463 |
|
1,190,606 |
|
1,156,068 |
|
7,584,295 |
|
7,055,181 |
|
6,600,264 |
|
11,789,971 |
|
10,966,924 |
|
11,713,893 |
|
395,512 |
|
1,779,392 |
|
1,759,359 |
|
21,405,241 |
|
20,992,103 |
|
21,229,584 |
其他信息: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
物业、厂房及设备、无形资产及使用权年度新增 |
|
56,796 |
|
53,216 |
|
60,503 |
|
155,534 |
170,763 |
|
107,030 |
|
255,575 |
|
214,227 |
|
467,819 |
|
10,285 |
|
11,911 |
|
12,151 |
|
478,190 |
|
450,117 |
|
647,503 |
|
(*)重报数字(附注2.d)
本附录构成综合财务报表附注5的组成部分。
F-142
附录三
GRIFOLS,S.A.和子公司
截至2024年、2023年及2022年12月31日止年度其他无形资产变动
(以千欧元表示)
余额 |
|
|
|
翻译 |
余额 |
|||||||
|
31/12/2023 |
|
新增 |
|
转让 |
|
处置 |
|
差异 |
|
31/12/2024 |
|
开发成本 |
|
1,853,483 |
|
102,092 |
|
— |
|
(2,472) |
|
49,866 |
|
2,002,969 |
优惠、专利、授权品牌&类似 |
|
284,736 |
|
1,288 |
|
1,852 |
|
(814) |
|
15,911 |
|
302,973 |
计算机软件 |
|
359,837 |
|
25,915 |
|
4,883 |
|
(1,755) |
|
12,432 |
|
401,312 |
目前已上市产品 |
|
1,389,248 |
|
— |
|
— |
|
— |
|
74,095 |
|
1,463,343 |
其他无形资产 |
|
117,172 |
|
9,534 |
|
(1,521) |
|
(3,012) |
|
4,953 |
|
127,126 |
无形资产总成本 |
|
4,004,476 |
|
138,829 |
|
5,214 |
|
(8,053) |
|
157,257 |
|
4,297,723 |
开发成本的累计额。摊销额。 |
|
(228,832) |
|
(32,582) |
|
— |
|
2,472 |
|
(7,449) |
|
(266,391) |
累计。特许权、专利、许可、br。 |
|
(91,496) |
|
(16,154) |
|
— |
|
815 |
|
(4,529) |
|
(111,364) |
Accum.amort.of cumputer软件 |
|
(251,438) |
|
(34,455) |
|
— |
|
467 |
|
(8,713) |
|
(294,139) |
目前已上市产品的累计额。摊销。 |
|
(499,347) |
|
(49,262) |
|
— |
|
— |
|
(31,454) |
|
(580,063) |
其他无形资产的累计额。摊销额。 |
|
(100,108) |
|
(1,225) |
|
— |
|
— |
|
(5,450) |
|
(106,783) |
合计accum.amort无形资产 |
|
(1,171,221) |
|
(133,678) |
|
— |
|
3,754 |
|
(57,595) |
|
(1,358,740) |
其他无形资产减值 |
|
(1,059) |
|
(10,113) |
|
(1,794) |
|
140 |
|
(25) |
|
(12,851) |
无形资产账面价值 |
|
2,832,196 |
|
(4,962) |
|
3,420 |
|
(4,159) |
|
99,637 |
|
2,926,132 |
本附录构成合并财务报表附注7的组成部分。
F-143
附录三
GRIFOLS,S.A.和子公司
截至2024年、2023年及2022年12月31日止年度其他无形资产变动
(以千欧元表示)
余额 |
|
翻译 |
|
余额 |
||||||||
|
31/12/2022 |
|
新增 |
转让 |
处置 |
差异 |
31/12/2023 |
|||||
开发成本 |
|
1,822,085 |
|
58,573 |
— |
|
— |
|
(27,175) |
|
1,853,483 |
|
优惠、专利、授权品牌&类似 |
|
292,158 |
|
2,747 |
(344) |
|
(1,478) |
|
(8,347) |
|
284,736 |
|
计算机软件 |
|
340,991 |
|
22,174 |
3,684 |
|
(117) |
|
(6,895) |
|
359,837 |
|
目前已上市产品 |
|
1,431,174 |
|
— |
— |
|
— |
|
(41,926) |
|
1,389,248 |
|
其他无形资产 |
|
117,485 |
|
2,388 |
(157) |
|
(678) |
|
(1,866) |
|
117,172 |
|
无形资产总成本 |
|
4,003,893 |
|
85,882 |
3,183 |
|
(2,273) |
|
(86,209) |
|
4,004,476 |
|
开发成本的累计额。摊销额。 |
|
(199,444) |
|
(32,694) |
— |
|
— |
|
3,306 |
|
(228,832) |
|
累计。特许权、专利、许可、br。 |
|
(77,331) |
|
(16,274) |
363 |
|
192 |
|
1,554 |
|
(91,496) |
|
Accum.amort.of cumputer软件 |
|
(220,305) |
|
(34,366) |
(1,294) |
|
104 |
|
4,423 |
|
(251,438) |
|
目前已上市产品的累计额。摊销。 |
|
(464,094) |
|
(51,484) |
— |
|
— |
|
16,231 |
|
(499,347) |
|
其他无形资产的累计额。摊销额。 |
|
(91,489) |
|
(12,391) |
— |
|
678 |
|
3,094 |
|
(100,108) |
|
合计accum.amort无形资产 |
|
(1,052,663) |
|
(147,209) |
(931) |
|
974 |
|
28,608 |
|
(1,171,221) |
|
其他无形资产减值 |
|
(2,083) |
|
(421) |
— |
|
1,438 |
|
7 |
|
(1,059) |
|
无形资产账面价值 |
|
2,949,147 |
|
(61,748) |
2,252 |
|
139 |
|
(57,594) |
|
2,832,196 |
本附录构成合并财务报表附注7的组成部分。
F-144
附录四
GRIFOLS,S.A.和子公司
截至2024年12月31日止年度的使用权变动
(以千欧元表示)
余额 |
|
|
|
翻译 |
余额 |
|||||||
|
31/12/2023 |
|
新增 |
|
转让 |
|
处置 |
|
差异 |
|
31/12/2024 |
|
土地和建筑物 |
|
1,216,059 |
|
71,698 |
505 |
|
(21,369) |
|
58,094 |
|
1,324,987 |
|
机械 |
|
7,693 |
|
854 |
(120) |
|
(167) |
|
365 |
|
8,625 |
|
电脑设备 |
|
4,221 |
|
852 |
— |
|
(745) |
|
199 |
|
4,527 |
|
车辆 |
|
22,216 |
|
5,646 |
— |
|
(3,100) |
|
555 |
|
25,317 |
|
|
|
|
|
|
||||||||
使用权总成本 |
1,250,189 |
79,050 |
385 |
(25,381) |
59,213 |
1,363,456 |
||||||
土地和建筑物的累积跌幅 |
|
(282,755) |
|
(74,929) |
(505) |
|
5,206 |
|
(15,387) |
|
(368,370) |
|
机械的accum.depr。 |
|
(3,975) |
|
(1,522) |
120 |
|
164 |
|
(239) |
|
(5,452) |
|
计算机设备的Accum. Depr。 |
(3,457) |
(559) |
— |
710 |
(189) |
(3,495) |
||||||
车辆的累计降速 |
|
(14,762) |
|
(5,106) |
— |
|
2,498 |
|
(465) |
|
(17,835) |
|
|
|
|
|
|
||||||||
总accum。使用权的Depr。 |
|
(304,949) |
|
(82,116) |
(385) |
|
8,578 |
|
(16,280) |
|
(395,152) |
|
使用权账面金额 |
|
945,240 |
|
(3,066) |
— |
|
(16,803) |
|
42,933 |
|
968,304 |
本附录构成合并财务报表附注8的组成部分。
F-145
附录四
GRIFOLS,S.A.和子公司
截至2024年12月31日止年度的使用权变动
(以千欧元表示)
余额 |
|
翻译 |
余额 |
|||||||||
|
31/12/2022 (*) |
|
新增 |
转让 |
|
处置 |
|
差异 |
|
31/12/2023 (*) |
||
土地和建筑物 |
|
1,198,363 |
|
94,699 |
(1,957) |
(41,103) |
|
(33,943) |
|
1,216,059 |
||
机械 |
|
6,664 |
|
2,871 |
(1,008) |
(658) |
|
(176) |
|
7,693 |
||
电脑设备 |
|
6,819 |
|
597 |
(2,484) |
(604) |
|
(107) |
|
4,221 |
||
车辆 |
|
20,958 |
|
4,737 |
(79) |
(3,191) |
|
(209) |
|
22,216 |
||
|
|
|
|
|||||||||
使用权总成本 |
1,232,804 |
102,904 |
(5,528) |
(45,556) |
(34,435) |
1,250,189 |
||||||
土地和建筑物的累积跌幅 |
|
(229,605) |
|
(71,157) |
1,957 |
8,830 |
|
7,220 |
|
(282,755) |
||
机械的accum.depr。 |
|
(3,647) |
|
(1,507) |
523 |
590 |
|
66 |
|
(3,975) |
||
计算机设备的Accum. Depr。 |
(5,793) |
(860) |
2,516 |
580 |
100 |
(3,457) |
||||||
车辆的累计降速 |
|
(12,499) |
|
(5,019) |
45 |
2,506 |
|
205 |
|
(14,762) |
||
|
|
|
|
|||||||||
总accum。使用权的Depr。 |
|
(251,544) |
|
(78,543) |
5,041 |
12,506 |
|
7,591 |
|
(304,949) |
||
使用权账面金额 |
|
981,260 |
|
24,361 |
(487) |
(33,050) |
|
(26,844) |
|
945,240 |
(*)重报数字(附注2.d)
本附录构成合并财务报表附注8的组成部分。
F-146
附录五
GRIFOLS,S.A.和子公司
截至2024年、2023年及2022年12月31日止年度物业、厂房及设备变动
(以千欧元表示)
余额 |
翻译 |
余额 |
||||||||||
31/12/2023 |
新增 |
转让 |
处置 |
差异 |
31/12/2024 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
成本: |
|
|
|
|
|
|
|
|
|
|
|
|
土地和建筑物 |
|
1,131,912 |
|
379 |
|
56,480 |
|
(4,453) |
|
46,289 |
|
1,230,607 |
厂房及机器 |
|
3,175,459 |
|
66,772 |
|
263,393 |
|
(78,230) |
|
127,055 |
|
3,554,449 |
在建固定资产 |
|
910,670 |
|
193,159 |
|
(323,173) |
|
— |
|
21,657 |
|
802,313 |
|
5,218,041 |
|
260,310 |
|
(3,300) |
|
(82,683) |
|
195,001 |
|
5,587,369 |
|
累计折旧: |
|
|
|
|
|
|
|
|
|
|
|
|
建筑物 |
|
(206,375) |
|
(31,505) |
|
57 |
|
1,481 |
|
(9,807) |
|
(246,149) |
厂房及机器 |
|
(1,757,723) |
|
(190,599) |
|
(177) |
|
31,039 |
|
(74,857) |
|
(1,992,317) |
|
(1,964,098) |
|
(222,104) |
|
(120) |
|
32,520 |
|
(84,664) |
|
(2,238,466) |
|
其他物业、厂房及设备减值 |
(6,820) |
|
(1,370) |
|
— |
|
1,120 |
|
13 |
|
(7,057) |
|
账面金额 |
|
3,247,123 |
|
36,836 |
|
(3,420) |
|
(49,043) |
|
110,350 |
|
3,341,846 |
本附录构成合并财务报表的组成部分。
F-147
附录五
GRIFOLS,S.A.和子公司
截至2024年、2023年及2022年12月31日止年度物业、厂房及设备变动
(以千欧元表示)
余额 |
商业 |
翻译 |
余额 |
|||||||||||
|
31/12/2022 (*) |
|
新增 |
|
组合 |
|
转让 |
|
处置 |
|
差异 |
|
31/12/2023 (*) |
|
成本: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
土地和建筑物 |
|
1,155,406 |
|
6,046 |
|
— |
|
342 |
|
(4,953) |
|
(24,929) |
|
1,131,912 |
厂房及机器 |
|
3,103,209 |
|
72,241 |
|
480 |
|
125,507 |
|
(58,245) |
|
(67,733) |
|
3,175,459 |
在建固定资产 |
|
879,542 |
|
183,044 |
|
— |
|
(125,460) |
|
(1,646) |
|
(24,810) |
|
910,670 |
|
5,138,157 |
|
261,331 |
|
480 |
|
389 |
|
(64,844) |
|
(117,472) |
|
5,218,041 |
|
累计折旧: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
建筑物 |
|
(181,337) |
|
(32,309) |
|
— |
|
181 |
|
1,954 |
|
5,136 |
|
(206,375) |
厂房及机器 |
|
(1,641,398) |
|
(188,361) |
|
(383) |
|
(2,336) |
|
34,705 |
|
40,050 |
|
(1,757,723) |
|
(1,822,735) |
|
(220,670) |
|
(383) |
|
(2,155) |
|
36,659 |
|
45,186 |
|
(1,964,098) |
|
其他物业、厂房及设备减值 |
(12,564) |
|
(1,173) |
|
— |
|
— |
|
6,767 |
|
150 |
|
(6,820) |
|
账面金额 |
|
3,302,858 |
|
39,488 |
|
97 |
|
(1,766) |
|
(21,418) |
|
(72,136) |
|
3,247,123 |
|
|
|
(见注3) |
(*)重报数字(附注2.d)
本附录构成合并财务报表的组成部分。
F-148