
Arcellx提供2025年第二季度财务业绩和业务亮点
--在RRMM患者anito-cel的2期关键iMMagine-1研究中,提供了2025年5月1日数据截止日期的所有117名患者的初步数据,中位随访时间为12.6个月--
--中位随访12.6个月时,ORR为97%,CR/SCR为68%;6个月、12个月和18个月时的PFS发生率分别为92%、79%和66%--
--未出现延迟性神经毒性包括无帕金森症、无脑神经麻痹、无格林-巴利综合征,未观察到免疫介导的小肠结肠炎--
--获得FDA批准ACLX-004利用公司ARC-SparX平台靶向CD33和CD123的IND申请--
--本季度末持有5.38亿美元现金,预计将为2028年的运营提供资金--
加利福尼亚州红木城2025年8月7日电(BUSINESS WIRE)--Arcellx, Inc.(NASDAQ:ACLX)是一家生物技术公司,通过为患有癌症和其他无法治愈的疾病的患者开发创新的免疫疗法来重新构想细胞疗法,该公司今天公布了截至2025年6月30日的第二季度业务亮点和财务业绩。
Arcellx董事长兼首席执行官Rami Elghandour表示:“注册性iMMagine-1研究中登记的所有117名患者提供的数据继续证明,anito-cel具有成为多发性骨髓瘤患者改变生活疗法的潜力。”“与Kite的合作伙伴一起,我们正计划执行我们预期的2026年商业发布,目标是确保尽可能多的患者能够尽快受益。为此,我们预计将在上市的第一年内在美国超过160家授权治疗中心推出,并拥有充足的供应以满足医生的期望。我们致力于通过确保与作为细胞疗法领导者的Kite合作伙伴一起提供一流的支持和运营执行,从而发挥anito-cel的潜力。我们感谢参与我们多发性骨髓瘤anito-cel计划的患者、护理人员和医生,为我们提供了一个机会,将这种疗法推广到更多有需要的患者。我们期待在今年晚些时候分享iMMagine-1研究的长期数据。此外,令人兴奋的是,我们与美国食品和药物管理局进行了接触,并比预期更早地批准了我们下一个利用我们的ARC-SparX平台针对CD33和CD123的AML临床项目的IND。”
近期业务进展
在EHA2025上为anito-cel在复发或难治性多发性骨髓瘤(RRMM)患者中的2期关键iMMagine-1研究提供了积极的初步数据。2期iMMagine-1数据来自于2025年5月1日的数据截止日期,包括所有117名患者,中位随访时间为12.6个月,在用anito-cel治疗后最少随访时间为4个月。所有患者均接受单次anito-cel输注(目标剂量115 × 106CAR +活体T细胞)。117例患者中100例(85%)为三联难治,117例患者中47例(40%)为五联难治。患者接受过三种既往治疗的中位数,117名患者中有60名(51%)接受过三种既往治疗。
总体应答率(ORR)为97%(114/117),完全应答/严格完全应答(CR/SCR)率为68%(79/117),非常好的部分应答或更高(> VGPR)率为85%(100/117),根据国际骨髓瘤工作组(IMWG)标准作为研究者评估。在本次数据削减时可评估的最小残留病(MRD)检测中,93.3%(70/75)在最低10-5灵敏度下实现了MRD阴性。6个月、12个月、18个月无进展生存期(PFS)率分别为92%、79%和66%,6个月、12个月、18个月总生存期(OS)率分别为97%、95%和90%。中值PFS和中值OS均未达到。
未观察到延迟性或非免疫效应细胞相关神经毒性综合征(ICANS)的神经毒性,包括无帕金森症、无脑神经麻痹和无Guillain-Barr é综合征,且未观察到免疫介导的小肠结肠炎与anito-cel。自上一次于2024年12月提交数据以来,没有发生与治疗或治疗相关的死亡或≥ 3级细胞因子释放综合征(CRS)或ICANS事件。
利用公司ARC-SparX平台的ACLX-004靶向CD33和CD123的研究性新药申请获得药监局批准。
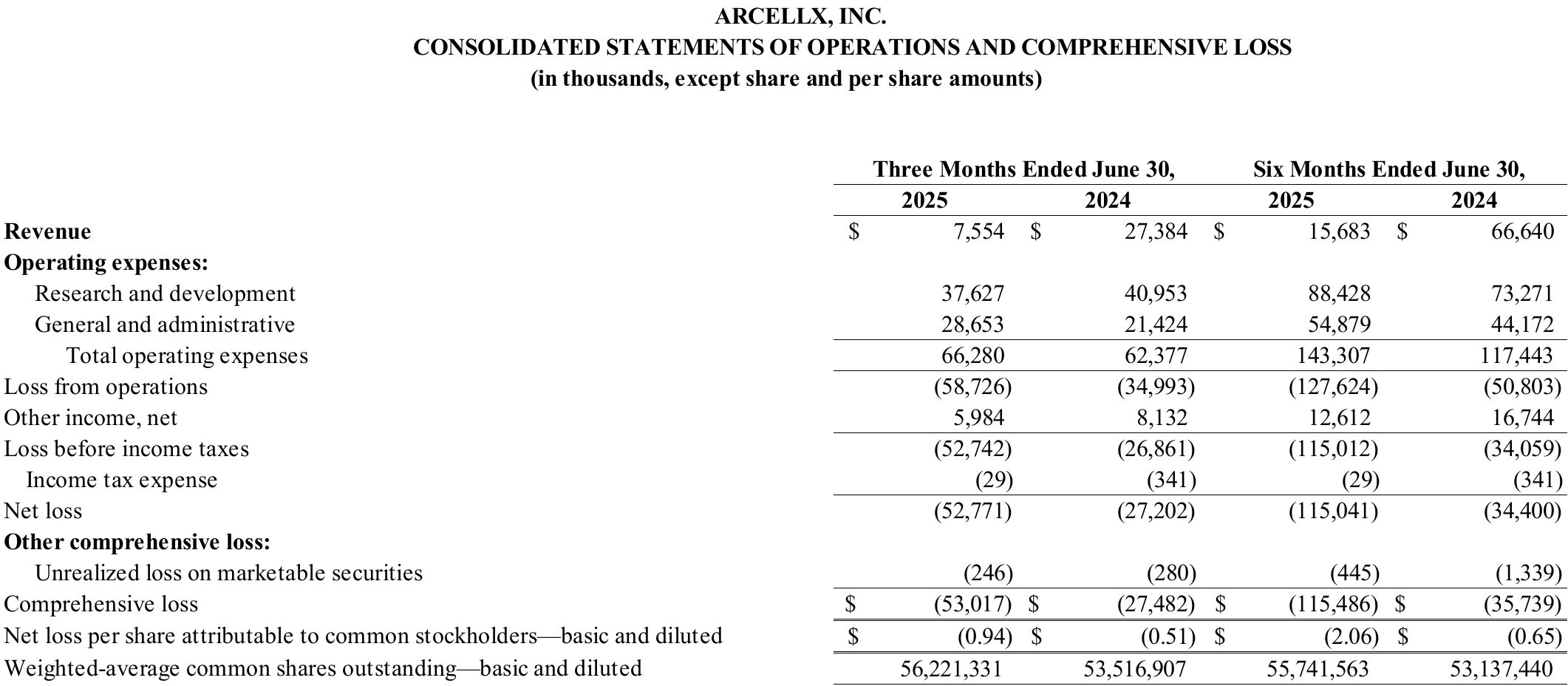
2025年第二季度财务摘要
现金、现金等价物、有价证券:
截至2025年6月30日,Arcellx拥有现金、现金等价物和有价证券5.376亿美元。Arcellx预计,其现金、现金等价物和有价证券将为其到2028年的运营提供资金。
协作收入:
截至2025年6月30日和2024年的季度,协作收入分别为760万美元和2740万美元,减少了1980万美元。这一下降主要是由于2024年第四季度在iMMagine-1试验中完成了给药和制造anito-cel。
研发费用:
截至2025年6月30日和2024年的季度,研发费用分别为3760万美元和4100万美元,减少了340万美元。这一下降主要是由于2024年第四季度在iMMagine-1试验中完成了anito-cel的给药和制造,部分被人员成本增加所抵消,其中包括基于非现金股票的补偿费用。
G & A费用:
截至2025年6月30日和2024年6月30日的季度,一般和行政费用分别为2870万美元和2140万美元,增加了730万美元。这一增长主要是由于商业准备成本和人员成本增加,其中包括基于非现金股票的补偿费用。
净收入或亏损:
截至2025年6月30日和2024年6月30日的季度净亏损分别为5280万美元和2720万美元。
关于Arcellx, Inc.
Arcellx,Inc.是一家临床阶段的生物技术公司,通过为患有癌症和其他无法治愈的疾病的患者设计创新的免疫疗法,重新构想细胞疗法。Arcellx认为,细胞疗法是医学的向前支柱之一,Arcellx的使命是通过开发更安全、更有效、更广泛可及的细胞疗法来推动人类进步。欲了解有关Arcellx的更多信息,请访问www.arcellx.com。在X @ arcellx和LinkedIn上关注Arcellx。
前瞻性陈述
本新闻稿包含经修订的1933年《证券法》第27A条和经修订的1934年《证券交易法》第21E条含义内的前瞻性陈述。本新闻稿中所有非纯粹历史性的陈述均为前瞻性陈述,其中可能包括但不限于以下方面的陈述:临床数据读出的时间;anito-cel成为多发性骨髓瘤患者改变生活的疗法的潜力;预计2026年anito-cel的商业上市,但须经FDA批准,与Kite合作;期望在上市的第一年内在美国超过160个授权治疗中心推出anito-cel,并有充足的供应来满足医生的期望;承诺在推出anito-cel之后,与Kite合作,确保提供一流的支持和运营执行;期望Arcellx的现金、现金等价物和有价证券将为其运营提供资金到2028年;期望在2025年晚些时候分享iMMagine-1研究的更长期数据。此处包含的前瞻性陈述基于Arcellx目前的预期,其中涉及的假设可能永远不会实现,或者可能被证明是不正确的。这些前瞻性陈述既不是承诺也不是保证,并受到各种风险和不确定性的影响,包括可能在本协议日期或前后向美国证券交易委员会(SEC)提交的截至2025年6月30日的财政季度的10-Q表格季度报告中题为第II部分第1A项(风险因素)的部分中发现的风险,以及Arcellx可能不时向SEC提交的其他文件。这些前瞻性陈述是在本新闻稿发布之日作出的,并且Arcellx不承担更新或修改任何前瞻性陈述的义务,无论是由于新信息、未来事件或其他原因,除非法律要求。

联系人:
投资者:
Myesha花边
ir@arcellx.com
510-418-2412
媒体:
安德里亚科恩
Sam Brown有限责任公司
andreacohen@sambrown.com
917-209-7163
###


