
附件 99.1来自RESET 1/2期试验的CABA-201临床和转化数据2024年11月©2024年Cabaletta Bio。版权所有。

免责声明以下演示文稿,包括这些幻灯片的任何印刷或电子副本、演示者进行的谈话、在任何演示文稿交付和任何问答环节期间传达的信息以及在演示文稿上分发或与演示文稿相关的任何文件或材料(统称“演示文稿”)均由Cabaletta Bio, Inc.(“我们”、“我们”、“我们的”、“Cabaletta”或“公司”)准备,仅供参考。本演示文稿并不旨在是一份招股说明书,也不是完整的或包含您可能想要的所有信息。除非另有说明,否则此处包含的陈述是在本演示文稿之日作出的,并且本演示文稿在任何情况下均不得暗示此处包含的信息在该日期之后的任何时间都是正确的,或者信息将被更新或修订以反映随后可获得的信息或在本演示文稿之日之后发生的变化。本演示文稿可能包含与我们的业务、运营和财务状况相关的1995年《私人证券诉讼改革法案》含义内的“前瞻性陈述”,包括但不限于关于我们目前的信念、期望和假设的明示或暗示的陈述:我们的业务,我们CAAR T和CARTA技术的未来计划和战略;我们发展以自身免疫为重点的管道的能力;利用我们的研究和转化洞察力产生的资本和潜在利益的能力;包括那些与任何类似设计的构建体或给药方案相关的能力;CABA-201在自身免疫性疾病患者中的预期市场机会;我们成功完成研究以及进一步开发和商业化我们的候选药物的能力,包括我们临床试验的时间和结果以及我们进行和完成临床试验的能力;期望临床结果将支持CABA-201的安全性和活性概况;关于对试验修改和预防措施、持续试验操作的期望的声明;关于与监管机构进行监管备案和互动的时间安排的声明,包括此类互动的时间安排,包括这些当局对Cabaletta正在进行的临床试验的信息以及CABA-201的潜在注册方案设计的审查;我们的业务计划和目标;我们对CABA-201的潜在成功和治疗益处的期望,我们推进CABA-201在系统性红斑狼疮(SLE)、肌炎、SSC和全身性重症肌无力(GMG)患者中的单独1/2期临床试验,并推进RESET-PV试验,包括其时间安排,包括我们的预期进展、入组时间、对临床试验设计效率的预期、与状态、安全性数据或其他相关的更新以及相关数据读出的预期时间,以及利用我们在自身免疫细胞治疗方面的经验的能力;2024年11月ACR Convergence 2024临床数据读出对肌炎患者的临床意义,使用CABA-201治疗的SLE和SSC;我们计划在2025年上半年为使用CABA-201治疗的GMG患者读出初步临床数据;我们在美国及其他地区快速扩展的RESET临床项目的临床网络中增加注册人数的能力;我们在欧洲启动临床试验地点和追求RESET-SLE试验的患者注册以及利用我们最近的CTA的能力;对Cabaletta可能改善患有SLE、SSC、肌炎、GMG、黏膜寻常型天疱疮患者预后的预期,或其他自身免疫性疾病;我们的临床策略降低风险、最大限度扩大覆盖范围和加快CABA-201的1/2期临床试验的时间线的能力;与CAR T在自身免疫环境中的区分相关的声明;我们成功完成产品候选者临床前和临床研究的能力,包括我们招募必要数量的患者、按预期方式给每个给药队列以及推进试验的能力;我们获得并维持对我们的产品候选者的监管批准的能力,包括我们对我们的候选产品所赋予的预期激励以及保留孤儿药指定和快速通道指定(如适用)的能力的期望;我们加速我们的管道和为患者开发有意义的疗法的能力,包括与学术和行业合作伙伴合作以及在我们的开发项目上优化此类合作的能力;以及我们对我们使用资本和其他财务结果的期望,包括我们为2026年上半年的运营提供资金的能力。诸如, 但不限于“期待”、“相信”、“预期”、“预期”、“估计”、“打算”、“计划”、“将”、“应该”和“可以”,以及类似的表达或词语,识别前瞻性陈述。各种风险、不确定性和假设可能导致实际结果与我们前瞻性陈述中预期或暗示的结果存在重大差异。此类风险和不确定性包括但不限于与我们的产品候选者开发活动以及临床前研究和临床试验的成功、成本和时间相关的风险,与我们在CABA-201、DSG3-CAART和MUSK-CAART的临床前研究和临床试验中证明安全性、有效性和耐受性的充分证据的能力相关的风险,使用类似设计的结构观察到的结果的风险,包括但不限于,由于给药方案,并不表明我们使用CABA-201寻求达到的结果,eThe risk that biological activity or persistence signs may not inform long-term results,the risk that interim results do not always inform lateral results,the risk that piersistence observed with effective CD19-CAR T tonology studies with lymphodoplement is not indicative or applicable to clinical response in patients with mPV,risk related to clinical trial site activation or enrent rate are与监管机构评估监管备案和与我们的产品候选者相关的其他信息相关的不确定性,我们保留和认可任何孤儿药指定和快速通道指定所赋予的预期激励的能力,与监管备案和潜在许可相关的风险,我们的任何一个或多个产品候选者将无法成功开发和商业化的风险,临床前研究或临床研究的结果无法预测与未来研究相关的未来结果的风险,以及与波动的市场和经济条件以及公共卫生危机相关的风险。新的风险和不确定因素可能会不时出现,不可能预测所有的风险和不确定因素。除适用法律要求外,我们不打算公开更新或修改此处包含的任何前瞻性陈述,无论是由于任何新信息、未来事件、变化的情况或其他原因。尽管我们认为此类前瞻性陈述中反映的预期是合理的,但我们不能保证此类预期将被证明是正确的。因此,请注意不要过分依赖这些前瞻性陈述。不对任何此类前瞻性陈述的准确性作出任何陈述或保证(明示或暗示)。有关这些和其他风险和不确定性以及其他重要因素的讨论,其中任何一个都可能导致我们的实际结果与前瞻性陈述中包含的结果存在重大差异,请参阅我们最近的10-K表格年度报告中标题为风险因素的部分,以及我们在其他和随后提交给美国证券交易委员会的文件中对潜在风险、不确定性和其他重要因素的讨论。本演示文稿中包含的某些信息涉及或基于从第三方来源获得的研究、出版物、调查和其他数据以及公司自己的内部估计和研究。虽然公司相信这些第三方来源在本介绍之日是可靠的,但它没有独立核实,也不对从第三方来源获得的任何信息的充分性、公平性、准确性或完整性作出任何陈述。该公司是各种商标、商号和服务标志的所有者。本演示文稿中出现的某些其他商标、商品名称和服务标记是第三方的财产。仅为方便起见,本演示文稿中提及的商标和商号没有®和TM符号,但此类引用不应被解释为其各自所有者不会根据适用法律在最大程度上主张其权利的任何指标。2

今天的议程主题发言人Steven Nichtberger,医学博士CABA-201概述首席执行官肿瘤学的教训:将CAR T Carl H. June,医学博士,细胞免疫疗法中心主任,宾夕法尼亚大学医学细胞疗法扩展为自身免疫性CABA-201临床和转化数据David Chang,医学博士,公共卫生硕士,FACR TM来自RESET临床项目的首席医疗官Steven Nichtberger,医学博士总结首席执行官问答3

CABA-201:专为自身免疫设计的CD19-CAR T 1,3 Cabaletta的CD19结合剂具有类似的体外和体内活性构建用于学术研究的临床数据IASO报告的使用4种获得许可的CD19结合剂的肿瘤学全人源抗CD19结合剂的类似结合亲和力和生物活性与FMC63,1,2与相同表位结合的全人粘合剂被评估为双CAR联合CD22粘合剂与标准Flu/CY预处理迄今在中国约20名患者中报告的4-1BB共刺激域B细胞白血病和淋巴瘤的数据与学术研究中使用的相同的共刺激结构域CD3-φ信号域安全性数据支持自身免疫开发5 CABA-201 IIT –研究者发起的试验;flu/Cy –氟达拉滨/环磷酰胺1。Peng,Binghao J,et al.“CABA-201的临床前特异性和活性,CABA-201是一种全人4-1BB含CD19 CAR T疗法,用于治疗耐药的自身免疫性疾病。”海报展示于:美国学会基因与细胞治疗第26届年会;2023年5月19日;加利福尼亚州洛杉矶。2。Dai,Zhenyu,et al.新型全人源抗CD19嵌合抗原受体用于T细胞治疗的开发和功能表征。细胞生理学杂志236.8(2021):5832-5847。3.M ü ller,Fabian,et al. CD19 CAR T细胞治疗自身免疫性疾病—病例系列随访。新英格兰医学杂志390.8(2024):687-700。4.作为CT120的一部分进行评估,由南京安硕生物治疗有限公司(安硕生物)开发的双CD19xCD22 CAR T候选产品。5.CABA-201中的跨膜结构域是CD8 α vs.学术构建体中使用的TNFSF19(Troy)。这两个跨膜结构域在临床前研究中未显示出在功能或4IFN-γ产生方面的显着差异。CD8 α跨膜结构域用于tisagenlecleucel。

CABA-201的RESET临床方案,a CD19-directed CAR T多种自身免疫性疾病在跨越五个临床试验的不同疾病队列中进行评估1/2期关键项目试验临床前皮肌炎风湿病抗合成酶综合征神经病学RESET-肌炎IMNM皮肤病包含队列(s)未预处理幼年肌炎儿科适应症狼疮性肾炎FTD RESET-SLE CABA-201非肾SLE 4-1BB CD19-CAR T皮肤+器官队列RESET-SSC皮肤队列ACHR-AB pos.gMG RESET-MG ACHR-AB neg.gMG 2黏膜皮肤&黏膜寻常型天疱疮RESET-PV RESET-PVFDA快速通道指定在皮肌炎、SLE和狼疮性肾炎、系统性硬化症、黏膜寻常型天疱疮和MISK-AB阳性MG中获得。
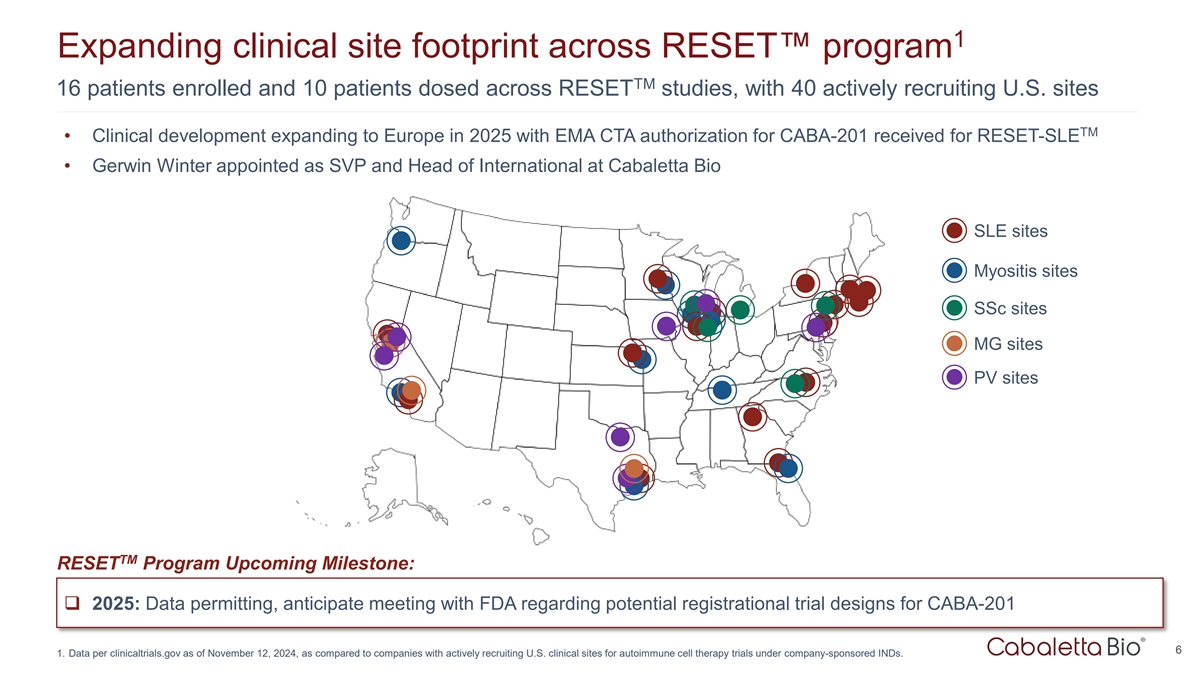
1在RESET项目TM中扩大临床站点足迹16名患者入组,10名患者在RESET研究中给药,有40名正在积极招募美国站点TM • 2025年临床开发扩展到欧洲,CABA-201的EMA CTA授权获得RESET-SLE • Gerwin Winter被任命为高级副总裁兼国际主管,在Cabaletta Bio SLE站点肌炎站点SSC站点MG站点PV站点TM RESET项目即将到来的里程碑:q 2025:如果数据允许,预计将与FDA就CABA-201的潜在注册试验设计举行会议61。截至2024年11月12日的每clinicaltrials.gov数据,与在公司赞助的IND下积极招募美国临床站点进行自身免疫细胞治疗试验的公司相比。

肿瘤学的教训:将CAR T细胞疗法拓展为自身免疫7

CAR T在肿瘤学中的成功建立了数十年的B细胞癌症经验CAR T告知在自身免疫患者中的使用1987 1994 200320171首次CAR设计CAR T细胞首次报告首次抗CD19首次CAR T细胞疗法获FDA批准25 7杀死小鼠肿瘤细胞CAR报告(tisagenlecleucel)1994199820042021首次CD28-首次4-1BB-CAR T细胞CAR T用于HIV共刺激CAR共刺激CAR疗法的早期报告针对自身免疫3468启动报告的人类疾病9 •多类细胞疗法处于1/2期研究,大部分为自体CAR T细胞疗法10 •~800正在进行的CAR T试验,其中大部分在美国和中国肿瘤学方面的经验为自身免疫疾病1的应用奠定了基础。Kuwana Y,et al. Biochem Biophys Res Commun。1987;149(3):960-968.2.Moritz D,et al. Proc Natl Acad Sci USA。1994;91:4318-4322.3.罗伯茨MR,et al. Blood。1994;84(9):2878-2889.4.Krause A,et al. J exp med. 1998;188:619-626。5.Brentjens RJ,et al. Nat Med. 2003;101(4):1637-1644。6.Imai C,et al.白血病。2004;18:676-684.7.O’leary MC,et al. Clin Cancer Res.2019;25(4):1142-146。8.Mougiakakos D,et al. N Engl J Med. 2021;385(6):567-569。9.Krishnamurthy A,et al. 富国银行,2017年11月。10.Clinicaltrials.gov。于2024年11月14日访问。8 https://clinicaltrials.gov/search?intr=chimeric%20antigen%20receptor。
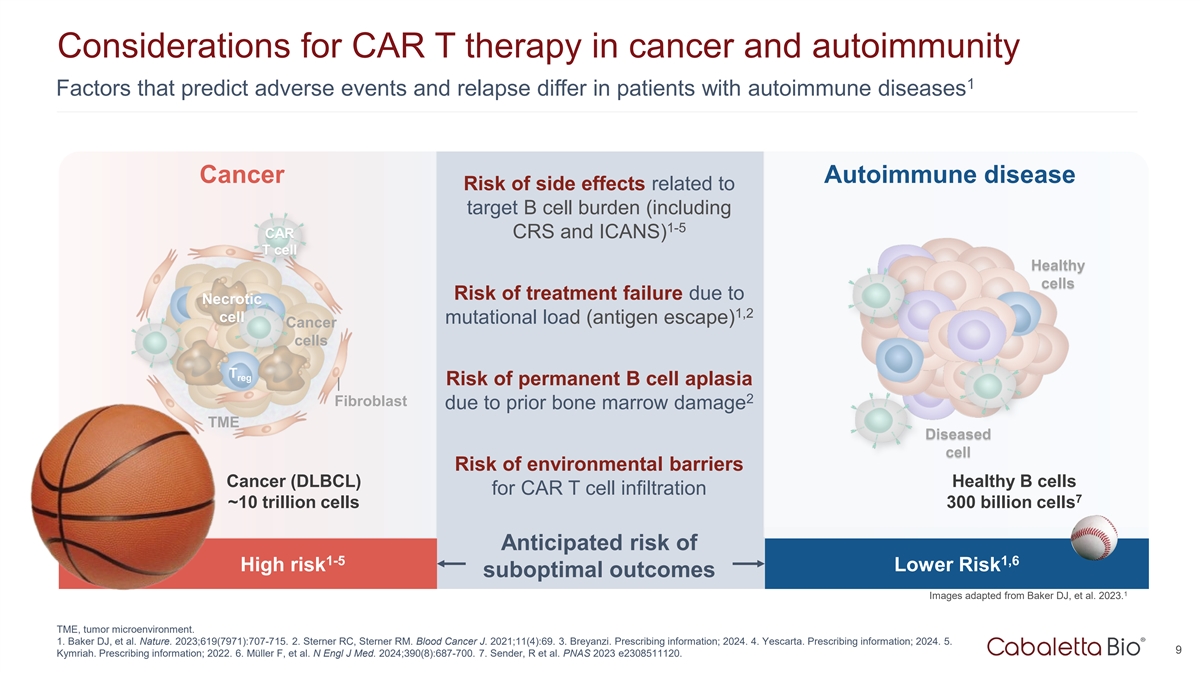
CAR T治疗癌症和自身免疫的注意事项1因素预测自身免疫性疾病患者不良事件和复发的差异癌症自身免疫性疾病与靶点B细胞负荷相关的副作用风险(包括1-5 CAR CRS和ICANS)T细胞健康细胞因坏死1,2细胞突变负荷(抗原逃逸)导致治疗失败的风险癌细胞T reg因既往骨髓损伤导致永久性B细胞再发育不良2成纤维细胞的风险TME病变细胞发生环境屏障癌(DLBCL)健康B细胞CAR T细胞浸润的风险7~10万亿细胞3000亿细胞预期风险1-5 1,6高风险较低风险次优结果1图片改编自Baker 丨DJ等人2023。TME,肿瘤微环境。1.Baker DJ等人。Nature。2023;619(7971):707-715.2.Sterner RC,Sterner RM。血癌J. 2021;11(4):69。3.Breyanzi。处方信息;2024年。4.Yescarta。处方信息;2024年。5.9 Kymriah。处方信息;2022。6.M ü ller F,et al. N Engl J Med. 2024;390(8):687-700。7.Sender,R et al. PNAS 2023 e2308511120。
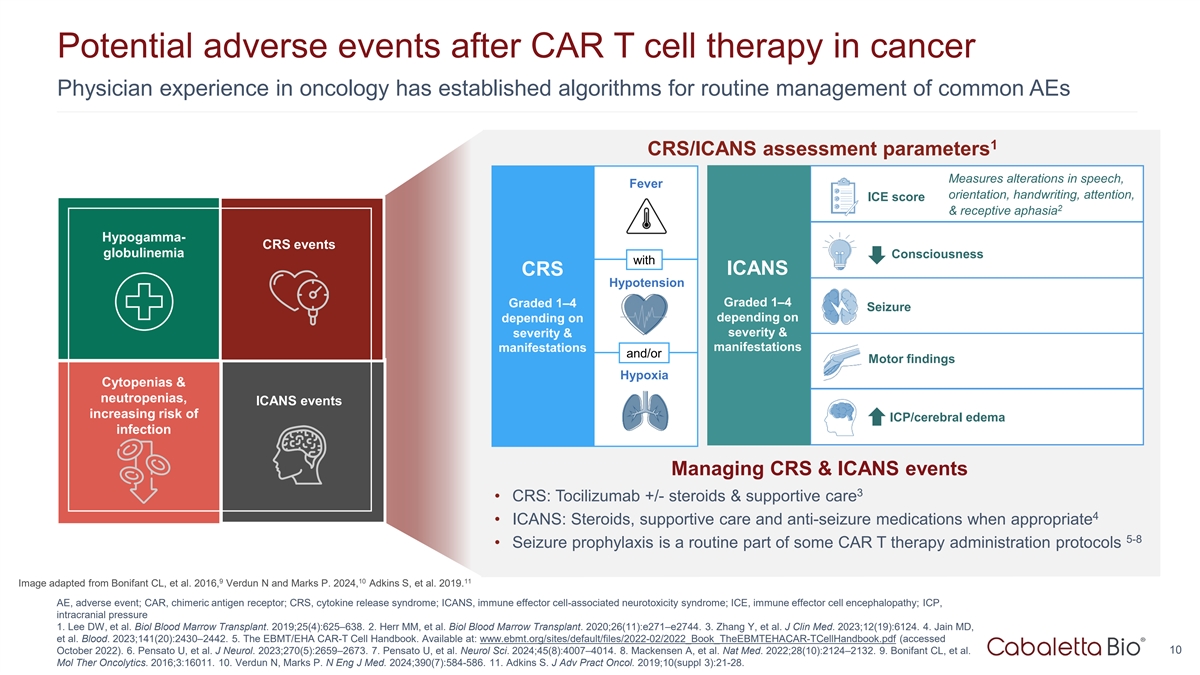
CAR T细胞治疗癌症后的潜在不良事件肿瘤学经验的医生建立了常规管理常见AEs的算法1 CRS/ICANS评估参数测量言语、发烧方向、笔迹、注意力、ICE评分2 &接受性失语低伽马值-CRS事件球蛋白血症意识与ICANS CRS低血压分级1 – 4分级1 – 4癫痫发作取决于取决于严重程度&严重程度&表现表现和/或运动表现缺氧细胞减少和中性粒细胞减少,ICANS事件增加ICP/脑水肿感染风险管理CRS & ICANS事件3 • CRS:托珠单抗+/-类固醇&支持性护理4 • ICANS:类固醇,支持性护理和适当时的抗癫痫药物5-8 •癫痫预防是一些CAR T疗法给药方案的常规部分91011 Image改编自Bonifant CL,et al. 2016,Verdun N和Marks P. 2024,Adkins S,et al. 2019。AEE,不良事件;CAR,嵌合抗原受体;CRS,细胞因子释放综合征;ICANS,免疫效应细胞相关神经毒性综合征;ICE,免疫效应细胞脑病;ICP,颅内压1。Lee DW等Biol骨髓移植。2019;25(4):625–638.2.Herr MM,et al. Biol骨髓移植。2020;26(11):e271 – e2744。3.Zhang Y,et al. J Clin Med. 2023;12(19):6124。4.Jain MD,et al. Blood。2023;141(20):2430–2442.5.《EBMT/EHA CAR-T细胞手册》。可查阅:www.ebmt.org/sites/default/files/2022-02/2022_ Book _ theEBMTEHACAR-TCellHandbook.pdf(2022年10月10日访问)。6.Pensato U,et al. J Neurol。2023;270(5):2659–2673.7.Pensato U,et al. Neurol Sci. 2024;45(8):4007 – 4014。8.Mackensen A,et al. Nat Med. 2022;28(10):2124 – 2132。9.Bonifant CL,et al. mol ther oncolytics。2016;3:16011.10.Verdun N,Marks P. N Eng J Med. 2024;390(7):584-586。11.Adkins S. J Adv Pract Oncol。2019;10(Suppl 3):21-28。

CABA-201临床和转化数据TM来自RESET临床计划11

自身免疫性疾病患者面临大量未满足的医疗需求1-4尽管有慢性广泛免疫抑制的疗法,死亡率增加,生活质量下降*系统性狼疮性肌炎系统性红斑硬化症6 •慢性炎症常导致•进行性、多器官损害•进行性皮肤和器官纤维化,其中1种永久性组织损害常导致不可逆的肺、心脏和2种•~40%发展为狼疮性肾炎,25%的风险为肾损害7,8•进行性虚弱、疼痛、吞咽困难,且10年内死亡或ESKD肌外表现也有9 •从诊断起平均生存期~12年5常见患者寻求无药物、无症状生活;10医师也优先预防终末器官损伤*与一般人群ESKD相比,终末期肾病1。Lundberg IE,et al. Nat Rev DIS Primers。2021;7(1):86.2.Allanore Y,et al. Nat Rev DIS Primers。2015;1:15002.3.Zen M,et al. Eur J Intern Med. 2023;112:45 – 51。4.Refai RH,et al. SciRep. 2024;14(1):5234。5.Suh J,阿马托AA。肌肉神经。2024;70(2):166–172.6.Murimi-Worstell IB,et al. BMJ Open。2020;10(5):e031850。7.Anders HJ,et al. 12 Nat Rev DIS Primers。2020;6(1):7.8.胡佛PJ,Costenbader KH。肾脏国际。2016;90(3):487–492.9.梅斯医学博士。Rheum DIS Clin North AM。2003;29(2):239-254.10.戈尔德等人,狼疮。2018;27(3): 501-506

RESET临床项目中的TM关键纳入和排除标准,旨在评估CABA-201在患有活动性、难治性疾病的受试者中的安全性和耐受性1 – 3关键纳入标准尽管先前或当前使用标准护理治疗RESET-肌炎RESET-SLE RESET-SSC进行了活动性疾病的证据•年龄≥ 18且≤ 65且诊断为IIM •年龄≥ 18且≤ 75且诊断为IIM •筛查时ANA或抗DSDNA阳性•年龄≥ 18且≤ 70且伴有局限性或弥漫性(ASYS、DM或IMNM)• SLE(非肾性):活动性,中度至重度SSC诊断•存在至少一种MSA SLE,SLEDAI-2K ≥ 8;纯V类LN患者•有明显皮肤、肺部的证据,符合该队列的条件• JIIM:年龄≥ 6岁且≤ 17且至少存在肾脏,或心脏受累一种MSA或MAA • LN:活跃,活检证实的LN III类或IV类(± V类)1 – 3关键排除标准先前3-6个月内的B细胞消耗剂;既往CAR T治疗和/或HSCT •存在LN以外的肾脏疾病•癌症相关肌炎•严重肺或心脏损害•当前症状严重、进行性或•肺或心脏损害不受控制的肺或心脏疾病ASYS、抗合成酶综合征;CAR,嵌合抗原受体;DM,皮肌炎;HSCT,造血干细胞移植;IIM,特发性炎症性肌病;JIIM,青少年特发性炎症性肌病;LN,狼疮性肾炎;MAA,肌炎相关抗体;MSASLE疾病活动指数2000;SSC,系统性硬化症。1.ClinicalTrials.gov。可查阅:www.clinicaltrials.gov/study/NCT06121297(2024年10月访问)。13 2.ClinicalTrials.gov。可查阅:www.clinicaltrials.gov/study/NCT06328777(2024年10月访问)。3.ClinicalTrials.gov。可查阅:www.clinicaltrials.gov/study/NCT06154252(2024年10月访问)。
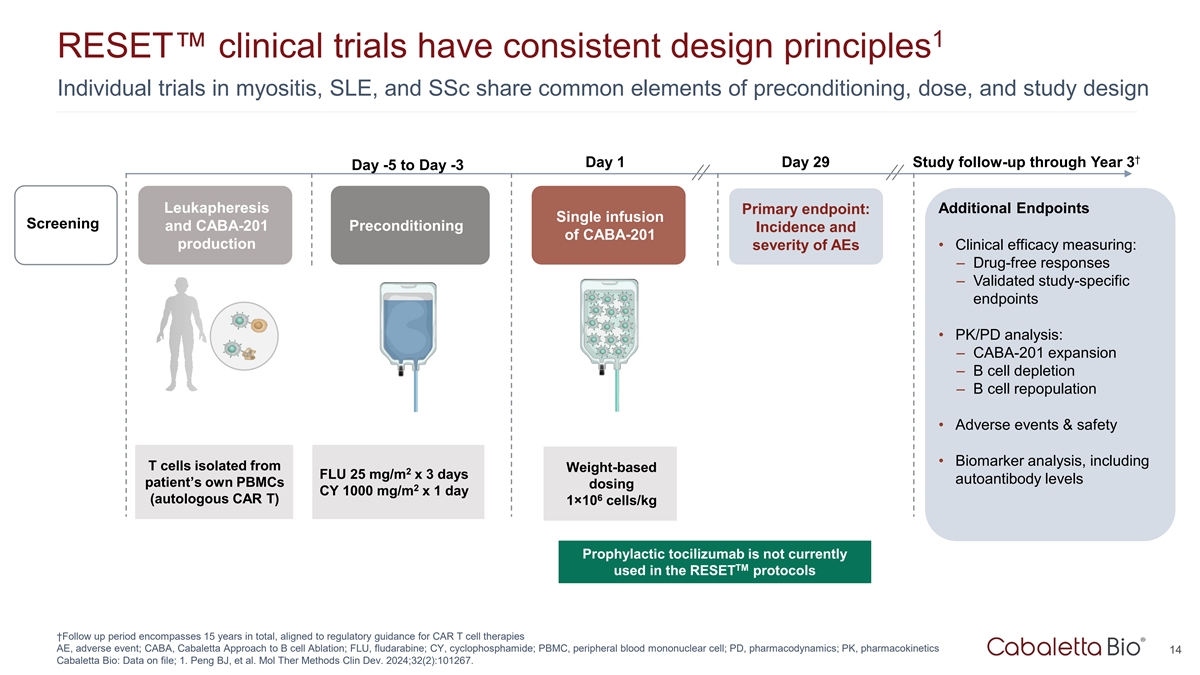
1项RESET临床试验具有一致的设计原则肌炎、SLE和SSC中的个体试验具有预处理、剂量和研究设计的共同要素↓第1天第29天研究随访至第3年第3天-5至第3天白质分离主要终点:额外终点单次输注筛查和CABA-201预处理发生率以及CABA-201产生AEs的严重程度•临床疗效测量:–无药物应答–经过验证的研究特定终点• PK/PD分析:– CABA-201扩增– B细胞耗竭– B细胞再聚群•不良事件和安全性•生物标志物分析,包括从基于体重的2个FLU中分离出的T细胞25mg/m x3天自身抗体水平患者自身的PBMC给药2 CY 1000mg/m x1天6(自体CAR T)1 × 10个细胞/kg的预防性托珠单抗目前未在RESET方案中使用TM ↓随访期总共包括15年,符合CAR T细胞疗法AE、不良事件的监管指导;CABA,Cabaletta方法治疗B细胞消融;FLU、氟达拉滨;CY、环磷酰胺;PBMC,外周血单个核细胞;PD,药效学;PK,药代动力学14丨卡巴莱塔生物丨Cabaletta Bio:数据存档;1。Peng BJ等人Mol Ther Methods Clin Dev. 2024;32(2):101267。
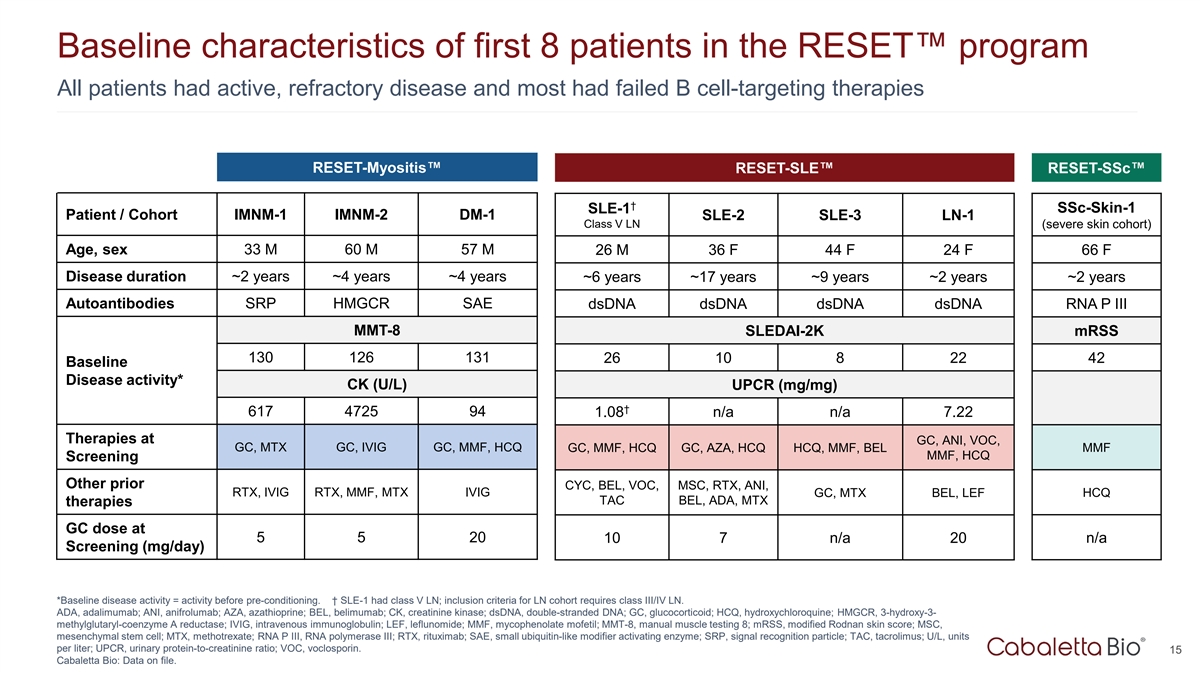
RESET项目前8名患者的基线特征所有患者均为活动性、难治性疾病,且大多数B细胞靶向治疗失败RESET-Myositis RESET-SLE RESET-SSC/队列IMNM-1 IMNM-2 DM-1 SLE-2 LLE-3 LN-1 Class V LN(重度皮肤队列)年龄,性别33 m 60 m 57 m 26 m 36 f 44 f 24 f 66 f病程~2年~4年~4年~6年~17年~9年~2年~2年自身抗体SRP HMGCR SAE DSDNA DSDNA DSDNA dsDNA RNA P III MMT-8 SLEDAI-2K mRSS 130126131261082242基线疾病活度*CK(U/L)UPCR(mg/mg)† 6174725941.08 n/a n/a 7.22治疗GC、ANI、VOC、GC、MTX GC、IVIG GC、MMF、HCQ GC、MMF、HCQ GC、HCQ GC、AZA、HCQ HCQ、MMF、BEL MMF MMF,HCQ筛查其他既往CYC、BEL、VOC、MSC、RTX、ANI、RTX、IVIG RTX、MMF、MTXTERMIVIG GC、MTX BEL、LEF HCQ TAC BEL、ADA、MTX疗法GC剂量在5520 n/a107 n/a20筛查(mg/day)*基线疾病活动=预处理前的活动。↓ SLE-1有V类LN;LN队列的纳入标准要求III/IV类LN。ADA,阿达木单抗;ANI,阿尼福单抗;AZA,硫唑嘌呤;BEL,贝利木单抗;CK,肌酐激酶;DSDNA,双链DNA;GC,糖皮质激素;HCQ,羟氯喹;HMGCR,3-羟基-3-甲基戊二酰辅酶A还原酶;IVIG,静脉注射免疫球蛋白;LEF,来氟米特;MMF,吗替麦考酚酯;MMT-8,手动肌肉检测8;mRSS,修饰Rodnan皮肤评分;MSC,间充质干细胞;MTX,甲氨蝶呤;RNA P III,RNA聚合酶III;RTX15 Cabaletta Bio:已存档的数据。
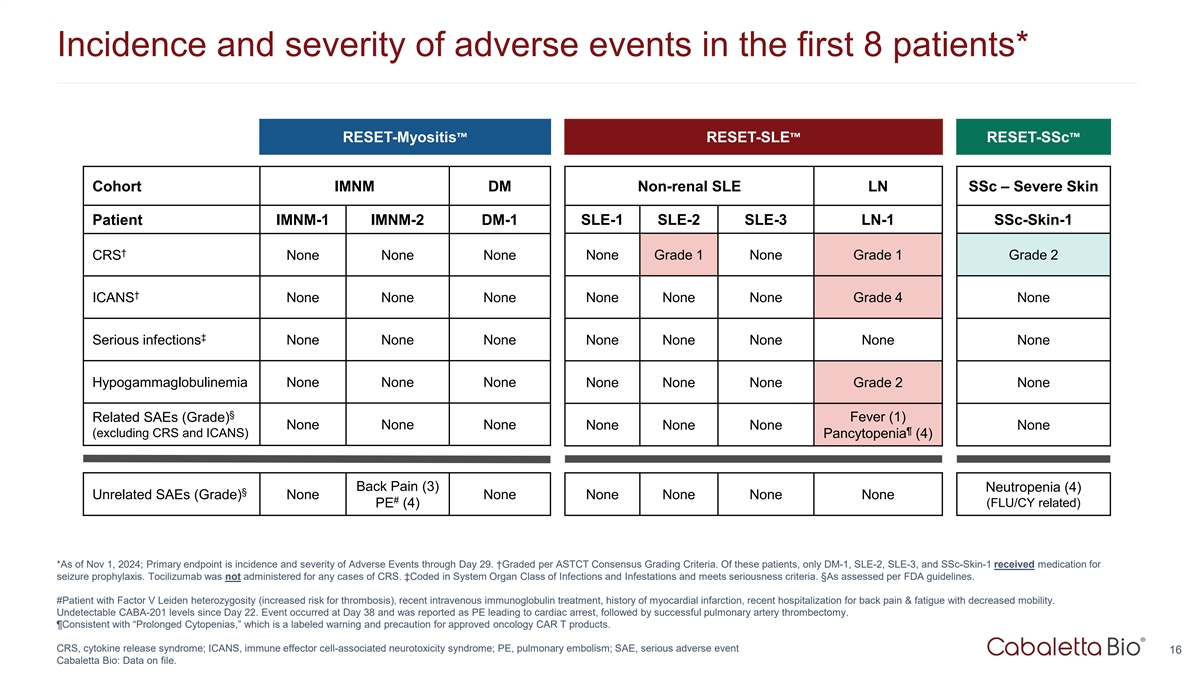
前8例患者不良事件发生率及严重程度*RESET-Myositis RESET-SLE RESET-SSC队列IMNM DM非肾性SLE LN SSC –重症皮肤患者IMNM-1 IMNM-2 DM-1 SLE-1 SLE-2 SLE-3 LN-1 SSC-Skin-1 † CRS无无无1级无1级无1级2级↓ ICANS无无无无无4级无↓严重感染无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无无和ICANS)血细胞减少(4)背痛(3)中性粒细胞减少(4)§不相关SAE(级)无无无无无无# PE(4)(FLU/CY相关)*截至2024年11月1日;主要终点是截至第29天的不良事件发生率和严重程度。↓根据ASTCT共识评分标准进行评分。在这些患者中,只有DM-1、SLE-2、SLE-3和SSC-Skin-1接受了预防癫痫发作的药物治疗。托珠单抗未用于任何CRS病例。丨码入系统器官类感染和侵扰,符合严重性标准。§根据FDA指南评估。#患者因子V莱顿杂合性(血栓形成风险增加),近期静脉注射免疫球蛋白治疗,有心肌梗塞病史,近期因背痛&疲劳伴活动能力下降住院。自22日以来无法检测到的CABA-201水平。事件发生在第38天,报告为PE导致心脏骤停,随后成功进行肺动脉血栓切除术。⑤与“长期血细胞减少”一致,这是对已获批准的肿瘤CAR T产品的标记警告和注意事项。CRS,细胞因子释放综合征;ICANS,免疫效应细胞相关神经毒性综合征;PE,肺栓塞;SAE,严重不良事件16 Cabaletta Bio:数据存档。
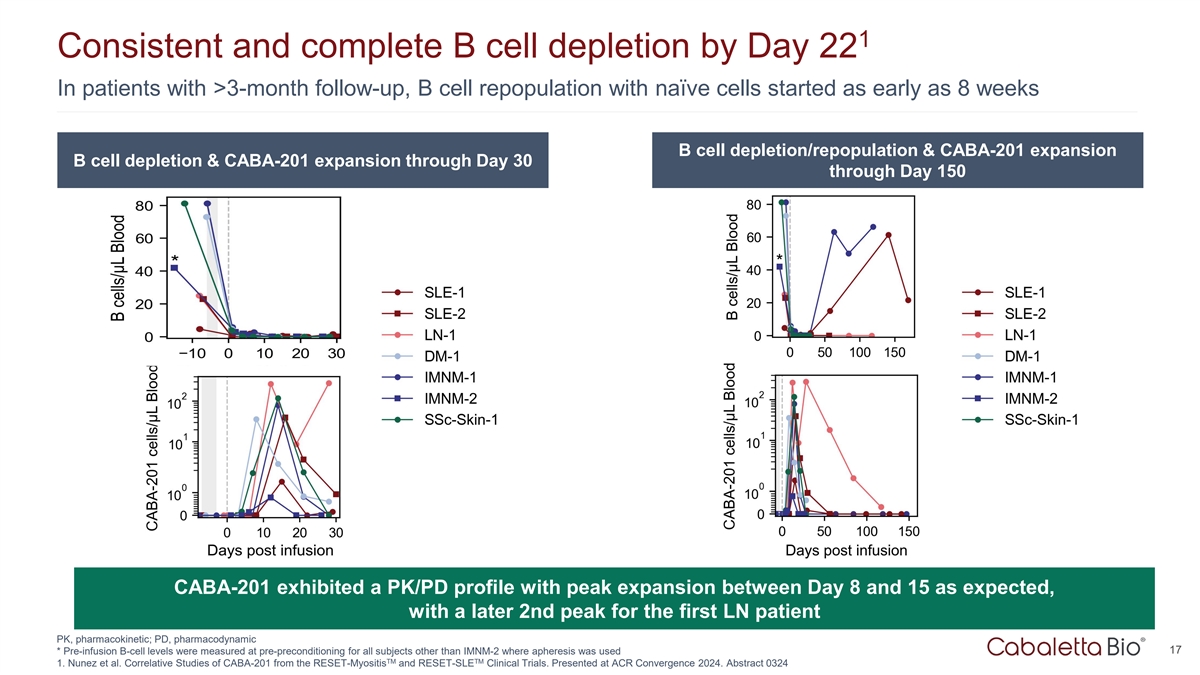
1在> 3个月随访的患者中,B细胞在第22天前一致和完全耗竭,B细胞早在8周时就开始与幼稚细胞重新聚集B细胞耗竭/再聚集& CABA-201扩增B细胞耗竭& CABA-201扩增至第30天至第150天CABA-201表现出PK/PD曲线,如预期的那样在第8天至第15天之间出现峰值扩增,随后第一个LN患者出现第2个峰值PK,药代动力学;PD,药效学17*对除IMNM-2外使用TM TM 1单采血浆的所有受试者,在预预处理时测量输注前B细胞水平。Nunez et al. CABA-201 from the RESET-Myositis and RESET-SLE clinical trials的相关研究。在ACR Convergence 2024上发表。摘要0324
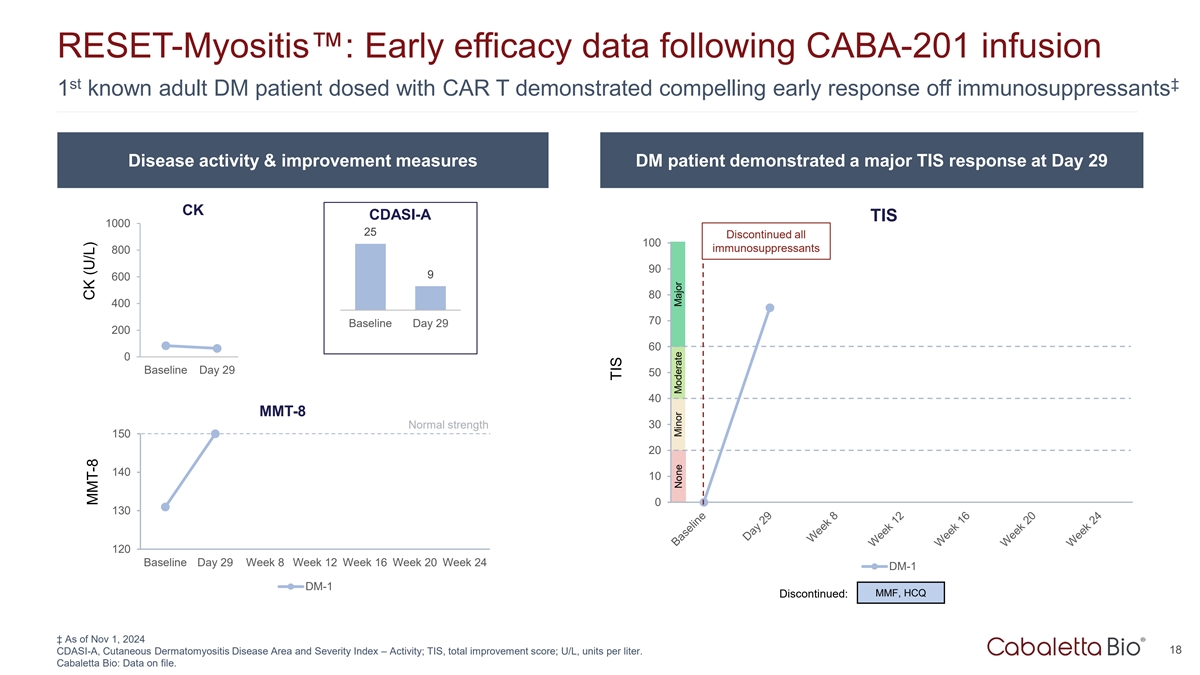
RESET-Myositis:CABA-201输注ST 21.81已知成人DM患者服用CAR T后的早期疗效数据显示免疫抑制剂的早期反应令人信服疾病活动和改善措施DM患者在第29天表现出主要的TIS反应CK CDASI-A TIS 100025停用所有100种免疫抑制剂8009096008040070基线第29200 DM-1 600基线第29周第8周第12周第16周第20周第24周第5040 MT-8正常强度3015020140100130120基线第29周第8周第12周第20周第24周DM-1 DM-1 MMF,HCQ停售:↓截至2024年11月1日18CDASI-A,皮肤皮肌炎病区及严重指数–活度;TIS,总改善评分;U/L,单位/升。Cabaletta Bio:已存档的数据。CK(U/L)MMT-8 TIS无次要中度主要
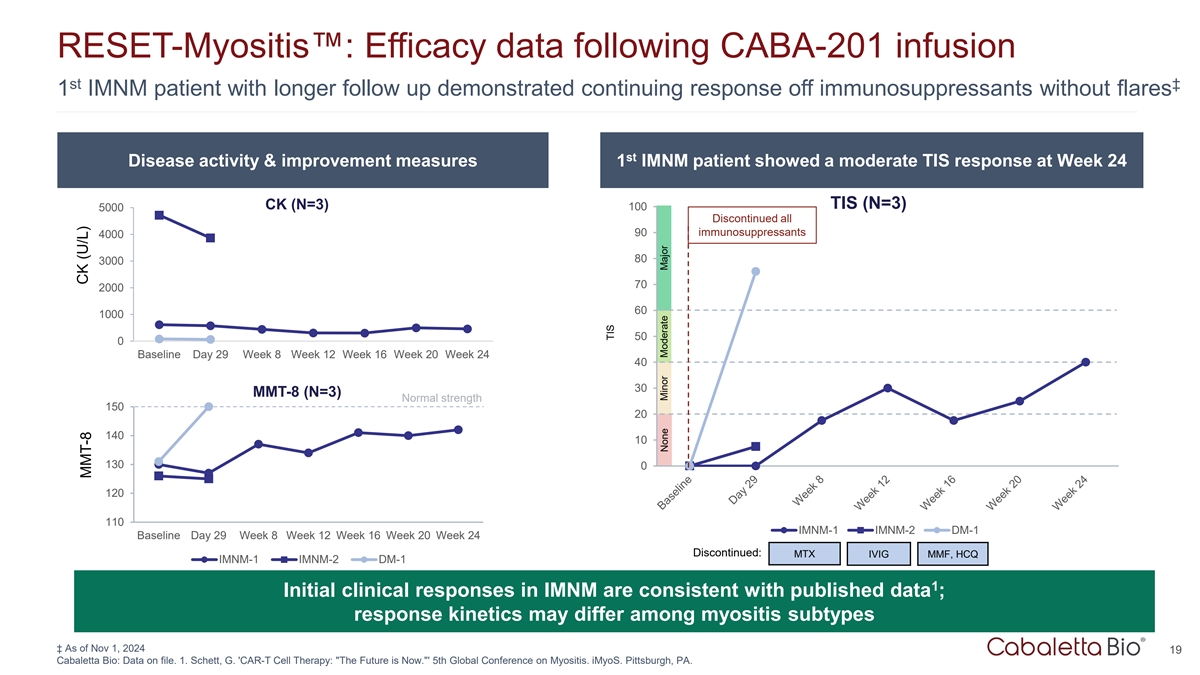
RESET-Myositis:CABA-201输液ST丨1 IMNM患者随访时间较长后的疗效数据显示免疫抑制剂持续反应无耀斑ST疾病活动&改善措施1 IMNM患者在第24周TIS(N = 3)时出现中度TIS应答CK(N = 3)1005000停用所有90种免疫抑制剂4000803000702000601000500基准日29周8周12周16周20周24 4030 MMT-8(N = 3)正常强度15020140101300120110 IMNM-1 IMNM-2 DM-1基准日29周8周12周16周20周24停用:MTX IVIG MMF,HCQ IMNM-1 IMNM-2 DM-1 1在IMNM中的初步临床反应与已公布的数据一致;不同肌炎亚型之间的反应动力学可能存在差异↓截至2024年11月1日19 Cabaletta Bio:数据已存档。1.Schett,G. ' CAR-T细胞疗法:未来就是现在。'第五届全球肌炎大会。iMyOS。宾夕法尼亚州匹兹堡。CK(U/L)MMT-8 TIS无小、中、大
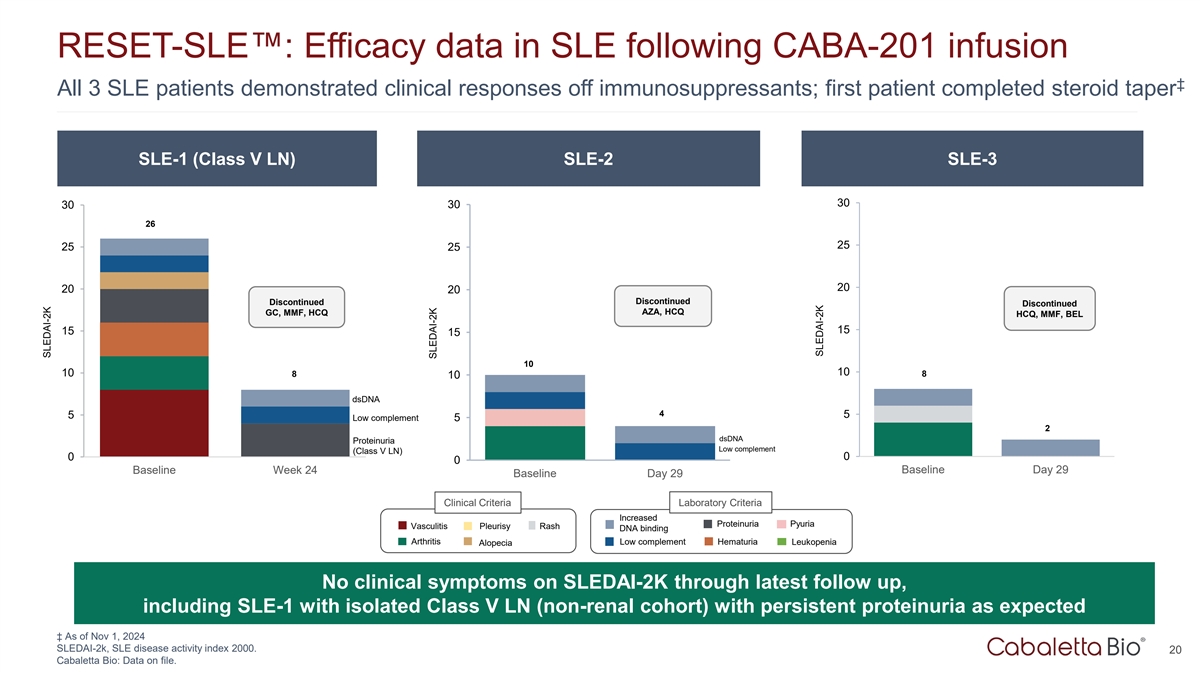
RESET-SLE:CABA-201输注后SLE的疗效数据丨所有3名SLE患者均表现出对免疫抑制剂的临床反应;首例患者完成类固醇taper SLE-1(V类LN)SLE-2 SLE-3 3030303026252525202020停用停用停用停用AZA、HCQ GC、MMF、HCQ HCQ、MMF,BEL 1515151010108810 DSDNA 455低补体52 DSDNA蛋白尿低补体(V类LN)000基线第24周基线第29天基线第29天临床标准实验室标准增加蛋白尿脓尿血管炎胸膜炎皮疹DNA结合关节炎低补体血尿白细胞减少症脱发在SLEDAI-2K上无临床症状通过最新随访,包括SLE-1与孤立的V类LN(非肾性队列)持续蛋白尿如预期相一致↓截至2024年11月1日SLEDAI-2k,SLE疾病活动指数2000。20 Cabaletta Bio:已存档的数据。SLEDAI-2K SLEDAI-2K SLEDAI-2K
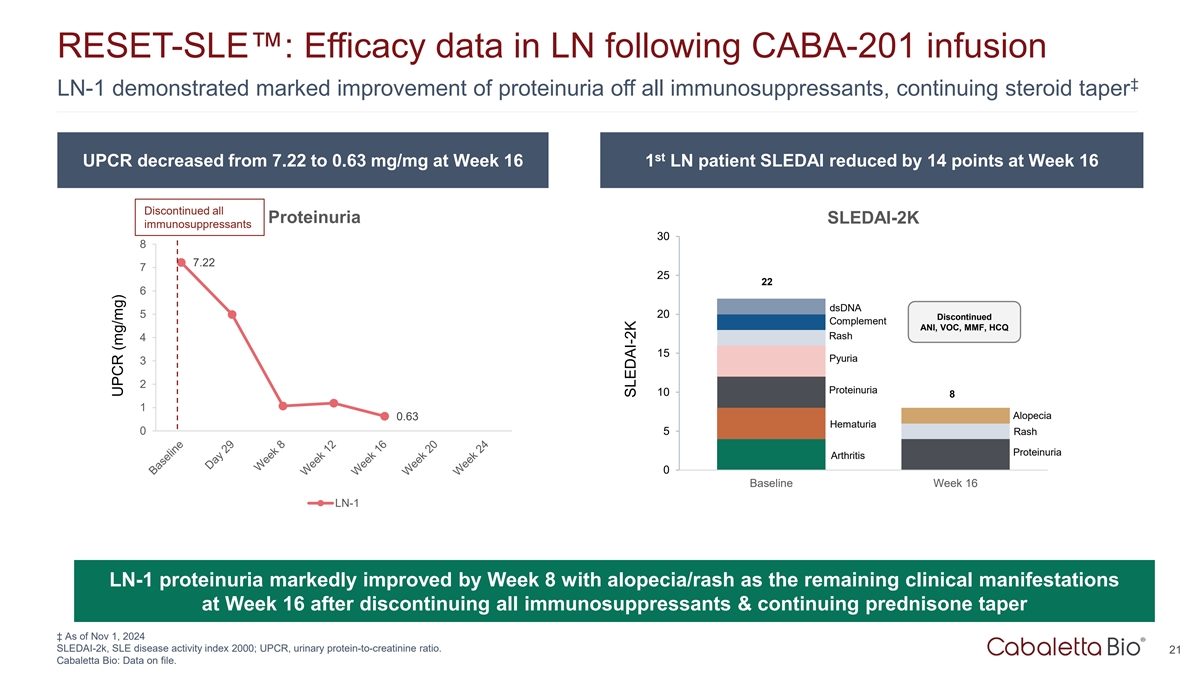
RESET-SLE:CABA-201输注后LN中的疗效数据证明所有免疫抑制剂的蛋白尿都有显着改善,持续的类固醇taper ST UPCR在第16周从7.22降至0.63mg/mg 1 LN患者SLEDAI在第16周降低了14个点停用所有蛋白尿SLEDAI-2K免疫抑制剂3087.22725226 DSDNA 520停用补体ANI、VOC、MMF,HCQ皮疹415脓尿32蛋白尿1081脱发0.63血尿05皮疹蛋白尿关节炎0基线第16周LN-1 LN-1蛋白尿在停用所有免疫抑制剂后第8周显着改善,脱发/皮疹是第16周剩余的临床表现&持续强的松逐渐变细↓截至2024年11月1日SLEDAI-2k,SLE疾病活动指数2000;UPCR,尿蛋白-肌酐比。21 Cabaletta Bio:已存档的数据。UPCR(mg/mg)SLEDAI-2K
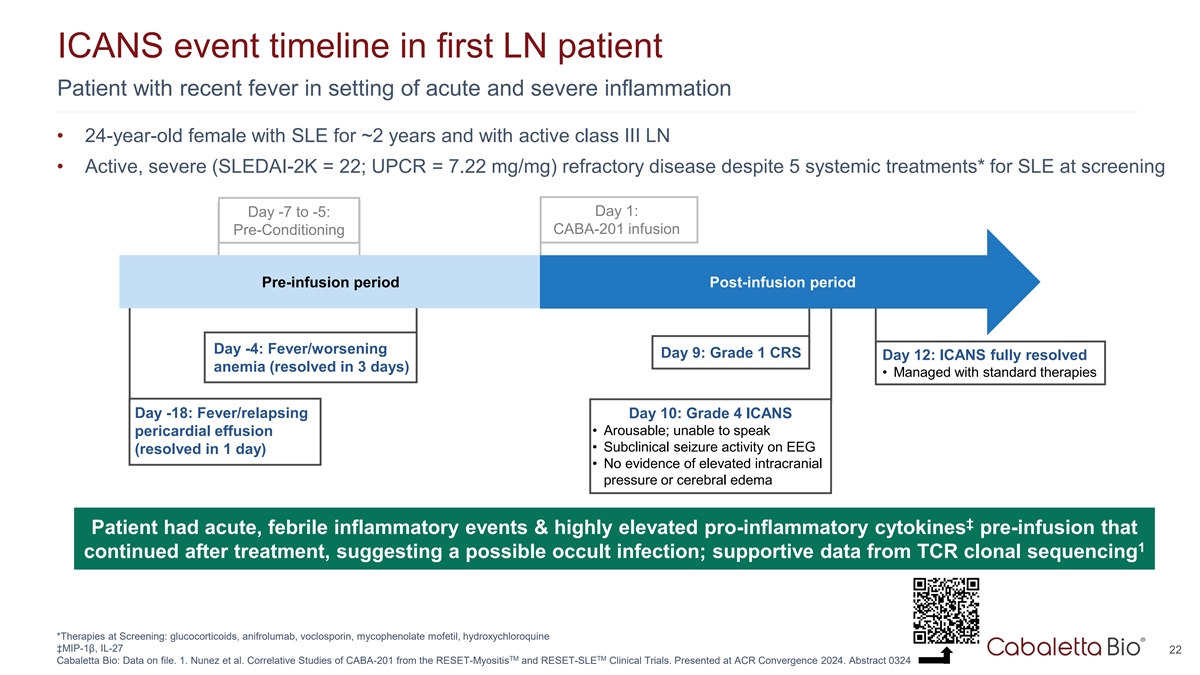
首例LN患者近期在急性和严重炎症情况下出现发热的患者的ICANS事件时间线• 24岁女性SLE约2年且有活动的III类LN •活跃,重症(SLEDAI-2K = 22;UPCR = 7.22mg/mg)难治性疾病尽管5次全身治疗*筛查时的SLE第1天:第7天至-5天:CABA-201输液前条件预输注期输注期后第4天:发烧/恶化第9天:1级CRS第12天:ICANS完全解决贫血(3天解决)•用标准疗法管理第18天:发烧/复发第10天:4级ICANS •可唤醒;不能说心包积液•脑电图上的亚临床癫痫活动(1天解决)•没有颅内压升高或脑水肿的证据↓患者有急性,热性炎症事件&治疗后1继续输注前高度升高的促炎细胞因子,提示可能存在隐匿性感染;来自TCR克隆测序的支持性数据*筛查中的疗法:糖皮质激素、阿尼弗鲁单抗、沃氯霉素、吗替麦考酚酯、羟氯喹↓ MIP-1 β、IL-27 22 TM Cabaletta Bio:数据存档。1.Nunez et al. CABA-201 from the RESET-Myositis and RESET-SLE clinical trials的相关研究。在ACR Convergence 2024上发表。摘要0324
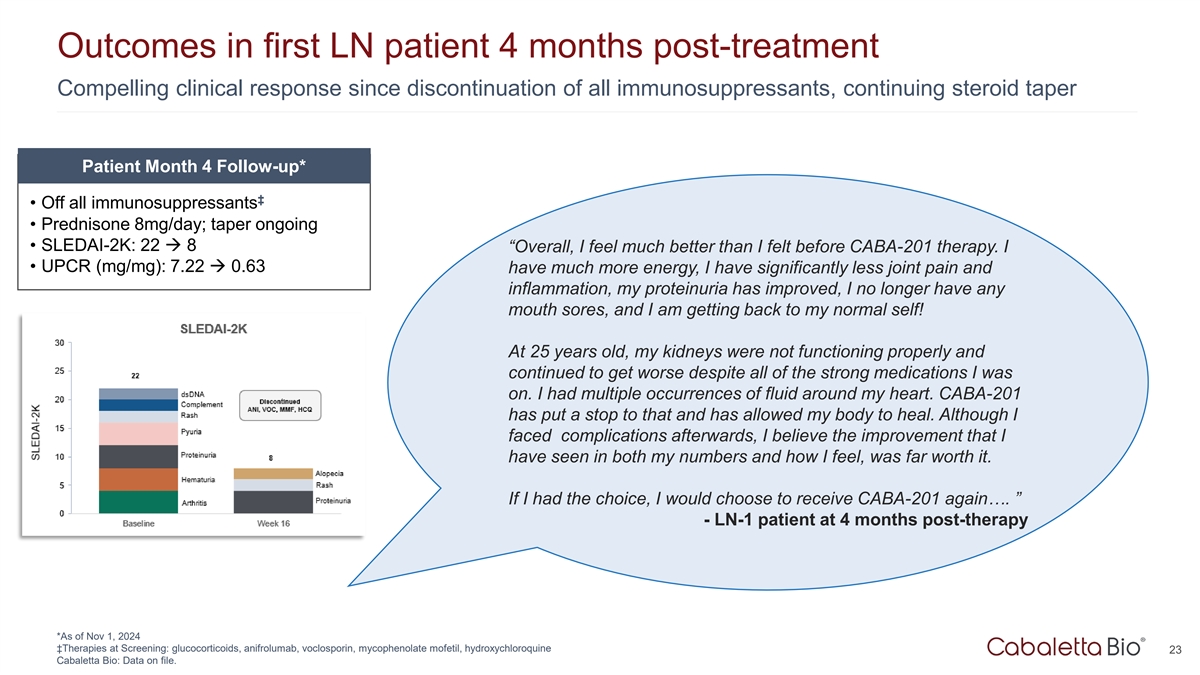
首例LN患者治疗后4个月的结果自停用所有免疫抑制剂以来令人信服的临床反应,继续类固醇逐渐减少患者第4个月随访*↓ •停用所有免疫抑制剂•强的松8mg/天;持续减量• SLEDAI-2K:22 à 8“总的来说,我感觉比CABA-201治疗前好多了。I • UPCR(mg/mg):7.22 à 0.63能量多了很多,我的关节疼痛和炎症明显少了,我的蛋白尿改善了,我不再有任何口腔溃疡,我正在恢复正常的自己!在25岁时,尽管我服用了所有强力药物,但我的肾脏没有正常运作,并且继续恶化。我的心脏周围多次出现液体。CABA-201制止了这种情况,让我的身体痊愈了。尽管之后我面临并发症,但我相信,我在数据和感觉上看到的改善,是值得的。如果我有选择,我会再次选择接收CABA-201…。”-LN-1患者治疗后4个月*截至2024年11月1日↓筛查中的疗法:糖皮质激素、阿尼弗鲁单抗、沃氯霉素、吗替麦考酚酯、羟氯喹23 Cabaletta Bio:数据已归档。
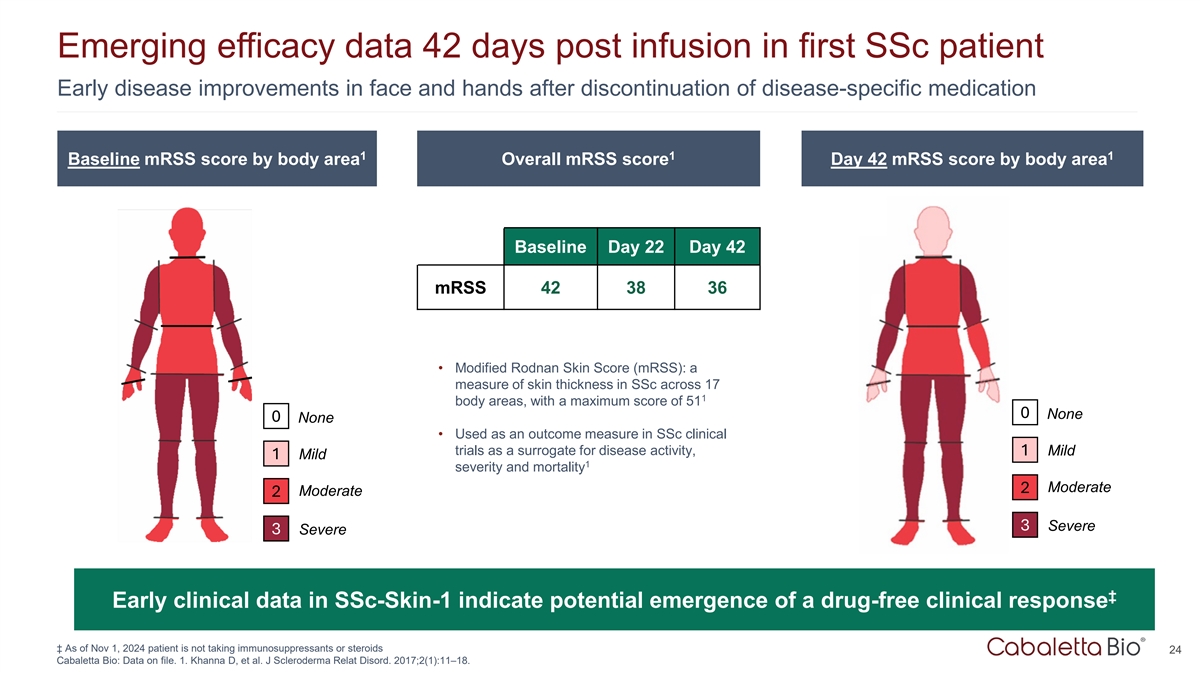
首例SSC患者输注后42天的新出现的疗效数据停用特定疾病药物后面部和手部的早期疾病改善111按体区划分的基线mRSS评分总体mRSS评分第42天按体区划分的mRSS评分第22天42 mRSS 423836 •修正的Rodnan皮肤评分(mRSS):SSC中17个体区皮肤厚度的测量,最高评分为510无0无•在SSC临床试验中用作结果测量,作为疾病活动的替代指标,1轻型1轻型1严重程度和死亡率中度2中度23重型3重型↓ SSC-Skin-1的早期临床数据表明可能出现无药物临床反应↓截至2024年11月1日,患者未服用免疫抑制剂或类固醇24 Cabaletta Bio:存档数据。1.Khanna D,et al. J Scleroderma Relat Disord。2017;2(1):11–18.

结论25

前8名患者的临床和转化数据总结• CABA-201似乎具有有利的风险收益情况•在近期发烧或感染的患者中,应考虑延迟CAR T输注• CABA-201在随访期间为高度活跃和难治的自身免疫患者提供了令人信服的疗效•初步数据支持无药物临床反应的潜力•所有患者都停用了所有免疫抑制剂• SLE患者有更长的随访时间:已完成或正在进行的类固醇逐渐减少(泼尼松8mg/天)1 • PK/PD数据支持CABA-201 TM TM261的当前剂量。Nunez et al. CABA-201 from the RESET-Myositis and RESET-SLE clinical trials的相关研究。在ACR Convergence 2024上发表。摘要0324
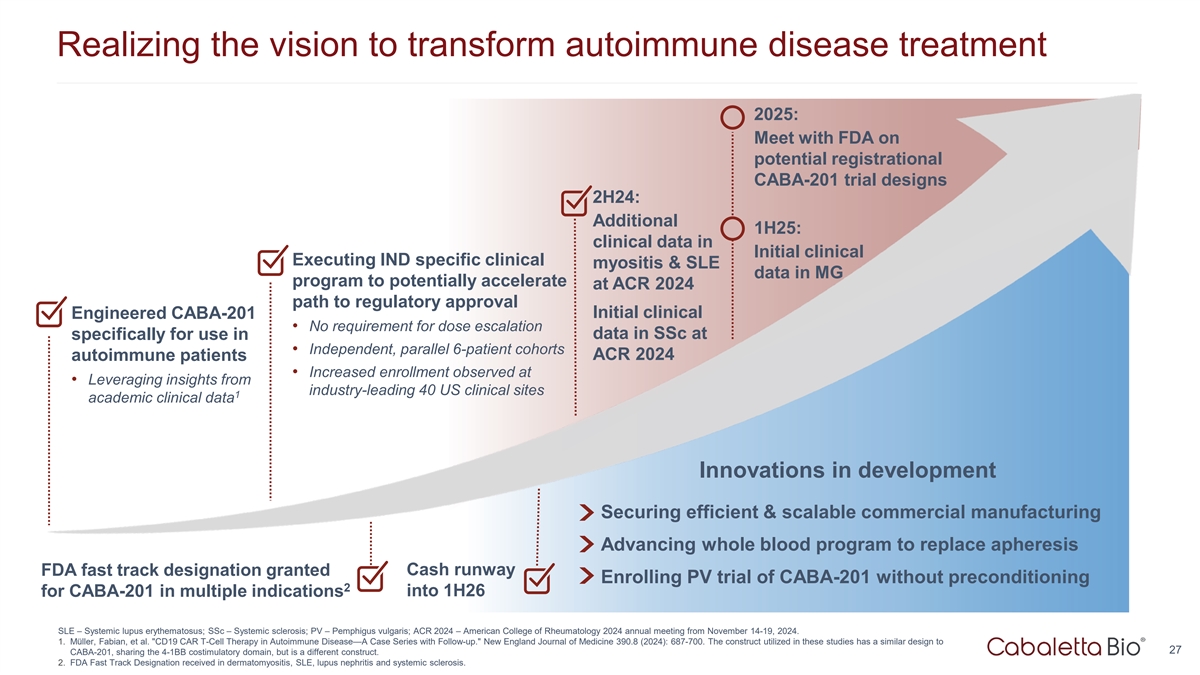
实现转变自身免疫性疾病治疗的愿景2025:就潜在的注册性CABA-201试验设计与FDA会面2H24:额外的1H25:初始临床中的临床数据在MG计划中执行IND特异性临床肌炎和SLE数据,以在ACR2024潜在加速获得监管批准的路径工程化CABA-201初始临床•无需SSC中的剂量递增数据,具体用于•独立,平行6例患者队列ACR2024例自身免疫患者•在•利用行业领先的40个美国临床站点的洞察力1学术临床数据创新开发中确保高效和可扩展的商业制造推进全血项目以取代单采血浆Cash跑道FDA快速通道指定批准CABA-201在多个适应症SLE –系统性红斑狼疮;SSC –系统性硬化症;PV –寻常型天疱疮;ACR 2024 –美国风湿病学会2024年11月14日至19日举行的CABA-201无预处理2入组PV试验。1.M ü ller,Fabian,et al. CD19 CAR T细胞治疗自身免疫性疾病—病例系列随访。新英格兰医学杂志390.8(2024):687-700。这些研究中使用的构建体具有与27 CABA-201相似的设计,共享4-1BB共刺激结构域,但是不同的构建体。2.在皮肌炎、SLE、狼疮性肾炎和系统性硬化症方面获得FDA快速通道指定。

问答28