附件 99.3
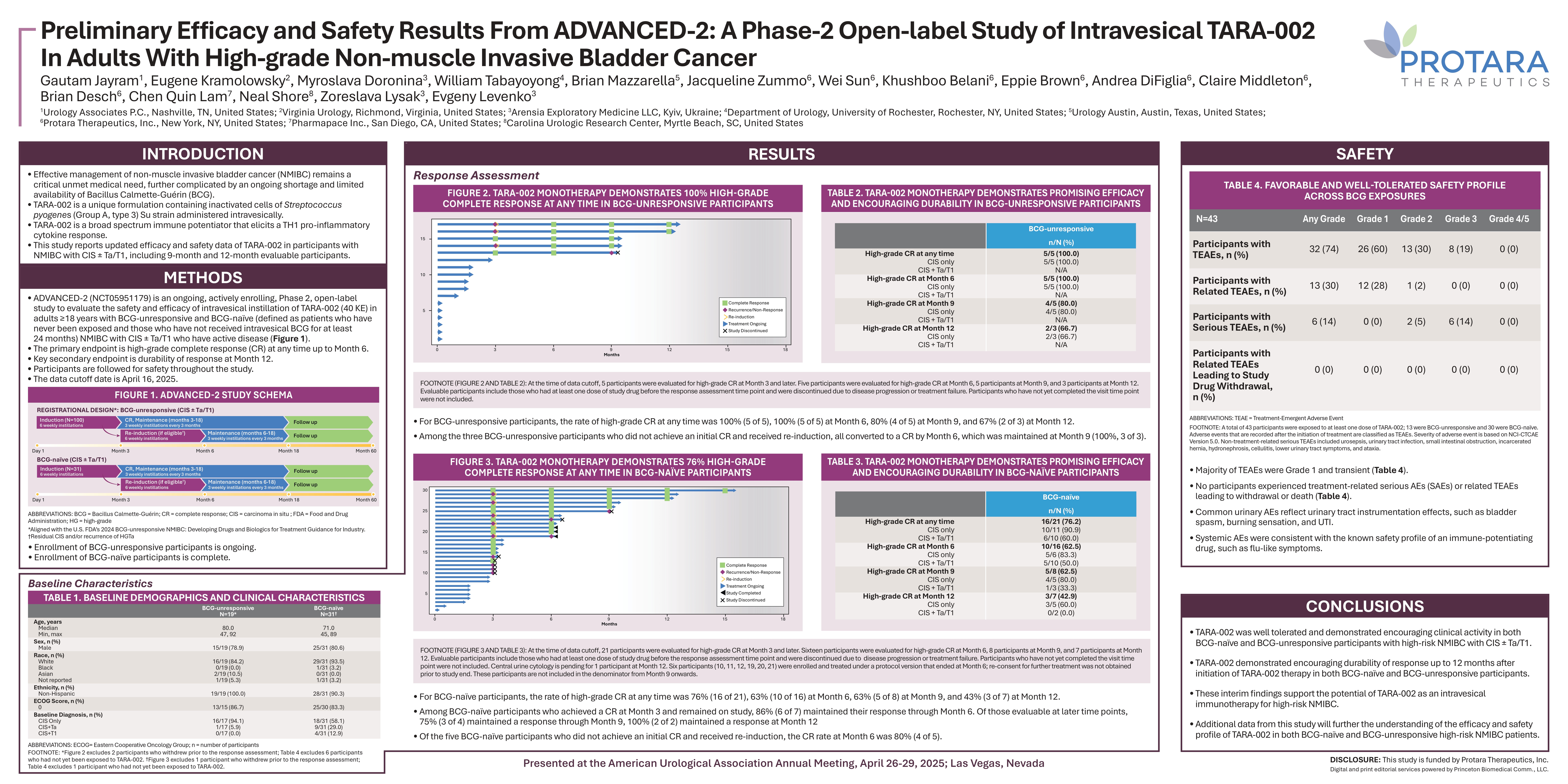
安全表4。有利且良好的-全卡介苗暴露的安全状况4/5级3级2级1任意等级N = 430(0)8(19)13(30)26(60)32(74)有TEAEs的参与者,n(%)0(0)0(0)1(2)12(28)13(30)有相关TEAEs的参与者,n(%)0(0)6(14)2(5)0(0)6(14)有严重TEAEs的参与者,n(%)0(0)0(0)0(0)0(0)0(0)有相关TEAEs导致研究药物退出的参与者,n(%)ABREVIATIONS:TEAEE = treatment-emergent adverse event footnote:共有43名参与者暴露于至少一剂TARA-002;13名BCG-无反应,30名BCG-初治。开始治疗后记录的不良事件被归类为TEAEs。不良事件的严重程度基于NCI-CTCAE 5.0版。非治疗相关的严重TEAEs包括尿毒症、尿路感染、小肠梗阻、嵌顿疝、肾积水、蜂窝组织炎、下尿路症状、共济失调。•大多数TEAEs为1级和瞬态(表4)。•没有参与者经历与治疗相关的严重AEs(SAE)或相关TEAEs导致退出或死亡(表4)。•常见的泌尿系AEs反映的是尿路仪器作用,如膀胱痉挛、烧灼感、UTI等。•全身性AEs与已知的增强免疫药物安全性特征一致,例如流感样症状。基线特征表1。基线人口与临床特征卡介苗-无反应N = 1g*BCG-Na ï ve N = 31 †年龄,年龄中值80.07 1.0 min,最大值47,9245,89性别,n(%)男性15/19(78.9)25/31(80.6)种族,n(%)白人黑人亚裔未报告16/19(84.2)0/19(0.0)2/19(10.5)1/19(5.3)29/31(93.5)1/31(3.2)0/31(0.0)1/31(3.2)族裔,n(%)非西班牙裔19/19(100.0)28/31(90.3)ECOG评分,n(%)013/15(86.7)25/30(83.3)基线诊断,n(%)CIS only CIS + TA CIS + T1 16/17(94.1)1/17(5.9)0/17(0.0)18/31(58.1)9/31(29.0)4/31(12.9)缩写:ECOG =东部合作肿瘤学组;n =参与人数脚注:*图2不包括在响应评估之前退出的2名参与者;表4不包括尚未接触过TARA-002的6名参与者。↓图3不包括1名在响应评估前退出的参与者;表4不包括1名尚未接触过TARA-002的参与者。结果在美国泌尿外科协会年会上发表,2025年4月2C-2G;内华达州拉斯维加斯披露:这项研究由Princeton Biomedical COM.,LLC提供支持的Protara Therapeutics, Inc.数字和印刷编辑服务资助。Advanced-2的初步疗效和安全性结果:膀胱内TARA-002在患有高级别非肌肉侵袭性膀胱癌的成人中的2期开放标签研究Gautam Jayram 1,Eugene Kramolowsky 2,Myroslava Doronina 3,William Tabayoyong 4,Brian Mazzarella 5,Jacqueline Zummo 6,Wei Sun 6,Khushboo Belani 6,Eppie Brown 6,Andrea DiFiglia 6,Claire Middleton 6,Brian Desch 6,Chen丨uin Lam 7,Neal Shore 8,Zoreslava Lysak 3,Evgeny Levenko 31 Urology Associates P.C.,田纳西州纳什维尔;2 Virginia Urology,美国弗吉尼亚州里士满;3 Arensia Explorative Medicine LLC,乌克兰基辅;4美国纽约州罗切斯特大学泌尿外科;5美国德克萨斯州奥斯汀泌尿外科;6 Protara Therapeutics, Inc.,美国纽约州纽约;7 Pharmapace Inc.,美国加利福尼亚州圣地亚哥;8卡罗莱纳泌尿外科研究中心,南卡罗来纳州默特尔比奇,美国结论• TARA-002在CIS“TA/T1”高风险NMIBC的BCG初治和BCG无反应参与者中均表现出良好的耐受性,并显示出令人鼓舞的临床活性。• TARA-002在BCG-Na ï ve和BCG-无反应的参与者中显示出在开始TARA-002治疗后长达12个月的令人鼓舞的反应持久性。•这些中期发现支持了TARA-002作为高风险NMIBC的膀胱内免疫疗法的潜力。•来自这项研究的额外数据将进一步了解TARA-002在BCG-NAVEN和BCG-无反应的高风险NMIBC患者中的疗效和安全性。响应评估图2。TARA-002单药治疗在卡介苗中任何时候都表现出100%的高等级完全反应-无反应参与者036121518完全反应复发/无反应再诱导治疗正在进行的研究中止9个月15105 •对于卡介苗初治参与者,任何时候的高等级CR率为76%(21中的16),第6个月为63%(16中的10),第9个月为63%(8中的5),第12个月为43%(7中的3)。•在第3个月取得CR并仍在研究的BCG-初治参与者中,86%(7人中有6人)的反应保持到第6个月。在以后的时间点可评估的人中,75%(4人中有3人)在第9个月之前保持了响应, 100%(2 of 2)在第12个月保持响应•在未实现初始CRR并接受再诱导的5名BCG-NAve参与者中,第6个月的CRR率为80%(4 of 5)。•对于BCG-无反应的参与者,任何时候的高等级CRR比率为100%(5之5),第6个月为100%(5之5),第9个月为80%(4之5),第12个月为67%(2之3)。•未实现初始CRR并接受再诱导的3名BCG-无反应参与者中,到第6个月全部转为CRR,维持在第9个月(100%,3中的3)。表2。TARA-002单药治疗在卡介苗中显示出有希望的效率和令人鼓舞的持久性-反应迟钝的参与者图3。TARA-002单药治疗在卡介苗中任何时候都表现出76%的高等级完全应答-NA ï VE参与者036121518完全应答复发/无应答再诱导治疗正在进行的研究完成研究终止9个月30252015105表3。TARA-002单疗法在BCG中显示出有希望的效率和令人鼓舞的持久性-NA ï VE参与者BCG-无反应n/n(%)任何时候的高品位CR CIS仅5/5(100.0)5/5(100.0)CIS + TA/T1高品位CR在第6个月N/A 5/5(100.0)CIS仅5/5(100.0)CIS + TA/T1 N/A高品位CR在当月G CIS仅4/5(80.0)4/5(80.0)CIS + TA/T1 N/A高品位CR在第12个月CIS仅CIS + TA/T1 2/3(66.7)2/3(66.7)N/A BCG-na ï ve n/N(%)任何时候的高品位CR CIS仅CIS + TA/T1月6日的高品位CR 16/21(76.2)10/11(90.9)6/10(60.0)10/16(62.5)CIS仅5/6(83.3)CIS + TA/T1 5/10(50.0)月的高品位CR G 5/8(62.5)CIS仅CIS + TA/T1月12日的高品位CR 4/5(80.0)1/3(33.3)3/7(42.G)CIS仅CIS + TA/T1 3/5(60.0)0/2(0.0)导言•非肌肉浸润性膀胱癌(NMIBC)的有效管理仍然是一个关键的未满足的医疗需求,由于卡介苗-Gu é rin(BCG)的持续短缺和有限的可用性,这一点变得更加复杂。• TARA-002是一种独特的制剂,含有化脓性链球菌s(A组,3型)Su菌株的灭活细胞,静脉内给药。• TARA-002是一种广谱免疫增强剂,可引发TH1促炎细胞因子反应。•本研究报告了TARA-002在具有CIS“TA/T1”的NMIBC参与者中的最新疗效和安全性数据,包括9个月和12个月的可评估参与者。方法• Advanced-2(NCT05951179)是一项正在进行的、积极入组的2期开放标签研究,旨在评估TARA-002(40 贝壳)在≥ 18岁BCG-无反应和BCG-初治(定义为从未接触过的患者和至少24个月未接受过BCG的患者)NMIBC with CIS“TA/T1且有活动性疾病(图1)的成人中的膀胱内滴注安全性和有效性。•主要终点是高级别完全缓解(CR),可持续到第6个月。•关键的次要终点是第12个月反应的持久性。•在整个研究过程中对参与者进行安全跟踪。•数据截止日期为2025年4月16日。图1。Advanced-2 Study Schema注册设计*:BCG-无反应(CIS“TA/T1”)诱导(N = 100)CR,维持(第3-18个月)随访6周灌注3周灌注每3个月再诱导(如果符合条件↓)维持(第6-18个月)随访6周灌注3周灌注每3个月第1天3个月6个月18个月60 BCG-NA ï ve(CIS“TA/T1)诱导(N = 31)CR,维持(第3-18个月)随访6周灌注3周灌注每3个月再诱导(如符合条件↓)维持(第6-18个月)随访6周灌注3周灌注每3个月第1天1个月3个月6个月18个月60个缩写:BCG = Bacillus Calmette-Gu é rin;CR =完全应答;CIS =原位癌;FDA = Food and Drug Administration;HG = high-grade*与美国FDA的2024年BCG-无反应NMIBC:为行业开发用于治疗指导的药物和生物制剂保持一致。↓残留CIS和/或HGTA复发•卡介苗无反应参与者的注册工作正在进行中。•卡介苗-初治参与者注册完成。Footnote(图3和表3):在数据截止时,有21名参与者在第3个月及之后接受了高等级CR评估。16名参与者在第6个月进行了高等级CR评估,8名参与者在第9个月进行了评估,7名参与者在第12个月进行了评估。有价值的参与者包括那些在反应评估时间点之前至少服用了一剂研究药物并且由于疾病进展或治疗失败而停用的人。尚未完成访问时间点的参与者不包括在内。中心尿细胞学正在等待1名参与者在第12个月。六名参与者(10、11、12、19、20、 21)在第6个月结束的方案版本下入组并接受治疗;在研究结束前未获得进一步治疗的重新同意。这些参与者从第9个月起不计入分母。Footnote(图2和表2):数据截止时,5名参与者在第3个月及之后接受了高等级CR评估。5名参与者在第6个月进行了高等级CR评估,5名参与者在第9个月进行了评估,3名参与者在第12个月进行了评估。有价值的参与者包括那些在反应评估时间点之前至少服用了一剂研究药物并因疾病进展或治疗失败而停用的人。尚未完成访问时间点的参与者不包括在内。